摘要
背景
不定根(AR)由主根以外的组织发育而来,这一过程受植物激素的生理调节。不定根提供结构支撑,有助于水分和养分的吸收,对几种作物的商业性营养繁殖至关重要。在此,我们从一个拟回交种群的插枝中量化了AR的数量、根系结构性状和根系生物量摘要而且杨树trichocarpa.对具有AR数量替代QTL等位基因的个体进行定量性状位点(QTL)映射和全转录组分析,以确定AR发展的假定调控因子。
结果
亲本个体和后代在AR发育性状上表现出广泛的分离。AR数量的数量性状位点在连锁组(LG) II和LG XIV的同一区间内定位一致,可解释7 - 10%的表型变异。时间序列转录组分析发现,AR发育过程中有26121个基因差异表达,尤其是在扦插收获后的头24小时。其中,在一个或多个时间点,携带两个AR数量的备选等位基因的个体之间,有1929个基因被差异调节。这些基因中的81个物理定位在AR数量的QTL区间内,包括假定的同源性拟南芥基因SUPERROOT2(SUR2),色氨酸合成酶α链(tsa1),两者都参与生长素吲哚-3-乙酸(IAA)生物合成途径。
结论
这项研究表明,色氨酸依赖性生长素生物合成途径的两个基因参与其中,SUR2而且TSA1在木本植物无性系繁殖的一个关键性状的调控中。这种调节的一个可能模型是AR形成不良的杨树个体主要通过色氨酸(Trp)途径合成生长素吲哚-3-乙酸(IAA)。Trp通路的大部分通量似乎指向吲哚类硫代葡萄糖苷(IG)的合成,这是由的过表达所暗示的SUR2.在AR形成中有效的个体可能利用替代途径(非色氨酸)合成IAA,根据观察,他们下调了IAA的表达TSA1这是合成色氨酸的关键步骤之一。
背景
不定根(AR)由主根以外的植物组织发育而来,提供结构支持,并有助于水分和养分的吸收[1].不定根和侧根遵循一个共同的发育程序,尽管AR的形成需要已经提交的细胞去分化[2].AR的形成分三个阶段,这三个阶段可能重叠:(1)先前提交的细胞(典型的次生韧皮部细胞)去分化;(2)诱导,即细胞开始分裂形成内根分生组织;(3)伸长,当根原基生长并从茎中伸出时[1].当ARs从茎切屑中形成时,也会发生伤口反应,从而激活修复反应和系统信号循环[3.].通常,AR原基产生于韧皮部和形成层附近,在射线细胞或芽或叶间隙。不定根也可在根的内皮层和韧皮部之间的中柱鞘中出现[3.].AR形成的每个阶段的时间因物种而异,并取决于外界刺激,但第一个根分生组织通常在96 h后观察到[1,4,5].
植物激素是AR形成的关键内源因子,直接作用于细胞分裂和生长,或间接与其他分子或植物激素相互作用[6].生长素是启动生根的主要植物激素,对AR发展的第一阶段至关重要[7,尽管在伸长过程中有抑制作用。乙烯可能与生长素相互作用,以控制茎或茎插枝中的不定根[2],一些研究表明生长素通过刺激乙烯合成促进去分化[8].尽管乙烯在去分化的第一阶段是促进的,但在诱导阶段是抑制的[4].细胞分裂素也已被证明影响AR的形成[9],与生长素相互作用形成静止中心[7].赤霉素似乎通过干扰生长素的极性运输而对ARs的最初形成产生负面影响[10],同时积极应对它们的出现和延伸[11].最后,独角内酯也被证明会影响AR的形成[12,13],尽管通过与其他激素的相互作用对表型的贡献仍有待发现。不管激素调节的机制如何,ARs最初的发展主要是由生长素的可用性及其适当的定位所控制,而大多数其他激素作为抑制剂或与生长素联合使用。
植物激素在AR形成中的一般作用已经相对众所周知,但很少有与这一发育过程相关的基因被确定。虽然调节木本多年生物种AR的基因和分子机制尚不清楚,但在木本物种中,AR的发展显然受到显著的基因控制(例如,参见[14,15])。属的Aigeiros和Tacamahaca部分的种和杂种杨树属可由插枝产生不定根的植物类群,但在生根的程度和活力上存在相当大的差异[16].因此,杨树杂交种之间存在广泛的性状变异,且有完善的遗传和基因组资源,因此特别适合研究AR形成的遗传控制[17- - - - - -20.].最重要的是,DNA序列p . trichocarpa基因型Nisqually-1 [21和全转录组微阵列[22使基因组信息与复杂性状的定量遗传解剖相结合,从而利用遗传基因组学发现与它们的变异有关的基因[23].
在这里,我们报道了对北美两种最具经济价值的木本树种之间AR形成变异的基因解剖,p .摘要而且p . trichocarpa.我们将传统的定量遗传方法与AR形成发育过程中测定的基因组信息相结合,以确定与该属中该性状控制相关的主要假定基因和激素生物合成途径杨树.
结果
亲本个体的不定根
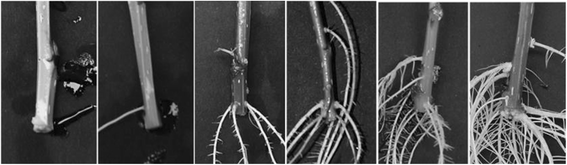
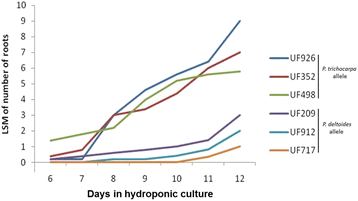
不定根形成的特征杨树伪回交居群,以下简称谱系52-124 [24,25(图。1).该种群是由杂交的雌性亲本(p . trichocarpa×p .摘要,基因型52-225)p .摘要(基因型D124)。将亲本个体和后代236个个体的扦插置于水培溶液中,每天统计可见ARs。第5天时出现不定根原基,第18天时85%以上的扦插生根。在两个亲本个体中,AR的形成几乎同时开始,但可见根总数明显较低(P< 0.01)p .摘要与杂交母本相比,雄性直到第17天1).第17天以后,观察到的两个亲本的根数差异不再显著。因此,父母双方似乎都有相似的AR发展能力,但有一个延迟的发展p .摘要相对于混合父级(p . trichocarpa×p .摘要).
不定根形成的定量遗传控制
广义遗传力(H2)的计算,以估计AR形成的程度,遗传控制在谱系52-124,此前的研究表明,在性状的高遗传控制杨树[26- - - - - -28].在本研究中,根数的遗传力为中等(H2= 0.27-0.34),与之前在该谱系中分析的其他复杂性状相似[25].
除了根数外,还测量了扦插在水培溶液中保存18天后收获的根的几个结构特征。分析的性状包括总根长、比表面积、总根体积和平均根径、一级(主根)根和根分枝数。所有的根结构特征和总干重均表现为海侵分离2).对于这些结构性状,根枝长度的遗传力为0.12,平均直径的遗传力为0.261).
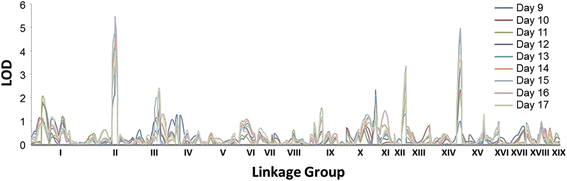
利用杂交种母本的遗传图谱对根系构型性状和水培培养18天后的根数进行了QTL分析[22].在母本图谱上检测到15个根系构型性状和根系生物量QTL,每个QTL解释的表型变异范围为6% ~ 11%3.).ARs数量的数量性状位点在连锁组(LG) II和LG XIV的相同区间内定位一致,并解释了7 - 10%的表型变异(图)。2和额外的文件4).这些QTL的LOD评分的对数分别为5.60 (LG II)和4.99 (LG XIV), LG II的QTL长度34.89 cM,包含380个基因,LG XIV的QTL长度26.81 cM,包含241个基因。为了确定调控ARs数量的元素,进一步分析集中在位于LG II和LG XIV两个QTL区间内的基因。
AR QTL等位基因选择性个体的转录组分析
为了确定AR形成的假定调控因子,我们搜索了LG II和XIV的qtl中的转录本,这些转录本在携带替代亲本等位基因的个体之间被差异调控。该分析假设遗传替代QTL等位基因的个体之间的遗传差异导致了影响AR的基因表达差异,即该性状至少部分受转录调控的差异控制。3个携带等位基因的个体的基因表达来源于p . trichocarpa祖父母(UF352, UF498和UF926,以下简称为PtQTL基因型类)与有等位基因的QTL进行比较p .摘要祖父母(UF717, UF209和UF912或PdQTL基因型类别)。这些个体是从遗传了QTL侧翼标记的个体中随机选择的p . trichocarpa祖父母(PtQTL基因型分类)或p .摘要祖父母(PdQTL基因型类别)。为了进行转录组分析,在水培溶液中培养了6个选定个体的25根插片,并在5个时间点(插片收获后0、24、48、96和192小时)分别收集每个个体的4个生物重复的基础(1厘米)切割切片。我们强调在最初96小时收集样本,因为先前的研究表明,AR的形成始于这一时期[29].每个个体在水培条件下额外重复5次直到第12天,并确认根系发育与QTL检测实验中观察到的表型一致(图1)。3.).通过先前开发的全转录组微阵列来评估扦插在水培溶液中的转录组响应[22,24].为每个基因生成的微阵列数据分别使用方差分析(ANOVA)对时间(0、24、48、96和192 h)、基因型(UF209、UF352、UF498、UF717、UF912和UF926)和基因型×时间相互作用作为固定效应进行评估(见方法)。对每个基因进行方差分析f检验,以确定样本收集次数(0、24、48、96和192 h)之间的表达是否存在显著差异。根据错误发现率(FDR)为5%确定显著性。此外,还比较了不同个体间各基因的表达情况PdQTL基因型类别(UF717、UF209和UF912)和个体PtQTL基因型分类为UF352、UF498和UF926。本分析采用5%的FDR显著性阈值来评估AR QTL对基因表达的影响,下文称为QTL基因型效应。我们将进一步的分析集中在两个比较上:(1)时间效应和(2)QTL基因型效应。
时间的影响
样本收集时间影响的f检验确定了26121个假设基因在实验中至少两个时间点之间显著差异表达(FDR < 5%)(附加文件5).为了确定基因表达发生最显著变化的时间,我们比较了连续时间点(即时间点0-24小时、24-48小时、48-96小时和96-192小时)之间的基因表达(附加文件)6).大多数转录组水平的差异发生在实验的前24小时(即0到24小时之间)。这种广泛的转录组变化可能与剪枝收割后立即发生的应激和损伤反应有关,并将其放置在水培溶液中,而不是完全由于AR的发展。另一方面,在水培培养的96 ~ 192 h内,只有10个基因受到差异调控,说明这两个时间点处于同一生根阶段。
QTL基因型的影响
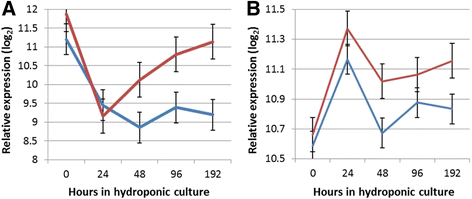
接下来,我们试图识别个体间差异表达的基因PdQTL和PtQTL分类,在每个时间点。这项比较的目的是确定在AR的最初发展过程中,在个体之间携带控制该性状的替代等位基因的差异调节基因。个体间基因调控差异PdQTL和PtQTL类别,在任何时间点,位于QTL区间,代表候选AR调节器。我们鉴定了1929个基因型之间的差异调节基因PtQTL和PdQTL分类,在组织收集的至少一个时间点7).在这1929个基因中,有81个位于LG II和XIV的QTL区间内。其中,对色氨酸生物合成途径的酶进行编码的两个假定的同源基因:POPTR_0002s04640和POPTR_0002s02770尤其令人感兴趣。色氨酸是生长素的前体[30.,31),是AR形成的主要激素调节剂。基因POPTR_0002s04640被认为与TSA1(色氨酸合酶α链).编码的酶TSA1催化吲哚-3-甘油磷酸转化为吲哚,是色氨酸生物合成的倒数第二反应,在生根较好的个体中表达量较低PtQTL类在48和192 h。POPTR_0002s02770,假定的同系物拟南芥基因SUR2(SUPERROOT2)的表达显著高于PdQTL类相比于PtQTL, 192 h ASUR2敲除突变体已被证明会导致生长素过量产生和异常数量的不定根[32,33].在时间效应分析中,POPTR_0002s02770在0和24 h之间也有显著差异表达PdQTL和PtQTL类别。
其他与植物激素反应相关的基因和位于目标QTL区间内的基因在不同个体之间也有不同的调控PdQTL和PtQTL分类,在几个时间点。例如,在96和192 h时,观察到POPTR_0002s02420基因的高表达拟南芥ga刺激的转录本1 (GASA1)在PdQTL类别。GASA1参与对赤霉素刺激、油菜素类固醇、脱落酸刺激和单维细胞生长的响应[34].在48和96小时,类似于拟南芥基因eto1样蛋白1 (eol1), POPTR_0002s04910在大鼠个体中表达较高PtQTL类别。EOL1编码的谐音ETHYLENE-OVERPRODUCER1它是该基因的负调控因子1-AMINOCYCLOPROPANE-1-CARBOXYLATE合酶5,乙烯生物合成途径中的一种关键酶[35].
聚类的转录组反应的差异PtQTL和PdQTL基因型
个体间基因调控差异PtQTL和PdQTL分类可能是协调反应的一部分,以区分两个物种形成AR的能力。为了揭示差异功能反应,我们聚类了1929个差异调节的基因PtQTL和PdQTL分类,基于两者在每个时间点的转录本丰度差异。使用基于调制模块化聚类(MMC)图的方法对整个实验过程中具有共同差异调控模式的基因进行聚类[36].共鉴定出60个聚类,大小从2到148个转录本不等,其中8个基因未聚类8和额外的文件9).
转录因子结合位点分析
在所有被鉴定为个体间差异调节的基因中PdQTL和PtQTL类别,并且位于QTL区间内,只有POPTR_0002s02770与拟南芥先前显示的控制AR发展的基因(SUPERROOT2,Boerjan 1995 (32];德拉鲁等人,1998年[33])。鉴于POPTR_0002s02770在杨树AR形成中的潜在作用,我们利用PLACE(植物顺式作用调控DNA元件)数据库对包含该基因的簇中过代表的保守基序进行了识别。这种分析是受限于事实,它仅仅是基于检测到的主题p . trichocarpa,因为没有合适的参考基因组序列p .摘要.共有48个基因组合在superroot2簇中,其中一半在植株个体中高表达PdQTL类,而另一半在个体中高表达PtQTL类别。我们假设这个簇中的基因将共享与激素调节相关的基序,特别是生长素。采用Fisher精确度检验来识别两个QTL类别中其中一个中频率较高的基序,确定了25个显著基序(表2).有趣的是,所有的主题都显著(P-value > 0.05)PtQTL分类组基因。半数检测到的基序先前被描述为与植物激素反应有关,主要是生长素(6个基序类别),但也有乙烯、脱落酸和赤霉素。此外,有几个基序与生根和伤害反应直接相关。这些结果进一步证明了这些共表达基因在调控不定根形成中的影响。
讨论和结论
植物产生AR的能力被许多工业和研究部门广泛用于繁殖育种计划或自然种群中选择的精英个体。岩屑根系质量差或完全无法形成根系,会造成重大经济损失[1].在本研究中,我们将分离人群的遗传(QTL)分析与基因组和转录组数据相结合,以确定AR发展的假定调控因子杨树.分析集中在杂交种的等位基因分离上p . trichocarpa而且p .摘要在映射总体中。先前的观察发现,这两个物种在AR形成方面截然不同。
我们检测到大多数AR发育特征的中度遗传力,与其他类似研究一致杨树物种(37,38].只有两项关于AR发育的QTL研究杨树曾有过报道[26,39].Han和他的同事研究了体外不定根形成和芽再生的定量遗传方面,Zhang等人。26]采用功能映射法检测不同时间点的根数和最大根长qtl。然而,在这些研究和本文报道的结果之间没有发现共同的QTL。差异可能是由于使用了具有不同遗传背景、生长条件和插枝类型的科系。
转录组数据表明,无论遗传的QTL等位基因是什么,在扦插收获后的24小时内,差异调节的基因数量最多。这一结果可能是由于激素和基因调控的变化,与伤口反应和细胞去分化到能够细胞分裂的分生组织状态有关。预计,在最初24小时内大量上调的基因反映了这些变化。这些包括CPC902(复组分c亚基中的冷凝物),与拟南芥基因同源SMC1(染色体的结构维持).SMC1编码内聚复合体家族中的一种蛋白质[40],是核分裂过程中正确的染色体分离所必需的,可能指示了根分生组织组织所必需的细胞分裂的开始。
鉴定在扦插收集后的不同时间点差异调节的转录本,提供了可能参与损伤和细胞去分化、根诱导和伸长的基因和途径的广泛的转录组概述[1].然而,它并没有确定一组基因或特定的多态性,负责AR形成的表型差异p .摘要而且p . trichocarpa.为了实现这一目标,我们对比了在每个时间点携带控制AR形成的替代等位基因的个体之间的基因表达,基于QTL分析检测。遗传了替代基因的个体之间的基因调控存在差异p .摘要或p . trichocarpa然后评价QTL等位基因在杨树基因组,以检测位于QTL区间内的基因。在这些基因,SUR2在扦插时间和水培培养的前24小时之间,表达量显著降低。这种表达的减少是独立于qtls的基因型的-它在那些个体中观察到PtQTL和PdQTL类别。然而,在接下来的时间点(48-192 h),的水平SUR2在早期形成AR的个体中仍然很低(PtQTL类),但在AR发育不良的个体中,0小时检测到的水平急剧上升(PdQTL类别(图)。4).有趣的是,杨树和TSA1,它编码了催化吲哚-3-甘油磷酸转化为吲哚的酶,这是色氨酸生物合成中倒数第二个反应,也位于LG II QTL区间。TSA1也显示在生根较好的个体中表达较低Pt在48和192 h后的时间点QTL分类(图。4 b).综上所述,AR形成受限的杨树基因型主要通过色氨酸(Trp)途径合成生长素吲哚-3-乙酸(IAA)。然而,许多途径通量似乎指向合成吲哚硫代葡萄糖苷(IG),因为在的过表达SUR2.相反,AR形成有效的基因型下调Trp的合成(通过下调TSA1)和/或转向合成IG的途径。长期以来,人们一直认为生长素IAA是通过多种途径合成的[41],包括一个trp独立通路[42].最近,一个拟南芥发现了不依赖色氨酸的生长素生物合成途径中存在缺陷的吲哚合酶突变体[43].本研究研究了杨树假设同源基因的基因表达,但结果显示,不同基因株之间转录水平无显著差异,且随时间的推移无显著差异。
显然,基因表达可能不能反映蛋白质水平的变化或其他过程(如蛋白质修饰),可能影响IAA生物合成。其他基因在个体间的差异调节PtQTL和Pd位于AR QTL区间内的QTL类别也可能是相关的,应在进一步分析后加以考虑。此外,虽然检测到基因表达的显著差异SUR2和其他与IAA生物合成相关的基因,这些变化的生物学影响只能通过进一步的实验来评估,这超出了本文所述的研究范围。基因表达的微小差异可能具有统计学意义,但没有或只有有限的生物学影响。尽管存在这些担忧,本研究提出了一个有吸引力的假设,即AR形成的差异p .摘要而且p . trichocarpa是由IAA生物合成途径中基因表达的差异驱动的,可能是在杨树的同系物SUR2而且TSA1.
方法
植物材料和表型测量
本研究使用的谱系(52-124)是杂交母本52-225 [p . trichocarpa(克隆93 - 968)×p .摘要(克隆ILL-101))和不相关的雄性亲本D124 (p .摘要),由明尼苏达大学自然资源研究所建立。母体D124来自明尼苏达州北部。的p . trichocarpa混血儿的父母来自华盛顿西部,而混血儿的父母来自华盛顿西部p .摘要母质原产于伊利诺伊州。从52-124家系的234个个体以及亲本个体中收集了12厘米(cm)的根尖切屑。岩屑放置在58 × 41 × 15 cm的容器中,每个容器最多59根岩屑,用水培培养(H2O缓冲在pH 5.7, 0.5 g L−1的MES)在实验期间。实验设计为不完全块设计,共4块,3次重复,共708块岩屑。每天同一时间(上午10时)记录根系出芽,直至培养第18天。在水培溶液中浸泡18天后,收获根系,使用Scanner CanoScan LiDE 600 F (Cannon)扫描根系,并干燥测量总干重。使用WinRHIZO Pro (Regent Instruments Inc.)分析扫描根的总根长、表面积、体积和总根、一级(初级)根和根分枝的平均直径。由于实验是在封闭的环境中进行的,所有的材料在测量完成后被销毁,因此现有的立法不需要许可证。佛罗里达大学建立了一个公共收藏,提供了本研究所用材料的永久访问权。
统计分析
使用PROC MIXED (SAS Institute Inc. 9.2®2004,Cary, NC, USA)估计所有性状的协方差参数,考虑以下模型中的所有变量都是随机的:
在哪里γijkl是表现型的价值我基因型j第Th块k在复制中,μ是总体平均值,α我是基因型的随机效应;βj是复制的随机效应,γk(j)不完全块的随机效应(复制内)和eijkl是残差。
广义家系遗传力计算采用协方差参数估计,公式如下:
在哪里σ2c而且σ2e分别对应于三个复制的基因型和残留效应的方差分量。
除根的数量外,对所有的性状都进行了对数变换。QTL分析中使用的最小二乘均值通过将克隆作为模型中的固定效应计算,使用PROC MIXED。
QTL分析
根相关性状的qtl是基于先前描述的连锁图谱识别的[22,25].该连锁图谱由181个标记组成,在杂交母本中均质分布的基础上选择。这幅地图的平均密度是每16厘米一个标记。qtl的鉴定采用复合区间映射[44在Windows QTL Cartographer v.2.5中使用标准模型6,行走速度为2厘米。全基因组显著性水平P根据1000个排列建立< 0.05 [45].
QTL区选择性等位基因个体的选择
根数的数量性状位点在LG II和XIV上得到了一致的定位(见结果)。我们根据等位基因(p . trichocarpa或p .摘要),在两个QTL区均可见到。定义了四类:(1)个体携带p .摘要或(2)p . trichocarpa(3)个体携带p . trichocarpaLGII和QTL的等位基因p .摘要(4)反之亦然。在两个QTL的侧翼标记间发生重组的个体不归为任何一类。不出所料,个人携带p . trichocarpa在两个QTL区域的等位基因(PtQTL类)一般比携带的根多p .摘要这些区间的等位基因(PdQTL类别)。对于这6个个体,我们收集了12厘米长的扦插,并将它们建立在之前QTL检测实验中使用的相同的水栽条件下。连续12天每天记录这些个体中形成的新根的数量,并收集样本进行转录组分析。
用于微阵列分析的组织取样
为了测量从每个QTL类别中选择的三个个体不定根形成过程中的基因表达(PtQTL和PdQTL),从每根切面基部取1 cm截面,分别于0、24、48、96和192 h置于水培溶液中采集。样品在液氮中快速冷冻后提取RNA。在每个时间点,从每个个体中收集4个生物重复。此外,每个个体在水培条件下保持5个生物重复,直到第12天,以验证根系发育与QTL检测实验中观察到的表型一致。
RNA提取,cDNA合成和标记
提取总RNA [46]从每个样本底部1厘米的茎段中采集。样品包括木质部、韧皮部和树皮。RNA用RNeasy Mini Kit柱纯化(Qiagen), DNase用RNase-Free DNase set处理(Qiagen)。RNA质量在1% w/v琼脂糖凝胶中进行评估。使用安捷伦低输入快速安捷伦标记试剂盒(Agilent)扩增RNA,合成cRNA并进行标记。所使用的微阵列平台由单个60微米探针组成,分别针对来自基因组测序的43,803个注释基因模型设计p . trichocarpa(国家生物技术信息中心基因表达综合平台GPL20736)。这些探针之前被选择用于分析该定位群体中的基因表达[22].
微阵列实验设计与数据分析
在转录组分析中总共使用了60个微阵列。在5个时间点(0、24、48、96和192小时)对6个个体的基因表达进行分析,每个个体和时间点进行4个生物重复。设计的选择有利于来自不同QTL类别的样本的对比基因表达(PtQTL和PdQTL),以及从不同时间点采集的同一个体样本。数据存储在国家生物技术信息中心基因表达综合系列GSE71630中。信号强度的中位数经分位数归一化处理[47)和日志2改变了。归一化信号在SAS 9.2 (SAS Institute Inc. 9.2®2004,Cary, NC, USA)中进行分析,采用混合模型方差分析,基因型和基因型×时间相互作用为固定效应,微阵列为随机效应。不同个体之间的表达差异PtQTL和Pd在每个时间点估计QTL类别,根据错误发现率(FDR)为5%确定显著性[48].基因表现出相似的表达模式差异的个体PtQTL和Pd在所有时间点上,使用基于调制模块化聚类图的技术(使用Spearman相关)对QTL类别进行聚类[36].
注释
杨树通过使用BLASTx搜索序列相似性对基因模型转录本序列进行注释杨树(JGI .1.1和v2.2)和拟南芥信息资源(TAIR v8.0)基因模型。
转录因子结合位点分析
的起始密码子上游的启动子序列p . trichocarpa先前提取的基因模型[24]以识别常见植物的存在与缺失独联体表演元素。包含基因POPTR_0002s02770,拟南芥根据基因表达模式将SUR2的同源基因分为两组,即在PtQTL中表达较高的基因和在PtQTL中表达较高的基因PdQTL类别。(植物独联体-作用调节DNA元件)核苷酸基序数据库[49]被用来识别在每一组中被过度代表的保守基序,并推断共调控基因中的功能角色。在SAS (SAS Institute Inc. 9.2®2004,Cary, NC, USA)中进行双面fisher精确试验,使用PROC FREQ测试在个体中高表达的基因中特定基元的过表达PdQTL类针对个体间高表达的基因PtSUR2聚类中的QTL类。
支持数据的可用性
微阵列数据可在国家生物技术信息基因表达综合中心公开获取,注册号为GSE71630。
缩写
- 基于“增大化现实”技术:
-
不定根
- CIM:
-
复合区间映射
- cM:
-
厘摩
- 罗斯福:
-
错误发现率
- 国际宇航科学院:
-
indole-3-acetic酸
- 格林:
-
连锁群
- LOD:
-
概率的对数
- MMC:
-
调制模块化聚类
- QTL:
-
数量性状位点
- SUR2:
-
SUPERROOT2
- Trp:
-
色氨酸
- TSA1:
-
色氨酸合酶α链
参考文献
- 1.
De Klerk G-J, van der Krieken W, De Jong JC。回顾不定根的形成:新概念,新可能性。Vitr Cell Dev Biol Plant 1999; 35:189-99。
- 2.
斯利瓦斯塔瓦LM。植物生长发育:激素与环境。牛津大学:学术出版社;2002.
- 3.
杨建平,张建平。不定根形成过程中的解剖学变化。正确用法:植物和插枝中新根的形成。1985.111 - 40页。
- 4.
德克勒克颁奖G-J。微扦插生根:理论与实践。Vitr Cell Dev Biol Plant, 2002; 38:415-22。
- 5.
Ahkami AH, Lischewski S, Haensch K-T, Porfirova S, Hofmann J, Rolletschek H, Melzer M, Franken P, Hause B, Druege U, Hajirezaei mr牵牵花扦插不定根形成的分子生理学:创伤反应和初级代谢的参与。新植醇。2009;181:613-25。
- 6.
Da Costa CT, de Almeida MR, Ruedell CM, Schwambach J, Maraschin FS, Fett-Neto AG。当胁迫和发育同时发生时:扦插不定根的主要激素控制。植物科学,2013;4:133。
- 7.
Della Rovere F, Fattorini L, D 'Angeli S, Veloccia A, Falasca G, Altamura MM.生长素和细胞分裂素控制拟南芥不定根顶端静止中心的形成。安机器人。2013;112:1395 - 407。
- 8.
孙W-Q, Bassuk NL。“皇室”玫瑰插枝生根过程中生长素诱导的乙烯合成和蓓蕾抑制。中国科学(英文版)1993;
- 9.
Ramírez-Carvajal GA, Morse AM, Dervinis C, Davis JM。细胞分裂素b型反应调控因子PtRR13是杨树不定根发育的负调控因子。植物杂志。2009;150:759 - 71。
- 10.
赤霉素通过影响生长素转运抑制杂交白杨和拟南芥的不定根。植物j . 2014; 78:372 - 84。
- 11.
牛松,李智,袁浩,方鹏,陈旭,李伟。调控烟草不定根发育需要赤霉素在维管组织中的定位。J Exp Bot. 2013; 64:3411-24。
- 12.
孙浩,陶娟,侯敏,黄松,陈松,梁铮,谢涛,魏勇,谢旭,Yoneyama K,徐刚,张勇。水稻不定根形成需要一个独角金内酯信号。安机器人。2015;115:1155 - 62。
- 13.
Rasmussen A, Beveridge CA, Geelen D.抑制独角羚内酯促进不定根形成。植物信号行为学报2012;7:694-7。
- 14.
Borralho NMG, Wilson PJ。蓝桉初始生存和生根能力的遗传。抑制岩屑。Silvae麝猫。1994;43:238-42。
- 15.
Grattapaglia D, Bertolucci FL, Sederoff RR。巨桉和尾叶桉无性繁殖控制qtl的拟测试杂交和RAPD标记定位《应用理论》1995;90:933-47。
- 16.
克隆杨树不定根系统发育的模拟研究。在:戴维斯T,海西格B,编辑。不定根形成的生物学。纽约:全会出版社;1994.203 - 18页。
- 17.
植物生物学中新兴的模式系统:杨树(Populus)作为一种模式林木。植物生长学报2000;19:306-13。
- 18.
杨树:林业用拟南芥。我们需要一个模型树吗?安机器人。2002;90:681-9。
- 19.
基因组学和森林生物学:胡杨成为常年的宠儿。植物细胞。2002;14:2651-5。
- 20.
杨树基因组序列:一种生态优势植物的功能基因组学。植物科学进展2004;9:49-56。
- 21.
Tuskan GA, Difazio S, Jansson S, Bohlmann J, Grigoriev I, Hellsten U,等。黑杨木胡杨(Populus trichocarpa, Torr。&灰色)。科学。2006;313:1596 - 604。
- 22.
Drost DR, Novaes E, Boaventura-Novaes C, Benedict CI, Brown RS, Yin T, Tuskan GA, Kirst M.一种基于微阵列的基因分型和遗传定位方法用于高度杂合子的异交种,使未组装的trichocarpa基因组序列的大部分定位成为可能。植物j . 2009; 58:1054 - 67。
- 23.
Jansen RC, Nap JP。基因基因组学:来自分离的附加价值。趋势麝猫。2001;17:388 - 91。
- 24.
Drost DR, Benedict CI, Berg A, Novaes E, Novaes CRDB, Yu Q, Dervinis C, Maia JM, Yap J, Miles B, Kirst M.杨树器官分化中基因表达和转录网络的遗传结构多样性。中国科学(d辑:自然科学版)2010;
- 25.
Novaes E, Osorio L, Drost DR, Miles BL, Boaventura-Novaes CRD, Benedict C, Dervinis C, Yu Q, Sykes R, Davis M, Martin TA, Peter GF, Kirst M.不同氮水平下杨树生物量和木材化学的定量遗传分析新植醇。2009;182:878 - 90。
- 26.
张斌,童超,尹涛,张旭,朱葛强,黄敏,王敏,吴锐。利用函数映射法检测杨树不定根生长轨迹的数量性状位点。树Genet基因组2009;5:539-52。
- 27.
杨文华,杨文华,杨文华。东部杨木扦插早期根系生长的遗传力和C效应。遗传(Edinb)。1968; 23:239-45。
- 28.
应CC, Bagley WT.三角胡杨生根能力的变化。Silvae麝猫。1977;26:204-7。
- 29.
王晓燕,王晓燕,王晓燕,等。苹果微扦插中不定根形成阶段的研究。J Exp Bot 1995; 46:965-72。
- 30.
麻口K,田中K,坂井T, Sugawara S, Kawaide H,夏目M,花田A, Yaeno T, Shirasu K,姚H, McSteen P,赵Y, Hayashi K, Kamiya Y, Kasahara H。拟南芥生长素生物合成的主要途径。中国科学(d辑:自然科学版)2011;
- 31.
王晓燕,王晓燕。植物生长素生物合成途径的研究。J Exp Bot 2012; 63:2853-72。
- 32.
Boerjan W. superroot是拟南芥中的一个隐性突变,使生长素产生过剩。植物细胞在线,1995;7:1405-19。
- 33.
Delarue M, Prinsen E, Onckelen HV, Caboche M, Bellini C.拟南芥的Sur2突变确定了一个控制生长素稳态的新位点。植物j . 1998; 14:603-11。
- 34.
布昆T, Meier C, Foster R, Nielsen ME, Mundy J.赤霉素和油菜素内酯对特异性基因表达的控制。植物杂志。2001;127:450-8。
- 35.
christian MJ, Gingerich DJ, Hansen M, Binder BM, Kieber JJ, Vierstra RD. BTB泛素连接酶ETO1, EOL1和EOL2通过控制2型ACC合成酶水平共同调控拟南芥乙烯生物合成。植物j . 2009; 57:332-45。
- 36.
Stone EA, Ayroles JF。调制模块化聚类作为功能基因组推断的探索性工具。公共科学图书馆麝猫。2009;5:e1000479。
- 37.
Riemenschneider DE, Bauer EO。胡杨不定根形成能力的定量遗传分析。在:Altman A, Waisel Y编辑。根形成和发育的生物学SE - 36。65卷。美国纽约:施普林格;1997.p . 193 - 201。(基本生命科学)。
- 38.
Zalesny RSJ, Riemenschneider DE, Hall RB。杨树休眠硬木扦插的早生根:数量遗传学与基因型x环境相互作用分析。Can J For Res Can reach For. 2005; 35:918-29。
- 39.
韩k, Bradshaw HDJ, Gordon议员。杂交杨树F2家族的不定根和不定芽的体外再生是由主基因控制的。麝猫。1994;1(3):139 - 46所示。
- 40.
Schubert V, Weissleder A, Ali H, Fuchs J, Lermontova I, Meister A, Schubert I.拟南芥内聚蛋白基因缺陷可能影响姐妹染色单体对齐和基因组稳定性。Chromosoma。2009;118:591 - 605。
- 41.
赵艳。生长素生物合成:植物中色氨酸转化为吲哚-3-乙酸的简单两步途径。摩尔。2012;5:334-8。
- 42.
Normanly J, Cohen JD, Fink GR.拟南芥营养不良菌揭示了一种不依赖色氨酸的吲哚-3-乙酸生物合成途径。中国科学(英文版)1993;90:10355-9。
- 43.
王斌,褚娟,于涛,徐强,孙鑫,袁静,熊刚,王刚,王勇,李娟。拟南芥色氨酸依赖性生长素生物合成对早期胚胎发生的影响。中国生物科学进展2015;112:201503998。
- 44.
曾庆红ZB。定量性状位点定位中多连锁基因效应分离的理论基础。中国科学(英文版)1993;90:10972-6。
- 45.
丘吉尔GA,多奇RW。定量性状映射的经验阈值。遗传学。1994;138:963 - 71。
- 46.
张志强,张志强,张志强,等。一种简便高效的松木RNA分离方法。植物分子生物学报告1993;11:113-6。
- 47.
Bolstad BM, Irizarry RA, Astrand M, Speed TP。基于方差和偏差的高密度寡核苷酸阵列数据归一化方法比较。生物信息学。2003;19:185 - 93。
- 48.
Storey JD, Tibshirani R.全基因组研究的统计学意义。中国科学(d辑:自然科学版)2003;
- 49.
高志强,黄川勇,李志强,李志强。植物顺式作用调控DNA元件(PLACE)数据库:1999。核酸决议1999;27:297-300。
确认
这项工作得到了能源部、科学办公室、生物和环境研究办公室的支持,资助编号为DE-FG02-05ER64114和DE-SC0003893(给MK)。我们感谢福里达大学森林基因组实验室的所有工作人员和学生,感谢他们在数据收集方面的帮助,感谢Dudley Huber博士在实验设计方面的帮助。我们也感谢两位匿名审稿人,他们提供了宝贵的建议,改进了手稿。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明没有竞争利益。
作者的贡献
CR参与了分析并起草了稿件。CS进行数据收集和统计分析。DD参与了表型数据分析和遗传图谱的构建。EV参与了表型数据分析和遗传图谱的构建。CRDBN参与了微阵列实验。CD参与了研究的设计和数据的收集。MK构想了这项研究,参与了它的设计,并帮助起草了手稿。所有作者阅读并批准了最终稿件。
附加文件
额外的文件1:
谱系52-124的亲本累积根数。杂交种母本上产生不定根数的最小二乘平均数杨树trichocarpa×p .摘要52- - - - - -225(红线),和无血缘关系的男性父母p .摘要D124(蓝线),在水培溶液中保存25天。多克斯(67 kb)
额外的文件2:
根系构型和生物量性状的频率分布。家系52 ~ 124 225个个体根系构型和生物量性状的最小二乘均值频率分布父母的P。(D)和(p . trichocarpa×P.deltoides)×P.deltoides(TD)表示。在水培溶液中生长18天后进行测量。性状为总根长(cm,图A),总根表面积(cm2,面板B),总根体积(cm3.图C)、平均直径(mm,图D)、根枝长度(cm,图E)、根枝表面积(cm2图F),根枝体积(cm3.(图G),主根总长度(cm,图H),主根表面积(cm2(图I),主根体积(cm3.18 d不定根数(图K)和根系生物量(mg,图L)。
额外的文件3:
根系构型性状和根系生物量QTL检测。根系构型性状和根系生物量的各QTL区间解释表型变异。各连锁群(LG)、侧翼标记位置、LOD评分和阳性等位基因来源。(多克斯17 kb)
额外的文件4:
不定根性状数量的QTL检测。由根系性状数量的每个QTL区间解释的表型变异。各连锁群(LG)、侧翼标记定位、LOD峰值和阳性等位基因起源。(多克斯16 kb)
额外的文件5:
不同采集时间点的基因调控存在差异。不同采样时间的基因表达差异。该表根据杨树基因组的所有三个主要注释(v. 1.1, v. 2.2和v. 3.0)描述了每个杨树基因的名称,微阵列上探针的名称,方差分析中TIME效应的f检验FDR调整p值,以及TIME在0、24、48、96和192 h时的效应估计。
额外的文件6:
不同时间点间调控基因的差异。对比连续时间点时差异表达的基因数量。(多克斯44 kb)
额外的文件7:
差异调节基因之间PdQTL和PtQTL分类,在每个时间点。该表根据基因组的所有三个主要注释(1.1、2.2和3.0)、微阵列上探针的名称和基因表达差异(log)描述了每个杨树基因的名称2)之间的个人PdQTL和PtQTL类别。数据仅为那些基因和时间点之间的差异表达PdQTL和PtQTL显著,FDR校正p值为5%。(XLSX 139 kb)
额外的文件8:
聚类的转录组反应的差异PtQTL和PdQTL基因型。基因型间表达差异模式相似的基因聚类PtQTL和PdQTL类别,在所有时间点。(多克斯25 kb)
额外的文件9:
调制模块化簇的基因成员关系。基于基因型间表达差异相似模式的基因,检测到调制模块化簇的基因成员关系PtQTL和PdQTL类别,在所有时间点。(XLSX 262 kb)
权利和权限
开放获取本文根据创作共用署名4.0国际许可协议发布(http://creativecommons.org/licenses/by/4.0/),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于这篇文章
引用这篇文章
里贝罗,c.l.,席尔瓦,c.m.,德罗斯特,dret al。整合遗传,基因组和转录组信息确定假定的调控不定根形成杨树.BMC植物杂志16日,66(2016)。https://doi.org/10.1186/s12870-016-0753-0
收到了:
接受:
发表:
关键字
- 不定根
- QTL
- 杨树
- SUR2
- 营养繁殖