摘要
背景
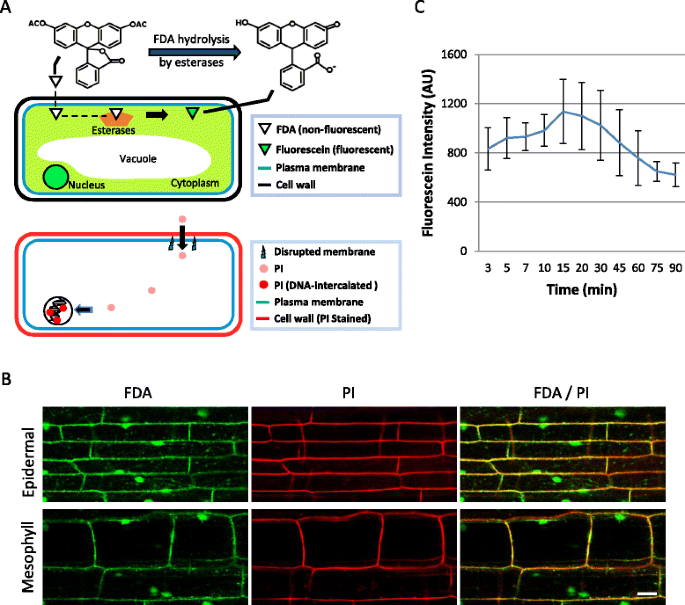
植物细胞死亡在植物-病原体相互作用中起着重要作用。为了研究病原体诱导的细胞死亡,需要使用细胞学工具,不仅可以确定宿主细胞的活力,还可以通过可视化病原体的发展来确定导致细胞死亡的细胞事件。在这里,我们描述了一种活细胞成像方法,为了解水稻细胞死亡的动态提供了见解(水稻).该方法利用荧光标记技术对机械损伤或侵犯的水稻鞘细胞进行活细胞共聚焦显微镜观察Magnaporthe oryzae与荧光染料二乙酸荧光素(FDA)和碘化丙啶(PI)一起。FDA只染色活细胞的细胞质,因此也可见液泡,而PI染色死细胞的细胞核。
结果
我们首先证明了用FDA和PI染色的水稻叶鞘共聚焦显微镜可以区分活细胞和机械杀死的细胞。fda来源的荧光素局限于活细胞的细胞质,表明完整的空泡和质膜。我们还在机械损伤的细胞中观察到以前未报道过的荧光素模式。这些形态包括:(1)细胞质中荧光素均匀分布于因液泡萎缩而增大的区域;(2)荧光素强度增加;(3)仅在受影响的细胞中包含较亮的荧光素信号,可能是由于胞间连丝的闭合。在本研究中,我们将这些称为新的荧光素模式。荧光标记的同时成像m . oryzae(红色)和FDA染色(绿色)在水稻细胞中显示了半生物营养相互作用的特征。也就是说,新入侵的细胞是活的,但当真菌扩散到邻近细胞时就会死亡,生物营养界面复合体与宿主的细胞质有关。这也揭示了受侵细胞中新的荧光素模式。时间延迟成像显示,受感染细胞的FDA染色模式从典型的细胞质定位(活细胞带有完整的液泡),发展为新的模式(死亡细胞胞间连丝闭合,液泡萎缩或破裂),到荧光缺乏(死亡细胞)。
结论
我们已经开发了一种方法来可视化在稻瘟病期间导致宿主细胞死亡的细胞事件。该方法可用于比较和对比水稻寄主细胞死亡与抗病性和易感性的关系-m . oryzae以及其他宿主与病原体的相互作用。
背景
植物受到各种病原体的挑战,植物细胞死亡可能与抗病性和易感性有关[1- - - - - -4].过敏细胞死亡是一种富含良好的抗性相关的细胞死亡,在感染部位迅速发生,并限制某些病原体的生长[2,4- - - - - -8]. 这种细胞死亡涉及调节过程,导致细胞死亡的特征性形态,称为程序性细胞死亡(PCD),与细胞完整性的意外破坏不同[2,4,8- - - - - -10].
为了研究植物-病原体相互作用中的细胞死亡,几种细胞学方法已经被普遍用于评估感染期间宿主细胞的生存能力。一种染料排除法使用某些染料,如色氨酸蓝和SYTOX,这些染料从活细胞的质膜中排除,但染色死细胞的内部成分[1,11].另一种方法是蔗糖诱导质裂,在高渗溶液(如0.5 M蔗糖)的存在下,活细胞的质膜脱离细胞壁[12,13]. 这些方法有助于确定宿主细胞活力是否与促进或限制病原体的生长相关,也有助于确定病原体的生活方式,如生物营养(从活宿主细胞获得营养)、坏死营养(从死宿主细胞获得营养),或半生物营养不良(最初从活的宿主细胞获得营养,但后来从死的宿主细胞获得营养)[14]. 然而,这些方法并没有提供细胞死亡前过程的细胞学细节。越来越多的证据表明,导致宿主细胞死亡的过程取决于病原体的生活方式,而液泡是这些过程中的关键细胞器[4,15- - - - - -18].因此,为了研究与病原体相关的植物PCD,需要一种细胞学工具,不仅可以确定宿主细胞活力,而且可以表征病原体发育过程中导致细胞死亡的细胞动力学。
荧光化合物的细胞可视化是分析细胞结构和活力的有用工具。FDA是一种荧光酯化合物,可以通过质膜,并被细胞内酯酶水解,产生带负电荷的不透膜荧光素,具有绿色荧光[19- - - - - -21.](图。1A).因此,FDA可以作为代谢活性活细胞的阳性检测方法[21.]. 此外,FDA染色还可以显示液泡,因为带负电荷的荧光素选择性地聚集在细胞质中,但被排除在液泡之外[22.].一些研究已经利用FDA可视化空泡,如在表皮细胞Pisum一[23.),毛状体的拟南芥[24.]和保护细胞蚕豆根尖[25.],但目前尚无基于fda的液泡动力学可视化对病原体反应的报道。FDA染色的是活细胞的细胞质和空泡,而PI染色的是死细胞的细胞核[26.]. PI穿过受损的细胞膜并与DNA插层,显示出明亮的红色荧光(图。1A).由于这种染料被完整的细胞膜所排除,PI是鉴别死细胞的有效染色剂。此外,PI对植物细胞壁的染色与细胞活力无关。
植物细胞的FDA和PI染色。一个植物细胞荧光素二乙酸酯(FDA)和碘化丙啶(PI)染色图。上图:非荧光FDA分子通过完整的质膜,被细胞内的酯酶水解产生荧光素。膜不透性荧光素在细胞质中聚集并呈现绿色荧光。底图:在质膜被破坏的不能存活的细胞中,PI进入细胞并与DNA插层,在细胞核中形成一个明亮的红色荧光复合物。PI还可以在活细胞和死细胞中染色细胞壁。b水稻鞘表皮细胞(上)和紧接着下的叶肉细胞(下)分别用FDA(绿色)和PI(红色)染色的单平面共聚焦图像。Bar = 20 μm。cFDA染色水稻鞘表皮细胞时程平均像素强度。蓝线是平均值 ± 细胞质荧光特定区域强度测量的标准差(n = 每个时间点6个)。荧光强度平均在染色后15分钟达到峰值,然后稳步下降
稻瘟病是由稻瘟病菌引起的一种重要的经济病害Magnaporthe oryzae. 在水稻叶片表面,真菌产生一种特殊的渗透细胞,称为附着胞,机械地侵入水稻表皮细胞[27.].基于光学透明叶护套的活细胞成像,细胞学研究已经记录了血脂性真菌侵袭和水稻细胞应答[12,13,18].真菌产生侵袭性菌丝(IH),填充第一次入侵的细胞,然后扩散到邻近的细胞。第一个细胞的初始入侵和相邻细胞的连续入侵是生物营养的,因为被入侵的细胞保留了响应高渗溶液的质酶解能力。在生物营养入侵过程中,IH与生物营养界面复合体(BICs)有关,BICs被认为是通过侵袭性菌丝膜(EIHM)将效应蛋白传递到宿主细胞质中[28.].到达被入侵细胞的细胞质的效应蛋白移动到毗邻的未被入侵的宿主细胞,这表明被入侵的细胞与周围的细胞保持着共同的连续性,并且这些周围的细胞为随后的入侵做好了准备[28.].当IH转移到邻近细胞时,被入侵的细胞似乎失去了活力。有人认为,寄主液泡的保持对寄主成功入侵具有重要意义m . oryzae[18].
在这里,我们描述了一种活细胞成像方法,通过活细胞共焦显微镜观察被荧光标记物机械损伤或侵入的水稻鞘细胞,提供细胞死亡动力学的见解m . oryzae与FDA和PI一起。利用这种方法,我们证明了最初入侵的水稻细胞是有活力的,但当真菌进入邻近细胞时失去活力。此外,该方法还揭示了在水稻细胞的伤口和病原体诱导死亡中FDA染色模式的意外变化。这使得我们可以假设在易感水稻细胞定植期间导致植物细胞死亡的细胞学事件序列m . oryzae.
结果与讨论
用FDA和PI双染色水稻细胞
为了确定水稻细胞的FDA染色模式,我们用手工修剪的稻壳[12]以FDA工作液(2μg/ml,0.2%丙酮)为包埋剂。FDA染色鞘的共聚焦显微镜显示,与细胞核相关的细胞壁附近有亮绿色荧光,在表皮细胞和下面的叶肉细胞中有细的荧光链(图1)。1B.).这些模式与活植物细胞的细胞质和核质中的荧光素一致,这些细胞包含一个大的中央空泡,导致靠近细胞壁的薄薄的细胞质层和穿过空泡的细胞质链[19,23.,29.].由于非荧光的FDA被细胞内酯酶转化为荧光素类似物显示绿色荧光(图。1A) [20.,21.),我们手工修剪的鞘条上的明亮荧光染色证实了表皮层和一、两层叶肉细胞仍然存活,代谢活跃。
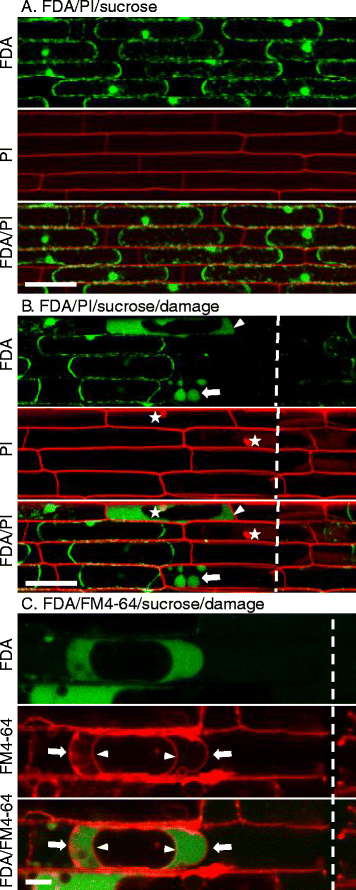
作为FDA的计数器污渍,我们还染色了用PI(10μg/ ml)的切除米鞘。为了确保FDA和PI之间的荧光检测中没有重叠,我们首先用每种染料进行单独染色并通过为两者配置的检测进行成像。单独的FDA染色不产生可检测的红色荧光,而单独的PI染色没有产生可测量的绿色荧光(数据未显示)。这表明绿色荧光特异于荧光素,红色荧光特异于PI,并且在任一通道中未收集自发荧光。在双FDA / PI染色时,在表皮内并立即观察到细胞质荧光素,并且在细胞壁中观察到PI荧光,但不在核(N> 300)中(图。1B.).细胞核缺乏PI染色表明,在我们手工修剪的鞘中,最上面的两层细胞是可行的,这与FDA的应变结果一致。水稻细胞的活力通常是通过蔗糖诱导的质裂试验来测定的,其标志是活细胞的质膜从细胞壁上缩回[12,13].为了确保水稻细胞显示细胞质荧光素和细胞核中PI染色的缺失与基于质分解的实验一致,我们在FDA/PI双染色后用0.5 M蔗糖处理水稻鞘。在10min的蔗糖处理(n > 150)后,所有细胞均出现胞质荧光素和胞核不含PI(图1)。2A),一致证实了水稻细胞的存活。
直接受损细胞旁细胞质中的新荧光素模式。一个共聚焦图像显示FDA(绿色)和PI(红色)的双重染色,随后用0.5 M蔗糖处理,以诱导活细胞的质浆溶解。Bar = 50 μm。b共聚焦图像显示双FDA/PI染色,然后用0.5 M蔗糖诱导活细胞的浆质分解,然后用剃刀机械损伤。白色虚线表示剃须刀鞘被损坏的地方。白色星星表示PI染色的核。白色箭头表示含有荧光素的膜结合室。箭头表示荧光素均匀分布在细胞质中,但不存在于液泡中。Bar = 50 μm。c用FM4-64处理水稻细胞2小时,FDA处理10分钟,0.5 M蔗糖处理10分钟,然后用剃刀机械损伤。白色虚线表示细胞被剃刀损坏的地方。FM4-64染色质膜(箭头)和液泡膜(箭头),荧光素(绿色)保留在细胞质中。酒吧 = 10微米
FDA染色动力学
为了确定FDA染色后荧光产生的速率和检测时间,切除的鞘被安装在FDA工作溶液中,并通过时间过程共聚焦显微镜进行分析。追踪选定的细胞质区域内荧光素的强度,以比较荧光强度随时间的变化。平均而言,强度在15分钟达到峰值,然后缓慢下降。1C).虽然荧光素的强度在90分钟后减少到峰强度的大约一半,但通过调节共聚焦设置以增加荧光检测灵敏度(数据未示出),仍然在染色后仍然可检测到仍然是可检测的。荧光素在水稻细胞质中的快速积累和持续性使FDA成为一种方便的染料来处理和用于活细胞荧光显微镜。
机械损伤水稻细胞中新的荧光素模式
为了确定荧光素和磷脂酰肌醇(PI)的模式在受伤后会发生怎样的变化,我们用剃须刀片在FDA/PI染色的鞘中引入了划痕。在荧光素染色的活细胞中,添加0.5 M蔗糖可使原生质体脱离细胞壁(图。2B.). 大多数直接损伤的细胞完全缺乏荧光素,细胞核用PI(n)染色 > 100),表明活性丧失(图。2B.). 有时,在直接损伤的细胞中观察到含有荧光素的膜结合球形隔室(n=(图8)。2B.).出乎意料的是,我们还在直接受损的细胞(n = 15) (图。2B.).这些模式包括:(1)荧光素的均匀分布在整个细胞质的增加的内容增加,伴随地减少了液泡;(2)通过增加酯酶活性或可在低pH下发生的FDA的FDA水解,荧光素强度的增加可能导致的荧光素强度可能导致更多FDA。20.];(3)仅在受影响的细胞内容纳较亮的荧光素,可能是由于胞间连丝的闭合。在本研究中,我们将这些模式称为新的荧光素模式,因为它们不同于在中央有一个大液泡的活表皮细胞中观察到的典型细胞质荧光素(图。1B.和2A)以及之前报告中描述的模式[23.,24.,29.,30.].使用FM4-64染色质膜和空泡膜[31.[我们证实,荧光素释放出一种新型图案的荧光素被排除在液泡(N> 200)之外(图。2C).
显示新的荧光素模式的细胞通常包含pi染色的细胞核,不能浆溶(n=(图22)。2B.). 细胞质荧光素和细胞核PI的阳性染色似乎是矛盾的,因为荧光素只保留在完整的膜中,PI染色的细胞核的出现表明膜的完整性丧失。然而,这可能是由于荧光素和PI在部分通透性的质膜上的扩散速率不同造成的。我们推测这些细胞处于细胞解体过程中,膜完整性丧失,逐渐使PI进入细胞,荧光素扩散出去(图。2B.).总之,我们的结果表明,双重FDA/PI染色对水稻鞘细胞是一种强大的活力检测方法,而且新的荧光素模式可以作为细胞死亡期间发生的细胞学事件(如空泡收缩)的指标。
FDA指出水稻细胞感染稻瘟病菌后的活力
为了评价FDA染色在真菌侵染过程中的效果,我们将一株转基因菌株接种在水稻的叶鞘上m . oryzaeCKF1997型。该菌株组成性表达细胞质红色荧光蛋白,通过共聚焦显微镜分析,可同时观察水稻细胞中的真菌菌丝(红色)和荧光素(绿色)。
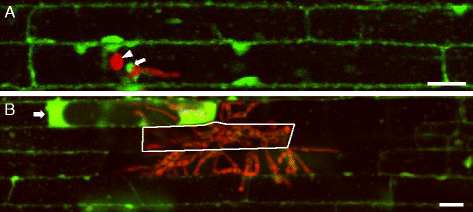
在感染早期(接种后约28 h, hpi),真菌通过附着胞侵入表皮细胞并产生IH。经FDA染色后,我们观察到浸润和未浸润细胞(n = 33例感染)(图。3A),证实了先前关于这一阶段宿主细胞是活的,菌丝入侵是生物营养性的报道[12,13].此外,我们观察了寄主细胞侵袭的早期阶段与BICS相关的荧光素(n=(图30)。3.)与以前观察到的BICs被寄主细胞质包围的现象一致[18,28.].
水稻稻瘟病入侵早期和晚期宿主细胞活力。一个水稻叶鞘表皮细胞感染的单平面共聚焦图像m . oryzae转质CKF1997表达细胞质td番茄(红色)在28 hpi和FDA染色(绿色)。附着胞(箭头)介导穿透宿主细胞产生IH。荧光素定位于受感染和非受感染细胞的细胞质中,也与BIC相关(箭头)。b连续3幅z-stack图像的最大投影面积为6μm,显示水稻叶鞘表皮细胞感染了病毒m . oryzae转化CKF1997在48 hpi和FDA染色。IH(红色)已扩散成两个细胞,远离最初被侵的细胞,显示实白色轮廓。新被侵细胞和未被侵细胞均显示荧光,而完全被侵细胞和部分被侵细胞均缺乏荧光素。在部分浸润的细胞(白色箭头)中观察到一种新的荧光素模式(增大的细胞质中荧光更亮)。棒= 20 μm
在稍后的感染阶段(〜48 HPI),IH从最初侵略的细胞中分散了两到三个细胞,并且我们观察到了生物和死宿细胞的共存(n = 28例感染)(图。3B.). 在感染区边缘的一些侵入细胞中典型的细胞质荧光素或在部分或完全定植的细胞中缺乏荧光素代表了细菌的半营养生活方式m . oryzae,在这种情况下,活宿主细胞被入侵,但在IH扩散到邻近细胞时被杀死[13].有趣的是,许多部分被侵染的细胞显示出新的荧光素模式,如增大的细胞质(n = 65)(图。3B.)我们在机械损伤的细胞中观察到(图。2 b和c). 这表明植物细胞的死亡是由植物成功入侵引起的m . oryzae机械损伤涉及相似的形态学特征。对产生新的荧光素模式的过程的进一步研究可能为细胞反应和细胞死亡模式提供新的见解。
水稻稻瘟病入侵的延时成像
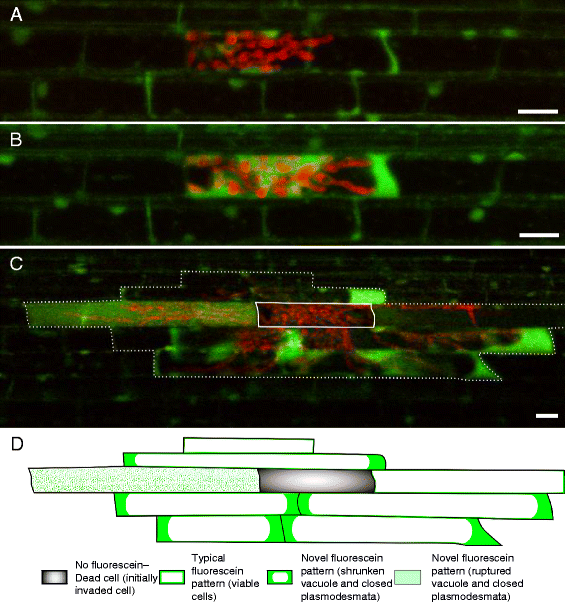
为了确定水稻稻瘟病侵染期间宿主细胞死亡的动态,我们对水稻鞘层进行了时间过程共聚焦显微镜观察m . oryzaeCKF1997型(n= 3)。一旦大部分初始细胞定植(30 hpi),我们用FDA对感染组织进行染色。与~ 28hpi时的感染类似(图。3A),最初被侵的细胞表现出典型的细胞质荧光素模式(图)。4a级).2小时后(32 hpi),同样的感染部位进一步被IH定植,显示出新的荧光素模式(图。4b级). 当第二天(48hpi)观察到相同的感染部位时,IH已经扩散到随后的两个相邻细胞中。与对照感染相比,菌丝生长似乎没有受到FDA的影响,但很少检测到荧光素(数据未显示)。因为荧光素在水溶液中的不稳定性使其强度随时间而降低[32.],我们再次染色相同的鞘安装在一个新准备的FDA工作溶液。这导致了被侵染水稻鞘中荧光素的补充,我们能够观察到典型的和新的荧光素模式(图。4摄氏度),与以前48 hpi时感染的结果一致(图。3B.).我们还观察到整个被侵细胞内均质荧光素(图。4摄氏度)说明液泡破裂了。延时成像显示,感染宿主细胞的FDA染色模式从典型的细胞质定位(完整液泡的活细胞)发展到新的模式(胞间连丝闭合、液泡萎缩或破裂的死亡细胞),再到缺乏荧光(死细胞)。综上所述,我们的结果表明,荧光素动态染色植物细胞在细胞死亡造成的各种刺激。
结论
我们开发了一种荧光成像方法来观察水稻细胞在机械损伤或真菌入侵下的死亡动态。这种方法利用了(a)活细胞共聚焦显微镜,(b)光学透明的水稻鞘细胞,(c)荧光标记的组合m . oryzae(D)荧光致命染料PI和FDA。特别是,我们发现FDA是一个有用的调查工具,其不仅用于细胞活力,而且在真菌侵袭期间用于宿主真空动力学。此外,该方法在伤口和病原体诱导的水稻细胞死亡期间揭示了荧光素模式的意外变化。这使我们能够假设在易感水稻细胞的定植过程中导致水稻细胞死亡的细胞学事件序列m . oryzaeIH:(i)活的具有完整液泡的宿主细胞,(ii)液泡收缩,酯酶活性增加,胞间连丝闭合,(iii)液泡塌陷,和(iv)感染细胞死亡。该方法可用于比较和对比水稻寄主细胞死亡与抗病性和易感性的关系-m . oryzae以及其他宿主与病原体的相互作用。
方法
植物和真菌菌株
米饭(水稻)菌株YT16在白天温度为28℃,夜间温度为24℃的Conviron PGW36生长箱中,在长日照条件下(14/10h,白天/夜晚)生长。植物生长在4“盆与范福德3B土壤混合。种植时先加入铁螯合液(3.25%铁螯合液),然后每周施20-10-20泥炭肥一次。我们创造了m . oryzae转基因株系CKF1997m . oryzae农杆菌介导质粒pCK1292转化野生型O-137菌株的研究[33.].从pAN582中克隆tdTomato基因获得pCK1292 [34.]在本构启动子的控制下m . oryzae双载体pBGt的核糖体蛋白27基因[35.].
感染测定
如前所述进行稻壳接种[13].简单地说,从17- 21日龄的植株上剪下叶鞘(5-9厘米长),用孢子悬液(2 × 10)接种4孢子/ml无菌水中)。接种的鞘层在22-28 hpi手工裁剪,并立即用于应变或共聚焦显微镜。
染色程序和质浆分离
荧光素二酸(FDA;目录No.F7378,5g Power; Sigma)溶解在丙酮中以1g / ml的储备浓度。通过在1ml水中稀释2μl储备溶液来制备工作溶液(2μg/ ml)FDA。通过在1ml水中稀释10μl储备溶液,制备10μg/ mL的PI(目录号P3566; 10ml 1mg / ml溶液)的溶液。通过将2μLFDA储备溶液和10μl的PI储备溶液在最终体积的1mL水中混合来制备双FDA / PI工作溶液。通过将100μg溶解在9.2μl水中,制备17毫米的FM4-64(目录号T13320; 10×100μg;热炉)。通过在1ml水中稀释1μl储备溶液来制备17μm的工作溶液。通过将护套在1mL0.5μm蔗糖中浸没10分钟,然后在同一蔗糖溶液中安装鞘进行等离子体分解。
共聚焦显微镜和图像分析
共聚焦显微镜采用蔡司LSM 510 Meta激光扫描共聚焦显微镜。荧光素用488 nm激光激发,发射波长在505 ~ 530nm之间,tdTomato用543nm激光激发,发射波长在560 ~ 615 nm之间。用543 nm激光激发PI,用615 nm长通滤波器采集发射。图像处理使用Zen软件(Black edition, version 10.0, Zeiss)。
数据和材料的可用性
支持本文结果的数据集包含在本文中。
缩写
- 银行识别码:
-
biotrophic界面复杂
- 艾姆:
-
侵入性菌丝膜
- 食品药品监督管理局:
-
双乙酸酯荧光素
- hpi公司:
-
接种后小时数
- IH公司:
-
侵入性菌丝
- 纤毛运动:
-
程序性细胞死亡
- PI:
-
碘化丙锭
工具书类
- 1.
超敏反应促进植物被坏死病原菌感染葡萄孢菌.咕咕叫医学杂志。2000;10(13):751 - 7。
- 2。
细胞程序性死亡在植物-病原体相互作用中的作用和调控。细胞Microbiol。2004;6(3):201 - 11。
- 3.
Mengiste T.植物免疫到坏死性。Annu Rev phytopathol。2012; 50(1):267-94。
- 4.
Dickman MB,Fluhr R.植物微生物相互作用中宿主细胞死亡的中心。Annu Rev phytopathol。2013; 51(1):543-70。
- 5.
Morel J-B, Dangl JL。植物超敏反应与细胞死亡的诱导。细胞死亡不同。1997;4:671-83。
- 6.
控制细胞死亡,植物生存与发育。细胞生物学杂志。2004;5(4):305-15。
- 7.
Mur LAJ、Kenton P、Lloyd AJ、Ougham H、Prats E。超敏反应;一百周年就要到了,但我们知道多少?J实验机器人。2008;59:501–20.
- 8.
范多恩WG,啤酒EP,Dangl JL,富兰克林通德,Gallois P,Hara-Nishimura I,Jones Am,Kawai-Yamada M,Lam E,Mundy J等人。植物细胞死亡的形态学分类。细胞死亡有所不同。2011; 18(8):1241-6。
- 9
琼斯上午。在开发和防御中编程细胞死亡。植物理性。2001; 125(1):94-7。
- 10.
Wertman J,Cord C,Dauphinee A,Gunawardena A.在蕾丝植物中编程细胞死亡期间细胞拆解的途径(马达加斯加隐孢子虫)树叶。植物生物学。2012;12(1):115.
- 11.
关键词:细胞死亡,细胞自噬,细胞凋亡菌核病sclerotiorum. 公共科学图书馆。2013;9(4):e1003287。
- 12.
Koga H,Dohi K,Nakayachi O,Mori M。一种新的细菌接种方法稻瘟病菌利用完整的水稻叶鞘进行侵染过程的细胞学观察。植物病理学杂志。2004;64:67-72。
- 13。
关键词:稻瘟病菌,膜动力学,胞间连丝,水稻abstract:植物细胞。2007;19(2):706 - 24。
- 14。
霍巴赫R,纳瓦罗·克萨达AR,克诺格W,迪辛HB。何时及如何杀死植物细胞:植物病原真菌的感染策略。植物生理学杂志。2011;168(1):51–62.
- 15.
鸠山N、鸠山由纪夫M、山田K、网溪T、津田S、近藤M、西村M、西村原I。植物液泡蛋白酶,VPE,介导病毒诱导的超敏细胞死亡。科学。2004;305(5685):855–8.
- 16
Hatsugai N、Iwasaki S、Tamura K、Kondo M、Fuji K、Ogasawara K、Nishimura M、Hara Nishimura I。一种新的膜融合介导的植物抗病原菌免疫。基因发展,2009年;23(21):2496–506.
- 17
Hirakawa Y,Nomura T,Hasezawa S,Higaki T.通过培养滤液引发的植物细胞死亡期间的液泡结构简化卡氏欧文氏菌.中国生物医学工程学报,2015;
- 18
Mochizuki S, Minami E, Nishizawa Y. Live-cell imaging of rice细胞学变化揭示了宿主液泡维护对稻瘟病菌生物营养入侵的重要性。Magnaporthe oryzae.微生物学开放。2015;4(6):952 - 66。
- 19
植物侧根形成的一个途径拟南芥.基因Dev。1995;9(17):2131 - 42。
- 20.
荧光素二乙酸酯水解活性的测定:土壤样品的优化。土壤生物化学学报。2006;38(4):693-701。
- 21.
Saruyama N、Sakakura Y、Asano T、Nishiuchi T、Sasamoto H、Kodama H。用荧光素二乙酸酯活染色法定量培养植物细胞的代谢活性。肛门生物化学。2013;441(1):58–62.
- 22.
Fricker M ., Parsons A ., Tlalka M ., Blancaflor E ., Gilroy S ., Meyer A ., Plieth C.。答案:Hawes C, Satiat-Jeunemaitre B, editors。植物细胞生物学。纽约:牛津大学出版社;2001.35 - 84页。
- 23.
梅勒什DG,希思MC。在真菌侵染过程中,植物防御反应的表达需要质膜细胞壁的粘附。植物细胞。2001;13(2):413–24.
- 24.
拟南芥中肌动蛋白相关蛋白2和3的突变影响细胞形状发育。植物细胞。2003;15(7):1632 - 45。
- 25。
高×Q,李春光,魏鹏鹏,张×Y,陈杰,王×C。保卫细胞液泡膜的动态变化对气孔运动具有重要意义蚕豆根尖.植物杂志。2005;139(3):1207 - 16。
- 26。
谷丙氨酸诱导细胞程序性死亡的研究进展诉出发细胞悬液的文化。植物科学。2006;171(6):734 - 44。
- 27。
Ryder LS, Talbot NJ。病原真菌附着胞发育的调控。植物生物学杂志。2015;26:8-13。
- 28
Khang CH, Berruyer R, Giraldo MC, Kankanala P, Park S- y, Czymmek K, Kang S, Valent bMagnaporthe oryzae效应子进入水稻细胞及其随后的细胞间运动。植物细胞。2010;22:1388 - 403。
- 29
一种用共聚焦显微镜鉴定活植物组织中不可活细胞的简单方法。工厂方法。2008;4(1):15。
- 30.
Krasnow M, Matthews M, Shackel K.证据表明正常发育的葡萄细胞膜完整性和细胞活力得到了实质性的维持(vitis ViniferaL.)浆果。机器人学报。2008;30(4):549 - 554。
- 31.
Vida TA,呃,SD。一种用于观察酵母液泡膜动力学和内吞作用的新的重要染色剂。细胞生物学杂志。1995;128 - 779。
- 32.
博伊德五世,乔洛瓦,奥姆,爸爸。使用荧光素二乙酸酯/碘化丙啶(FDA/PI)和细胞渗透性核酸染色法测定胰岛存活率的局限性。当前趋势生物技术制药。2008;2:66–84.
- 33.
Khang CH, Park S-Y, Rho H-S, Lee Y-H, Kang S.丝状真菌(稻瘟病菌和尖孢镰刀菌). 在:农杆菌协议,第2卷,2006年。403–20.
- 34.
关键词:拟南芥,细胞器标记,共定位,生物信息学51植物j . 2007;(6): 1126 - 36。
- 35.
关键词:植物根系,camp依赖,蛋白激酶A,失活尖孢镰刀菌.植物微生物学报。2011;24:719-32。
致谢
我们感谢康实验室的现任和前任成员(http://www.khanglab.org/),供他们帮助和讨论。我们感谢佐治亚大学生物医学显微镜核心在蔡司LSM 510共聚焦显微镜成像方面的帮助。本研究得到了美国农业部国家食品与农业研究所2014-67013-21717农业与食品研究计划竞争性赠款项目的支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有相互竞争的利益。
作者的贡献
CHK和KJ构思并设计了实验。KJ和DWK进行了实验。K.J.和JSP制作了数字。CHK和KJ分析了数据并撰写了论文。所有作者都已阅读并批准了手稿的最终版本。
权利和权限
开放获取本文在知识共享归属4.0国际许可条款下发布(http://creativecommons.org/licenses/by/4.0/),允许在任何介质中不受限制地使用、分发和复制,前提是您给予原始作者和来源适当的信任,提供到知识共享许可证的链接,并说明是否进行了更改。知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
琼斯,金姆,d.w.,帕克,J.S.et al。活体细胞荧光成像研究稻瘟病菌侵染过程中植物细胞死亡的动态Magnaporthe oryzae.BMC植物BIOL.16,69 (2016). https://doi.org/10.1186/s12870-016-0756-x
收到了:
接受:
发表:
关键字
- Biotrophic界面复杂
- 共焦显微镜
- 荧光素二酸
- 半生物营养不良
- Host-pathogen交互
- 水稻
- 胞间连丝
- 程序性细胞死亡
- Propidium碘化
- 液泡