抽象的
背景
Fusarium oxysporum感染导致镰刀一直在枯萎的威尔,这是亚麻最大的损失(Linum Usitatissimum.作物产量。植物感染Fusarium oxysporum表现出严重的脱水症状,因为真菌在维管组织中生长。随着病害的发展,可以观察到血管褐变和叶片黄变。如果是毒性更强的菌株,植物就会死亡。病原体的攻击开始于分泌的酶降解宿主细胞壁。本研究的主要目的是探讨细胞壁聚合物在亚麻植物对侵染反应中的作用,以便更好地了解抗病过程,并开发新的途径来保护植物免受侵染。为此,研究了亚麻苗期细胞壁聚合物代谢相关基因的表达及相应的聚合物水平Fusarium oxysporum.
结果
通过选择对感染不同的两组基因来促进该分析。第一个组包含受感染强烈影响的基因,并发以后激活(苯丙氨酸氨裂解酶和葡糖糖基转移酶)。第二组包含略微受影响的基因(最多五次),它们的表达随着感染进展而变化。Fusarium oxysporum感染没有影响细胞壁聚合物的含量,但改变了它们的结构。
结论
结果表明,细胞壁聚合物在植物反应中的作用Fusarium oxysporum通过改变它们的基因和细胞壁聚合物的重排的变化表现出感染。我们的研究提供了有关纤维素和半纤维素在感染过程中的作用的新信息,其结构的变化以及在病原体感染期间参与其新陈代谢的基因的表达。我们还确认了果胶和木质素在该过程中的作用,表明木质素代谢基因的mRNA水平和果胶结构的松动的主要变化。
背景
亚麻(Linum Usitatissimum.)是一种独特的植物,是一种有价值的纤维和油来源。亚麻原料适用于许多工业分支:医学,药房和化妆品。据估计,大约20%的亚麻培养损失是具有镰刀菌病的结果。这些疾病由镰刀种属真菌导致产量、籽粒和纤维品质下降。对亚麻的致病性最高的是F. oxysporum.F。sp。linii,这会导致亚麻枯萎[1那2].
植物细胞壁是对病原体感染的第一个物理屏障。在感染的第一阶段期间,病原体分泌酶降解细胞壁:果胶酶,纤维素酶和半纤维素酶。它们的首次目的是果胶的降解,导致细胞壁结构的松动,从而能够消化以下聚合物:纤维素和血管纤维素[3.那4.].在植物中的殖民化期间,产生抗真菌化合物:Phytoalexins,Pr蛋白,小抗真菌肽和反应性氧物质[5.-7.].PR蛋白在感染部位、邻近组织和非感染组织中局部积累,为植物抵抗后续感染提供了条件。作为植物系统反应的一部分,这些基因在病原体攻击后不会立即被激活,尽管它们的分析足以确定感染的初始阶段[8.那9.].
植物细胞壁是一种动态结构,由多糖聚合物(纤维素,半纤维素和果胶)和非多糖聚合物(木质素)和蛋白质(结构和酶)组成[10.].细胞壁组合物在其生长,发育和植物对非生物和生物应激因子的生长,发育和植物反应中严格调节在不同类型的细胞中[11.].
纤维素由长而非分枝的微纤维组成,由β-1,4-葡萄糖链组成,它们通过氢键和范德华力横向连接。纤维素结构有两种:高度聚合有序和较少聚合松散无定形[12.].描述纤维素结构的参数是结晶度指数(CI),它决定纤维素中结晶度的含量[13.].在纤维素生物合成期间,通过锚固在细胞膜中的大蛋白质复合物和六个亚基组成的关键作用,每个亚单位组成,由六种蛋白质(纤维素合成酶; CESA)组成;14.].
半纤维素由低分子质量的异源多糖组成。半纤维素有五种不同的种类:木葡聚糖、木聚糖、甘露聚糖、葡甘露聚糖和β-(1→3,1→4)葡聚糖[15.那16.].关于半纤维素类的多样性,许多属于甘糖基转移酶的蛋白质家族的酶参与该异质聚合物的合成[17.-19.].在半纤维素的降解过程中,许多酶参与其中,除其他外endo-β-1,4-木聚糖酶,外甲基酶,β-1,4-木糖苷酶,α-1,4-木糖苷酶,α-阿拉伯呋喃糖苷酶,α-葡糖醛酸酶,β-甘露糖苷酶,β-甘露糖苷酶和β- -葡糖苷酶[18.].
果胶是多糖的复合物,其主要成分是与α-1,4-糖苷键合的半抗果酸(Galac)(果胶中的约70%)的分子。另外,存在鼠李糖,阿拉伯糖,木糖,半乳糖酸和半乳糖。果胶有四种结构类型,称为果胶结构域:同源肌肌炎(Hg),XylogalactuRonan(XGA),rhamnogalacturonan I(RGI)和rhamnogalacturonan II(RGII)[20.].果胶生物合成涉及糖基转移酶、甲基转移酶和乙酰转移酶等约70种酶。最重要的是udp - d -半乳糖酸4-异丙酯酶(GAE) [21.],α-1,4-半乳糖酰基转移酶(Gaut),rhamnogalactuRonanan的Xylosyl转移酶II(RGXT)[22.那23.],木糖苷转移酶(XGD),阿拉米糖基转移酶(Araad),半乳糖基转移酶(GAL),木糖苷改移酶[20.那21.那24.]和甲基转移酶(PMT)。在同偶琥珀醛水解的过程中,下列酶参与:外泌体和止气聚氨酯(通过水解),果胶裂解酶和果胶裂解酶(通过渗透率作用),果胶甲基酯酶和果胶乙酰酯酶;在水解RhamnogalactuRonan I:rhamnogalacturonan水解酶,鼠李菇裂解酶,rhamnogalactulanan rhamnohydroxylase,rhamnogalactulanan rhamnohydrolase,rhamnogalactulananal ron羟基羟基羟基羟基羟基羟基苯甲酰基酶和rhamnogalacturonan乙酰酯酶;在XylogalactuRonan的水解中:外虫肺酸酶和内甲酰甲酸酯酶羟基羟基化酶[25.].
在病原菌侵染过程中,果胶脱酯化在植物防御反应中起着关键作用。果胶脱酯化导致游离羧基的生成,改变细胞壁的pH值,使聚醛酸酯聚集在凝胶结构上,从而导致细胞壁孔隙度的变化[26.].另外,该方法能够通过果胶聚氨酯酶,果胶裂解酶和果胶裂解酶进行Hg降解[27.].果胶的甲基酯化水平决定了植物对病原体感染的敏感性。Hg中的半乳糖醛酸的甲基化残基的高含量对应于植物阻力的增加[28.那29.].此外,果胶的甲基酯化的水平和图案影响了多糖抑菌酶的活性,这是对同源肌炎链的短片段的产生,其是在病原体中发挥至关重要的ElicogeruRonids(OG)的Eligogaluctulonides(OG),其内源性分子通过增强植物自然反应来抗辩反应[30.-32.].
木质素包含芳族聚合物的复合物,其主要是血管植物的二次细胞壁中的局部化。有三种类型的木质素聚合物:G木质素(Guaiacyl-lignins),S木质素(陶氏木质素)和H木质素(羟基香豆素木质素),其由相应的单醇(羟基氨基醇)组成:Coniferyl酒精,突触醇和p-coumaric酒精[33.].Lignification是一种动态过程,包括生成木质素聚合物及其在植物细胞壁中的嵌入[33.].这一过程包括以下几个阶段:在细胞质中合成单木质素,将单木质素转运到细胞壁,并聚合生成木质素复合体。木质素合成途径是苯基丙素合成途径中的一条。许多酶参与这些反应:苯丙氨酸解氨酶(PAL)、4-香豆酸:辅酶A连接酶(4CL)、羟基肉桂酰辅酶A shikimate/quinate羟基肉桂酰转移酶(HCT)、咖啡酰辅酶A o -甲基转移酶(CCoAOMT)、儿茶酚o -甲基转移酶(COMT)、肉桂酰辅酶A还原酶(CCR)、突触醇还原酶(SAD)、肉桂酰醇脱氢酶肉桂酸4-羟化酶、对香豆酸3-羟化酶和阿ferulate 5-羟化酶(F5H) [34.-36.].在细胞壁中,通过氧化活化,并产生稳定的单甘醇基团,其能够与生长的木质素聚合物结合。单甘醇氧化的反应被过氧化物酶(POX),漆酶(LAC)和其它酚醛氧化酶催化[33.-35.]也负责木质素降解的酶[37.].
通过加强细胞壁,木质素提供了一个更好的屏障,以抵御病原体的攻击。生物胁迫因子引起的木质素合成增加是由苯丙素途径刺激和木质素聚合引起的[38.那39.].
基因工程的发展能够产生遗传修饰的植物,其特征在于增加对病原体感染的抗性增加。亚麻更耐受F. oxysporum.和F. Culmorum.感染是由与发病机制有关的基因(PR基因)过表达引起的[40]次生代谢物的基因[41.-43.].
对细胞壁组分进行研究,以发现其在植物抗病中的重要意义是有必要的。
本研究的目的是估算亚麻细胞壁聚合物的作用响应于Fusarium oxysporum.通过分析涉及这些化合物的代谢的基因的表达水平,并通过分析亚麻酸的相应代谢物,响应于致病性真菌来阐明细胞壁聚合物(纤维素,半纤维素,果胶和木质素)的重要性。
结果
孵育亚麻幼苗的表型分析Fusarium oxysporum
为了确定细胞壁聚合物在亚麻中的作用响应于致病菌株的响应Fusarium oxysporum将感染的亚麻幼苗与真菌孵育6,12,24,36和48小时。在随后的孵化期间,拍摄转移的植物(附加文件1:图S1)。在转移后24小时内观察到亚麻幼苗的第一个表型变化。幼苗的子叶仍然是绿色的,而不定根提示变得坏死,并且滋润时间的坏死进展。最初,在24小时后,只有少数根细胞变得坏死,而在48小时后,大部分根部都观察到坏死的变化。尽管如此,那个宫耳仍然是绿色和坚定的F. oxysporum.在MS培养基的表面上未观察到菌丝体。转移后,分析的最后潜伏期为48小时,植物保留其绿色和Turgor,从而能够激活其防御机制。在孵育的连续时间内,感染的进展导致亚麻籽的弱化和衰弱(数据未显示);因此,他们的详细分析被遗弃了。
pr基因的表达在感染的亚麻幼苗中增加Fusarium oxysporum
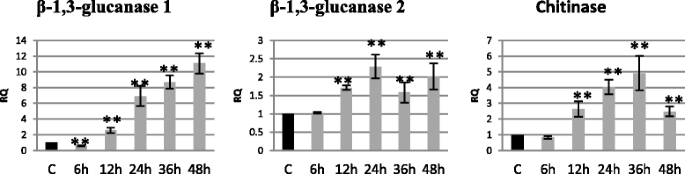
为了确定感染的早期阶段,我们调查了在与病原菌孵育6和12 h期间发生的变化。我们测定了PR基因的mrna水平,因为已知PR基因在植物中响应病原菌感染时强烈表达。亚麻PR基因表达的变化Fusarium oxysporum真菌菌株在图2中示出。1.分析的基因的特征在于6小时的孵育(β-1,3-葡聚糖酶2和几丁质酶)或较低的表达(×40%),然后在随后的孵育时间增加β-1,3-葡聚糖酶1.在孵育期间β-1,3-葡聚糖酶1的表达水平(在48小时内从12小时的2.6倍至11倍)。发现几丁质酶基因的表达模式。其成绩符的水平从12小时的2.6倍增加到36小时,并在对照中掉落至2.5倍。β-1,3-葡聚糖酶2的分析显示与测试的其他PR基因相比表达的最小变化。然而,与控制相比,该基因的mRNA水平在12小时内增加1.7倍,24小时,2.3倍,1.6倍,在36小时内,48小时孵育2倍,F. oxysporum..
纤维素代谢基因的表达在感染的亚麻幼苗中改变Fusarium oxysporum
在下一步中,我们分析了在细胞壁聚合物代谢中涉及的基因MRNA的水平的变化,并确定了亚麻幼苗中感染的亚麻幼苗的量F. oxysporum..研究了多糖(纤维素,半纤维素,果胶)和非多糖(木质素)聚合物。
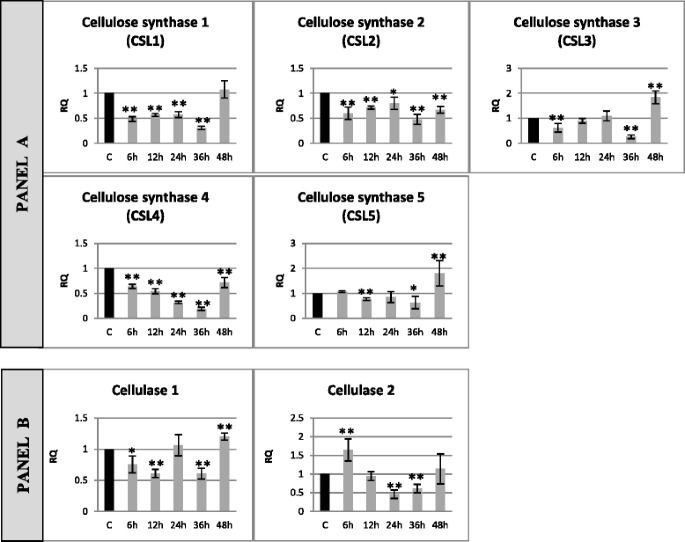
硫酸中硫酸纤维素合成和降解的基因表达及纤维素(纤维素合成酶的2种同种型的2种同种型)的表达培养48小时F. oxysporum.应变在图2中示出。2.通过双重的表达模式表征纤维素合成基因。在第一组(CSL1,CSL2和CSL4)中,表达水平降低(根据分析的基因和孵育时间为20%至80%),而在第二组(CSL3和CSL5)中,表达首先降低(60对于CSL3的36小时,在36小时内为6小时和26%,在12小时内为77%,对于CSL5为36小时,对于两个基因(CSL3和CSL5)增加1.8倍。在纤维素降解基因的mRNA的水平中,纤维素酶1基因的表达(在6小时内为6小时至61%,12和36小时),然后在48小时温育中增加1.2倍F. oxysporum..6 h时,纤维素酶2的表达量先增加1.65倍,后降低(24 h时为46%,36 h时为60%)。
染毒后亚麻幼苗纤维素含量增加Fusarium oxysporum
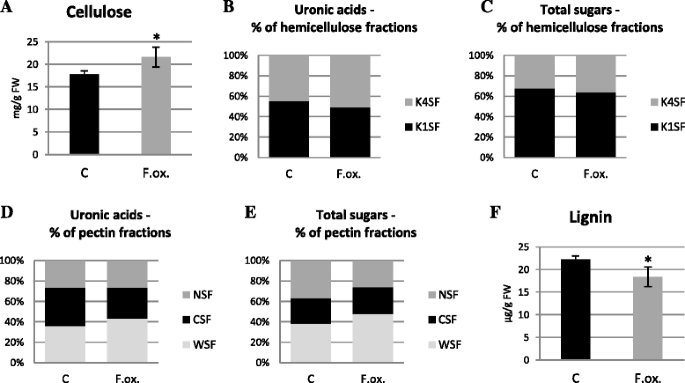
纤维素含量的分析显示亚麻幼苗增加了20%的孵育48小时Fusarium oxysporum与未感染的幼苗相比(图。3A)。纤维素的量在亚麻与病原体孵育的剩余时间没有变化。
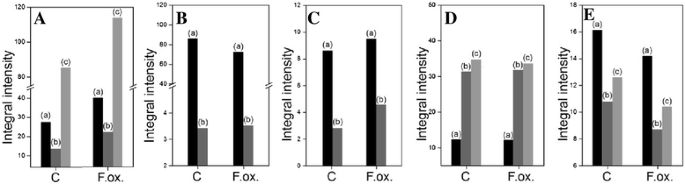
亚麻幼苗中细胞壁聚合物的含量Fusarium oxysporum.纤维素的变化(一个)和木质素(f)HemiCellulose中氧膦酸和单糖的含量(b和c)及果胶(d和e)在用病原菌菌株治疗的亚麻幼苗中F. oxysporum.(F.ox.)在接种相对于对照亚麻(C)的接种后的48小时,通过分光光度法测定。K1SF - 1 M KOH可溶性分数;K4SF - 4 M KOH可溶性分数;WSF - 水溶性分数;CSF - CDTA可溶性分数;nsf - na2有限公司3.可溶性分数。数据表示来自四个独立测量的平均值±SD。使用学生的手段之间的差异的重要性t测试(* -P. < 0.05, **-P. < 0.01)
在感染的亚麻幼苗中改变了半纤维素代谢基因的表达Fusarium oxysporum
结果描述变化的半纤维素合成相关基因的表达水平(葡甘露聚糖4 -β-mannosyltransferase格林尼治时间,半乳甘露聚糖半乳糖基转移酶- GGT, xyloglucan xylosyltransferase - XXT)和退化(endo-1, 4 -β木聚糖酶——XYN、1,4 -α木糖苷酶——XYLa、1,4 -β木糖苷酶——XYLbα牛乳糖- GS,用β-甘露糖苷酶- MS (endo-β-甘露糖苷酶- MS)、β-糖苷酶- GLS (β-glycosidase - GLS)与致病性菌株F. oxysporum.如图所示4..
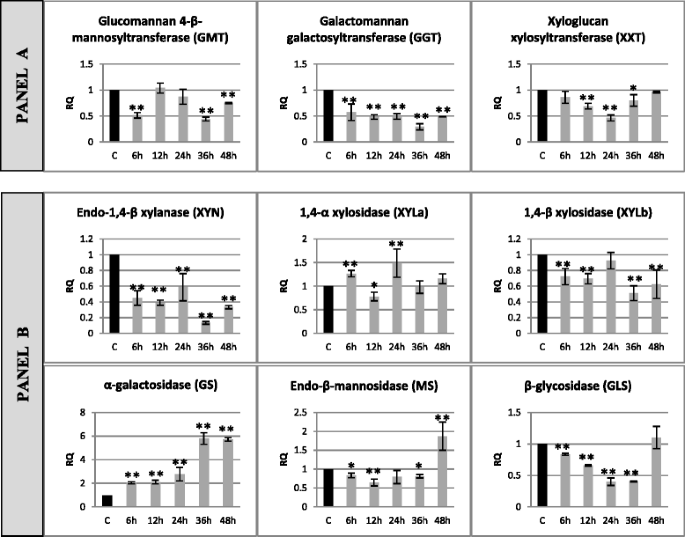
亚麻籽幼苗中半纤维素代谢基因转录物的相对表达Fusarium oxysporum.基因表达水平的变化:半纤维素合成(葡糖胺4-β-甘露糖基转移酶 - GMT,半乳甘油胺烷基三烷基转移酶 - GGT,木瓜葡聚糖Xylosylylansfare - XXT) - 面板 - 面板一个和降解(Endo-1,4-β-木烷酶 - Xyn,1,4-α-木糖苷酶 - Xyla,1,4-β-木糖苷酶 - Xylb,α-半乳糖苷酶 - Gs,endo-β-甘露糖苷酶 - MS,β-Glycosidase - GLS) - 面板b在亚麻籽中用病原菌菌株治疗F. oxysporum.(F.ox.)在接种后6,12,24,36和48小时,相对于对照(C)相对于参考基因(actin)呈现相对量(RQ)。从实时RT-PCR分析获得数据。数据表示与三个独立实验的平均值±标准偏差。使用学生的手段之间的差异的重要性t测试(*P. < 0.05, **P. < 0.01)
半纤维素合成基因的表达量下降。减少(从57 29%)的观察GGT基因表达在整个孵化时间的亚麻病原体(6-48 h),同时减少基因表达是在格林尼治时间6小时(50%)、36 h(44%)和在48 h(75%)和XXT基因表达在12日24和36 h,到70年,分别46和80%。参与半纤维素降解过程的一些基因的表达水平也有所下降。XYN基因的表达水平在亚麻的所有孵育期均有所降低F. oxysporum.(从24小时内的40%到36小时的87%)。对于XIGLB和GS,还注意到表达水平的减少,对于XINB,它是恒定的(在6,12,36和48小时内约30%),同时GS在孵育期间增强的表达减少(a 17在36小时内6小时的%降低和60%)。MS基因的特征在于,表达的初始降低20-35%,在6,12和36小时内,48小时增加1.9倍。孵育后的另一种表达模式F. oxysporum.结果表明,XYLa基因在6 h表达量增加1.3倍,12 h表达量下降至78%,24 h表达量再次增加1.5倍。半纤维素降解基因中,GS的表达量在6 h内增加了2倍,在36和48 h内增加了5.8倍F. oxysporum..
半纤维素组成在感染的亚麻幼苗中改变了Fusarium oxysporum
用细胞壁不同半纤维素组分(K1SF - 1 M KOH可溶性组分;K4SF - 4 M KOH可溶组分)F. oxysporum.48小时。总尿酸(附加文件2:图S2A)和总单糖(附加文件2:图S2B)后幼苗的含量保持不变F. oxysporum.菌体的含量分别为1 mg/g FW和17 mg/g FW。糖醛酸的变化(图。3B.)和简单的糖(图。3C)特别地观察到含量的半纤维素级分。在感染后K1SF分数下降并在K4SF中增加润碳酸含量并增加。对于简单的糖,注意了类似的关联。此外,两种级分中的简单糖的分析表明K1SF级分的贡献增加到全半纤维素的贡献。
果胶代谢基因的表达在感染的亚麻幼苗中改变Fusarium oxysporum
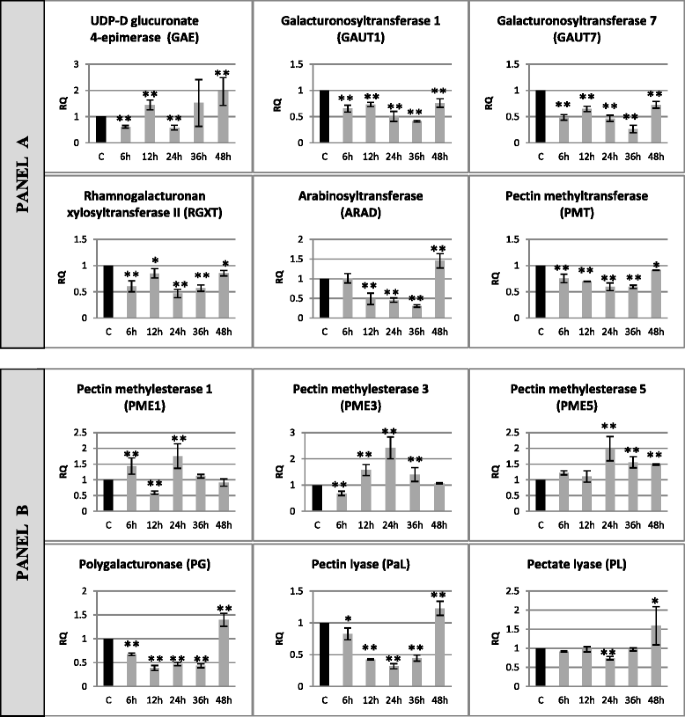
果胶合成的基因表达水平的变化(UDP-glucuronate 4-epimerase, GAE galacturonosyltransferase 1 - GAUT1 galacturonosyltransferase 7 - GAUT7 rhamnogalacturonan II xylosyltransferase RGXT,阿拉伯糖转移酶-阿拉德,果胶甲基转移酶- PMT)和降解果胶methylesterase 1 - PME1,果胶甲基酯酶3 - PME3、果胶甲基酯酶5 - PME5、聚半乳糖醛酸酶- PG、果胶裂解酶- PaL、果胶裂解酶- PL)F. oxysporum.对于48小时(连续时间孵育:6,12,24,36,48h)。5..
果胶代谢基因转录物在感染的亚麻籽中的相对表达Fusarium oxysporum.基因表达水平的变化:果胶合成(UDP-glucuronate 4-epimerase - GAE,半乳糖醛酸转移酶1 - GAUT1,半乳糖醛酸转移酶7 - GAUT7,鼠李半乳糖醛酸II木糖基转移酶- RGXT,阿拉伯糖转移酶- ARAD,果胶甲基转移酶- PMT) - panel一个和降解(果胶甲基酯酶1 - PME1,果胶甲基酯酶3 - PME3,果胶甲基酯酶5 - PME5,POLEGALACTONA酶 - PG,果胶裂解酶 - PAL,Pectate Lyase - PL) - 面板b在亚麻籽中用病原菌菌株治疗F. oxysporum.(F.ox.)在接种后6,12,24,36和48小时,相对于对照(C)相对于参考基因(actin)呈现相对量(RQ)。从实时RT-PCR分析获得数据。数据表示与三个独立实验的平均值±标准偏差。使用学生的手段之间的差异的重要性t测试(*P. < 0.05, **P. < 0.01)
在大多数被分析的果胶合成基因(GAUT1, GAUT7, RGXT和PMT)中,在病原菌处理的所有孵育时间内,其表达均下降(15 - 70%)。ARAD基因在12、24和36 h表达量下降到50 - 30%,而在48 h表达量较对照增加1.4倍。GAE基因在6和24 h表达量下降40%,而在12和48 h表达量分别增加1.44倍和2倍。果胶甲基酯酶的表达随培养时间的变化而变化F. oxysporum.24 h PME1、PME3和PME5分别增加1.8倍、2.4倍和2倍。此外,PME5增加1.5倍的表达在36和48 h, PME1增加1.4倍的表达在6 h,但下降到60%在12 h和PME3的表达在6小时下降到68%,增加了1.5倍12和36 h PG的表达,PaL和PL基因在培养6 ~ 36 h时呈先下降趋势(PG为67 ~ 43%,PaL为82 ~ 32%,PL在24 h为75%),48 h后呈上升趋势,PG为1.4倍,PaL为1.23倍,PL为1.6倍。
果胶组合物在感染的亚麻幼苗中改变了Fusarium oxysporum
基于核酸酸和简单的糖含量的分析评估果胶含量。因为糖酸是主要的结构组分,所以果胶测定通常基于这些成分的分析。为了进行详细评估果胶含量,所有简单的糖在细胞壁的连续果胶部分中(WSF - 水溶性级分,CSF - CDTA可溶性级分,NSF - NA2有限公司3.必须测定可溶性分数。由于果胶的局部定性分析,应分析润碳酸含量,并且不需要省略。
总氧酸含量(约5mg / g fw)和简单的糖(约12mg / g fw)在悬浮液中没有改变48小时(附加文件2:图S2C和D)。然而,特别是细胞壁果胶级分的润酮含量不同,表明其在对照幼苗的CSF部分中的含量较高(占总果胶的37.5%)和感染的幼苗的WSF部分中F. oxysporum.(占总果胶的43.6%)(图。3E)。感染后NSF级分中的氧膦酸含量没有改变(总果胶的26%)。在感染和对照亚麻幼苗之间的果胶级分中的简单糖中观察到差异(图。3E)。感染后F. oxysporum.与对照相比,WSF馏分中简单糖的含量增加了10%,但在CSF分数中没有改变,并且在NSF分数中降低。
亚麻籽幼苗的木质素代谢基因表达增加Fusarium oxysporum
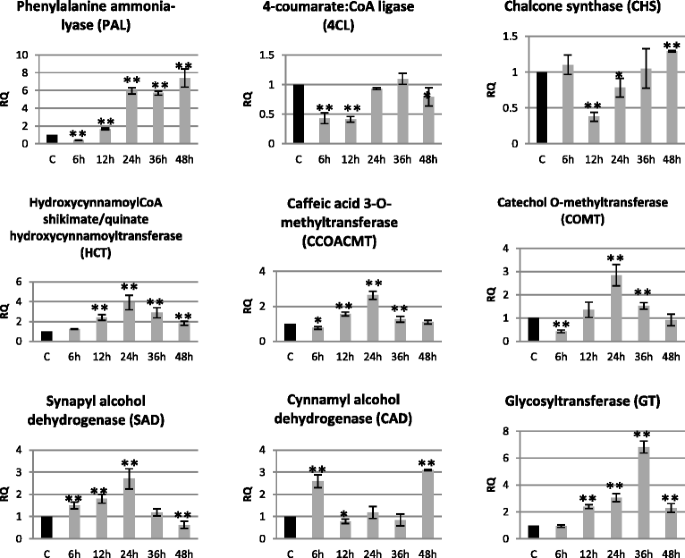
木质素代谢基因表达分析(苯丙氨酸氨催化剂 - PAL,4-羟基氨基酰基:CoA连接酶 - 4CL,Chalcone合酶 - CHS,P-羟基氨基酰基酰基CoA:奎因/ shikimic酸转移酶 - HCT,Caffeoyl-CoA O-甲基转移酶 - CCOOMT,Caffeic亚麻酸/ 5-羟基甲酸3 / 5-甲基转移酶 - COMT,突出酸脱氢酶 - 哀伤,羟基氨基醇脱氢酶 - CAD,葡糖糖基转移酶 - GT)孵育48小时的致病菌菌株F. oxysporum.如图所示。6..
苯丙素途径转录本精选基因在染毒亚麻幼苗中的相对表达Fusarium oxysporum.苯丙醇丙二醇代谢基因表达水平的变化:苯丙氨酸氨催化剂 - PAL,4-羟基氨基酰基酰基:COA连接酶 - 4CL,Chalcone合酶 - CHS,对羟基氨基酰基酰基COA:奎因/ shikimic酸转移酶 - HCT,Caffeoyl-CoA O-甲基转移酶 - CCOOMT,咖啡酸/ 5-羟基含酸3/5-O-甲基转移酶 - COMT,突触酸脱氢酶 - 悲伤,羟基氨基醇脱氢酶 - CAD,硫代葡萄糖转移酶 - GT在亚麻幼苗治疗的病原菌菌株F. oxysporum.(F.ox.)在接种后6,12,24,36和48小时,相对于对照(C)相对于参考基因(actin)呈现相对量(RQ)。从实时RT-PCR分析获得数据。数据表示与三个独立实验的平均值±标准偏差。使用学生的手段之间的差异的重要性t测试(*P. < 0.05, **P. < 0.01)
在所有分析的基因中,四个(HCT,CCOAomt,Comt和Sad)在孵育期间显示出相同的表达模式F. oxysporum.与对照组相比。它们的表达量从6 h开始增加,在24 h达到最大值(HCT表达增加3.9倍,CCoAOMT、COMT和SAD表达增加2.7倍),并在48 h下降到与对照组(CCoAOMT、COMT)相同的水平。低于对照水平(SAD表达降低40%),高于对照水平(HCT表达水平为对照的1.8倍)。同样,尽管在时间上发生了变化,但表达模式是GT基因的特征,GT基因的表达在36 h达到最大值(6.8倍)。PAL基因表达量在6 h时降低至40%,48 h后逐渐增加,达到最大值(为对照的7.4倍)。4 cl基因表达在6 - 12 h和下降到40%至80%在48 h。最后分析木质素代谢的基因(CAD)增加2.6——3.1倍在mRNA水平6和48 h,分别减少了30%在12 h的孵化F. oxysporum..
木质素含量在感染的亚麻幼苗中减少Fusarium oxysporum
在孵育的亚麻幼苗中测定木质素含量F. oxysporum.对于48小时,结果如图1所示。3F..染毒使亚麻幼苗的木质素含量比未染毒的降低了约20%。
亚麻细胞壁的红外光谱感染Fusarium oxysporum确认细胞壁部件的生化分析结果
亚麻侵染后细胞壁的红外光谱分析F. oxysporum.进行以确定细胞壁的结构,并验证用分光光度法获得的细胞壁聚合物含量测定结果。
亚麻幼苗感染F. oxysporum.影响细胞壁的组成和结构。染病和未染病的亚麻幼苗的红外光谱如图所示。7..通过光谱分析,测定了样品中纤维素、果胶和木质素含量的变化以及纤维素结构的变化。感染后纤维素含量增加40%F. oxysporum.与未感染的幼苗相比(图。7一个)。纤维素的结构是根据适当的谱带分析确定的。1058和988厘米波段的积分强度−1与ν(C-O-C)的不对称振动相对应,表明了纤维素链长度的变化,在受感染的亚麻幼苗中,纤维素链较短(图)。7 b)。频带的积分强度范围为3400-3425厘米−1对应于分子内振动O-H××××o,范围为3290-3315cm−1对应于分子间振动ν(O-H×××O)(图。7 c)。分析结果表明,在亚麻幼苗中纤维素链的排列发生了变化F. oxysporum.与未感染的幼苗相比,氢键数量较高的60%。感染的亚麻幼苗显示出结晶性指数增加16%,表明感染的亚麻幼苗的细胞壁中更有组织的纤维素结构。更高的结晶度还表明纤维素的反应性,降低吸水性和细胞壁更高的可塑性。
IR分光光度法分析细胞壁结构及亚麻幼苗组成Fusarium oxysporum.来自对照亚麻籽(C),幼苗的样品的IR光谱F. oxysporum.感染(F.ox.)。一个纤维素含量的变化呈现为1455厘米的带的整体强度差异−1(a),1319厘米−1(b), 1161厘米−1(c)。b纤维素(C-O-C键)结构的变化呈现为1058厘米的带的整体强度差异−1(a)和988厘米−1(b)。c纤维素结构的变化呈现为1230厘米的带的整体强度差异−1,对应于Δ(OH···O)(a)和625cm-1,对应于γ(OH•••O)(b)。d果胶含量的变化显示为1735厘米的频段积分强度的差异−1(一),1655厘米−1(b)和1609厘米−1(c)。e木质素含量的变化表现为1337 cm波段的积分强度的差异−1(一),1260厘米−1(b)和1245厘米−1(C)
通过分析1735、1655和1609 cm处的积分强度的差异来确定果胶和木质素含量的变化−1对于果胶(图。7 d)和1337、1260和1245厘米-1木质素(无花果。7 e)感染后,证实果胶和木质素含量的显着降低F. oxysporum..
讨论
如今,对宿主的互动研究非常兴趣,以实现植物防御机制的改善。
目前的文献仅描述了植物感染期间果胶的重要性,并且省略了细胞壁的其他多糖聚合物。该研究的研究目的是在感染致病菌株的不同阶段确定多糖聚合物和木质素的重要性Fusarium oxysporum.有人建议接近整个科学问题,并注意不同的聚合物,而不是省略所述过程中可能的相互作用。
为了检查亚麻感染的不同阶段F. oxysporum.收集与病原体、亚麻籽苗孵化6后,12日,24日,36和48 h。潜伏期的选择建立了基于感染植物的表型实验,确定最后的孵化时间和公关的基因表达水平显著增加植物感染病原体(44.-46.].亚麻中β-1,3-葡聚糖酶和几丁质酶基因的表达F. oxysporum.12小时后诱导,它们的水平随着时间的推移而增加。结果表明,尽管缺乏表型变化的孵育12小时,病原体感染了该植物并诱导了系统性反应。为了检查包含病原体渗透到根细胞的第一阶段,并通过宿主激活防御机制,选择第6小时的孵育作为第一小时。
第一次分析的聚合物在亚麻中感染F. oxysporum.是果胶,主要目的是感染初始阶段的病原体。果胶甲基酯酶除去同alacturonan的甲基,导致细胞壁结构的松动,使得通过纤维素酶和纤维素酶和半纤维素酶和半纤维素凝集凝集凝集凝集蛋白的降解[47.].然后表明,在感染的第一阶段,果胶的甲基化水平起主要作用。高度甲基化果胶导致植物感染的耐高抗性。在植物中,存在内源性果胶甲基酯酶,其参与许多生理过程,其中需要对细胞壁重排成为必要的。
果胶甲基酯酶的三种同种型分析显示,在PME1的第一阶段增加,PME3降低,PME5没有变化。这些结果表明,PME5可能不会参与感染过程,而是参与其他生理过程,尽管其水平在孵化24小时后增加。PME1涉及感染,并且由病原体引起PME1的表达水平的改变。先前的研究证实,感染真菌可以影响PME基因表达的增加[48.,以及一种特定的PME基因的沉默,这取决于病原体,导致植物抗性的增加[49.].然而,PME1表达的最初增加可以解释为有目的的植物策略,旨在放松果胶的结构,释放寡半乳糖醛酸(OG),以引发植物防御反应。果胶甲基酯酶的一种亚型过表达的转基因草莓具有增强抗性的特点Botrytis cinerea感染,由来自细胞壁的寡聚橡胶酸释放来解释[50.].综上所述,所观察到的PME1和PME3基因表达的减少和增加可能是由植物应对持续感染的防御机制引起的:最初通过维持高果胶甲基化,然后通过其重排和/或释放激发子(OG)。
亚麻侵染后苗期果胶的生化分析F. oxysporum.在总含量没有变化的情况下,在48 h后观察到其重排。病原菌诱导的真菌内源果胶甲基酯酶和亚麻内源果胶甲基酯酶的活性,可能是病原菌侵染过程中果胶去甲基化,再通过外源多半乳糖醛酸酶和果胶裂解酶使其结构松动的主要原因。果胶重排在水溶性组分中增加,在CDTA组分中降低,在与细胞壁结合的组分中含量没有变化。果胶结构的松动是真菌酶活性破坏离子键的结果[51.].
从感染的第一阶段(6小时)降低多肢乳突酶和果胶裂解酶的mRNA水平,直到根部的细胞坏死是从外源性真菌基因(PG和PAL)的存在,这包含一种形式防御过度果胶降解。相反,整个感染过程中果胶合成的大多数基因的表达水平的减少可能因传染转录到其他基因而导致在感染期间的丰富所必需的。果胶的松动和重排使细胞壁的其他聚合物可进入外源性真菌酶:半纤维素酶和纤维素酶。病原体降解多糖,以确保自己是营养素,主要是葡萄糖。半纤维素负责强化细胞壁[52.,但到目前为止,还没有证据表明植物参与了对病原体感染的反应。Fusarium oxysporum导致亚麻幼苗感染第一阶段的半纤维素合成的表达水平降低。类似地,观察到大多数半纤维素降解的基因表现出降低的表达水平。这种变化可以通过经过病原体感染的植物中的改变的转录简谱来解释。可能,植物将转录电位重定向到病原体衍生的压力期间必需的其他基因。尽管从半纤维素代谢基因表达的表达降低,但它们的含量没有变化,并且只观察到1M KOH中的半纤维素级分的轻微降低。
染毒亚麻幼苗纤维素代谢基因表达分析F. oxysporum.在所有研究的孵育时间内揭示了三种同种型纤维素合成基因(CSL1,CSL2和CSL4)的mRNA水平的降低。另外两种纤维素合成酶和两种纤维素降解基因的同种型反应弱或未精确感染。前面仅描述了纤维素合成基因表达的减少拟南芥蒂利亚纳感染了Botrytis cinerea并揭示了这种聚合物的基因参与了对病原体感染的反应。这种现象可以用转录调节来解释,但这一假说尚未得到证实[53.].之前的一项研究表明拟南芥蒂利亚纳沉默的纤维素合酶基因的特征在于抗性增加Ralstonia solanacearum.和Plectosphaerella cucumerina感染[54.].关于解释纤维素合成酶在植物对病原体的作用的困难中,研究了纤维素的含量和结构。定量分光光度分析显示感染的幼苗中纤维素含量的增加F. oxysporum.48小时。类似地,感染幼苗的细胞壁的红外光谱分析显示纤维素纤维素的显着增加,纤维素中的氢键增加了60%,纤维素结晶的增加16%。纤维素的结晶性增加是指更有序的结构,其特征在于较低的活性,降低吸水性和细胞壁的增率增加。然后推导出纤维素结晶度的增加是感染期间产生的植物的另外的屏障,其阻碍了通过病原体酶消化的宿主细胞壁聚合物消化。
感染该病原体的幼苗细胞壁中纤维素结晶度的变化很难解释。这可能是由于半纤维素的重排所致。尽管大多数半纤维素代谢基因缺乏表达,但其中一个基因在感染过程中表现出强烈的激活。α-半乳糖苷酶mRNA水平在侵染初期呈上升趋势,侵染后期呈上升趋势。据推测,这种从半乳甘露聚糖中切断半乳糖的酶间接地促进了纤维素中氢键的生成,从而提高了纤维素的结晶度。这一假设需要进一步的研究和证实。根据其他作者[55.],降解细胞壁中的半纤维素和释放半乳糖中的酶可以直接有助于纤维素结晶度的改变。
木质素的参与病原体感染是众所周知的,在文献中众所周知。增加木质素生物合成因刺激苯丙烷途径而导致的,而血液化过程由反应性氧物种诱导,在病原体感染期间存在大量存在[38.那39.].小麦感染后,苯丙素途径基因和木质素合成直接基因的表达量增加Fusarium Graminearum.和柄锈菌triticina[55.[棉花感染verticillium dahliae.[56.].
苯丙酸途径(PAL、HCT、CCoAOMT、COMT和GT)基因在侵染幼苗后期强烈表达F. oxysporum.在感染时增加。在孵育12小时后观察到这些变化,同样在PR基因的情况下,表明其参与全身亚麻反应。在感染的初始阶段F. oxysporum.(6小时后),木质素合成的基因 - 羟基氨基醇脱氢酶和突触醇脱氢酶的特征在于mRNA水平的显着增加。结果表明,木质素合成的发生非常快,以加强细胞壁,但可以受衬底的可访问性限制。48小时后亚麻籽细胞壁的生化分析和IR光谱测定F. oxysporum.木质素含量略有下降。也许从感染开始的这么短的时间不足以显示这种聚合物的变化。在被病原真菌侵染的棉花中,尽管木质素代谢基因的表达量显著增加,但从12 h开始,侵染数天后,木质素含量出现了变化[56.].
概括,分析亚麻聚合物细胞壁代谢基因的表达水平F. oxysporum.使我们能够区分两组基因,这些基因与感染不同。第一个组由强烈反应的基因组成,其表达水平超过5-10次:木质素合成的基因(苯丙氨酸氨裂解酶[PAL],葡萄糖酰转移酶[GT])和涉及发病机制的基因(β-1,3-葡聚糖酶和几丁质酶)。它们的特征在于全身反应基因,因为尽管表达水平显着增加,但后面的基因响应(与病原体孵育12小时后),并且最大表达升高大部分在48小时。第二组基因包含略微诱导的基因。它们参与代谢反应,其活化与由于通过真菌酶的细胞壁消化而产生的elicators(寡聚氨基糖苷)的活性。在该组中,存在其表达水平的基因(最多五次),减少和具有不同,通常是未指定的表达改变的基因。第一个亚组由其他木质素合成基因,β-糖苷酶基因(GLS)和β-1,3-葡聚糖酶2组成。在具有降低表达水平的基因的第二个子组中是果胶代谢的基因(Gaut1,Gaut7,RGXT,PMT,PME3,PG和PAL),半纤维素代谢(GMT,GGT,XXT,XYN,XYLB和GS)和纤维素合成(纤维素合成酶:CSL1,CSL2和CSL4)。表现出不同变化的最后一个亚组包括其他基因,包括果胶,半纤维素和纤维素代谢。建议,弱到病原体感染的基因仅是转录噪声,并且它们不会参加植物防御机制。
结论
本研究结果证实了亚麻细胞壁的聚合物参与了亚麻对植物的反应Fusarium oxysporum通过其基因表达的变化和细胞壁结构重排的感染.虽然果胶和木质素的作用已经被广泛研究,而且文献提供了很多信息,但我们的研究证实了果胶和木质素对感染过程的贡献,通过果胶结构的松动和参与木质素合成的基因mRNA水平的增加。我们提供了关于纤维素和半纤维素在病原体感染中的作用的新信息,这些纤维素和半纤维素是通过其结构而不是含量的变化表达的,以及它们的转录组谱。我们的初步研究鼓励进一步研究,以准确确定纤维素和半纤维素参与感染过程的机制。
方法
植物材料制备
所有实验均进行纤维状亚麻品种(Linum Usitatissimum.L. cv。耐克)。致病菌株Fusarium oxysporumF。sp。linii(Bolley) Snyder et Hansen (ATCC MYA-1201)从ATCC公司(美国)购买。在湿度50%,温度22℃/16℃,光照强度23 mmol/s/m的条件下,在添加1%蔗糖的0.8%琼脂凝固MS培养基上生长3.,昼/夜制:16/8小时。
种子萌发和幼苗发育在控制条件下进行。7 d后,用培养基将幼苗转移到长满病原菌的PDA培养基上Fusarium oxysporum或控制PDA(没有真菌)。真菌在实验前5天生长在PDA培养基上。在6,12,26,36和48小时后收集幼苗(每个阶段),在液氮中冷冻并储存在-70℃。
基因表达分析
使用RNA分离的总RIZOL试剂(Life Technologies,USA)。根据生产者的一式三份进行分离。为了从剩余的DNA中纯化分离的RNA,根据制造商的协议使用DNASEI试剂盒(Invitrogen,德国)。对于逆转录反应,即RNA基质上的cDNA合成,根据制造商的说明使用高容量cDNA逆转录试剂盒(Life Technologies,USA)。
根据制造商的协议,使用Dynamo Sybr Green QPCR套件(Thermo Scientific,USA)在StealOnPlus实时PCR系统热循环仪(Applied Biosystems)中进行实时PCR。制备引物以不扩增真菌序列。它们的退火温度为57℃,并且它们的序列在附加文件中呈现3.S1:表。每个分析样品进行3个重复的Real-time PCR反应。基因表达水平的变化以内参基因(肌动蛋白)的相对数量(RQ)计算,并以未处理植物基因表达量的x倍表示。
纤维素含量的测定
纤维素含量用Ververis[描述的蒽酮法]测定。57.].将组织样品(100mg)与65%硝酸和80%乙酸(1:8V / v)的混合物在100℃下孵育1小时,然后以14 000rpm离心5分钟。然后将沉淀用水洗涤两次并溶解在1ml 67%h中2所以4.(v / v)通过在室温下摇动1小时。将100μl萃取物加入到900μL的0.2%硫酸蒽酮的900μl冷却溶液中,混合,在100℃下加热15分钟并在冰上冷却。样品中的纤维素含量通过620nm的光度测量测量测量。可商购的纤维素用于标准曲线制剂。
细胞壁多糖的分离和分馏
使用Manganaris和Vicente描述的修饰方法进行细胞壁成分的分离和分馏[51.那58.].将亚麻组织与96%乙醇在100℃下孵育30分钟以灭活酶,以提取低分子质量的组分并预防自水解。接下来,将沉淀物与下列:80%的乙醇在80℃下孵育20分钟,氯仿:甲醇混合物(1:1 V / V),在40℃和丙酮中,5分钟。将样品在每种溶剂处理之间离心(以5000×g以50分钟),弃去上清液。将沉淀在37℃下干燥过夜,并使用不溶于醇(空气)的成分进行进一步分析。
将沉淀(空气)溶于1ml水中,并在室温下摇动12小时,离心(6000×g,4℃,10分钟)并用水冲洗。合并从两种离心衍生自两种离心的上清液并用于分析作为水溶性级分(WSF)。通过相同的方法获得以下级别的细胞壁,但水被其他溶剂取代:CSF(CDTA差异溶于CDTA) - 50mM CDTA(1,2-环己基二乙酸四乙酸)pH6.5;NSF(碳酸钠溶于碳酸钠) - 50mM NA2有限公司3.纳米20毫米4.另外,用收集的上清液的乙酸中和;K1SF(馏分溶于1M KOH) - 1 M KOH,20毫米NABH4.,用盐酸中和;K4SF(馏分溶于4M KOH) - 4M KOH,用盐酸中和。馏分CSF,NSF,K1SF和K4SF的上清液被透析到水(透析3.5-KDA的膜)中,并且在使用前冻干,以进一步分析。
糖醛酸含量的测定
用双酚法测定核酸含量[59.]先用硫酸水解多糖[60.].将冻干样品(约10mg)溶于0.1ml浓硫酸中,在冷却浴中,摇动5分钟。然后,在每个部分之间摇动加入0.1ml硫酸,0.05ml水,0.05ml水和0.7ml水。离心后(10分钟,2000×G,RT),取出0.1ml上清液,加入10μl4m氨磺酸,加入600μl浓硫酸中的75mM四硼酸钠。仔细混合后,将样品在100℃下孵育20分钟,冷却下来和20μl米在0.5% NaOH中加入-羟基联苯(0.15%),室温静置10 min,在525 nm分光光度法测定糖醛酸的含量。采用葡萄糖醛酸作为标准品。
用酚醛法测定单糖含量
用酚醛法测定总单糖的含量,用硫酸预先水解。加入0.3ml上清液,加入0.6ml浓硫酸,混合,加入50μl5%的苯酚。将样品在50℃下孵育20分钟,冷却后,在480nm处分光光度法测量单糖水平。采用葡萄糖醛酸作为标准品。
木质素含量确定
总木质素含量采用iyama和Wallis提出的乙酰溴法测定[61.].将100毫克的亚麻幼苗在100℃下加热2小时,然后加入10ml水并在65℃下加热1小时,每10分钟摇动。将样品通过GF / A 24mM过滤器过滤,并用以下冲洗三次:水,乙醇,丙酮,乙醚。将过滤器置于玻璃小瓶中,并在70℃下加热过夜。然后,2.5毫升25%(v / v)加入80%乙酸中的乙酰溴并在50℃下孵育2小时。将冷却的下落样品与10mL 2M氢氧化钠和12mL乙酸混合。在过夜孵育后,将木质素含量分光光度法在280nm处测定。作为校准曲线的标准,使用了Coniferyl醇。
亚麻细胞壁的红外光谱分析
采用红外光谱法测定了亚麻幼苗细胞壁的化学成分和分子结构。采用Bio-Rad 575C FT-IR光谱仪在室温下测量光谱。数据是在50 - 4000厘米的光谱范围内收集的−1分辨率为2厘米−1.在该范围的中红外部分,在KBr球团中制备样品。在这个范围的远红外线部分,样品被悬浮在Nujol。结晶度指数(CI),用来描述结构组织,在这个例子中是纤维素,被计算为1370厘米波段的强度比−1(−CH振动)2900 cm−1(-CH2和-CH振动)。
统计分析
所有实验都独立重复至少三次。所得结果以平均值±标准差表示。采用Statistica 7 (StatSoft, USA)进行统计学分析。为了确定统计显著性,学生的t以及(*P. < 0.05, **P. < 0.01) was used.
参考文献
- 1。
Olivain C,Trotvelot S,Binet Mn,Cordier C,坑蛋白A,Alabouvette C.亚麻根的定植和亚麻细胞接种的亚麻细胞的初期生理反应Fusarium oxysporum.应用环境微生物学报,2003;69(9):5453-62。
- 2。
Berrocal -Lobo M,Molina A.拟南芥防御反应Fusarium oxysporum.趋势植物SCI。2008; 13(3):145-50。
- 3.
Lionetti V,Cervone F,Bellincampi D.果胶的甲基酯化在植物病原体相互作用期间发挥作用,影响植物抗病抗病。J植物理性。2012; 169(16):1623-30。
- 4.
柏林A,Maximenko V,Gilkes N,鞍德·j.Ligncellulose水解的酶络合物优化。Biotechnol Bioeng。2007; 97(2):287-96。
- 5。
Pietro广告,马德里MP,Caracuel Z,Delgado-Jarana J,Roncero MIG。Fusarium oxysporum:探索血管蠕虫真菌的分子库。莫尔植物途径。2003; 4(5):315-25。
- 6。
Michielse CB,Rep M. pathogen概况更新:Fusarium oxysporum.莫尔植物途径。2009; 10(3):311-24。
- 7。
Takken F,Rep M.番茄之间的军备竞赛Fusarium oxysporum.莫尔植物途径。2010; 11(2):309-14。
- 8。
Balasubramanian V,Vashisht D,Cletus J,Sakthivel N.植物β-1,3-葡聚糖酶:它们对植物致病性真菌的生物学功能和转基因表达。Biotechnol Lett。2012; 34(11):1983-90。
- 9.
吴Ct,布拉德福德kj。I类Chitinase和Beta-1,3-葡聚糖酶通过卷曲,茉满红,乙烯和番茄种子和叶中的胃蛋白含有差异调节。植物理性。2003; 133(1):263-73。
- 10。
Keegstra K.植物细胞壁。植物杂志。2010;154(2):483 - 6。
- 11.
Freshour G,Bonin CP,Reiter Wd,Albersheim P,Darvill Ag,Hahn Mg。在Mur1突变体的细胞壁中含有含岩藻葡聚糖的分布拟南芥.植物杂志。2003;131(4):1602 - 12所示。
- 12.
纤维素合成酶与合成拟南芥.莫尔植物。2011; 4(2):199-211。
- 13。
植物细胞壁完整性的维持是生物胁迫反应机制的重要组成部分。植物学报2012;3:77。
- 14。
泰勒ng。纤维素生物合成和高等植物中的沉积。新植物。2008; 178(2):239-52。
- 15.
植物细胞壁多糖的生物合成——一个复杂的过程。植物学报。2006;9(6):621-30。
- 16。
Scheller HV,Ulvskov P. Hemicellulases。Annu Rev植物Biol。2010; 61:263-89。
- 17。
Faik A,价格NJ,Raikhel NV,Keegstra K. An拟南芥编码α-木糖苷改移酶的基因,涉及木糖葡聚糖生物合成。Proc Natl Acad Sci U S A. 2002; 99(11):7797-802。
- 18。
LIEPMAN AH,Wilkerson CG,Keegstra K.昆虫细胞中纤维素合酶样(CSL)基因的表达显示CSLA系列成员编码甘露甘露合酶。Proc Natl Acad Sci U S A. 2005; 102(6):2221-6。
- 19。
Pauly M,Scheller HV。植物细胞壁多糖的O-乙酰化:鉴定和部分表征来自马铃薯悬浮培养细胞的鼠李肌肌酐酸甲酸酯酶。Planta。2000; 210(4):659-67。
- 20。
Mohnen D.果胶结构和生物合成。CurrOp植物BIOL。2008; 11(3):266-77。
- 21。
果胶的结构、生物合成和寡半乳糖醛酸相关信号转导。植物化学,2001;57(6):929 - 67。
- 22。
酒吧 - Peled M,Urbunowz Br,O'Neill Ma。核苷酸糖形成和多样性的果糖多糖的合成及起源。前植物SCI。2012; 3(92):11。
- 23。
Egelund J,Petersen BL,Motawia Ms,Damager I,Faik A,Olsen Ce,Ishii T,Clausen H,Ulvskov P,Geshi N.拟南芥蒂利亚纳RGXT1和RGXT2编码高尔基定位(1,3)- α - d -木糖基转移酶,参与果胶鼠李糖半乳糖醛酸- ii的合成。植物细胞。2006;18(10):2593 - 607。
- 24。
果胶的生物合成。植物杂志。2010;153(2):384 - 95。
- 25。
果胶是一种存在于植物细胞壁中的多用途多糖。结构化学,2009;20(2):263 - 75。
- 26。
Willats Wg,Orfila C,Limberg G,Buchholt HC,Van Alebeek GJ,Voragen AG,Marcus Se,Christensen TM,Mikkelsen JD,Murray BS等。植物细胞壁果胶同源肌酐甲基酯化度和模式的调节。对果胶甲酯酶作用,基质特性和细胞粘附的影响。J Biol Chem。2001; 276(22):19404-13。
- 27。
Limberg G,Korner R,Buchholt HC,Christensen TM,Roepstorff P,Mikkelsen JD。用封闭素裂解酶和内核通过Galacturon酶II从A. niger用酶指纹对果胶的不同去酯化机制分析。Carboohydr Res。2000; 327(3):293-307。
- 28。
Marty P,Jouan B,Bertheau Y,Vian B,Goldberg R.杆状细胞墙的充电密度茄属植物tuberosum基因型和Blackleg的易感性。植物化学。1997年; 44(8):1435-41。
- 29。
Boudart G,Lafitte C,Barthe JP,Frasez D,Esquerré-TugayéM-T。豆幼苗果胶碎片的防御反应的差分引发。Planta。1998; 206(1):86-94。
- 30.
转基因表达真菌内聚半乳糖醛酸酶增加植物对病原菌的抗性,降低生长素的敏感性。植物杂志。2008;146(2):669 - 81。
- 31。
Spadoni S,Zabotina O,Di Matteo A,Mikkelsen JD,Cervone F,De Lorenzo G,Mattei B,Bellincampi D. polygalactulonase抑制蛋白与果胶通过精氨酸和赖氨酸的四种聚类残留物形成的结合位点相互作用。植物理性。2006; 141(2):557-64。
- 32。
De Lorenzo G, Cervone F, Bellincampi D, capari C, Clark AJ, Desiderio A, Devoto A, Forrest R, Leckie F, Nuss L等。聚半乳糖醛酸酶、PGIP和低聚半乳糖醛酸酯在细胞间通讯中的作用。生物化学学报1994;22(2):394-7。
- 33。
王Y,Chantreau M,Sibout R,霍金斯S.植物细胞壁褐煤和单氯代酚新陈代谢。前植物SCI。2013; 4:220。
- 34。
弗利米木质素:多方面作物组分的表征。SCI世界J. 2013; 2013年:25。
- 35。
刘c-j。破译紫花化的谜:前体运输,氧化和木质素组件的类别。莫尔植物。2012; 5(2):304-17。
- 36。
王志强,王志强,王志强,等。木质素生物合成与结构研究进展。植物杂志。2010;153(3):895 - 905。
- 37。
Achyuthan KE, Achyuthan AM, Adams PD, Dirk SM, Harper JC, Simmons BA, Singh AK。超分子自组装混乱:多酚木质素对具有成本效益的木质纤维素生物燃料的障碍。分子。2010;15(12):8641 - 88。
- 38。
Collinge DB。细胞壁对位:第一道防线。中国农业科学。2009;60(2):351-2。
- 39。
王志强,魏永强,王志强。木质素化在植物防御中的作用。植物信号学报。2009;4(2):158-9。
- 40.
WROKBEL-KWIATKOWSKA M,Lorenc-Kukula K,Starzycki M,OszmiańskiJ,KepczyńskiJ,血清j j.亚麻β-1,3-葡聚糖酶的表达导致对真菌的抗性增加。physiol mol植物疗法。2004; 65(5):245-56。
- 41.
Lorenc-Kukula K, Amarowicz R, Oszmianski J, Doermann P, Starzycki M, Skala J, Żuk M, Kulma A, Szopa J.转基因亚麻植株酚类化合物含量增加的多效效应。农业食品化学学报。2005;53(9):3685-92。
- 42。
Lorenc-Kukula K, Zuk M, Kulma A, Czemplik M, Kostyn K, Skala J, Starzycki M, Szopa J. GT家族工程亚麻1茄属植物sogarandinum糖基转移酶SsGT1增加了对镰刀感染。JAgric Food Chem。2009; 57(15):6698-705。
- 43。
通过过表达酵母Met25基因提高亚麻中硫氨基酸含量。植物科学。2009;177(6):584 - 92。
- 44。
Cheong Yh,Kim Cy,Chun Hj,Moon BC,Park HC,Kim JK,Lee S-H,Han C-D,Lee Sy,Cho MJ。大豆III类IIIβ-1,3-葡聚糖酶基因的分子克隆在发育和响应于病原体感染。植物SCI。2000; 154(1):71-81。
- 45。
黄志强,王志强,王志强,等。植物防御机制中的致病相关蛋白。中国微生物防治杂志。2011;2:1043-54。
- 46。
Li WL, Faris JD, Muthukrishnan S, Liu DJ, Chen PD, Gill BS。小麦穗侵染酸性几丁质酶和β-1,3-葡聚糖酶新cDNA克隆的分离与鉴定Fusarium Graminearum..Al Appl Genet。2001; 102(2-3):353-62。
- 47。
willats wt,mccartney l,mackie w,knox jp。果胶:功能分析的细胞生物学和前景。植物mol biol。2001; 47(1-2):9-27。
- 48。
从宿主获得最多:病原菌如何迫使植物在疾病中合作。植物与微生物学报。2010;23(10):1253-9。
- 49。
Raiola A,Lionetti V,Elmaghraby I,Immerzeel P,Mellerowicz EJ,Salvi G,Cervone F,Bellincampi D.果胶甲基酯酶被诱导拟南芥并且是坏死营养病原体成功定殖所必需的。植物与微生物学报。2011;24(4):432-40。
- 50.
Osorio S,Castillejo C,Quesada Ma,Medina-Escobar N,Brownsey GJ,苏兰,苯群岛A,Botella Ma,Valpuesta V.在野草莓中引出防御反应需要果胶甲酯酶1的部分去甲酰酯酶1草莓属vesca)。工厂J. 2008; 54(1):43-55。
- 51.
Manganaris Ga,Vicente Ar,Crisosto Ch,Labavitch JM。细胞壁修饰在冷却损伤的梅花果(Prunus salicina)中。波萨斯匹配Biol Technol。2008; 48(1):77-83。
- 52.
ordas - ortiz JJ, Marcus SE, Knox JP。细胞壁微观结构分析表明,半纤维素多糖在番茄果皮薄壁组织的细胞粘附中起着重要作用。摩尔。2009;2(5):910 - 21所示。
- 53.
Ramired V,Garcia-Andrade J,Vera P.增强疾病抵抗力Botrytis cinerea在myb46拟南芥植物与CESA基因的早期下调相关。植物信号表现。2011; 6(6):911-3。
- 54。
冯德兴,胡建军,冯德兴,等。拟南芥次生细胞壁形成所需的纤维素合成酶的损伤增强了抗病能力。植物细胞。2007;19(3):890 - 903。
- 55。
陈芳,李伟,毕超,李伟。木质素生物合成基因在小麦生长发育中的表达。植物学报2011;29(1):149-61。
- 56。
徐升,朱升,涂,刘升,元d,金l,长l,张x。木质素新陈代谢在棉花对枯萎的真菌的抵抗力作用verticillium dahliae.如RNA-SEQ依赖性转录分析和组织化学透露。J Exp Bot。2011; 62(15):5607-21。
- 57。
Ververis C, Georghiou K, Christodoulakis N, Santas P, Santas R.各种植物材料的纤维尺寸,木质素和纤维素含量及其对造纸的适用性。作物学报。2004;19(3):245-54。
- 58。
Vicente AR, Powell A, Greve LC, Labavitch JM。波森莓的细胞壁分解事件(rubus idaeus l..xrubus ursinus cham。&schl.。)水果开发。Funct植物Biol。2007; 34(7):614-23。
- 59。
Blumenkrantz N,Asboe-Hansen G.用于定量测定尿酸的新方法。肛门生物化学。1973; 54(2):484-9。
- 60。
Ahmed Aer,Labavitch JM。一种简化的精确测定细胞壁尿红素含量的方法。J Food Biochem。1978; 1(4):361-5。
- 61。
IIYAMA K,Wallis Afa。通过改进的乙酰溴方法测定草本植物中的木质素。J SCI食物农业。1990; 51(2):145-61。
致谢
本研究得到授予的支持。2012/06 / NZ1 / 00006和否。2013/11 / N / NZ1 / 02378来自国家科学中心(NCN),授予否。PBS2 / A5 / 42/2014来自国家研发中心(NCBIR)和弗罗茨瓦夫生物技术中心,2014 - 2018年领先的国家研究中心(认识)计划。
作者信息
隶属关系
通讯作者
额外的信息
利益争夺
提交人声明他们没有竞争利益。
作者的贡献
WW进行了所有的实验和统计分析,并撰写了手稿。AK参与了研究设计、统计分析和手稿的撰写。LD进行了红外分光光度法分析,并参与了手稿红外相关部分的撰写。JH参与了红外分光光度法分析。MC参与了植物材料的准备和手稿的撰写。JS参与了研究的设计、协调和手稿的撰写。所有的作者阅读并批准了手稿的最终版本。
附加文件
附加文件1:图S1。
致病性菌株接种亚麻幼苗的表型分析Fusarium oxysporum.亚麻幼苗的表型变化感染F. oxysporum.与未感染的对照植物相比,接种后,在6,12,24,36和48小时内。垂直面板显示孵育期内的亚麻幼苗的表型,水平面板显示:对照幼苗,放大的对照幼苗,感染的亚麻幼苗F. oxysporum.和放大感染的幼苗。多克斯(18171 kb)
附加文件3:表S1。
用于实时RT-PCR反应的引物序列。设计用于实时PCR的引物序列:(a)纤维素代谢基因。(b)半纤维素代谢基因(c)果胶代谢基因。(d)木质素代谢基因。(e)PR基因和actin。(DOCX 20 KB)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
wjtasik, W., Kulma, A., Dymińska, L.等等。用致病菌株感染亚麻细胞壁聚合物意义的评价Fusarium oxysporum.BMC植物BIOL.16,75(2016)。https://doi.org/10.1186/s12870-016-0762-z.
已收到:
公认:
发表:
关键词
- 亚麻
- Fusarium oxysporum
- 感染
- 细胞壁聚合物