摘要
背景
植物特异性TCP转录因子系列参与细胞生长和增殖的调节,在植物生长和发展的多个方面进行了多样化的功能。但是,对西瓜的TCP家族无综合分析(Citrullus lanatus.以前已经进行过。
结果
共鉴定出27个西瓜TCP编码基因,分布在9条染色体上。系统发育分析将这些基因聚为11个不同的亚群。此外,系统发育和结构分析区分了ClTCP家族中的两个同源类,指定为Class I和Class II。II类基因分化为CIN亚类和CYC/TB1亚类。采用半定量PCR法检测所有成员的表达模式。二的函数ClTCP基因,ClTCP14a和ClTCP15,在调节植物高度通过异位表达证实拟南芥野生型和ortholog突变体。
结论
本研究代表了西瓜TCP基因家族的第一个基因组分析,其提供了理解西瓜中TCP基因的分类和功能的有价值的信息。
背景
1999年首次描述了TCP基因家族,专用于高等植物的一小群转录因子(TF)[1].该家族在调节多种生理和生物过程中发挥重要作用,包括植物激素生物合成和信号转导、叶片形态发生和衰老、分枝、花发育、花粉发育和昼夜时钟[2-15.].TCP蛋白质的特征在于59-氨基酸非规范碱性螺旋环 - 螺旋(BHLH)基序,其负责DNA结合,核靶向和配对蛋白质 - 蛋白质相互作用[1那16.].该结构域首先从四种蛋白质中鉴定出具有危重作用的植物形态的危重作用:Teosinte分支1(TB1)的玉米(Zea Mays.)、金鱼草的CYCLOIDEA (CYC) (Antirrhinum Majus.)和稻米的增殖细胞因子1和2(PCF1和PCF2)(奥雅萨苜蓿)[16.-18.].因此,TCP TF系列的名称来自这些蛋白质的缩略语。TCP基因可以基于TCP结构域的同源性分为两个亚壳:I类(或TCP-P)和II类(或TCP-C)[19.].TCP类I,也称为PCF亚家族,包含水稻OsPCF1和OsPCF2,而TCP类II进一步细分为CIN和CYC/TB1亚类[7.].与II类蛋白相比,I类蛋白TCP结构域基本区域的4个氨基酸缺失是两类蛋白最明显的区别。此外,两类的DNA结合序列略有不同,但部分重叠(I类为GGNCCCAC, II类为GTGGNCCC) [20.那21.].
累积证据证实,I类TCP蛋白主要在细胞生长和增殖中发挥作用[13.那20.],而CIN蛋白可能涉及横向器官发展,并且CYC / TB1思工主要涉及腋生的发育,从而产生鲜花或横向射击[5.那7.那9.那22.-27.].通常,两类TCP基因被认为是对特定的生物过程拮抗作用。我通常认为I类基因促进植物增长,主要基于OSPCF1 / OSPCF2和ATTCP20作为转录激活者的发现PCNA.和cycb1; 1基因(7.那20.那28.].在实践中,大多数阶级单级突变体都没有显示出显眼的表型变异,这可能是因为功能冗余。例如,越来越多的证据表明attcp14和attcp15功能冗余以调节生物过程和影响植物结构。两种基因还介导叶子和花的反应,以胃肠杆菌素(GA)促进种子萌发[29.-31.].最近,attcp14和attcp15被证明通过直接调节细胞周期基因的表达来压制细胞循环基因以影响细胞和器官生长[32.].在植物中观察到显着的植物形态变化TCP14 TCP15双突变体,如缩短的节间长度以及变化的叶片和萼片形态,而单突变体表现出轻度表型缺陷[29.那33.].而且,attcp9.和attcp19以冗余的方式发挥积极的作用attcp20.控制叶衰老的,如tcp9 tcp20和TCP19 TCP20与野生型相比,双突变体表现出早期的衰老发作,而单个突变体均未表现出加速衰老[13.那15.].
相比之下,对突变体的许多表型观察表明,II类TCP蛋白通常在细胞生长和增殖中具有预防作用。cin型基因限制了正在发育的叶原基边缘的细胞增殖。在金鱼草,拟南芥和番茄cin- 型突变体,叶细胞表现出与野生型相比较长时段继续分割的能力,从而产生更大的改变形状和/或皱纹表面的叶子[2那21.那25.那34.那35.].此外,许多TB1型TCP基因充当腋芽特异性调节剂,例如TB1玉米的18.那22.],ATBRC1.和ATBRC2.的拟南芥[4.那36.],PSBRC1豌豆(Pisum sativum.)[37.] 和OSFC1 / OSTB1.大米(38.那39.].这些基因的缺陷导致过量的芽分支,这表明这些TCP基因对芽活动的负函数[4.那36.-39.].在某些情况下,II类TCP基因也可能在植物的生长发育中发挥积极作用。attcp1.,Cyc / TB1亚克片段,涉及对花卉对称的控制[40].一种主导否定形式的过度表达TCP1那TCP1-SRDX.结果表明,在叶柄、莲座叶和花序茎的纵向伸长中,均存在矮化表型和缺陷拟南芥[9.那40].
迄今为止,只识别了少数TCP TFS,并且在功能上以模型植物特征在一起拟南芥和米饭。西瓜(Citrullus lanatus.L.)是一个重要的葫芦作物,在全世界广泛种植。但是,Watermelon TCP系列的信息很少。在这项研究中,首次进行了对西瓜中TCP基因家族的全局分析。二十七ClTCP对西瓜基因组中的基因进行了系统分析,包括染色体定位、系统发育关系、基因复制、保守基序和表达模式的确定。株高是西瓜的重要农艺性状。一般情况下,株高降低的西瓜基因型更适合集约栽培和温室早熟。ClTCP在本研究中发现了参与西瓜植物高度调节的基因。
结果和讨论
鉴定TCP基因Citrullus lanatus.
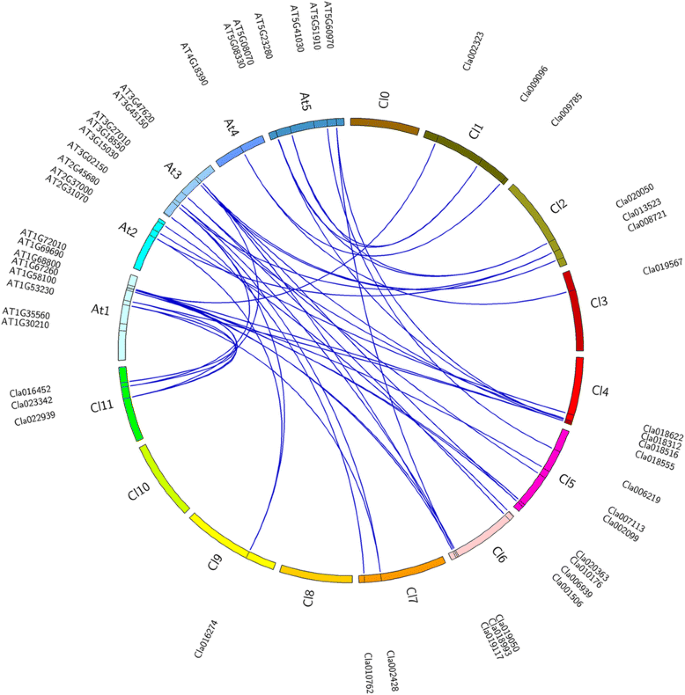
鉴定西瓜中的TCP蛋白质编码基因,拟南芥和水稻TCP蛋白序列在瓜类基因组数据库(http://www.icugi.org/cgi-bin/ICuGI/index.cgi).确定了包含保守的TCP领域的二十七个推定的TCP TFS(表1).在植物转录因子数据库(PlantTFDB;http://planttfdb.cbi.pku.edu.cn)与前一个搜索一致。由于缺乏指定在西瓜中27个TCP基因的标准注释,我们将基因命名为基因ClTCP1a到ClTCP21与之一致拟南芥序列相似性最高且遵循基因命名系统的TCP蛋白拟南芥.新鉴定的27个新鉴定的CLTCP TFS的长度从182〜517个氨基酸的范围为332.8氨基酸。表格中列出了CLTCP TFS的其他特性,包括分子量(MW),等电点(PI),型和染色体位置。1.根据TCP域的差异,ClTCP tf可以分为两个TCP类:12个TCP属于I类,因为相对于其他tf,其基本域存在4个氨基酸缺失;15个Class II ClTCP tf可以进一步聚集到CIN子类和CYC/TB1子类(附加文件1:图S1)。每个的基因组位置ClTCP西瓜的营养丰富,如图所示。1.将27个ClTCP基因映射到九条染色体。此外,基于由全长氨基酸序列构成的邻近的(NJ)系统发育树,建立了27个CLTCP TFS和24个attCP TFS之间推定的正非关系(图。1和额外的文件2:表S1)。西瓜中的TCP基因数量与此类似拟南芥,这与西瓜基因组中蛋白质编码基因的数量(23,440基因)的数量相一致[41近似于拟南芥(25,498个基因)[42].一些人拟南芥TCP基因在西瓜基因组中有多个对应基因,这可能是西瓜和西瓜基因组中存在差异基因扩增的结果拟南芥从共同的祖先分歧后。
可视化TCP地图链接组。CIRICOS图说明了TCP基因的相对位置。将基因绘制在其连接的对应染色体上。根据TAIR收集的染色体位置信息确定染色体位置(https://www.arabidopsis.org.)及瓜类基因组学数据库(http://www.icugi.org.).使用电池软件获得地图
系统发育分析与守恒图案
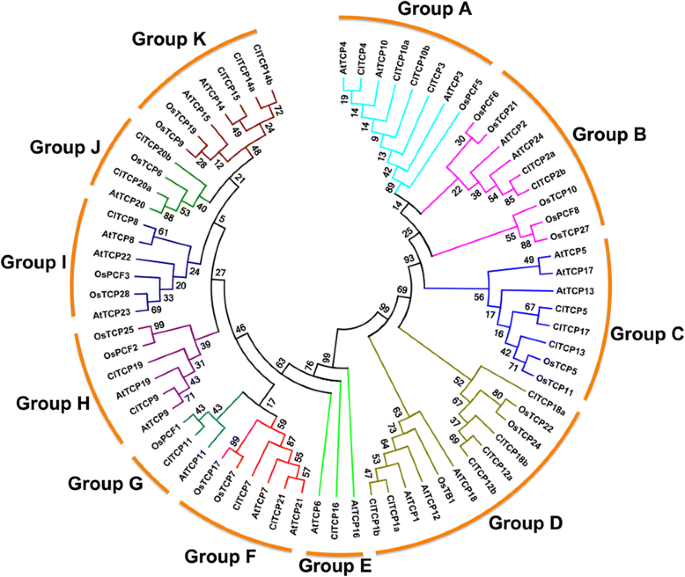
评估西瓜中TCP蛋白质中的系统发育关系,拟南芥和大米,使用NJ方法从27西瓜24的多序列对准构建一个大型系统发育树拟南芥和21种水稻TCP蛋白质(图。2).根据TCP域内外的序列特征,将TCP分为11个子组,分为A ~ K组。A、B、C组TCPs属于II类cin亚型,D组属于II类CYC/ tb1型,而其余TCPs属于I类亚家族(图1)。2).3种植物的TCP基因几乎分布在所有进化枝中,表明TCP家族在这些植物分化之前就已经分化。值得注意的是,在E组中没有大米TCP,在E组中观察到类似的结果高粱二色的(无花果。2和额外的文件3.:图S2)。这一发现意味着这一思想赛道可能在水稻和高粱中丢失,或者在祖先中获得拟南芥和柑橘类单焦点和双叶片分歧后。
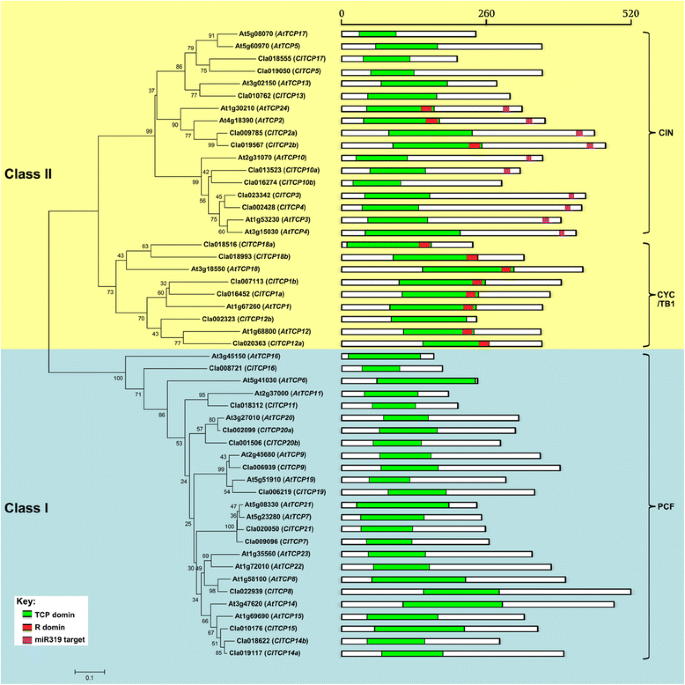
进行了保守的基序结构的分析以确认系统发育树的有效性。所有蛋白质中不存在于18-20个残基富有精氨酸的基序的R结构域,主要存在于Cyc / Tb1蛋白中。miR319位点仅存在于Cin样基因的子集中(图。3.).在拟南芥,MiR319调节茉莉酸酯生物合成,负调节叶片生长,呈正常调节叶片衰老并影响花瓣发育。这些功能取决于MiR319靶向TCP基因的转录后调节(attcp2.那attcp3.那attcp4.那attcp10和attcp24)[2那5.那27.那43].在本研究中,有5种cin类型ClTCP基因(cltcp2a.那2B.那3.那4.和10A)中含有推测的miR319靶点,序列相似性最高拟南芥miR319靶向TCP基因(图。3.).这些发现表明,MiRNA靶向同源TCP TFS的激素应答和叶片发育的调节可能在西瓜和拟南芥.此外,外显子/内含子结构分析显示大部分ClTCP基因缺乏内含子,除了ClTCP1a和ClTCP12b,其中包含一个内含子ClTCP18a包含两个内含子(数据未显示)。有趣的是,这三个ClTCP基因属于CYC / TB1型亚克片。
TCP家族成员的系统发育分析及保守基序拟南芥蒂利亚纳和Citrullus lanatus..一个大型的系统发育树,显示所有TCP转录因子之间的关系答:芥(在)和C. lanatus.(CL),使用Mega 5.0与邻近加入方法构建。通过使用1000重复的引导分析评估对拓扑的支持。I类以蓝色突出显示,II类以黄色突出显示。在右侧是使用狗2.0构建的蛋白质结构,指示保守的主题:TCP域(绿色)(http://pfam.xfam.org)、R域(红色)(PlntTFDB数据库)。microRNA miR319识别序列在mRNA中的位置用浅紫色表示(未按比例绘制)。这个比例尺代表氨基酸的长度
中TCP基因的表达谱Citrullus lanatus.
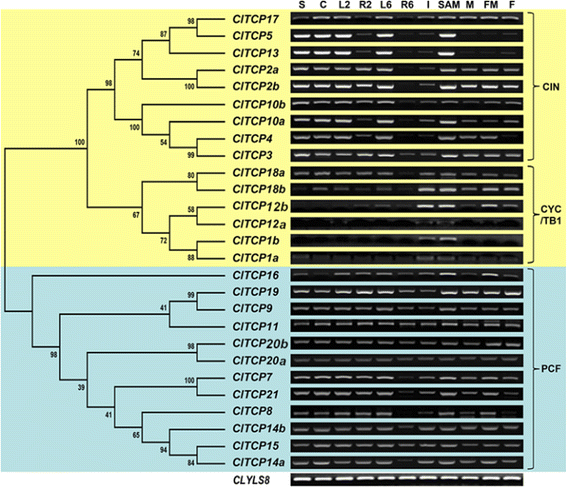
为了预测TCP基因在西瓜种子、子叶、叶、根、节间、茎尖分生组织(SAM)、雄性和雌性花蕾和果实中可能的功能,我们采用半定量PCR (semi-quantitative PCR)分析了TCP基因在西瓜不同器官中的转录本。有趣的是,表达分析表明,每个类/支都有一个独特的表达谱。如图所示。4.,大多数CIN-typeClTCP基因未表达或仅在根,花或水果中弱表达,并且在种子,子叶和叶中更高度表达,这表明这些基因可能在芽中进行重要作用。大多数CYC / TB1型ClTCP基因在种子、早期叶和根中表达相对较弱,但在特定组织中表达相对较高。例如,ClTCP18b和ClTCP12b在六叶阶段和水果中,在水槽和山姆中相对高度表达,而且在花和水果中,而且ClTCP1a, ClTCP1b和ClTCP12a仅在六叶阶段的Internode和Sam中表达。这些结果表明Cyc / TB1型ClTCP基因可能在节间和花的发育中起重要作用。II类TCP基因的功能类似,主要通过抑制细胞分裂和植物生长,一般表现出组织特异性的表达模式。CYC/TB1亚分支基因长期以来被认为是腋生分生组织发育的关键因素,这些分生组织产生花或侧枝。attcp1.与之最接近的基因赛克,参与叶子的纵向伸长。这拟南芥功能TCP1-1D.突变体表现为叶片伸长表型,而突变体的表达为叶片伸长表型TCP1-SRDX.野生型中的嵌合阻遏物基因导致相反的表型TCP1-1D.突变体[9.那40].而且,突变的hacyc2c.基因,TCP1 /赛克向日葵同系物促进了不育花向雌雄同体花的发育转变[44].表达at.TCP1在叶柄,花序茎的下部和膨胀玫瑰花叶的中间叶片和远端区域是强的。二ClTCP1基因,这是密切相关的attcp1.,在西瓜节间和SAM中强烈表达(图。4.).该结果与表达式模式一致一致attcp1.在拟南芥和暗示ClTCP1基因可能在西瓜节间和花序发育中发挥作用。attcp18,也被称为BRANCHED1(BRC1.) 和墨西哥类蜀黍BRANCHED1-LIKE1(TBL1.),作用于生长素和独角珠内酯的下游,协调腋芽的生长[4.那36.].attcp18也通过相互作用抑制腋生分生组织的成花转变开花轨迹T.(英国《金融时报》)[45].attcp12.,也被称为BRC2.,表现出较弱或没有突变表型attcp18[4.那36.].此外,在酵母双杂交实验中未检测到BRC2和FT蛋白之间的相互作用[45].在西瓜,表达水平ClTCP12b和ClTCP18b节间,山姆,花和水果中显着高。表达式ClTCP12a仅在节间和SAM中检测到(图。4.).这些观察结果表明,这些基因在西瓜分枝和/或花序发育中可能起到与西瓜分枝和/或花序发育相似的作用拟南芥同源物。相反,CIN型TCP基因被认为是在CYC / TB1型TCP之前发起的,并且对于产生平坦表面和叶子的平滑边缘非常重要。因此,cin型突变体通常表现出卷曲和/或锯齿状的叶子[2那23.那27.那35.].在西瓜中,所有cin型TCP基因均在子叶、叶片和SAM中表达(图2)。4.).该结果与叶片和侧向器官发展中的预测作用一致。
的表达模式Citrullus lanatus.不同组织中的TCP基因。表达剖面ClTCP通过半定量PCR分析,获得种子、叶片、节间、茎尖、根、花和果实中的基因。表达式的Clyls8.基因被监测为内部对照。所有TCP转录因子的系统发育树Citrullus lanatus.使用Mega 5.0与邻近加入方法构建。通过使用1000重复的引导分析评估对拓扑的支持。S:萌发种子;C:子叶;L2:叶在两个真叶阶段;R2:在双真叶阶段的根;L6:六个真叶阶段的叶子;r6:六个真叶阶段的根;我:尤基;山姆:拍摄顶端公司; M: male flower; FM: female flower; F: immature fruit 3 hours after pollination
相比之下,大多数I类基因,通常促进植物生长和细胞增殖,表现出更广泛和更少的组织特异性表达模式,如在叶、花和果实发育早期(图2)。4.).这一发现暗示这些基因可能在多种开发阶段发挥多样化的监管作用。在拟南芥,即使在单个突变体中观察到少量表型变化,已经发现了I类TCP TFS的几个重要功能。例如:attcp8.提出参与线粒体生物发生[46].attcp14和attcp15据报道,在种子,叶,花卉和节间发展期间调节细胞增殖[31.那33.那47].attcp15对于Endoreduplication也可能是重要的[48].attcp16.在早期花粉发育中发挥作用[3.].attcp20.的上游attcp9.,通过茉莉酸盐信号通路控制叶片发育[13.那15.那28.].所有这些ATTCP基因在西瓜中至少有一个对应物,暗示西瓜中的I类TCP可以进行类似的功能。在一起占据了模型植物的上述研究结果,强调了TCP系列在多种生物过程中表现不同的功能。ClTCP基因很可能与拟南芥同源物,因为它们不仅显示出高序列相似性,而且表达了类似的表达模式。
的角色ClTCP14a和ClTCP15在植物高度
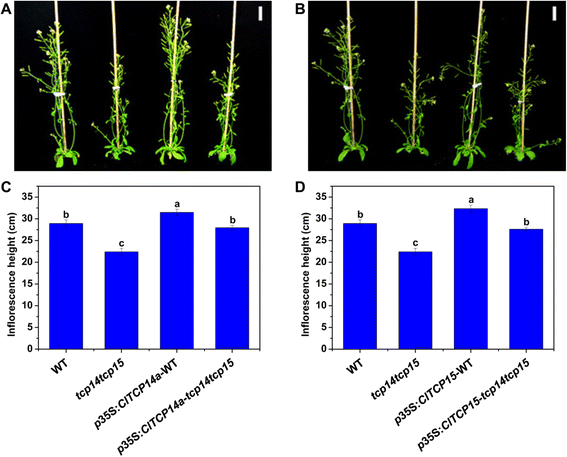
ClTCP14a和ClTCP15是西瓜中TCP TFs的I类亚家族成员(图。3.).这两个CLTCP基因与之密切相关拟南芥AtTCP14和attcp15以及Antirrhinum.TCP TF.Tic.[33.那49].给定一个TCP.- 西瓜中的突变体,我们检查了这两个的功能ClTCP四种独立转基因素基因(P35S:CLTCP14A-wt,p35区域:ClTCP15-wt,p35区域:ClTCP14a-tcp14 tcp15和P35S:CLTCP15-TCP14 TCP15),过度ClTCP14a或者ClTCP15同时拟南芥Col-0和TCP14 TCP15双突变体背景。在长日条件下生长42天后,双突变幼苗显示出花序高度显着降低,而不是野生型的5.).在任何单一突变体中没有鉴定可见表型,类似于Kieffer等人的观察结果。[33.].异位表达ClTCP14a或者ClTCP15是否足以恢复TCP14 TCP15是野生型的双突变体。这P35S:CLTCP14Awt和p35区域:ClTCP15-WT线与野生型相比,花序高度的增加(图。5.).这些结果表明ClTCP14a和ClTCP15函数冗余控制拟南芥株高对西瓜茎节间伸长有一定的促进作用。扫描电镜观察发现,与野生型相比,双突变体的毛状体分枝过多,且在突变体中过表达ClTCP14a或者ClTCP15在两个背景中抑制毛状体分支(附加文件4.:图S3)。此外,在两种背景下,每个西瓜TCP基因的异位表达均增加了成熟叶片的相对叶绿素含量5.:图S4)。这些调查结果表明ClTCP14a和ClTCP15也可能参与叶片发展。
组成型表达的形态学效应ClTCP14a和ClTCP15在转基因拟南芥.一种野生型(WT;Col-0),双突变体(TCP14 TCP15) 和P35S:CLTCP14A在WT和双突变体背景下长日条件下生长42天。B.WT、双突变体和p35区域:ClTCP15在WT和双突变体背景下长日条件下生长42天。C幼苗的花序高度如(一种).D.幼苗的花序高度如(B.).比例尺= 3厘米。不同小写字母表示不同基因型花序高度差异显著(P. < 0.05, one-way ANOVA and then Tukey’s test for multiple comparisons). Values are means ± SD (N. = 20)
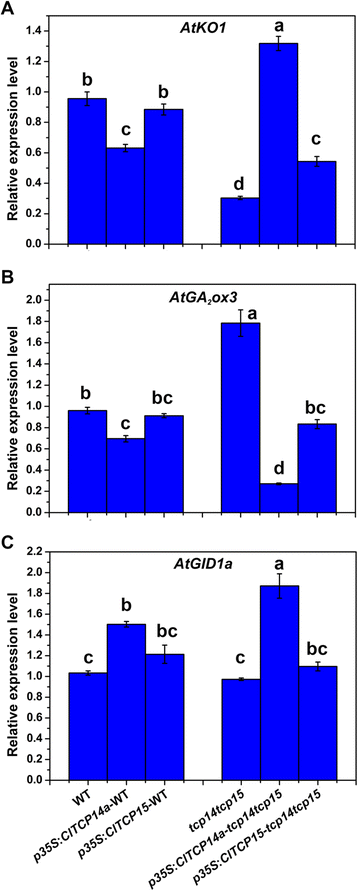
考虑到GA是植物高度的调节因子,我们研究了是否过表达ClTCP14a和ClTCP15影响GA的生物合成和代谢。ATKO1和阿尔戈2ox3参与GA生物合成和降解的参与,分别更弱,更高度表达TCP14 TCP15与野生型相比双突变体。每个西瓜的异位表达TCP.在TCP14 TCP15背景显示对表达的积极和负面影响ATKO1和阿尔戈2ox3分别(图。6 a和B).然而,这些效应在野生型背景中没有观察到。GA受体,ATGID1A,略微但显着上调cltcp14a-和ClTCP15 -过度表达拟南芥(无花果。6摄氏度).这些结果表明过表达ClTCP14a和ClTCP15可以增强GA累积和信令TCP14 TCP15这些TCP基因对植物高度的影响可能与GA通路相关。有趣的是,所有GA相关基因的表达与所有GA相关基因之间有显着差异ClTCP14a- 和ClTCP15转基因拟南芥,这可能反映了较高的表达水平ClTCP14a与之相比ClTCP15在每个转基因线中(附加文件6.:图S5)。
赤霉素(GA)相关基因在转基因植物中的表达拟南芥.相对表达水平一种GA Biosynthesis基因ATKO1那B.GA降解基因阿尔戈2ox3和CGA受体基因ATGID1A在野生型(WT)的幼苗中,双突变体(TCP14 TCP15),P35S:CLTCP14A和p35区域:ClTCP15在WT和双突变体背景下由定量RT-PCR确定。表达式的Clyls8.基因被监测为内部对照。不同的小写字母表示相对表达水平的显着差异(P. < 0.05, one-way ANOVA and then Tukey’s test for multiple comparisons). Values are means ± SD (N. = 3)
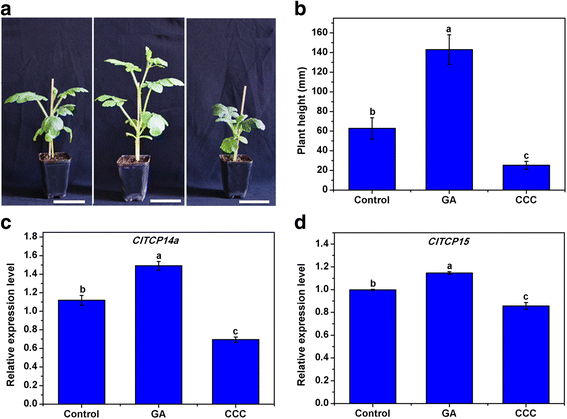
此外,还研究了赤霉素和赤霉素生物合成抑制剂氯化氯(CCC)对植株高度的影响ClTCP14a和ClTCP15在西瓜中检查表达。结果表明,Ga和CCC分别是西瓜植物高度的功能性增强剂和抑制剂(图。7一个和B.).这两个调节器可能通过影响节点长度而不是节电区号来函数,因为观察到的节间数没有差异。两者的表达式ClTCP14a和ClTCP15通过Ga和CCC处理显着上调和下调(图。7 c和D.).这些结果证实了ClTCP14a和ClTCP15可能通过GA相关的途径积极调节西瓜植物身高和节间长度。
赤泡酸(GA)和ChlorMequat氯化物(CCC)对植物高度及表达的影响ClTCP西瓜基因。在双真叶阶段用水(对照),GA和CCC处理西瓜幼苗。一种和B.西瓜六真叶期苗株高。比例尺= 7厘米。不同小写字母表示各处理间株高有显著差异(P. < 0.05, one-way ANOVA and then Tukey’s test for multiple comparisons). Values are means (N.= 5)±sd。C相对表达水平ClTCP14a在治疗后1天的西瓜幼苗。D.相对表达水平ClTCP15在不同治疗后1天的西瓜幼苗。不同的小写字母表示相对表达水平的显着差异(P. < 0.05, one-way ANOVA and then Tukey’s test for multiple comparisons). Values are means ± SD (N. = 3)
植物高度是西瓜的重要农艺征,这显着影响了该领域的种植密度和结果。众所周知的细胞增殖调节剂,TCP TFS无疑是节间和植物伸长的重要参与者。目前的结果显示ClTCP14a和ClTCP15通过ga相关途径对转基因植株节间长度和株高进行冗余调控拟南芥(无花果。5.那6.和7.).在拟南芥那attcp14和attcp15据报道,通过促进细胞增殖,主要是在双突变体中观察到的表型和TCP14:SRDX.线[33.].本结果为该基因型表型相关性提供了直接证据。而且,attcp14和attcp15在幼嫩花序茎、幼嫩花梗、子叶和叶原基节间表达[33.].这些结果通常与本表达分析一致ClTCP西瓜中的基因(图。4.).此外,最近据报道attcp14和attcp15在种子萌发期间介导细胞周期的GA依赖性激活[31.].因此,我们假设CLTCP14A和CLTCP15还可以在GA的下游作用于类似的方式在节间形成期间促进细胞增殖。有趣的是,我们的研究结果表明CLTCP14A和CLTCP15也可能影响GA生物合成和信令(图。6.),可能是由反馈监管机制产生的。
结论
在该研究中,在西瓜基因组中鉴定了27个TCP基因,其在具有不同密度的九个染色体上分布。基于TCP域中的相似性,将这些TCP基因分类为两类。表达分析表明,每个类/思工的成员显示了类似的表达模式。而且,许多人ClTCP基因向他们的表达模式显示了类似的表达模式拟南芥同源物,表明TCP家族在两种物种中显示出保守的功能。另外,两个功能ClTCP基因,ClTCP14a和ClTCP15,在规定的间伸缩中得到了确认。最终,这些发现将导致通过基因工程改善西瓜品种的潜在应用。
方法
植物材料和生长条件
西瓜(Citrullus lanatus.l .简历。以浙江大学种质创新与分子育种实验室自交系IVSM9为主要植物材料。在光合光子通量密度为600 μmol m的植物加速器中,植物在27°C(白天)的光周期为16 h, 24°C(夜晚)的光周期为8 h-2S.-1相对湿度为70-80%。
拟南芥蒂利亚纳生态型哥伦比亚-0(COL-0)用作野生型。全部拟南芥材料,包括tcp14-4那TCP15-3那tcp14-4 tcp15-3他们的背景是从英国利兹大学获得的,并通过Kieffer等人所述的PCR进行基因分型。[33.].植物在三洋的生长室中生长(三洋,http://www.sanyobiomedical..Co.UK)在20°C下,在长期条件下,光周期为16 H / 8 H(日/夜),光合光子通量密度为200μmolm-2S.-1和60%的相对湿度。
染色体分析
关于所有的染色体位置的信息attcp.基因是从拟南芥信息资源获得的(Tair;http://www.arabidopsis.org),而且为所有人ClTCP通过针对葫芦科学数据库(http://www.icugi.org)来获得基因。所有TCP基因组数据都使用电流软件在CIRCOS地图中进行了可视化(http://circos.ca).
序列对准和系统发育分析
在基因组中的24个TCP家族成员的序列拟南芥从TAIR (http://www.arabidopsis.org)或planttfdb(http://planttfdb.cbi.pku.edu.cn/)。二十七ClTCP从葫芦基因组学数据库(http://www.icugi.org)的爆炸分析中鉴定了基因。TCP蛋白的氨基酸序列的多序列比对Citrullus lanatus.和拟南芥使用Clustalx 2.0软件生成,具有默认设置,如Thompson等人所述。[50].使用Mega 5.0软件构建基于序列比对的一个无根曲线发育树(http://www.megasoftware.net/)[51]和邻域连接方法,采用以下参数:两两对齐、1000次bootstrap重复、泊松校正模型、均匀替代率和完全删除。此外,对所有TCP蛋白序列构建了单独的系统发育树Citrullus lanatus.进一步分析。
鉴定保守的主题
使用PFAM(http://pfam.xfam.org)和smart(http://smart.embl-heidelberg.de)工具来识别保守的TCP域。R域从PlantTFDB (http://planttfdb.cbi.pku.edu.cn/)中获得。鉴定mir319靶向TCP基因的方法已在前面介绍[2].可视化蛋白质结构域结构,IBS 1.0软件(http://www.mybiosoftware.com/ibs-illustrator-biological-序列.html.)使用。
RNA分离和RT-PCR分析
使用RNAprep Pure Plant Kit从组织中分离总RNA,并用DNase I (Tiangen,http://www.tiangen.com).使用RNA Nanodrop(Thermo Scientific)的Thermo 2000生物分析仪评估RNA浓度和质量。http://www.thermo.com.).采用逆转录试剂盒(ReverTra Ace®qPCR RT Master Mix with gDNA Remover kit, Toyobo),以总RNA为1 μg,体积为20 μl,用水稀释至200 μl进行逆转录。半定量PCR和PCR以1 μL反转录产物为模板,体积反应为20 μL。采用不同的退火温度对结果进行优化,并在35个循环后终止PCR。PCR产物经1.5%琼脂糖凝胶电泳分离,紫外扫描可见。RT-qPCR检测采用20 μl的qPCR混合物,其中包含2.5 μl第一链cdna, 10 μl 2× FastStart Universal SYBR Green Master (Roche),每个基因的正、反引物均为0.25 μM。每个基因的相对表达量归一化为黄叶特异蛋白8 (CLYLS8)的mRNA水平作为加载对照。每个病例分析三个生物学重复。CT值通过Real-Time PCR System StepOne version 2.1软件(Applied Biosystems)获得。比较CT法计算相对皱襞表达变化:皱襞变化计算为2-ΔΔct.计算∆CT值为CLYLS8 CT值与∆CT值的差值。∆CT为TCP基因的∆CT值与参照基因的∆CT值的差值。用于半定量PCR和RT-qPCR程序的基因特异性引物列于附加文件7.:表S2。
向量构造
研究…的作用ClTCP14a和ClTCP15,使用Camv35s.启动子。全长ClTCP14acDNA(1197 BP)和ClTCP15通过双圆形PCR扩增cDNA(1062bp):第一轮与基因特异性引物ClTCP14a-Fl-F和ClTCP14a-Fl-R,ClTCP15-Fl-F和ClTCP15-fl-r分别;第二轮与常见的引物attb1-f和attb2-r。最后,通过BP和LR反应将两个序列克隆到网关™载体PMDC83(Invitrogen)中,如Curtis和Grossniklaus所述[52].用于载体构建的引物列在附加文件中8.:表S3。
转型拟南芥
两种构建体被转化为农杆菌肿瘤术菌株GV3101(PMP90)[53].野生型和TCP14 TCP15通过花浸法进行植物[54].转化后,植物被保存在生长室直到种子结实率。在含50 μg ml的萌发培养基上进行转化菌筛选-1潮霉素-B(Roche,http://www.roche.com.)培养10 d后,T1将幼苗转移到土壤中并生长直至种子套装。在选择时1植物,选择湿霉素抗性阴性的植物系作为阴性对照。此外,过度表达分析TCP14A或者TCP15在候选转基因中拟南芥用于确认成功的转换(附加文件6.:图S5)。纯合子T3.本研究使用植物。在大多数实验中鉴定并分析了六十个初级转化体。
节间测量
42日龄花序高度和节间长拟南芥植物被测量。所有测量值均来自3个独立实验,每次实验至少测量10个重复幼苗。
显微镜
分析解剖和制备用于扫描电子显微镜分析的样品如前所述[33.].
植物激素治疗
赤霉酸(150 mg L.-1)(生物技术级Biosharp,http://www.biosharp.cn)及150毫克升-1在双真叶阶段喷洒ChlorMequat氯(上海Biorc Co.,Ltd.)喷洒到西瓜幼苗的叶子表面上。用水作为对照。三天后,重复治疗。在六个真叶阶段测量植物高度。
提供支持数据的可用性
支持本文结果的数据集可在http://dx.doi.org/10.5061/dryad.9pp6q.
参考文献
- 1。
Cubas P,Lauter N,Doebey J,Coen E. TCP领域:在蛋白质调节植物生长和发育中发现的基序。工厂J. 1999; 18:215-22。
- 2。
王志强,王志强,王志强,等。微rna对水稻叶片形态发生的调控作用。华北农学报。大自然。2003;425:257 - 63。
- 3。
Takeda T,Amano K,Ohto M,Nakamura K,Sato S,Kato T,Tabata S,Ueguchi C. RNA干扰拟南芥推定转录因子TCP16基因导致堕胎的早期花粉发育。植物mol biol。2006; 61:165-77。
- 4.
Aguilar-Martínez J, posa - carrion C, Cubas P. ArabidopsisBRANCHED1作为腋芽分支信号的整合者。植物细胞。2007;19:458 - 72。
- 5.
nag a,king s,杰克t. mir319a瞄准TCP4.是花瓣生长发育的关键拟南芥.美国国家科学研究院2009;106:22534-9。
- 6.
Pruneda-Paz J,Breton G,Para A,Kay S.一种功能基因组学方法揭示了Che作为一个组成部分拟南芥昼夜时钟。科学。2009; 323:1481-5。
- 7.
Martín-Trillo M,古巴群体P.TCP基因:十年后的家庭快照。趋势植物SCI。2010; 15:31-9。
- 8.
Giraud E, Ng S, Carrie C, Duncan O, Low J, Lee CP, Van Aken O, Millar AH, Murcha M, Whelan J. TCP转录因子将编码线粒体蛋白的基因的调控与生物钟联系在一起拟南芥蒂利亚纳.植物细胞。2010;22:3921-34。
- 9.
郭志强,郭旭,李建军。TCP1通过调控油菜素内酯关键基因的表达调控油菜素内酯的合成矮人4在拟南芥蒂利亚纳.植物细胞。2010; 22:1161-73。
- 10。
SarvePalli K,Nath U.TCP4转录因子的超激活拟南芥蒂利亚纳加速植物成熟的多个方面。植物j . 2011; 67:595 - 607。
- 11.
Viola I, Uberti Manassero N, Ripoll R, Gonzalez D. The拟南芥I类TCP转录因子attcp11是由于在TCP结构域的位置15处存在苏氨酸残基而具有明显的DNA结合特性的发育调节剂。Biochem J 2011; 435:143-55。
- 12.
赤霉素对番茄披针形细胞活性的影响。植物j . 2011; 68:571 - 82。
- 13。
Danisman S,Van der Wal F,Dhondt S,Waites R,De Folter S,Bimbo A,Van Dijk A,Muino J,Cutri L,Dornelas M,Angenent G,Immink R.拟南芥I级和II类TCP转录因子调节茉莉酸代谢和叶片发育拮抗作用。植物理性。2012; 159:1511-23。
- 14。
Balsemão-Pires E,Andrade L,Sachetto-Martins G. TCP23的功能研究拟南芥蒂利亚纳在植物开发期间。植物理性生物化学。2013; 67:120-5。
- 15.
Danisman S, van Dijk A, Bimbo A, van der Wal F, Hennig L, de Folter S, Angenent G, Immink R.内部功能冗余分析拟南芥TCP转录因子家庭。J Exp Bot。2013; 64:5673-85。
- 16.
PCF1和PCF2特异性结合水稻增殖细胞核抗原基因中的顺式元件。植物细胞。1997;9:1607-19。
- 17.
罗丹,卡彭特,文森Antirrhinum..自然。1996年; 383:794-9。
- 18.
王志强,王志强,王志强,等。玉米根尖优势的进化。大自然。1997;386:485-8。
- 19.
Navaud O,Dabos P,Carnus E,Tremousayque D,HervéC.TCP转录因子预测土地植物的出现。J Mol Evol。2007; 65:23-33。
- 20.
关键词:TCP蛋白家族,DNA结合,二聚体,特异性植物j . 2002; 30:337-48。
- 21.
ABAP1是一种新的植物犰狳BTB蛋白,参与了DNA的复制和转录。EMBO j . 2008; 27:2746-56。
- 22.
张志强,张志强,张志强,等。大刍草分枝与玉米的起源:上位性和显性进化的证据。遗传学。1995;141:333-46。
- 23.
王志强,王志强,王志强,等。表面曲率的遗传控制。科学。2003;299:1404-7。
- 24.
Cubas P.花卉Zygomorphy,成功特质的重复演变。生物。2004; 26:1175-84。
- 25。
Crawford B,Nath U,Carpenter R,Coen E.辛辛那亚控制瓣膜叶片和抗饲料叶片的细胞分化和生长。植物理性。2004; 135:244-53。
- 26。
Koyama T,Furutani M,Tasaka M,Ohme-Takaqi M.TCP转录因子通过对基因特异性基因表达的负调节控制射击横向器官的形态拟南芥.植物细胞。2007; 19:473-84。
- 27。
王志强,王志强,王志强,等。miR319靶点对茉莉酸酯合成和衰老的调控作用。公共科学图书馆杂志。2008;6:1991 - 2001。
- 28。
Li C,Potuschak T,Colón-Carmona A,Gutiérrezr,德国人P. Arabidopsis TCP20环节调节生长和细胞分裂控制途径。Proc Natl Acad Sci U S A. 2005; 102:12978-83。
- 29。
Steiner E,Efroni L,Gopalraj M,Saathoff K,Tseng T,Kieffer M,Eshed Y,Olszewski N,Weiss D.的拟南芥O-连接的N-乙酰葡糖胺转移酶与I类TCPS立即相互作用,以促进叶子和花中的细胞蛋白反应。植物细胞。2012年; 24:96-108。
- 30.
I类TCPs调控番茄细胞分裂素诱导的分支和分生组织活性。植物信号行为。2012;7:807-10。
- 31。
resentiin f,Felipo-benavent A,Colombo L,Blázquezm,alabadíd,masiero s. tcp14和TCP15调解了吉布林林的种子萌发拟南芥蒂利亚纳.摩尔。2015;8:482-5。
- 32。
彭y,陈l,卢y,吴y,dumenil j,zhu z,bevan m,li y。泛素受体DA1,DAR1和DAR2通过调制TCP14 / 15的稳定性来冗余调节结束补充。拟南芥.植物细胞。2015; 27:649-62。
- 33。
Kieffer M,Master V,Waites R,Davies B.TCP14和TCP15影响拟南芥中的节间长度和叶形。工厂J1111; 68:147-58。
- 34。
ori n,cohen a,etzioni a,品牌a,yanai o,shleizer s,menda n,amsellem z,efroni i,pekker i,alvarez j,blum e,zamir d,Eshed Y.披针形经过mir319.番茄中复合叶发育需要。NAT Genet。2007; 39:787-91。
- 35。
EFRONI I,BLUM E,GoldShmidt A,Eshed Y.一种旷日持久和动态成熟时间表拟南芥叶发育。植物细胞。2008; 20:2293-306。
- 36。
Finlayson S.拟南芥Teosinte分支1样调1调节腋芽过剩,并且与单胶质Teosinte分支的同源形式。植物细胞生理。2007; 48:667-77。
- 37。
Braun N,De Saint Germain A,Pillot J,Boutet-Mercey S,Dalmais M,Antoniadi I,Li X,Maia-Grondard A,Le Signor C,Bouteiller N,Luo D,Bendahmane A,Turnbull C,Rameau C.该豌豆TCP转录因子PSBRC1作用下游毒蕈作用以控制射击分支。植物理性。2012; 158:225-38。
- 38。
Takeda T,Suwa Y,Suzuki M,Kitano H,Ueguchi-Tanaka M,Ashikari M,Matsuoka M,Ueguchi C.该OSTB1.基因负调节水稻中的侧枝。工厂J. 2003; 33:513-20。
- 39.
Minakuchi K,Kameoka H,Yasuno N,Umehara M,Luo L,Kobayashi K,Hanada A,Ueno K,Asami T,Yamaguchi S,Kyozuka J.细CULM1(FC1)在杂草酮的下游工作,以抑制水稻中腋芽的生长。植物细胞生理。2010; 51:1127-35。
- 40.
Koyama T,Sato F,Ohme-Takagi M.的作用TCP1在叶片的纵向伸长中拟南芥.生物科学与技术。2010;74:2145-7。
- 41.
郭S,张j,孙h,萨斯j,卢卡斯w,张h,zheng y,mao l,任y,wang z,min j,gu x,murat f,火腿b,张z,gao s,huang m那Xu Y, Zhong S, Bombarely A, Mueller L, Zhao H, He H, Zhang Y, Zhang Z, Huang S, Tan T, Pang E, Lin K, Hu Q, Kuang H, Ni P, Wang B, Liu J, Kou Q, Hou W, Zou X, Jiang J, Gong G, Klee K, Schoof H, Huang Y, Hu X, Dong S, Liang D, Wang J, Wu K, Xia Y, Zhao X, Zheng Z, Xing M, Liang X, Huang B, Lv T, Wang J, Yin Y, Yi H, Li R, Wu M, Levi A, Zhang X, Giovannoni J, Wang J, Li Y, Fei Z, Xu Y. The draft genome of watermelon (Citrullus lanatus.),并对20个不同种质进行重测序。Nat麝猫。2013;45:51-8。
- 42.
拟南芥基因组倡议。开花植物基因组序列分析拟南芥蒂利亚纳.自然。2000; 408:796-815。
- 43.
Palatnik J,Wollmann H,Schommer C,Schwab R,Boisbouvier J,Rodriguez R,Warthmann N,Allen E,Dezulian T,Huson D,Carrington J,Weigel D.序列和表达差异基础和表达差异拟南芥Micrornas mir159和mir319。DEV细胞。2007; 13:115-25。
- 44.
Fambrini M,Salvini M,Pugliesi C.转座介导的灭活环淋巧类基因起源于多对称和雌雄同体的射线花Helianthus Annuus..遗传。2011;139:11-2。
- 45.
Niwa M,Daimon Y,Kurotani K,Higo A,Pruneda-Paz JL,Breton G,Mitsuda N,Kay Sa,Ohme-Takagi M,Endo M,Araaki T.分支1与开花轨迹T相互作用,以抑制花卉过渡腋生分生成品拟南芥.植物细胞。2013;25:1228-42。
- 46.
Hammani K,Gobert A,Hleibieh K,Choulier L,Small I,GiegéP.An拟南芥双定位五磷酸重复序列蛋白与参与基因表达调控的核蛋白相互作用。植物细胞。2011;23:730-40。
- 47.
Hiratsu K,Matsui K,Koyama T,Ohme-Takagi M.嵌合压缩机的主导压制靶基因,包括耳图案,镇压领域,拟南芥.植物j . 2003; 34:733-9。
- 48.
李泽,李波,董安拟南芥转录因子AtTCP15通过调节关键细胞周期基因的表达来调控核内复制。摩尔。2012;5:270 - 80。
- 49。
Weir I, Lu J, Cook H, causer B, Schwarz-Sommer Z, Davies B。Cupuliformis.建立侧器官边界Antirrhinum..发展。2004; 131:915-22。
- 50。
汤普森JD,Gibson TJ,Plewniak F,Jeanmougin F,Higgins DG。Clustal_x Windows接口:通过质量分析工具提供多个序列对齐的灵活策略。核酸RES。1997年; 25:4876-82。
- 51。
田ura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:利用最大似然、进化距离和最大简约法的分子进化遗传学分析。生物化学学报2011;28:2731-9。
- 52。
柯蒂斯MD,Grossniklaus U.一种在Planta中基因的高通量功能分析的网关克隆传染媒介。植物理性。2003; 133:462-9。
- 53。
KONCZ CAND SCHELL J. T的启动子L.-DNA基因5控制着一种新类型的嵌合基因的组织特异性表达农杆菌属二元载体。Mol Gen Genet。1986; 204:383-96。
- 54。
花的倾斜:一种简化的方法农杆菌属介断的转换拟南芥蒂利亚纳.工厂J. 1998; 16:735-43。
致谢
中国国家自然科学基金(31501782),浙江省自然科学基金(LQ16C150002),教育部研究,中国天然科学基金(31501782)(31501782)的专用基金(Cars-26-17)的专用基金支持浙江省计划(Y201329960)和中央大学基本研究资金(2013 QA6013)。我们感谢Martin Kieffer博士捐赠突变体。
作者信息
从属关系
通讯作者
额外的信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
ZH、JY、MZ对研究进行了构思和设计;PS、WW、BF和KG进行了实验并对数据进行了分析;ZH和PS写论文;所有作者都已阅读并批准了最终版本。
附加文件
附加文件1:图S1。
西瓜TCP家族成员氨基酸序列预测的比对。(PDF 3445 kb)
附加文件2:表S1。
西瓜与中国TCP的正交关系拟南芥.(XLSX 39 KB)
附加文件3:图S2。
西瓜TCP转录因子的系统发育关系,拟南芥,水稻和高粱。(PDF 2881 KB)
附加文件4:图S3。
的影响ClTCP14a和ClTCP15在胎儿枝条上拟南芥叶子。(TIF 3851 KB)
附加文件5:图S4。
相对叶绿素含量拟南芥叶子。(PDF 371 kb)
附加文件6:图S5。
ClTCP14a和ClTCP15转基因过表达水平拟南芥。(PDF 893 KB)
附加文件7:表S2。
用于半QPCR和RT-QPCR的基因特异性引物。(XLSX 47 KB)
附加文件8:表S3。
用于矢量结构的引物。(XLSX 30 KB)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Shi,P.,Guy,K.m.,Wu,W.等等。基因组识别和表达分析ClTCP转录因子Citrullus lanatus..BMC植物杂志16,85(2016)。https://doi.org/10.1186/s12870-016-0765-9.
已收到:
公认:
发表:
关键词
- TCP.
- 转录因素
- 西瓜
- 节间伸长