摘要
背景
在许多物种中,花的衰老是由乙烯协调的。内源性水平上升,外源性应用加速衰老。此外,花的衰老通常与活性氧的增加有关,并被外源性细胞分裂素延缓。然而,这些过程之间的联系在很大程度上仍未得到解决。Erysimum linifolium(壁花)为理解这些相互作用提供了一个很好的模型,因为它的花很容易分期,并且与植物有密切的分类关系拟南芥。这为花瓣衰老过程中基因表达的微阵列分析提供了便利,并为跟踪处理对不同调控途径的影响提供了基因标记。
结果
在分离Erysimum linifolium(壁花)花在开放花中乙烯产量最高。此外,乙烯信号抑制剂硫代硫酸银延缓了衰老,2-氯乙基膦酸释放的乙烯加速了衰老。用外源性细胞分裂素或6-甲基嘌呤(一种细胞分裂素氧化酶抑制剂)处理都能延缓花瓣衰老。然而,细胞分裂素处理也增加乙烯的生物合成。尽管对衰老的影响相似,但基因标记的转录丰度受到不同处理的影响不同。的转录丰度显著上升WLS73细胞分裂素或6-甲基嘌呤处理可消除(一种假定的氨基环丙基羧酸氧化酶)。相比之下,WFSAG12转录本(衰老标志物)继续显著积累,尽管速度降低。硫代硫酸银抑制了两者转录本丰度的增加WFSAG12和WLS73。活性氧清除酶的活性随着衰老而改变。增加细胞分裂素水平或抑制乙烯作用的处理可减少过氧化氢的积累。此外,尽管生长素水平随着衰老而上升,但延缓早期衰老的处理并不影响转录物丰度WPS46这是一种生长素诱导基因。
结论
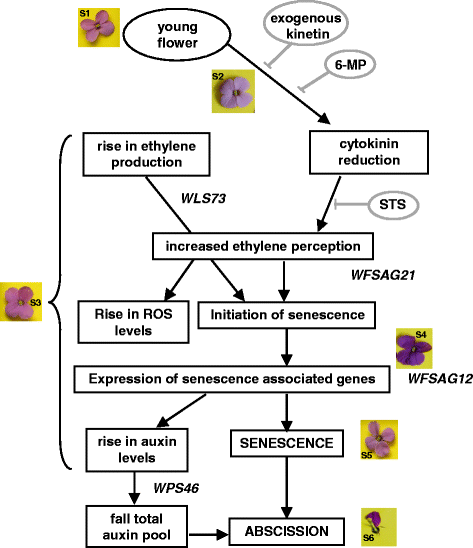
提出了细胞分裂素、乙烯、活性氧和生长素相互作用调控壁花衰老的模型。乙烯的增加和细胞分裂素的减少共同引发了衰老的开始,这两种植物生长调节剂直接或间接地导致活性氧水平的增加。结合生长素和/或总生长素库的下降最终引发脱落。
背景
花瓣衰老结束了花的生命,是将养分重新输送到植物其他部位的重要过程[1,2]。因此,在许多物种中花瓣衰老的一个关键特征是它的时间协调。这确保了在器官分离之前已经进行了再活动。许多在叶片衰老过程中参与重组的基因在花瓣衰老过程中也被上调[3.]。然而,叶片和花瓣衰老的时间很难作为基准。衰老相关基因(SAG12)通常被认为是花瓣上的特定衰老标记[4]和树叶[5]。然而,在壁花花瓣中,这种基因的表达要比在处于类似衰老生理阶段的叶子中要早得多[3.]。这表明在花瓣转录丰富SAG12是早期衰老的标志。
几种植物生长调节剂(pgr)参与花瓣衰老的调控。然而,它们之间的相互作用和具体的调节作用仍有待充分阐明。在许多物种中,授粉刺激乙烯的产生,乙烯的产生和敏感性是花瓣衰老的主要协调者[6]。在这些物种中,呼吸爆发伴随着乙烯产量的突然增加。这可能通过刺激乙烯生物合成基因而成为自催化[7,8]。也有充分的证据表明,用生长素处理一些乙烯敏感花会导致加速衰老。即使对分离的花瓣进行处理,也会发生这种情况[9,10]。乙烯生物合成基因在许多物种的花中都有很好的特征[11]。乙烯生物合成的关键调控因子是氨基环丙烷羧酸合成酶(ACC合成酶或ACS)和氨基环丙烷羧酸氧化酶(ACC氧化酶或ACO)。的表达ACS和华在花的衰老过程中,基因通常是协调调节的Alstroemeria[12];康乃馨(13]和番茄[14])。在壁花中,可用的ESTs分析显示一个ACC氧化酶样蛋白(WLS73)。喜欢它的拟南芥同系物(15]WLS73在微阵列上的叶片和花瓣衰老过程中表达上调[3.]。
生长素通过增加ACC合成酶的活性诱导乙烯生成[j]。16]。然而,生长素的内源水平只在少数几种花卉中测量过[17,18]。辅助/ IAA在康乃馨花瓣衰老过程中转录本短暂增加[19),拟南芥叶片衰老[20.],但在拟南芥衰老花瓣[15]。然而,一个假定的同源词拟南芥生长素反应样蛋白DFL1(光中的侏儒)和西红柿GH3基因(21],在传粉诱导的矮牵牛花冠衰老过程中表达上调[22]。这个基因的壁花同源物,WPS46在壁花微阵列上随着花瓣和叶片的衰老而上调[3.]。DFL1编码一种IAA-氨基合酶,催化吲哚-3-乙酸(IAA)与氨基酸结合,从而调节游离IAA的水平[23]。
与乙烯相反,细胞分裂素延缓了花组织的衰老[24]。在过表达异戊烯基转移酶(ipt)基因驱动的衰老特异性SAG12启动子。这些转基因具有高水平的细胞分裂素,延迟授粉诱导的乙烯产生和延长花瓣寿命[25]。用合成细胞分裂素、动素或玉米素处理可延缓离体康乃馨花瓣的花瓣衰老,并可能通过降低乙烯敏感性导致乙烯产量的缓慢上升[26,27]。用6-甲基嘌呤(一种细胞分裂素氧化酶抑制剂)处理切花也能延长康乃馨的花瓣寿命[28]。这表明通过细胞分裂素氧化酶降解细胞分裂素可能在花瓣衰老中起重要作用。然而,细胞分裂素和乙烯之间的关系似乎是相互的,因为在矮牵牛花中,外源施加乙烯既诱导花瓣衰老,又诱导细胞分裂素失活[j]。29]。
活性氧(ROS)被认为在植物衰老中起重要作用[30.]。这与衰老过程中抗氧化能力的丧失是一致的。在许多不同的物种中都报道过这种损失[31,32]。在花瓣衰老中,ROS的作用仍有争议[33尽管在乙烯敏感和不敏感的物种中,ROS水平的上升伴随着花的衰老。目前尚不清楚ROS水平的增加是否具有调节信号功能,还是细胞进入程序性细胞死亡时发生的抗氧化系统去调节的结果[24]。H的增加2O2黄花菜在开花时的含量[31],菊花[34]和玫瑰[35]。此外,H2O2在关键的衰老标记(如蛋白酶的增加和线粒体中细胞色素c的释放)出现后,郁金香花瓣的衰老也很晚才出现峰值[36]。在黄花草中也有类似的峰值,发生在与膜降解相关的离子泄漏急剧上升之后[31]。在花瓣中,活性氧水平的上升伴随着活性氧相关酶(如过氧化氢酶、抗坏血酸过氧化物酶和超氧化物歧化酶)的活性以及抗氧化剂(如生育酚)水平的变化[33,37]。重要的是,这些酶都是由基因家族编码的,活性的变化与特定同工酶活性的变化有关。ros应答基因已在许多物种中被鉴定出来。SAG21(At4g02380)是可诱导ros的拟南芥[38,39并可能在减轻活性氧对线粒体功能的影响中发挥作用。然而,这个基因也受到发育调控,并对其他压力做出反应。壁花同源物,WFSAG21在壁花微阵列上,在花瓣衰老过程中表达上调,而在叶片衰老过程中表达上调[3.]。
转录组学研究揭示了花瓣衰老过程中基因表达的全局变化。这些主要与分解代谢的活化和生物合成的下调有关[15,24]。然而,很少有研究检查了干扰PGR水平和对衰老相关基因表达的作用的治疗的影响。
“壁花”(Erysimum linifolium)为研究花瓣衰老提供了良好的模型系统,因为它们在分类学上有密切的关系拟南芥。这使得基因识别变得容易,但提供了一个更持久的花与一个更可预测的发展计划比拟南芥花(3.]。最近对壁花的转录组学研究提供了不同衰老过程的基因标记,可用于研究pgr对花瓣衰老进程的影响[3.]。本文介绍了壁花花瓣衰老过程中乙烯、细胞分裂素、生长素和活性氧之间的复杂关系。我们特别关注延缓衰老的不同方法,并表明延缓衰老的治疗也抑制ROS的上升。我们还发现,当衰老延迟时,与花瓣衰老相关的不同途径(包括蛋白质水解、乙烯、生长素和ROS反应)的基因受到不同的调控。
结果
壁花的衰老是乙烯调控的
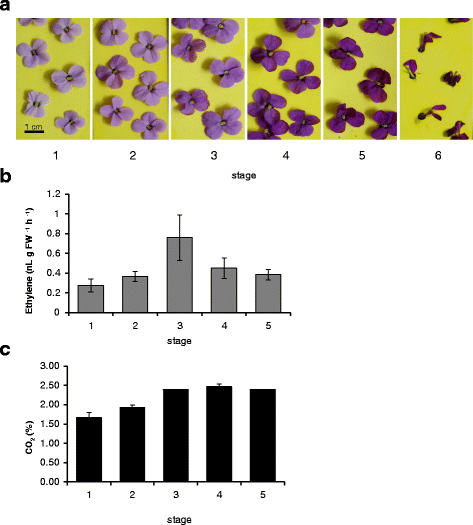
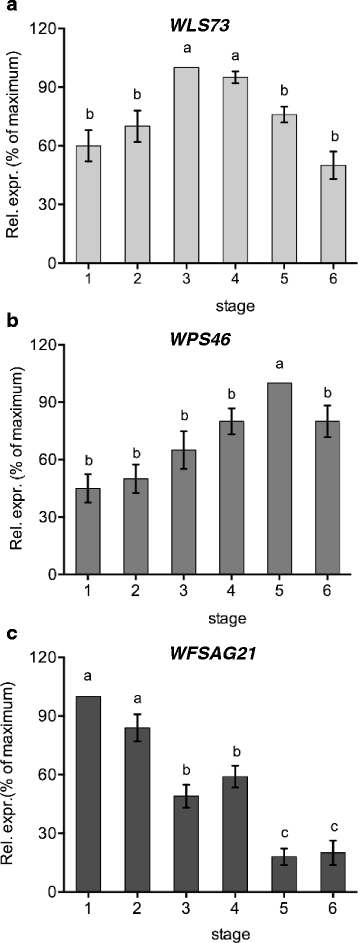
分析了壁花花瓣从第1阶段(第一次开放的花)到第5阶段花瓣明显变质的花的乙烯产量(图2)。1)。从最年轻的开放花中可以检测到乙烯,尽管产量很低(0.28 nL g FW)−1h−1;无花果。1 b)。乙烯产量在第3阶段达到峰值(0.76 nL g FW)−1h−1)。在整个花的排放中也看到了类似的模式1:图S1)。乙烯产量高峰与CO最大值一致2排放水平,此后保持不变(图2)。1 c)。转录水平WLS73(一种假定的ACC氧化酶)[40]在较年轻的花瓣中相对较低,但显著增加(P< 0.001),与年龄有关。2)在第3-4阶段达到高峰。这与乙烯生产的模式相似。
虽然用硫代硫酸银(STS)治疗将脱落时间推迟了2天(图2)。3)衰老的延迟在各个阶段是不一致的。在处理的前2天,衰老的进展速度与水中对照组相同。然而,在以与对照组相同的速度恢复衰老之前,他们在第三和第四阶段多呆了一天。根据花瓣颜色、花药发育和花瓣肿胀度和完整性的变化,阶段明显不同,直至花瓣脱落(图2)。1)。2-氯乙基膦酸(CEPA)产生的外源乙烯也会影响花的衰老。3 b)。这导致了比水控制提前一天半的脱落。
激动素治疗延缓衰老和脱落,但增加内源性乙烯生产
用外源激动素处理第1期花,或用细胞分裂素氧化酶抑制剂6-甲基嘌呤(6-MP)处理抑制内源细胞分裂素降解,导致花瓣脱落延迟两天。这是由于3-5阶段的延长造成的。3 c, d)。
为了确定激动素或6-MP是否对内源乙烯有直接影响,我们比较了在水中放置2天的花和用激动素或6-MP处理的花的乙烯积累水平。令人惊讶的是,在动素处理的花中,乙烯的积累超过3倍。3 e),尽管这种治疗延缓了衰老。相比之下,6-MP处理花的乙烯释放量与对照没有显著差异(图2)。3 f)。
在壁花衰老过程中,游离生长素水平上升,而共轭生长素水平下降
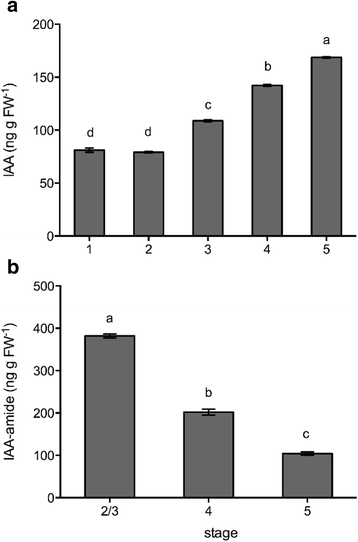
游离IAA在第2阶段后持续上升,直至第5阶段。4)。从第2/3期到第5期,IAA-amide在开放的花中不断下降。4 b)。壁花衰老期间未检测到iaa -酯含量的变化(数据未显示)。
转录丰度WPS46(一种生长素诱导基因)在花朵开放的前两个阶段保持低水平,仅显著上调(P< 0.001)。2 b)。这与内源性游离IAA水平的规律相同,但与IAA-酰胺水平的趋势相反。
活性氧水平和相关酶的活性随衰老而变化
用H . s测定,壁花花瓣中ROS的积累随年龄的增长而增加2O2浓度(图。5)。H2O2在第二阶段和第四阶段之间积累,之后趋于平稳。比较了第1阶段收获的切花在水、STS或6-MP中保存3天的ROS积累情况。6-MP或STS治疗可显著降低H2O2处理2-3天后的水平与水中对照组相比(图2)。5 b)。
利用酶谱分析抗坏血酸过氧化物酶(APX)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)同工酶活性,揭示了同工酶活性随花瓣年龄变化的复杂模式。5 c, d)。2个APX同工酶(70和55 kDa)在1-6期的花瓣中表达。这两种同工异构体的活性在阶段1和阶段2之间上升,然后保持相当稳定,直到阶段6上升。在不同的表达模式下,检测到三种SOD亚型(72,45和38 kDa)。这三种异构体在衰老花瓣中都有所下降,但45 kDa异构体的活性在第4阶段比其他两种异构体在第6阶段下降得更早。检测到两种CAT亚型(80和65 kDa)。80 kDal异构体的活性在第二阶段和第四阶段之间上升,然后在第六阶段再次下降。65 kDa亚型的活性一直很低。
细胞分裂素水平或乙烯信号的扰动对基因表达有不同的影响
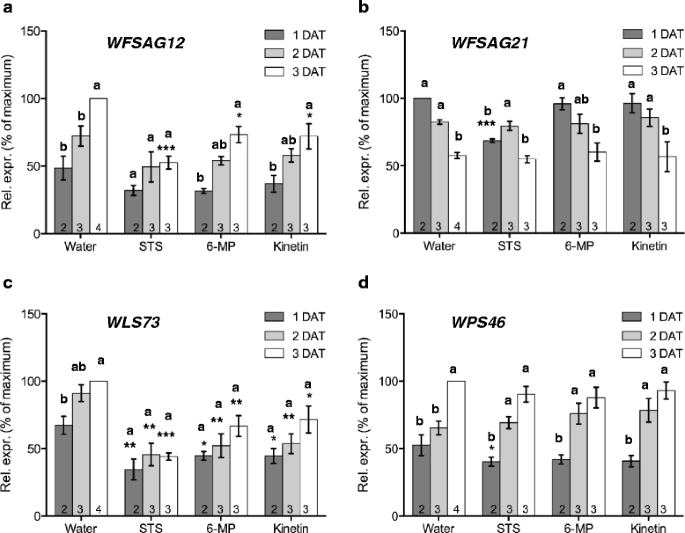
从壁花表达序列标签(ESTs)中筛选出4个基因[3.作为不同衰老相关途径的标志。WFSAG12是一种衰老特异性半胱氨酸蛋白酶[4,5因此,它可以作为衰老相关蛋白水解的标志。WFSAG21壁花是ROS反应基因的同源物吗拟南芥[38,39]。WLS73和WPS46分别作为乙烯和生长素的标记物。在3天的时间内(处理后- DAT 1-3天),在切花中,或在三种延迟衰老进程的不同处理(STS,激动素和6-MP)中,监测所有四种基因的表达。花在第1阶段收获,并在这段时间内在水中进行到第4阶段。当进行延缓衰老处理时,花在这段时间内只进展到第3阶段(图2)。6)。在水中,转录丰度WFSAG21在治疗开始后的1-3天内(DAT1至DAT3),转录本丰度显著下降WLS73,WPS46和WFSAG12显著增加。STS处理抑制了转录物丰度的增加WFSAG12DAT3。在化粪池污水处理的数据3上,WFSAG12表达明显减少(P< 0.001)。6)。转录丰度WFSAG21在DAT1 (P< 0.001),且在DAT2上不降反升(图2)。6 b)。转录丰度WLS73在所有阶段都受到STS处理的影响,并且其从DAT1到DAT3的表达上升被消除(图2)。6摄氏度)。相比之下,转录本丰度WPS46与每天的水控制相比,没有受到影响。然而,所有的处理都导致了DAT2的升高,这在对照组中没有看到(图2)。6 d)。
讨论
乙烯和细胞分裂素
壁花花和花瓣中乙烯产量的定量证实乙烯可能是花瓣衰老的重要调节剂。这可以从壁花与其他乙烯敏感物种的密切分类关系中得到预期拟南芥[41]。在壁花中,内源乙烯产量的高峰出现在第3阶段,这是可见花瓣衰老的开始。乙烯的峰值与CO的峰值一致2乙烯在壁花花瓣衰老过程中起着调控作用。乙烯的最大产量远低于其他对乙烯敏感的花卉,如康乃馨[8,42]。康乃馨的乙烯产量高出20-30倍以上。然而,壁花中所含的维生素d含量是英国《卫报》报道的3倍Alstroemeria[12],通常被认为对乙烯不敏感。此外,壁花的产量高峰发生在较早的发育阶段Alstroemeria在那里,只有在分离前才检测到乙烯。这与乙烯在调节壁花衰老进程中的作用是一致的,但只在壁花中脱落Alstroemeria[12]。但壁花对乙烯的敏感性不如石竹、天竺葵等对乙烯高度敏感的花卉。在壁花中,CEPA处理仅使花瓣衰老加快了一天半,而STS仅使花瓣衰老延缓了两天(如前面所示[3.])。在康乃馨和天竺葵中,乙烯引起立即和戏剧性的反应[6在一天内导致严重的萎蔫/脱落。
有趣的是,壁花花瓣表现出的乙烯产生模式也与其他乙烯敏感花略有不同[8]。壁花比其他乙烯敏感物种更早地检测到乙烯的产生,而且不限于晚衰老和脱落。这表明乙烯在壁花花瓣发育的早期阶段发挥了作用,可能是在第1阶段之前的花朵开放阶段。在此之前,乙烯被证明可以调节玫瑰的开花[35],这可能表明了激素在细胞壁松动和花瓣扩张过程中的作用。
如前所述,[3.当施用于第1期花时,STS延缓了壁花的衰老和脱落,而CEPA加速了壁花的衰老和脱落。这与一些对乙烯敏感的物种形成对比佩妮矮牵牛天竺葵[43,44在开花后第一天用乙烯处理对加速衰老没有效果。然而,效果较慢。在乙烯对矮牵牛花有效的阶段,在处理后24小时内可以看到对衰老进展速度的影响。然而,在壁花中,衰老的进展在治疗的前两天没有改变。这些观察结果支持了我们的观点,即壁花花瓣在早期阶段就有能力产生乙烯,这可能与花朵开放有关,而使用乙烯作为信号分子启动衰老的能力直到发育后期才发生。
如前所述[3.], 6-MP处理对壁花衰老的影响与使用激动素非常相似。这表明,抑制内源性细胞分裂素的降解与提供激素的外部来源具有相似的效果,康乃馨也证明了这一点[28]。三种细胞分裂素:玉米素、细胞分裂素和N6-苄基腺嘌呤也有类似的作用[27]。
在矮牵牛花中,外源乙烯通过o -糖基化和降解促进细胞分裂素失活[29]。相反,在香石竹中用动素处理似乎抑制了乙烯的生物合成和作用[26]。同样,增加内源性细胞分裂素水平通过表达ipt矮牵牛基因导致乙烯产量降低[j]。25]。因此,在细胞分裂素浓度延迟衰老进程的情况下,动素处理的壁花中乙烯积累的增加是出乎意料的。乙烯产量的增加仅见于康乃馨[26]含有非常高浓度的激动素(>15 μg ml)−1),这也减少了衰老的延迟。在壁花中,0.1 mM和1 mM的动素(22和222 μg ml)对衰老的延缓作用相同−1;数据未显示)。这表明壁花对外源激动素的敏感性低于康乃馨。它还表明,在这里报告的实验中使用的0.1 mM远低于该物种的毒性水平。然而,6-MP处理并没有增加壁花的乙烯产量。对这些结果的一种解释是外源性激动素处理使壁花对内源性乙烯水平不那么敏感,正如之前所表明的那样[26]。动素处理也可能使正常调节内源乙烯浓度与花发育阶段相关的机制失效。相反,用6-MP阻断细胞分裂素降解并不影响乙烯的产生。因此,我们可以得出结论,6-MP不会干扰乙烯生物合成-感知反馈机制。这种不同的影响可能是由于对内源性细胞分裂素池平衡的不同影响,尽管这种影响也可能是间接的。
生长素的作用
高生长素浓度与非脱落的脱落抑制有关百合longiflorum[18]。在百合属植物游离生长素和共轭生长素均在衰老后期持续增加。考虑到壁花的花瓣脱落,尽管游离IAA在花瓣衰老后期较高,但在衰老过程中共轭生长素下降了3倍,总生长素库下降了1.7倍。这表明,共轭生长素水平或总生长素库可能是引发脱落的关键因素。然而,外源生长素的作用因物种而异。在黄花菜里(萱草属植物),外源性生长素延缓衰老[45],而在康乃馨中,外源生长素(IAA 5-50 μM)处理加速衰老[9]。13 nM ~ 52 μM 1-萘乙酸(NAA)处理对壁花无加速衰老作用。然而,浓度超过13 μM会导致花瓣白化,提示有毒性作用(附加文件)1:图S2)。因此,生长素似乎不太可能是壁花衰老的早期调节器。这与内源性生长素水平的增加只发生在花期后是一致的。转录物丰度的变化WPS46反映了花期后游离生长素的增加。这与。的表达模式一致DFL1[23和水稻同源物GH3-8[46],它们是生长素诱导的,以及番茄的同源物GH3其表达随IAA水平下降[21]。这是可以预料到的WPS46由于水稻植株过表达IAA,因此IAA的表达水平与IAA共轭水平一致GH3与WT相比,同系物具有更高的共轭IAA水平[46]。然而,DFL1基因在生长素信号转导中的作用及其表达拟南芥被生长素上调。因此,它在壁花衰老中的表达与其响应游离生长素水平变化的作用是一致的。相反,生长素偶联的水平是由偶联酶调控的,如由WPS46同时也被生物合成酶所影响,因此与WPS46不期望表达。
活性氧
壁花发育和衰老过程中活性氧的变化模式与花瓣衰老过程中活性氧的急剧增加是一致的(第3-5阶段)。乙烯和ROS水平都在3-5阶段(早期衰老)达到峰值,这使得很难确定它们是否相互调节。因此,我们测试了通过干扰乙烯或细胞分裂素信号传导来抑制衰老是否会影响ROS水平。通过抑制乙烯信号传导(STS)或细胞分裂素还原(6-MP)延缓衰老对ROS水平的影响表明,ROS位于pgr的下游。然而,这种影响可能是直接的或间接的,通过延缓衰老。
虽然WFSAG21被选为潜在的ROS应答基因,结果表明其表达模式可能响应乙烯或ROS。跌入的时机WFSAG21这是自油价下跌以来对乙烯的反应WFSAG21第5阶段的表达发生在第4阶段乙烯产量下降后不久,而ROS水平仅在第6阶段晚一些时候下降。对这两种刺激的反应发生在拟南芥,但有人建议SAG21主要对活性氧作出反应[39]。这里的结果表明,至少在壁花中,乙烯反应是由WFSAG21不仅仅是ROS介导的。
部分SOD和CAT同工酶活性模式的变化与ROS水平的变化一致。80 kDa CAT同工酶活性明显上调,45 kDa SOD同工酶活性下调,与第3期和第4期ROS升高相一致。APX活性仅在衰老后期上升,尽管从酶图上也可以看到第1和第2阶段之间的上调。45 kDa的SOD异构体在第1和第2阶段的活性也有所增加。与叶子相比,CAT水平非常低(数据未显示)。这表明,与APX和SOD相比,CAT在壁花花瓣衰老过程中清除ROS的作用可能不那么重要。壁花中一些ros相关同种异构体的活性模式与康乃馨相似。在康乃馨中,SOD和APX活性在早开花时达到峰值,这与ROS的升高相一致,而CAT水平一直保持不变,直到衰老后期[47]。很少有研究调查活性氧相关酶的不同同工型的活性变化。然而Chakrabarty等人。[34研究表明,菊头中SOD和APX同种异构体的活性增加,并伴随着整个研究阶段ROS的稳定增加。请注意,菊花的花头是由许多不同发育阶段的小花组成的,尽管衰老小花的比例会随着年龄的增长而增加。这可能解释了菊花中活性氧缺乏明显的峰值或同工酶活性随年龄的离散变化。
延缓衰老对转录物丰度的影响
虽然用STS抑制乙烯信号,用6-MP抑制细胞分裂素分解或持续供应外源细胞分裂素对衰老的影响相似,但对标记基因转录丰度的影响并不相同。增加WFSAG12随着时间的推移,转录丰度仅被STS处理抑制。WFSAG12在6-MP和激动素处理的花中,转录本丰度继续上升,尽管这两种处理延迟了衰老进程,但转录本丰度的上升速度有所降低。这表明,至少在壁花中,在SAG12转录物丰度可能不像以前认为的那样与花瓣中视觉衰老迹象的进展紧密相关。转录丰度WFSAG21在第1天,STS处理的花明显低于对照。在拟南芥根SAG21乙烯和ROS都能诱导表达[39]。的增加SAG21STS处理引发的转录丰度进一步增加了乙烯对植物生长的直接影响WFSAG21表达式。
WLS73在所有三个时间点,所有三种抗衰老处理都降低了转录物丰度。这表明衰老进程与该基因的转录丰度之间存在良好的相关性。尽管WLS73在正常壁花发育和衰老过程中,乙烯的表达遵循上升和下降的规律,而动素处理引起的内源乙烯释放量的增加并不伴随着乙烯释放量的增加WLS73转录丰度。这表明该基因的表达并不仅仅受乙烯的调控。这也表明其他ACO家族成员可能被激动素处理诱导介导乙烯产生的增加。在番茄中有3个ACO基因,它们在花中的时空表达不同,在叶片中的诱导作用也不同[48]。
对转录本丰度无显著影响WPS46通过延缓衰老的治疗,进一步支持缺乏内源性生长素水平参与早期衰老的调节。由于该基因作为生长素反应的标记,它也强烈表明乙烯和细胞分裂素处理都不会影响内源性生长素水平。
结论
总的来说,这些结果可以总结为一个不依赖授粉的乙烯敏感花衰老的初步模型。7)。随着花的老化,内源性细胞分裂素下降,乙烯产量上升。细胞分裂素的下降可以通过6-MP治疗或外源性细胞分裂素的供应来逆转。供应外源性细胞分裂素刺激乙烯的生物合成,然而,这似乎是不转导。用6-MP抑制细胞分裂素去除对衰老的影响与细胞分裂素替代相似,但不改变乙烯的生物合成。乙烯感知的增加和细胞分裂素的减少共同触发了衰老的开始,这两种pgr直接或间接地导致ROS水平的增加。一旦衰老开始,结合生长素和/或总生长素池的下降最终引发脱落。
方法
植物材料
“壁花”,Erysimum linifolium简历。Bowles Mauve从英国卡迪夫当地的一个花园中心获得,在卡迪夫大学植物和研究花园(英国卡迪夫)的室外或温室中种植,温度设置为至少14°C。湿度和光周期不受控制。收集花瓣,并根据[3.(也见图的附图。1)从第一阶段到第六阶段。对于离花处理,花总是在第1阶段(第一次开放的花)与植株分离。提取蛋白质或RNA的材料立即冷冻在液氮中,保存在- 80°C,直到需要。
分离花处理
单花在第1阶段(第一次开放的花,通常比下面的花颜色浅)从总状花序上分离,花梗立即被淹没在蒸馏水中。花在20°C, 16 h光照,80 μmol m的条件下连续保存−2年代−1在蒸馏水中,或在kinetin (0.1 mM), 6-甲基嘌呤(0.1 mM), NAA (13 nM至52 μM)或125 ppm 2-氯乙基膦酸(CEPA)的溶液中;所有化学品来自SIGMA-ALDRICH, Dorset, UK)。乙烯抑制剂处理,花在4 mM AgNO的STS中保存3., 32mm NaS2O3.) 1小时,然后转移到水中。浓度的选择是根据其他切花品种的已发表研究中使用的浓度[12,26,28,29]以及之前测试过的浓度范围的结果。选择浓度为125 mM的CEPA,是因为50 mM对花的寿命没有影响,而250 mM和500 mM都能从第1阶段迅速发展到第4阶段,表明有毒性作用(附加文件)1:图S3)。NAA浓度范围基于Shimizu-Yumoto和Ichimura (2010) [49[5 μM NAA]Eustoma花。在所有其他处理中,所选择的浓度是每种化学物质在不损害花瓣的情况下影响花瓣衰老进程的最低浓度(数据没有显示,因为没有影响)。每个试验包括至少10个重复花,每天监测衰老阶段和花瓣脱落日期。
内源性吲哚-3-乙酸含量分析
吲哚乙酸(IAA)定量方法参照Mariotti等。[50]。每个阶段使用约500毫克花瓣,并在70% (v/v)丙酮(1:5 w/v)中均质。匀浆,50ng [13C6加入IAA (Olchemim Ltd)作为内标,在4℃下搅拌4小时。回收上清液并在4°C保存,同时再次提取颗粒两次。将上清液还原为水相,调整至pH 2.8,对等体积的乙醚进行三次分割。然后蒸发乙醚,将干燥后的样品溶解在含有0.1% (v/v)乙酸的10% (v/v)的小体积乙腈水溶液中,用高效液相色谱法纯化。
乙醚分割后的水相与提取的颗粒混合,加入100 ng[]在1 N NaOH中水解。13C6IAA作为内部标准。在27℃下继续水解1 h [51在一个有盖子的小瓶中不断地用氦气净化。为了防止其他吲哚类化合物在水解条件下转化为IAA,在气体管道中插入一个气体净化器(Supelco, Bellefonte, PA)以捕获任何残留的O2[52]。水解后,提取液在4℃下13000 g离心30 min。将上清液酸化至pH = 2.8,并按上述方法对乙醚进行分区。剩余水相与离心球团混合,在7 N NaOH中于100°C水解3 h [52],在加入100毫微克[13C6IAA作为内部标准。在水解结束时,样品按上述方法进行处理。
采用反相高效液相色谱法纯化IAA样品。探测器工作波长为280 nm。C18 Hypersil色谱柱(Thermo) 150 × 4.6 mm,粒径为5 μm,洗脱流速为1 mL min−1是使用。样品上柱,收集含IAA的馏分,用乙腈水溶液和0.01%乙酸线性梯度洗脱,从10%到50%洗脱15 min,再从50%到100%洗脱10 min。真空干燥馏分,用含1%三甲基氯硅烷(Sigma)的二(三甲基硅基)三氟乙酰胺在70℃下进行1 h的硅化。
气相色谱-质谱(GC-MS)分析在一台土星2200四极离子阱质谱仪与一台CP-3800气相色谱仪(Varian, Palo Alto, CA)上进行,配备一个MEGA 1毛细管柱(MEGA, Legnano,意大利)25 m × 0.25 mm ID × 0.25 mm膜厚,涂有100%二甲基聚硅氧烷。对于IAA分析,烘箱温度为120°C,持续2分钟,然后在35°C min下从120°C梯度到190°C−1,然后从190°C至210°C,最小温度6°C−1最后从210°C到300°C,温度为35°C min−1最后保持10分钟。以下离子用于IAA分析:IAA监测m\z 202和319,IAA监测208和32513c标内标。IAA的定量参照了一系列标准激素与其标记形式的混合物的气相色谱-质谱分析得到的校准图。
乙烯和CO的分析2发射
为了测量花发育不同阶段的乙烯排放,将9支花密封在5毫升的收集管中,收集乙烯3小时。乙烯从管的顶空测量,使用Hewlett Packard 5890系列2气相色谱仪(Hewlett Packard, Berks, UK),内置积分器,并配备火焰电离检测器,设置在150°C。30米GS-Q柱,内径0.53米,氦气载气流速15 ml min−1。色谱柱和进样器温度均设置为60℃。样品进样量为100 μl,定量量为1 μl−1乙烯样品作为标准。分析了管内顶空的CO含量2使用Abiss Print气体分析仪,型号S/N ABP12WP (EMCO包装系统,肯特,英国)。这台机器的分辨率为0.1%。进行了3次重复。
从48个花瓣中分离并密封到一个10毫升的收集管中,测量花瓣阶段的乙烯排放。乙烯收集12 h,在Agilent 6890 N网络气相色谱仪(Agilent Technologies)上进行测量,该色谱仪配备火焰电离检测器,设置在150°C, 30 m GS-Q柱,内径为0.32 mm,氦气载气流速为15 ml min−1。柱和进样器温度均设置为60°C。使用纯乙烯确定保留时间,并使用标准气体混合物(C1-C4碳氢化合物,Supelco, 2-3470)校准定量。进行了4次独立重复。
为了测量处理后的乙烯释放,在第1阶段将花分离并处理2 d,然后将三朵花密封在5ml收集管中,收集乙烯20小时。在Clarus 500上测量乙烯的顶空浓度,改良型2101分析仪(PerkinElmer, MA, USA),使用纯乙烯确认保留时间,并使用标准气体混合物(Scott Specialty gas, mixture54)校准定量。动素组进行5次独立重复,6-MP组进行3次独立重复。
活性氧分析
H2O2使用Amplex-Red过氧化氢/过氧化物酶测定试剂盒(Molecular probes, Eugene, USA)测定花瓣中的含量。花瓣在液氮和200 μL磷酸盐缓冲液(20 mM K)中研磨2HPO4取50 μL上清液,与100 μM Amplex Red试剂(10-乙酰-3,7-二氢苯恶嗪)和0.2单位/mL辣根过氧化物酶在RT下孵卵,黑暗条件下孵卵30 min。荧光定量使用BIO-TEK FL600荧光仪(BIO-TEK®)(激发波长650 nm,发射波长590 nm)。最终单位以pmol mg表示−1蛋白质。
酶分析
花瓣在200 μl萃取缓冲液(100 mM Tris-HCl pH 8.0, 20%甘油和30 mM二硫苏糖醇(DTT))中,4℃液氮均质。APX活性分析,样品在200 μl萃取缓冲液100 mM(磷酸钾缓冲液,pH 7.0,含5 mM抗坏血酸和1 mM EDTA)中用液氮研磨,温度4°C。匀浆后的样品在4°C下,14000 g离心30分钟,所得上清直接用于酶谱分析,每车道载蛋白量为10 μg, CAT酶谱分析为15 μg, APX酶谱分析为20 μg。CAT和APX酶谱按照Zimmermann等的方法进行。[53]根据Orendi等进行SOD酶谱分析。[32]。酶谱上的波段强度采用ImageJ软件v. 1.47进行量化。
RNA提取和逆转录pcr
使用RNAqueous®Kit (Ambion, Inc.)从壁花花瓣中分离总RNA。DNase处理使用RNAqueous®Kit (Ambion, Inc.)进行,如制造商所述。利用MMLV逆转录酶(Promega)合成cDNA。对于半定量RT-PCR,采用cDNA模板稀释(100、50、25%)验证最佳循环数,并检查模板浓度与该循环数下产物丰度之间的线性响应,并使用特定引物。在每个实验中,每组PCR反应都包含一个模板稀释系列,以验证在最佳循环数下扩增的线性。最终值以最大值的百分比表示,在特定引物对的每组反应中,最高转录物丰度的值为100%。至少三个可重复的生物重复被考虑用于最终的转录物丰度定量。在附加文件中详细介绍了引物1表S1。结合18S rRNA并扩增488 bp片段的PUV引物用于标准化,如[3.],结果以与18S rRNA信号的比值表示。
伦理批准并同意参与
不适用。
发表同意书
不适用。
数据和材料的可用性
本文中用于设计PCR引物的序列可在GenBank/EMBL数据库中找到,登录号为:WFSAG21: AM747887;WLS73: AM747819和WPS46: AM747914。所有其他支持数据都作为附加文件包含。
缩写
- 6 -巯基嘌呤:
-
6-methyl嘌呤
- ACC:
-
1-Aminocyclopropane-1-carboxylic酸
- APX型:
-
抗坏血酸盐过氧化物酶
- 猫:
-
过氧化氢酶
- CEPA:
-
2-chloroethylphosphonic酸
- 气相:
-
气相色谱-质谱法
- 乙酰天冬氨酸:
-
1-naphthaleneacetic酸
- SOD:
-
超氧化物歧化酶
- STS:
-
硫代硫酸钠
参考文献
罗杰斯HJ。花器官的程序性细胞死亡:花是如何以及为什么死亡的?安。博。2006;97:309-15。
罗杰斯HJ。从模型植物到观赏植物:花的衰老是如何调控的?植物学报,2013;32(2):563 - 564。
Price AM, Aros Orellana DF, Stevens R, Acock R, Buchanan-Wollaston V, Stead AD, Rogers HJ。壁花叶片和花瓣衰老的比较(Erysimum linifolium)揭示了基因表达和生理的共同和独特的模式。植物生理学报。2008;47(1):398 - 398。
Macnish AJ, Jiang CZ, negrei - zakharov F, Reid MS.开放和衰老过程中生理分子的变化烟草mutabilis花。植物科学,2010;39(1):67 - 72。
韦弗LM,甘S, Quirino B, Amasino RM。几种衰老相关基因在应激和激素处理下表达模式的比较。植物化学学报。1998;37(4):455 - 459。
Woltering EJ, van Doorn WG。乙烯在花瓣衰老中的作用及其形态学和分类学关系。[J]中国生物医学工程学报,1998;39(3):1605 - 1609。
花衰老过程中乙烯的产生。[J]中国生物医学工程学报(英文版);2009;31(1):389 - 398。
10 . Have A, Woltering EJ。乙烯生物合成基因在康乃馨(石竹)花的衰老。植物化学学报。1997;34(4):893 - 893。
吴志强,王志强,王志强。在分离的康乃馨花瓣衰老。植物生理学报。2002;19(3):391 - 391。
范士丹。激素对康乃馨花衰老的调控作用。植物学报。1995;405:232-9。
葛培理,陈志强,陈志强。乙烯与衰老过程的关系。植物学报,2012;44(4):305 - 41。
刘建军,刘建军,刘建军,刘建军,刘建军。乙烯和花的寿命在Alstroemeria花被片衰老、脱落与乙烯生物合成的关系。[J] .中国生物医学工程学报,2005;16(6):597 - 596。
Savin KW, Baudinette SC, Graham MW, Michael MZ, Nugent GD, Lu CY, Chandler SF, Cornish CE。反义ACC氧化酶RNA延缓康乃馨花瓣衰老。植物科学。1995;30:970-2。
李建军,李建军,李建军,等。番茄花中乙烯合成对传粉的响应。植物生理学。2000;123:971-8。
杨忠杰,杨忠杰,杨忠杰,杨忠杰。衰老的分子和结构表征拟南芥衰老花瓣和叶片的转录谱比较。植物学报,2009;37(5):690 - 695。
琼斯ML,伍德森WR。香石竹1-氨基环丙烷-1-羧酸合成酶基因家族3个成员的差异表达。植物生理学报。1999;19:755 - 64。
[3]陈建军,陈建军,陈建军,等百合属植物。足底。2012;236:343-54。
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。生长素参与花被片衰老和脱落百合属植物两个百合花的故事。[J] .中国生物医学工程学报,2015;33(1):445 - 456。
Hoeberichts FA, van Doorn WG, Vorst O, Hall RD, van Wordragen MF。蔗糖可防止康乃馨花瓣中衰老相关基因的上调。[J] .中国生物医学工程学报,2007;28(1):481 - 481。
Buchanan-Wollaston V, Page T, Harrison E, Breeze E, Lim PO, Nam HG, Lin FJ, Wu SH, Swidzinski J, Ishizaki K, Leaver CL。比较转录组分析显示,发育性衰老和黑暗/饥饿诱导的衰老在基因表达和信号通路上存在显著差异拟南芥。植物学报,2005;42(2):567 - 585。
Mignolli F, Mariotti L, Lombardi L, Vidoz ML, Ceccarelli N, Picciarelli P.番茄生长素抗性的果实发育分析我国突变体是由授粉引起的,而不是由生长素引起的。植物生理学报,2012;39(1):1 - 4。
引用本文:白淑娟,王晓明,王晓明,王晓明,王晓明。花被授粉诱导矮牵牛花冠衰老的蛋白质组学分析。[J] .生物医学工程学报,2010;31(1):389 - 391。
中泽M, Yabe N,市川T,山本YY,吉泉T, Hasunuma K,松井M。DFL1这是一种生长素反应GH3基因同源,负调控芽细胞伸长和侧根形成,正调控下胚轴长度的光响应。植物学报,2001;25(4):591 - 591。
van Doorn WG, Woltering EJ。花瓣衰老的生理学和分子生物学。[J] .中国生物医学工程学报,2008;29(1):453 - 458。
张宏,Jones ML, Banowetz GM, Clark DG。矮牵牛花中细胞分裂素的过量产生PSAG12-IPT延缓花冠衰老,降低对乙烯的敏感性。植物生理学报。2003;32(2):574 - 583。
细胞分裂素在康乃馨花衰老中的作用。植物生理学报。1977;59:707-9。
more Y, Spiegelstein H, Halevy AH。细胞分裂素对康乃馨花瓣乙烯合成的抑制作用。植物生理学报。1983;71:541-6。
王娟,李建平,王军,等。生长抑制剂和细胞分裂素对康乃馨花瓣发育的抑制作用。[J] .植物生理学报,2000;27:357 - 362。
Taverner EA, Letham DS, Wang J, Cornish E, Willcocks DA。乙烯对矮牵牛花冠衰老过程中细胞分裂素代谢的影响。植物化学。1999;51:341-7。
王晓明,王晓明,王晓明,等。植物过氧化氢酶的研究进展拟南芥作为压力模拟模型的突变体。[J] .生物医学工程学报,2010;31(1):493 - 498。
Panavas T, Rubinstein B.黄花菜细胞程序性死亡的氧化事件(萱草属植物混合动力)的花瓣。植物科学。1998;133:125-38。
王建军,张建军,张建军,等。应力诱导下基因表达的研究进展catalase3在叶片衰老期间拟南芥只限于氧化应激。植物科学。2001;31(1):31 - 31。
罗杰斯HJ。活性氧和氧化还原调控在花卉衰老过程中是否有重要作用?植物生态学报,2012;35(5):557 - 557。
李建军,李建军,李建军,等。氧化胁迫和抗氧化活性对菊花衰老的影响。植物学报,2007;53(3):107 - 15。
薛静,李艳,谭华,杨芳,马楠,高娟。乙烯增强玫瑰花开放过程中乙烯生物合成及受体基因的表达。[J] .中国生物医学工程学报,2008;29(1):391 - 391。
石川,石川,柴田,等。郁金香花瓣衰老过程中细胞内能量消耗引发的程序性细胞死亡。[J] .中国生物医学工程学报,2008;29(1):391 - 391。
[m] m . m . m . m . m . m . m . m . m . m . m . m . m . m百合属植物以及它在自然和人工衰老过程中的变化。植物科学,2010;39(3):389 - 391。
莫拉,陈建军,陈建军,陈建军,陈建军。酵母补体对水稻生长发育的影响拟南芥胚胎发生晚期丰富(LEA)样蛋白参与氧化应激耐受。植物学报。2006;28(4):444 - 444。
Mohd Salleh F, Evans K, Goodall B, Machin H, Mowla SB, Mur LAJ, rununj, theoooulou FL, Foyer CH, Rogers HJ。氧化还原相关LEA蛋白(SAG21/AtLEA5)在根发育和生物胁迫响应中的新功能。植物生态学报,2011;35(5):418 - 429。
Covington MF, Maloof JN, Straume M, Kay SA, Harme SL.全球转录组分析揭示植物生长发育关键途径的昼夜调节。中国生物医学工程学报,2008;9(8):693。
PF Stevens,被子植物系统发育网站,12版,2012年7月。http://www.mobot.org/MOBOT/research/APweb/。
Shibuya K, Yoshioka T, Hashiba T, Satoh S.雌蕊在康乃馨自然衰老中的作用(石竹类植物caryophyllusl .)花。[J] .中国生物医学工程学报,2009;22(1):391 - 391。
Whitehead CS, Halevy AH。乙烯敏感性:短链饱和脂肪酸在传粉诱导衰老中的作用佩妮矮牵牛花。[J] .植物生理学报,2009;8(1):481 - 481。
李建军,李建军,李建军,等。植物花瓣脱落规律的研究天竺葵。植物科学,1990;25:937-40。
Rubinstein B.花瓣细胞死亡的调控。植物化学学报,2000;44(4):393 - 398。
丁鑫,曹勇,黄磊,赵军,徐超,李鑫,王松。激活水稻吲哚-3-乙酸-氨基合成酶GH3-8抑制扩张素表达,促进水杨酸和茉莉酸非依赖性基础免疫。植物学报。2008;20(2):228 - 40。
张艳,郭伟,陈森,韩玲,李忠。n -月桂醇胺在康乃馨切花衰老中的调控作用(石竹类植物caryophyllus)。植物生理学报,2007;24(4):993 - 998。
张建军,刘建军,刘建军,等。番茄1-氨基环丙烷-1-羧酸氧化酶基因家族的克隆与表达。植物学报[j]; 1996;9:525 - 535。
Shimizu-Yumoto H, Ichimura K. 1-萘乙酸和氨基乙氧基乙烯基甘氨酸联合脉冲处理可显著提高采收后寿命Eustoma花。生物工程学报,2010;56(6):1094 - 1097。
Mariotti L, Picciarelli P, Lombardi L, Ceccarelli N.番茄坐果和早期生长与IAA、细胞分裂素和生物活性赤霉素的增加有关。植物生理学报,2011;30(5):591 - 591。
杨建军,张建军,张建军,等。植物种子生长素前体吲哚-3-乙酸肌醇酯的研究玉米[j] .植物生理学报。1980;65:422 - 422。
Bialek K, Cohen JD。直接组织水解法测定大豆种子中吲哚乙酸偶联物的含量。植物生理学报。1989;19(3):398 - 394。
张建军,张建军,张建军,等。植物过氧化氢酶的研究进展拟南芥(l)Heynh。植物学报。2006;29:1049-60。
致谢
FMS感谢马来西亚政府和比萨大学的资助,AMP感谢BBSRC为她的博士学位提供的资助,作者要感谢卡迪夫大学的林登·塔克(Lyndon Tuck)的植物生长,汤晓红(Xiaohong Tang)对乙烯气体测量的帮助。
资金
报告的工作由马来西亚政府、比萨大学和生物技术与生物科学研究理事会(BBSRC)资助,批准号:00 / B1 / G / 06478。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
FMS分析了处理对花寿命、基因表达、活性氧酶活性凝胶和IAA含量的影响;LM监督并协助分析IAA的含量;NDS分析了花瓣中的乙烯浓度;AMS分离标记基因;PP和LL监督在比萨大学进行的工作,并协助分析内源性IAA水平;CW协助分析花中的乙烯;HJR在卡迪夫监督了工作,对处理过的花进行了乙烯测量,并分析了生长素的作用。所有作者都阅读并认可了稿件的最终版本。
额外的文件
附加文件1:表S1。
用于RT-PCR的引物图S1。四个发育阶段的全离体花产生乙烯:壁花衰老阶段;阶段1 -完全开放的苍白花;4/6花药突出;第三阶段:花瓣握得更松,开始枯萎,颜色更深;第四阶段:花瓣柔软卷曲,颜色较深,凋谢明显;第五阶段:花瓣明显退化;图S2。不同NAA浓度对离体花花瓣衰老进程的影响。花在第1阶段分离,连续处理4天。图S3。不同浓度的CEPA对离体花花瓣衰老进程的影响。(PPTX 356kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有说明。
关于本文
引用本文
Salleh, f.m., Mariotti, L., Spadafora, n.det al。植物生长调节剂与活性氧的相互作用调控壁花花瓣衰老(Erysimum linifolium)。BMC Plant Biol16,77(2016)。https://doi.org/10.1186/s12870-016-0766-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-016-0766-8
关键字
- 生长素
- 细胞分裂素
- 乙烯
- 植物的衰老
- 活性氧
- 转录丰度
- “壁花”