摘要
背景
沉香,是一种树脂的部分派生中华秋葵,已广泛用于传统医药和熏香。2-(2-苯基乙基)色酮是影响沉香品质的主要成分。然而,2-(2-苯基乙基)色素的生物合成和调控的分子基础仍然是未知的。我们的研究表明,盐胁迫诱导了几种2-(2-苯基乙基)色酮的产生答:中国愈伤组织。转录组分析答:中国NaCl处理的愈伤组织进一步促进了响应盐胁迫的多条信号通路,并了解了2-(2-苯基乙基)色素的生物合成机制。
结果
经nacl处理后,共鉴定出41个2-(2-苯基乙基)色酮答:中国愈伤组织。对对照和盐处理愈伤组织进行组装后测序,共获得93 041条平均长度为1562 nt的unigenes,并与NR、Swiss-Prot、KEGG、COG和GO等公共数据库进行了注释。通过对照和24 h和120 h盐胁迫诱导的愈伤组织的转录组比较,共鉴定出18 069个差异转录本。参与信号转导途径的大量基因,包括激素信号转导、类受体激酶、MAPK级联、Ca2+在信号转导和转录因子方面,对照愈伤组织与nacl处理愈伤组织有明显的差异。此外,我们的数据表明,被注释为查尔酮合酶和O甲基转移酶可能有助于2-(2-苯基乙基)色素的生物合成。
结论
盐分胁迫可诱导大豆产生41个2-(2-苯乙基)色酮答:中国愈伤组织。我们进行了第一个深度测序的转录组分析答:中国在盐胁迫下观察到大量的差异表达基因响应盐胁迫。此外,盐胁迫诱导了参与信号转导的新型应答基因的转录本丰度的动态变化,包括激素信号转导、受体样激酶、MAPK级联、Ca2+信号转导和转录因子。这项研究将有助于选择基因调控的靶基因答:中国盐胁迫信号转导及盐胁迫下2-(2-苯乙基)色素的生物合成。
背景
中华秋葵是一种热带常绿乔木,广泛分布于中国福建、广东、广西和海南等省,以及越南、印度、印度尼西亚、马来西亚和泰国等国家[1].在真菌感染或被风、闪电、昆虫咬伤等胁迫条件下,树脂浸渍的心材在树干和树枝中慢慢形成答:中国[2- - - - - -4].那些树脂的心材是商业上称为琼脂,这些是长期用作传统药物中的抗催吐剂,消化和镇静剂,也是香精和奇特的香水[1].然而,琼脂木的生产通常需要几十年的自然过程,而且Aquilaria.沉香木价值高,需求量大,各国森林遭到严重破坏。因此,答:中国已列入《濒危野生动植物种国内贸易公约》附录II [5].在这种情况下,Aquilaria.种植树木以生产具有重要医药价值和商业价值的沉香,使用人工方法,如燃烧凿子钻、树干修剪和真菌接种[3.].但人工生产沉香的时间较长,产品质量较差。
以往的研究表明,2-(2-phenylethyl)色酮是银葛的主要成分[6- - - - - -9].报道了2-(2-苯基乙基)铬的100多种同质化合物[10.,许多2-(2-苯乙基)色素具有潜在的药理活性,包括神经保护活性、细胞毒性活性、抗菌活性、疼痛抑制,抗炎活性和抗氧化活性[7,11.- - - - - -14.].然而,2-(2-苯基乙基)色素的生物合成和调控仍然是完全未知的。
沉香木生产植物是一种木材,需要相当长的时间来生长,树脂部分形成在木材内部。这使得使用新鲜植物的研究变得困难和不便。建立愈伤组织和悬浮培养细胞答:中国沉香的主要成分2-(2-苯基乙基)色酮的高产无疑将有助于沉香形成机理的研究[15.,16.].有报道称,水杨酸和真菌粗提物可诱导愈伤组织和悬浮细胞产生2-(2-phenylethyl)色素答:中国[15.,16.].近年来,沉香的形成机制一直是研究的重点,因此,建立有效的方法来诱导愈伤组织和悬浮细胞产生2-(2-phenylethyl)色酮是非常重要的。令人惊讶的是,我们首先发现盐胁迫诱导了2-(2-苯基乙基)色素的产生答:中国愈伤组织和悬浮细胞,提示2-(2phenylethyl)色素可能与盐胁迫反应有关。对盐处理愈伤组织和悬浮细胞产生的2-(2-phenylethyl)染色素进行鉴定,有助于进一步研究2-(2-phenylethyl)染色素在胁迫反应中的生物学功能和沉香的形成机制。
另一方面,植物整合了复杂的信号通路,这些信号通路在应对盐胁迫时可能会相互干扰并在不同的步骤上发生分歧[17.].高盐胁迫诱导激素的生物合成,以调节特定基因和代谢产物的表达,包括最重要的应激反应激素脱落酸(ABA) [18.].盐胁迫引起水分亏缺和渗透胁迫,增加了茎和根中ABA的产生[19.,20.].ABA的积累可以缓解盐胁迫对光合作用和生长的抑制作用[21.].其他一些植物激素,如水杨酸(SA)和油菜素内酯(BR),也参与植物对非生物胁迫的反应[22.,23.].相声中Ca2+最近据报道了信号传导途径和丝裂剂活化的蛋白激酶(MAPK)级联[24.- - - - - -26.]此外,用于信号转导的新型转录因子家族成员由盐胁迫诱导,包括bZIP、WRKY、AP2/ERF和NAC家族,它们促进各种基因的表达水平,最终影响植物对盐胁迫的耐受性[27.- - - - - -31.].前期研究表明,在盐胁迫下,bZIP基因的转录表达在盐敏感小麦品种中富集,而在耐盐小麦品种中则降低[28.].在拟南芥,盐胁迫诱导了At WRKY8的表达,它直接与启动子结合RD29A[29.].水稻Ap2/ERF家族成员在盐胁迫响应中发挥重要作用[30.].水稻和小麦中NAC转录因子家族成员的过度表达赋予耐盐性[31.].虽然传统的正向和遗传方法可以为盐胁迫反应提供有价值的见解,但技术限制可能阻止进一步的研究。全基因组转录组分析极大地提高了盐胁迫相关基因发现的效率[26.,32.].在拟南芥,通过转录组分析,发现超过20%的转录组在盐胁迫下进行调控[32.].然而,对于响应盐胁迫的特定信号事件所对应的特定基因类型,迄今尚未形成系统的共识。鉴定和表征盐胁迫响应信号通路的关键因子,对进一步了解盐胁迫响应机制和特异性次生代谢产物的生物合成具有重要意义。
结果表明,NaCl是诱导2-(2-苯基乙基)色酮生成的理想激发子答:中国愈伤组织。采用LC-MS-IT-TOF法,从nacl处理的样品中鉴定出41个苯乙基色酮答:中国愈伤组织。为了阐明盐胁迫反应的可能机制答:中国,利用Illumina测序技术进行转录组测序,并对数据进行分析,确定盐调节基因的差异和特异性表达的转录本。同时,对盐胁迫信号转导相关的新盐应答基因进行了描述。研究结果为进一步研究盐胁迫信号转导和沉香形成机制提供了理论依据。
结果与讨论
盐胁迫诱导2-(2-苯基乙基)铬素的产生A.sinensis愈伤组织
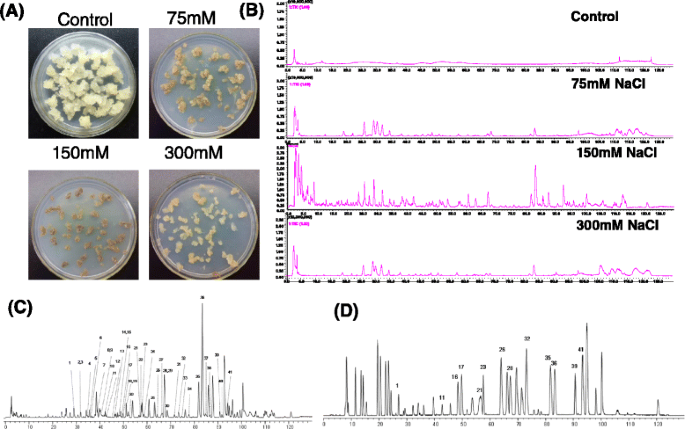
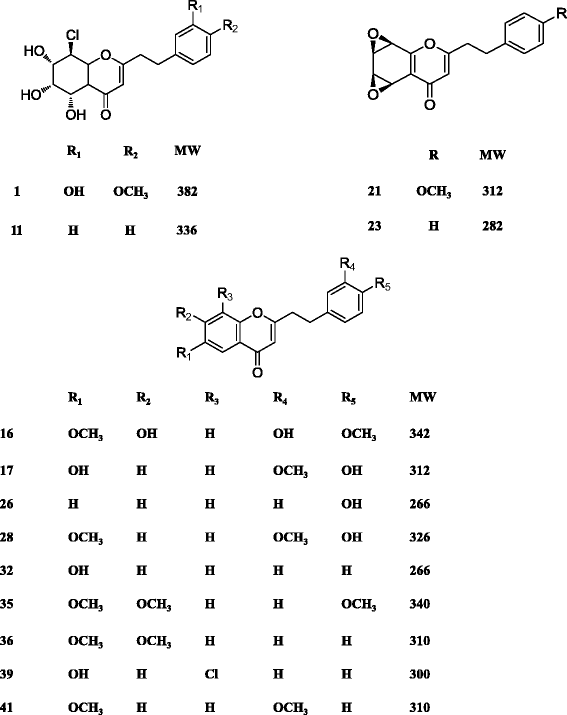
为了研究不同NaCl浓度对2-(2-phenylethyl)色酮生物合成的影响,在培养基上分别施加75 mM、150 mM和300 mM的NaCl, 10 d后用LC-MS-IT-TOF系统测定2-(2-phenylethyl)色酮(图2)。1A).呼叫提取物的BPC谱中的暂定2-(2-苯基乙基)铬的峰表明,最多物种和含量的2-(2-苯基乙基)铬的含量由150mM NaCl诱导(图。1B.).在对照愈伤组织中产生了No 2-(2-phenylethyl)染色素(图2)。1 a和b).我们的实验表明,nacl处理愈伤组织中2-(2-phenylethyl)色素的积累持续增加,直到4周。因此,提取A.sinensis用LCMS-IT-TOF分析150 mM NaCl处理4周的愈伤组织。的BPC配置文件A.sinensis愈伤组织提取物和由33个已知的2-(2-苯基乙基)色酮组成的混合标准物如图所示。1 c和d.通过紫外光谱和质谱分析,初步鉴定出41个2-(2-phenylethyl)色酮,其中13个通过比较保留时间(Rt)与HPLC色谱图,UV和MS数据与真实化合物的数据。通过从其Hresims数据推导的预测分子公式暂时鉴定另外28个化合物,并通过与文献中的MS / MS数据进行比较进一步证实[10.].从NaCl处理的2-(2-苯基乙基)铬的所有数据答:中国愈伤组织概述见表1, 包含Rt,分子式,计算及实验分子量(m / z)、生成分子式的误差(计算值与实测值之间的相对误差)、MS/MS数据。在nacl处理下,13个2-(2-苯基乙基)色酮的结构得到了明确的鉴定A.sinensis愈伤组织如图所示。2.以前的研究表明,粗提物Melanotus flavolives(B.etc)。唱歌。仅诱导4个2-(2-苯乙基)色酮A.sinensis细胞悬浮培养[15.].在本研究中,我们首先利用盐处理这一最重要的非生物胁迫产生大量的2-(2-phenylethyl)色酮。说明盐胁迫是诱导愈伤组织产生2-(2-苯乙基)色素的有效途径。
Illumina测序时机的优化
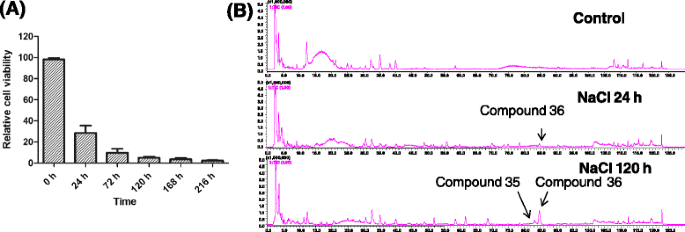
结果表明,150 mM NaCl处理愈伤组织后,细胞活性和2-(2-phenylethyl)染色素积累量分别在0 h、24 h、72 h、120 h、结果表明,NaCl处理后的细胞活性在24 h和120 h显著降低,分别达到对照的30%和5%(图3)。3).从愈伤组织中检测到的主要2-(2-苯基乙基)色酮为6,7-二甲氧基-2-[2-(4′-甲氧基苯基)乙基]色酮(化合物)35.)和6,7-二甲氧基-2-(2-苯乙基)色酮(化合物36.)。3 b).这两种化合物也是沉香中主要的2-(2-苯基乙基)色酮,并在沉香的木组织中不断增加答:中国随真菌感染的时间而变化[27.]因此,这两种2-(2-苯乙基)色酮的出现可作为研究琼脂木形成的重要指标。复合物36.在nacl处理愈伤组织24 h后首次检测到。3 b),然后是化合物的含量35.和36.不断增加。2-(2-苯乙基)色酮的生成35.和36.在120 h显著增加(图。3 b),经150 mM NaCl处理至120 h,从愈伤组织中连续分离出高质量、充足的RNA。因此,从对照和诱导得到3个cDNA文库A.sinensis使用Illumina测序构建用24小时和120小时用盐处理的Calli。
基因的转录组序列组装和注释
以对照愈伤组织mRNA和150 mM NaCl诱导愈伤组织24 h和120 h的cDNA文库进行组装和注释。总共68 962 124,70 631 522和70 951 038清洁读取控制(指定控制)和诱导愈伤组织的150毫米氯化钠处理24 h(指定induced-24 h)和120 h(指定诱导- 120 h)后生成的适配器和未知或低质量的读取,总共6 206 591 160元,6 356 836 980 nt和6 385 593 420 nt分别为对照、诱导24小时和诱导120小时文库(表1)2).在读取的读数,104116,99 429和98 697的诱导-24h和474nt中,分别从476nt,466nt和474nt中的中值屈曲大小和诱导-120h文库产生104 316,99 429和98 697 697。进一步的组装分析表明,对照,诱导-24h和诱导-120h文库由91 835,83 674和83 674 ungenes组成(表2),分别。然而,从三个文库中共生成93 041个unigenes,平均长度为1562 nt。unigenes的长度分布在附加文件中1S1:表。
根据与NR、Swiss-Prot、KEGG、COG、GO等公共数据库序列的相似性,BLASTX对unigenes的功能进行注释,并与核苷酸数据库NT (E-value≤1.0e)进行比对−5)通过Blastn。与一个或多个数据库匹配有29个387个未成年人,共注释65585个未成年人。NR分类结果表明,与此数据库和未成年人匹配了64092个unigenesA.sinensis与同源物的相似性分别为23.2%和20.9%葡萄和萝藦分别为15.5%和14.5%杨树balsamifera和Amygdalus Persica分别(无花果。4).为了进一步对总unigenes的功能进行分类,将这些unigenes通过GO、COG和KEGG数据库进行注释。GO分析表明,unigenes主要分为3大类(生物过程、细胞组分和分子功能),共包括55个功能类(附文件)2:图S1;见支持信息)。29395个unigenes有COG注释,分布在25个簇中,最大的一组为“General function prediction”,其次为“replication, recombination and repair”和“transcription”(补充文件)3.:图S2;见支持信息)。Kegg数据库中的基因注释和途径测绘表明,40552 unigenes分布在128 kegg途径中。包含最大数量的unigenes的前三个Kegg途径是代谢途径,二次代谢物的生物合成和植物 - 病原体互动(附加文件4S2:表;见支持信息)。
随着测序技术的出现,全基因组分析在许多植物物种中可用,并显著提高了基因发现的效率。然而,没有基因组数据可用A.sinensis.Illumina技术自2012年以来一直是转录组测序研究领域的首选,原因是测序reads长度增加到150 bp以上[33.].在这项研究中,我们进行了新创转录组的组装A.sinensis愈伤组织。迄今为止,转录组信息A.sinensis已被罗氏454 GS平台收购[2].然而,我们的新创转录组分析产生了更深入的测序,与之前研究的454焦磷酸测序相比,获得了更完整的转录组覆盖。在这项研究中,我们使用454焦磷酸测序将我们的转录组组装与之前发表的转录组进行了比较[2].如附加文件所示1表S1,大于1 kb的unigenes占57%以上,大于500 bp的unigenes占73%以上。而在454gs平台上组装的unigenes中,长度为200 bp和600 bp的占70%以上。这些结果表明,我们的seq-RNA组装捕获了较大的转录组A.sinensis.由于缺乏基因资源A.Sinensis,将与Genbank中已知的蛋白质显着对应的unigenes的比例被认为是另一种有用的指标。近68.89%的unigenes在NR蛋白质数据库中匹配,该值高于454 GS平台组件报告的42.8%[2].因此,新创mRNA-seq的组装将显著改善基因组注释A.sinensis并可用于进一步研究基因家族的功能成员。
差异表达基因的功能分析
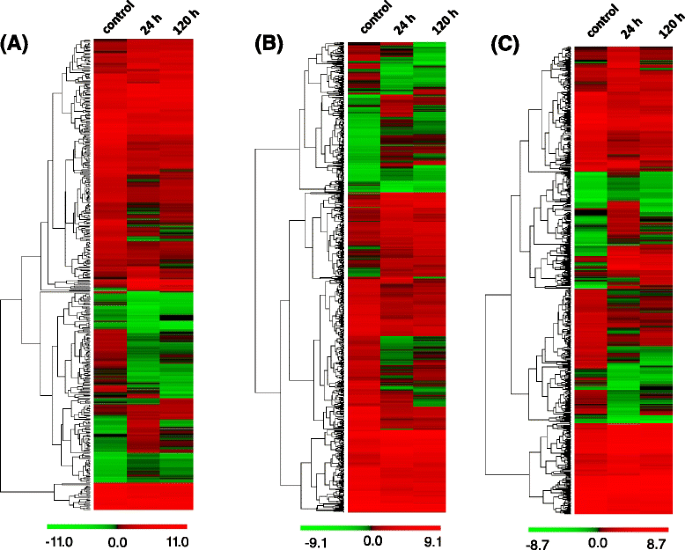
为了探讨响应盐度应力的基因表达变化,基因表达水平在映射(FRKM)的外显子(FRKM)和错误发现率[FDR] <0.001的假序列和Log2比率的绝对值≥1用作估计转录表达的统计学意义的阈值。鉴定了总共18069个差异表达基因,包括454,940和220,分别唯一地表达,诱导-24小时和诱导-120 H文库;10 881 unigenes在三个文库中表达,但在不同的水平(图。5).通过盐处理诱导24小时后,诱导5313个基因,而10266基因被下调。然而,上调2898个基因,通过盐胁迫诱导120小时后,将6268个基因下调(图。5 b).
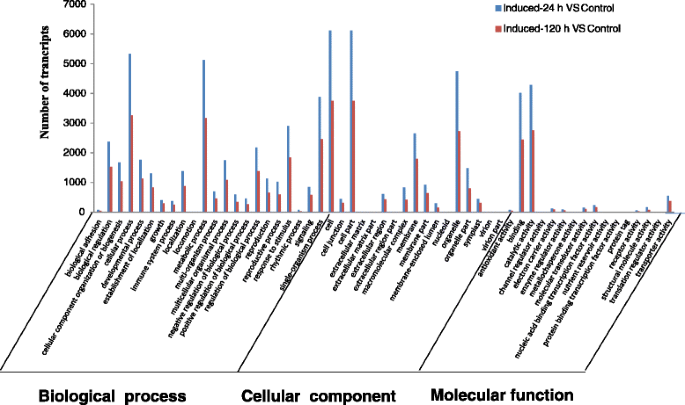
通过GO富集分析,将来自对照和诱导文库的差异表达基因按功能分类进行组织(图)。6).根据序列同源性,将差异表达基因分为生物过程、细胞组分和分子功能3大类,分别包含22、17和14个功能基团。在这些组中,VS诱导24 h对照和VS诱导120 h对照的基因功能在生物过程、细胞组分和分子功能上分布相似。而氧化石墨烯术语“细胞外围”、“细胞外区”和“外部包被结构”在盐胁迫诱导24 h后显著富集,而“细胞外围”、“锚定于膜”和“分生组织生长调控”在盐胁迫诱导120 h后主要富集(图)。6).我们还发现,盐诱导24 h和120 h后,高比例的转录本属于功能组:“细胞”、“细胞部分”、“细胞过程”、“代谢过程”和“细胞器部分”(图)。6).为了进一步分析差异转录本的功能,将差异表达基因在KEGG数据库中进行了定位。KEGG分析显示,盐处理24 h后,有6621个具有通路注释的DEGs分布在125条KEGG通路中,其中有31条p值≤0.01的通路受到显著影响(附加文件)5:表S3;见支持信息)。150 mM NaCl诱导120 h后,123条KEGG通路中有4168条注释的DEGs转运,其中40条p值≤0.01的通路显著富集(附文件)6:表S4;见支持信息)。值得注意的是,盐诱导24 h和120 h后,植物-病原互作途径、二苯乙烯类、二芳基庚烷类和姜酚生物合成途径、植物激素信号转导途径和苯基丙素生物合成均显著富集(表)3.).这些结果表明A.sinensis愈伤组织对盐胁迫的响应显著,为筛选盐胁迫和沉香形成所需的基因提供了资源。
通过定量实时PCR(qRT PCR)确认差异表达的候选转录本
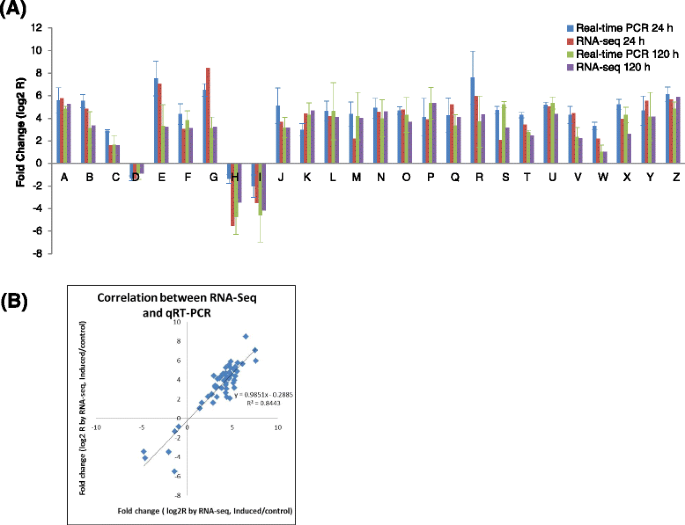
为验证RNA-seq结果的可靠性,共选择26个候选基因,利用特异性引物进行qRT-PCR分析(附文件)7:表S5;见支持信息)。分析结果表明,选择的所有26次选择具有与Illumia-SOLEX的序列相同的表达趋势(图。7一个).例如,qRT-PCR和RNA-seq分析均表明丝裂原活化蛋白激酶激酶激酶(MAPKKKA、MAPKKK2和MAPKKK3)、钙调素、WRKY转录因子(WRKY39、WRKY40和WRKY75)、caffeoyl-CoA-O- 与对照呼叫相比,甲基转移酶和Chalcone合成酶1(CHS1)在盐处理的Calli中显着高度表达。否则,通过QRT-PCR分析验证了通过RNA-SEQ分析表明的盐处理的抑制植物素流入载体和养蛋白响应因子4。此外,高相关(R2= 0.8443)。7 b).这些结果表明,通过RNA-seq分析,基因表达的变化反映了对照和盐处理愈伤组织的实际转录组差异。
通过定量RT-PCR (qRT-PCR)分析差异表达转录本的相对表达水平。一个由QRT-PCR(24小时:蓝色; 120h:Green)和RNA-SEQ(24小时:红色; 120 H:紫色)测定的相对于对照疾病相对于对照疾病的表达曲线相对于对照疾病。.X轴表示所选段的注释。Y轴表示基因的归一化表达水平。A:钙调蛋白1;B:钙结合蛋白CML37;C:钙依赖性蛋白激酶10;D:钙依赖性蛋白激酶13样;E:丝裂原活化蛋白激酶激酶激酶A;F:丝裂原活化蛋白激酶激酶激酶激酶2;G:丝裂原激活蛋白激酶激酶激酶激酶2; H: Auxin influx carrier; I: Auxin response factor 4; J: G-type lectin S-receptor-like serine/threonine-protein kinase; K: Cysteine-rich receptor-like protein kinase 25; L: LRR receptor-like serine/threonine-protein kinase FLS2; M: WRKY transcription factor 75; N: WRKY transcription factor 40; O:WRKY transcription factor 29; P: Ethylene-responsive transcription factor ERF(AP2/ERF); Q: MYB-related protein MYB4; R: MYB superfamily protein 1; S: Methyltransferase PMT15; T: Caffoyl-CoA-O甲基转移酶;U:咖啡酸3- o -甲基转移酶;V:查耳酮合酶;W:呼吸爆发氧化酶同源蛋白A;X:呼吸爆发氧化酶同源蛋白B;Y:呼吸爆发氧化酶同源蛋白D;Z:致病相关蛋白th -2。选择的基因通过qRT-PCR进行3次生物复制,以作用作为内参考。误差棒表示qRT-PCR信号的标准差(n ≥ 3).bqRT-PCR和RNA-seq分析所选deg表达比例的相关性
盐胁迫诱导了一个复杂的激素信号通路
盐胁迫对植物激素非依赖性信号通路和激素生物合成的影响[34.].KEGG富集分析结果显示,40 402株中有2 042株A.sinensis在3个文库中检测到与激素信号转导途径相关的愈伤组织基因,其中396个基因在盐胁迫下的愈伤组织中有差异表达。激素信号转导相关的度,130上调和下调202 24小时盐引起的治疗,而74和163表达的基因上调下调120 h引起盐治疗,共有175人被粘住在24 h和120 h对盐胁迫。激素相关基因表达差异的层次聚类表明,在对照、24 h和120 h响应盐胁迫时存在总体差异(图)。8)途径富集分析表明,盐处理24小时和120小时后,愈伤组织中诱导了8条激素非依赖性信号途径,包括ABA、细胞分裂素、生长素、油菜素类固醇、茉莉酸、水杨酸、乙烯和赤霉素途径(表1)4).然而,下调了超过70%的与毒素,细胞分离激素和乙烯途径的次数,而甘毛蛋白所需的50%以上,含水蛋白含量较高。这些结果表明盐度应力诱导复杂的激素信号转导途径。
高盐度引起基因表达的快速和持续变化,与对激素的反应重叠[34.].脱落酸是一种重要的激素,通过调节许多基因的表达来调节植物对盐胁迫的生长,这些基因编码各种对生物化学和生理过程至关重要的蛋白质。ABA通过重要的信号元件介导盐胁迫信号转导途径,包括ABA受体PYR/PYL家族蛋白、蛋白磷酸2C组、丝氨酸/苏氨酸蛋白激酶SnRK2成员和ABA响应元件结合蛋白[35.,36.].在A.sinensis盐胁迫愈伤组织中,ABA受体PYR/PYL家族、磷酸盐2C家族和ABA响应元件结合蛋白家族的蛋白表达模式存在显著差异,而丝氨酸/苏氨酸蛋白激酶SnRK2的转录本则无明显变化(表2)4).表达谱的比较分析表明盐胁迫与ABA信号通路之间存在串扰。除了众所周知的应激反应ABA,其他植物激素也对盐胁迫负责。最近的研究表明,细胞分裂素信号的改变影响了植物对非生物胁迫的响应、种子萌发、细胞分裂和花的起始[37.,38.].在拟南芥,内源性细胞分裂素过多降低了番茄对盐胁迫的抗性,而低水平的细胞分裂素则促进了番茄的盐诱导衰老[39.].我们的转录组分析表明,大多数负责细胞分裂素信号转导的受体激酶和响应调节因子在盐处理下显著降低(表)4).例如,大部分都改变了A.sinensis在盐胁迫下,重要的细胞分裂素受体CRE1基因表达下调。下游基因如ARR-B基因在不同时间点盐胁迫下均表现为上调或下调。植物利用生长素信号调节根系发育,以响应多种生物和非生物信号,包括盐胁迫[37.,38.].在拟南芥,盐胁迫抑制PIN2(一种生长素外排载体)的表达,众所周知,PIN2通过监测二头叶生长素的运输支配向地根响应[40].盐胁迫下愈伤组织中生长素信号通路所需的72个基因差异表达。大部分改变了Aquilaria.在盐胁迫条件下,愈伤组织中的生长素内流载体和生长素反应因子基因表达下调,然而,在盐处理过程中,注释为生长素反应蛋白(IAA)、生长素反应GH3基因家族和SAUR家族蛋白的基因表达上调和下调(表1)4).此外,许多Aquilaria.铜绿素信号转导基因,例如铜绿酮抗性1/2和铜绿素不敏感的1-相关受体激酶(Bak1)基因家族,在盐胁迫下也不同地表达。特别地,在盐处理期间,铜绿素抗性1/2家族基因受到了下调的,然而,Bak1家族成员作用于含丝氨酸/苏氨酸的底物,并对芸苔类固醇信号转导所需的[41],在不同时间点的盐胁迫下愈伤组织中均有上调和下调4)此外,参与茉莉酸和水杨酸信号转导的茉莉酸ZIM结构域包含蛋白(JAZ)、转录因子MYC2和TGA家族[42]除了ABA、细胞分裂素、生长素、油菜素萜、茉莉酸和水杨酸信号通路对盐胁迫的响应外,乙烯和赤霉素等激素在盐胁迫信号转导中也起着重要作用。表达谱的比较分析表明,盐胁迫诱导了复杂的激素信号通路。
盐胁迫调节与信号转导相关的基因:类受体激酶,Ca2+-结合蛋白和MAPK蛋白
对盐胁迫的适当防御反应首先需要对胁迫的认识。与各种生物和非生物胁迫反应相关的最大受体蛋白群之一是类受体激酶超家族,它具有氨基末端信号序列、跨膜段和胞内丝氨酸/苏氨酸激酶结构域[43- - - - - -45]我们鉴定了688个DEG注释为盐胁迫下愈伤组织中诱导的受体样激酶(附加文件8:表S6,参见支持信息)。525度确定在24 h后愈伤组织诱导的盐胁迫的注解为受体激酶,而409度分为受体激酶被盐诱导治疗h。120度,265被上调,263被盐抑制诱导治疗后24 h,然而,在盐诱导后120 h,有181个表达上调,230个表达下调,而在盐诱导后24 h和120 h共有279个表达下调。通过对不同表达基因的分级聚类分析,可以看出盐胁迫诱导的愈伤组织在对照、24 h和120 h的总体差异(图1)。8 b).
至少有4个受体样激酶家族被报道在应激反应基因中被诱导:LRR受体样丝氨酸/苏氨酸蛋白激酶(LRR- rlk)、脯氨酸富受体样激酶(PERK)、半胱氨酸富受体样蛋白激酶(CRR-RLK)和g型凝集素s受体样丝氨酸/苏氨酸蛋白激酶(SRK)(附加文件)8:表S6,参见支持信息)。LRR-RLK家族是类受体激酶中最大的一类,在非生物胁迫和生物胁迫反应中调控植物生长发育的各种过程[44- - - - - -46].例如,FLS2是LRR-RLK的成员,它识别细菌鞭毛蛋白片段并介导植物的防御反应[47].brassinosteroids insensitive 1-associated receptor kinase (BRI)是LRR-RLK的成员,负责BR激素,调节植物对非生物和生物胁迫的耐受性[46].与此一致的是,我们观察到共有262个差异表达的转录本被注释为LRR-RLK家族成员,包括88个FLS2亚组成员和16个BRI亚组成员(附加文件)8:表S6,参见支持信息)。例如,一个FLS2亚家族成员,在24和120 h NaCl诱导愈伤组织4倍以上,我们通过qRT-PCR证实了这一点。PERK家族成员作为细胞壁的传感器/受体,在植物暴露于非生物和生物胁迫时监测细胞壁的变化[48].第一个典型的PERK成员是芸苔属植物显著PERK1,在不同的组织中表达,并可迅速被损伤诱导[49].Perk家族,Perk4的另一个成员是ABA和盐压力的阳性调节因子。我们观察到检测到检测到的Perk家族成员的92种转录物,响应于NaCl治疗,并对约一半的转录物进行上调。然而,我们观察到大多数CRR-RLK和SRK家族成员在不同时间点的盐胁迫下上调,正如这两个压力诱导的受体激酶的所预期的那样(附加档案8:表S6,参见支持信息)。表中显示的许多其他盐反应类受体激酶是盐胁迫反应的潜在调节因子A.thaliana.这些结果表明,通过盐胁迫来控制和调节大多数受体样基因的转录,暗示其在盐的重要作用胁迫信号转导。受体样激酶信号传导的下游事件涉及通过丝裂原活化的蛋白激酶(MAPK,MAPKK,MAPKKK)级联蛋白质磷酸化[50,51].在我们的分析中,盐胁迫影响了几个丝裂原激活蛋白激酶基因的表达模式。总共有26个差异表达的转录本涉及MAPK途径和上调转录本在丝裂原激活的蛋白激酶激酶家族中尤其占优势(附加文件)8:表S6,见支持信息)。例如,编码MAPKKKA、MAPKKK2和MAPKKK3的三种丝裂原活化蛋白激酶激酶在盐处理24小时和120小时时转录富集(Unigene19214_-All、Unigene3063_-All、CL5738.contig1_-All)(表5),通过qRT-PCR验证。然而,大多数成员的丝裂原激活蛋白激酶激酶和丝裂原激活蛋白激酶基因包括编码MPK3和MEKK2的蛋白A.thaliana在应激反应中起重要作用的基因在两个时间点被下调[51,52] (桌子5).钙离子(Ca2+)已被证明是植物信号通路中的第二信使,包括对盐胁迫的反应。据报道,盐处理会触发钙的瞬时增加2+水平(53].通过应激激活MAPK始终依赖于Ca的结合2+钙结合蛋白包括钙调素(CaM),钙结合蛋白(CML),钙依赖蛋白激酶(CDPKs)和钙调磷酸酶b样蛋白(CBL)(附加文件)8:表S6,见辅助信息)[53- - - - - -56].在我们的分析中,81个差异表达的ungenes注释为Ca2+盐胁迫24 h和120 h时,CML蛋白的依赖蛋白对盐胁迫信号转导有响应,其中上调转录本占主导地位。Aquilaria.愈伤组织基因编码Ca2+包括CaM1, CML37, CML27, CML29和CDPK1在内的依赖蛋白负责植物先天免疫[54- - - - - -56] (桌子5),表达量高,提示这些蛋白可能是Ca的组成部分2+调节植物对盐胁迫的防御反应的信号。因此,受体样激酶、MAPK级联和Ca2+参与盐胁迫信号转导的依赖蛋白。
盐胁迫调节愈伤组织中转录因子基因的表达
转录因子对基因表达,生物和非生物应激反应的调节至关重要,以及信号转导。的拟南芥基因组中至少有1819个预测转录因子,被分为56个家族。然而,有428个预测转录因子受到盐处理的调控。在A.sinensis,共有598个DEGs被注释为转录因子。512度由150毫米氯化钠在24 h,以264度和248度表达是上调衰减,而氯化钠引起的330度在120 h, 128被上调,202被抑制,然而,只有220度被粘住在24 h和120 h(附加文件9:表S7,参见支持信息)。被标注为转录因子的DEGs的层次聚类表明,在对照、诱导24 h和诱导120 h文库中存在总体差异(图2)。8 c).至少有7个转录因子家族被报道在应激反应基因中丰富:AP2/ERF(Apetala-2/EREBP)、MYB(Myeloblastosis)、WRKY(以WRKY氨基酸基序命名)、bHLH(碱性螺旋-环-螺旋)、HOX(Homeodomain-containing transcription factor)、NAC(NAC domain protein)和HSF(Heat Shock factor)(见表)6).AP2/ERF是参与盐胁迫响应的最大转录因子家族之一,可进一步分为4个亚家族:ERF、DREB、AP2、RAV [57].这些,小块土地和AP2s表达水平与耐盐性相关,并激活下游的盐应答基因。在A.sinensis,我们观察到73个AP2/ERF家族转录本受到盐胁迫的调控(附加文件9表S7,见支持信息),在AP2/ERF家族的三个亚群(AP2、ERF、DREB)中检测到两个时间点的上调转录本(表6).然而,在盐胁迫24 h和120 h时,ERF亚家族成员被显著诱导A.sinensis愈伤组织(表6).最近对MYB家族成员表达水平的分析得出结论,大多数MYB转录因子与应激和激素有关[58].与此分析一致的是拟南芥, 84个预测MYB转录因子中至少有1 / 3在转录丰度水平上被NaCl富集,在小麦中60个可检测到的MYB家族成员中有16个在转录丰度水平上被高盐诱导[32.,59].同样,我们观察到共有71个deg被注释为MYB家族成员,24个共调控转录本中有14个被NaCl富集(附加文件)9:表S7,参见支持信息)。MYB1(Unigene9921_All)和MYB4(CL3573.Contig1_All), NaCl在每个时间点的诱导倍数均超过4倍6),我们用qRT-PCR证实了这一点。此外,其他MYB家族成员如MYB75,MYB39,MYB78和MYB21NaCl上调。大多数含有锌指基序的WRKY家族成员都参与了生物和非生物反应[60].在拟南芥NaCl诱导的WRKY转录因子超过1/2WRKY17,WRKY25和WRKY33显著富集[32.].我们观察到,58个DEGs被注释为WRKY家族转录因子,大多数WRKY家族成员在盐处理24 h和120 h时被上调(附加文件)9:表S7,参见支持信息)。我们还使用qRT-PCR验证了这些观察结果WRKY29,WRKY40和WRKY75(表6)盐分胁迫显著富集。另外三个具有不同DNA结合基序的转录因子大家族是bHLH、HOX和NAC基因[32.].所有这些家族都含有nacl响应基因,然而HOX和NAC家族成员在nacl诱导的转录本中显著富集。此外,大多数HSF家族成员在盐胁迫下富集[61] (桌子6),这与应激反应转录因子家族的预期一致。许多其他转录家族包括MYC, GRAS, TGA, TCP和GATA(附加文件9:表S7,见支持信息),含有NaCl响应基因,并对对NaCl治疗的生理反应发挥着重要作用。我们观察到的大量上调或下调转录因子基因与存在于盐胁迫的响应的复杂信号转导网络的存在一致。
在盐度应力下呼应中的2-(2-苯基乙基)铬的生物合成的推定基因
我们的研究表明,盐胁迫诱导了2-(2-苯基乙基)色素的产生A.sinensis愈伤组织。这些结果表明,负责2-(2-苯基乙基)铬的生物合成的酶活性富含盐度应力。RNA-SEQ分析表明,二芳基庚烷和甘甲生物合成途径显着富集,但是姜黄素合成酶是植物聚酮合成酶,是二芳基甲酸和吲哚生物合成的最重要的合酶[62],不能注释三个文库,包括控制,诱导-24小时和诱导-120小时。根据2-(2-苯基乙基)铬的结构,我们提出了2-(2-苯基乙基)铬的生物合成可能与二芳基合成酶(PKS)相似,除姜黄素合酶以外的作用可能在2-(2-苯基乙基)铬的生物合成[63].转录组数据表明,在盐诱导24小时和120小时后,受到III型聚酮合成酶的成员的Chalcone合酶的表达(附加档案10.:表S8,参见支持信息)。其中,愈伤组织诱导24 h和120 h后查尔酮合成酶1 (CHS1)表达上调;然而,在120 h时,CHS2的表达降低7).利用mega6.0软件,根据PKSs氨基酸序列,采用Neighbor-Joining法构建系统进化树,研究不同种PKSs之间的进化关系和分布。系统发育树分析将高等植物中的PKSs分为两个不同的簇,称为CHS(chalcone- producing)簇和非CHS(nonchalcone-producing)簇,AsCHS1被归为非CHS簇,包括来自单子叶植物的姜黄素合成酶(CUS)Oriza漂白亚麻纤维卷二酮辅酶a合酶(DCS)和姜黄素合酶(curcumin synthase)姜黄,ASCHS2被分组为CHS Cluster [63)(附加文件11.:图S3)。这些结果表明,AsCHS1可能具有不寻常的催化潜能,可能是生物合成2-(2-苯基乙基)色酮的重要酶。(2) - 2-phenylethyl色酮总是显示O -苯基乙基色酮支架上的甲基。它表明,O-甲基转移酶在转移过程中起关键作用O-甲基到2-(2-苯基乙基)色酮支架。近年来,对药用植物进行转录组分析Glaucium flavum表明,O-甲基转移酶(OMTs)是必需的苄基异喹啉生物碱(显示4O-甲基在C6, C7, c3 '和C4 '上的苄基异喹啉支架)生物合成[64].转录组资源分析Aquilaria.CALLI揭示了2-(2-苯基乙基)铬的生物合成,需要黄酮醇的成员3-O-甲基转移酶和咖啡酰辅酶AO甲基转移酶家族转让O-甲基到2-(2-苯基乙基)色单体支架上7).RNA-SEQ分析表明,总共21次注释为黄酮醇3-O- 甲基转移酶和总共8℃作为咖啡酰基 - COA注释O-methyltransferase(附加文件10.:表S8,参见支持信息)。超过一半的文本注释为O盐胁迫24 h和120 h后-甲基转移酶活性显著增强O甲基转移酶在2-(2-苯基乙基)色素的生物合成中起着关键作用。
结论
我们首先从盐处理中鉴定了41个2-(2-苯基乙基)色酮A.sinensis用LC-MS检测愈伤组织。通过对对照愈伤组织和150 mM NaCl处理诱导愈伤组织的转录组进行综合分析,寻找与盐胁迫相关的转录组。共获得93 041个unigenes,平均长度为1562 nt,并与NR、Swiss-Prot、KEGG、COG和GO等公共数据库进行了注释。我们的转录分析显示,在盐胁迫24小时和120小时的愈伤组织中,有许多基因存在差异表达。RNA-seq候选基因的差异表达通过qRT-PCR分析得到。我们发现许多基因参与激素信号转导,MAPK级联信号转导,Ca2+信号转导或编码受体样激酶和转录因子在对照和盐处理愈伤组织中表达不同。这些差异表明盐胁迫诱导了一个复杂的信号通路。此外,我们的RNA-seq分析发现查尔酮合成酶和O甲基转移酶可能调节2-(2-苯基乙基)色素的生物合成。这些结果为进一步研究盐胁迫信号转导机制提供了依据A.sinensis愈伤组织和促进沉香形成机制的线索。
方法
植物材料及化学处理
的A.sinensis将中国广东省中山市的茶叶切成直径1 cm的片状,表面用2.5%高氯乐消毒10 min, 70%乙醇消毒30 s,无菌蒸馏水洗涤4次。将处理后的叶片在含有2 μg/mL萘-1-乙酸(NAA)和1 μg/mL 6-BA的MS培养基上诱导愈伤组织。愈伤组织在25℃暗培养1个月后,每月传代到含2 μg/mL NAA、1 μg/mL 6-BA、1 μg/mL二氯苯氧乙酸(2,4- d)和1 μg/mg激动素(KT)的MS培养基上。为了鉴定和推测2-(2-phenylethyl)色酮,将愈伤组织转移到含150mm NaCl的培养基上,每4周收获一次,用LCMS-IT-TOF分析。优化排序时间,150毫米氯化钠治疗愈伤组织在收获0 h, 24小时,72小时,120小时,168小时,216 h。盐治疗,氯化钠添加到介质最终浓度为75毫米,150毫米,300毫米,愈伤组织接种亚文化4周后转移到这些中有或没有生理盐水,并在第10天收获。盐处理后,收集愈伤组织,用蒸馏水洗涤5 min。
处理后的2-(2-苯基乙基)色素分析Aquilaria.愈伤组织
愈伤组织在65℃干燥,用95%甲醇(0.1 g干愈伤组织,1ml 95%甲醇)在室温超声浴中提取半小时。然后提取液在4℃,12 000 rpm离心1小时,上清液用LC-DAD-IT-TOF-MS系统(Shimadzu, Kyoto, Japan)分析。对于液相色谱分析,采用安捷伦SB-C进行色谱分离18.柱(250×4.6mm I.D.,粒度5μm,安捷伦技术。帕洛阿尔托,加利福尼亚州,美国)。注射体积设定为10μL。流动相由乙腈(A)和0.1%甲酸水溶液(B)组成,并在梯度方案后在1.0ml / min下递送:0-20分钟,10% - 20%a;20 - 35分钟,20% - 25%a;35 - 55分钟,25% - 35%a;55-70分钟,35% - 38%a;70 - 90分钟,38% - 50%a;90 - 105分钟,50-70%a;105 - 120分钟,等物质70%a;120-130分钟,70% - 90%A.爸爸模块记录超过190-400nm的UV吸收。 In mass spectrometer domain, an hybrid ion trap-time-of-flight mass spectrometer (IT-TOF-MS, Shimadzu) equipped with an electrospray ionization (ESI) interface was connected to LC system via a PEEK tube (0.13 mm i.d.) to perform high-resolution tandem mass spectrometry. The accurate ion axis was calibrated using the sodium trifluoroacetate (TFA) clusters as reference. Positive mass spectra were recorded in the full scan and automatic multiple stage fragmentation scan modes over a range ofm / z所有MS1, MS2谱采集100 - 1000。用实验质量与计算质量的偏差计算的质量差公差±5ppm来确定指定化学式的准确性。
RNA提取及cDNA文库制备
根据制造商的建议,使用总RNA提取试剂盒(Norgen, Cat 72200),在24 h、120 h从对照和nacl诱导的愈伤组织中提取总RNA。采用Nanodrop2000 (ND-100分光光度计,Peqlab)分析RNA浓度和完整性。RNA诱导的愈伤组织(三个复制)混合比例相等为诱导库,生成池和RNA控制愈伤组织(三个复制控制愈伤组织在24 h和三个复制控制愈伤组织在120 h)混合池的控制库。
图书馆建设和新创转录组测序
使用Oligo(DT)磁珠纯化来自对照和诱导的CALLI的总RNA,并根据制造商的指示(Illumina,San Diego,CA USA)分离成小块。然后使用裂解的片段与随机六烯酮血脂和逆转录酶(Invitrogen,Carlsbad,CA USA)合成第一链cDNA。使用DNA聚合酶I(Invitrogen,Carlsbad,Ca USA),DNTP和RNase H合成二链cDNA。在下面,通过PCR扩增cDNA片段并在去除连接适配器并终修复后纯化以构建最终文库.使用100bp配对端方法在Illumina Hiseq-2000平台上测序了一个带有插入尺寸的图书馆,使用100bp配对结束方法在Illumina Hiseq-2000平台上进行测序。总共有74,881,134,80,382,270和77,355,892次原始读数分别在三个图书馆中被索尔卡斯/ illumina测序产生,该库在NCBI中的序列读取归档数据库中被沉积在NCBI,加入号码319923中。
新创Unigene功能的转录组组装与注释
去除适配器序列后,读品质量较低(质量值≤10的读品占20%以上)和未知核苷酸大于5%的读品,用短读品组装程序- Trinity程序进行clean reads组装[65]首先,Trinity将具有一定重叠长度的读数据组装成重叠,将重叠数据聚类成簇,并为每个簇构建代表给定基因完整转录复杂性的de Brujin图,然后在这些图中划分完整的读集。最后,Trinity处理各个图,追踪阅读在图中的路径,最终编程全长转录本,并测试与同源基因相对应的转录本。trinity组装的最终序列被定义为“unigenes”。三个库的trinity unigenes通过TGICL软件进一步组装,以获得非冗余的unigenes用于进一步分析的基因[66].Unigenes的功能使用BLASTX搜索对齐(具有10的电子值阈值−5)到公共蛋白质数据库,包括NCBI非冗余数据库(NR)(http://www.ncbi.nlm.nih.gov), Swiss-Pot数据库(http://www.expasy.ch/spot)、COG数据库(http://www.ncbi.nlm.gov/COG)、京都基因与基因组百科全书(KEGG)数据库(http://www.genome.jp/kegg).检索序列相似性最高的蛋白进行分析。COG将每个注释的序列与一个古老的保守域匹配,以预测和分类可能的功能,而KEGG则产生细胞内代谢途径。在NR标注的基础上,利用Blast2GO程序(http://www.blast2go.com/b2ghome)[67].
差异表达基因功能分析
通过FPKM方法计算unigenes表达的值和转录水平[68].斯蒂芬Audic描述的严格算法用于鉴定不同样本之间的差异表达基因[69,并采用FDR (False discovery rare)方法分析多次试验中p值的阈值。我们选择“FDR≤0.001,log2 Ratio绝对值≥1”作为判断基因表达差异显著性的阈值。将所有差异表达基因进行GO富集分析,并将其映射到KEGG数据库中,以确定显著富集的代谢途径或信号转导途径。
实时定量PCR (qRT-PCR)分析
为了研究苯乙基色素生物合成和盐胁迫相关基因的mRNA表达情况,根据制造商的说明,使用Bio-Rad Real-time System和SYBR Green PCR Master试剂盒进行qRT-PCR。根据制造商的建议,使用MLV试剂盒(Sigma)对不同样本的总RNA进行逆转录。将10 ng模板cDNA加入20 μL的PCR反应混合物中,该混合物包含10 μL快速SYBR Green master mix (Invitrogen公司)和0.2 μM基因特异性引物(附加文件)7:表S5;见支持信息)。DNA Engine Option 2热循环器按如下程序进行:一次95℃循环3 min, 40次95℃循环30 s, 60℃循环30 s。候选基因的表达归一化到肌动蛋白通常用作内部控制的基因[4].对每个样本的相对基因表达水平进行归一化,取负值∆∆Ct的2次方[70].对于所有的qRT-PCR分析,计算3个生物学实验和3个实验重复来分析候选基因的表达。
缩写
- 爆炸:
-
基本的局部对齐搜索工具
- CBF:
-
CRT结合转录因子
- CHS:
-
查耳酮合酶
- COG:
-
直际蛋白质群体
- 度:
-
差异表达基因
- 罗斯福:
-
错误发现率
- 走:
-
基因本体论
- KEGG:
-
KEGG资源用于破译基因组
- Nr:
-
ncbi nr数据库
- qPCR:
-
定量实时PCR
- RNA-seq:
-
RNA测序
- TF:
-
转录因子
参考文献
- 1。
沉香的挥发性成分和半挥发性成分Aquilaria.物种:审查。中国农业科学;2011;26(2):73-89。
- 2。
徐勇,张震,王敏,魏军,陈辉,高志,隋超,罗辉,张旭,杨勇,等。沉香形成相关基因的鉴定:沉香健康和损伤组织的转录组分析中华秋葵.BMC基因组学。2013; 14:227-43。
- 3.
张晓丽,刘云云,魏建辉,杨勇,张智,黄建强,陈华强,刘宇军。生产优质沉香中华秋葵树木采用整树沉香诱导技术。中国化学快报。2012;23(6):727-30。
- 4.
高振华,魏建华,杨勇,张震,赵文涛.胁迫相关沉香形成内参基因的选择与验证中华秋葵.植物学报2012;31(9):1759-68。
- 5.
中国药典委员会。中华人民共和国药典(一)。北京:化学工业出版社;2010.
- 6.
陈慧卿,魏建辉,杨建生,张智,杨艳,高振华,隋超,龚波。特有属沉香的化学成分Aquilaria.植物。化学Biodivers。2012;9(2):236 - 50。
- 7.
陈丹,徐志仁,柴学勇,曾伟华,贾应祥,毕丹,马泽忠,涂鹏飞。树脂木材中9种2-(2-苯基乙基)色酮衍生物的研究中华秋葵抑制lps诱导的RAW 264.7细胞NO生成。Eur J Org Chem. 2012; 27:5389-97。
- 8.
沉香木的芳香倍半萜化合物。植物化学,1993;33(5):1147 - 55。
- 9.
从培养的细胞中提取δ-愈创木烯合酶的特性Aquilaria.,负责沉香中倍半萜的形成。植物杂志。2010;154(4):1998 - 2007。
- 10。
易卜拉欣SRM, GAM。天然存在的2-(2-苯基乙基)色酮,结构阐明和生物活性。中国科学(d辑:地球科学)2015;29(16):1-32。
- 11.
Yoon JS, Lee MK, Sung SH, Kim YC。白茅神经保护2-(2-苯乙基)色素。中国科学(d辑:地球科学)2006;69(2):290-1
- 12.
刘杰,吴杰,赵耀新,邓YY,梅WL,戴HF。一种新的细胞毒性2-(2-苯乙基)青蒿素。中国化学出版社。2008;19(8):934-6。
- 13。
杨大东,王辉,郭志坤,董文辉,梅伟林,戴慧峰。沉香中一个新的2-(2-苯基乙基)色酮衍生物中华秋葵.中国生物医学工程学报。2014;16(7):770-6。
- 14。
李伟,蔡超,董文辉,郭志坤,王辉,梅伟林,戴慧峰。人工打孔沉香中2-(2-苯乙基)色酮衍生物的研究。Fitoterapia。2014;98:117-23。
- 15.
齐少华,何曼丽,林立德,张超,胡丽娟,张洪志。悬浮培养2-(2-苯乙基)染色体的产生中华秋葵.acta botanica sinica(云南植物研究与开发),2017;
- 16.
沉香木芳香成分的研究Aquilaria.愈伤组织和细胞悬浮培养。生物科技植物》。2009;26(3):307 - 15所示。
- 17.
朱镕基JK。植物的盐和干旱胁迫信号转导。植物学报2002;53:247-73。
- 18.
Kempa S, Krasensky J, Dal Santo S, Kopka J, Jonak C.在应激调节碳水化合物代谢中的中心作用。《公共科学图书馆•综合》。2008;3 (12):e3935。
- 19.
他t,克莱默gr。脱落酸浓度与两种盐胁迫快速循环芸苔属物种中的叶面积减少相关。植物土壤。1996年; 179(1):25-33。
- 20。
Cramer GR, Quarrie SA。脱落酸与4个不同基因型的玉米叶片生长抑制有关。植物生态学报。2002;29(1):111-5。
- 21.
盐胁迫下大麦光合过程中脱落酸的参与。植物生长规律。1995;14(4):211-8。
- 22.
Fragnire C,Serrano M,Abou-Mansour E,Métrauxjp,haridon fl。水杨酸及其响应生物和非生物应激的位置。费用。2011; 585(12):1847-52。
- 23.
SD,Sasse JM子句。芸苔类固醇:植物生长和发展的必要调节因素。Annu Rev植物Biol。1998年; 49:427-51。
- 24.
朱建平。植物非生物胁迫信号传递的交叉和特异性的分子遗传学研究。中国生物医学工程学报。2004;32(4):427 - 427。
- 25.
黄光谷,马少林,白立平,张磊,马辉,贾鹏,等。植物在冷、盐和干旱胁迫下的信号转导。acta photonica sinica; 2012;39(2): 969-87。
- 26.
罗建林,唐树华,彭晓军,闫晓华,曾晓华,李军,李晓峰,吴刚。盐和peg模拟干旱胁迫的相互作用及早期响应机制的特异性研究芸苔属植物显著使用比较蛋白质组分析。《公共科学图书馆•综合》。2015;10 (10):e0138974。
- 27.
黄建平,黄建平。植物耐盐机制的研究进展。基因组学杂志。2014;701596。
- 28.
脱落酸反应激酶PKABA1与种子特异性脱落酸反应元件结合因子TaABF相互作用,并使TaABF肽序列磷酸化。植物杂志。2002;130(2):837 - 46所示。
- 29.
胡勇,陈丽,王浩,张磊,王芳,于东。拟南芥转录因子WRKY8与其互作伙伴VQ9拮抗调节盐胁迫耐性。植物j . 2013; 74:730-45。
- 30.
Mizoi J,Shinozaki K,Yamaguchi-Shinozaki K. AP2 / ERF家庭转录因子植物非生物应激反应。Biochim Biophys Acta。2012; 1819(2):86-96。
- 31.
歌曲SY,Chen Y,Chen J,Dai Xy,张WH。稻草依赖性水稻植物与非生物胁迫的生理机制。Planta。2011; 234(2):331-45。
- 32.
6 .蒋勇,陈志强,陈志强。nacl胁迫下拟南芥根的转录分析。BMC Plant Biol. 2006;6:25。
- 33.
王Y,道X,唐XM,肖L,孙建立,燕XF,李D,邓HY,马XR。番茄比较转录组分析(茄属植物lycopersicum)对外源脱落酸的反应。BMC基因组学。2013;14:841。
- 34。
王志强,王志强。植物抗逆性和抗逆性的研究进展。植物学报。2011;14(3):1290-5。
- 35。
杨永强,王志强,王志强,王志强。PP2C磷酸酶活性的调节因子在细胞脱落酸传感器中的作用。科学。2009;324(5930):1064 - 8。
- 36。
Sang-Youl Park PF, Nishimura N, Jensen DR, Fujii H, Zhao Y, Lumba S, Rodrigues A, Tsz-fung F. Chow等。脱落酸通过aba结合START蛋白的PYR/PYL家族抑制pp2c。科学。2009;324(5930):1068 - 71。
- 37。
关键词:盐渍化,番茄,叶片衰老,激素变化中国生物医学工程学报。2008;59(11):3039-50。
- 38。
盐胁迫信号塑造植物的根。植物学报。2011;14(3):296-302。
- 39.
在渗透胁迫条件下,脱落酸通过与细胞分裂素、乙烯和生长素相互作用的激素网络调控根系生长。2016年新植醇。。doi: 10.1111。
- 40。
徐健,贾lg,巴鲁斯卡f,丁gc,shi wm,ye nh,张jh。PIN2需要适应拟南芥根通过调节质子分泌来抵抗碱性胁迫。J Exp机器人。2012;63(17):6105–14.
- 41。
邮箱J,Liebrand Tw,Bi G,Evrard A,Bye Rr,Mbengue M,Kuhn H,Jaosten MH2,Robatzek S.AVR4促进与Bak1 / Serk3受体样激酶的CF-4受体样蛋白质相关性以引发受体内吞作用和植物免疫力。新植物。2016; 210(2):627-42。
- 42。
MA,Munemasa S,Uraji M,Nakamura Y,Mori IC,Murata Y.内源性脱落酸参与茉莉酸甲酯诱导的大鼠气孔关闭拟南芥.植物杂志。2011;156(1):430 - 8。
- 43。
植物受体样激酶基因家族的结构、功能和信号转导。Sci抽烟可以。2001; 2001: re22。
- 44。
受体样激酶/Pelle基因家族的扩增及其受体样蛋白的研究拟南芥.植物杂志。2003;132:530-43。
- 45.
Marshall A, Aalen RB, Audenaert D, Beeckman T, Broadley MR, Butenko MA, Cano-Delgado AI, de Vries S, Dresselhaus T, Felix G, et al.;应对干旱胁迫:类受体激酶提出了新的方法。植物细胞,2012;24(6):2262 - 78。
- 46.
阿夫扎尔·AJ,伍德·AJ,莱特福特地方检察官。植物类受体丝氨酸苏氨酸激酶:在信号传导和植物防御中的作用。植物营养与肥料学报。2008;21(5):507-17。
- 47.
Brassica完整的膜s位点受体激酶在膜环境中具有丝氨酸/苏氨酸激酶活性,并在植物中自发形成低聚体。美国国家科学研究院2000;97:3759-64。
- 48.
韩飞龙,孙海涛,孙海涛,等。PERK-KIPK-KCBP信号负调控根生长拟南芥thalian一个.J Exp Bot. 2015;66(1): 71-83。
- 49.
PERK1基因是一种富含脯氨酸、类伸展素受体激酶-1 (PERK1)的基因。acta botanica sinica(云南植物学报)2002;50(4-5):667-85。
- 50
李春华,王刚,赵金龙,张丽琴,艾丽芬,韩艳芳,孙勇。受体样激酶SIT1通过激活MAPK3/6调控水稻的盐敏感和乙烯稳态。植物细胞。2014;26(6):2538 - 53。
- 51
Asai T,Tena G,Plotnikova J,Willmann Mr,Chiu WL,Gomez-Gomez L,Boller T,Ausubel FM,Sheen J. Map Kinase信号传导级联拟南芥我《自然》杂志,2002;415(6875):977-83。
- 52
王志强,王志强,王志强,等。植物丝裂原活化蛋白(MAP)激酶在植物金属胁迫中的调控与响应[J]。中华医学杂志。2012;13(6):7828-53。
- 53.
Wurzinger B,Mair A,Pfister B,Teige M.依赖钙蛋白激酶的串扰和MAP激酶信号传导。植物信号表现。2011; 6(1):8-12。
- 54.
钙调素和钙调神经蛋白b -样蛋白:植物钙传感器的研究。植物细胞。2002;14(增刊):s389 - 400。
- 55.
突触信息传递的决定因素2+将蛋白质结合到CA.2+信号域。Front Cell Neurosci. 2016;10:69。doi: 10.3389。
- 56.
一种钙依赖蛋白激酶的过表达通过阻止膜脂过氧化来增强水稻的耐盐和耐旱能力。植物杂志。2014;165(2):688 - 704。
- 57.
NAKANO T,SUZUKI K,FUJIMURA T,Shinshi H.INA的基因组分析拟南芥和米饭。植物杂志。2006;140:411-32。
- 58。
陈艳华,杨学勇,何科,刘明辉,李景国,高志飞,林志强,张艳飞,王XX,等。MYB转录因子超家族拟南芥:与水稻MYB家族的表达分析及系统发育比较。植物学报。2006;60:107-24。
- 59。
张丽玲,赵国宇,贾建忠,刘旭,孔祥云。60个分离的小麦MYB基因的分子特征及其在非生物胁迫下的表达分析中国生物医学工程学报。2012;63(1):203-14。
- 60.
董建新,陈超,陈泽新。的表达式概要拟南芥植物防御反应中的WRKY基因超家族。植物学报。2003;51(1):21-37。
- 61.
王志强,王志强,王志强,等。植物热休克因子相关基因的克隆与表达分析拟南芥.植物j . 2005; 41(1): 1 - 14。
- 62.
姜黄素合成酶一锅合成二芳基庚酸支架的结构基础栽培稻. Proc Natl Acad Sci U S.2010;107(46):19778–83.
- 63.
Abe I,Morita H.植物III型聚酮合成酶查尔酮合成酶超家族的结构和功能。Nat Prod Rep.2010;27(6):809-38。
- 64。
Farrow SC, Facchini PJ。双加氧酶催化O-去甲基化和O-去甲基化,在罂粟中苯异喹啉生物碱的代谢中具有广泛的作用。中国生物化学杂志。2013;288(40):28997-9012。
- 65。
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I, Adiconis X, Fan L, Raychowdhury R, Zeng Q, et al.;没有参考基因组的RNA-Seq数据的全长度转录组组装。生物科技Nat》。2011;29:644-52。
- 66。
黄雪梅,梁飞,黄雪梅,等。tiger基因指数聚类工具(TGICL):一个用于大型EST数据集快速聚类的软件系统。生物信息学。2003;19:651-2。
- 67。
Blast2GO:功能基因组学研究中用于注释、可视化和分析的通用工具。生物信息学。2005;21:3674-6。
- 68。
基于RNA-Seq的哺乳动物转录组的定位和定量研究。Nat方法。2008;5:621-8。
- 69.
Audic S, Claverie JM。数字基因表达谱的意义。基因组研究》1997;7(10):986 - 95。
- 70.
张旭,廖敏,常东,张飞。盐胁迫下甘蓝星科植物的转录组比较分析。BMC Res Notes. 2014;7:927。
确认
我们要感谢北京基因组研究所为Illumina测序中华秋葵愈伤组织。
资金
北京市自然科学基金项目(No.7154216);国家自然科学基金项目(No. 81503262);BSJJ201607)。
数据和材料的可用性
不适用。
作者的贡献
XHW进行了差异基因表达分析,QRT-PCR并起草了稿件。BWG鉴定和推测来自盐处理的2-(2-苯基乙基)铬A.sinensisCalli,并对结果进行统计分析和可视化。XL、ZXZ、HYF为稿件的编辑和修改提供了建议。XJD, ZL, WJ参与RNA-Seq分析。石世波和涂鹏飞发起了这个项目,并全程监督工作。所有作者阅读并批准了最终的手稿。
作者信息
隶属关系
相应的作者
伦理宣言
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
同意发布
不适用。
伦理
不适用。
额外的信息
王小惠、高博文为第一作者。通讯作者:石淑波、涂鹏飞
附加文件
附加文件1:表S1。
单基因的长度分布。(多克斯18 kb)
附加文件2:图S1。
基因本体(GO)功能富集分析。共53514个配对的unigenes被分为生物过程、细胞成分和分子功能三类。(PPTX 165 kb)
附加文件3:图S2。
所有unigenes序列的COG功能分类。29 387份(31.59%)转录本与COG数据库中的序列具有显著相似性,并被聚类为25个类别。(PPTX 213 kb)
附加文件4:表S2。
所有unigenes的KEGG分析。(XLSX 17 kb)
附加文件5:表S3。
盐处理愈伤组织24h差异表达基因的KEGG分析(XLSX 20 kb)
附加文件6:表S4。
盐处理愈伤组织120h差异表达基因的KEGG分析(XLSX 19 kb)
附加文件7:表S5。
26个候选基因的特异性引物。(XLSX 15 kb)
附加文件8:表S6。
受体激酶、MAPK通路及Ca相关差异表达基因的数量2+信号通路。(多克斯22 kb)
附加文件9:表S7。
与转录因子相关的差异表达基因的数量。(多克斯20 kb)
附加文件10:表S8。
参与2-(2-苯基乙基)色素生物合成的差异表达非基因的数量。(多克斯19 kb)
附加文件11:图S3
III型PKSs的系统发育树分析。采用邻居连接算法构建树,并采用1000次重复的自举分析方法对树的可靠性进行测量。该刻度表示每个位点的0.05个氨基酸替换量。(PPTX 150 kb)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
王旭东,高斌,刘旭东。et al。盐胁迫诱导2-(2-苯基乙基)色素的产生,并调节涉及信号转导的新型应答基因中华秋葵愈伤组织。BMC植物杂志16,119(2016)。https://doi.org/10.1186/s12870-016-0803-7
收到了:
接受:
发表:
关键字
- 中华秋葵
- (2) - 2-phenylethyl色酮
- 盐度的压力
- 转录组差异表达基因
- 信号转导