抽象的
背景
MicroRNAs (miRNAs)是一类小的非编码内源性rna,在植物生长发育以及生物和非生物胁迫反应中发挥着多种关键作用,在转录后调控基因表达。mirna在石榴果实发育过程中的作用和认识尚未深入研究。
结果
石榴在皮肤和假种皮中积累了大量的花青素,对人体健康很有价值,主要是由于其抗氧化性能。在这项研究中,我们从幼苗到成熟果实的聚合RNA样本中建立了一个小RNA库,并从29,948,480个高质量reads中鉴定了保守的和石榴特异性的miRNA。在15- 30 nt的小rna库中,约50%的小rna为24 nt, miR157家族数量最多,其次是miR156、miR166和miR168,每个家族都有变异。5 '端第1位碱基偏倚对大多数18 ~ 26 nt srna具有强烈的U偏好,对18 ~ 26 nt srna具有强烈的a偏好。此外,对于所有24-nt sRNAs,核苷酸U优先(97%)在第一个位置。采用茎环RT-qPCR方法,对主要mirna和新mirna在叶片、雄花和雌花以及多个果实发育阶段的表达进行验证;miR156、miR156a、miR159a、miR159b和miR319b在果实发育后期上调。miR156在果实发育后期的高表达可能通过降低SPL转录因子正向调控花青素的合成。新型mirna在不同组织间表达存在差异。这些新的mirna靶向不同的转录因子和激素相关调节因子。 Gene ontology and KEGG pathway analyses revealed predominant metabolic processes and catalytic activities, important for fruit development. In addition, KEGG pathway analyses revealed the involvement of miRNAs in ascorbate and linolenic acid, starch and sucrose metabolism; RNA transport; plant hormone signaling pathways; and circadian clock.
结论
我们的第一次和初步报告MiRNA将提供有关未来研究的石榴生化化合物的合成信息。新型miRNA的目标的功能需要进一步调查。
背景
石榴 (石榴L.),属内两种之一菲尼察,产生呼吸频率低的非更年期果实[1,是一种热带和亚热带吸引人的落叶灌木。石榴以前被归为石榴科,但最近的系统发育研究表明它属于石蒜科。它是最古老的可食用水果之一,虽然原产于伊朗,但自古以来就在伊朗和印度北部的喜马拉雅地区自然生长[2- - - - - -4].虽然石榴种植广泛,但五大石榴生产国是印度、伊朗、中国、美国和土耳其[5].
这种植物能适应各种土壤条件,在阳光和暖冬下生长良好。6].果实圆形或球形,具肉质管状花萼和坚韧的果皮,颜色常为深粉红色或深红色[7].果实的内部通过膜壁分离成堆叠的囊状结构,填充有肉质多汁的,红色,粉红色或染色纸浆,称为ariL,并且每个Aril囊含有一个白色或红色,角度,柔软或硬种子[6,7].
近年来,石榴因其药用特性和在人类饮食中的营养价值而广受欢迎。石榴是一种富含植物化合物的营养丰富的食物来源。它含有高水平的类黄酮和多酚,有效的抗氧化剂,可以预防心脏病和癌症。由于水果的可食用和不可食用部分都具有促进健康的特性,可以治疗广泛的人类疾病,如癌症、糖尿病、肥胖、阿尔茨海默病和高血压,石榴被认为是世界上重要的商业和有价值的水果作物[8,9].代谢组分析显示,石榴的果皮、果汁、根和皮、花、叶和种子等部分含有近40种生化化合物,在不同的治疗中都有益处[10].这些化合物包括没食子酸、鞣花酸、类黄酮、抗氧化剂、萜类和生物碱[11- - - - - -13].
包括阿兰斯的石榴果实的颜色从花青素的存在,水溶性黄酮类颜料的存在,大多是橙色到红色和紫色/蓝色[14].除了在植物防御机制中扮演重大作用[15],花青素被认为对人类健康有价值,因为它具有高的抗氧化活性[16和水果酸盐,石榴的可食用部分含有最高量的花青素[17].花青素产量的生化途径在许多植物物种中有很好的记录,含Chalcone合成酶,Chalcone异构酶和白藻藻啶蛋白[18].
在拟南芥中,花青素途径在转录水平上受到R2R3-MYB结构域、WD40重复和基本螺旋-环-螺旋(bHLH)等转录调控因子的调控[19- - - - - -21].WD40重复基因是拟南芥的功能同源物TTG1.参与调控石榴果实发育过程中花青素的生物合成[22].近年来,对红、白石榴花青素生物合成基因进行了克隆和表征[23],分析了石榴花青素生物合成关键调控基因的表达[24].
植物有两大类小型非编码调节rna。它们是小干扰RNA (sirna)和microRNAs (miRNAs),都是在Dicers或Dicer-like (DCL)的帮助下,由双链RNA前体生成20- 24 nt分子[25].植物发育和胁迫的许多基本方面是由miRNA家族控制的[26].大多数mirna由100-400 nt的基因编码,并由rna诱导的含Argonaute (AGO)蛋白的沉默复合物进一步加工。在加工结束时,根据AGO效应蛋白类型的存在,靶标可以在mRNA水平上被降解,也可以在翻译水平上被抑制[27].生物信息学分析显示至少21个保守的miRNA家庭,包括在Angiospers中的mir156,mir159和mir160。植物含有比保守的mirnas更不保守[28[高通量测序导致从不同植物物种(如葫芦,葡萄,大麦和苹果)的非保守MiRNA的发现[29- - - - - -34].mirna在不同作物的发育和胁迫反应中发挥关键作用,调控番茄花青素积累[35,氮素饥饿适应的调节拟南芥[36,以及棉花纤维的伸长率[37].
虽然石榴是一种具有许多药用特性的重要果实作物,但缺乏有关石榴麦芽糖的信息。在这项研究中,我们报告了MiRNA从幼苗对果蝇的分析,利用叶片,花朵和水果发育期间的特定miRNA的特定miRNA的表达分析。MiR157是MiRNA最丰富的miRNA,其次是MiR156,MiR166等。在不同的小RNA(SRNA)中,24个NT的最丰富。我们发现了28个新的miRNA以及预测的前体结构和参与途径。本研究的结果可以提供有价值的信息,以进一步揭示石榴中的监管作用。
方法
植物材料
发育果实的幼叶、雄花、雌花和假种皮(发育阶段I至VI在图中描述。1)were collected in 2014 from the cultivar ‘Al-sirin-nar’ grown in the USDA pomegranate germplasm collection at the Wolfskill experimental orchard in Winters, CA, USA (38°50’34.48“ N; 121°97’83.02” W), were immediately frozen in liquid nitrogen, and were finally stored at − 70 °C. For each tissue type, we have collected leaves, flowers, and fruits of different stages from three independent trees. And these three independent trees were considered as biological replications for stem-loop RT-qPCR experiments.
从成熟的果实中收集假种皮来种植幼苗
生理成熟的‘Al-sirin-nar’果实通过轻轻打开果实,在空气和水的帮助下提取假种皮,去除假种皮。将提取出来的石榴假种皮浸泡在冷水中,将水果中的其他成分全部洗掉。所有提取的假种皮都从水果的其他部分分离出来,保持它们的原始、完整和未被接触,然后清洗和风干。假种被播种在泥炭苔上以培育幼苗。
RNA提取
从10日龄幼苗中提取总RNA,如所述[38]通过使用Trizol试剂(Invitrogen,Carlsbad,Ca)和RNA Miniprep套件(Zymo Research,Irvine,CA)。使用改性的CTAB-LICL方法提取来自叶片,叶片,花和果实的总RNA [39].对于果实样品,我们只在所有发育阶段使用分离的假种皮。每个组织约200毫克的细磨样品在液氮中被用于提取。提取缓冲液I、II等溶液按建议配制[39].氯仿:异戊醇(24:1)和氯化锂步骤重复三次。最后将RNA颗粒溶解在40 μL无rnase水中。使用RNA Clean & Concentrator试剂盒,使用DNase I (Zymo Research, Irvine, CA)在柱上消化基因组DNA,纯化所有RNA样品。RNA完整性号> 8.0通过2100生物分析仪(安捷伦技术,圣克拉拉,CA)得到证实。对于整体miRNA转录组分析,从所有样本的三个生物复制中提取的等摩尔浓度的总RNA被汇集并发送给RNA测序。在茎环RT-qPCR中独立使用三个生物学复制的总RNA。
小核糖核酸测序
SRNA样品由北京基因组学院(BGI,香港)对illumina Hiseq 2000平台进行测序。SRNA文库和测序的构建包括以下步骤[40].After extracting the total RNA from the samples, sRNAs of 18 ~ 30 nt were gel-purified, 5’ RNA adapter-ligated and gel-purified, 3’ RNA adapter-ligated and gel-purified, then underwent RT-PCR and gel purification. Finally, the library products were ready for sequencing by using Illumina HiSeq 2000.
深度测序的sRNAs几乎涵盖了所有类型的RNA,包括miRNAs、sirna、piwi- interaction RNAs (piRNAs)、核糖体RNA (RNAs)、转移RNA (tRNAs)、小核RNA (snrna)、小核仁RNA (snoRNAs)、重复相关sRNAs以及外显子或内含子的降解标签。基于高通量测序的sRNA数字化分析涉及到合成测序(SBS),可以减少由二级结构引起的核苷酸损失。该方法对小样本量、高通量、高精度的要求,操作简单的自动化平台,具有较强的鲁棒性。这样的分析从石榴RNA样本中产生了数百万个sRNA序列标签。
RNA-SEQ生物信息学分析和miRNA预测
测序后,原始序列读取(FASTQ文件)被处理为干净读取,然后过滤掉低质量的适配器污染标签,其余长度< 18 nt的读取被丢弃。通常,sRNA为18 ~ 30 nt (miRNA为21或22 nt;核,24元;及piRNA, 30元)。所有独特的干净reads,特别是非冗余的,被考虑进一步分析,包括非编码RNA鉴定和适当的注释。首先,通过BLASTall对Rfam (v10.1)和GenBank数据库进行搜索,确定了RNAs、小胞质rna (scRNAs)、snoRNAs、snrna和tRNAs等sRNAs的干净读本。利用SOAP2定位针对杨树基因组序列的sRNA reads,鉴定了mirna [41].使用内部过滤工具对SOAP2输出进行过滤,通过分析一个或多个完全匹配的对齐小rna块的映射模式,确定候选序列为miRNA前体[42].通过提出严格的标准来检查候选序列的二次结构[43].为了确定保守的miRNA,将清洁读数与沉积在miRBase的已知植物miRNA进行比较[44].那些不完全匹配的被认为是已知miRNAs的变种。其他未映射到已知miRNA和其他类型的srna的序列被认为是新的miRNA预测的未注释序列。为了获得miRNA预测的前体结构,使用TurboFold [45]http://rna.urmc.rochester.edu/RNAstructure.html)和指导和星序列获得。
目标预测,功能注释和途径分析
目标预测方法涉及加载miRNA以包含SRNA序列的快速格式文件读取,以搜索已知杨树的目标(杨树trichocarpa)抄本资料库,使用建议的规则[46,47].具体地,选择miRNA /靶双链体的标准为1)SRNA和靶之间的四个错配,2)小于miRNA /靶双链体中的两个相邻的错配,3)在miRNA的位置2-12中没有相邻的错配/t一个rget duplex (5’ of miRNA), 4) no mismatches in positions 10–11 of the miRNA/target duplex, 5) less than 2.5 mismatches in positions 1–12 of the miRNA/target duplex (5’ of miRNA), and 6) minimum free energy (MFE) of the miRNA/target duplex ≥74 % of the MFE of the miRNA bound to its perfect complement. To investigate the putative functions of potential target genes, the target sequences from poplar were annotated by using the databases Gene Ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) Orthology (KO) [48,49].氧化石墨烯的结果被分为三个独立的组:细胞成分,分子功能和生物过程。KO通路分为不同的代谢功能和信号转导。
茎环RT-QPCR验证miRNA变体和新型miRNA
利用茎环RT-qPCR方法,确定mirna及其变异在叶片、花朵和果实发育阶段的差异表达。将大约1 μg无dna总RNA与6个miRNA家族和6个新miRNA的miRNA特异性茎环RT引物杂交,并使用Superscript III试剂盒(Thermo Fisher Scientific, Waltham, MA USA)将杂交分子反转录成cdna。设计成熟miRNA序列的正向miRNA特异性引物和茎环序列的通用反向引物(附加文件)1:表S8)。对于每次反应,混合1μLcDNA,10μL2X快速Sybr Green(Roche)和引物。PCR延伸为95℃,10s,60°C,30°C,具有斯蒂莫普满正日PCR系统(应用生物系统,福斯特城,美国,美国)。在所有三种生物复制中,miRNA的表达被标准化为叶片中的叶片。5.8S核糖体RNA作为参考,以计算2的相对基因表达——ΔΔCt方法(50].
结果与讨论
石榴果含有多种天然化合物,如酚类、生物碱、萜类和脂肪酸,并在许多健康促进活动中发挥作用[51].果皮果皮和基果果皮都用于提取天然化合物,如瞳孔(内脏酸和葡萄糖的衍生物)和花青素(对粉红色的粉红色的水溶性酚醛化合物类)[52].许多报道都描述了石榴天然产物对人类的益处,但缺乏基因组信息是石榴基因组研究的主要瓶颈。在本研究中,我们分析了石榴中保守的和新的mirna,并讨论了它们不同的生化途径。
果实发育和组织收集
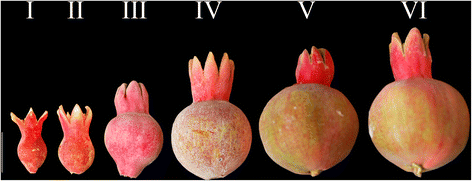
石榴果实发育分为不同的阶段。果实的生长模式取决于品种、地点和季节[53,54].我们将Al-sirin-nar的发育阶段划分如下(图。1):花期1,从开花期(花瓣脱落期)开始约8-10天;第2阶段,从第1阶段开始约10天(果实开始膨胀,但没有颜色变化);第三阶段,约12-15天后(果实膨胀更多,刚开始由红变绿);第4阶段,约15-18天后(果实由梨形扩展为圆形,由红色扩展为绿色);第5阶段,约15天后(果实继续膨胀,颜色继续由红变绿);第6阶段,约15天后(果实继续膨大,颜色继续由红色变为绿色),花萼仍为红色,称为“口红期”。从最初的花期到花期6需要75 - 85天的时间。第6阶段后,果实变得有光泽的红色,含有玫瑰粉色的假种皮,有甜的酸味。为了分析miRNA的总体表达,我们收集了不同时期的叶片、雄花和雌花以及果实组织。在整个果实发育阶段,果皮(暗红色褪色)和果实内部假种皮(暗红色积累)的颜色发展相反。 So, the anthocyanin is increasingly accumulating in arils during the later stages of fruit development.
在水果发育过程中,石榴积累了各种植物化合物[55]用作防御机制。可食用部分是果实的50%:40%和10%分别是基础和种子。Arils含有大多数水(85%),10%糖(葡萄糖和果糖),有机酸(柠檬酸,抗坏血酸,苹果酸)和生物活性化合物花青素(酚类和黄酮)[56].此外,种子皮含有6种糖苷,其中飞燕草苷-3,5-二葡萄糖苷是果汁中主要的花青素[57].果皮和假种皮的着色是果实品质的重要指标。与表示“奇妙”的深红色相比,Al-sirin-nar果皮是玫瑰红的,果皮的颜色和假种皮的颜色没有关系[2].
小rna的高通量测序和注释
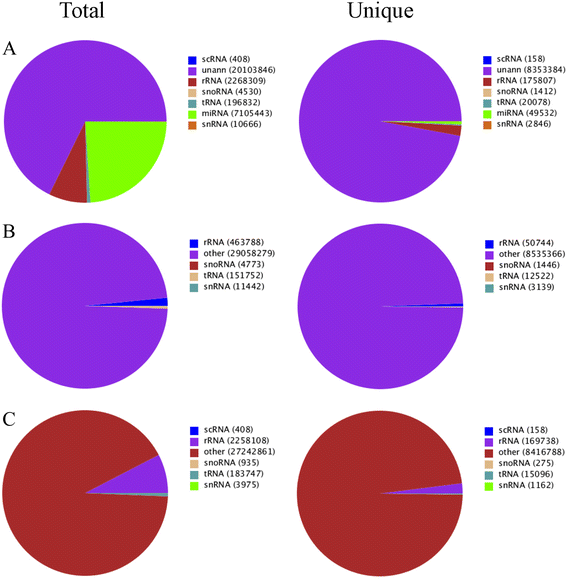
从幼苗和其他组织中提取总RNA,并将其汇集起来,建立一个小RNA库,用于进一步测序。使用Illumina HiSeq 2000生成约3000万条读取信息(见表2)1).在去除5 ' -和3 '适配器、插入空值、srna < 18 nt和poly A读后的2995万个高质量读中,99%获得了干净读。在所有类别中,共有8603217个(28.97%)是石榴所独有的。由于没有石榴基因组序列,而杨树是一种落叶开花树,具有完整的基因组信息,因此我们使用杨树基因组作为参考,利用SOAP2绘制clean reads [41].
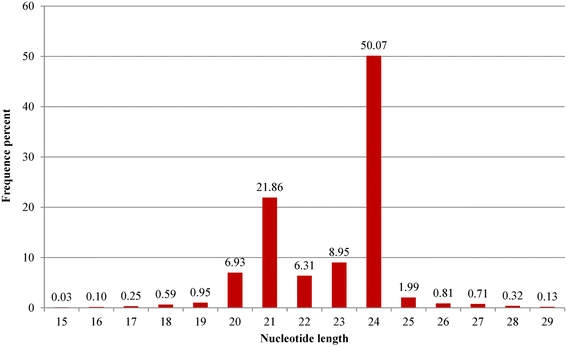
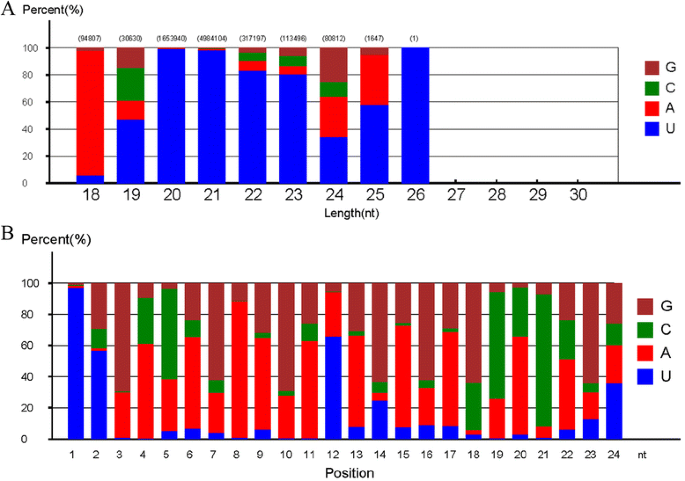
将约8.3%(2,480,745)的读取被映射到已知的非编码RNA,包括ScRNA,TrNAS,Snornas和SnRNA(图。2).在所有srna中,23.9%属于mirna, 0.7%是石榴特有的。然而,当与Rfam和GenBank数据库匹配时,每个类别的读取数量有所不同。特别是,GenBank中rRNA特异reads的数量较高(2,258 108),而Rfam中rRNA特异reads的数量较低(463,788)。在Rfam和Genbank数据库中,包括mirna在内的其他srna的数量或多或少是相似的(图2)。2 b, c).石榴中已知和新发现的小RNA片段最多为24 nt(~ 50%),其次为21 nt(21.8%)、23 nt(8.95%)、20 nt(6.93%)和22 nt(6.31%)。其他在15 - 29 nt之间的srna不明显丰富(图。3.;额外的文件2:表S1)。24-nt小rna也存在于许多植物物种中,如玉米、拟南芥、番茄、桶状三叶草和三叶橙[40,58- - - - - -61].因此,24nt小rna在石榴中也可能像在其他植物中一样参与关键功能。
石榴中保守mirna的鉴定
植物系统中的mirna可以通过检测发夹结构的一个臂内包含~21 nt序列的潜在折叠前体结构来识别。为了识别已知的miRNA并获得miRNA的数量,我们分别在石榴文库的第一个位置和每个位置上使用碱基偏差;sRNA标签的clean reads与储存在miRBase 20.0中的动植物的miRNA前体/成熟miRNA进行比对(http://www.mirbase.org)[62].结果提供了有关对准的信息,包括已知的miRNA前体,长度和计数的结构。来自我们图书馆的30名已知的miRNA家庭匹配mirbase,其中包含28,645名参赛作品(表2).对已知miRNA家族的读计数分析表明,不同miRNA家族的表达频率在4,015,427 - 511之间存在显著差异。已知的小于500 reads的miRNA家族被忽略。每个miRNA家族都有自己的变种。MiR157是最丰富的家族(4,015,427),其次是miR156(1,632 172)、miR166、miR168、miR167、miR535、miR169和miR390。石榴中mirna的变异量最多的是miR156,其次是miR157、miR159和miR160。这些mirna在石榴中显示了一些家族的变异,尽管计数较高(附加文件)3.:表S2)。
miR156和miR157由于序列相似性高、靶标保守,被归为一个家族。在包括拟南芥在内的不同作物中,已经证实了miR156/157切割Squamosa启动子结合蛋白样蛋白(SPL) [63]和米[64,65].在我们的研究中,MIR157是所有家庭中最大的MiRNA家族。这种发现与最近的梨果发育报告形成鲜明对比[66和花生[67,显示miR156含量最为丰富。MiR157在miR156/ MiR157之间可能有独特的靶标和共同的靶标。除了家族外,每个家族的变异也表现出差异表达。计算mirna的数量,并将其归一化到srna的总reads中。每个家族变异的总数差异很大。miRNA家族的miR157a、miR156、miR157b、miR156a、miR156g、miR159a和miR160b在我们的聚合石榴样品中表达量较高。相比之下,其他一些家族和变异表现得更少(附加文件3.:表S2)。每个家庭的丰富也各种各样。当从MiRBase预测miRNA时,不同的家庭成员与拟南芥,米饭,葡萄,杨树,玉米和大豆等不同植物的已知miRNA完全匹配。
石榴中新型mirna及其鉴定
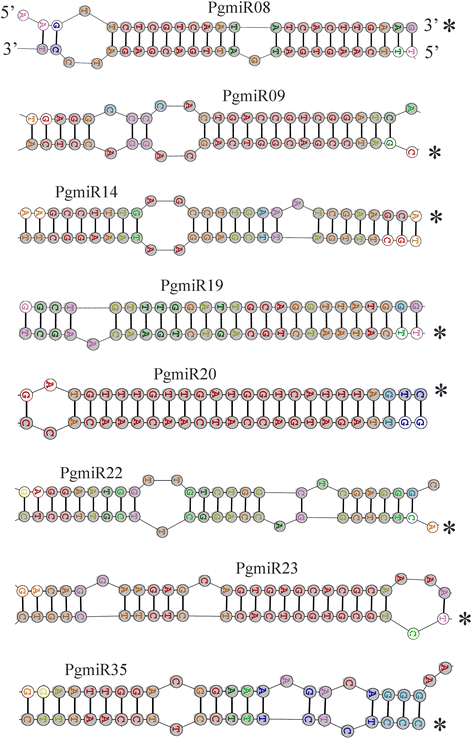
为了从石榴小RNA库中发现新的miRNA候选基因,我们使用MIREAP技术探索了miRNA前体的发夹结构特征。只有自由能最低、配对程度高的二级结构被纳入miRNA前体。形成发夹结构的前体为10个新mirna(表3.)预测,平均最小折叠自由能-55.82 kcal / mol,来自 - 73.1至-11.94 kcal / mol(附加文件4:表S3)。新型miRNA的计数范围为115(pgmir25)至4807(pgmir08)。新型miRNA的前体的长度范围为74nt(pgmir35)至336nt(pgmir20)。这个长度范围几乎类似于日本杏的新细胞miRNA前体[68].在10个mirna中,6个有5 '臂,4个有3 '臂。利用TurboFold从前体序列中提取预测的新miRNA候选miRNA的茎环结构(图)。4)[45].
新的miRNA预测总结为从每个位置的5'端和基部偏置的第一位置上的基础偏置(图。5).除了为18 - 18 nt 26-nt小rna,基本在第一个位置的偏差5 '端有强烈的偏爱U但不是g .核苷酸和主要占据第一位置基地18 - 20-nt小rna的偏见,分别同意基地偏见的结果acipenser schrenckii.[69[该范围内的miRNA的NONE显示G或C偏好(图。5;额外的文件5表S4)。尽管在20- 23 nt mrna中,80%以上的核苷酸U是首选的第一个碱基,但在21- 23 nt的新miRNAs中,碱基偏好显示出U在a、C和G之后的模式。对于24-nt mrna每个位置的核苷酸偏倚,总体而言,核苷酸A最普遍(37.7%),其次是G (30.3%), C(17.0%)和U(15.0%)。U在第1位和第2位的比例分别为96.9%和56.9%,与金线兰相似[70].24 nt sRNA标签中从1到24位的主要碱基位置为uugacagaagagcacagu(图1)。5 b;额外的文件6:表S5)。
不同组织中高通量RNA测序的验证
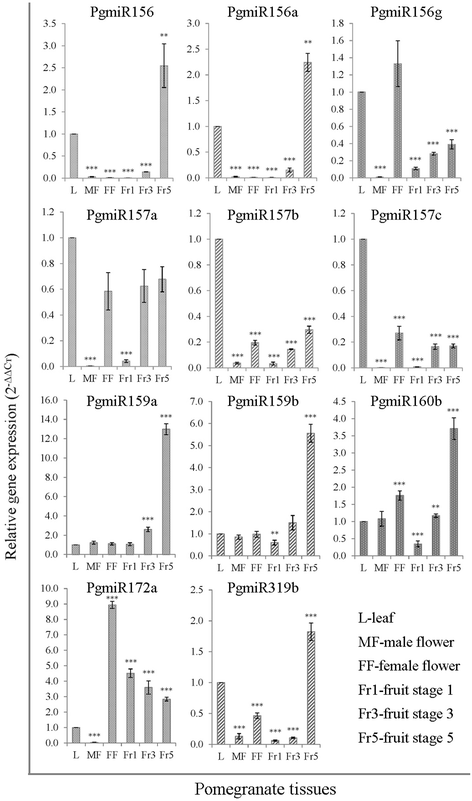
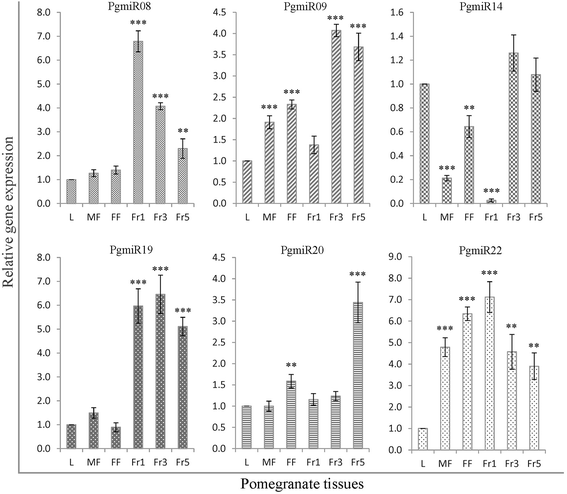
为了阐明mirna在石榴果实发育中的潜在作用,我们对已知和新的mirna的表达水平进行了分析。mirna在植物组织中广泛表达,在生理和发育过程中发挥多种关键调控作用[71].植物中大多数miRNA通过破坏其靶mRNA来调节发育过程,因为靶基因与miRNA完全互补[72].我们利用茎环RT-qPCR和独特的引物组合,验证了高表达miRNA家族(PgmiR156、PgmiR157、PgmiR159、PgmiR160、PgmiR172和PgmiR319)及其变异(PgmiR156a、PgmiR156g、PgmiR157b、PgmiR157c和PgmiR159b)在叶片、雄性和雌性花中的表达模式。不同果实发育阶段的石榴(图。6).该方法可以证实石榴miRNA的存在,并且还检测各种组织中miRNA的表达。我们发现跨组织的差异表达模式。MiRNA PGMIR156,PGMIR156A,PGMIR159A,PGMIR159B,PGMIR160B和MPGIR319B在水果发育的后期高度上调;PGMIR172的雌性花朵高,然后用果实成熟逐渐降低到较低水平。其他家庭成员在叶片和其他组织中普遍表达,包括水果。另外,我们验证了几个具有高计数读取的新型miRNA读取测序(图。7).它们在不同组织中的表达模式不同。新型mirna PgmiR08和PgmiR22在果实发育早期高表达,并逐渐向成熟期消退。有趣的是,PgmiR19仅在果实发育阶段表达,而在叶和花中不表达。这些差异表达的mirna可能在果实发育和成熟过程中调控不同的靶标。
MiRNA靶基因,基因本体学(GO)和KEGG途径分析预测
大多数miRNA的靶标在包括拟南芥、水稻、杨树和小麦在内的几种植物中都是保守的[73- - - - - -76].其中大多数是调控植物发育和植物激素信号转导的各种转录因子,包括SQUAMOSA启动子结合蛋白样(SPB/SPL) (miR156)、NAM (miR164)、MYB (miR159、miR172、miR319) [77].SPL是拟南芥miR156靶标之一[78],表达量与miR156呈负相关。SPL在果实发育早期miR156表达缺失的情况下大量表达,可能使MYB-bHLH-WD40复合物不稳定,从而抑制花青素生物合成途径,进一步积累[64].基于这一假设,由于SPL表达量的增加是花青素积累的负调控因子,在假种皮发育早期,随着黄酮醇含量的增加,石榴花青素含量可能仍处于可检测水平以下。但在成熟后期,SPL表达降低,花青素积累增多,PgmiR156表达增加。虽然这个结论还为时过早,没有对不同果期SPL的积累进行量化,但我们观察到PgmiR156/PgmiR157表达的增加可能对提高成熟石榴花青素、原花青素或单宁的水平有积极的作用。
为了更好地理解在石榴中鉴定的新型miRNA的功能,我们通过使用生物信息分析预测推定的候选基因[79,80].鉴定了总共288个靶基因,为十种新的miRNA,并找到了注释细节的基因本体(附加档案7:表S6)。与先前的报道一致,大多数新的miRNA靶属于植物特异性转录因子,(AP2,MYB,ARF,GRAS,PHD和BZIP),然后是代谢过程调节剂(蛋白激酶,LRR激酶,RLK,等等。)和激素信号传导。此外,还有几个其他目标,其功能在很大程度上是未知的。PGMIR08 ARFS,BHLH,SECY蛋白,TiR1 F箱和助枝素信号传导F-BOX2(AFB2)的靶标显示为根系和果实发育,花青素积累以及非生物应激。与更年性的水果(苹果,香蕉,番茄)相比,特别是对非更年期水果中的致荷尔蒙治疗的荷尔蒙治疗,如石榴,葡萄和草莓的荷尔蒙治疗[81],而且已经证明,在非更年期果实成熟过程中,即使是乙烯水平或呼吸作用也相当低[82].这可能是我们在我们的目标识别中没有找到任何主要乙烯途径候选人的可能性。花青素生物合成是在几个水果中发现并研究了参与花青素生物合成和调节的类黄酮途径和基因的分支,如苹果中的BHLH [83[桃子中的myb和bhlh [84].为了支持这一概念,ARF10在Pomegrante的花青素生物合成中起关键作用。Go(附加文件7表S6)显示,MYB转录因子作为PgmiR14、PgmiR22和PgmiR31的靶标,参与了果实发育和成熟过程中赤霉素、乙烯、水杨酸等多种激素信号通路[85].
此外,GRAS转录因子(PGMIR25)和核转录因子Y(PGMIR22),铜转运蛋白(PGMIR09),抗病蛋白TIR-NBS-LRR和LRR蛋白激酶(PGMIR31)是几种新的miRNA的靶标。最近,编码GRAS转录因子的基因被鉴定为果实发育期间miRNA的靶点,番茄成熟[86]和葡萄藤[87].此外,F-box家族蛋白在不同激素的信号转导途径中发挥着重要作用[88],在苹果成熟和果实成熟过程中鉴定出166个F-box基因[89].PgmiR08和PgmiR20靶向的一组F-box基因可能主要参与了促进果实成熟的生长素信号通路。在果实发育过程中,叶片中合成的蔗糖被运输到如果实等库组织中,直接用于代谢或转运到贮藏组织中,通过碳水化合物代谢合成主要贮藏产物[90.].蔗糖转运蛋白(SUT)的突变体专门影响番茄果和种子发展[91.].Sut2,PGMIR31的靶标和蔗糖中的关键球员:氢交与者活动,可能是正常水果发育中的关键球员。种子发展是果实成熟度和成熟的一部分,两者的发育同时发生。在石榴中,在基础内部的种子被果汁包围。由新型miRNA pgmir22和pgmir23靶向的核转录因子Y亚基A-1(NF-YA1),以及PGMIR31靶向的BZIP转录因子似乎涉及石榴果实中的种子成熟和休眠。
首先,果实衰老过程中组织完整性和细胞壁阳离子结合非常重要,果胶甲基酯酶(PME)活性改变了番茄成熟过程中的组织完整性[92.].作为一种普遍存在的植物酶,PME催化果胶的半乳糖醛酸甲酯脱酯化到其自由羧基,并被认为引起酯交换到醛基-糖交联[93.].PME在成熟的水果中涉及各种过程,包括纹理变化,形成脱落区和细胞壁生长,成熟和可伸展性。在旁边,倒转酶可能涉及蔗糖的长距离传输,参与韧皮载荷和卸载[94.].通过我们的转录组和GO分析,我们认为PgmiR31可以靶向植物转化酶/果胶甲基酯酶抑制剂来帮助果实成熟过程。总的来说,新microrna的已知和未知靶点参与了石榴果实发育和进一步成熟的过程。
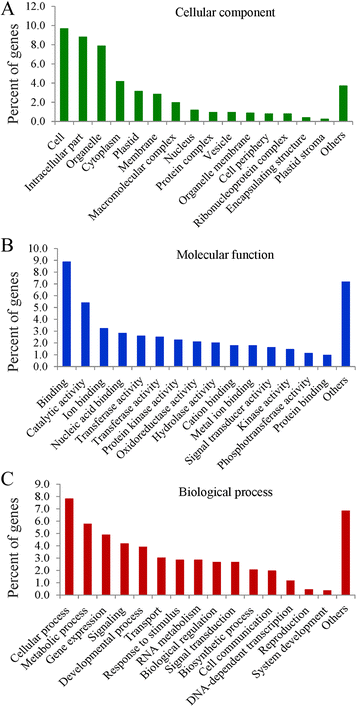
为了评估miRNA靶基因的潜在功能,我们对所有预测基因进行了GO分类,将其划分为三个独特的类别:细胞成分、分子功能和生物过程(图)。8).在细胞成分中,主要的类别是“细胞”,其次是“细胞内部分”和“细胞器”。在分子功能范畴中,主要分为“结合”和“催化活性”。在生物过程中,“细胞过程”和“代谢过程”是最丰富的范畴。代谢过程是果实发育的关键活跃过程[66[细胞过程和代谢过程是生物过程中的前两个GO类别。
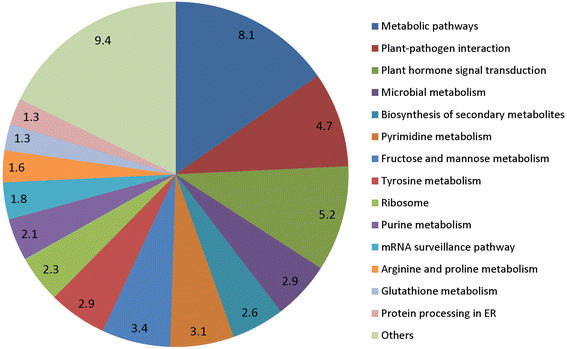
为了进一步评估miRNA转录组的完整性以及注释已知和新miRNA候选靶标的益处,我们使用KEGG通路组对所有来自杨树的注释序列进行了鉴定。共识别了629个来自多个KO路径的候选基因P价值和问- 来自kegg数据库的value(图。9;额外的文件8:表S7)。在淀粉合成、氨基酸合成、蛋白质合成、植物与病原体相互作用、激素信号转导等107个主要代谢途径中,共富集了41个miRNA家族。此外,次生代谢产物的生物合成、果糖和甘露糖代谢途径对果实成熟也有重要影响。为了支持KEGG途径参与石榴果实发育,先前的证据表明,石榴的可食用部分arils含有10%的总糖,包括果糖和葡萄糖、抗坏血酸、柠檬酸、酚类和类黄酮等生物活性化合物,主要是花青素[56].具体来说,新mirna被发现参与了多个途径的不同步骤(附加文件9图S1),包括抗坏血酸代谢(l -抗坏血酸转化为l -脱氢抗坏血酸)、脂肪酸代谢、碳固定(5-磷酸核糖转变为5-磷酸核酮糖)和RNA转运(通过调节核孔复合物和外显子连接复合物的成员)。更重要的是,新的miRNA成员参与植物激素转导途径,如生长素(调控基因)Tir1.,东盟地区论坛和阿富汗二月),cytokinin(CRE1和A-ARR)、赤霉素(德拉)、脱落酸(PP2C),芸苔类固醇(BAK1 / BRI1和BZR1/2)和茉莉酸(JAZ和MYC2).这些关键激素相关通路可能参与了成熟石榴果实中多种植物化合物的合成。KEGG通路分析显示14个候选基因参与果糖和甘糖代谢,1个参与碳固定,23个参与次生代谢产物的生物合成,4个参与蔗糖和淀粉代谢。综上所述,石榴果实品质受糖和酸组成的影响较大,糖和酸组成是果实发育最显著的特征之一。
结论
我们利用Illumina Hiseq2000对石榴进行小rna测序,鉴定出10个新的mirna。我们揭示了几种主要表达mirna及其变体在果实不同发育阶段的差异表达。这是第一个研究石榴sRNAs的报告,发现了大量已知和新的miRNAs。通过对杨树基因组的搜索,预测了10个新mirna的288个可能的靶基因,并利用GO和KEGG数据库对其进行注释,探讨其在不同代谢途径中的可能功能。我们揭示了几种果实发育途径,包括糖和酸以及植物激素信号。石榴中新型mirna的鉴定对进一步了解其他相关植物mirna的功能和调控机制具有重要意义。
参考
- 1.
石玉华,李玉华,李玉华,等。石榴果实的发育与成熟。acta Hortic science and Biotechnol. 1984; 59:265-74。
- 2.
荷兰d,哈布布k,酒吧ya'akov i.石榴:植物学,园艺,繁殖。:园艺评论。霍博肯,美国NJ 07030-5774:Wiley;2009.第127-191页。
- 3.
Rana J, Pradheep K, Verma VD。印度西喜马拉雅地区温带水果的自然发生的野生亲缘:一项分析。Biodivers Conserv。2007;16(14):3963 - 91。
- 4.
Singh NV,Abburi VL,Ramajayam D,Kumar R,Chandra R,Sharma KK,Sharma J,Babu Kd,Pal RK,Mundewadikar DM,等。遗传多样性及其与印度石榴微卫星标志物与园艺枯草和其他园艺重要性状的关联映射。摩尔。遗传。2015年基因组学; 290(4):1393-402。doi:10.1007 / s00438 - 015 - 1003 - 0.
- 5.
Da Silva Jat,Rana Ts,Narzary d,verma n,meshram dt,ranade sa。石榴生物学和生物技术:综述。SCI Hortic。2013; 160:85-107。
- 6.
Levin GM:石榴之路:一个被逐出伊甸园的苏联植物学家:石榴之路;2006
- 7.
莫顿摩根富林明。气候温暖的水果。迈阿密:摩根富林明莫顿;1987.ISBN: 0-9610184-1-0。
- 8.
Malviya S,JHA A,Hettiarachchy N.石榴剥皮提取物的抗氧化剂和抗菌潜力。J Food Sci Technol。2014; 51(12):4132-7。
- 9。
关键词:黑豆皮,石榴皮,氧化应激,高血糖医学杂志。2015;9(1):43-8。
- 10。
石榴是一种富含生物活性化合物的水果。BioMed Res Int. 2014;
- 11.
Ahmed MM, Samir E-SA, El-Shehawi AM, alkafy ME。塔伊夫和埃及石榴的抗肥胖作用:分子研究。生物化学学报。2015;79(4):598-609。
- 12.
Aslan A, Can Mİ, Boydak D.石榴汁的抗氧化作用酿酒酵母细胞生长。美国临床医学杂志。2014;11(4):14-8。
- 13.
石榴鞣花丹宁在体外抑制α-葡萄糖苷酶活性,降低淀粉消化率。中国食品科学。2015;66(1):85-92。
- 14.
Tanaka Y,Sasaki N,Ohmiya A.植物颜料的生物合成:花青素,玻璃苷,贝甲虫和类胡萝卜素。工厂J. 2008; 54(4):733-49。
- 15.
Koes R,Verweij W,Quattrocchio F.FlavOnoids:一种彩色模型,用于生化途径的调节和演变。趋势植物SCI。2005; 10(5):236-42。
- 16.
花青素:从植物到健康。Phytochem启2008;7(2):281 - 99。
- 17.
关键词:石榴,抗氧化活性,多酚,均质液农业食品化学学报,2007;55(23):9559-70。
- 18.
黄酮类化合物的生物合成。遗传学、生物化学、细胞生物学和生物技术的彩色模型。植物杂志。2001;126(2):485 - 93。
- 19。
李志刚,李志刚,李志刚。拟南芥植物的研究进展TT2基因编码一个R2R3 MYB结构域蛋白,该蛋白在种子发育过程中对原花青素积累起关键决定作用。植物细胞。2001;13(9):2099 - 114。
- 20.
Pelletier MK, Murrell JR, Shirley BW。拟南芥黄酮醇合酶和白花青素双加氧酶基因的特性(进一步证明“早”和“晚”基因调控差异)植物杂志。1997;113(4):1437 - 45。
- 21。
Shirley BW, Kubasek WL, Storz G, Bruggemann E, Koornneef M, Ausubel FM, Goodman HM。类黄酮生物合成不足的拟南芥突变体分析。植物j . 1995; 8(5): 659 - 71。
- 22。
Ben-Simhon Z,Judeinstein S,Nadler-Hassar T,Trainin T,Bar-Ya'akov I,Borochov-Neori H,Holland D.石榴(石榴L.)WD40重复基因是拟南芥的功能同源物TTG1.并参与在石榴果实发育过程中对花青素生物合成的调节。Planta。2011; 234(5):865-81。
- 23.
赵旭,袁志,冯丽芳:红、白石榴花青素合成基因的克隆与表达。acta botanica yunnanica(云南植物研究);2012;doi:10.1007 / s10265 - 015 - 0717 - 8.
- 24.
Rouholamin S,Zahedi B,Nazarian-Firouzabadi F,SAEI A.涉及石榴的花青素生物合成关键调控基因的表达分析(石榴l .)。SCI Hortic。2015; 186:84-8。
- 25.
汉密尔顿AJ,鲍库姆DC。植物转录后基因沉默中的一种反义小RNA。科学。1999;286(5441):950 - 2。
- 26.
利马JC,损失 - 莫拉斯G,Margis R. MicroRNA在植物开发期间发挥关键作用,并应对非生物胁迫。Genet mol Biol。2012; 35(4):1069-77。
- 27.
microRNAs的基因沉默:翻译抑制和mRNA衰减的贡献。中国科学:地球科学。2011;12(2):99-110。
- 28.
Axtell MJ,Bowman JL。植物微小RNA的演变及其目标。趋势植物SCI。2008; 13(7):343-9。
- 29.
Jagadeeswaran G,Nimmakayala P,Zheng Y,Gowdu K,Reddy UK,Sunkar R.来自四种不同葫芦属物种的叶子和水果小RNA成分的表征。BMC基因组学。2012; 13(1):1-13。
- 30.
Manohar S,Jagadeeswaran G,Nimmakayala P,Tomason Y,Almeida A,Sunkar R,Levi A,Reddy UK。不同葫芦属各种组织的新型和保守麦芽糖的动态调节。植物mol biol报告。2012; 31(2):335-43。
- 31.
Martínez G, Forment J, Llave C, Pallás V, Gómez G.黄瓜新保守mirna的高通量测序、鉴定和检测。《公共科学图书馆•综合》。2011;6 (5):e19523。
- 32.
Mica E, Piccolo V, Delledonne M, Ferrarini A, Pezzotti M, Casati C, Del Fabbro C, Valle G, Policriti A, Morgante M.高通量方法揭示初级microRNA转录本的剪接和成熟microRNA的组织特异性表达葡萄.BMC基因组学。2009;10(1):558。
- 33。
Schreiber Aw,Shi B-J,Huang C-Y,Langridge P,Baumann U.通过短读的深度测序发现大麦MiRNA。BMC基因组学。2011; 12(1):129。
- 34。
Liu Z., Liu Z., Liu Z., Liu Z., Liu Z., Liu Z., Liu Z., Liu Z.。基因组医学杂志。2012;13 (6):R47。
- 35.
Jia X, Shen J, Liu H, Li F, Ding N, Gao C, Pattanaik S, Patra B, Li R, Yuan L. Small tandem target mimai inhibitor介导的microRNA858对番茄花青素积累的影响。足底。2015;242(1):283 - 93。
- 36.
他H,Liang G,Li Y,Wang F,Yu D.源自目标重复的两种幼苗通过调节葡糖苷合成的调节介导氮饥饿适应拟南芥.植物杂志。2014;164(2):853 - 65。
- 37.
薛W,王z,du m,liu y,liu j-y。小RNA的基因组分析显示延长棉纤维细胞中的八种纤维伸长率和257个新微大RNA。BMC基因组学。2013; 14(1):629。
- 38.
Saminathan T, Nimmakayala P, Manohar S, Malkaram S, Almeida A, Cantrell R, Tomason Y, Abburi L, Rahman MA, Vajja VG等。二倍体和四倍体西瓜基因表达差异与选择性剪接。J Exp Bot. 2015;66(5): 1369-85。
- 39.
Zarei A, Zamani Z, Mousavi A, Fatahi R, Alavijeh MK, Dehsara B, Salami SA。从石榴种子中分离高质量RNA的一种有效方法。acta botanica yunnanica(云南植物研究). 2012;6:32-7。
- 40.
赵王T,陈L, M,田问张W-H。干旱响应microrna的鉴定Medicago truncatula通过基因组高通量测序。BMC基因组学。2011; 12(1):367。
- 41.
Li R,Yu C,Li Y,Lam T-W,Yiu S-M,Kristiansen K,Wang J. SOAP2:简短读取对齐的改进超快工具。生物信息学。2009; 25(15):1966-7。
- 42.
Kulcheski FR, de Oliveira LF, Molina LG, Almerao MP, Rodrigues FA, Marcolino J, Barbosa JF, Stolf-Moreira R, Nepomuceno AL, Marcelino-Guimaraes FC等。大豆非生物和生物胁迫新microrna的鉴定。BMC基因组学。2011;12:307。
- 43.
Meyers Bc,Axtell Mj,Bartel B,Bartel DP,BaulCombe D,Bowman JL,Cao X,Carchton JC,Chen X,Green PJ等。植物微稻草注释标准。植物细胞。2008; 20(12):3186-90。
- 44.
Kozomara A, griffith - jones S. miRBase:整合microRNA注释和深度测序数据。核酸Res 2010:gkq1027。
- 45。
Harmanci Ao,Sharma G,Mathews DH。TurboOdold:多RNA序列二次结构的迭代概率估计。BMC Biochem。2011; 12:108。
- 46。
Allen E, Xie Z, Gustafson AM, Carrington JC。植物中反式作用siRNA生物发生中的microrna定向阶段。细胞。2005;121(2):207 - 21所示。
- 47.
Schwab R, Palatnik JF, Riester M, Schommer C, Schmid M, Weigel D. microrna对植物转录组的特异作用。Dev细胞。2005;8(4):517 - 27所示。
- 48.
Ashburner M, Ball CA, Blake JA, Botstein D, Butler H, Cherry JM, Davis AP, Dolinski K, Dwight SS, Eppig JT。基因本体论:生物学统一的工具。Nat麝猫。2000;得分上以25 - 9胜过25(1):。
- 49.
KEGG:京都基因和基因组百科全书。核酸学报2000;28(1):27-30。
- 50.
Livak KJ, Schmittgen TD。利用实时荧光定量PCR技术分析相关基因表达数据-ΔΔct方法。方法。2001;25(4):402 - 8。
- 51.
鞣花丹宁对癌症的多靶点治疗。癌症。2008;269(2):262 - 8。
- 52.
Ismail T,Sestili P,Akhtar S.石榴果皮和水果提取物:审查潜在的抗炎和抗感染效果。J属植物。2012; 143(2):397-405。
- 53.
Ben-Arie R, Segal N, Guelfat-Reich S.“奇妙的”石榴的成熟和成熟。j。Soc。Hortic。Sci 1984。
- 54.
Gil MI, García‐Viguera C, Artés F, Tomás‐Barberán FA。石榴汁成熟过程中色素沉着的变化。中国农业科学。1995;68(1):77-81。
- 55.
Miguel Mg,Neves Ma,Antunes MD。石榴 (石榴一种具有无数生物学特性的药用植物——一个简短的综述。药用植物学报2010;4:2836-47。
- 56.
Viuda‐Martos M, Fernández‐López J, Pérez‐Álvarez J.石榴及其与人类健康相关的许多功能成分:综述。食品科学与技术,2010;9(6):635-54。
- 57。
关键词:石榴,果皮,种子,叶和花,总酚含量,抗氧化活性J Med Plants Res. 2012;
- 58。
Fahlgren N,Howell Md,Kasschau Kd,Chapman Ej,Sullivan Cm,Cumbie JS,Givan SA,法律TF,Grant SR,Dangl JL。拟南芥的高通量测序:MiRNA基因频繁出生和死亡的证据。Plos一个。2007; 2(2):E219。
- 59.
Li D, Wang L, Liu X, Cui D, Chen T, Zhang H, Jiang C, Xu C, Li P, Li s。《公共科学图书馆•综合》。2013;8 (1):e55107。
- 60.
Moxon S, Jing R, Szittya G, Schwach F, Pilcher RLR, Moulton V, Dalmay t。基因组研究》2008;18(10):1602 - 9。
- 61.
Song C, Wang C, Zhang C, Korir NK, Yu H, Ma Z, Fang J. Deep sequencing discovery of new and保守microRNAs in trifoliate orange (柑橘类三牛菇).BMC基因组学。2010; 11(1):431。
- 62.
Kozomara A, Griffiths-Jones S. miRBase:利用深度测序数据注释高可信度microrna。核酸Res 2013:gkt1181。
- 63.
吴刚,吴国华。植物生长发育的时间调控拟南芥通过miR156及其靶标SPL3.发展。2006; 133(18):3539-47。
- 64.
苟建勇,刘志杰,魏格尔,王建伟。mir156靶向的SPL转录因子对拟南芥花青素合成的负调控植物细胞。2011;23(4):1512 - 22所示。
- 65.
谢凯,沈军,侯旭,姚军,李旭,肖军,熊磊。miR156的逐渐增加对水稻叶片发育过程中多个基因的时间表达变化的调控。植物杂志。2012;158(3):1382 - 94。
- 66.
吴军,王东,刘艳,王磊,乔旭,张思生。梨果实发育和品质相关miRNAs的鉴定。BMC基因组学,2014;15(1):953。
- 67.
赵C-Z,夏H,Frazier TP,Yao Y-Y,Bi Y-P,Li A-Q,Li M-J,Li C-S,张B-H,王X-J。深度测序识别花生中的新型和保守的microRNA(落花生hypogaeal .)。植物学报。2010;10(1):3。
- 68.
高Z,Shi T,Luo X,张Z,庄W,王L.小RNA的高通量测序和日本杏雌岩发育中的差异表达微大血管分析。BMC基因组学。2012; 13(1):371。
- 69。
袁磊,张欣,李丽,姜辉,陈建军。鲟鱼microRNA转录组的高通量测序及表达分析。acipenser schrenckii..Plos一个。2014; 9(12):E115251。
- 70.
李X,金F,金湖,杰克逊A,MA X,Shu X,Wu D,Jin G.在开花两阶段中的小RNA转录om的表征和比较分析兰花ensifolium.BMC基因组学。2015;16(1):622。
- 71.
何丽,汉农GJ。MicroRNAs:在基因调控中发挥重要作用的小rna。[j] .中国科学(d辑:地球科学)2004;5(7):522-31。
- 72.
微rna在植物发育中的作用。咕咕叫医学杂志。2003;13 (21):R851-2。
- 73.
关键词:microrna,遗传算法,计算预测拟南芥.Genome Res。2005; 15(1):78-91。
- 74.
金伟,李能,张博,吴芳,李伟,郭安,邓铮小麦).acta botanica yunnanica(云南植物研究);2008;
- 75.
吕某,孙yh,蒋师傅。应力响应的microRNA杨树.工厂J. 2008; 55(1):131-51。
- 76.
朱建康。水稻内源小干扰rna的鉴定与特性研究。核酸学报2005;33(14):4443-54。
- 77.
刘强,陈永强。植物发育机制:mirna途径与植物激素反应的相互作用。生物化学学报。2009;384(1):1 - 5。
- 78.
Wang J-W, Czech B, Weigel D. mir156调控SPL转录因子的内源性开花途径拟南芥.细胞。2009;138(4):738 - 49。
- 79.
赖欧,Tomancak P,Williams Rw,Rubin Gm。果蝇微稻草基因的计算鉴定。基因组Biol。2003; 4(7):R42。
- 80.
Rhoades MW, Reinhart BJ, Lim LP, Burge CB, Bartel B, Bartel DP。植物microRNA靶标的预测。细胞。2002;110(4):513 - 20。
- 81.
Adams Ls,Seeram NP,Aggarwal BB,Takada Y,Sand D,Heber D.石榴汁,全石榴壳蛋白和瞳孔抑制结肠癌细胞中的炎症细胞信号传导。JAgric Food Chem。2006; 54(3):980-5。
- 82.
Seymour GB,Taylor Je,Tucker Ga。果实成熟的生物化学:DONDRECHT,荷兰:Springer科学与商业媒体;2012年。
- 83.
冯飞,李敏,马飞,程立军。遮荫果皮中花青素合成关键基因的表达及其代谢产物的影响。植物生理与生物化学。2013;69:54-61。
- 84.
Rahim Ma,Busatto N,Trainotti L.在桃子果实中的花青素生物合成的调节。Planta。2014; 240(5):913-29。
- 85.
Kumar R, Khurana A, Sharma AK。植物激素在肉质果实发育和成熟中的作用及其相互作用。[J] .机器人。2014;65(16):4561-75 .]
- 86.
Karlova R, van Haarst JC, Maliepaard C, van de Geest H, Bovy AG, Lammers M, Angenent GC, de Maagd RA。利用高通量测序和降解组分析鉴定番茄果实发育中的microRNA靶点。J Exp Bot. 2013;64(7): 183 - 78。
- 87.
Gremplet J,Agudelo-Romero P,Teixeira RT,Martinez-Zapater Jm,Fortes Am。葡萄牙葡萄牙Gras基因家族的结构和功能分析表明GRAS蛋白在控制发育和应激反应中的作用。边疆植物科学。2016; 7:353。
- 88.
F-box蛋白调控乙烯信号转导等。基因Dev。2009;23(4):391 - 6。
- 89.
崔慧荣,张志荣,徐建宁,王学勇。F-box蛋白编码基因的全基因组特征和分析马吕斯有明显基因组。中国生物医学工程学报。2015;29(4):1435-46。
- 90。
关键词:蔗糖,贮藏薄壁组织,维管束,蔗糖分配,ShSUT1足底。2005;220(6):817 - 25所示。
- 91.
Hackel A,Schauer N,Carrari F,Fernie AR,Grimm B,KühnC.蔗糖运输车LeSUT1和LeSUT2抑制作用对番茄果实发育有不同的影响。植物j . 2006; 45(2): 180 - 92。
- 92.
Tieman DM,Handa AK。降低果胶甲基酯酶活性改变成熟的番茄中的组织完整性和阳离子水平(Lycopersicon esculentum轧机)。水果。植物杂志。1994;106(2):429 - 36。
- 93.
被子植物生长细胞壁基质聚合物的交联。植物生理学报。1986;37(1):165-86。
- 94.
自由空间转化酶及其在韧皮部卸载中的作用。acta photonica sinica . 1980;93(1): 363-78。
确认
本项目由美国国家自然科学基金(USDA-NIFA)资助。2013-04023),并得到印度农业研究委员会(ICAR)的额外支持。作者感谢国家农业创新项目ICAR赞助了Nripendra V. Singh和Ramajayam Devarajan的访问。我们也非常感谢Jagadeeswaran大师对大幅度提高手稿质量的建议。
数据和材料的可用性
小RNA库和其他分析数据集的测序数据可在NCBI-GEO登录号GSE78498下获得。所有支持数据都包含在附加文件中。
作者的贡献
TS,PN和UR设计了研究并起草了手稿。使用不同的方法提取和清洁总RNA的TS,AB和NVS。NVS和RD从成熟的果实中提取了基础。ST分析并解释了RNA-SEQ数据。ST和AB进行了RT-QPCR实验。MJ和MA在各个阶段维持材料和收集组织。所有作者阅读并认可的终稿。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
同意发布
不适用。
道德
不适用。
作者信息
从属关系
相应的作者
附加文件
附加文件1:表S8。
本研究使用的引物为茎环RT-qPCR。(XLSX 10 kb)
附加文件2:表S1。
小RNA标签的长度分布和频率。(XLSX 10 kb)
附加文件3:表S2。
已知mirna变异总数。(XLSX 11 kb)
附加文件4:表S3。
小型miRNA列表,其具有发夹结构序列的前兆。(XLSX 10 kb)
附加文件5:表S4。
新mirna具有18- 26 nt小rna的第一核苷酸偏倚。(XLSX 8 kb)
附加文件6:表S5。
24nt小rna每个位置的miRNA核苷酸偏倚。(XLSX 9 kb)
附加文件7:表S6。
小说MiRNA的目标候选人名单。(XLSX 112 KB)
附加文件8:表S7。
不同的Kegg路径列表。(XLSX 19 KB)
附加文件9:图S1。
米尔纳斯参与的途径列表。(PDF 343 KB)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Saminathan,T.,Bodunrin,A.,Singh,N.v。et al。石榴microrna的全基因组鉴定(石榴通过高通量测序。BMC植物杂志16,122(2016)。https://doi.org/10.1186/s12870-016-0807-3
收到了:
接受:
发表:
关键字
- 石榴
- 微
- 茎环RT-QPCR
- 水果开发
- 高通量测序