摘要
背景
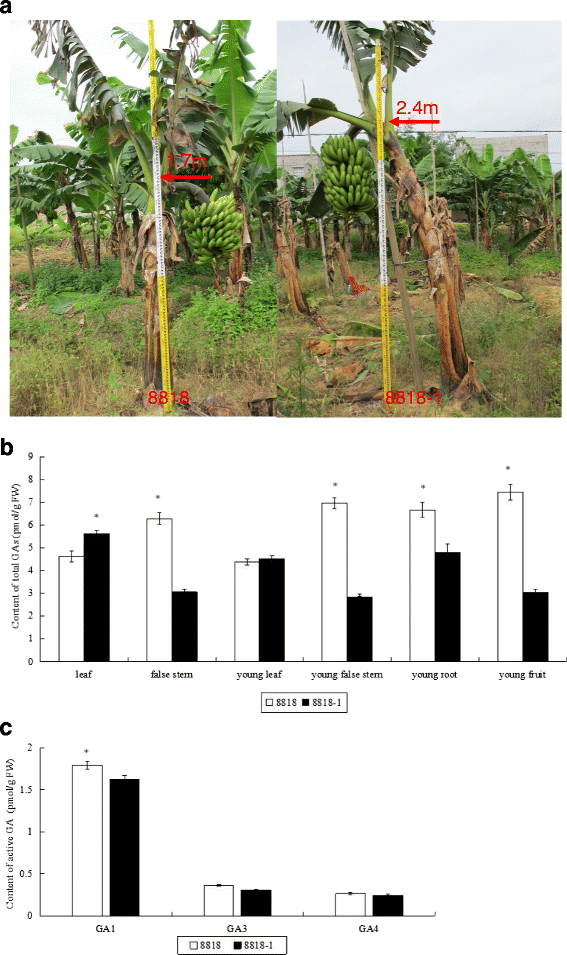
矮化是香蕉育种中最有价值的性状之一,因为半矮化品种具有良好的抗风雨害能力。这些品种具有栽培方便、管理方便等优点。通过EMS(乙基甲烷磺酸盐)诱变威廉姆斯香蕉8818 (穆萨SPP。AAA组)。我们的研究表明,在8818-1假赤霉素(气)的含量是茎比其父8818和矮型8818-1显著降低,可以通过外源GA的应用恢复3..虽然GA对8818-1矮人的型号产生了重要影响,但我们对香蕉矮人突变体发展期间对GA新陈代谢调节的理解仍然有限。
结果
基因组筛选揭示了36个候选GA代谢基因首次被系统地鉴定出来;这些基因包括3麦克斯,2mak,1Mako.,2MaKAO10.maga20ox.,4MaGA3ox, 14MaGA2ox基因。系统进化树和保守蛋白结构域分析显示序列保守和分化。GA代谢基因表现出组织特异性的表达模式。Williams香蕉早期GA生物合成基因在不同组织中均有组成表达,但有差异调控。GA氧化酶家族基因主要在幼果中转录,表明幼果是参与GA代谢最活跃的组织,其次是叶片、苞片,最后是接近成熟的果实。8818和8818-1之间的表达模式揭示了这一点maga20ox4.,maga20ox5., 和maga20ox7.的maga20ox.基因家族和Maga2ox7.,Maga2ox12., 和Maga2ox14的MaGA2ox基因家族在假茎中表现出显著差异表达和高表达水平。这些基因可能是调控8818-1假茎中GAs含量的原因。
结论
总的来说,通过对GA代谢基因的系统进化、组织特异性和差异表达分析,可以更好地理解GA调控香蕉的发育。目前的结果表明maga20ox4.,maga20ox5.,maga20ox7.,Maga2ox7.,Maga2ox12., 和Maga2ox148818和8818-1之间GA含量差异的主要调控基因。这些基因可能在香蕉的发育过程中发挥重要作用,但每个基因在不同的组织或发育阶段可能发挥不同的功能。
背景
耕地的香蕉的高度通常超过2米,并且其假茎在台风频繁地区容易被打破。矮人香蕉品种的股票建设可以在一定程度上抵抗台风损坏,提供培养方便,现场管理,劳动力储蓄,关闭种植等优势。矮种突变体是一种用于挖掘和研究矮化相关基因的有用材料。Banana Dwarf相关基因的鉴定和利用对于繁殖矮人香蕉品种具有相当大的意义。
我们通过EMS诱变威廉姆斯香蕉8818获得了Dwarf突变体'8818-1'。8818-1假茎的状况约为1.7米。威廉姆斯8818-1较强,熊较短的水果,并呈现与其父母8818相比的矮化特征。以前的研究表明,通过施用活性激素生物合成途径的相应外源性活性激素,可以恢复激素缺陷的矮种突变体被抑制或阻塞[1- - - - - -3.].而矮化突变体由于激素信号的吸收、转移、代谢调节基因的问题,可能会变得激素不敏感,相应的外源活性激素的应用不能恢复矮化[2,4].威廉姆斯香蕉矮化突变体8818-1假茎中总气体含量显著低于亲本8818,外源活性赤霉素GA可使8818-1的植株高度恢复3..因此我们推测8818-1可能是一个激素缺乏的矮化突变体。
天然气在植物生长和发展中进行基本功能,参与众多发育过程的调节,如种子萌发[5,6],茎伸长[7,叶伸展[8],花诱导[9],和坐果[10.,11.].减少活性气体含量导致植物表现出矮化表型。Ga生物合成途径在模型植物中很好地阐明,并且它们的相关突变体已被孤立[12.].气体是由香叶酰二磷酸盐生物合成的,一种常见的C20二萜前体。生物合成的酶,包括耳鼻喉科-copalyl二磷酸合酶(CPS),耳鼻喉科-kaurene合成酶(KS),耳鼻喉科-kaurene氧化酶(KO),耳鼻喉科-Kaureno酸氧化酶(KaO),Ga 20-氧化酶(Ga20ox),Ga 3-氧化酶(Ga3ox)和Ga 2-氧化酶(Ga2Ox)[12.,13.,可分为萜烯合成酶(TPSs),包括CPS和KS;细胞色素P450单加氧酶(P450),包括KO和KAO; 2-氧戊二酸依赖的双加氧酶(2ODDs),包括GA20ox、GA3ox和GA2ox。
参与GA代谢途径的早期步骤的CPS,KS,KO和Kao酶通常由单一或少数基因编码[14.].它们的突变体显示出严重的矮主义和生育能力丧失,可以在喷洒外源性活性气体后回收[15.- - - - - -19.].虽然许多植物中存在多种同源基因,但这些基因中只有一种参与Ga代谢途径。例如,水稻OSCP和OSKS样基因家族分别由3和11个成员组成,但只有OSCPS1和OSKS1负责ENT-Kaurene Biosynthesis [20.].
GA20ox、GA3ox和GA2ox是GA生物合成途径中催化后期反应的三种酶,属于2g - fe (II)加氧酶超家族。在许多植物物种中,酶是由不同的基因家族独立编码的[12.,21.],从而考虑到一定的功能冗余,以及组织特异性[22.].在植物中,这些GA氧化酶基因(GA2ox除外)功能的丧失可以产生矮化表型,通过外源GA的应用可恢复矮化表型[22.- - - - - -25.].例如,众所周知的绿色革命基因,SD-1,由丢失函数生成osga20ox2.大米(26.].相比之下,GA2ox降低了植物中活性GAs的水平,并使其过表达Ga2ox.基因可以导致侏儒型[27.,28.].
Ga新陈代谢基因已在真菌,细菌中鉴定出[29.),拟南芥30.- - - - - -35.)、大米(3.)、玉米(36.,大豆21.),南瓜37.豌豆[38.,39.], 黄瓜 [40], 葡萄藤 [41.],毛花瓣[42.],面包小麦[42.),而萨尔维亚米尔蒂希萨[43.),等等。目前国内外的研究大多集中在GA氧化酶基因家族的系统进化分析上,并开展了多个植物个体通路成员的基因功能研究。
以前的结果表明米饭(奥雅萨苜蓿)拥有8个GA20ox,2Ga3ox., 11Ga2ox.基因;Arabidopsis拥有5个GA20ox,4Ga3ox., 8Ga2ox.基因;和大豆(甘氨酸最大)包含8.GA20ox,6Ga3ox., 10Ga2ox.基因(21.].这些GA氧化酶基因表现出独特的表达模式,并在不同器官,组织和植物的发育阶段进行不同的发育功能[21.,22.,33.,35.,44.].例如,AtGA3ox1和AtGA3ox2在营养生长期间负责生物活性GA生物合成,而AtGA3ox1,AtGA3ox3, 和AtGA3ox4对生殖器官的发展很重要[22.,33.].在5AtGA20ox基因,ATGA20Ox1,ATGA20Ox2., 和ATGA20OX3占主导地位的常见性是[35.].ATGA20OX3是功能上多余的吗ATGA20Ox1和ATGA20Ox2.,而ATGA20Ox4.和Atga20ox5.在大多数发展阶段扮演次要角色[35.].在水稻中也观察到不同的表达和不同的发育功能[3.,21.,45.,46.].此外,若干但不是全部,GA代谢基因的转录水平受到反馈控制[30.,47.- - - - - -49.].控制包括抑制几种Ga0ox和Ga3ox基因的表达水平,以及几种Ga2Ox基因的激活[12.,22.,27.].
Banana在2012年完成了基因组测序[50.,但有关香蕉GA代谢的相关信息有限。香蕉A基因组中GA代谢基因的数量及其系统进化、功能、组织特异性和表达时机尚未得到证实和探索。为了了解GA代谢基因在香蕉A基因组中的分布和系统进化,我们搜索了香蕉基因组中心和国家生物技术信息中心(NCBI)中所有的GA代谢基因。对这些基因系统进化的初步分析为香蕉GA代谢基因的研究奠定了基础。Williams banana 8818和8818-1中GA代谢基因的表达水平以及调控GAs含量的主要基因尚不清楚。为了阐明8818-1矮化表型的可能原因,我们分析了8818和8818-1的组织特异性,并比较了7种编码早期GA生物合成基因和GA氧化酶基因的基因表达差异。这些结果提高了我们目前对香蕉GA代谢途径的认识,并有助于其他具有重要农业意义的密切相关物种的研究。
结果
气体含量分析和外源性GA3.申请治疗
在该领域,与父母8818相比,成年人8818-1植物呈现更强,短的假茎和较短的果实(图。1A).气体总量在威廉姆斯8818及其突变体,8818-1的不同组织来确定。结果如图2所示。1B..此外,在叶子,在8818-1大多数组织总气体含量比不同发育阶段的中低8818。虚假的总气体含量在青年和成年发育阶段8818分别为113%和145%,比那些在8818-1较高,茎。在8818幼果和根的总气体含量也高于8818-1显著较高。无论是成年或苗期,8818-1假的气体总量茎比8818.气体被显著降低有几种形式,其中许多是无效和中间体,以及只有少数是活动的形式,即GA1,Ga3.和遗传算法4.那么GA的含量1,Ga3.和遗传算法4在8818和8818-1的假茎中确定(图。1C).结果表明ga18818-1假茎的三种活性GA含量均低于8818。其中GA的差异18818和8818-1之间的内容显着。假茎与植物身材密切相关;因此,8818-1显着短于8818,这可能是由于前者的气体含量下降,特别是ga1内容。
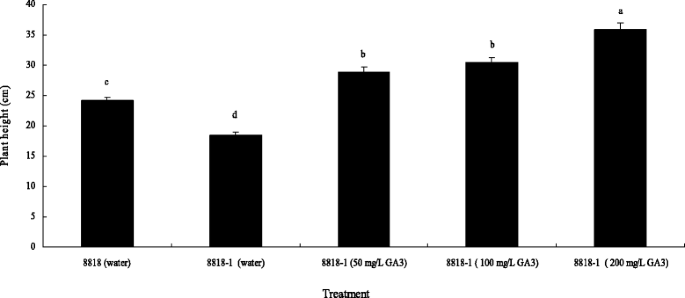
外源GA3.(50,100和200 mg / L)申请于8818-1进行;在该实验中,使用水作为对照。结果表明,所有三种浓度的治疗可以将植物高度恢复为8818-1至8818℃甚至更高(图。2).GA.3.施加在8818-1的剂量依赖性效果;浓度越高,较快的假茎在50-200mg / l ga范围内伸长3..
考虑到气体含量测定及株高恢复的结果,我们可以推测的8818-1的侏儒症可以通过减少气体含量的假茎造成的。
香蕉GA代谢推测基因的分离
以鉴定编码7种GA代谢酶在香蕉A基因组的基因,我们筛选所有可用的香蕉氨基在香蕉基因组集线器和NCBI酸序列。香蕉A基因组进行测序,发表在2012年测序基因型是双单倍体(2n = 22, 1C = 523 Mb) from theMusa Acuminata.(基因组)无性系种群。Malaccencis DH-Pahang [50.].三CPS样基因(麦克斯1-3),2ks.样基因(mak1-2),2-kao-喜欢基因(MaKAO1-2),1ko-就像基因(Mako1.), 10Ga0ox-喜欢基因(maga20ox.1-10),5GA3ox -喜欢基因(maga3ox1-3), 15Ga2ox-喜欢基因(MaGA2ox1-15搜索)。在香蕉A基因组中,38个候选基因分布在所有11条香蕉染色体和1条随机染色体上(见表1)1;附加文件1).我们根据染色体中的位置命名基因。
早期GA生物合成基因
我们在Banana基因组中心搜索了两个类似CDNA序列(MACPS2和MACPS3)和一个CPS样(MACPS1,GSMUA_ACHR8T31500_001)片段序列,然后在NCBI中搜索了MACPS1的完整cDNA序列。三种基因均位于染色体8.MAMPS1,分别呈现98.54和84.27%的IMP和MACPS3和MACPS1,2,2和3的同一性,显示45.38,4.82和48.71%的奥斯普斯(OS02G0278700)。在NCBI中,BLAST分析显示MACPS 1,2和3显示与CP的最高相似性凤凰dactylifera和74%,72%和76%的身份与PdCPS。
在NCBI中搜索了两种类似的CDNA序列。两个序列位于染色体10上,共用62.70%的同一性。在NCBI,Mak-Like揭示了与KS的最高相似性Elaeis guineensis(77%和78%的身份),但与OsKS共享的身份仅为41.6%和31.52% (Os04g0611800)。在NCBI和Banana Genome Hub中,我们发现只有一个MaKO-like基因,位于第6染色体,与KO的相似性最高凤凰dactylifera(77%)和62.50%的同一性与OSKO / CYP701A(D35)(OS06G0570100)。两种makao样基因位于染色体3和10中,彼此共用75.16%的同一性,最大相同kao.的凤凰dactylifera(79和76%),分别与OSKAO / CYP88A5(OS06G0110000)分别为62.33和67.38%的同一性。
GA氧化酶基因(GA20Ox,GA2OX和GA3OX)
Ga20ox,Ga3ox和Ga2ox是催化Ga生物合成途径中的后期反应的三种酶。这些酶属于2-氟(II)氧酶超家族,由多烯家族编码[12.].在香蕉A基因组中发现了10个ga20ox样基因;而GA20ox基因在拟南芥和水稻中分别有5个拷贝和8个拷贝[21.,43.].10个ga20ox样基因位于第2、4、6、7、8和11号染色体上1).在米饭,osga20ox2.被报道为水稻绿色革命基因,以前被称为Semi-Dwarf1 (SD1) [51.];损失osga20ox2.可以产生矮化表型。推测的香蕉MaGA20ox2氨基酸序列(GSMUA_Achr4T16380_001)与OsGA20ox2/SD1同源性最高(68.65%);MaGA20ox4 (GSMUA_Achr7T08230_001)与该基因的同源性仅为40.76%。
五GA3ox样的基因进行了检索香蕉基因组中心。然而,四个GA3ox基因进行了检索NCBI。四GA3ox样的香蕉基因组中心基因分别匹配4个GA3ox基因NCBI搜查BLAST。同时,MaGA3ox1(GSMUA Achr1P03100)显示用香蕉GA20ox基因在NCBI BLAST X 100%的一致性。系统发育分析还显示,MaGA3ox1被分组为单进化枝和具有与水稻,玉米,和拟南芥的基因GA3ox一个遥远的亲缘关系。因此,GSMUA Achr1P03100在香蕉基因组中心的注解应予以修订。相比之下,GA3ox基因都有两个副本四份已报道在拟南芥和水稻分别为[21.,43.].来自的遗传证据d18突变体(有缺陷OsGA3ox2)证明了OsGA3ox2是必不可少的,丧失功能OsGA3ox2/ D18可以产生矮化表型。与该基因显示59.66,57.26,56.85和56.67%的4个GA3ox样基因(Maga3ox2-5)。
十五GA2ox样的基因进行了检索香蕉的基因组。通过比较,GA2ox基因的7组11份已报道在拟南芥和水稻,分别[21.,43.].将十五个Ga 2ox样基因分布在染色体的其余部分,除了染色体1,2,5。然而,NCBI的Blast X显示,Maga2ox2(GSMua_achr4T00800_001)与...共享100%的身份Musa Acuminata.可能是2-氧戊二酸依赖性双加氧酶基因。GA氧化酶基因系统发育分析表明,MaGA2ox2与其他GA2ox基因具有较远的亲缘关系。因此,我们推测MaGA2ox2属于2g - fe (II)加氧酶超家族,而不是GA2ox家族。
香蕉及其他植物GA代谢基因的系统发育树及保守蛋白结构域分析
早期GA生物合成基因
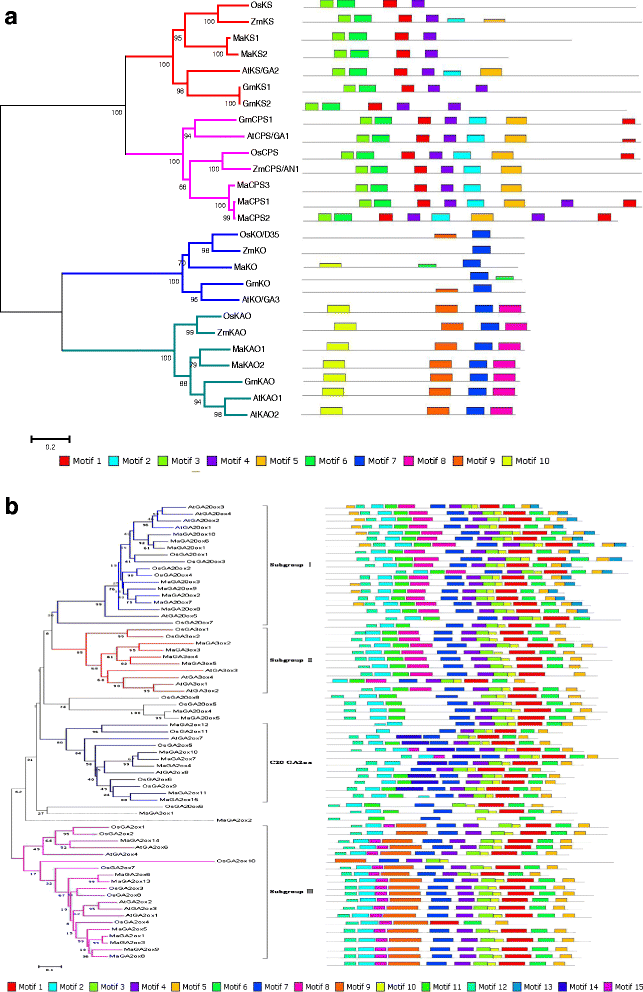
二萜酶(CPS和Ks)和Cyt p450单氧基酶(Ko和Kao)的系统发育分析(图。3A)香蕉,水稻,玉米,大豆和拟南芥的氨基酸序列(附加档案2)显示CPS,Ks,Ko和Kao蛋白可以分为单子叶和二脚孔组。这一发现与单码植物的香蕉,米饭和玉米一致。单子宫组被细分为两个亚组;米和玉米被分组在同一思想家,而香蕉与单胞植物中的稻米和玉米呈现遥远的遗传关系。在NCBI,爆炸分析表明Elaeis guineensis和凤凰dactylifera与香蕉共享最高的相似性。系统发育分析表明,三种CPS样蛋白质高度相似并在同一地形中分组;此外,属于Cyt P450单氧基酶的两种KS样和KaO样在同一液体中被分组(图。3A).
GA代谢基因的系统发育关系和保守蛋白质基序分析。一个早期GA生物合成基因(MaCPS,MAKS,MAKO和MaKAO)。bGA氧化酶基因(Maga20ox,Maga3ox和Maga2ox)。嘛,Musa Acuminata.;在,拟南芥蒂利亚纳;卫生,奥雅萨苜蓿;通用汽车,甘氨酸最大;Zm评选,玉蜀黍。本研究中引用的蛋白序列登录号见附加文件2
保守结构域的分析(图3A)显示所有CPS都拥有相同的主题1、2、3、4、5和6,而KS拥有主题1、3、4和6。因此,我们推测蛋白质结构域1、3、4和6是二萜环化酶特异的。CPS与KS的不同之处在于具有保守的基序2和5。花王仅保存了7、8、9和10,表明了进化保护。KO只有motif 7,这在所有Cyt p450依赖的单加氧酶中都是常见的。
GA氧化酶基因
为了鉴定香蕉,拟南芥和水稻的Ga氧化酶基因的进化关系,我们基于Ga20ox,Ga3ox和香蕉,拟南芥和稻米的Ga2Ox蛋白序列构建多序列比对(附加文件2).通过使用邻居连接(NJ)方法根据对准结果建立进化树(图。3B.).系统发育分析表明,大多数GA氧化酶基因可以主要分成四个亚组(I,II,III和C20 Ga2Ox)。亚组I,II和III清楚地对应于Ga20Ox,Ga3Ox和Ga2ox的功能的差异。Ga20ox和Ga3ox可以促进活性Ga的产生,而Ga2ox灭活Ga,从而调节植物中的GA含量[21.].
进化树显示,GA水稻,拟南芥的氧化酶,和香蕉比对方更类似于它们各自的同源物各亚组内。这一发现表明的GA氧化酶基因的扩张这个蛋白家族的进化早期出现。GA3ox属于一个小的基因家族比GA20ox和GA2ox。GA3ox基因的四,二,四份在拟南芥,水稻,香蕉分别被发现。相比之下,图5,图8,和GA20ox基因的10个拷贝和7,图11,和在拟南芥,水稻,香蕉和分别被发现GA2ox基因的14份,。这一发现表明,GA3ox基因家族是超过GA20ox和GA2ox家庭保守。此外GA20ox和GA3ox通过一个相对小的距离(图分开。3B.),而Ga2ox位于这些基因的远离这些基因。
几种Ga20ox和Ga2ox的同源序列显示出低序列同一性,并且某些分支公开了明显的发散,并且没有聚集在一起。六个Maga2ox基因(maga2ox4,maga2ox7,maga2ox10,maga2ox11,maga2ox12和maga2ox15)未出现在亚组I,II和III中。这些基因构成了具有OSGA2Ox5,OSGA2Ox6,OSGA2OX9,OSGA2OX11,ATGA2OX7和ATGA2OX8的单独的分支,显示与其他GA2OX蛋白的相似性较小。先前的结果已经验证了OSGA2Ox5,OSGA2Ox9,OSGA2Ox6,OSGA2OX11,ATGA2OX7和ATGA2OX8属于C20 GA2OX [21.,45.].因此,六种Maga2ox基因也可以属于C20 Ga2Ox。
发现C20 Ga2Ox对C20-GA前体(分别将GA12和GA53转换为GA110和GA97),而不是C19-气体,从而降低有源GA水平[21.,34.].例如,OSGA2OX9已被验证以失活生物活跃GA1,从而抑制细胞生长[44.],类似于亚组III中的成员。水稻中野生型或改性C20 Ga2Ox的过度表达可以产生半矮种类型,增加根系和更高的分蘖数[45.].C20 Ga2ox从系统发育树中的C19 Ga 2Ox分裂(图。3B.)但Ga氧化酶中编码序列的关键功能区域较小(图。3B.).C20 GA2ox不仅存在于水稻、拟南芥和香蕉中,也存在于其他植物中,如菠菜中的SoGA2ox3 [45.来自大豆的Gmga2ox4 [21.].在香蕉,六个C20 GA2oxs被发现,这表明C20 GA2ox可能是植物代谢GA普遍。
此外,在四个亚组中,几种GA氧化酶如OSGA20Ox5,OSGA20Ox6,OSGA20Ox7,OSGA20Ox8,Maga20Ox4和Maga20Ox5没有出现,并且与Ga Ol 40ox没有聚集在一起,这意味着Ga20Ox基因可能具有更复杂的进化。
蛋白结构域2、3、4、5、6、7和12在大多数GA20ox、GA2ox和GA3ox基因中是共同的。我们发现蛋白结构域13是亚群I所特有的,而亚群III所特有的蛋白结构域9和15。蛋白结构域14仅被C20-GA2ox所包含,而亚群II不包含特殊的蛋白结构域,表明C20-GA2ox在进化过程中具有更大的保守性。蛋白结构域8仅存在于亚群I和亚群II中;这一结构域在III亚群和C20-GA2ox中缺失。C20-GA2ox不具有存在于I、II、III亚群中的蛋白结构域10。这些特殊的母题可能是功能差异的原因。
三种GA氧化酶基因中GA20ox和GA2ox的基因数量均大于GA3ox,且在系统发育树中具有相当长的分支。这些结果表明GA20ox和GA2ox比GA3ox进化得更快。GA20ox和GA2ox表现出更动态的进化路径,从而产生更大的功能冗余。此外,更多GA20ox和GA2ox的拷贝可能导致进化过程中选择压力的放松或约束的放松。亚群I, II和III包含单子叶和双子叶蛋白。这种进化关系表明GA20ox/GA3ox/GA2ox蛋白的每个亚群都可能在单子叶植物和双子叶植物之间进行同源功能杂交[21.,28.,52.].
威廉姆斯香蕉GA代谢基因的组织特异性分析
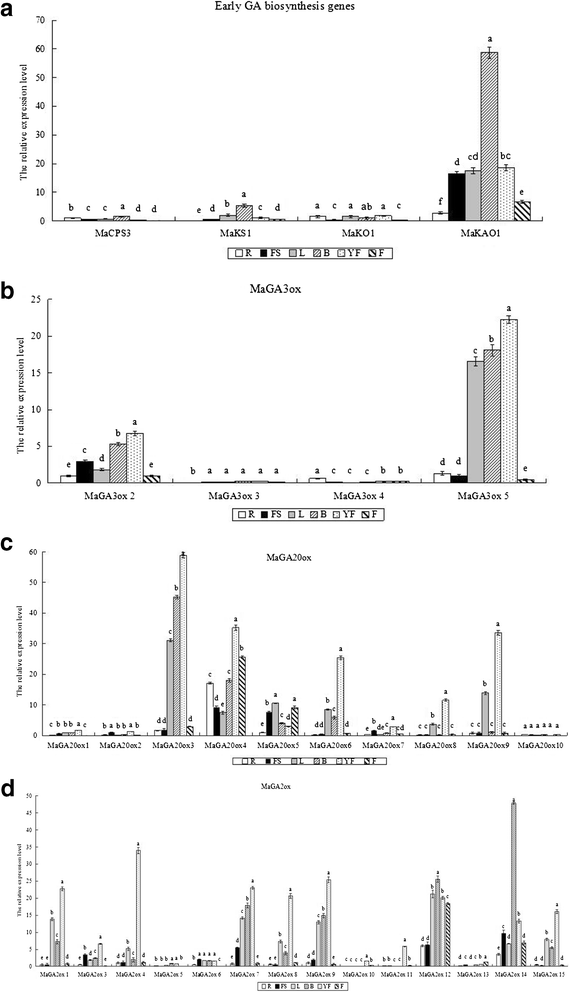
定量实时聚合酶链反应(QRT-PCR)分析显示,分离的Ga代谢基因在威廉姆斯香蕉8818-1的各种组织中以不同水平表达(图。4).
香蕉矮种突变体的各组织Ga代谢基因的组织特异性表达8818-1。从叶子(L),苞片(B),假茎(FS),根(R),幼年果子(FF)和近似成熟的水果(F)中分离出总RNA,并且QRT-PCR是近似成熟的水果(F)实施。使用“相对表达值”肌动蛋白'作为2的参考-ΔΔCT方法。表达水平的MaCPS3,Maga3ox2.,maga20ox5.和Maga2ox4.在a、b、c、d中分别定义为1。目的基因在各组织中的Fold change,归一化为肌动蛋白相对于的表达MaCPS3,Maga3ox2.,maga20ox5.,Maga2ox4.在A,B,c和d分别根,计算用于使用2每个样品-ΔΔCT方法。每个基因的CT值为3个技术重复的平均值,有标准误差。图中有Duncan’s检验估算的同一目的基因在不同组织中相对表达值的显著差异(p值< 0.05)。由相同字母标记的手段没有显着差异
MaCPS3,MAKS1.,Mako1., 和Makao1.在不同层次的威廉斯香蕉8818-1,其中包括叶,根,茎假,苞片,幼果的所有测试组织中广泛表达,约成熟果实(图4A).表达水平Makao1.不同组织中的基因通常高于相应组织中的三种其他基因的基因。表达水平Makao1.苞片中最高,其次是叶子,假茎和年轻的水果。最高的基因表达水平MaCPS3和MAKS1.在苞片中观察到,而Mako1.在幼果中有表达。作为一个整体,表达水平Makao1.在所有组织中,GA早期生物合成基因的表达量最高,而其他3个基因在所有组织中的表达量差异较小,提示Makao1.可能在香蕉GA生物合成的转录水平上发挥重要的调节作用。
分析四GA3ox -喜欢基因(Maga3ox2.,Maga3ox3.,Maga3ox4., 和Maga3ox5.)显示它们在6个组织中以不同水平表达(图。4B.).Maga3ox2.表达水平在幼叶和苞片中较高,但在大约成熟的水果中较低。和....相比Maga3ox4.和Maga3ox5.,Maga3ox3.和Maga3ox4.表达水平较低。的相对表达水平Maga3ox3.在幼料中是六个组织中最高的,但相对表达值仍然低于0.3,类似于相对表达值Maga3ox4.(<0.3)在不包括根部的所有组织中。Maga3ox5.与?相比,在幼果、苞片和叶中的表达分别为22倍、18倍和16倍Maga3ox2.在根。而Maga3ox5.在根、假茎和接近成熟的果实中弱表达。的Maga3ox2.和Maga3ox5.四GA3ox -like基因可能是香蕉正常发育过程中调控GA含量的关键基因。然而,不同的基因在不同的组织中发挥不同的功能。
maga20ox1,2, 和10.表现出相对低的表达并揭示在营养组织中不太明显的组织特异性。与此相反,其他基因在若干组织至少(图显示出高表达。4C.).maga20ox3.在叶、苞片和幼果中表达量较高,而在根、假茎和近成熟果中表达量较低。表达水平maga20ox4.在所有被测植物组织中表达量均较高,在幼果中表达量最高,在叶片中表达量最低。maga20ox5.在叶子,假茎和近似成熟的水果中突出表达,并在根中表达差异。maga20ox6在所有组织中也有表达,在幼果中表达量极高,而在根中表达量极低。这些结果显示了明显的组织特异性。
maga20ox8和maga20ox9.表达水平相对相似,表现出明显的组织特异性,尤其在幼果中表达量高,在根、假茎和近似成熟果中表达量低。maga20ox7.表达量高于maga20ox1,2和10.但低于丰富的基因,如maga20ox3.,maga20ox4., 等等。这些基因之间的组织特异性是显而易见的。一般来说,年轻的水果含有丰富的基因,除了maga20ox5.和Maga20ox10和其他maga20ox.基因所有都展示了年轻水果中的最大表达水平。
14MaGA2ox基因通常可以分为两类。在大多数组织中,第一类中包含的基因在大多数组织中强烈表达,并且在大多数组织中表达不同。这个小组包括在内Maga2ox1.,Maga2ox3.,Maga2ox4.,Maga2ox7.,Maga2ox8.,Maga2ox12.,Maga2ox14, 和Maga2ox15..第二类基因在个体组织中略微表达和略微高。这个小组包括在内maga2ox5.,maga2ox6.,Maga2ox10,Maga2ox11., 和Maga2ox1.3。Maga2ox12.在根中展示了最高的表达水平,随之而来Maga2ox14;其他MaGA2ox基因表达弱。
在假茎,Maga2ox14但是,最丰富的基因是什么呢Maga2ox12.,Maga2ox7.,Maga2ox3., 和maga2ox6.也强烈表达。其他MaGA2ox基因表达弱。Maga2ox12.叶片中表达量最高,其次Maga2ox7.,Maga2ox1.,Maga2ox15., 和Maga2ox8.;相比之下,maga2ox5.,Maga2ox10,Maga2ox11., 和maga2ox13在这种组织中略微表达。在Bracts中,包括前三名最丰富的表达基因Maga2ox14,Maga2ox12., 和Maga2ox7..年轻果实中的高表达基因数超过其他组织中的数量。Maga2ox4.是高表达基因,其次是Maga2ox1.,Maga2ox7.,Maga2ox8.,Maga2ox12.,Maga2ox15.,Maga2ox14, 和maga2ox6..
在接近成熟的果实中,高表达MaGA2ox基因。Maga2ox12.是表达最强烈的基因吗Maga2ox14;所有其他基因都弱表达。上述分析表明,在大多数组织中表达强烈的基因,即,Maga2ox14,Maga2ox12., 和Maga2ox7.等,可能是调控GA含量的关键基因。假茎、假苞片、假叶中基因表达量较高,尤其在幼果中表达量较高,对这些组织中GA含量的调控具有重要意义。MaGA2ox与8818的8818相比,8818-1中不同组织中不同组织中的基因家族表达模式可以解释8818-1的形态特征的变化,例如Dwarf假茎和较短的水果。
威廉姆斯香蕉8818和8818-1假茎中GA代谢基因的差异表达分析
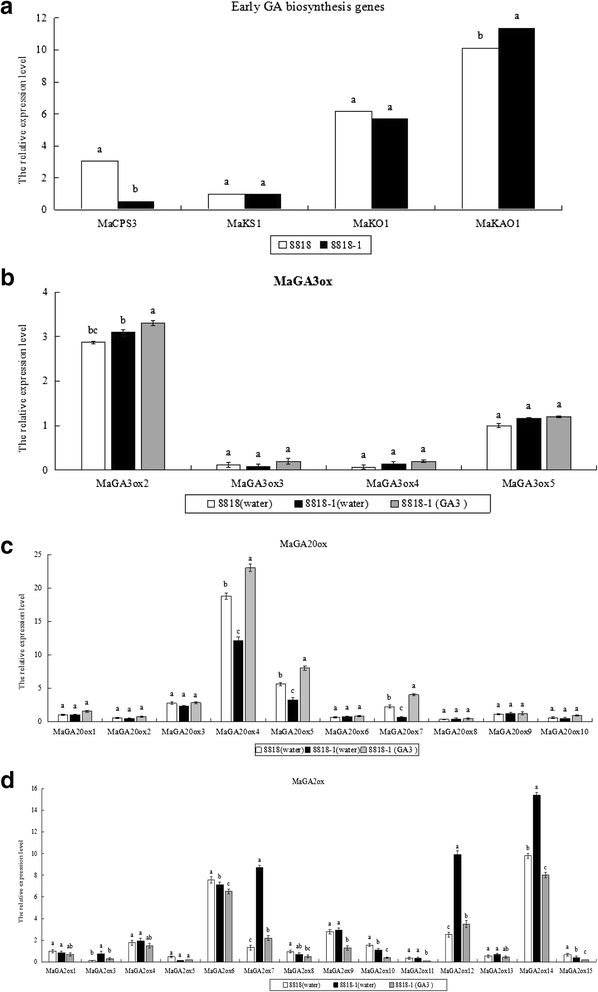
差异表达MaCPS3,MAKS1.,Mako1., 和Makao1.在威廉姆斯香蕉8818及其突变体8818-1的假茎(图。5A).Makao1.是在8818和8818-1假茎中4个早期GA生物合成基因中表达最高的基因。与8818年相比,Makao1.在8818-1中更加高度表达。相比之下,8818-1显示出较低的表达水平MaCPS3超过8818,观察到的差异是显着的。MAKS1.和Mako1.8818与8818-1的表达水平无显著差异。
威廉姆斯香蕉8818及其突变体8818-1假茎中GA代谢基因的表达分析一个早期的GA生物合成基因(MaCPS3,MAKS1.,Mako1.,Makao1.).bMaGA3ox.cmaga20ox..dMaGA2ox.当植物生长至八片叶片时,从8818到8818-1中分离出总RNA的总茎,并进行QRT-PCR。使用“相对表达值”肌动蛋白'到2.-ΔΔCT方法。表达水平的MAKS1.,maga20ox1,Maga3ox5.,Maga2ox1.在8818中,分别定义为A,B,C和D中的1。每个基因的CT值为3个技术重复的平均值,有标准误差。在图形上报道了Duncan测试估计的相同目标基因中相对表达值的显着差异(p值< 0.05)。由相同字母标记的手段没有显着差异
Maga3ox2.和Maga3ox5.的四个GA3ox -类似基因的表达水平高于Maga3ox3.和Maga3ox4.在假茎中(图。5B.).4个基因在8818和8818-1中的表达水平差异不显著。外源Ga3.在8818-1中的应用,四种基因的表达水平或多或少高于水处理的8818-1次,它们之间没有显着差异。GA3OX基因表达可能不是8818和8818-1的假茎的总气体和活性GA含量的主要原因。
分析十的表达水平maga20ox-威廉姆斯香蕉的假茎8818及其突变体8818-1的基因揭示了这一点maga20ox4.被最显着表达GA20ox家族成员被表达在8818超过18倍高maga20ox1在8818和3倍高于maga20ox5.在8818(maga20ox5.表达是之后maga20ox4.)(图。5C).maga20ox4.8818-1中的表达明显低于8818,只有65%的表达值在8818中。此外,表达水平maga20ox3.,maga20ox5., 和maga20ox7.高于其他人maga20ox.基因。的maga20ox5和maga20ox7.8818中的表达水平分别比8818-1的表达水平分别为1.7倍,3倍。表达水平maga20ox3.8818年高于8818-1,但它们之间没有显着差异。其他maga20ox.基因,如maga20ox1,maga20ox2.,maga20ox6,maga20ox8,maga20ox9., 和Maga20ox10,在8818和8818-1中表达量相近,但差异不显著。
外源Ga3.在8818-1上应用,结果显示maga20ox4.,maga20ox5., 和maga20ox7.比用水处理的8818-1 in 8818-1的那些增加。虽然表达水平maga20ox.外源GA后基因或多或少增加3.应用,它们没有显着差异。这些结果表明maga20ox4.,maga20ox5., 和maga20ox7.在maga20ox.基因家族是外源活性GA诱导香蕉假茎的主要基因。
总的来说,表达水平maga20ox4.,maga20ox5., 和maga20ox7.同时,在8818-1中显着低于8818中的那些,这三种基因在8818-1的假茎中显着诱导。因此我们推测这一点maga20ox4.,maga20ox5., 和maga20ox7.,可能在香蕉假茎GA合成中发挥重要的调控作用,它们的表达差异可能导致8818和8818-1之间总GA和活性GA含量的差异。
如图所示。5 d,maga2ox6.,Maga2ox7.,Maga2ox12., 和Maga2ox14表现出较高的表达水平maga20ox.例如基因家族成员。的表达水平Maga2ox7.,Maga2ox12., 和Maga2ox148818-1显著低于8818,分别仅占8818表达水平的15%、25%和63%;maga2ox6.8818与8818-1的表达水平无显著差异。Maga2ox3.,maga2ox5.,Maga2ox10, 和Maga2ox15.表现出较上述四个基因低的表达量(maga2ox6.,Maga2ox7.,Maga2ox12., 和Maga2ox14)假茎与8818和8818-1之间显著差异。Maga2ox1.,Maga2ox4.,Maga2ox8.,Maga2ox9.,Maga2ox11., 和maga2ox13还显示出比上述四种基因更低的表达水平(maga2ox6.,Maga2ox7.,Maga2ox12., 和Maga2ox14),但8818与8818-1之间无显著差异。
在8818-1中,假茎,大多数基因MaGA2ox基因家族被外源GA抑制3.治疗。的表达Maga2ox3.,Maga2ox7.,Maga2ox9.,Maga2ox10,Maga2ox11.,Maga2ox12.,Maga2ox14和Maga2ox15.被抑制,并且在GA之间的8818-1假茎有显着差异3.和水处理。Maga2ox9.和Maga2ox11.GA3.但8818和8818-1之间并无显著差异,因此它们可能不是关键调控基因。Maga2ox3.,Maga2ox10和Maga2ox15.GA3.治疗及其表达水平在8818和8818-1之间具有显着差异,但它们显示出较低的表达水平,也许不是主要调节基因。Maga2ox7.,Maga2ox12., 和Maga2ox14不仅有较高的表达水平,而且在8818-1其表达水平显着高于8818降低,大概在GA合成中起重要调节作用的香蕉茎假。
讨论
香蕉Ga代谢酶基因的系统发育分析
早期GA生物合成基因
在香蕉A基因组中,对应于涉及GA生物合成途径的早期阶段的酶的基因有几个同源序列,其也被在其他植物中报道[15.- - - - - -19.].虽然存在多种CPS样,KS样,KaO样和KO样基因,但这些基因中的一种是大多数植物中的GA代谢酶[20.].在拟南芥中,参与GA生物合成的CPS、KS和KO酶是由单基因编码的[53.].水稻基因组中包含两个基因编码功能CPS,但只有OsCPS1已经证明,参加由突变的研究GA生物合成;OsCPS2参与二萜植物抗毒素的生物合成3.].Prisic和Xu [18.]将OsCPS1ent、OsCPS2ent和OsCPSsyn序列与玉米中的An1/ZmCPS1ent序列进行比较(玉米),发现OsCPS1ent比其旁系同源物(44%)中的任一个更类似于AN1 / ZmCPS1ent(64%同一性)。三CPS类基因香蕉A基因组进行筛选;MaCPS1和MaCPS2具有特别高的同源性,而用MaCPS1和MaCPS2,与OsCPS1 MaCPS3股更高同一性比较。MaCPS3可能涉及GA合成,而MaCPS1和MaCPS2可以在香蕉植物抗毒素的生物合成涉及。然而,这个假设需要进一步调查。虽然KS和KO各具有低同一性两个同源基因,这两种酶可能执行不同的功能,类似于多KS样和KO状存在于水稻基因组序列。然而,KS和KO在GA生物合成也由单个基因编码[3.,53.].
晚期GA生物合成和失活基因
本研究对水稻、拟南芥和香蕉GA氧化酶基因家族的进化特性进行了研究,以阐明物种分裂后香蕉GA氧化酶基因的扩展模式。根据系统发育情况,大多数GA氧化酶基因主要分为4个亚群(I、II、III和C20 GA2ox),反映出GA20ox、GA3ox、GA2ox和C20 GA2ox对应的功能分类。这些结果与Han和Zhu对水稻、拟南芥和大豆的研究一致[21.].前述结果表明,在拟南芥,水稻,葡萄和大豆中发现了16,21,17和24天氧化酶基因[3.,21.,41.].相比之下,香蕉A基因组中含有多达28个GA氧化酶基因,这表明香蕉中的GA氧化酶比拟南芥和水稻中的GA氧化酶更为分散。鉴于观察到的共同保守的蛋白质结构域,这四个亚群具有相似的功能。
在拟南芥,大米和香蕉中,Ga3ox的序列变化很少发生,因此暗示Ga3Ox可能在与其他GA氧化酶相比更大的压力和更保守。然而,存在更多的GA OOX和GA2Ox的拷贝,并且这些基因的序列更为不同。Ga2ox基因家族分为两个亚组,即,亚组III和C20 GA2OX,并且几种GA氧化酶基因不包括在四个亚组中。这些基因包括OSGA20Ox5,OSGA20Ox6,OSGA20Ox7,OSGA20Ox8,Maga20Ox4和Maga20Ox5从Ga Ol OOX演变。这些结果表明,GA20ox和Ga2ox可能发生更具动态的进化路线,从而产生更大的功能冗余,特别是在香蕉中。更多副本的GA20ox和GA2Ox可能导致进化期间的放宽选择性压力或更少的约束。另一方面,Ga20ox和Ga3ox通过相对较小的距离分离。与Ga20ox和Ga3ox的正调节一起,结果表明优先生产生存基因。尽管Ga2ox基因家族具有更多的发散序列,但亚组III和C20 GA2OX可以共享类似的功能。发现C20 Ga2ox在野生型中,通过灭活C20 GA前体来引起半侏儒症[34.].这些发现暗示Ga2ox基因以各种方法执行重要功能。
矮秆香蕉与正常香蕉GA代谢基因的差异表达
Ga代谢基因的组织特异性表达模式表明它们的每个成员可以进行不同的生理功能。GA含量的精确调节似乎在植物正常发展中至关重要。早期的GA生物合成基因(CPS,KS,KO和Kao)通常是大多数植物中的单拷贝基因。尽管存在几种同源基因,但是通过突变体研究证明一个基因以参与GA代谢途径[3.,53.].由于这些基因在早期的GA合成阶段表达,因此突变容易发生极端的矮化植物。然而,如果只改变一个基因的表达水平,则可能不会发生侏儒症,因为通过反馈回路机制,Ga生物合成途径的控制主要由Ga氧化酶施加[54.它们对有限组织的表达定位。早期的GA生物合成基因(MaCPS3,MAKS1.,Mako1., 和Makao1.)在威廉姆斯香蕉8818-1的所有测试组织中广泛表达。MaCPS3是GA合成途径中的第一个基因和表达水平MaCPS38818-1比8818低。同时,Makao1.示出了8818-1较高表达。因此,表达差异MaCPS3可能不足以降低8818-1的GAs和活性GA含量。
GA3ox基因家族中,Maga3ox2.和Maga3ox5.表达水平较高,具有明显的组织特异性。因此,在香蕉的某些发育阶段,这两个基因可能在不同的组织中发挥重要作用。这四个基因在8818和8818-1中的表达水平差异无统计学意义。因此,这些基因表达水平的变化可能不会导致8881-1假茎中GA含量的降低。
GA20ox和GA2ox基因家族比GA3ox基因家族包含更多的家族成员。先前的研究表明,复制基因的功能多样化是多倍体长期进化的一个重要特征[55.].这一发现提示GA20ox和GA2ox基因家族可能在香蕉中发挥着多种重要的功能。大多数证据表明GA生物合成是通过调控2-ODD基因而动态调控的,而不是在通路的早期阶段萜烯环化酶和细胞色素P450基因[56.].GA氧化酶的表达水平的改变已经被证明在大多数植物中能够成功地控制植物的身材,并经常影响一些性状[41.].功能丧失osga20ox2.可以产生侏儒表型[51.].过度表达ptaga2ox1在杨树中产生短且粗壮的表型[57.],而矮李子混合显示增强的表达PslGA2ox[58.].
除了maga20ox1,2, 和10., 其他maga20ox.基因显示出几种组织中的高表达水平,从而揭示了明显的组织特异性。maga20ox.基因在幼果中表达量最高,可能是因为幼果正处于生长发育的关键时期,需要更活跃的GA来促进果实伸长。相比之下,根中高表达基因较少,说明被检测期的根不是GA合成的主要区域。maga20ox4.和maga20ox5.同时,检测到组织中最表达的基因是最高表达的基因,它们在8818和8818-1的假茎之间显示出显着不同的表达水平。这些观察结果表明这两个人GA20ox基因不仅在整个植物器官发育中发挥重要作用,而且可能是调控香蕉假茎GA含量的核心基因。值得注意的是,MaGA20ox4和MaGA20ox5与OsGA20ox5、OsGA20ox6和OsGA20ox8一起被排除在四个亚组之外,并且不与其他GA20ox聚集在一起。最近的研究也证明了这一点OSGA20Ox5和osga20ox6.在水稻的愈伤组织、根、叶和花中表达[21.].这些结果表明,这类基因在植物发育中具有重要的作用。此外,一些研究人员推测GA20ox的多重功能化可能导致序列发散[21.].
在系统发生树的距离的基础上,MaGA2ox基因被分成亚组III(C19 GA2ox)和C20 GA2ox。据中检测组织中的表达水平,MaGA2ox基因分为高表达基因和低表达基因。亚群III和C20 GA2ox都含有数量相近的高表达和低表达基因,可能这两个亚群在香蕉的生长发育中都起着重要作用。在水稻中,过表达C20 GA2ox或改性C20 GA2ox可诱导植株结构的改善,如半矮化、根系增加和分蘖数增加[45.].C20 GA2ox提供了一种控制内源性GA水平的替代机制。
组织特异性分析表明,在幼年水果和假茎中存在更高表达GA氧化酶基因。特别是在幼叶中,基因对于调节活性GA含量的活性具有相当大的意义。多种基因调节可以大大有助于在适当的水平维持GA含量并满足不同发育阶段的细胞和器官的需要。可以在该阶段精确调节GA浓度并运输到需要进一步伸长的组织。
通过受控的失活在激素合成水平下调节生物活性激素浓度[27.,43.].通过下调某些GA20ox和GA3ox基因(也称为负反馈调节)和上调某些GA2ox基因(也称为正正向调节)可以控制生物活性GA含量。Maga2ox7.,Maga2ox12., 和Maga2ox14的MaGA2ox基因家族本显著不同的表达与高表达水平在8818和8818-1假茎,和外源性GA被显着抑制3..maga20ox4.,maga20ox5., 和maga20ox7.也存在不同显著表达与高表达水平在8818和8818-1假茎,和外源性GA被显着地诱导3。低表达maga20ox.基因(maga20ox4.,maga20ox5., 和maga20ox7.)的高表达MaGA2ox基因(Maga2ox7.,Maga2ox12., 和Maga2ox14)8818-1可以导致减少有源GA内容。在一定程度上,8828和8818-1之间的不同表达和表达模式maga20ox.和MaGA2ox与8818相比,8818-1不同组织中的基因可以解释其矮化假茎和矮化果实等形态特征的变化。这些基因可能是调控威廉姆斯香蕉假茎中GA含量的关键基因。
结论
在本研究中,我们筛选了A基因组中所有的香蕉GA代谢基因,分析了它们的同源进化关系,并鉴定了这些基因的组织特异性。这些分析可能有助于阐明其他单子叶植物的代谢基因。
在Williams香蕉中发现了36个GA代谢基因,基因特征和系统发育分析表明它们具有保守性和分化性。此外,我们的研究发现,高表达的GA氧化酶基因存在于幼果中。这一发现表明幼果是GA代谢最活跃的区域,有助于果实长度的调节。本研究通过分析8818及其矮秆突变体8818-1的表达差异,以及水分和GA处理后8818-1的表达差异,研究了香蕉假茎中调控GA含量的关键基因3..GA氧化酶基因,其中包括Maga2ox7.,Maga2ox12.,Maga2ox14,maga20ox4.,maga20ox5., 和maga20ox7.,可执行关键的调节功能。这些基因在8818-1假茎中GA含量的表达水平差异低于8818,从而解释了8818-1突变体的半矮化表型。在组织特异性和表达水平差异的基础上,鉴定重要的GA代谢酶基因,可以通过基因工程获得具有矮胖特征但果实长度相近的香蕉新品种。目前的结果也将有利于对其他密切相关的具有重要农业意义的物种的研究。
方法
植物材料
本试验选用的香蕉品种为威廉姆斯香蕉8818 (Musa Acuminata.AAA集团简历。卡文迪什,var. Williams)及其突变体8818-1。威廉斯8818是一种广泛栽培的商品品种。本课题组将威廉姆斯8818的茎尖浸泡,用0.4% EMS处理3 h,通过田间种植筛选得到矮化突变株8818-1。Williams 8818及其突变体8818-1在湛江中国农业科学院南亚热带作物研究所植物资源苗圃栽培。以威廉姆斯香蕉8818-1生长至八叶期的叶片(L)、根(R)、假茎(FS)为材料进行组织特异性分析;采集8818-1的苞片(B)、幼果(YF)和近成熟果(F)作为组织特异性分析材料。所有样品取样后均冷冻于液氮中,置于−80℃保存备用。所有的评估都进行了三个生物重复。
气体含量的裁定
以威廉姆斯香蕉8818和8818-1植株生长至八叶期的幼叶、幼根和幼假茎和植株发育完全时的幼茎、幼果、幼叶为材料,测定总气体含量。对于主动GA (GA1,Ga3.和遗传算法4)含量测定时,只选取8818和8818-1长至8片叶片的假茎幼嫩茎作为材料。威廉姆斯香蕉8818和8818-1的总气体和活性GA含量由酶联免疫吸附测定试剂盒(Rapidbio,美国)测定,根据制造商的说明,并由Yang和Guo描述[59.].每一组织来自三个个体植物采样为重复,并且确定对每个样品进行三次。
GA.3.治疗和植物生长测量
确定遗传算法3.8叶期的William 8818-1植株喷施赤霉素对植株生长的促进作用3.溶液(50、100、200 mg/L);威廉姆斯香蕉8818和8818-1用水喷淋至叶片和假茎完全湿润(10 mL/盆),每5天喷淋1次。每次处理用10个花盆作为重复。30 d后测定株高。
威廉香蕉8818和8818-1生长至8叶期的假茎收集作为GA的代谢的基因的差异表达分析材料。同时,假与200毫克/升GA喷洒8叶期的8818-1茎3.4 h后收集溶液。采样后所有物料均冷冻于液氮中,置于−80℃保存备用。所有的评估都进行了三个生物重复。
序列检索,对准和系统发育分析
所有序列均来自4个数据库:TAIR(拟南芥信息资源)、http://www.arabidopsis.org/),水稻基因组注释项目数据库(http://rice.plantbiology.msu.edu/)、香蕉基因组中心(http://banana-genome.cirad.fr/blast)和NCBI (http://www.ncbi.nlm.nih.gov/).在香蕉A基因组和NCBI中对香蕉GA代谢基因进行序列搜索。我们只选择了全长cDNA序列,而排除了只有cDNA片段的序列。表中列出了所有的GA代谢基因1.
为了确定与其他物种的序列相似性,通过使用Bkanana Ga代谢基因的蛋白质序列通过Banana,拟南芥,水稻和大豆和Ga氧化酶基因使用Banana Ga代谢基因的蛋白质序列对NCBI进行Blast搜索。来自香蕉,通过Clustalx1.83和Mega5.0软件分别通过NJ方法分析了稻米和拟南芥,用于系统发育树施工。参数包括用于测试系统发育,1000个引导复制,随机种子和泊松模型的引导程序方法。通过使用在线软件,MEME分析保守的蛋白质基序(http://meme-suite.org/tools/meme.)[60.],参数设置如下:最大保存motif数为15;尺寸范围,6- - - - - -200个氨基酸残基。
对于早期的GA生物合成基因(CPS,KS,KO和Kao)拥有多个序列,我们选择了具有最高同源性的具有最高的大米基因的组织特异性和差异表达分析。已证明OSKO(OS04G027870),OSKO(OS04G0570100),OSKO(OS06G0570100)和OSKAO(OS06G0110000)基因已被证明参与GA合成途径。因此,我们选择并将这些基因与Banana早期GA生物合成基因(MacP,Maks,Mako和Makao)与DnaStar软件进行了对齐。
中存在表达分析
冷冻组织被用研钵和杵在液氮中磨碎。采用快速RNA分离试剂盒(华悦洋,中国北京),按照制造商的方案提取总RNA。用DNAse I酶切和RNAse-free试剂盒去除潜在的污染DNA(华悦杨,北京,中国)。以无dna总RNA为模板进行反转录。使用PrimeScript™RT reagent Kit和gDNA Eraser (Takara Bio)从1 μg总RNA中合成第一链cDNA。有限公司、大连、中国)。将上述cDNA稀释10倍后作为模板进行PCR反应。
通过使用Primer Premier 5.0软件(Premier,Canada)和Sangon Biotech Co. Ltd.(中国上海)合成设计了定量逆转录PCR(QRT-PCR)的引物。香蕉肌动蛋白选择基因(GenBank登录号:AB022041)作为参考。所有引物都被显示为附加文件3..通过熔化曲线验证引物特异性并显示出单一产品特异性熔融温度。使用SYBR绿色的PCR测定对Lighcycler®480实时PCR系统(Roche,Basel,瑞士)进行定量逆转录PCR,每种样品用于QRT-PCR实验的三种技术复制。每个基因的CT值是三种技术复制的平均值。
各反应混合物为20μL,含有稀释的第一链cDNA(引物各250nM的)和10的6μL μ.L Transstart Tip Sybr Green Master Mix(Transgen Biotech,北京,中国)。扩增程序设定如下:95℃5分钟,其次是95℃的40℃,58℃,20s,72℃,25 s,然后95 °下5秒,65 °C 1分钟,97分钟°C用于96孔光学反应板中的荧光收集。
所测试的基因的表达水平通过CT值确定,并且由2计算-ΔδCt方法(61.].数据以归一化到参照基因'的基因表达的倍数变化表示。肌动蛋白'和相对于设置控制。使用等式分析相对表达值,其中2-ΔδCt = 2(CT,靶标 - CT,肌动蛋白)组织X - (CT,Target-CT,Actin)设定控制.组织x是任何组织,设置控制表示1 ×目的基因的表达归一化肌动蛋白.
统计分析
所有测量重复三次。根据该模型,用于通过使用SPSS软件(SPSS公司,Chicago,IL,USA)完全随机设计的所有数据进行方差分析。两个样本之间的差异由评价t-检验在0.05水平,3个或3个以上样本间差异采用0.05水平的邓肯检验。
缩写
- 2几率:
-
2-oxoglutarate-dependent加双氧酶
- CPS:
-
烯基二磷酸合酶
- EMS:
-
甲烷磺酸乙酯
- Ga0ox:
-
GA20-氧化酶
- Ga2ox:
-
GA2-oxidase
- GA3ox:
-
GA3-氧化酶
- 气体:
-
赤霉素
- 花王:
-
Ent-Kaureno酸氧化酶
- KO:
-
Ent-Kaurene氧化酶
- KS:
-
ent-kaurene合酶
- NCBI:
-
国家生物技术信息中心
- 存在:
-
实时定量聚合酶链反应
- 支持:
-
萜烯合成酶
参考文献
- 1。
太阳t-p。胃骨细胞信号转导。CurrOp植物BIOL。2000; 3:374-80。
- 2。
山口S,神谷浩Y.赤霉素生物合成:由内源性和环境信号的调节。植物细胞生理学。2000; 41:251-7。
- 3。
Sakamoto T,Miura K,Itoh H,Tatsumi T,Ueguchi-Tanaka M,等。赤霉素新陈代谢酶基因及其相关突变体的概述。植物理性。2004; 34:1642-53。
- 4.
赤霉素信号转导的分子机制。植物学报2004;55:197-223。
- 5。
胡建辉,胡建辉,王志强,王志强,等。Della蛋白和赤霉素调控拟南芥种子萌发和花发育。植物杂志。2004;135:1008-19。
- 6。
Ayele BT, Ozga JA, Reinecke DM. GA生物合成基因对豌豆萌发和幼苗生长的调控(Pisum一L.)。Ĵ植物生长雷古尔。2006; 25:219-32。
- 7.
Junttila O, Jensen E, Pearce DW, Pharis RP。赤霉素GA3对五味子柳茎伸长的刺激作用活性似乎依赖于通过GA3羟基化生成GA1。植物杂志。1992;84:113-20。
- 8.
Hedden P,PREBSTING WM。嗜酸盐素生物合成的遗传分析。植物理性。1999年; 119:365-70。
- 9.
Blazquez MA, Green R, Nilsson O, Sussman MR, Weigel D. Gibberellins通过激活叶状启动子促进拟南芥开花。植物细胞。1998;10:791 - 800。
- 10。
Santes Cm,Hedden P,Gaskin P,Garcia-Martinez JL。豌豆的幼莓和与水果集的关系中的赤霉素及其相关化合物。植物化学。1995年; 40:1347-55。
- 11.
Serrani JC,SanjuánR,Ruiz-Rivero O,Fos M,García-MartínezJL。番茄水果集和生长的吉布林林调节。植物理性。2007; 145:246-57。
- 12.
Hedden P,Phillips al。Gibberellin新陈代谢:基因揭示的新见解。趋势植物SCI。2000; 5:523-30。
- 13。
山羊氏菌拟拟拟南芥生物合成。Phytochem Rev. 2006; 5:39-47。
- 14。
赫登P,托马斯SG。赤霉素生物合成及其调节。生物化学杂志2012; 444:11-25。
- 15.
张志强,张志强,孙涛,等。赤霉素生物合成基因GA1对水稻生长发育的调控拟南芥蒂利亚纳.植物杂志1997; 12:9-19。
- 16。
拟南芥kaurene氧化酶催化赤霉素生物合成的三个步骤。植物杂志。1999;119:507-10。
- 17。
赤霉素信号转导:生物合成、分解代谢和反应途径。植物细胞。2002;14:s61 - 80。
- 18.
Rice含有两种不同代谢功能的- copalyl二磷酸合酶。植物杂志。2004;136:4228-36。
- 19.
许男,Wilderman PR,Morrone的d,徐军,罗伊A,Margis-Pinheiro的M,等。水稻贝壳杉的功能特性合酶样基因家族。植物化学。2007; 68:312-26。
- 20。
格兰南AK。吉布林素在水稻中的代谢酶。植物理性。2006; 141:524-6。
- 21。
韩飞,朱斌。水稻、拟南芥和大豆赤霉素氧化酶基因的进化分析。基因。2011;473(1):23-35。
- 22。
王志强,王志强,王志强,等。两种赤霉素3-氧化酶在拟南芥发育中的独特和重叠作用。植物j . 2006; 45:804-18。
- 23。
Huang SS, Raman AS, Ream JE, Fujiwara H, Cerny RE, Brown SM。在拟南芥中,过表达20氧化酶导致赤霉素生产过剩的表型。植物杂志。1998;118:773 - 81。
- 24。
Oikawa T,Koshioka M,Kojima K,Yoshida H,Kawata M. Osga20ox1的作用,编码嗜酸盐素20-氧化酶的同种型,用于水稻植物身材的调节。植物mol biol。2004; 55:687-700。
- 25。
山C,Mei ZL,段JL,陈海,冯HF,CAI WM。Osga2Ox5,嗜酸甘油蛋白代谢酶参与植物生长,根重响应和盐胁迫。Plos一个。2014; 9:E87110。
- 26。
Spielmeyer W,Ellis MH,Chandler PM。Semidwarf(SD-1),“绿色革命”米,含有缺陷的嗜酸虫素20-氧化酶基因。Proc Natl Acad SCI U S A. 2002; 99:9043-8。
- 27。
赤霉素2-氧化酶的分子克隆及功能表达。美国国立科学学院1999;96:4698-703。
- 28。
Schomburg FM, Bizzell CM, Lee DJ, Zeevaart JA, Amasino RM。一种新的赤霉素2氧化酶的过度表达降低赤霉素水平,并造成矮生植物。植物细胞。2003;15:151 - 63。
- 29。
赤霉素在维管植物、真菌和细菌中的分布。植物生长规律。2002;20:387-442。
- 30.
Phillips Al,Ward da,Uknes S,Appleford Ne,Lange T,Huttly Ak等人。拟南芥中三种嗜酸叶蛋白20-氧化酶cDNA克隆的分离与表达。植物理性。1995年; 108:1049-57。
- 31。
Helliwell CA, Chandler PM, Poole A, Dennis ES, Peacock WJ。CYP88A细胞色素P450是腺苷酸氧化酶,催化赤霉素生物合成途径的三个步骤。美国国家科学研究院2001;98:2065-70。
- 32。
Helliwell CA,沙利文JA,模具RM,灰色JC,孔雀WJ,丹尼斯ES。拟南芥贝壳杉烯氧化酶的质信封位置链接,赤霉素生物合成途径的质和内质网的步骤。植物杂志2001; 28:201-8。
- 33。
Hu J,Mitchum Mg,Barnaby N,Ayele Bt,Ogawa M,Nam E等。拟南芥生殖生长过程中生物活性胃蛋白酶产生的潜在遗址。植物细胞。2008; 20:320-36。
- 34。
李DJ, Zeevaart JA。菠菜ga2 -氧化酶3的克隆及其在樟子烟中的异位表达。植物杂志。2005;138:243-54。
- 35。
Plackett AR,Powers SJ,Fernandez-Garcia N,Urbanova T,TakeBayashi Y,Seo M,等。拟南芥嗜酸甘油蛋蛋白20-氧化酶的发育作用分析表明GA20Ox1,-2和-3是优势常规蛋白酶。植物细胞。2012; 24:941-60。
- 36。
宋军,郭波,宋飞,彭华,姚颖,张勇,等。玉米种子萌发过程中赤霉素代谢酶基因的全基因组鉴定及表达谱分析。基因。2011;482:34-42。
- 37。
兰格T,卡普勒Ĵ,费A,Frisse A,Padeffke T,Schmidtke就S,等人。赤霉素合成开发南瓜苗。植物理性。2005; 139:213-23。
- 38。
戴维森,Swain SM,Reid JB。治疗豌豆早期的GA生物合成途径。Planta。2005; 222:1010-9。
- 39。
Stavang JA,LindgårdB,Erntsen A,盖SE,萌R,奥尔森JE。Thermoperiodic茎伸长涉及豌豆赤霉素失活的转录调控。植物理性。2005; 138:2344-53。
- 40。
Lange MJP, Liebrandt A, Arnold L, Chmielewska SM, Felsberger A, Freier E, et al.;黄瓜赤霉素氧化酶的功能特性Cucumis巨大成功l .植物化学。2013;90:62-9。
- 41。
Giacomelli L, Rota-Stabelli O, Masuero D, Acheampong AK, Moretto M, Caputi L, et al.;葡萄开花和座果期赤霉素代谢:葡萄赤霉素氧化酶的功能特性和进化。J Exp Bot. 2013;64(14): 4403-19。
- 42。
Pearce S,Huttly AK,Prosser Im,Li Yd,Vaughan SP,Gallova B等。吉布林素生物合成基因的异源表达和转录性分析草地的GA3OX家族中的新功能。BMC植物BIOL。2015; 15:130。
- 43。
杜强,李春林,李迪强,卢淑福。通过全基因组分析、分子克隆和表达谱分析,揭示了丹参中参与赤霉素代谢的组织特异性表达、反馈调节、应激响应和交替剪接的新基因。BMC基因组学。2015;16:1087。
- 44。
刘志强,刘志强,刘志强,等。遗传分析表明,c19 - ga2氧化是拟南芥赤霉素失活的主要途径。植物细胞。2008;20(9):2420 - 36。
- 45。
罗斯F,杨调,陈姑,兴毅,ZeevaArt Ja,Chen LJ等。一种新型嗜酸盐蛋白2-氧化酶的嗜酸盐,分蘖和根部发育。植物细胞。2008; 20:2603-18。
- 46。
赤霉素对雄蕊发育的控制:一个可育的领域。植物科学学报2011;16:568-78。
- 47。
蒋浩,黄一,古德曼HM。拟南芥GA4位点的分离。植物细胞。1995;7:195 - 201。
- 48。
Carrera E,Jackson SD,PRAT S.在马铃薯中的胃肠杆菌素20-氧化酶转录水平的反馈控制和昼夜调节。植物理性。1999年; 119:765-74。
- 49。
徐玉玲,李丽,Gage DA, Zeevaart JA。拟南芥GA5表达的反馈调控及赤霉素水平的代谢工程。植物细胞。1999;11:927-36。
- 50.
D’hont A, Denoeud F, Aury JM, Baurens FC, Carreel F, Garsmeur O, et al.;香蕉(Musa acuminata)基因组与单子叶植物的进化。大自然。2012;488:213-7。
- 51.
王志强,王志强,王志强,等。绿色革命:水稻赤霉素合成基因的突变体。大自然。2002;416:701-2。
- 52.
Sakai M, Sakamoto T, Saito T, Matsuoka M, Tanaka H, Kobayashi M.新型水稻赤霉素2-氧化酶基因的表达受生物活性赤霉素的稳态调控。植物学报2003;116:161-4。
- 53.
山口甘蓝芽孢菌素新陈代谢及其监管。Annu Rev植物Biol。2008; 59:225-51。
- 54.
王志强,王志强,王志强,等。数学模型阐明了转录反馈在赤霉素信号转导中的作用。中国科学院院刊2012;109:7571-6。
- 55.
Blanc G, Wolfe KH。从重复基因的年龄分布推断模式植物广泛存在的古多倍性。植物细胞。2004;16:1667 - 78。
- 56。
黄勇,杨伟,裴志,郭旭,刘东,孙军,等。小麦赤霉素生物合成的基因。功能整合基因组学。2012;12:199-206。
- 57。
杨树赤霉素分解代谢基因(ga2 -氧化酶)的激活标记研究。植物杂志。2003;132:1283 - 91。
- 58。
El-Sharkawy I,El Kayal W,Prasath D,Fernandez H,Bouzayen M,Svircev Am,等。葛根素2-氧化酶基因的鉴定和遗传表征,用于控制李子树立和繁殖生长的树立和繁殖生长。J Exp Bot。2012; 63:1225-39。
- 59。
杨军,郭志强。柱花草9-顺式环氧类胡萝卜素双加氧酶基因(SgNCED1)的克隆及其对非生物胁迫的响应。植物学报2007;26(8):1383-90。
- 60。
陈志强,陈志强。基于p-值的序列同源性搜索。生物信息学。1998;14(1):48-54。
- 61。
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相对基因表达数据。方法。2001;25:402-8。
致谢
我们感谢南亚热带清志亮博士作物研究所,他在英语语言版本。我们也感谢对稿件提出宝贵意见的编辑和匿名评论和建设性的建议。这项工作是由海南省自然科学基金项目(No.314109)和南亚热带基础研究基金支持的作物研究所,热科院(No.1630062013005)。
资金
该项目由海南省自然科学基金会(314109号)提供资金,也得到了南亚热带农作物研究所的基本研究资金,CATAS(1630062013005)。
数据和材料的可用性
所有支持数据都可以在稿件及其附加文件中找到。
作者的贡献
CJJ和XJH构思和设计了实验;CJJ进行了数据分析并写了稿件;XJH参加了起草部分稿件并修改了论文;Hyl进行了气体含量测定和植物高度测量。CJJ和LWM搜索了香蕉GA新陈代谢基因的序列并进行了系统发育分析;CJJ,DYJ和拥抱进行了RNA提取和QRT-PCR。所有作者阅读并认可的终稿。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
同意发布
不适用。
伦理
该研究由海南省自然科学基金资助,已获得海南省自然基金会委员会的批准。此外,本研究中的材料只参与科研,没有道德问题。
作者信息
隶属关系
通讯作者
附加文件
附加文件1:图S1。
香蕉A基因组上38个候选基因的染色体定位。(PDF 61 kb)
附加文件2:表S1。
本研究中引用的蛋白质序列的加入数。(PDF 45 KB)
附加文件3:表S2。
该研究QRT-PCR参考基因和Ga代谢基因的引物序列。(PDF 71 KB)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
陈,J.,谢,J.,段,Y.等等。全基因组鉴定和表达谱揭示了Williams香蕉及其矮化突变体之间参与赤霉素代谢的组织特异性表达和差异调控基因。BMC植物BIOL.16,123(2016)。https://doi.org/10.1186/s12870-016-0809.1.
已收到:
接受:
发表:
关键词
- 吉布林斯
- 香蕉
- GA氧化酶基因
- 早期GA生物合成基因
- 表达式模式
- 组织特异性