摘要
背景
植物激素乙烯(ET)是诱导紫草素及其衍生物生物合成的关键信号分子,是紫草素的次生代谢产物紫草erythrorhizon。einsensitive3 (EIN3)/EIN3样蛋白(EILs)是ET信号转导通路中至关重要的转录因子,但EIN3/EIL1在紫草素生物合成中的可能功能尚不清楚。在本研究中,通过靶向LeEIL-1(l . erythrorhizon在表达水平上,我们揭示了ein3样蛋白基因1的正调控作用LeEIL-1关于紫草素的形成。
结果
细胞的mRNA水平LeEIL-1显著上调和下调LeEIL-1-过度表达毛状根线和LeEIL-1-RNAi毛状根线。具体地说,LeEIL-1过表达导致ET信号转导通路下游基因转录水平升高(LeERF-1)和一组紫草素形成、排泄和/或运输的基因(LePAL,LeC4H-2,Le4CL-1,HMGR,LePGT-1,LeDI-2,LePS-2),这与紫草素含量的增加相一致LeEIL-1 -毛状根线过度表达。相反,LeEIL-1-RNAi显著抑制上述基因的表达,显著减少紫草素的产生。
结论
结果显示,LeEIL-1紫草素及其衍生物的生物合成是否有正向调节作用l . erythrorhizon多毛的根源。我们的发现对ET在紫草素生物合成中的分子调控机制有了新的认识。LeEIL-1是否可能成为紫草素生物合成基因工程的关键靶基因。
背景
药用植物的根紫草erythrorhizon能特异性积累具有显著抗炎、抗肿瘤和抗菌活性的紫草素及其衍生物[1- - - - - -4]。这些红色萘醌色素也是优良的天然染料,广泛应用于织物、食品和化妆品等行业。5,6]。
在过去的十年中,细胞或毛状根培养系统l . erythrorhizon已被成功地用于生产这些有价值的化合物,通过两阶段培养系统,即(1)l . erythrorhizon(2)转入M9生产培养基,在黑暗条件下生产紫草素色素[7- - - - - -9]。这个优良的系统已成为更好地了解紫草素色素代谢的一个有前途的工具。编码紫草素生物合成、排泄和/或运输的关键酶或调节因子的基因也已被克隆和鉴定,如l . erythrorhizon苯丙氨酸解氨酶基因(LePAL) [10),l . erythrorhizon肉桂酸4-羟化酶基因(LeC4H) [11], 3-羟基-3-甲基戊二酰辅酶A还原酶基因(HMGR) [12),l . erythrorhizon对羟基苯甲酸酯:香叶基转移酶基因(LePGT) [13- - - - - -15),l . erythrorhizon色素愈伤组织特异性基因(LePS-2) [16],而l . erythrorhizon暗诱导基因(LeDI-2) [17,18]。此外,有几个因素,如光[8,19,20.],矿物元素[21,22]、真菌激发剂[23]、培养基[9],一氧化氮[24]、茉莉酸甲酯[25]和ET [26],被认为是紫草素生物合成的关键调节因子。
乙烯不敏感3 (EIN3)/EIN3样蛋白(EILs)是植物特异性转录因子,可调节各种ET反应[27- - - - - -29]。在复杂的分子信号网络中,EIN3/EIL1是ET与其他信号之间的关键集成节点[30.]。EIN3/EIL1通过与特定的启动子元件结合,激活或抑制负责ET信号传导的靶基因的表达,从而调节植物的多种ET相关反应,如发育、表型和对环境胁迫的适应[qh]31- - - - - -33]。然而,对EIN3/EIL与植物次生代谢之间关系的认识仍然有限。
在药用植物中l . erythrorhizonET是紫草素生物合成的重要调控因子[26]。此外,内源性ET的最佳浓度被认为是紫草素形成的关键[34]。LeEIL-1的同系物拟南芥EIN3,已被隔离l . erythrorhizon细胞。据推测,它对et调控的紫草素生物合成很重要[35]。的功能LeEIL-1紫草素在分子水平上的生物合成尚不清楚。功能研究LeEIL-1可以用来解释它们之间的关系吗LeEIL-1、ET、紫草素生产等。
本研究采用过表达和RNA干扰(RNAi)两种转基因策略进行诱导LeEIL-1超表达和LeEIL-1-RNAi转基因毛状根。表达模式之间的关系LeEIL-1并对紫草素的生产进行了研究,为了解紫草素的可能功能提供了新的见解LeEIL-1紫草素生物合成。
结果
毛状根的诱导、培养和鉴定
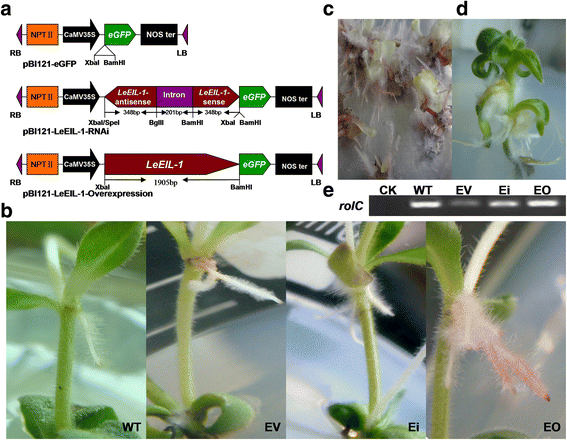
的功能更详细的了解LeEIL-1在紫草素形成过程中,RNAi和过表达转基因策略在本研究中同时应用。pBI121-的质粒LeEIL-1 -过表达(EO)与pBI121-LeEIL-1基于pBI121增强型绿色荧光蛋白基因空载体(pBI121-)构建- rnai (Ei)并进行验证eGFP) (EV)(图1;额外的文件1:图S1)。的农杆菌属rhizogenes菌株15834 (WT)和答:rhizogenes用含有EV、Ei或EO质粒的15834感染无菌苗的节点[36]。每个构建体(即EV、Ei和EO)和WT(图2)已成功诱导出15个以上毛状根转基因系。1 b)。
在家畜培养中,将所有毛状根(WT, EV, Ei和EO)在26-28°C的弱光下转入B5固体培养基(无激素和无抗生素)。在侵染部位观察到4种毛状根显著的生长多态性(图2)。1 b)或在原始培养基中(附加文件)2:图S2)。在弱光条件下,在苗节侵染部位和继代砧木培养基上,EO毛状根线均呈现明显的红色。WT、Ei和EV均未观察到明显的红色毛状根线。在大多数Ei中观察到许多黑色片段。与WT和EV相比,EO和Ei在砧木培养基或倍增培养基中的生长速度相对较慢,其中Ei的生长速度最慢(另附文件)3.:图S3)。这一发现表明l . erythrorhizon的表达水平过低或过高都可能影响毛状根LeEIL-1。我们还发现,在B5培养基中培养的Ei容易发生愈伤组织和再生现象(图5)。1 c和d)与其他毛状根线相比。因此,我们推测受抑制的mRNA水平LeEIL-1在一定程度上改变了毛状根的发育和表型。
为了证实毛状根的转化,将所有转基因毛状根(WT、EV、Ei和EO)的DNA样本作为模板,进行PCR扩增标记rolC基因的答:rhizogenes15834年(37,38],以及未转化的DNAl . erythrorhizon以幼苗为阴性对照。结果表明:rolC基因仅从WT、EV、Ei和EO毛状根中扩增得到(图2)。1 e),证实了毛状根转化的成功l . erythrorhizon。
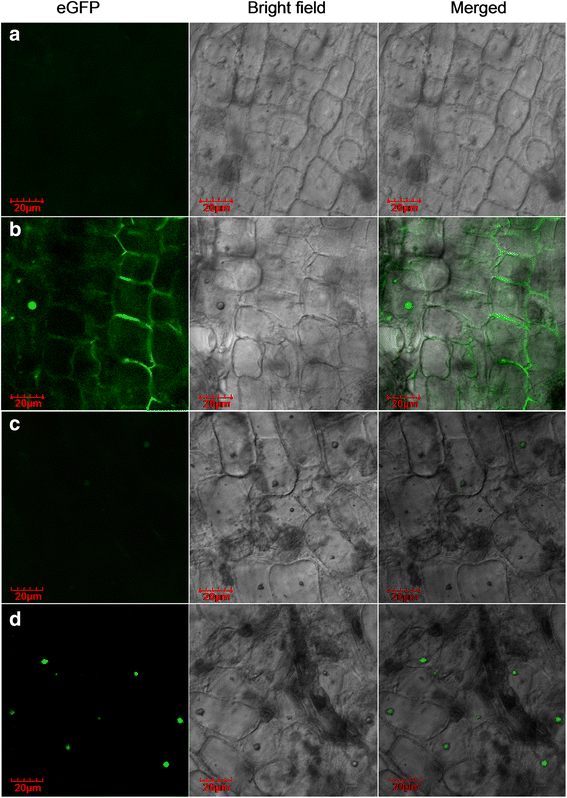
对egfp标记的细胞进行共聚焦扫描激光显微镜分析,以确定所有毛状根,并明确leil -1的亚细胞定位。在毛状根中观察到不同的eGFP定位模式。WT毛状根未观察到荧光(图2)。2),而叶青毛状根的细胞核、细胞壁和细胞质中出现均匀而强烈的荧光信号(图2)。2 b)。在Ei毛状根线中,只识别到微弱的荧光信号(图2)。2摄氏度)。在EO毛状根线中,eGFP发出的强信号主要在细胞核中检测到(图2)。二维),其中EIN3/EILs本地化[39]。基于这些发现,我们推测融合蛋白eGFP: leil -1的共表达或共定位可能发生在EO的细胞核中,但可能在Ei毛状根中被有效抑制。
的表达模式LeEIL-1在两阶段培养系统中
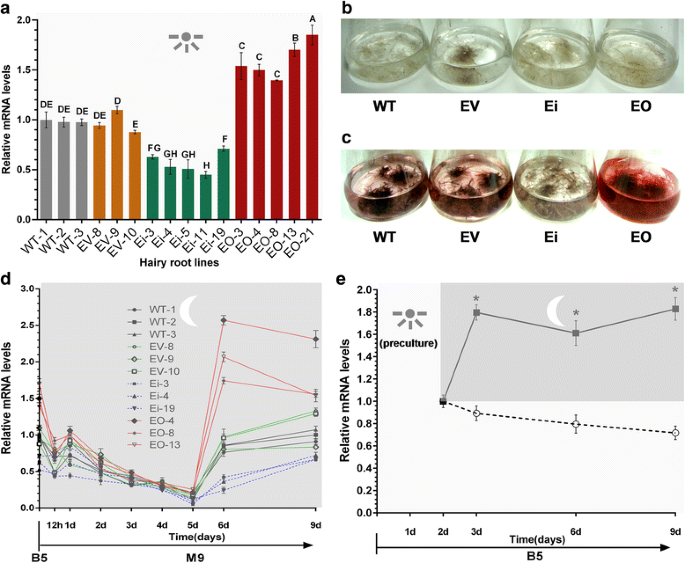
为评价转基因效果,对LeEIL-1采用实时荧光定量PCR方法对4种毛状根进行了鉴定。在B5培养基中随机选择Ei和EO各5株;每3行WT和EV作为对照。在三条WT毛状根系(WT-1、WT-2和WT-3)中观察到相似的转录水平。与WT毛状根线相比,LeEIL-1叶片毛状根线无显著变化(P> 0.05)。然而,在毛状根线中,LeEIL-1与WT或EV (P< 0.01)。在EO毛状根线中,LeEIL-1显著增加(P< 0.01)。3)。因此,成绩单的水平LeEIL-1实际上在毛状根中显著增加LeEIL-1 -过度表达和减少的LeEIL-1 -RNAi毛状根线。
LeEIL-1WT、EV、Ei、EO毛状根线的表达模式及目测。(一个)的转录水平LeEIL-1随机选择WT、EV、Ei和EO的毛状根系,在B5培养基中,光照26-28℃,以80 rpm恒定摇动培养15天。给出了两个生物学实验的代表性例子;数据代表平均值±SD (n= 3)酒吧与不同的大写字母指出在P <0.01(差异不显著);(b) WT、EV、Ei、EO毛状根在含无激素B5液体培养基的锥形瓶中增殖培养的表型;(c)肉眼观察WT、EV、Ei、EO毛状根线在M9中6天的颜色变化(20 ml培养基/50 ml烧瓶);(d的动态表达模式分析LeEIL-1当毛状根线从B5转移到M9培养基时。Ei、EO系与WT、EV系分别在6天和9天的时间点上差异显著(差异最不显著;P <0.05);(e)的表达模式LeEIL-1将毛状根在光照下预培养2天,然后转入黑暗。的星号表明,黑暗中的平均值与光照下的平均值分别在第3、6和9天时间点有显著差异(Student 'st -测试中,P< 0.05)。的阳光的标志和浅灰色为B5培养条件下的光照期月亮的标志和深的灰色为M9培养条件下的夜间时段
我们推测的变换LeEIL-1基因影响紫草素的生物合成。紫草素及其衍生物为红色特异色素,目测毛状根中色素以及毛状根排出的M9培养基中色素的颜色变化[23]。并通过目测法对WT、EV、Ei和EO的毛状根中紫草素色素的积累进行了时间过程分析。B5增殖培养基在光照下未见色素(图2)。3 b)。将毛状根从B5增殖培养基转移到M9生产培养基1 - 6天后,红色发生了显著变化,6-9天后达到最高水平,此后变化不大,其中EO产量最高,Ei产量最低(图1 - 9)。3 c)。采用随机选择WT-1、EV-9、Ei-19和EO-13 4个典型品系,对不同类型毛状根中紫草素的积累进行时程分析。从第1 ~ 6天,上述毛状根中紫草素浓度迅速上升,在第6天达到较高水平。此后,不同毛状根中紫草素含量开始以不同的方式积累。在3、6、9和12 d的每个时间点,EO-13的紫草素含量显著高于EV-9或WT-1,而Ei-19的紫草素含量显著低于EV-9或WT-1 (P< 0.05)(附加文件4:图S4)。
在分析紫草素形成时程的基础上,选择WT、EV、Ei和EO各3个品系,从B5增殖培养基中转移到M9生产培养基中进行表达模式分析LeEIL-1。的动态表达模式LeEIL-1在M9生产培养基中(12 h和1-9 d)检测到,表达模式与LeEIL-1在l . erythrorhizon我们之前报道的愈伤组织细胞[35]。将WT、EV、Ei和EO的毛状根从B5增殖培养基转移到M9生产培养基中9天后,发生了显著的变化。细胞的mRNA水平LeEIL-1在WT的3个品系中,EV、Ei和EO在12 h时显著降低,在1 d时呈上升趋势,在5 d时呈下降趋势,达到最低水平。
的转录水平LeEIL-1在M9中培养5 ~ 9天,不同类型毛状根的生长速率显著不同(图2)。3 d)。在WT EV和Ei的毛状根中LeEIL-1转录本在5 ~ 6 d呈快速增加趋势,6 ~ 9 d呈持续增加趋势。的LeEIL-1而在第6 ~ 9天,EO毛状根系的转录本水平略有下降,在第9天与WT、EV和Ei毛状根系相比仍保持较高水平。与目测结果一致的是,在M9培养基中紫草素的产量最高LeEIL-1转录水平在EO系中发现,在5至9天内,Ei系的转录水平最低,EV或WT系的转录水平中等(图2)。3 d)。很明显,在M9培养基中的第6天是表达水平的重要时间点LeEIL-1在不同的毛状根应进行比较。这个结果表明LeEIL-1表达可能与紫草素及其衍生物的积累同时发生。
有趣的是,我们注意到了这一点LeEIL-1无论是否位于CaMV-35s启动子下游,均在早期5天内下调。在两段式培养体系中,在恒光条件下,用不含抗生素和激素的B5培养基作为毛状根繁殖的培养基,在连续暗培养条件下,用含激素的M9培养基使毛状根产生紫草素及其衍生物。我们推测这两个阶段之间的显著差异(培养基成分和培养条件)可能会影响LeEIL-1在转移的早期阶段l . erythrorhizon毛状根从B5增殖培养基转入M9生产培养基。
由于紫草素的生物合成是在黑暗中进行的,因此我们也检测了光信号对紫草素表达模式的影响LeEIL-1。随机选择WT-1毛状根系,在恒光条件下于B5中预培养2 d。的表达模式类似LeERF-1,这是我们先前研究中报告的另一个ET反应因素[40],LeEIL-1暗诱导(图2)。3 e)。这一结果也与黑暗诱导的EIN3在拟南芥[41]。
LeEIL-1是紫草素生产的积极调节剂吗
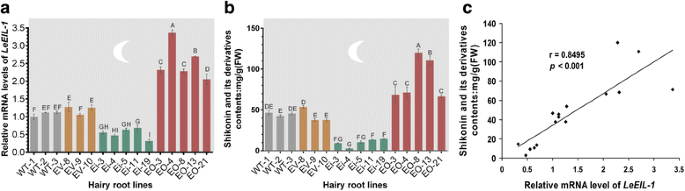
基于以上结果,我们推测LeEIL-1正介导et调控的紫草素生物合成。为了验证推测,我们进行了表达水平与LeEIL-1(无花果。4)和紫草素含量(图2)。4 b)在M9生产培养基中培养6天。此外,对于不同毛状根类型(WT、EV、Ei和EO),只有LeEIL-1受RNAi影响或过表达的差异;其他所有因素,包括M9培养基、培养条件(26°C黑暗)在研究系统中均相同。
结果表明LeEIL-1与WT和EV对照相比,EO毛状根系中紫草素的表达量和产量显著增加,Ei则显著降低(P< 0.01)。4a和b)。因此,紫草素含量与紫草碱含量呈显著的线性正相关LeEIL-1根据以上检测到的所有细胞系的结果推断出表达水平(r= 0.8495;P< 0.001)。4摄氏度)。此外,从EO(附加文件)中获得了许多高产的紫草毛状根5:图S5),建议的策略LeEIL-1 -过表达具有获得毛状根高产紫草素的潜力。
LeEIL-1通过调控紫草素合成关键基因的表达来促进紫草素的产生
由于EIN3/EILs是ET信号转导通路最下游的关键正调控因子[39,42,我们推导出的表达式LeEIL-1可能与调控紫草素形成的下游靶基因有关。ET信号转导通路和紫草素生物合成通路相关基因在过表达和RNAi机制下的进一步研究LeEIL-1将弥合紫草素生产和积累之间的差距LeEIL-1记录。
由于紫草素的产量和表达水平没有差异LeEIL-1为了避免质粒的转基因效应,选择3个pBI121载体系(EV-9、Ei-19和EO-13)在M9中培养6 d,进一步分析了与紫草素生物合成相关的几个关键基因的表达。这些基因包括推测的下游基因LeEIL-1(LeERF-1)、紫草素生物合成途径的关键基因(LePAL,LeC4H-2, Le4CL-1,HMGR,LePGT-1)(图。5),以及可能负责紫草素色素运输、稳定和/或排泄的基因(LeDI-2和LePS-2)。
的表达水平LeERF-1与对照组EV-9相比,EO-13显著上调,Ei-19显著下调(P< 0.01)。同样的,LeEIL-1过表达显著上调mRNA的积累LePAL,LePGT-1,LeC4H-2,LePS-2,Le4CL-1,LeDI-2和HMGR在EO毛状根线(P< 0.01)。相比之下,rnai介导的LeEIL-1在Ei毛状根中,显著抑制了所有基因的表达,尤其是LeDI-2(P< 0.01)。5 b)。我们推测,上调或下调的转录本LeEIL-1进而改变了紫草素生物合成途径中大部分基因的转录。在M9培养的毛状根中,这些紫草素生物合成相关基因的表达模式(LePAL,LePGT-1,LeC4H-2,LePS-2,Le4CL-1,LeDI-2和HMGR的表达式模式匹配LeEIL-1,以及6天时间点的紫草素产量(图2)。4和b)。这表明这些紫草素生物合成相关基因是由紫草素诱导的LeEIL-1并且可能参与了LeEIL-1-控制紫草素的生产。
LeDI-2基因不参与紫草素的生物合成,但可能在稳定和/或运输紫草素中起作用[j]。8,17]。LePS-2可能是在紫草色素的捕获和/或细胞壁内排泄中起关键作用的基因[16]。这些研究共同表明LeEIL-1紫草素的积累还可能包括生物合成后紫草素及其衍生物的排泄、稳定和/或运输。因此,之间有一定的合作关系是必要的LeEIL-1以及参与紫草素生物合成的基因l . erythrorhizon。
综上所述,LeEIL-1通过调控参与紫草素生物合成的关键基因来产生紫草素。
讨论
LeEIL-1一个关键的靶基因是否有助于有效的紫草素形成
在植物信号网络中,EIN3/EIL1是ET与其他信号之间的关键集成节点[30.]。EIN3/EIL1激活下游基因的表达,其中ERFs是典型的下游基因[39,43]。然后将erf绑定到GCC框独联体-受ET调控的许多基因的元件,并通过激活ET反应发挥积极作用[44]。
在药用植物中l . erythrorhizon紫草素及其衍生物在黑暗条件下特异性积累,而在白光或蓝光条件下被抑制。与暗诱导基因的mRNA水平一致LeERF-1[40),LeDI-2[17],LeEIL-1在黑暗中也被上调。这一发现表明,光信号作为一个关键的调节LeEIL-1在紫草素生物合成过程中。
作为紫草素生物合成的第一个前体,p-羟基苯甲酸(PHB)是通过苯丙酸途径合成的。PHB受顺序酶,即PAL、C4H和4CL [10,45]。另一种前体是香叶基焦磷酸(GPP),由HMGR催化在类异戊二烯途径中合成[12]。的形成米-香叶酰羟基苯甲酸(GBA)是紫草素形成的关键步骤。在此过程中,底物PHB和GPP被LePGT催化形成GBA,从而合成紫草素色素l . erythrorhizon[15,46(图。5)。在这项研究中,LeEIL-1过表达增强了下游基因的表达LeEIL-1(LeERF-1)和一个与紫草素生物合成、排泄和/或运输和稳定(即:LePAL,LePGT-1,LeC4H-2,LePS-2,Le4CL-1,LeDI-2和HMGR)(图。5 b),从而增加了紫草素的积累。相反,的RNAiLeEIL-1有效减少紫草素积累,下调上述基因。因此,我们推测紫草素生物合成的类异戊二烯途径和类苯丙烯途径都受到LeEIL-1,但未来的研究应提供进一步的直接证据。此外,调控过程还包括形成后紫草素及其衍生物的运输、排泄和稳定。总之LeEIL-1可能是et调控的紫草素生物合成中最重要的贡献者之一l . erythrorhizon。
虽然一些EIN3/EIL成员的转录上调有助于组成性ET反应,但外源ET不能影响EIN3/EIL mRNA水平[47,48];然而,EIN3/EIL蛋白的丰度在ET暴露后显著增加,因为该蛋白具有很强的稳定性[42]。在体内,EIN3/EIL蛋白的积累主要在转录后水平受到调控,EIN2在调节et诱导的EIN3/EIL中至关重要[1]。49,50]。基于以往和现在的研究结果,我们提出了一个模型来描述LeEIL-1-调控的紫草素产生可能在ET信号级联中(图2)。6);在该模型中,与Li et al.(2013)描述的相似,暗诱导LeEIL-1在et调控的紫草素形成中起积极调节作用。因此,采用该方法可获得高产量的毛状根LeEIL-1-过度表达策略(附加文件5:图。S5)。
LeEIL-1是ET和其他信号分子之间可能的集成节点吗
在拟南芥, EIN3及其相近的同系物EIL1调控无数ET反应[39,47]。在植物的生命周期中,EIN3/EIL1调控ET信号以及发育和胁迫反应等多种过程[29,32]、植物免疫防御系统[28], ET和茉莉酸之间的串扰[30.]。此外,EIN3/EIL1也参与了植物形态表型的改变[43]、幼苗去黄化和叶片衰老[41,51]。
在本研究中,两种处理下毛状根的多态性和生长速率都发生了变化LeEIL-1超表达或LeEIL-1rnai(无花果。1 b;额外的文件2:图。S2)。同时,在B5固体或液体培养基中培养的Ei毛状根系容易发生愈伤组织、分化和再生现象(图5)。1c和d),与相同条件下培养的其他毛状根系比较。因此,我们推测LeEIL-1可能在ET信号级联的多个层面调控其他输入或ET特异性效应器,从而诱导细胞发育、分化和再生的ET级联反应。因此,调查是否……将会很有趣LeEIL-1在复杂的ET转导通路网络中,是ET与其他信号分子的交汇点之一l . erythrorhizon。
结论
虽然对紫草素及其衍生物的生物合成途径已基本了解,但对其形成的分子机制和关键靶点调控因子仍知之甚少。本研究通过采用优良的两段毛状根培养体系作为生产紫草素的基础条件,为紫草素的积极作用提供了证据LeEIL-1在调节紫草素的形成。在EO的毛状根线中,LeEIL-1在相同培养条件下,过表达的紫草素含量显著高于Ei,也高于WT和EV的对照。我们的发现为未来的工作铺平了道路,旨在扩大我们对紫草素生物合成中ET的分子调控机制的认识。此外,我们还提供了一个在紫草素基因工程中高效生物合成潜力巨大的关键靶基因l . erythrorhizon。今后的研究主要集中在对的直接作用LeEIL-1或其他LeEILs在ET信号转导通路中l . erythrorhizon为乙烯对紫草素生物合成的调控提供更多证据。
方法
植物材料及处理
的种子l . erythrorhizon摘要。等朱克采自中国内蒙古自治区乌兰浩特市野外地点(N46°04′13.55″,E122°07′42.15″),符合当地法律规定,本研究无需特别许可。种子的分层和灭菌,以及幼苗的培养条件基本与我们之前报道的一样[52]。将健壮的幼苗进行毛状根诱导。
质粒的构建和转化
的质粒LeEIL-1 -超表达或LeEIL-1 -以植物表达载体pBI121-为载体构建RNAieGFP。选择XbaI/BamHI酶切pBI121-eGFP向量,编码区域的LeEIL-1cDNA表达盒位于CaMV35s启动子和CaMV35s启动子之间eGFP,从而产生pBI121-质粒LeEIL-1超表达(52]。
构建pBI121-LeEIL-1-RNAi质粒,采用了与之前报道类似的策略[52- - - - - -54]。采用含内含子中间载体pUCCRNAi [55]。的序列LeEIL-1(348个碱基)LeEIL-1。将sense序列克隆并以正方向插入pUCCRNAi中,生成pUCCRNAi-内含子- f载体。该反义序列也被扩增并反向插入puccrnai -内含子- f中。该过程生成puccrnai - r -内含子- f质粒。为获得目标倒置重复序列,选择SpeI/XbaI酶切puccrnai - r -内含子- f质粒。最后,将得到的序列插入pBI121-eGFP载体,从而产生pBI121-的质粒LeEIL-1rnai [52,56]。
所有质粒(pBI121-LeEIL-1rnai pBI121 -LeEIL-1-过表达和pBI121-eGFP)变成了大肠杆菌菌株TOP10进行扩增和PCR验证。最后,将重组的表达质粒导入答:rhizogenes先前报道的菌株ATCC15834 [52,57,58]。所有用于构建质粒和验证携带载体ATCC15834的引物都列在附加文件中6表S1。
毛状根的诱导和培养
利用毛状根系对紫草素进行生物合成和表达分析LeEIL-1通过两阶段培养系统[8,9]。毛状根诱导的感染菌株如下:答:rhizogenes菌株15834 (WT)答:rhizogenes携带质粒pBI121-的15834菌株eGFP(EV), pBI121 -LeEIL-1 -过表达(EO)或pBI121-LeEIL-1rnai (Ei)。所有染色剂接种于YEB液体培养基中,在旋转摇床(120转/分,26-28℃)中接种约36小时−1)加入YEB培养基中进行EV、Ei和EO的耐药筛选。当OD600感染菌株达到0.5,补充100 μM的乙酰丁香酮(AS)。
然后用我们之前报道的方法诱导毛状根[36,52]。简单地说,用浸泡在感染培养基中的针刺穿幼苗节。接种后移栽到MS固体培养基中,在弱光或暗条件下,2周后直至毛状根出现,每种毛状根产生15行以上。在感染部位切除单个约1cm的毛状根。消除残差后农杆菌属与头孢噻肟,毛状根在B5固体培养基(不含抗生素和激素)中培养。砧木栽培条件为:26-28℃弱光栽培。
毛状根的培养采用两阶段培养体系,如前所述[7- - - - - -9,21]。切取在B5固体培养基上培养的毛状根,转入B5增殖液体培养基(不含抗生素和激素),在26-28℃连续白光下快速扩增,恒摇速为80 rpm。毛状根每隔15天传代一次(图2)。3 b)。
对于紫草素的生物合成,将毛状根从B5增殖培养基转移到M9生产培养基中,在26-28℃、恒定摇速80转/分的黑暗条件下培养[21,36,52,59(图。3 c)。
leil -1亚细胞定位分析
采用共聚焦激光扫描荧光显微镜(LSFM, FV10-ASW, Olympus, Japan)检测eGFP荧光。激发波长为488 nm,发射波长为510 nm [39,60]。
实时PCR分析
选择在B5增殖培养基和M9生产培养基中培养的毛状根株系进行mRNA水平分析。使用TRIzol试剂(TaKaRa Biotech,滋贺,日本)从毛状根中提取总RNA。用1 μg的总RNA和M-MLV逆转录酶(Promega, Madison, WI, USA)合成第一链cDNA。采用CFX96TM (Bio-Rad, USA)和SYBR Green real-time PCR Master Mix (Toybo Co., Ltd, Osaka, Japan)进行实时PCR。根据GenBank数据库中的序列设计实时PCR分析引物[24[附加文件7表2)。甘油醛-3-磷酸脱氢酶基因(GAPDH)是一种内参基因,与我们先前的报告[24,36,52]。热程序使用以下参数进行:在95°C下变性1分钟,然后进行40次扩增循环(95°C 15 s, 55°C 15 s, 72°C 45 s)。40次循环后绘制熔化曲线以确认反应的特异性。使用ΔΔCt方法计算相对表达水平[24,35,36,40,52]。为进行数据分析,至少进行了2至3次生物重复和3次技术重复。
紫草素含量的测定
测量紫草素含量的方法与我们之前报道的一样[19,20.,24,36,52]。用汽油醚提取紫草素及其衍生物,用WFZ UV-2800H分光光度计(Unico, Shanghai, China)测定。在520 nm的特征波长处检测了这些色素的吸收。采用标准曲线测定紫草素含量(紫草素含量= 41.66 × OD)520×稀释倍数)[19,20.,24,52]。从毛状根和M9生产培养基中提取的紫草素总含量以毛状根鲜重mg/g (FW)表示。
缩写
乙烯等;增强型绿色荧光蛋白;EO pBI121 -LeEIL-1超表达;EIN3/EIL,乙烯不敏感3/EIN3样蛋白;Ei, pBI121 -LeEIL-1rnai;电动汽车,pBI121 -eGFP空向量;LeEIL-1,l . erythrorhizonein3样蛋白基因1;LePAL,l . erythrorhizon苯丙氨酸解氨酶基因;LeC4H-2,l . erythrorhizon肉桂酸4-羟化酶基因2;Le4CL-1,l . erythrorhizon4-香豆酸辅酶a连接酶基因1;HMGR-3-羟基-3-甲基戊二酰辅酶A还原酶基因;LePGT-1,赤藓菌-羟基苯甲酸酯:香叶基转移酶基因1;LePS-2, (l . erythrorhizon色素愈伤组织特异性基因2);LeDI-2,l . erythrorhizon暗诱导基因2;LeERF-1,l . erythrorhizon乙烯反应因子基因1;RNAi, RNA干扰;野生型。
参考文献
陈旭,杨玲,张宁,Turpin JA, Buckheit RW, Osterling C,等。紫草素具有抑制趋化因子受体功能,抑制人类免疫缺陷病毒1型的作用。抗菌素与抗菌药物。2003;47(1):2810 - 6。
张勇,钱瑞强,李鹏鹏。紫草素,紫草的一种成分紫草erythrorhizon,下调乳腺癌细胞中类固醇硫酸酯酶基因的表达。癌症杂志,2009;28:47 - 54。
陈静,谢军,姜志,王斌,王勇,胡鑫。石草素及其类似物通过靶向肿瘤丙酮酸激酶- m2抑制癌细胞糖酵解。致癌基因。2011;30:4297 - 306。
王忠,刘涛,甘玲,王涛,袁鑫,张斌,等。紫草素具有抗氧化作用,对小鼠脑缺血再灌注损伤具有保护作用。中国药理学杂志,2010;43(3):391 - 391。
天然异己基萘杂酚色素:一类新药。植物医学。1980;38:193-203。
Papageorgiou VP, Assimopoulou AN, Couladouros EA, Hepworth D, Nicolaou K.烷烃素、紫草素及其相关萘酚天然产物的化学和生物学研究。化学工程学报,1999;38(1):1 - 3。
Shimomura K, Sudo H, Saga H, Kamada H紫草erythrorhizon。植物学报,1991;10:28 - 5。
刘建军,刘建军,李建军,等。生物合成技术的研究进展紫草erythrorhizon:光诱导的次级代谢负调控。植物与生物技术。1999;16:35 - 42。
Touno K, Harada K, Yoshimatsu K, Yazaki K, Shimomura K. Shikonin衍生物在培养芽茎上的形成紫草erythrorhizon。植物学报,2000;19:1121 - 116。
王玉华,王晓明,王晓明,等。植物苯丙氨酸解氨酶基因的克隆与表达紫草erythrorhizon。生物科学与技术。1997;61:1995-2003。
王志强,王志强,王志强。肉桂酸4-羟化酶的研究进展紫草erythrorhizon: cDNA克隆及基因表达。植物学报,2001;20:655 - 662。
李建军,李建军,李建军,等。微体3-羟基-3-甲基戊二酰辅酶A还原酶在紫草素合成中的调控作用紫草erythrorhizon细胞悬浮培养。足底。1998;204:234-41。
杨建军,李建军,李建军,等。香叶基二磷酸转移酶的研究进展紫草erythrorhizon紫草素生物合成关键酶的克隆与鉴定。中国生物医学工程学报,2002;27(1):1 - 6。
[3]王志强,王志强,王志强,等。一种膜结合的戊烯基转移酶- - - - - - -p羟基酸。生物化学学报。2009;21(4):391 - 391。
[2]王志强,王志强,王志强,等。一种新型的植物代谢酶的研究进展紫草erythrorhizon。[j] . 2013;28(2):25 - 25。
杨建军,李建军,李建军,等。一种新型紫草愈伤组织蛋白的克隆与表达ithospermum erythrorhizon。植物生理学报。2003;44(4):437 - 446。
杨建军,张建军,张建军,等。植物基因克隆及功能分析LEDI-2这是一种在黑暗中优先表达的基因紫草细胞悬浮培养。植物生理学报。1997;14(4):344。
Touno K, Harada K, Yoshimatsu K, Yazaki K, Shimomura K紫草erythrorhizon。植物学报。2000;17:127-30。
刘忠,齐建林,陈林,张明生,王晓青,庞永军,等。光照对培养紫草素基因表达及形成的影响Onosma paniculatum细胞。植物学报。2006;44(4):388 - 388。
张文军,苏军,谭明勇,刘国利,庞永军,沈海国,等。紫草素合成基因对M9中、光胁迫的表达分析紫草erythrorhizon细胞培养。植物学报。2010;31(1):344 - 344。
Fujita Y, Hara Y, Suga C, Morimoto T.紫草素衍生物的细胞悬浮培养紫草erythrorhizon。植物学报,1981;1:61-3。
刘忠,李勇,杨涛,苏军,张敏,田睿,等。紫草素的积累与体内钙稳态有关Onosma香细胞培养。植物科学学报,2011;51(1):1093 - 1093。
Brigham LA, Michaels PJ, Flores HE。根中萘醌类化合物的细胞特异性产生及抑菌活性紫草erythrorhizon。植物生理学报。1999;19(1):417 - 428。
吴绍军,齐建林,张文军,刘绍华,肖凤华,张明生,等。一氧化氮调节悬浮培养中紫草素的形成Onosma paniculatum细胞。植物生理学报。2009;50(5):1158 - 1158。
杨建军,杨建军,杨建军,等。茉莉酸甲酯对紫草素和二氢呋喃产生的影响。植物学报。1997;38(3):776 - 782。
李建军,李建军,李建军,等。乙烯诱导紫草素的合成紫草erythrorhizon。植物生理与生物化学。2005;43:101-5。
Potuschak T, Lechner E, Parmentier Y, Yanagisawa S, Grava S, Koncz C,等。ein3依赖性植物乙烯激素信号的调控拟南芥F盒蛋白:EBF1和EBF2。细胞。2003;115:679 - 89。
陈辉,薛磊,Chintamanani S, Germain H,林辉,崔辉,等。乙烯INSENSITIVE3和乙烯INSENSITIVE3- like1抑制水杨酸诱导缺陷2表达负向调节植物先天免疫拟南芥。植物学报。2009;21:25 - 40。
彭军,李志,文旭,李伟,石华,杨玲,等。盐诱导的EIN3/EIL1稳定通过阻止ROS积累来获得耐盐性拟南芥。生物医学工程学报,2014;10,e1004664。
朱忠,安峰,冯毅,李鹏,薛磊,牟安,等。乙烯稳定转录因子(EIN3/EIL1)的抑制介导茉莉酸盐和乙烯信号的协同作用拟南芥。科学通报,2011;38(2):539 - 544。
Boutrot F, Segonzac C, Chang KN, Qiao H, Ecker JR, Zipfel C,等。的直接转录控制拟南芥免疫受体FLS2通过乙烯依赖性转录因子EIN3和EIL1表达。科学通报,2010;37(1):1 - 4。
石勇,田松,侯磊,黄霞,张霞,郭华,等。乙烯信号通过抑制基因的表达负向调控抗冻性CBF和俘虏加勒比海盗基因在拟南芥。植物学报。2012;24(4):559 - 559。
张俊,张建明,张超。细胞色素的关联b5与ETR1乙烯受体信号通过RTE1 in拟南芥。植物科学学报,2014;37(1):558 - 567。
齐建林,张文军,刘山,王华,孙元达,徐海华,等。光调控基因的表达分析Onosma paniculatum细胞培养。植物生理学报,2008;16(2):444 - 444。
邹安,张伟,潘强,朱生,尹杰,田荣,等。的克隆、表征和表达LeEIL-1,一个拟南芥EIN3同源物紫草erythrorhizon。植物学报。2011;26(6):771 - 779。
赵宏,常强,张东,方荣,吴峰,王旭,等。过度的LeMYB1通过上调紫草素合成相关关键基因来促进紫草素的形成紫草erythrorhizon。生物工程学报。2015;39(5):529 - 535。
刘建军,刘建军,李建军,等。植物体内萜类吲哚类生物碱的合成与生长Catharanthus roseus也叫毛状根无性系与左右端链Ri T-DNA基因整合的关系。植物科学进展,2004;23(3):148 - 54。
Grąbkowska R, Królicka A, Mielicki W, Wielanek M, Wysokińska H.遗传转化Harpagophytum procumbens通过农杆菌属rhizogenes毛状根培养中环烯醚萜和苯乙醇苷的积累。植物物理学报,2010;32:665-73。
安峰,赵强,纪勇,李伟,姜志,余旭,等。乙烯诱导的乙烯INSENSITIVE3和EIN3- like1的稳定是由EIN3结合的F-box 1和2的蛋白酶体降解介导的,这需要EIN2 in拟南芥。植物学报,2010;22:2384-401。
张伟,邹安,苗军,尹勇,田睿,庞勇,等。LeERF-1是AP2/ERF家族B3亚簇中的一个新基因,受光信号的下调紫草erythrorhizon。植物学报,2011;13(3):343 - 348。
李忠,彭军,文旭,郭华。Ethylene-insensitive3衰老相关基因是否通过直接抑制加速年龄依赖性叶片衰老miR164转录的拟南芥。植物学报,2013;25(3):391 - 391。
郭红华,李建军。植物对乙烯气体的反应及其调控机制EBF1 / EBF2依赖性蛋白水解EIN3转录因子。细胞。2003;115:667 - 77。
张建军,张建军,张建军,等。乙烯信号转导的转录级联:乙烯- insensitive3和乙烯- response - factor1的表达。基因工程学报。1998;12:397 - 397。
Fujimoto SY, Ohta M, Usui A, Shinshi H, ohme takagi M.拟南芥乙烯响应元件结合因子在GCC盒子介导基因表达中的转录激活或抑制作用。植物学报。2000;12:393-404。
王晓明,王晓明,王晓明,等。4-香豆酸辅酶A连接酶基因的克隆与表达紫草细胞培养。植物生理学报。1995;36(6):1319 - 29。
藤崎,王晓明,王晓明,等。一种芳香族底物戊烯基转移酶的研究进展。中国林业大学学报(自然科学版);2003;9:1 - 2。
赵琦,罗腾宝,李建平,李建平,等。植物体内乙烯反应途径的研究进展拟南芥由核蛋白ETHYLENE-INSENSITIVE3和相关蛋白引起。细胞。1997;89:1133-44。
杨秀泽,刘绍东,张建军,等。葡萄糖和乙烯信号对植物EIN3稳定性的调控。大自然。2003;425:521-5。
纪勇,郭华。从内质网到细胞核:EIN2在乙烯信号传导中的桥梁作用。植物学报。2013;6:11-4。
王晓明,王晓明,王晓明,等。EIN2基因对乙烯信号转导的调控Lotus对虾。植物生理学报,2013;44(4):569 - 579。
钟松,赵敏,石涛,石宏,安峰,赵强,等。EIN3/EIL1与PIF1协同防止光氧化,促进绿色化拟南芥幼苗。科学通报,2009;26(6):391 - 391。
方荣,吴峰,邹安,朱勇,赵华,赵华,等。转基因分析显示LeACS-1作为乙烯诱导的紫草素生物合成的正调节因子紫草erythrorhizon多毛的根源。中国生物医学工程学报。2016;39(2):444 - 444。
Manamohan M, Chandra GS, Asokan R, Deepa H, Prakash M, Kumar NK。在植物中表达含内含子发夹RNA的一步DNA片段组装,用于基因沉默。生物化学学报,2013;33(3):389 - 391。
张晓明,张晓明,张晓明,等。香豆酸辅酶a连接酶对丁香酚生物合成代谢产物的影响。植物生理学报,2013;44(4):1238 - 1252。
甘东,张军,姜辉,姜涛,朱生,程斌。细菌表达的dsRNA对玉米抗SCMV感染的保护作用。植物学报,2010;29:1261-8。
朱明,陈刚,周生,涂勇,王勇,董涛,等。新发现的番茄NAC (NAM/ATAF1/2/CUC2)转录因子SlNAC4对果实成熟和类胡萝卜素积累具有正向调节作用。植物生理学报,2014;55(5):119 - 135。
Höfgen R, Willmitzer L.农杆菌属转换。核酸学报。1988;16:98 . 77。
鲍华,陈文杰。利用冻融法转化根瘤菌的研究进展。环境科学学报,2006;32(2):1290 - 1290。
苏默S, Köhle A, Yazaki K, Shimomura K, Bechthold A, Heide L.紫草素生物合成毛状根培养的基因工程紫草erythrorhizon用细菌转化ubiC基因。植物学报。1999;39(3):683 - 693。
于鹏,袁军,邓旭,马敏,张华。细菌亚细胞靶向CusF增加拟南芥铜的积累,改变根到茎的铜转运。植物生理学报,2014;55(5):568 - 581。
致谢
国家自然科学基金项目(31170275、31071082、31171161、31470384)、长江学者及高校创新科研团队计划(IRT_14R27)、新世纪高校优秀人才计划(NCET-11-0234)和教育部高校博士学位项目(20120091110037)资助。
数据和材料的可用性
所有支持数据都可以在手稿及其附加文件中找到。
作者的贡献
JQ、GL、YY设计研究;RF、AZ、HZ、FW、YZ、HZ、YL进行研究;RF、R-JT、YP、RY、XW、JQ、GL、YY分析数据;RF, JQ, GL, YY撰写论文。所有作者都阅读并认可了稿件的最终版本。
相互竞争的利益
作者宣称他们没有竞争利益。
发表同意书
不适用。
伦理批准并同意参与
不适用。
作者信息
从属关系
相应的作者
附加文件
附加文件1:图S1。
构建的重组载体验证。(A)识别eGFP利用引物对eGFP-F/R将基因插入pBI121-eGFP载体;(B)插入的目标序列在pBI121-LeEIL-1-RNAi载体,引物对35S-F/GFP-R。(C)插入的靶序列扩增LeEIL-1在pBI121-LeEIL-1-用引物对35S-F/GFP-R过表达载体。引物集在附加文件中列出6表S1。(TIF 456kb)
附加文件2:图S2。
砧木培养WT (A)、EV (B)、Ei (C)和EO (D)毛状根l . erythrorhizon在B5固体培养基上(无抗生素和无激素)。(TIF 3277kb)
附加文件3:图S3。
WT-1、EV-9、Ei-19和EO-13在B5增殖培养基(26-28℃连续光照,恒定摇速80 rpm)中培养的鲜重(FW)时间过程。接种量为0.2 g毛状根,在20 ml培养基/50 ml烧瓶中传代。进行3次生物重复;在3至15天的每个时间点,Ei-19或EO-13的值分别与WT-1或EV-9的控制线有显著差异t以及,P< 0.05)。(TIF 83 kb)
附加文件4:图S4。
四种典型毛状根线紫草素积累的时间过程。在3至12天的每个时间点上,Ei-19或EO-13的值分别与对照线WT-1或EV-9的值有显著差异t以及,P< 0.05)。(TIF 125kb)
附加文件5:图S5。
Ei典型低产紫草品系(A)与EO典型高产紫草品系(B)生长特性比较毛状根在M9生产培养基(20 ml培养基/50 ml烧瓶)中黑暗培养6天。(TIF 3133kb)
附加文件6:表S1。
引物对LeEIL-1cDNA克隆及载体构建与验证。(DOC 39kb)
附加文件7:表S2。
用于基因表达分析的实时PCR引物。(DOC 34kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有说明。
关于本文
引用本文
方荣,邹安,赵华。et al。转基因研究揭示了LeEIL-1在调控紫草素生物合成方面紫草erythrorhizon多毛的根源。BMC Plant Biol16日,121(2016)。https://doi.org/10.1186/s12870-016-0812-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-016-0812-6
关键字
- 乙烯
- 多毛的根部
- LeEIL-1
- 超表达
- RNAi
- 紫草素