摘要
背景
在次生代谢产物中,黄酮类化合物对植物的生长、发育和繁殖尤为重要,对维持人体健康也十分有益。作为一种开花植物,红花已经合成了多种具有不同药理特性的类黄酮。然而,关于产生这些神奇的类黄酮,特别是喹诺查尔酮的生物合成途径中涉及的基因的研究却少得多。在本研究中,我们首先从红花中克隆并研究了黄酮3-羟化酶基因(F3H)的参与。CtF3H)在类黄酮生物合成途径中的作用。
结果
生物信息分析表明CtF3H与其他植物的F3H具有较高的保守残基和置信度。亚细胞定位揭示了核和细胞质定位Ct洋葱表皮细胞中的F3H。的函数表达式CtF3H在大肠杆菌以柚皮素为底物时,pMAL-C5x载体中的BL21(DE3)pLysS细胞可产生二氢山奈酚。此外,转录组表达Ct在茉莉酸甲酯(MeJA)的外部刺激下,F3H在喹酮查尔酮型红花(花橙黄色)和黄酮醇型红花(花白色)中表现出截然相反的表达模式,茉莉酸甲酯已被确定为类黄酮代谢产物的激发子。进一步的代谢产物分析表明,喹诺查尔酮型红花系中喹诺查尔酮和黄酮醇,如羟红花黄酮A、山奈酚-3- o -β- d -葡萄糖苷、山奈酚-3- o -β-芦丁苷、芦丁、红花素和木犀草素有增加的趋势。MeJA处理后,黄酮醇型红花系中山柰酚-3- o -β-芦丁苷和山柰酚-3- o -β- d -葡萄糖苷的积累呈增强趋势。而黄酮醇型红花系中其他黄酮醇,如山萘酚、二氢山萘酚和槲皮素-3- o -β- d -葡萄糖苷对MeJA刺激的反应呈下降积累。
结论
我们的结果表明,高表达Ct在喹诺查尔酮型红花系中,F3H的低表达与喹诺查尔酮和黄酮醇的积累有关,而在黄酮醇型红花系中,F3H的低表达不影响糖基化衍生物(山奈酚-3- o -β-芦丁苷和芦丁)的增加积累,但影响上游前体(d -苯丙氨酸,二氢山奈酚,山奈酚)的增加CtF3H在不同表型和化学型红花系中的表达。
背景
具有杂色结构的类黄酮广泛分布在自然界的大多数植物中,在植物适应不同环境中起着关键作用。例如,它们为抵御虫害提供了强有力的防御措施[1,2]食草动物[3.],以及病原微生物[4]并将信号分子传导到环境中,以促进与共生细菌的相互作用[5]和病毒[6].色素类黄酮作为视觉和嗅觉冲击来吸引传粉者和食草动物,并保护它们免受光强、温度以及生物和非生物压力的影响[7].此外,它们为促进和维持健康的制剂提供了丰富的资源[8].
由于黄酮类化合物在遗传研究和生物医学上的重要意义,近年来其生物合成引起了科学界的广泛关注[9,10].通过在植物模型中的酶学研究,黄酮类化合物的生物合成途径已基本明确拟南芥[11].然而,植物的次生代谢途径极其复杂。虽然模型植物中的代谢途径已经被了解,但这些途径在另一个物种或特定品种中具有不同的调节机制,特别是当类黄酮与模型植物中的类黄酮不同时。因此,在类黄酮生物合成途径中鉴定种特异性基因是非常必要的。
红花(Carthamus tinctoriusL.)在中国不仅是一种油料作物,而且被广泛用作一种传统药物。现代药理学实验表明,红花及其活性化合物具有广泛的生物活性,包括扩张冠状动脉,改善心肌缺血,调节免疫反应[12,13].许多植物化学研究表明,红花能合成多种黄酮类化合物,如喹诺查尔酮(水红花黄酮a、红花素、丁嘌呤胺和丁嘌呤胺)和黄酮醇(山奈酚及其葡萄糖苷和槲皮素及其葡萄糖苷),等等[13].同时,对红花的基因组和转录组进行了研究,阐明了参与黄酮类化合物和脂肪酸生物合成的unigenes [14].到目前为止,编码异chorisate合成酶,肉桂酸4-羟基化酶,油脂酰磷脂酰胆碱去饱和酶(FAD2)、红花中苯丙氨酸解氨酶和查尔酮合成酶的克隆和鉴定[15- - - - - -17].然而,关于类黄酮生物合成相关酶的编码基因及其功能的研究仍然缺乏。
黄酮3-羟基化酶(F3H)是一种作用于类黄酮生物合成途径分叉的核酶,可催化(2S)-黄酮(如柚皮素)3-羟基化生成二氢黄酮醇[18].类黄酮代谢途径中的大多数F3H基因已经从许多不同的植物中获得,包括银杏叶[19],拟南芥[20.],红砂[21],列氏寒暑表trigyna[22],小麦l . (23),而茶树[24],并加以表征。但红花F3H基因的生物信息分析和功能鉴定尚未见报道。同时,对于F3H酶在细胞水平上的研究尚未见报道。为了了解红花中黄酮类化合物的生物合成,我们选择了桔黄色花的喹诺查尔酮型和白色花的黄酮醇型两个不同的红花品系,研究了红花中F3H的功能和表征(图2)。1).克隆CtF3H全长,将其开放阅读框插入原核表达载体pMAL-c5X中进行蛋白表达和体外酶活性鉴定。还有,重组CtF3H和pCAMBIA-1380-CaMV35S-MCS-EGFP-NOS (PMT-39)构建,研究其亚细胞定位。同时,我们研究了MeJA诱导下两种化学分型红花品系(开橙黄色花的喹酮型红花品系和开白色花的黄酮型红花品系)花冠中黄酮类化合物的转录组表达模式和积累情况。
结果
描述的CtF3H
cDNACtF3H包含1086bp的开放读帧,编码361aa。分子量为40.72 kDa,理论等电点为5.57。预测氨基酸序列的比对表明Ct与其他F3H蛋白一样,F3H蛋白也含有2-ODD(2 -氧谷二酸依赖双加氧酶)超家族保守结构域:2-氧谷二酸结合结构域RxS (Arg289和Ser291)和亚铁结合位点HxDxnH (His78、His121、His211、Asp213、His221、Asp 223、His265、His267和His279)(图5)。2).在这些氨基酸中观察到的守恒揭示了CtF3H蛋白具有潜在的生物学功能。系统发生树分析表明CtF3H和F3H的关系更密切大丽羽状的,Gynura二色的而且Pilosella officinarum(附加文件1:图S1)。
CtF3H与来自其他物种的F3H蛋白的比对。该比对蛋白的Genbank登录号如下:AcF3H (ACL54955.1)、CcF3H (Q05963.1)、AgF3H (AFN70721.1)、DcF3H(AAD56577.1)、AtF3H (NP_190692.1)、GmF3H (ACM62745.1)、GhF3H (ABA01482.1)、CaF3H (AEO36935.1)、CtF3H (AEG64806.1)、DpF3H (BA J21534.1)、GbF3H (BAJ17667.1)、CcF3H (AFC37250.1)、PoF3H (ACB56921.1)、CmF3H (AAB97310.1)和NtF3H (AAC15414.1)。使用DNAMAN软件对序列进行比对。的铁2+-结合位点和氧戊二酸结合位点用空三角形(∆)或填充三角形(▲)表示,保守的2-氧戊二酸- fe (II)加氧酶结构域在黑盒子中显示
CtF3H的亚细胞定位
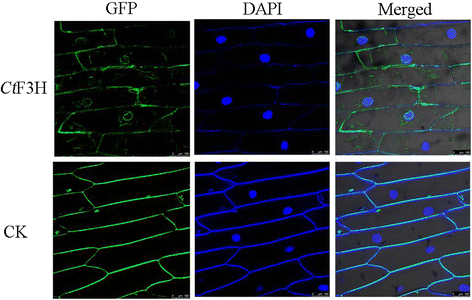
可能的亚细胞定位Ct利用WoLF PSORT程序对F3H进行了计算分析,结果表明CtF3H可能定位于细胞质或细胞核。准确的定位CtF3H,的融合结构Ct通过农杆菌菌株GV3101介导,将CaMV 35S启动子控制的F3H和绿色荧光蛋白(GFP)以及单独的GFP载体导入洋葱表皮细胞。如图所示。3.,洋葱表皮细胞感染农杆菌窝藏CtF3H-GFP蛋白主要在细胞核、细胞质和细胞膜中发出GFP信号。然而,单独用GFP载体转化的洋葱细胞在细胞膜上表现出GFP信号。结果表明,CtF3H是一种核和细胞质定位蛋白,为其在植物生物学过程中的功能提供了一些线索。
纯化及体外活性研究CtF3H
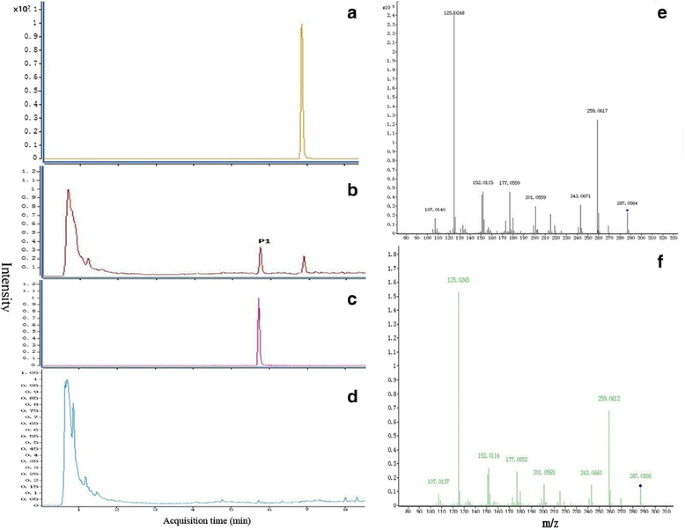
显示酶的活性CtF3H体外表达,粗重组蛋白在大肠杆菌采用淀粉酶树脂柱纯化。如附加文件所示2:图S2, 4巷Ct不带MBP(麦芽糖结合蛋白)标签的F3H蛋白分子量约为40kDa,与预测的大小一致CtF3H蛋白质。体外活性Ct以柚皮素、山奈酚、二氢山奈酚、槲皮素和二氢槲皮素为底物,对F3H进行了检测。但只有柚皮素能被CtF3H蛋白催化生成其他产物。其他四种化合物不能被CtF3H蛋白催化生成其他产物。我们的数据表明,除了柚皮素和溶剂峰外,还识别出一种产物(p1)(图2)。4,b,d),其保留时间与二氢山奈酚相同(图。4摄氏度).LC-MS/MS分析表明产物中含有一个分子离子[M-H]。-在质荷比(m/z)为287的情况下,与m/z为259、243、201、177、152、125和107的子离子一起形成(图2)。4 e);这与二氢山奈酚的真实标准产品一致(图。4 f).结果也与F3H能将柚皮素转化为二氢山奈酚相一致拟南芥[20.].
动力学参数CtF3H通过使用柚皮素浓度范围进行测试。初速度V0与柚皮素浓度的关系形成了一个带V的矩形双曲线马克斯=(22.90±0.94)μM/min米=(43.75±7.12)Mm(附加文件3.:图S3)。我们的数据表明CtF3H能有效催化柚皮素合成二氢山奈酚,表明其在类黄酮生物合成途径中发挥作用。
表达水平分析Ct两种红花系花组织中的F3H
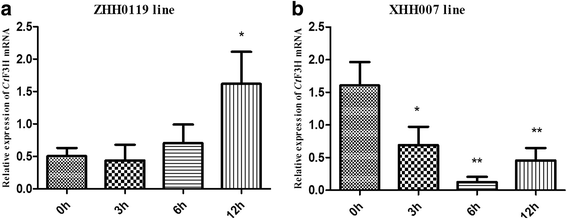
强调的作用Ct红花黄酮醇通路中的F3H基因与非生物胁迫Ct首先选择F3H,通过实时荧光定量PCR分析了两个化学分型红花品系(ZHH0119和XHH007)的meja刺激反应。如图所示。5,CtF3H基因在ZHH0119花中的表达量随着时间的推移逐渐升高。其在治疗后12 h的表达量也明显高于治疗后0 h、3 h、6 h,差异有统计学意义(p< 0.05)。这一结果表明CtF3H可能在红花的防御反应中起作用。但与0 h相比,3 h和6 h添加激发子的效果不明显(p> 0.05)。与其在ZHH0119花中的表达水平相反CtMeJA处理12 h后,XHH007系F3H基因转录丰度持续受到抑制,3 h、6 h、12 h与0 h比较,差异有统计学意义(图2)。5 b).这一结果表明CtMeJA处理正调控了ZHH0119花中F3H表达水平,而XHH007花中F3H表达水平可被扰动。
MeJA刺激下黄酮类化合物在花组织中的积累
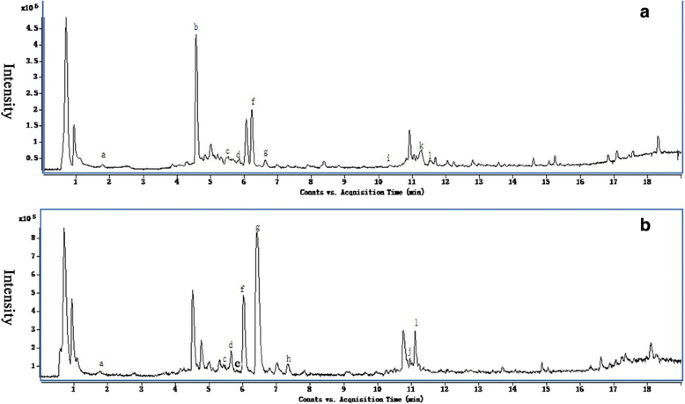
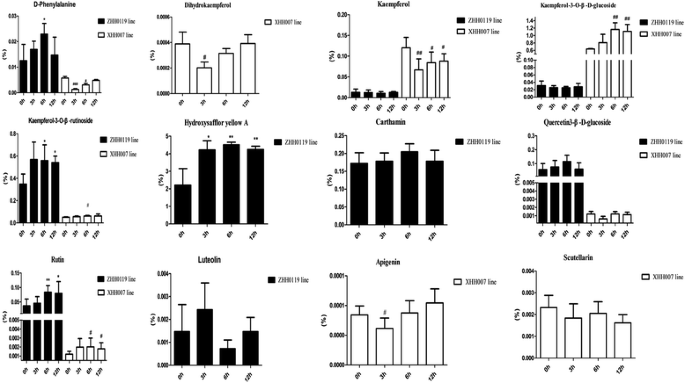
正宗标准品提取的碎片质量离子为:羟基红花黄A: m/z 613.177 ([m + H]+), rutin: m/z 611.1627 ([m + H]+), quercetin3 -β-D-glucoside: 465.1038 m / z ([m + H]+),黄芩素:m/z 463.0882 ([m + H]+), kaempferol-3-O -β-rutinoside: 595.1675 m / z ([m + H]+), kaempferol-3-O -β-D-glucoside: 449.109 m / z ([m + H]+),二氢山奈酚:m/z 289.072 ([m + H]+),木犀草素:m/z 287.0555 ([m + H]+),芹菜素:m/z 271.061([m + H]+),红花素:m/z 909.2104 ([m - h]-),山奈酚:m/z 287.056 ([m + H]+).EIC(提取离子色谱图)的概况在附加文件中提出4:图S4利用MassHunter定性分析软件(Agilent)进行峰拟合,在ZHH0119系花中检测到9种目标化合物:羟基红花黄A、芦丁、槲皮素3-β- d -葡萄糖苷、山奈酚-3- o -β-芦丁糖苷、山奈酚-3- o -β- d -葡萄糖苷、木犀草素、红花素和山奈酚(图)。6).进一步对比分析发现,与0 h诱导相比,MeJA诱导下ZHH0119花中这9种目标化合物的含量呈现不同的积累模式(图2)。7).羟红花黄A是ZHH0119的特征性和显性含量,MeJA刺激3h、6h和12h时羟红花黄A的积累量持续增加,与0 h时相比差异有统计学意义(p< 0.05)。在ZHH0119系中,另一种喹诺查尔酮型化合物红花素也受到MeJA刺激的正向调控。另一方面,受MeJA处理的ZHH0119系黄酮醇型含量也呈现不同程度的上升趋势。MeJA处理后6 h和12 h,山奈酚-3- o -β-芦丁苷和芦丁的积累均显著增强(p< 0.05)。然而,山奈酚-3- o -β- d -葡萄糖苷、山奈酚、木犀草素和槲皮素-3-β- d -葡萄糖苷的积累在MeJA刺激下没有显示出统计学上显著的变化。对于XHH007系花的积累,9个鉴定出的化合物表现出不同的积累趋势(图7)。6 b).MeJA刺激3小时后,芹菜素和二氢山柰酚的积累明显降低,与0小时比较差异有统计学意义(p< 0.05)。但在6 h和12 h时,山奈酚和d -苯丙氨酸的积累量增加到与0 h时无统计学差异的水平。相反,山奈酚-3- o -β-芦丁苷和芦丁的积累呈持续上调模式。此外,槲皮素3-β- d -葡萄糖苷和黄芩素的积累没有发现统计学上的显著变化,尽管在MeJA治疗后3h,槲皮素3-β- d -葡萄糖苷的积累减少(图)。7).在ZHH0119和XHH007中均能识别山奈酚-3- o -β-芦丁苷、山奈酚、芦丁、槲皮素-3- β- d -葡萄糖苷和d -苯丙氨酸。山奈酚、槲皮素-3- β- d -葡萄糖苷和d -苯丙氨酸除了在两个红花品系中都有增强的积累外,其余均呈相反或不同的积累模式。从整体上看,山奈酚-3- o -β- d -葡萄糖苷、芦丁和槲皮素-3- β- d -葡萄糖苷的相对含量均低于XHH007系,这与山奈酚的积累相反。上述结果表明,两个红花品系在MeJA处理后黄酮类化合物的积累模式不同,进一步揭示了两个表型和化学分型红花品系的潜在形成机制。
讨论
黄酮类化合物在红花中大量积累,已被证明具有独特的生物学特性。从红花中分离鉴定了多种黄酮类化合物;然而,它们的代谢途径在很大程度上仍然不清楚。在本研究中,我们进行了序列分析Ct研究了MeJA处理的两个红花系F3H的体外活性、转录本丰度和代谢积累。
F3H属于Fe2及2-ODD [25].所有f3h均具有两个保守基序:HxDxnH (His233, Asp235和His289),用于结合Fe2和RxS (Arg299和Ser301)结合2-OG (2 - oxglutarate) [26,27].这些保守残基也在CtF3H。我们的研究结果也表明CtF3H与其他植物的F3H具有高度同源关系。这些生物信息分析提示了其潜在的功能Ct红花类黄酮生物合成途径中的F3H。
在细胞水平上,黄酮类化合物沉积在液泡、细胞壁、囊泡、细胞质、叶绿体、细胞核、内质网等各种细胞腔室中,然后整合到蛋白质和核酸中,参与重要的生物过程[28].位于植物核中的类黄酮酶被认为是抵御紫外线和氧化损伤的DNA保护剂,或直接或间接地调节生长发育所必需的基因的转录[29].在本研究中,亚细胞定位的结果表明CtF3H蛋白定位于细胞核和细胞质,不仅丰富而且进一步支持了之前的观点[30.],他指出,拟南芥中参与类黄酮代谢的查尔酮合酶和查尔酮异构酶存在于一些细胞的细胞质和细胞核中。
体外酶活性分析表明Ct以柚皮素为底物时,F3H能有效催化二氢山奈酚的形成,这与F3H参与黄酮醇生物合成途径是一致的。K米和V马克斯在30℃时,分别为43.75±7.12 μM和22.90±0.94 μM/min。然而,K米的CtF3H(24±3 μM)高于对照组在F3H。这些差异可能在某种程度上反映了红花和红花之间F3H基因的纯粹区别拟南芥,这可能是由于它们之间的演化关系较远,也可能是由于反应条件不同,如温度和反应体系等。
在自然界中,开花是确保植物生存和繁殖成功的重要发育过程[31].这一过程受到环境和内部因素的影响。MeJA作为植物内源信号分子,调控春化、种子萌发、根生长、开花、果实成熟和衰老[32- - - - - -35].此外,MeJA已被确定为涉及次级代谢产物途径的全局基因的主要诱导物,这些基因在各种植物中积累,如甜罗勒[36),Medicago truncatula[37].作为开花植物,MeJA对植物转录水平的影响Ct研究了两个化学分型红花品系的F3H和花中黄酮类化合物的产生。植物表型是基因表达差异在严格的时空条件调控下的最终结果[38,39].F3H基因突变可影响颜色色素沉着,如先前在牵牛花、大豆、日本牵牛花、康乃馨和托雷花中所述[40- - - - - -42].在本研究中,的转录水平Ct在MeJA处理下,桔黄色花系的F3H在12 h内逐渐上调。相反,在白花红花系中观察到一个逐渐下降的调控,这表明可能是无色花表型的原因。的相反表达模式Ct两个红花品系中F3H对MeJA的响应可能在一定程度上反映了红花不同化学型的分子机制。此外,植物的许多表型特征在很大程度上取决于特定器官和组织中各种代谢物的积累,或在植物生命周期中的特定时间,根据特定的(内部和外部)信号。对橙黄花红花系代谢产物积累的进一步分析表明,羟基红花黄A、红花素、山萘酚-3- o -β-芦丁苷和芦丁含量增加。在MeJA诱导下,白花红花系山柰酚-3- o -β-芦丁苷和芦丁的积累量也增加。除了山萘酚-3- o -β-芦丁苷和芦丁在两个红花品系中均有明显的积累外,其他化合物在两个红花品系中均有相反或不同的积累规律。此外,并不是所有化合物都在橙黄花红花系和白花红花系中被识别出来。这些不同的类黄酮积累模式可能进一步揭示了两种表型和化学型的形成机制。
结论
为了研究红花中黄酮类化合物合成相关酶的编码基因及其功能,本研究首先从红花中克隆了F3H基因,通过体外酶促实验,分析了F3H基因的表达及MeJA处理对黄酮类化合物积累的影响,阐明了该基因的功能。体外酶活性分析表明Ct以柚皮素为底物时,F3H能有效催化二氢山奈酚的形成,这与F3H参与黄酮醇生物合成途径是一致的。亚细胞定位结果提示CtF3H蛋白定位于细胞核和细胞质。MeJA处理对其表达和类黄酮积累的响应结果表明Ct在MeJA诱导下,F3H在两个红花系中呈相反的表达模式。其在橙黄花红花中的高表达与喹诺查尔酮和黄酮醇的积累有关,而其在白花红花中的低表达不影响黄酮醇的积累,部分揭示了其功能CtF3H在不同表型和化学型红花系中的表达。这些结果也表明,红花的其他F3H基因或转座元件可能正调控白花红花中黄酮醇的积累。本研究为提高红花类黄酮的积累提供了理论和实践基础。需要进一步的调查来核实其他的功能和作用Ct其他红花系中的F3Hs。
方法
从转录谱数据库中发现CtF3H
为研究红花的功能基因,对红花进行了花转录组测序。表达序列标记(est)由BLASTx和BLASTn在Nr和Nt数据库中标注(未发表)。在红花中,只有一个基因被标记为F3H。
植物材料
ZHH0119系系采自新疆农业科学院红花种质资源。XHH007系系由我实验室和新疆农业科学院选育的栽培品种,2007年通过新疆省非主要作物品种注册局审定。他们被确认为Carthamus tinctoriusL.郭美丽教授。株系ZHH0119和XHH007的Voucher标本分别为SMMU120625和SMMU120626。保存于第二军医大学药学院生药学系药用植物标本室。
ZHH0119和XHH007系在第二军医大学温室栽培。ZHH0119和XHH007系均在实验室反复纯化。具有橙黄色花瓣的ZHH0119系是喹诺查尔酮的主要来源,而具有白色花瓣的XHH007系主要含有黄酮醇,不含喹诺查尔酮(图2)。1).在16小时的光周期内,植物的平均温度为25°C。
分离和克隆CtF3H
获得的cDNA全长序列Ct红花中的F3H, 5 ' -和3 ' -RACE实验采用SMART RACE cDNA扩增试剂盒(Clontech, USA)进行。设计基因特异性引物TGATCCAACTCTCCCCACCATCACG (GSP-1)和GAGGGAGAACCGGTGGAAGATTGGAGG (GSP-2)Ct本实验室红花est数据库中的F3H片段。将5 ' -和3 ' - race扩增片段克隆到pMD-19载体(Takara, Dalian, China)中进行测序。引物对CtF3H-F/-R随后根据序列装配结果进行设计(CtF3H-F: CATCAACAAACACCCCACAC和CtF3H-R: AGTGATAGCAACAAAAGCACAC)扩增全长cDNA。将扩增片段克隆到pMD-19载体中,进行测序。
序列分析CtF3H
的序列CtF3H mRNA已提交到GenBank,登录号为AEG64806.1。蛋白质的理论等电点和质量值通过使用ExPASyProtParam工具(http://web.expasy.org/protparam/).确定…的保守母题CtF3H,其推导出的氨基酸序列使用DNAMAN软件8.0版本与其他物种的F3H蛋白进行比对[21].利用MEGA软件5.0版本的邻居连接方法构建了不同植物F3H基因的系统发育树,显示了不同植物F3H基因的系统发育关系。所构建的树参数为:系统发育重建:自举法(1000个重复),替代模型:氨基酸和p-距离,替代包括:全部,谱系间模式:相同(同质),位点间率:均匀率。
亚细胞定位CtF3H蛋白质
的亚细胞定位CtF3H蛋白首先通过WoLF PSORT程序预测(http://www.genscript.com/psort/wolf_psort.html) [43].然后,整个打开阅读框CtF3H蛋白通过引物在5 '端添加pmt -39载体特异性序列(F:GAGCTTTCGCGGATCCGCCACCATGGCTCCGATATCGTCGT和R: CATGGTGGCAAGCTTAGGGCCGGGATTCTCCTCCACGTCACCGCATGTTAGAAG)进行扩增。然后使用SunBio克隆试剂盒(Sun Bio, Shanghai, China)将扩增片段与线性化PMT-39载体融合。经测序确认,生成的重组t转化为农用电穿孔仪和PMT-39单独分离GV3101。选择阳性农杆菌,在加50mg/L卡那霉素和100mg /L链霉素的Luria-Bertani (LB)培养基中培养。在OD600为1.0的条件下收获农杆菌后,以5500 rpm的转速离心10min,并在相同体积的MS液体培养基中重悬。将洋葱表皮层置于Murashige和Skoog(MS)液体培养基中20min,然后在MS固体琼脂上加0.4mol/L甘露醇,25℃黑暗条件下孵育24小时。核提取和4 ',6 ' -二氨基-2-苯基吲哚(DAPI)染色[44].的GFP荧光Ct在共聚焦显微镜(Leica TCS SP5)下观察F3H蛋白和对照组。
重组蛋白表达CtF3H蛋白、纯化及活性测定
的编码区Ct通过使用KOD DNA聚合酶(Toyobo, Japan)和引物对将F3H从pMD19 (Takara)扩增到pMAL-C5x载体(NEB, New England)CtF3H-F/R (forward: 5 ' -CAAAGAACGTGCcatatgAAACCTAT-3 ',增加NdeI限制位点;逆序:5 ' - tcttaagcagatattttctcgatgggt -3 ',并增加EcoRI酶切位点),该酶由的序列设计而成Ct本实验室提交的F3H mRNA (GenBank登录号;AEG64806.1)。扩增产物测序,然后用限制性内切酶(NEB, New England)消化,以促进与编码麦芽糖结合蛋白(MBP)的线性化质粒pMAL-C5x的适当克隆位点的连接。在对其完整性进行验证后,将该结构引入大肠杆菌BL21(DE3)pLysS细胞(TransGen Biotech,北京)蛋白表达。
重组CtF3H蛋白按照之前的方法表达[45,并作了一些修改。大肠杆菌BL21(DE3)pLysS细胞含有pMAL-C5x-CtF3H在含氨苄西林(100mg/L)的300ml LB培养基中培养。当细胞生长到2x10时,加入IPTG至终浓度0.4mM8细胞/ml (A600 = 0.5)。37℃孵育4小时,5000 × g离心收集10分钟;上清液滗出。将细胞重悬在由20 mM Tris-HCl、200 mMNaCl和1 mM EDTA组成的100 ml柱缓冲液中,然后进行15秒脉冲超声处理。用13000 × g离心20分钟收集上清液,然后用淀粉酶树脂柱纯化。将纯化后的蛋白浓缩至至少1mg/ml,用Xa因子切割,以消除载体表达的mbp标记对酶活性分析的影响。根据制造商说明书,使用pMAL™蛋白融合和纯化系统(NEB, New England),通过阴离子交换色谱从MBP中分离目标蛋白,然后用于体外酶测定。纯化后的可溶性pMAL-C5x-CtF3H进行变性SDS-PAGE凝胶电泳(10%丙烯酰胺),考马斯亮蓝染色观察[46].
的CtF3H蛋白采用改良Bradford蛋白检测试剂盒(生工生物科技有限公司)检测,并采用相同方法测定BSA蛋白的标准曲线进行定量(附加文件)5:图S5)。然后Ct以100 mMtricine (pH 7.5)、10% (w/v)甘油、2 mg/ml抗坏血酸、0.5 mg/ml过氧化氢酶、0.1mg/ml牛血清白蛋白、40μM FeSO4、1mM 2-氧化戊二酸、100 μMnaringenin为底物(均来自美国Sigma-Aldrich公司),50μg纯化,在30℃下反应10 min,测定F3H活性Ct不含mbp标记的F3H蛋白[20.,47].反应产物自动进样于XBridge™BEH-C18反相色谱柱(2.1mm × 100mm, 2.5 μM)的UPLC-Q-TOF/MS系统中。溶剂为(a)含0.1%甲酸的水和(b)含0.1%甲酸的乙腈。分离工艺为:0 ~ 2 min, 5% B;2-15分钟,95% B。在相同条件下,通过色谱行为和紫外光谱与柚皮素和双氢山奈酚的标准品进行比较,对产品进行了鉴定。柚皮素的催化动力学Ct通过改变反应缓冲液中柚皮素的浓度(10 ~ 800 μM)测定F3H。每一浓度柚皮素重复3次。利用Graphpad Prism 5软件,应用Michaelis-Menten方程得到了动力学参数。应用标准校准曲线计算反应产物的数量(附加文件6:图S6)。
惩罚处理
将100μM的MeJA (Sigma-Aldrich)溶液喷洒于ZHH0119和XHH007在花冠从萼片突出的第一天开放的健康花上。在对照组中,花被喷洒了相同的溶液,但没有使用MeJA,然后用塑料袋覆盖。为了尽量减少因单株间的差异而可能产生的误差,每一种处理浓度喷洒5朵花,每朵花连续喷洒5次。处理后的花用透明塑料袋包裹,以防止挥发性植物激素的释放,并使激发子溶液被更大程度地吸收。处理0 h、3 h、6 h、12 h后,取出塑料袋,分别在4个时间点采集5个花样,立即在液氮中冷冻,并在−80°C的冰柜中保存。
实时荧光定量PCR分析CtF3H
分别于0、3、6、12 h采收两组花,分析ZHH0119和XHH007系CtF3H的转录本。利用花总RNA合成第一链cDNA进行qRT-PCR (quantitative RT-PCR)分析。用特异性引物进行PCR分析CtF3H基因(正向:ACACGAACCGACTATCCATA;反向:GACCTATCTCCTTCATTCACTT)和Ct60s基因(正向:CATCCATTATCCAACAATC;反向:AAGAGTAATCAGTCTCCA)。qRT-PCR采用ABI7500实时PCR检测系统(Applied Biosystems),使用TransStart Green qPCR supermix (TransGen Biotech, Shanghai, China),按照制造商的协议进行。所有qRT-PCR扩增均在3个独立的生物重复和3个技术重复中进行。的Ct选择60s基因(KJ634810)作为管家基因(资料未发表)。的相对表达量CtF3H以0 h相对表达量为参比,2-△△Ct方法。
代谢物提取和超高相色谱质谱(MS)/飞行时间(TOF)分析
5朵精确称量(4.0mg)的冻干花浸泡在1ml溶剂(甲醇:H2O = 6:4)过夜,然后超声检查一次40分钟。提取液以8000rpm离心10min;获得上清液,保存于-80°C或直接使用超高效液相色谱(UHPLC)系统(Agilent 1290 Infinity UHPLC;安捷伦技术公司,Waldbronn,德国)配备了安捷伦6538超高清精确质量Q-TOF LC/MS(安捷伦技术公司,圣克拉拉,加州,美国),配备了ESI(电喷雾电离)接口。色谱分离采用Waters XSELECT™HSS T3 C18色谱柱(100 × 2.1mm,粒径2.5μm),流动相为(a)水(0.1%甲酸)和(b)乙腈(0.1%甲酸)。柱式烘箱温度维持在40℃。电离参数包括气体温度350℃,气体流量11 L/min;毛细管、破碎器和脱脂器1的电压分别为4000V、120V和60V,雾化器的电压为45psi。八极体射频峰值电压设置为750V,参考质量分别为m/z 121.0509和m/z 922.0098。质量采集范围为100- 1100amu,光谱在正模式下获得。 The gradient elution of samples went from 95 % A to 5 % B in 2 min, 80 % A to 20 % B in 4 min, 79 % A to 21 % B in 6 min, 74 % A to 26 % B in 9 min, 60 % A to 40 % B in 11 min, 20 % A to 80 % B in 15 min, and 5 % A to 95 % B in 19 min, at a flow rate of 0.4ml/min. The compound identification was confirmed with the use of 12 authentic standards, namely: D-phenylalanine, hydroxysafflor yellow A, rutin, quercetin 3-β-D-glucoside, scutellarin, kaempferol-3-O-β-rutinoside, kaempferol-3-O-β-D-glucoside, dihydrokaempferol, luteolin, apigenin, carthamin, and kaempferol. Metabolite data were processed by using the MassHunter qualitative analysis software (Agilent) to obtain the peak fitting and abundance values. The metabolite accumulation in flowers after treatment with MeJA for 3 h, 6 h, and 12 h were respectively compared with that in flowers treated with MeJA for 0 h.
统计分析
采用单因素方差分析对花代谢产物的积累进行统计分析。每个结果以至少3个生物重复的平均值±标准差(SD)表示,统计学意义由P-value cut off为0.05。
缩写
时尚,oleoylphosphatidylcholinedesaturase;F3H,黄酮3-羟化酶;PMT-39 pcambia - 1380 - camv35s mcs - egfp -号;2-ODD, 2-羟戊二酸依赖双加氧酶;GFP,绿色荧光蛋白;MBP,麦芽糖结合蛋白;2-OG 2-oxoglutarate;MeJA,茉莉酸甲酯;磅,Luria-Bertani;MS, Murashige和Skoog; DAPI, 4’,6’-diamidino-2-phenylindole; UHPLC-MS/TOF, Ultra performance liquid chromatography- Mass Spectrometry/Time of Flight.
参考文献
Ortuño A, Báidez A, Gómez P, Arcas MC, Porras I, García-Lidón A,等。柑橘黄酮和柑橘黄酮在抗青霉防御机制中的作用。食品化学,2006;98(2):351-8。
El-Wakeil NE。植物农药及其作用方式。中国科学(d辑:自然科学),2013;
Sosa T, Chaves N, Alias JC, Escudero JC, Henao F, Gutiérrez-Merino C.柑橘黄酮对口腔骨骼肌松弛的抑制作用:一种针对食草动物的植物防御机制。化学生态学报,2004;30(6):1087-101。
施泰克尔纳,兰泽莫,李文杰,李文杰,等。根分泌物中的黄酮类化合物和独脚金内酯在共生和致病植物-真菌相互作用中的信号作用。分子。2007;12(7):1290 - 306。
王晓明,王晓明,王晓明,等。大豆根瘤菌对黄酮类化合物的响应。中国微生物学杂志,2010;30(1):344 - 344。
黄志强,李志强,李志强,等。黄酮类化合物在植物与环境相互作用中的作用。分子。2014;19(10):16240 - 65。
花的颜色和细胞色素P450。植物化学,2006;5(2-3):283-91。
S Leena S, N Aravindha B, Vidya R, Priyadharsini C, Masthan KMK。黄酮类化合物-临床效果和应用在牙科:综述。《药学与生物联合科学杂志》2014;6(增刊1):S26-9。
黄酮类化合物生物合成和进化的系统研究。植物学报。1978;44(4):399-429。
Gutha LR, Casassa LF, Harbertson JF, Naidu RA。病毒感染对葡萄叶片类黄酮生物合成途径基因和花青素的调控。植物学报。2010;10(4):315-19。
Routaboul JM, Kerhoas L, Debeaujon I, Pourcel L, Caboche M, Einhorn J,等。拟南芥种子类黄酮的多样性及生物合成。足底。2006;224(1):96 - 107。
李锐,郭敏,张刚,徐霞,李强。烟苷降低原代培养大鼠脑血管内皮细胞缺血性损伤,上调内皮型一氧化氮合酶。中华民族药物学杂志,2006;37(1):1 - 5。
涂艳,薛艳,郭东,孙玲,郭敏。红花的民族药理学、药理及临床应用综述。中国农业科学。2015;25(5):553-66。
李华,董勇,杨娟,刘鑫,王勇,姚楠,等。红花从头转录组与油苷和黄酮类化合物生物合成推测基因的鉴定。科学通报。2012;7(2),e30987。
Sadeghi M, Dehghan S, Fischer R, Wenzel U, Vilcinskas A, Kavousi HR,等。红花盐胁迫、损伤和水杨酸处理过程中等脉络酸合成酶和肉桂酸4-羟化酶的分离与表征。植物信号和行为。e27335 2013; 8(11)。
曹山,周旭,Wood CC, Green AG, Singh SP,刘林,等。红花(Carthamus tininctorius L.)中Fad2基因的大而功能多样的家族。植物学报。2013;13(1):5。
Dehghan S, Sadeghi M, Poppel A, Fischer R, lake - harlan R, Kavousi HR,等。红花的苯丙氨酸解氨酶和查尔酮合成酶在损伤、水杨酸处理和盐度胁迫中的差异诱导。生物科学通报2014;34(3):273-82。
王晓明,王晓明,王晓明。余子叶黄酮3-羟化酶基因的功能鉴定。植物生物化学学报。2015;24(4):453-60。
沈刚,庞勇,吴伟,邓智,赵林,曹勇,等。银杏黄酮3-羟化酶基因的克隆与鉴定。科学通报2006;26(1):19-29。
欧文斯DK,克罗斯比KC, Runac J,霍华德BA,温克尔BS。拟南芥黄酮3β-羟化酶的生物化学和遗传特性。植物生理学报,2008;46(10):833-43。
刘敏,李霞,刘颖,曹斌。黄酮3-羟化酶基因对紫外光- b辐射和干旱胁迫下红砂黄酮生物合成途径的调控。中国生物医学工程学报,2013;
张慧,赵玲,王娟,郑玲,党志,王艳。三叶沙鳖黄酮-3-羟化酶两个基因的克隆及功能分析。植物物理学报,2014;36(5):1221-29。
小麦科植物F3h复制基因的多样性研究。中华生物医学杂志,2013;26(4):326 - 326。
王晓明,王晓明,王晓明,等。茶黄酮3-羟化酶基因在转基因烟草中的表达及其对盐胁迫和疫病抗性的影响。植物分子生物学杂志,2014;85(6):551-73。
张哲。2-羟戊二酸依赖加氧酶及其相关酶的结构和机制研究。中国生物医学工程学报。1999;9(6):722-31。
Clifton IJ, McDonough MA, Ehrismann D, Kershaw NJ, Granatino N, Schofield CJ。2-氧戊二酸加氧酶及相关双链β-螺旋折叠蛋白的结构研究。中国生物医学工程学报。2006;30(4):344 - 344。
Koehntop KD, Emerson JP, Jr LQ。2- his -1-羧酸面部三联体:单核非血红素铁(II)酶双氧激活的多功能平台。生物无机化学学报。2005;10(2):87-93。
赵杰,Dixon RA。类黄酮运输的“进”和“出”。植物科学进展,2010;15(2):72-80。
Polster J, Dithmar H, Burgemeister R, Friedemann G, Feucht W.植物核中的黄酮类化合物:激光显微解剖和压力弹射(LMPC)、体内染色和紫外可见光谱滴定法检测。植物科学进展。2006;28(1):344 - 344。
萨斯洛斯基德,韦克乌,温克尔b。拟南芥类黄酮酶的核定位。中国生物医学工程学报,2005;29(2):339 - 339。
傅迪特,柯娜杰,普拉查罗恩瓦塔娜I,布莱斯JH,史密斯SM。拟南芥3-酮酰基辅酶a硫酶-2 (kat2-1)突变体显示开花时间增加,但繁殖成功率降低。应用物理学报,2007;32(11):2959-68。
王志强,王志强,王志强,等。一个mvp突变体的转录组分析揭示了全局基因表达的重要变化以及茉莉酸甲酯在小麦春化和开花中的作用。中国机械工程学报,2014;26(3):344 - 344。
王晓明,王晓明,王晓明,等。茉莉酸甲酯对拟南芥突变体根系生长和叶片蛋白诱导的抑制作用减弱。美国国家科学院。1992; 89(15): 6837 - 40。
Concha CM, Figueroa NE, Poblete LA, Oñate FA, Schwab W, Figueroa CR. jasmonate甲基处理通过改变chiloensis果实若干成熟基因的表达,诱导果实成熟的变化。中国生物工程学报,2013;
胡晓峰,张志刚,张志刚,张志刚。茉莉酸甲酯蒸汽对蔬菜幼苗花青素、生物胺和脱羧酶活性的影响。Acta SciPol-Hortoru。2014; 13(1): 3日- 15日。
米斯拉,马迪,夏诺提亚,尚克,高希。茉莉酸甲酯诱导的甜罗勒转录应答和五环三萜生物合成。中国生物医学工程学报,2014;29(2):344 - 344。
Broeckling CD, Huhman DV, Farag MA, Smith JT, May GD, Mendes P,等。截断紫花苜蓿细胞培养的代谢谱揭示了生物和非生物激发子对代谢的影响。中国机械工程学报,2005;26(4):529 - 529。
盖塔RT,皮雷JC,伊尼格斯-卢伊F,莱昂E,奥斯本TC。人工合成甘蓝型油菜的基因组变化及其对基因表达和表型的影响。植物学报。2007;19(11):3403-17。
Zia M, Mirza B, Malik SA, Chaudhary MF。转基因大豆(Glycine max L.)中rol基因的表达导致植株表型、叶片形态和开花时间的改变。植物科学进展。2010;36(2):366 - 366。
Va A, Houwelingen N, Souer E, Spelt K, Kloos D, Mol J,等。矮牵牛随机转座子诱变产生的花色素突变体分析。植物学报,1998;13(1):39-50。
Hoshino A, Abe Y, Saito N, Inagaki Y, Iida S.黄酮3-羟化酶基因在携带斑点突变的日本牵牛花淡黄色花朵中正常表达,不产生黄酮醇和花青素,但积累查尔酮、金酮和黄酮。植物细胞生理学杂志,1997;38(8):970-4。
西原M,山田E,齐藤M,藤田K,高桥H,中冢t。白花托雷乃属植物突变的分子特征。植物学报。2014;14(1):86。
Horton P, Park K, Obayashi T, Fujita N, Harada H, Adams-Collier CJ,等。WoLF PSORT:蛋白质定位预测器。Nucleic Acids Res. 2007;35附录2:W585-7。
李志强,李志强,李志强,等。拟南芥叶片冷冻切片和分离核的三维荧光原位杂交。植物科学进展。2009;5(1):1 - 7。
谭军,涂林,邓峰,胡红,聂艳,张霞。通过遗传代谢分析发现,类黄酮柚皮素可延缓棉纤维细胞发育。中国生物医学工程学报,2013;29(1):344 - 344。
韩旭,吴勇,高松,余辉,徐荣,娄华,等。尾斜裂黄酮合酶I的功能表征,显示黄酮2-羟化酶活性。中国科学(d辑),2014;
徐峰,李林,张伟,程华,孙宁,程松,等。银杏黄酮醇合成酶基因的分离、鉴定及功能分析。Mol生物学杂志2012;39(3):2285-96。
确认
作者对新疆农业科学院为红花株系ZHH0119提供种子表示感谢。董欣(第二军医大学讲师)对代谢产物分析提出建议。本工作得到国家自然科学基金(81173484,81473300)和上海市自然科学基金(13ZR1448200)的资助。
资金
本工作得到国家自然科学基金(81173484,81473300)和上海市自然科学基金(13ZR1448200)的资助。
支持数据的可用性
所有的支持性数据都作为附加文件包含在这篇手稿中。
作者的贡献
YHT、FL和DDG参与了大部分实验、数据分析和手稿的撰写。LJF和ZXZ对CtF3H进行克隆。YRX在材料收集和稿件格式方面做出了贡献。MLG和YG发起了项目,提出了稿件大纲,并指导了稿件的撰写和数据分析。所有作者都阅读并批准了最终的手稿。
作者信息
从属关系
相应的作者
道德声明
相互竞争的利益
作者宣称他们之间没有利益冲突。
发表同意书
不适用。
道德
这项研究没有涉及人类或动物。
附加文件
附加文件1:图S1。
不同植物F3Hs氨基酸序列的系统发育树。(JPG 50kb)
附加文件2:图S2。
重组体SDS-PAGE分析Ct不含MBP-标记的F3H蛋白。(JPG 33kb)
附加文件3:图S3。
无mbp标记纯化CtF3H的动力学分析。(JPG 32kb)
附加文件4:图S4。
黄酮类化合物的ECI谱。(PDF 890kb)
附加文件5:图S5。
改进Bradford法测定牛血清白蛋白的标准曲线。(JPG 36kb)
附加文件6:图S6。
二氢山奈酚和柚皮素的标准曲线。(JPG 41kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
涂,Y,刘,F,郭,D。et al。茉莉酸甲酯刺激下两个化学分型红花品系黄酮3-羟化酶基因和类黄酮积累的分子特征BMC植物生物学16日,132(2016)。https://doi.org/10.1186/s12870-016-0813-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-016-0813-5
关键字
- 黄酮3-羟化酶基因
- 功能描述
- 类黄酮积累
- 甲基jasmonate
- 红花(Carthamus tinctoriusl .)