- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发布:GydF4y2Ba
不定根形成在黄瓜中一氧化氮是参与氢气诱导的细胞周期激活GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba16GydF4y2Ba文章编号:GydF4y2Ba146.GydF4y2Ba(GydF4y2Ba2016年GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
不定根的发育是一个复杂的过程,受到多种信号分子的调控。氢气(HGydF4y2Ba2GydF4y2Ba)和一氧化氮(NO),这两个新的信号分子都参与植物的发育和逆境耐受性。GydF4y2Ba
结果GydF4y2Ba
为了研究不定根发育由富氢水(HRW)诱导的机制,荧光显微镜和分子方法的组合被用来研究细胞周期激活和细胞周期相关基因的表达在黄瓜(GydF4y2BaCucumis sativusGydF4y2Ba'新春4')外植体。结果表明,HRW对不定根发育的影响是依赖于剂量的,最大生物反应在50%HRW下。HRW治疗以时间依赖的方式没有增加内容。结果还表明,HRW和促进了G1-o的转变和上调细胞周期相关基因:GydF4y2BaCycAGydF4y2Ba(a类型细胞周期蛋白),GydF4y2BaCycBGydF4y2Ba(B型细胞周期蛋白),GydF4y2BaCDKA.GydF4y2Ba(周期素依赖性激酶A)和GydF4y2BaCDKB.GydF4y2Ba(周期蛋白依赖性激酶B)的表达。在黄瓜外植体中,HRW和NO上调了与黄瓜不定根相关的靶基因。而hrw诱导的不定根发育和NO含量增加的响应部分被特定的NO清除剂2-(4-羧基苯基)-4,4,5,5-四甲基咪唑啉-1-氧基-3-氧化物钾盐、NO合酶(NOS)样酶抑制剂N所阻断GydF4y2BaGGydF4y2Ba硝基 -GydF4y2BaL.GydF4y2Ba-Arpinine甲基酯盐酸盐,或硝酸还原酶抑制剂钨酸盐和南GydF4y2Ba3.GydF4y2Ba.这些化学物质还部分逆转了HRW对细胞周期激活以及细胞周期调控基因和与不定根形成相关的靶基因转录的影响。GydF4y2Ba
结论GydF4y2Ba
在一起,否可能出现在H中的下游信号分子GydF4y2Ba2GydF4y2Ba诱导不定根器官发生。此外,HGydF4y2Ba2GydF4y2Ba在不定根形成过程中通过NO途径介导的细胞周期激活。GydF4y2Ba
背景GydF4y2Ba
不定根是植物无性繁殖的关键环节。了解不定根的形成机制对制定育种策略以最大限度地提高其市场产量具有重要意义[GydF4y2Ba1GydF4y2Ba].不定根开发是由几种环境和内源性因素调节的复杂过程。近年来,在偶然生根期间对信号转导领域的兴趣日益增加。立即直接ill,一氧化氮(否)[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba),GydF4y2Ba2+GydF4y2Ba钙调素(CaM) [GydF4y2Ba4.GydF4y2Ba),GydF4y2Ba2+GydF4y2Ba- 依赖蛋白激酶活动(CDPK)[GydF4y2Ba5.GydF4y2Ba],环状guanosinemonophosphate(cGMP)的[GydF4y2Ba6.GydF4y2Ba),乙烯(GydF4y2Ba7.GydF4y2Ba],丝裂原激活蛋白激酶[GydF4y2Ba2GydF4y2Ba], 一氧化碳 [GydF4y2Ba8.GydF4y2Ba),多胺(GydF4y2Ba9.GydF4y2Ba],过氧化氢[GydF4y2Ba10GydF4y2Ba],硫化氢[GydF4y2Ba11GydF4y2Ba]和氢气(HGydF4y2Ba2GydF4y2Ba) [GydF4y2Ba12GydF4y2Ba已建议参与外来生根过程。然而,与不定根相关的信号传导分子的复杂网络仍不清楚。更好地理解通过信号分子的不定根引发的调节将推进我们对调节不定根发育的分子机制的理解。GydF4y2Ba
气态化合物NO是一种氧化还原活性小信号分子,可以调节几乎所有的生物和非生物应激反应[GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba].以往的研究也表明NO参与植物的成熟、衰老等各种生理过程[GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba]种子萌发或休眠[GydF4y2Ba17GydF4y2Ba那GydF4y2Ba18GydF4y2Ba],花卉过渡[GydF4y2Ba19GydF4y2Ba]和气孔运动[GydF4y2Ba20.GydF4y2Ba].在根的器官发生中,包括侧根的形成,也需要NO [GydF4y2Ba21GydF4y2Ba],根毛的形成[GydF4y2Ba22GydF4y2Ba和不定根[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba23GydF4y2Ba].虽然众多研究表明,禁止不定的根部形成,但目前有关于其机制的信息。GydF4y2Ba
HGydF4y2Ba2GydF4y2Ba,一种无色,无臭,无味的气体在本质上是已知的和作为惰性气体的结构最简单的气体。以前的研究已经表明,^ hGydF4y2Ba2GydF4y2Ba是潜在的治疗医疗气体[GydF4y2Ba24GydF4y2Ba].它已在全球范围内引起关注,因为它可以在细胞中选择性地减少羟基和过氧基酯[GydF4y2Ba25GydF4y2Ba].随后,从各种动物实验和临床试验中积累的证据表明,HGydF4y2Ba2GydF4y2Ba可能具有抗炎、抗凋亡和抗过敏作用[GydF4y2Ba26GydF4y2Ba].最近,有一些报道表明HGydF4y2Ba2GydF4y2Ba可能在包括盐度的植物压力反应中发挥关键作用[GydF4y2Ba27GydF4y2Ba-GydF4y2Ba29GydF4y2Ba],干旱[GydF4y2Ba29GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba],百草枯诱导的氧化应激[GydF4y2Ba30.GydF4y2Ba],镉毒性[GydF4y2Ba31.GydF4y2Ba],铝应力[GydF4y2Ba32.GydF4y2Ba],汞毒性[GydF4y2Ba33.GydF4y2Ba]和紫外线 - 一种照射[GydF4y2Ba34.GydF4y2Ba].通过调节抗氧化剂防御,富含氢水也可以在储存期间延迟猕猴桃的开采成熟和衰老[GydF4y2Ba35.GydF4y2Ba].值得注意的是,Lin等人[GydF4y2Ba12GydF4y2Ba]发现hGydF4y2Ba2GydF4y2Ba可能以血红素加氧酶-1/一氧化碳依赖的方式调控黄瓜不定根的发育。作者认为,外源HRW处理可能是诱导植物根系器官发生的较好选择。然而,HGydF4y2Ba2GydF4y2Ba对不定根发育的调控需要充分研究。GydF4y2Ba
因此,H.GydF4y2Ba2GydF4y2BaNO和NO被认为是植物中具有多种生物学功能的信号调节剂。然而,关于HGydF4y2Ba2GydF4y2Ba和NO在调节生理过程中的作用。人们发现HGydF4y2Ba2GydF4y2Ba抑制LPS /IFNγ诱导的NO的产生通过信号转导的调节巨噬细胞和小鼠中改善炎症性关节炎[GydF4y2Ba36.GydF4y2Ba].它为H,条件的分子基础GydF4y2Ba2GydF4y2Ba对炎症的影响和HGydF4y2Ba2GydF4y2Ba也没有。HGydF4y2Ba2GydF4y2Ba和NO也在苜蓿找到。最近,人权观察报告,以减轻根伸长的铝 - 诱导抑制通过降低NO产生[GydF4y2Ba32.GydF4y2Ba].最近,H之间的串扰GydF4y2Ba2GydF4y2Ba而NO在气孔运动过程中ABA信号级联中起核心作用[GydF4y2Ba37.GydF4y2Ba].GydF4y2Ba
细胞发育是植物生命周期中完成个体发生程序的关键驱动力,细胞发育是植物生命周期中完成个体发生程序的关键驱动力。细胞周期的所有阶段都由高度保守的蛋白质、周期蛋白依赖性激酶(CDK)和周期蛋白的异二聚体复合物调控[GydF4y2Ba38.GydF4y2Ba].在高等真核生物中,CYCD和CDKA的激活导致产生抑制蛋白激酶,在g1 - s期转变时磷酸化视网膜母细胞瘤蛋白[GydF4y2Ba39.GydF4y2Ba].在下一个检查点中,b型CKDs和a、b型cyclin参与g2 - m期转变[GydF4y2Ba40GydF4y2Ba].此外,CDK/周期蛋白复合物可被一类CDK抑制蛋白灭活[GydF4y2Ba41.GydF4y2Ba].GydF4y2Ba
有人建议使得hGydF4y2Ba2GydF4y2Ba和NO对不定根的形成有积极的影响。前期研究结果表明,50 μM NO供体硝普钠(SNP)对不定根有显著影响[GydF4y2Ba10GydF4y2Ba].但是,否定的串扰GydF4y2Ba2GydF4y2Ba在促进不定根方面的作用及其机理尚不清楚。本研究采用分子和药理学方法研究了HGydF4y2Ba2GydF4y2Ba没有关于黄瓜的不定根发育(GydF4y2BaCucumis sativusGydF4y2Ba“新春4”)外植体,以及细胞周期激活和细胞周期和细胞周期和偶然生根相关基因在下杆杆菌。因此,本研究的目的是确定不在H中的作用GydF4y2Ba2GydF4y2Ba- 在不定根期间进行细胞周期。GydF4y2Ba
结果GydF4y2Ba
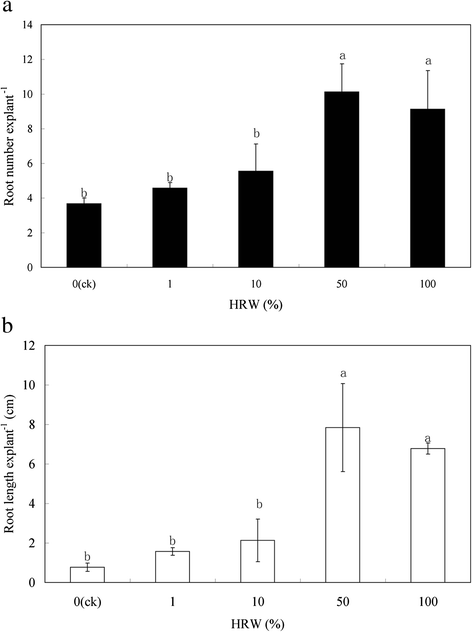
HRW以剂量依赖的方式促进不定根的发育GydF4y2Ba
为了理解HRW对不定根发育的影响,黄瓜外植体用不同浓度的HRW处理(0,1%,10%,50%,100%)。与对照(蒸馏水)相比,HRW对不定根(图显著影响。GydF4y2Ba1GydF4y2Ba).与对照相比,1和10% HRW处理的根数和根长差异不显著,但显著低于50和100% HRW处理。在不同浓度中,50% HRW处理根数(10.13)和根长(7.84 cm)最大(图)。GydF4y2Ba1GydF4y2Ba).因此,根部发育的促进在50%HRW下最大化,并且在生根过程中进一步使用该浓度进行研究。GydF4y2Ba
NO的消除逆转了hrw诱导的不定根的发育GydF4y2Ba
然而,SNP诱导不定根的开发,CPTIO降低了SNP的积极作用。进一步调查NO中的参与GydF4y2Ba2GydF4y2Ba引起的不定根发育,NO清除剂CPTIO的影响,NOS抑制剂L-名称和NR抑制剂NANGydF4y2Ba3.GydF4y2Ba和与HRW处理的外植体的不定根发育钨进行了测定。HRW诱导生根部分被cPTIO,L-NAME钨或NaN反转GydF4y2Ba3.GydF4y2Ba.与对照相比,HRW + cPTIO、L-NAME或NaN处理的外植体效果更好GydF4y2Ba3.GydF4y2Ba导致显着降低根系和长度(图。GydF4y2Ba2GydF4y2Ba).此外,SNP分解的其他副产品对不定根发育的显着促进,它显着低于活性SNP的治疗。上述结果表明,不可能充当HRW诱导的不定根开发中的下游信号分子。GydF4y2Ba
HRW,SNP,Li SNP,CPTIO,L-NAME和NAN的影响GydF4y2Ba3.GydF4y2Ba黄瓜外植体的不定根发育。将5日龄萌发黄瓜下胚轴的初生根系去除。黄瓜外植体用50% HRW、50 μM SNP、50 μM LI SNP、光灭活硝普钠、200 μM cPTIO、30 μM L-NAME和10 μM NaN培养GydF4y2Ba3.GydF4y2Ba如图5天所示。不定根根(GydF4y2Ba一种GydF4y2Ba)及长度(GydF4y2BaB.GydF4y2Ba)表示为平均值±se(GydF4y2BaNGydF4y2Ba = 3). 10 explants was used in an independent experiment. Bars not sharing the same letters were significantly different by Duncan’s test (P.GydF4y2Ba< 0.05)。照片(GydF4y2BaCGydF4y2Ba)治疗后的5天服用。Bar = 5 cm
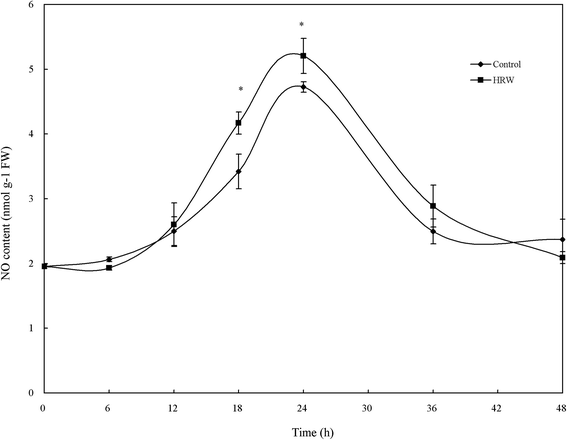
内源性的生产没有参与HRW诱导的不定根形成GydF4y2Ba
由于NO在调控不定根发育中起着关键作用,我们测定了HGydF4y2Ba2GydF4y2Ba影响与硬红冬小麦或用蒸馏水处理胚轴NO生产。如图1所示。GydF4y2Ba3.GydF4y2Ba50% HRW诱导NO的产生具有时间依赖性。HRW处理6 h后NO含量增加,在处理24 h达到最大值。对照外植体中NO含量较低,在18和24 h显著低于hrw处理的外植体(图2)。GydF4y2Ba3.GydF4y2Ba).GydF4y2Ba
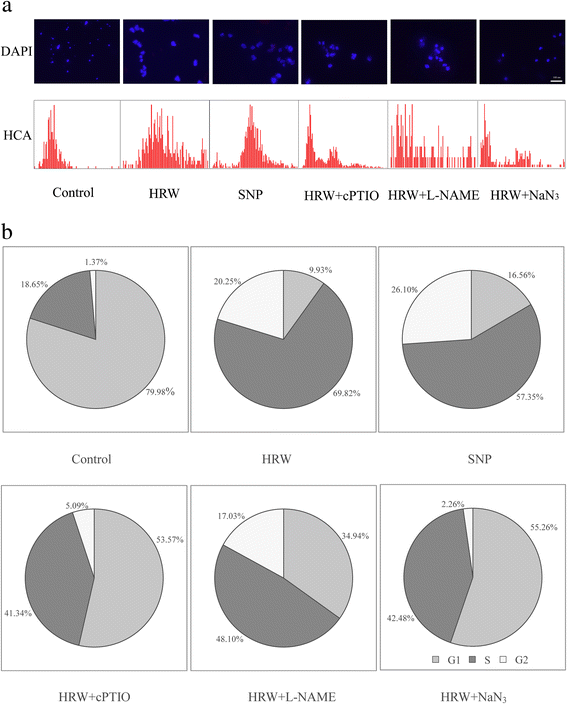
在不定根开发期间,不可涉及HRW诱导的细胞周期激活GydF4y2Ba
为了深入了解HRW诱导不定根发育的机制,我们分析了NO是否可能参与HRW诱导细胞分裂活性的功能。细胞核的代表性图片(DAPI板),以及DAPI染色得到的DNA直方图(HCA板),如图所示。GydF4y2Ba4GydF4y2Ba.与对照样品相比,具有50%HRW或50μMSNP的处理显示得更明显的焦点(图。GydF4y2Ba4GydF4y2Ba),说明处于g1 - s过渡阶段的细胞较多。然而,cPTIO, L-NAME或NaNGydF4y2Ba3.GydF4y2BaHRW引起的明显病灶减少。DAPI染色得到的DNA直方图及细胞核的代表性图片如图所示。GydF4y2Ba4GydF4y2Ba(HCA面板)。DNA histograms of asynchronous cells clearly display a S peak in HRW and SNP treatment and a diploid (G1) peak in the control, HRW + cPTIO, HRW + L-NAME and HRW + NaN3.GydF4y2Ba治疗方法。GydF4y2Ba
HRW,SNP,CPTIO,L名和NAN的影响GydF4y2Ba3.GydF4y2Ba不定根期细胞周期分布的研究。将5日龄萌发黄瓜下胚轴的初生根系去除。黄瓜外植体分别用50% HRW、50 μM SNP、200 μM cPTIO、30 μM L-NAME和10 μM NaN培养GydF4y2Ba3.GydF4y2Ba用多聚甲醛固定黄瓜下胚轴,用Galbraith缓冲液切取细胞核。DAPI检测细胞核形成,荧光显微镜观察;对相同样品进行多参数细胞周期高含量分析(HCA) (GydF4y2Ba一种GydF4y2Ba).酒吧=100μm。通过图像Pro软件分析核的相对荧光强度(GydF4y2BaB.GydF4y2Ba)GydF4y2Ba
对照中G1期细胞比例最高,分别比HRW和SNP处理高700.50%和634.20%(图2)。GydF4y2Ba4 bGydF4y2Ba).然而,HRW和SNP处理的细胞总数百分比高于对照(图2)。GydF4y2Ba4 bGydF4y2Ba).因此,H.GydF4y2Ba2GydF4y2Ba并且没有促进G1至S转化阶段,表明诱导G1相中细胞的亚群以同步方式进入新的细胞周期。如果cptio,l-name或nanGydF4y2Ba3.GydF4y2Ba同时加入HRW溶液,G1期细胞百分率分别增加了43.64、25.01和45.33%,S期细胞百分率分别减少了28.48、21.72和27.3%(图3)。GydF4y2Ba4 bGydF4y2Ba).GydF4y2Ba
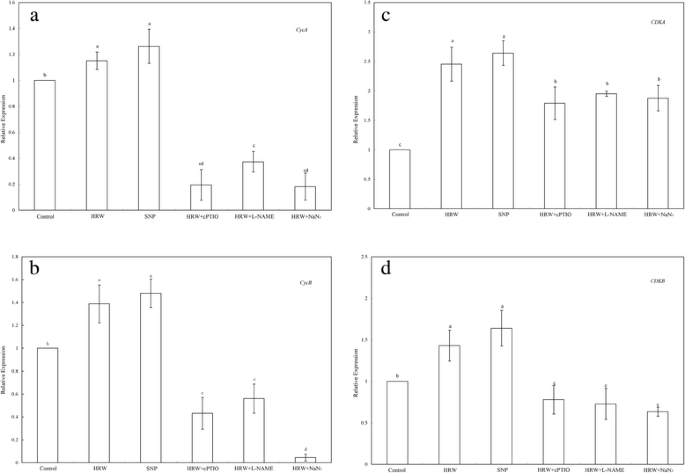
不定根发育过程中细胞周期调控基因HRW介导的转录水平NO参与GydF4y2Ba
为了研究hrw诱导不定根发育时相变化的分子机制,我们通过研究两种周期蛋白(GydF4y2BaCycA和CycBGydF4y2Ba)和两个CDK(GydF4y2BaCDKA.GydF4y2Ba和GydF4y2BaCDKB.GydF4y2Ba)基因进行qRT-PCR分析。如图1所示。GydF4y2Ba5GydF4y2Ba, HRW和SNP表达增加GydF4y2BaCycAGydF4y2Ba与对照相比,15.14和26.28%。但是,与HRW治疗相比,表达GydF4y2BaCycAGydF4y2Bawas significantly reduced by 83.00, 67.70 and 98.90 % in the treatments of HRW + cPTIO, HRW + L-NAME and HRW + NaN3.GydF4y2Ba(无花果。GydF4y2Ba5GydF4y2Ba).数字GydF4y2Ba5bGydF4y2Ba表明,HRW和SNP治疗增加了增加的表达GydF4y2BaCycBGydF4y2Ba分别为138.83和148.11%的对照。后续观察表明,cPTIO、L-NAME和NaN的应用GydF4y2Ba3.GydF4y2Ba是否能够下调hrw介导的GydF4y2BaCycBGydF4y2Ba由64.97,54.50和96.30%,分别为(图GydF4y2Ba5bGydF4y2Ba).的转录水平GydF4y2BaCDKA.GydF4y2Ba在外植体中,HRW和SNP均显著增加,分别比对照增加了145.38和164.21%。而当,cPTIO, L-NAME和NaNGydF4y2Ba3.GydF4y2Ba施用到HRW处理的外植体,它导致26.96,20.44,和在表达减少23.51%GydF4y2BaCDKA.GydF4y2Ba(无花果。GydF4y2Ba5度GydF4y2Ba).同时,较高的成绩单水平GydF4y2BaCDKB.GydF4y2Ba在HRW和SNP处理中,分别比对照高143.72和163.95%。cPTIO、L-NAME、NaNGydF4y2Ba3.GydF4y2Ba降低了转录水平GydF4y2BaCDKB.GydF4y2Ba在HRW处理(图。GydF4y2Ba5 dGydF4y2Ba).这些发现表明NO可能参与了HGydF4y2Ba2GydF4y2Ba诱导细胞周期调控基因的表达。GydF4y2Ba
HRW,SNP,CPTIO,L名和NAN的影响GydF4y2Ba3.GydF4y2Ba细胞周期相关基因在不定根中的表达。将5日龄萌发黄瓜下胚轴的初生根系去除。黄瓜外植体分别用50% HRW、50 μM SNP、200 μM cPTIO、30 μM L-NAME和10 μM NaN培养GydF4y2Ba3.GydF4y2Ba单独或联合处理6 h后,GydF4y2BaCycAGydF4y2Ba(GydF4y2Ba一种GydF4y2Ba),GydF4y2BaCycBGydF4y2Ba(GydF4y2BaB.GydF4y2Ba),GydF4y2BaCDKA.GydF4y2Ba(GydF4y2BaCGydF4y2Ba),GydF4y2BaCDKB.GydF4y2Ba(GydF4y2BaD.GydF4y2Ba)表达水平的实时RT-PCR分析。这些基因的表达水平以相对于水处理(Con)的值表示。值(平均值±SE)是三个独立实验的平均值。不同字母的条形图与对照相比有显著差异GydF4y2BaP.GydF4y2Ba < 0.05 according to Duncan’s multiple test
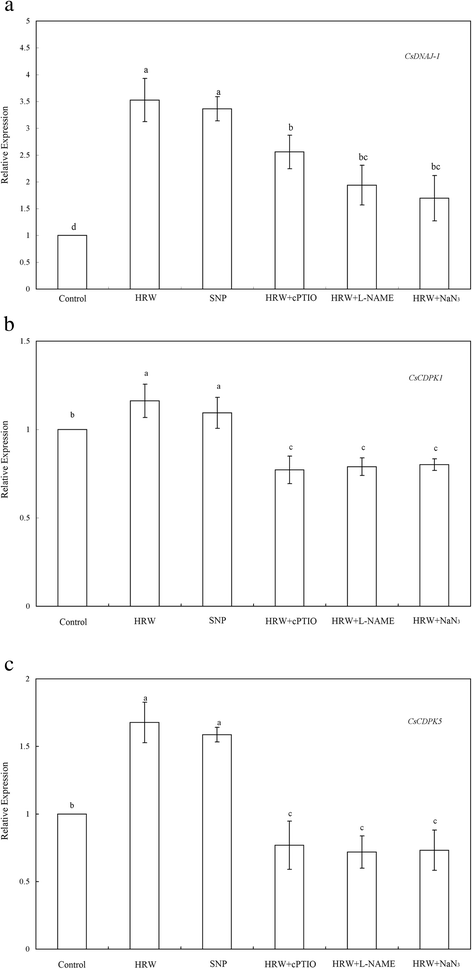
NO与hrw诱导的不定根发育过程中CsDNAJ-1、CsDPK1和CsCDPK5的表达谱有关GydF4y2Ba
此外,GydF4y2BaCsDNAJ-1GydF4y2Ba那GydF4y2BaCsCDPK1GydF4y2Ba和GydF4y2BaCsCDPK5GydF4y2Ba基因表达用作分子探针,研究HRW诱导的不定根生根的分子机制。与对照,HRW和SNP治疗能够诱导更高的表达GydF4y2BaCsDNAJ-1GydF4y2Ba那GydF4y2BaCsCDPK1GydF4y2Ba和GydF4y2BaCsCDPK5GydF4y2Ba在处理前24 h(图2)。GydF4y2Ba6.GydF4y2Ba).这些表达与4天后观察到的不定根的数量和长度很好地匹配。有趣的是,他的表情GydF4y2BaCsDNAJ-1GydF4y2Ba与对照处理相比,HRW和SNP分别提高了252.67和236.35%(图2)。GydF4y2Ba6GydF4y2Ba).这GydF4y2BaCsCDPK1GydF4y2Ba和GydF4y2BaCsCDPK5GydF4y2Ba转录水平也比对照(图更高诱导HRW和SNP。GydF4y2Ba6.GydF4y2Baa和b). HRW和cPTIO联合处理下调了转录水平GydF4y2BaCsDNAJ-1GydF4y2Ba那GydF4y2BaCsCDPK1GydF4y2Ba和GydF4y2BaCsCDPK5GydF4y2Ba由27.46,33.56和54.20%,分别为(图GydF4y2Ba6.GydF4y2Ba).同时,如果将L-NAME注入hrw处理的外植体中,也会导致这些基因的表达减少。与HRW处理相比,HRW + NaNGydF4y2Ba3.GydF4y2Ba治疗显着降低了这些基因的转录水平(图。GydF4y2Ba6.GydF4y2Ba).因此,hrw诱导的表达GydF4y2BaCsDNAJ-1GydF4y2Ba那GydF4y2BaCsCDPK1GydF4y2Ba和GydF4y2BaCsCDPK5GydF4y2BacPTIO、L-NAME和NaN显著抑制基因表达GydF4y2Ba3.GydF4y2Ba.上述结果进一步强化了NO可能至少部分参与hrw诱导不定根发育的假设。GydF4y2Ba
HRW,SNP,CPTIO,L名和NAN的影响GydF4y2Ba3.GydF4y2Ba关于表达概况GydF4y2BaCsDNAJ-1GydF4y2Ba(GydF4y2Ba一种GydF4y2Ba),GydF4y2BaCsDPK1GydF4y2Ba(GydF4y2BaB.GydF4y2Ba),GydF4y2BaCsCDPK5GydF4y2Ba(GydF4y2BaCGydF4y2Ba)在诱导不定根方面的作用。将5日龄萌发黄瓜下胚轴的初生根系去除。黄瓜外植体分别用50% HRW、50 μM SNP、200 μM cPTIO、30 μM L-NAME和10 μM NaN培养GydF4y2Ba3.GydF4y2Ba分别单独或联合处理24 h后,采用实时荧光定量pcr (real-time RT-PCR)分析基因的相对表达量。这些基因的表达水平以相对于水处理(Con)的值表示。值(平均值±SE)是三个独立实验的平均值。不同字母的条形图与对照相比有显著差异GydF4y2BaP.GydF4y2Ba < 0.05 according to Duncan’s multiple test
讨论GydF4y2Ba
不定根在植物吸收养分和水分方面起着重要作用;它们的形成被广泛应用于植物无性系繁殖。以往的研究表明,HGydF4y2Ba2GydF4y2Ba植物压力反应没有否[GydF4y2Ba32.GydF4y2Ba]及气孔关闭[GydF4y2Ba37.GydF4y2Ba].然而,在H中之间的串扰的研究很少GydF4y2Ba2GydF4y2Ba不定芽生根过程中NO含量的变化。这里,我们关注NO H的参与GydF4y2Ba2GydF4y2Ba诱导不定根过程中细胞周期的激活。GydF4y2Ba
HGydF4y2Ba2GydF4y2Ba由于其选择性还原,在全世界引起了兴趣[GydF4y2Ba25GydF4y2Ba].越来越多的证据表明,HGydF4y2Ba2GydF4y2Ba是一种新的信号分子,在植物中起着重要的作用。在本研究中,我们发现,当外源施用HRW时,以剂量依赖的方式增加了不定根的数量和长度(图。GydF4y2Ba1GydF4y2Ba).这些发现也与之前的报告一致,表明外源性HGydF4y2Ba2GydF4y2Ba能调节黄瓜不定根发育[GydF4y2Ba12GydF4y2Ba].许多研究都集中在H的生理作用GydF4y2Ba2GydF4y2Ba在对盐胁迫的植物反应[GydF4y2Ba27GydF4y2Ba那GydF4y2Ba28GydF4y2Ba],镉毒性[GydF4y2Ba31.GydF4y2Ba],汞毒性[GydF4y2Ba33.GydF4y2Ba],百草枯诱导的氧化应激[GydF4y2Ba30.GydF4y2Ba]和铝胁迫[GydF4y2Ba32.GydF4y2Ba].充足的证据表明,NO分类为gasotransmitter能够诱导不定根[GydF4y2Ba23GydF4y2Ba].我们之前已经证明外源施用NO也能促进万寿菊不定根的形成[GydF4y2Ba10GydF4y2Ba].没有被发现促进不定根的发展GydF4y2BaPanax Ginseng.GydF4y2Ba由O代产生GydF4y2Ba2-GydF4y2Ba[GydF4y2Ba42.GydF4y2Ba].为了确定是否NO信号传导途径参与H中GydF4y2Ba2GydF4y2Ba诱导不定根,NO清除剂cPTIO和抑制剂L-NAME和钨NaN的GydF4y2Ba3.GydF4y2Ba被用于实验。我们发现cPTIO, L-NAME钨酸盐和NaNGydF4y2Ba3.GydF4y2Ba导致部分抑制HRW诱导的不定根发育(图。GydF4y2Ba2GydF4y2Ba).从NO清除剂、nos -抑制剂和nr -抑制剂在hrw诱导的反应中的抑制作用来看,NO可能是H中必不可少的气体信号分子GydF4y2Ba2GydF4y2Ba- 相关的偶然生根。到目前为止,H之间的关系GydF4y2Ba2GydF4y2Ba和NO在动植物中的作用尚待阐明。尽管HGydF4y2Ba2GydF4y2Ba不能抑制细胞内没有生产,它在PC12细胞中显着抑制了无诱导的细胞毒性[GydF4y2Ba43.GydF4y2Ba].在紫花苜蓿,HGydF4y2Ba2GydF4y2Ba通过降低NO产量来缓解铝应力[GydF4y2Ba32.GydF4y2Ba].Xie et al. [GydF4y2Ba37.GydF4y2Ba表明NO的产生对H有促进作用GydF4y2Ba2GydF4y2Ba促进的气孔关闭在拟南芥中。我们的研究结果还表明,当NO生产被阻断,人权观察在不定根的促进角色互换(图GydF4y2Ba2GydF4y2Ba).这些结果表明,不可能充当涉及H的下游信号分子GydF4y2Ba2GydF4y2Ba诱导不定根发育。然而,还需要进一步研究,以确定h的串扰GydF4y2Ba2GydF4y2Ba和NO在不同生理过程中的作用。GydF4y2Ba
以前的动物研究表明,H之间存在关系GydF4y2Ba2GydF4y2Ba在某些情况下,“不”[GydF4y2Ba36.GydF4y2Ba那GydF4y2Ba43.GydF4y2Ba].在植物中,Xie等[GydF4y2Ba37.GydF4y2Ba]发现拟南芥暴露于HRW,导致没有内容的增加。另外,h的效果GydF4y2Ba2GydF4y2Ba缓解铝对紫花苜蓿根系伸长的抑制作用可能来自NO的降低[GydF4y2Ba32.GydF4y2Ba].此外,H的增加GydF4y2Ba2GydF4y2Banos样蛋白和NR介导的NO生成可能是必需的,是HGydF4y2Ba2GydF4y2Ba行动。在这里,我们的证据支持nos样和nr依赖的NO产生有助于H的可能性GydF4y2Ba2GydF4y2Ba-促进黄瓜不定根发育(图。GydF4y2Ba3.GydF4y2Ba).巧合,已经证明了H中没有明显的水平GydF4y2Ba2GydF4y2Ba诱导的气孔闭合[GydF4y2Ba37.GydF4y2Ba].它也被发现对面的观察GydF4y2Ba2GydF4y2Ba在铝诱导的根伸长率抑制中不降低生产[GydF4y2Ba32.GydF4y2Ba].因此,目前的研究表明,HGydF4y2Ba2GydF4y2Ba没有一些生理过程。GydF4y2Ba
以前的研究已经显示在木质部中柱鞘细胞周期调控可能在根器官至关重要的作用[GydF4y2Ba44.GydF4y2Ba那GydF4y2Ba45.GydF4y2Ba].细胞周期调节发生在木质部中柱鞘,细胞进入G2期,其余中柱鞘保持在G1期[GydF4y2Ba46.GydF4y2Ba].在这里,我们的分析表明HGydF4y2Ba2GydF4y2Ba-和no诱导细胞在不定根S期的积累,表明HGydF4y2Ba2GydF4y2Ba- 和NO诱导的细胞周期活化促成了生根(图GydF4y2Ba4.GydF4y2Ba).之前报道,细胞周期感应在不定根生长中发挥了关键功能[GydF4y2Ba45.GydF4y2Ba]及侧根形成[GydF4y2Ba47.GydF4y2Ba].这是第一份报告显示HGydF4y2Ba2GydF4y2Ba在不定根开发期间,没有参与细胞周期进展。有趣的是,CPTIO,L-NAME和NANGydF4y2Ba3.GydF4y2Ba全部部分还原HGydF4y2Ba2GydF4y2Ba- 诱导S期细胞的积累,然后抑制不定根发育(图。GydF4y2Ba4.GydF4y2Ba).通常接受植物激素在根部发育期间在细胞周期的再激活中发挥着核心作用[GydF4y2Ba48.GydF4y2Ba].NO对番茄侧向形成细胞周期激活的诱导作用已有报道[GydF4y2Ba47.GydF4y2Ba].作者指出,生长素依赖的细胞周期基因调控可能依赖于NO。因此,我们的药理学证据支持这种可能性,至少在我们的实验条件下,HGydF4y2Ba2GydF4y2Ba和NO可能形成不定根期间调节细胞周期激活的线性信号传导途径。GydF4y2Ba
细胞周期调节基因已被证明参与调节节间生长中的细胞分裂[GydF4y2Ba49.GydF4y2Ba]和根分生组织的诱导[GydF4y2Ba45.GydF4y2Ba].为了解NO参与H的机制GydF4y2Ba2GydF4y2Ba- 在本研究中进行了导致根本引发的细胞周期,详细分子研究。参与G1至S的转变的基因,GydF4y2BaCycAGydF4y2Ba那GydF4y2BaCycBGydF4y2Ba那GydF4y2BaCDKA.GydF4y2Ba和GydF4y2BaCDKB.GydF4y2Ba没有明显上调,没有GydF4y2Ba2GydF4y2Ba治疗(图。GydF4y2Ba5.GydF4y2Ba),与细胞周期的相变相一致。Otvos等人[GydF4y2Ba50.GydF4y2Ba报道NO促进了紫花苜蓿叶片原生质体来源细胞的细胞分裂和胚性细胞的形成。暂时没有诱导GydF4y2BaCyCA2; 1GydF4y2Ba和GydF4y2BaCYCD3; 1GydF4y2Ba细胞悬液中mRNA的表达。这些结果很好地符合的表达式GydF4y2BaCycAGydF4y2Ba和GydF4y2BaCycBGydF4y2Ba在我们的实验条件下。以前的研究还发现,没有介导的诱导GydF4y2BaCYCD3; 1GydF4y2Ba基因在侧根形成原基开始[GydF4y2Ba47.GydF4y2Ba].这些结果证实了NO参与了侧根和不定根过程中细胞周期相关基因的调控。值得注意的是GydF4y2BaCDKA.GydF4y2BaHGydF4y2Ba2GydF4y2Ba否则暗示A型CDK可能在G1到S转换中发挥主要作用。Himanen等人。[GydF4y2Ba44.GydF4y2Ba还发现转录水平GydF4y2BaCDKA.GydF4y2Ba在早侧根引发期间诱导在肿瘤介导的细胞周期激活中。水平GydF4y2BaCDKA.GydF4y2Ba转录物在侧向生根期间没有治疗,表明植物细胞可能是番茄中细胞分裂的态度[GydF4y2Ba47.GydF4y2Ba].此外,我们的数据显示了成绩单水平GydF4y2BaCDKB.GydF4y2Ba比的少GydF4y2BaCDKA.GydF4y2BaH.之后GydF4y2Ba2GydF4y2Ba治疗。它可能是因为B型CDKS调节细胞周期进程到有丝分裂阶段,G2至M [GydF4y2Ba51.GydF4y2Ba].这项研究进一步表明,转录水平的GydF4y2BaCycAGydF4y2Ba那GydF4y2BaCycBGydF4y2Ba那GydF4y2BaCDKA.GydF4y2Ba和GydF4y2BaCDKB.GydF4y2Ba由HGydF4y2Ba2GydF4y2Ba由NO清除剂cPTIO,NOS抑制剂L-NAME和NR抑制剂的NaN被部分抑制GydF4y2Ba3.GydF4y2Ba(无花果。GydF4y2Ba5.GydF4y2Ba).因此,转录配置文件提出这里允许提出一个简单的模型NO可能在细胞周期活化中H参与GydF4y2Ba2GydF4y2Ba诱导不定根。提供的证据在这里进一步证实使得hGydF4y2Ba2GydF4y2Ba和NO具体可以调节细胞周期激活和不定根形成。另外,NO可以是H期间下游信号分子GydF4y2Ba2GydF4y2Ba诱导的不定根,存在于有能力的中柱鞘细胞中,最终激活细胞周期相关基因。GydF4y2Ba
已经观察到不定根发展的目标基因,GydF4y2BaCsDNAJ-1GydF4y2Ba那GydF4y2BaCsCDPK1GydF4y2Ba和GydF4y2BaCsCDPK5GydF4y2Ba可以通过生长素,CO [诱导GydF4y2Ba8.GydF4y2Ba],以及硫化氢[GydF4y2Ba11GydF4y2Ba].所有DNAJ样蛋白质的特征在于J结构域对Hsp70的蛋白质折叠和组装和蛋白质复合物的组装和拆卸的相互作用。已经说明了DNAJ样蛋白和钙依赖性蛋白激酶(CDPK)的基因涉及不定根的启动和发展[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba52.GydF4y2Ba].此外,IAA和NO诱导了与不定根形成过程中细胞分化、分裂和/或分化相关的CDPK活性[GydF4y2Ba5.GydF4y2Ba].在本研究中,分子证据表明HGydF4y2Ba2GydF4y2Ba和NO处理均可诱导高表达GydF4y2BaCsDNAJ-1GydF4y2Ba那GydF4y2BaCsCDPK1GydF4y2Ba和GydF4y2BaCsCDPK5GydF4y2Ba基因(图GydF4y2Ba6.GydF4y2Ba),这与观察到的不定根数量一致。Bai et al. [GydF4y2Ba52.GydF4y2Ba]发现IAA,3-O-C10-HL和H.GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba增加的表达GydF4y2BaCDC2GydF4y2Ba那GydF4y2Baarc2.GydF4y2Ba,GydF4y2BaCDPKGydF4y2Ba以及Aux/IAA基因家族成员GydF4y2BaAUX22cGydF4y2Ba那GydF4y2BaAUX22dGydF4y2Ba,和AUX22e。最近,Lin等人[GydF4y2Ba12GydF4y2Ba还报告说GydF4y2Ba2GydF4y2Ba以血红素加氧酶-1/一氧化碳依赖的方式诱导黄瓜不定根形成相关靶基因的表达。NO清除剂cPTIO、NOS抑制剂L-NAME和NR抑制剂NaN的应用GydF4y2Ba3.GydF4y2Ba能够下调HGydF4y2Ba2GydF4y2Ba诱导的转录水平GydF4y2BaCsDNAJ-1GydF4y2Ba那GydF4y2BaCsCDPK1GydF4y2Ba和GydF4y2BaCsCDPK5GydF4y2Ba(无花果。GydF4y2Ba6.GydF4y2Ba).因此,我们推断使得hGydF4y2Ba2GydF4y2Ba- 诱导GydF4y2BaCsDNAJ-1GydF4y2Ba那GydF4y2BaCsCDPK1GydF4y2Ba和GydF4y2BaCsCDPK5GydF4y2Ba表达可能受NO产生的调控。这些发现可能表明GydF4y2BaCsDNAJ-1GydF4y2Ba那GydF4y2BaCsCDPK1GydF4y2Ba和GydF4y2BaCsCDPK5GydF4y2BaH可能需要更早状态的表达式GydF4y2Ba2GydF4y2Ba- 以无独立的方式引起了不定根开发。GydF4y2Ba
结论GydF4y2Ba
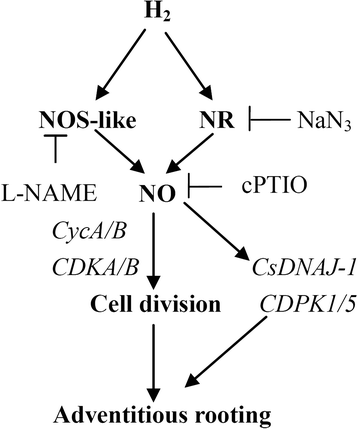
综上所述,我们的结果表明HGydF4y2Ba2GydF4y2Ba参与不定根发育,NO可能是HGydF4y2Ba2GydF4y2Ba信号级联。同时,这里提出的证据表明hGydF4y2Ba2GydF4y2Ba通过NO途径激活细胞周期,上调细胞周期相关基因和不定根相关靶基因(图2)。GydF4y2Ba7.GydF4y2Ba).而HGydF4y2Ba2GydF4y2Ba和NO可能是非常复杂的。因此,相当多的工作将在分子机制H的进一步调查完成GydF4y2Ba2GydF4y2Ba-和no诱导不定根。GydF4y2Ba
方法GydF4y2Ba
植物材料及生长条件GydF4y2Ba
黄瓜 (GydF4y2BaCucumis sativusGydF4y2Ba“新春4号”种子由甘肃省农业科学院提供。选择相同的种子在蒸馏水滤纸浸渍的培养皿中萌发,然后转移到照明培养箱中,在25±1℃下培养5d,光周期14 h(光合有效辐射= 200 μmol mGydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba).除去5-D型幼苗的初级根,然后在如下所示的不同培养基存在下,在上述相同的温度和光周期条件下保持黄瓜外植体在另外5d中保持另外5d。然后,记录拍摄每次外植物的根数,根长度。同时,采取了相应的照片。GydF4y2Ba
外植体的处理,化学物质GydF4y2Ba
后初生根被拆除,每十黄瓜外植体放入含有6毫升蒸馏水,不同浓度的如图2所示的富含氢气的水(HRW)的培养皿中。GydF4y2Ba1GydF4y2Ba.30μMN-硝基-L-精氨酸甲基酯(L-NAME,Sigma,美国)或200μM2-(4-羧基苯基)-4,4,5,5- tetramethylimidazoline -1-氧基-3-氧化物(cPTIO,Sigma,美国),或100μM钨酸盐或10μM的NaNGydF4y2Ba3.GydF4y2Ba加入最佳浓度的HRW。200 μM cPTIO与最适SNP浓度加在一起。失活的SNP (50 μM)曾在光照下去除NO约24小时,这些化学物质的浓度是根据初步实验和前期实验的结果选择的[GydF4y2Ba10GydF4y2Ba].溶液在完全黑暗中制备,并立即在pH值为6.5的情况下稀释至所需浓度。除另有说明外,其余化学品均为中国公司的分析级化学品。GydF4y2Ba
富含氢水的制备(HRW)GydF4y2Ba
纯化的H2GydF4y2Ba2GydF4y2Ba天然气(99.99%,GydF4y2Bav / V.GydF4y2Ba),由氢气发生器(QL-300, saikesasi氢能有限公司,中国)以300ml min的速度将其鼓泡到2 l蒸馏水中GydF4y2Ba-1GydF4y2Ba然后,将相应HRW迅速稀释至所需饱和度(1,10,50%,[GydF4y2Bav / V.GydF4y2Ba])。在我们的实验条件下,HGydF4y2Ba2GydF4y2Ba用“便携式溶解氢计”(Trustlex Co., Led, hm -1000,日本)测定新鲜制备的HRW中的浓度为0.45 mM,并在25°C中保持相对恒定水平至少12小时。GydF4y2Ba
内源NO含量测定GydF4y2Ba
NO含量采用Greiss试剂法测定[GydF4y2Ba3.GydF4y2Ba经过一些修改。黄瓜下胚轴样品(0.2 g)用液氮冷冻,然后研磨在研钵和杵中,加入4 mL 50 mM的冰醋酸缓冲液,pH 3.6,含4% (GydF4y2BaW / V.GydF4y2Ba)二乙酸锌。匀浆10000 ×离心GydF4y2BaGGydF4y2Ba在4℃下持续15分钟,收集上清液。对于每个样品,加入0.1克炭(上海化学试剂有限公司)。在涡旋混合和过滤后,滤滤液并收集。将1ml滤液和1ml Greise试剂的混合物在室温下温育30分钟以使亚硝酸盐纳硝酸盐。然后在540nm处测定吸光度。通过与纳米标准曲线进行比较来计算任何内容GydF4y2Ba2GydF4y2Ba.GydF4y2Ba
下胚轴细胞核提取物GydF4y2Ba
黄瓜下胚轴切出约0.5cm,并固定在4%甲醛(0.1M磷酸盐缓冲液,pH 7.4)中15分钟。然后下胚轴在加尔布雷思黄油(45毫米氯化镁削减了刀片GydF4y2Ba2GydF4y2Ba,30mM柠檬酸钠,20mM 4-吗啉代丙烷磺酸)。最后,在5ml管中用30μm网筛收集细胞核悬浮液。GydF4y2Ba
细胞周期的荧光显微图像分析GydF4y2Ba
如[GydF4y2Ba53.GydF4y2Ba]有修改。细胞核悬浮液加入荧光染料DAPI(1:100000,分子探针),0.1%Triton-X 100和50μgmLGydF4y2Ba-1GydF4y2Ba用荧光显微镜(Leica 400×, Planapo, Wetzlar, Germany)观察Rnase1 (DNase-free, Qiagen)并拍照。显微摄影条件设定值固定,核未过度曝光。每个样品都被用来分析至少1000张荧光显微镜下的细胞核图像。利用Image Pro软件(Media Cyberntics, USA)测量细胞核的荧光强度(灰度值)。GydF4y2Ba
RNA提取GydF4y2Ba
使用TRIZOL试剂(中国Sangon)处理6 h和24 h后,从大约200 mg(鲜重)的黄瓜下胚轴(5mm)中提取总RNA。GydF4y2Ba
用定量RT-PCR转录水平估计GydF4y2Ba
使用ABI Stepone Plus系统(Applied Biosystems,Carlsbad,CA)以及Qiagen Quantifast Sybr Green PCR套件(华夏海洋科技Con。,Ltd。,Ltd.,China)进行定量实时PCR(QRT-PCR)反应。使用表中的引物扩增,对细胞周期相关基因(在处理后6小时的处理)和靶基因(在处理后24小时)(在治疗后24小时)进行扩增,这些基因负责QRT-PCR的偶然生根GydF4y2Ba1GydF4y2Ba.每种反应(20μL总体积)由10μLIQSYBR Gree Supermix,1μl稀释的cDNA和0.4μl的正向和储备引物组成。PCR循环条件如下:在95℃下在95℃下,在95℃和30s的60℃下,在60℃下,在退火步骤中的数据收集,50分钟。在40次循环之后,我们包括在95℃,60℃下的离解/熔融曲线阶段,60℃,60℃,15℃,在95℃下。黄瓜GydF4y2Ba施GydF4y2Ba基因用作内部对照。如Livak和Schmittgen [中所述进行相对基因表达的计算GydF4y2Ba54.GydF4y2Ba].GydF4y2Ba
统计分析GydF4y2Ba
其中,结果表示为至少三个独立实验的平均值±SE。使用Windows社会科学统计软件包(13.00版本;SPSS, Inc.,芝加哥,IC,美国)。为进行统计分析,邓肯多重检验(GydF4y2BaP.GydF4y2Ba< 0.05)was chose as appropriate.
缩写GydF4y2Ba
CDKA,细胞周期蛋白依赖性激酶A;CDKB,细胞周期蛋白依赖性激酶B;CYCA,A型细胞周期蛋白;CycB,B型细胞周期蛋白;DAPI,4',6-二脒基-2-苯基吲哚;HGydF4y2Ba2GydF4y2Ba氢气;HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba过氧化氢;人权观察,研究水;LI SNP,光灭活SNP;L-NAME, NO合酶(NOS)样酶抑制剂GydF4y2BaGGydF4y2Ba硝基 -GydF4y2BaL.GydF4y2Ba精氨酸甲酯盐酸盐;NO,一氧化氮;SNP,souium硝普钠;cPTIO,2-(4-羧基苯基)-4,4,5,5- tetramethylimidazoline -1-氧基-3-氧化物钾盐GydF4y2Ba
参考文献GydF4y2Ba
- 1.GydF4y2Ba
不定根的形成:新概念,新可能性。体外细胞Dev-Pl。1999; 35:189 - 99。GydF4y2Ba
- 2.GydF4y2Ba
一氧化氮介导了吲哚乙酸诱导的丝裂原活化蛋白激酶级联的激活,参与不定根的发育。植物杂志。2004;135:279 - 86。GydF4y2Ba
- 3。GydF4y2Ba
廖WB,萧HL。一氧化氮和过氧化氢涉及吲哚-3-丁酸诱导的万寿菊的不定根发育。j hortic sci和biotech。2011; 86:159-65。GydF4y2Ba
- 4.GydF4y2Ba
廖WB,张ml,黄gb,yu jh。加利福尼亚州GydF4y2Ba2+GydF4y2Ba与CaM涉及NO-和HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba- 在万寿菊的不定根开发。J增长规范。2012; 31:253-64。GydF4y2Ba
- 5。GydF4y2Ba
LANTERI ML,Pagnussat GC,Lamattina L.钙和钙依赖蛋白激酶参与硝酸乙烷和在黄瓜植物生长素诱导的不定根形成。J Exp Bot。2006; 57:1341年至1351年。GydF4y2Ba
- 6.GydF4y2Ba
一氧化氮和环GMP是吲哚乙酸诱导的不定根过程中的信使分子。植物杂志。2003;132:1241-8。GydF4y2Ba
- 7.GydF4y2Ba
潘锐,王建新,田学森。乙烯对绿豆下胚轴扦插不定根形成的影响。植物生长规律。2002;36:135-9。GydF4y2Ba
- 8.GydF4y2Ba
宣伟,朱凤英,徐松,黄百科,凌特芬,齐建勇,叶明梅,沈文斌。血红素加氧酶/一氧化碳系统参与了生长素诱导的黄瓜不定根过程。植物杂志。2008;148:881 - 93。GydF4y2Ba
- 9.GydF4y2Ba
比昂迪S,迪亚兹T,Iglesias的I,甘贝里尼G,巴尼N.多胺以及相对于不定根形成在乙烯GydF4y2Ba甜樱桃GydF4y2Ba拍摄文化。physiol platararum。1990; 78:474-83。GydF4y2Ba
- 10.GydF4y2Ba
廖文斌,肖海林,张曼丽.一氧化氮和过氧化氢在万寿菊不定根发育中的作用及关系。植物学报。2009;31:1279-89。GydF4y2Ba
- 11.GydF4y2Ba
林YT,李MY,崔WL,鲁W,沉WB。血红素氧合-1参与了硫化氢引起的黄瓜不定根形成。J工厂增长调节。2012; 31:519-28。GydF4y2Ba
- 12.GydF4y2Ba
林yt,张w,qi f,cui wt,xie yj,shen wb。富含氢水调节血红素氧酶-1 /一氧化碳依赖性方式的黄瓜不定根发育。J植物理性。2014; 171:1-8。GydF4y2Ba
- 13。GydF4y2Ba
Cantrel C,Vazquez T,Puyaubert,Reze N,Lesch M,Kaiser W,Dulillcul C,Guillas I,Zachowski A,Baudouin E.一氧化氮参与冷敏磷磷脂形成和基因表达GydF4y2Ba拟南芥GydF4y2Ba.新植醇。2011;189:415-27。GydF4y2Ba
- 14。GydF4y2Ba
Camejo D,Romero-Puertas MDEL C,Rodriguez-Serrano M,Sandalio Lm,Lazaro Jj,Jimenez A,Sevilla F.盐度诱导的豌豆线粒体蛋白的S-亚硝基化变化。J蛋白质组学。2013; 79:87-99。GydF4y2Ba
- 15.GydF4y2Ba
郭fq, Crawford NM。GydF4y2Ba拟南芥GydF4y2Ba一氧化氮合成速度被攻破到线粒体,并防止氧化损伤和黑暗诱导的衰老。植物细胞。2005; 17:3436-50。GydF4y2Ba
- 16。GydF4y2Ba
廖文斌,张明利,于建华。一氧化氮延缓切花衰老的作用及其与乙烯的相互作用。Sci Hortic。2013;155:30-8。GydF4y2Ba
- 17.GydF4y2Ba
Bethke PC,Libourel Ig,Aoyama N,Chung Yy,仍然DW,Jones RL。这GydF4y2Ba拟南芥GydF4y2Ba糊粉层对一氧化氮、赤霉素和脱落酸有反应,是种子休眠的充分和必要条件。植物杂志。2007;143:1173 - 788。GydF4y2Ba
- 18.GydF4y2Ba
Libourel IG, Bethke PC, De Michele R, Jones RL。一氧化氮气体刺激休眠植物萌发GydF4y2Ba拟南芥GydF4y2Ba种子:使用流动装置来输送一氧化氮。足底。2006;223:813-20。GydF4y2Ba
- 19.GydF4y2Ba
何颖,唐瑞华,郝颖,Stevens RD, Cook CW, Ahn SM, Jing L, Yang Z, Chen L, Guo F, Fiorani F, Jackson RB, Crawford NM, Pei Z.一氧化氮的抑制作用GydF4y2Ba拟南芥GydF4y2Ba花卉过渡。科学。2004; 205:1968-71。GydF4y2Ba
- 20.GydF4y2Ba
郭FQ,冈本男,克劳福德NM。参与激素信号植物型一氧化氮合酶基因的鉴定。科学。2003; 302:100-3。GydF4y2Ba
- 21.GydF4y2Ba
一氧化氮在番茄侧根发育中起关键作用。足底。2004;218:900-5。GydF4y2Ba
- 22.GydF4y2Ba
Lombardo的MC,格拉齐亚诺男,Polacco JC,Lamattina L.一氧化氮用作根毛发育的正调节。植物西尼亚Behav。2006; 1:28-33。GydF4y2Ba
- 23.GydF4y2Ba
Pagnussat GC,Simontacchi男,Puntarulo S,Lamattina L.一氧化氮需要根器官。植物理性。2002; 129:954-6。GydF4y2Ba
- 24.GydF4y2Ba
多尔男,威尔逊FR,法伊夫WP。高压氢疗法:一种可能的治疗为癌症。科学。1975; 190:152-4。GydF4y2Ba
- 25.GydF4y2Ba
大泽I,石川男,高桥K,渡边男,西卷K,山形K,Kastsura K,片山Y,Asoh S,太田S.氢充当通过选择性地降低细胞毒性的氧自由基的治疗抗氧化剂。Nat Med。2007; 13:688-94。GydF4y2Ba
- 26。GydF4y2Ba
郑XF,太阳XJ,夏泽。氢复苏,一种新的细胞保护方法。Clin exppharmacol P. 2011; 38:155-63。GydF4y2Ba
- 27。GydF4y2Ba
谢YJ,毛泽东Y,赖d,张伟,沉WB。HGydF4y2Ba2GydF4y2Ba增强了GydF4y2Barabidopisis.GydF4y2Ba操纵ZAT10 / 12介导的抗氧化防御和控制钠排除耐盐性耐盐性。Plos一个。2012. 10.1371 /杂志。POE。004800。GydF4y2Ba
- 28。GydF4y2Ba
徐舒,朱树生,姜玉玲,王宁,王锐,沈文伟,杨军。富氢水缓解水稻种子萌发过程中的盐胁迫。土壤植物。2013;370:47-57。GydF4y2Ba
- 29.GydF4y2Ba
曾建强,张美美,孙晓军。氢分子参与植物激素信号传导和胁迫反应。《公共科学图书馆•综合》。2013。DOI:GydF4y2Ba10.1371 / journal.pone.0071038GydF4y2Ba.GydF4y2Ba
- 30.GydF4y2Ba
金QJ,朱KK,崔WT,谢YJ,韩B,申WB。氢气充当经由血红素的调制enhacning植物耐受性对百草枯诱导的氧化应激的新颖bioavitve分子氧酶1信号系统。植物细胞环境。2013; 36:956-69。GydF4y2Ba
- 31.GydF4y2Ba
崔WT,高CY,方P,林GQ,沉WB。镉的毒性减轻在GydF4y2Ba紫花苜蓿GydF4y2Ba通过富含氢水。j危险母体。2013; 260:715-24。GydF4y2Ba
- 32.GydF4y2Ba
富氢水通过降低一氧化氮的生成来缓解铝对紫花苜蓿根系伸长的抑制作用。J Hazard Mater. 2013; 267:40-7。GydF4y2Ba
- 33.GydF4y2Ba
崔文涛,方鹏,朱克康,毛勇,高春英,谢玉杰,王健,沈文斌。富氢水使苜蓿幼苗对汞毒性具有耐受性。Ecotox Environ Safe. 2014; 105:103-11。GydF4y2Ba
- 34.GydF4y2Ba
苏宁宁,吴强,刘媛媛,蔡金涛,沈文斌,夏锴,崔娟。UV-A辐照下富氢水对两种萝卜芽的活性氧稳态重建及花青素合成的影响。食品化学。2014;62:6454-62。GydF4y2Ba
- 35.GydF4y2Ba
胡HL,李PX,王YN,顾RX。富含氢的水延迟采后成熟过程和猕猴桃的衰老。食品化学。2014; 156:100--9。DOI:GydF4y2Ba10.1016 / j.foodchem.2014.01.067GydF4y2Ba.GydF4y2Ba
- 36.GydF4y2Ba
Itoh T,Hamada N,Terazawa R,Ito M,Ohno K,Ichihara M,Nozawa Y,Ito M.分子氢气通过调节巨噬细胞信号转导的调节抑制脂多糖/干扰素γ诱导的一氧化氮产生。Biochem Bioph Res Co.2011; 411:143-9。GydF4y2Ba
- 37.GydF4y2Ba
谢宇军,毛勇,张伟,赖德伟,王启宇,沈文斌。活性氧依赖的一氧化氮的产生有助于氢促进气孔关闭GydF4y2Ba拟南芥GydF4y2Ba.植物理性。2014 DOI:GydF4y2Ba10.1104 / pp.114.237925GydF4y2Ba.GydF4y2Ba
- 38。GydF4y2Ba
inzéd,de Veylder L.植物开发中的细胞周期调节。ANN Rev Genet。2006; 40:77-105。GydF4y2Ba
- 39。GydF4y2Ba
Boniotti MB,Gutierrez的C.细胞周期调节激酶活性phsphorylates植物视网膜细胞瘤蛋白和包含在GydF4y2Ba拟南芥GydF4y2Ba中,CDKA /细胞周期蛋白复合物d。植物杂志2001; 28:341-50。GydF4y2Ba
- 40。GydF4y2Ba
JoubèsĴ,士C,Dudits d,Heberle-博斯E,Inzéd,梅田男,Renaudin JP。在植物CDK相关的蛋白激酶。植物分子生物学。2000; 43:607-20。GydF4y2Ba
- 41。GydF4y2Ba
deveylder L, Beeckman T, Beemster GTS, krolls L, Terras F, Landrieu I, Van Der Schueren E, Maes S, Naudts M, Inzé D.周期蛋白依赖性激酶抑制剂的功能分析GydF4y2Ba拟南芥GydF4y2Ba.植物细胞。2001;13:1653 - 67。GydF4y2Ba
- 42。GydF4y2Ba
Tewari RK, Hahn EJ, Paek KY。一氧化氮和超氧阴离子在人参不定根发育和抗氧化防御中的作用。植物学报2008;27(3):563-73。GydF4y2Ba
- 43.GydF4y2Ba
Kashiwagi T,Yan HX,Hamasaki T,Kinjo T,Nakamichi N,Teruya K,Kabayama S,Shirahata S.电化学减少水免受氧化损伤的神经细胞。oxid med和cell longev。2014 DOI:GydF4y2Ba10.1155 /869121分之2014GydF4y2Ba.GydF4y2Ba
- 44.GydF4y2Ba
黄志强,黄志强,黄志强,等。生长素介导的生长素诱导侧根形成的细胞周期激活。植物细胞。2002;14:2339-51。GydF4y2Ba
- 45.GydF4y2Ba
Lorbiecke R,Sauter M. Deadwater Rice中的不定根生长和细胞周期诱导。植物理性。1999年; 119:21-9。GydF4y2Ba
- 46.GydF4y2Ba
作者简介:Beeckman T, Burssens S, Inzé dGydF4y2Ba拟南芥GydF4y2Ba.J Exp Bot。2001; 52:403-11。GydF4y2Ba
- 47.GydF4y2Ba
Correa-Aragunde N,Graziano M,Chevalier C,Lamattina L.一氧化氮在番茄侧根部形成期间调节细胞周期愈伤组织基因的表达。J Exp Bot。2006; 3:581-8。GydF4y2Ba
- 48.GydF4y2Ba
卡西米罗I,Marchant的A,Bhalerao BP,Beeckman T,Dhooge S,Swarup R,格雷厄姆N,Inzéd,Sandberg的G,卡西奥PJ,和Bennett M.生长素运输促进GydF4y2Ba拟南芥GydF4y2Ba侧根起始。植物细胞。2001;13:483 - 852。GydF4y2Ba
- 49.GydF4y2Ba
Sauter M,Mekhedov Sl,Kende H.Gibberellin促进组蛋白H1激酶活性和表达GydF4y2BaCDC2GydF4y2Ba诱导深水水稻间快速生长过程中的细胞周期基因。工厂J. 1995; 7:622-32。GydF4y2Ba
- 50。GydF4y2Ba
Otvos K, Pasternak TP, Miskolczi P, Domoki M, Dorjotov D, Szucs A, Bottka S, Dudits D, Feher A.在苜蓿细胞培养中,一氧化氮是必需的,并促进生长素介导的细胞分裂和胚胎细胞形成,但不影响细胞周期进程。植物j . 2005; 43:849-60。GydF4y2Ba
- 51。GydF4y2Ba
Boudolf V,Rombatus S,Naudts M,Inzéd,de Veylder L.鉴定与CKS1蛋白相互作用的新型细胞周期蛋白依赖性激酶GydF4y2BaArabisopsisGydF4y2Ba.J Exp Bot。2001; 52:1381-2。GydF4y2Ba
- 52。GydF4y2Ba
白晓刚,Todd CD, Desikan R, Yang YP, Hu XY。N -GydF4y2Ba3.GydF4y2Ba-OxO-癸酰-L-HOMOSELINELICONE通过在绿豆中通过过氧化氢 - 依赖于氧化氮依赖性细胞周期蛋白标记的促进型诱导的不定根形成。植物理性。2012年; 158:725-36。GydF4y2Ba
- 53。GydF4y2Ba
利用自动显微镜对细胞周期进行多参数分析。生物标志物筛选。2006;11:586-98。GydF4y2Ba
- 54。GydF4y2Ba
Livak KJ,Schmittgen TD。使用实时定量PCR和2 2相对基因表达数据的分析GydF4y2Ba-ΔΔGydF4y2BaCGydF4y2BaT.GydF4y2Ba方法。方法。2001;25:402-8。GydF4y2Ba
致谢GydF4y2Ba
作者感谢编辑和匿名评论者提供的宝贵意见和帮助。GydF4y2Ba
资金GydF4y2Ba
该研究得到了中国国家自然科学基金的支持(第31160398,31560563),中国博士后的中国博士学位(第20100470887,2012T50828),中国教育部的重点项目(第211182号),研究高等教育博士学位基金(20116202120005号),中国甘肃省自然科学基础(NO.1308RJZA179,1308RJZA262)。GydF4y2Ba
可用性数据和材料的GydF4y2Ba
原始数据可以通过对相应作者的要求获得。GydF4y2Ba
作者的贡献GydF4y2Ba
YZ和WL设计的研究;YZ,MW和LN进行了研究;YZ,WL和ZM贡献分析数据;和yz和wl写了这篇论文。所有作者阅读并认可的终稿。GydF4y2Ba
利益争夺GydF4y2Ba
作者宣称,他们有没有竞争的兴趣。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
相应的作者GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条提供的数据,除非另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
朱勇,廖伟,牛莉。GydF4y2Ba等等。GydF4y2Ba在黄瓜的不定根形成期间,一氧化氮参与氢气诱导的细胞周期激活。GydF4y2BaBMC植物BIOL.GydF4y2Ba16,GydF4y2Ba146(2016)。https://doi.org/10.1186/s12870-016-0834-0GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-016-0834-0GydF4y2Ba
关键词GydF4y2Ba
- 富氢水GydF4y2Ba
- 一氧化氮GydF4y2Ba
- 细胞周期GydF4y2Ba
- 细胞cycle-related基因GydF4y2Ba
- 不定根的形成GydF4y2Ba
- 黄瓜GydF4y2Ba