摘要
背景
叶黄素是一种含氧类胡萝卜素,在植物的生长发育中起着重要的作用。在植物中,两种不同类型的胡萝卜素羟化酶,非血红素二铁和含血红素的细胞色素P450,被报道参与叶黄素的生物合成。柑橘果实中积累了大量的叶黄素,尤其是β、β-叶黄素。然而,到目前为止,胡萝卜素羟化酶在调控叶黄素含量和组成中的作用还没有被阐明。
结果
在本研究中,四个胡萝卜素羟化酶基因(CitHYb,CitCYP97A,CitCYP97B,CitCYP97C)在柑橘果实叶黄素生物合成中的作用。系统发育分析表明,这4种柑橘类胡萝卜素羟化酶在高等植物中存在4个不同的聚类。CitHYb为非血红素二铁胡萝卜素羟化酶,而CitCYP97A、CitCYP97B和CitCYP97C为含血红素的细胞色素p450型胡萝卜素羟化酶。基因表达结果显示CitHYbβ、β-叶黄素在柑橘果实中积累的规律与果实中β、β-叶黄素积累的规律一致。的表达CitCYP97A而且CitCYP97C在11月达到高峰,这可能导致果汁囊中的叶黄素在成熟过程中增加。表达水平CitCYP97B远低于CitHYb,CitCYP97A,CitCYP97C在果汁囊中。功能分析表明,CitHYb能够催化β-胡萝卜素和α-胡萝卜素的β-环羟基化大肠杆菌BL21 (DE3)细胞。同时,当CitHYb与CitCYP97C共表达时,β-环和ε-环上α-胡萝卜素依次发生羟基化,产生叶黄素。
结论
CitHYb是柑橘果实中β、β-叶黄素合成的关键基因。CitCYP97Cε-环羟化酶利用玉米黄质作为底物产生叶黄素。研究结果将有助于阐明柑橘果实中叶黄素的生物合成,并为提高柑橘果实的营养品质和商品品质提供新的策略。
背景
类胡萝卜素是自然界中广泛存在的一类色素,为水果和花朵提供独特的颜色,在植物生长发育中发挥着重要作用[1- - - - - -4].在自然界中,已经发现了700多种类胡萝卜素,并分为两类:胡萝卜素和叶黄素。胡萝卜素是线性或环状碳氢化合物,而叶黄素是胡萝卜素的氧化衍生物,如叶黄素、β-隐黄质、玉米黄质和虾青素。在高等植物中,叶黄素在光合作用和光保护中起着重要作用。它们是光合机构的结构元素,叶黄素循环(叶黄素、玉米黄质和蒽黄质)通过耗散多余的光能来保护植物免受强光照射的损害[5- - - - - -8].此外,叶黄素可以通过位点特异性的方式氧化裂解,产生不同的罗布麻素,具有重要的代谢功能,如植物激素、色素以及香气和气味化合物[9- - - - - -13].叶黄素不仅对植物本身很重要,而且对人体健康也有好处。流行病学研究表明,叶黄素,如叶黄素、β-隐黄质和虾青素,由于其较高的抗氧化活性,可以有效预防眼病、某些癌症和炎症[14- - - - - -21].
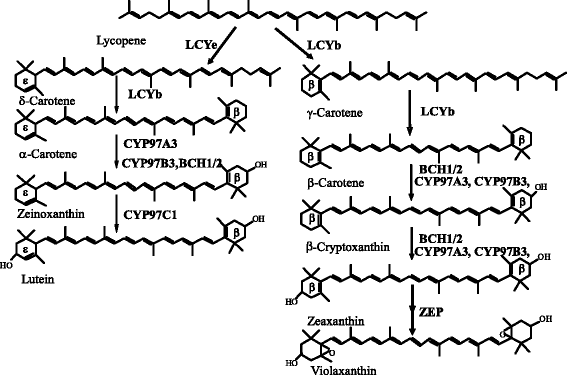
在植物中,两种不同类型的胡萝卜素羟化酶,非血红素二铁胡萝卜素羟化酶和含血红素细胞色素p450型胡萝卜素羟化酶参与叶黄素的生物合成。非血红素二铁胡萝卜素羟化酶(也称为BCH、HYD或HYb)能有效催化β-胡萝卜素β-环的羟化(图2)。1).在一些植物物种中,有报道称存在两个非血红素二铁胡萝卜素羟化酶成员,它们具有相似的功能,但具有组织特异性的表达模式[22- - - - - -25].拟南芥中,BCH1和BCH2双零突变导致β、β-叶黄素[24,26].最近,在拟南芥中发现了三种含血红素的细胞色素p450型胡萝卜素羟化酶CYP97A3、CYP97B3和CYP97C1。如图所示。1, CYP97C1编码LUT1拟南芥的ε-环羟基化位点[27,28].CYP97C1是叶黄素生物合成的关键酶,其活性是其他胡萝卜素羟化酶所不能替代的。在番茄中,上调CYP97C11导致叶片中叶黄素含量增加。相反,当CYP97C11下调,叶黄素在番茄叶片中几乎缺失(0.8%)[29].CYP97A3编码的LUT5在拟南芥中,基因座对β-胡萝卜素的β-环具有主要活性,对β-胡萝卜素的β-环具有次要活性[28,30.(图。1).Quinlan等[31]报道了OsCYP97A4与OsCYP97C2在玉米原生质体中相互作用,OsCYP97A4与OsCYP97C2之间的协同作用驱动叶黄素的形成。与CYP97A和CYP97C不同,CYP97B在叶黄素生物合成中的作用仍未得到充分研究。有研究表明CYP97B3可能对拟南芥中β-胡萝卜素和α-胡萝卜素的β-环进行羟基化[32,33].然而,在四重突变体(bch1,bch2,cyp97c1,cyp97a3)中,叶黄素没有积累,这表明CYP97B可能不是胡萝卜素羟基化的重要酶[8,24].
柑橘果实中积累了大量的叶黄素,尤其是β、β-叶黄素,占总类胡萝卜素的90% [34,35].在之前的研究中,人们对不同柑橘品种果实中的类胡萝卜素代谢进行了广泛的研究[11,34- - - - - -38].同时,已分离出一些关键类胡萝卜素代谢基因,并对其在柑橘果实中的功能进行了深入研究[9,11,12,37,39].然而,迄今为止,胡萝卜素羟化酶在柑橘类胡萝卜素含量和组成中的调控作用仍不清楚。在本研究中,4个胡萝卜素羟化酶基因(CitHYb,CitCYP97A,CitCYP97B,CitCYP97C结果表明,黄酮类化合物在成熟过程中对黄酮类化合物和果汁囊的含量有显著影响。此外,为了阐明它们在叶黄素生物合成中的作用,对4个胡萝卜素羟化酶基因进行了功能分析大肠杆菌细胞积累不同的类胡萝卜素。本研究结果将有助于进一步阐明柑橘类胡萝卜素积累的机制,为提高柑橘类水果的营养品质和商品品质提供新的思路。
结果
柑橘类果实中胡萝卜素羟化酶基因的分离与鉴定
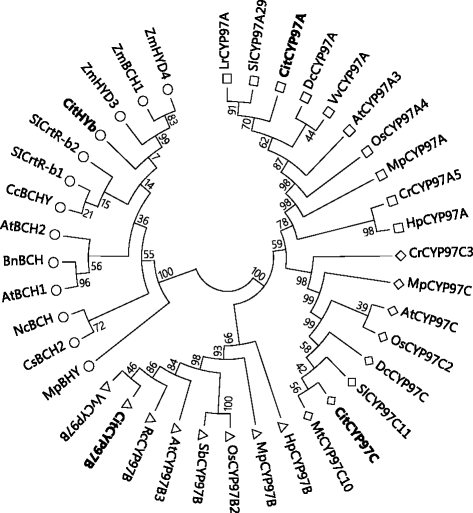
为了鉴定柑橘类胡萝卜素羟化酶基因,我们对柑橘类clementina v.10和柑橘sinesis v. 1.1基因组数据库(http://www.phytozome.net/),利用拟南芥的序列BCH1,BCH2,CYP97A3,CYP97B3,CYP97C1分别作为查询。四个胡萝卜素羟化酶基因(HYb,CYP97A,CYP97B,CYP97C)在柑橘基因组数据库中被鉴定。在我们之前的研究中,CitHYb从萨摩普通话(注册号:AB114653)中分离得到的CYP97A,CYP97B,CYP97C在柑橘类水果中是完全未知的。在本研究中,全长cdnaCYP97A,CYP97B,CYP97C根据柑橘基因组数据库中获得的5′和3′utr范围内的引物,采用RT-PCR方法从柑橘中分离得到。的序列CYP97A,CYP97B,CYP97C被命名为CitCYP97A,CitCYP97B,CitCYP97C,并提交至NCBI数据库(登录号:CitCYP97ALC143646;CitCYP97BLC143647;CitCYP97CLC143648)。系统发育分析表明,这四种柑橘类胡萝卜素羟化酶存在于四个不同的聚类中,这些聚类已在高等植物中被鉴定。2).CitHYb是一个非血红素二铁胡萝卜素羟化酶,其核苷酸序列长度为936 bp,编码311个氨基酸,预测分子量为34.7 kDa。CitCYP97A、CitCYP97B、CitCYP97C为含血红素的细胞色素p450型胡萝卜素羟化酶。的核苷酸序列CitCYP97A全长1839 bp,编码612个氨基酸,预测分子量为68.4 kDa。的核苷酸序列CitCYP97B全长1749 bp,编码582个氨基酸,预测分子量为65.2 kDa。的核苷酸序列CitCYP97C全长1641 bp,编码546个氨基酸,预测分子量为61.6 kDa。在CitHYb(62个氨基酸)、CitCYP97A(37个氨基酸)、CitCYP97B(50个氨基酸)和CitCYP97C(18个氨基酸)的n端预测到一个不同长度的叶绿体转运肽。
黄豆成熟过程中类胡萝卜素含量及羟化酶基因表达的变化
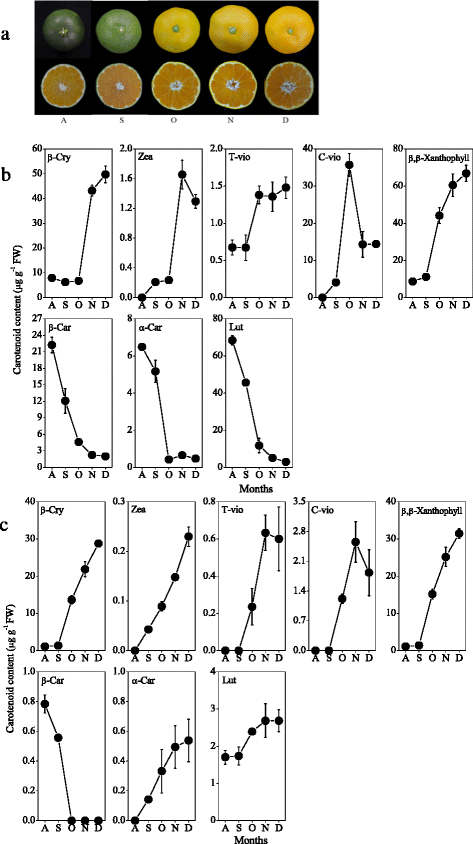
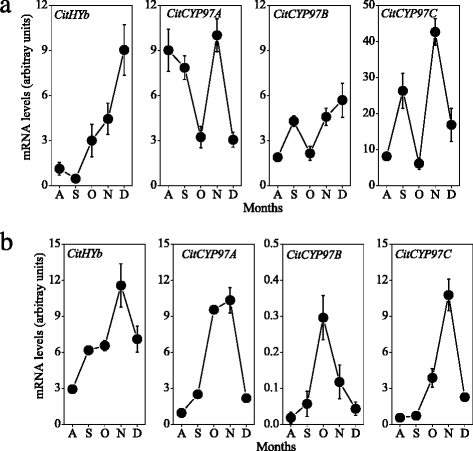
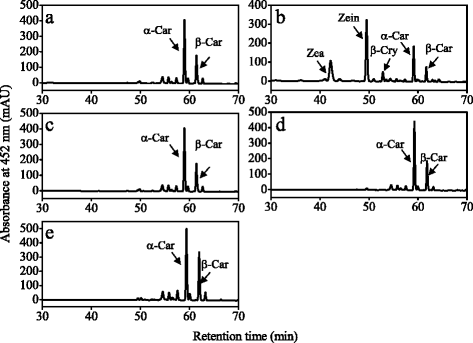
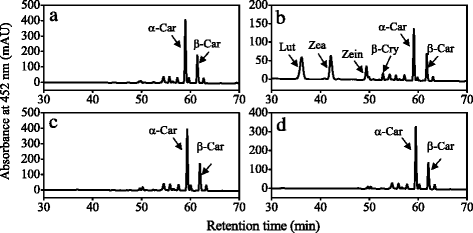
本研究从柑橘果实成熟过程中提取类胡萝卜素,采用高效液相色谱法分析了类胡萝卜素含量和组成的变化。黄酮类化合物中β-胡萝卜素、α-胡萝卜素和叶黄素的含量从8月开始迅速下降,并在成熟过程中保持在较低水平。3).柑橘果实中主要类胡萝卜素β-隐黄质含量在成熟过程中显著增加,达到49.7 μg g−112月。此外,玉米黄质的含量,全部-反式黄质和独联体-紫黄质也逐渐增加,β、β-叶黄素(β-隐黄质、玉米黄质、全-)含量增加反式黄质,独联体-紫黄质)在成熟过程中大量积累(图。3 b).基因表达结果显示CitHYb从9月开始逐渐增加,这与β、β-叶黄素在成熟过程中的积累一致(图3)。4).的表达CitCYP97A在10月迅速下降到较低水平,然后在11月上升,在成熟过程中达到高峰。的表达CitCYP97C在9月和11月分别达到两个高峰。类似于CitCYP97C,表示CitCYP97B逐渐增加,9月达到高峰。
果汁成熟过程中类胡萝卜素含量及胡萝卜素羟化酶基因表达的变化
在汁囊中,β-胡萝卜素含量在10月迅速下降到极低水平,而β-隐黄质和玉米黄质含量在成熟过程中显著增加(图2)。3 c).在成熟过程中,汁囊中α-胡萝卜素和叶黄素含量逐渐增加。基因表达结果显示CitHYb果实成熟过程中汁液中β、β-叶黄素含量增加,与β、β-叶黄素积累过程平行(图1)。4 b).的表达CitCYP97A,CitCYP97B,CitCYP97C分别在10月和11月达到高峰。此外,表达水平CitCYP97B远低于CitCYP97A而且CitCYP97C在成熟过程中在果汁囊中(图。4 b).
胡萝卜素羟化酶基因的功能分析大肠杆菌细胞
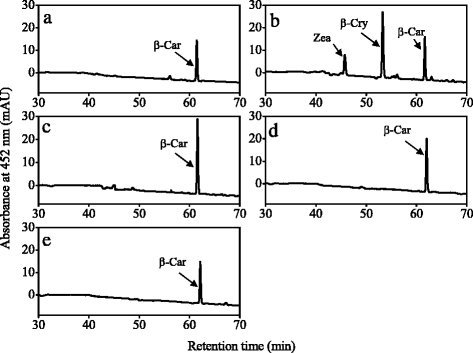
在本研究中,CitHYb,CitCYP97A,CitCYP97B,CitCYP97C分别克隆到pRSF-2 Ek/LIC载体中。4个重组质粒转化为β-胡萝卜素积累质粒大肠杆菌BL21 (DE3)细胞,以及α-胡萝卜素和β-胡萝卜素积累大肠杆菌分别为BL21 (DE3)细胞。采用高效液相色谱法从细菌中提取类胡萝卜素并进行分析。当CitHYb表达于β-胡萝卜素积累时大肠杆菌BL21 (DE3)细胞、β-隐黄质和玉米黄质峰(图;5 b).当CitHYb在α-胡萝卜素-和β-胡萝卜素-积累中表达时大肠杆菌除β-隐黄质和玉米黄质外,还检测到BL21 (DE3)细胞,一种单羟基化的中间产物zeinoxanthin(图3)。6 b).与CitHYb相比,CitCYP97A、CitCYP97B和CitCYP97C在β-胡萝卜素积累中没有表现出任何胡萝卜素羟基化活性大肠杆菌BL21 (DE3)细胞,或α-胡萝卜素和β-胡萝卜素积累大肠杆菌BL21 (DE3)细胞(图;5 c, d、e和6 c, d, e).
为了进一步研究柑橘类胡萝卜素羟化酶基因的功能,我们进行了共转化CitCYP97C与CitHYb,CitCYP97A,CitCYP97B,分别。重组质粒分别在α-胡萝卜素和β-胡萝卜素积累中表达大肠杆菌BL21 (DE3)细胞。如图所示。7 b当CitHYb和CitCYP97C共同表达时,由CitHYb产生的单羟基化玉米黄质经CitCYP97C进一步转化为叶黄素。然而,当CitCYP97A和CitCYP97C或CitCYP97B和CitCYP97C共同表达时,在α-胡萝卜素和β-胡萝卜素积累中未检测到羟基胡萝卜素大肠杆菌BL21 (DE3)细胞(图7 c, d).
高效液相色谱法分析α-胡萝卜素和β-胡萝卜素积累大肠杆菌pCDF-2 Ek/LIC-CitCYP97C和pRSF-2 Ek/LIC-CitHYb共转化BL21 (DE3)细胞b, pCDF-2 Ek/LIC-CitCYP97C和pRSF-2 Ek/LIC-CitCYP97A (c, pCDF-2 Ek/LIC-CitCYP97C和pRSF-2 Ek/LIC-CitCYP97B (d).从α-胡萝卜素和β-胡萝卜素积累的悬浮培养物中提取胡萝卜素大肠杆菌以含有pRSF-2(空载体)的BL21 (DE3)细胞为对照(一个).β汽车,β-胡萝卜素;β哭,β隐黄质;玉蜀黍属,玉米黄质;玉米蛋白,zeinoxanthin;附近地区,叶黄素
讨论
柑橘类果实中胡萝卜素羟化酶基因的分离与鉴定
胡萝卜素羟化酶是植物叶黄素生物合成的关键酶。在高等植物中发现了两种不同类型的胡萝卜素羟化酶,非血红素二铁胡萝卜素羟化酶和含血红素细胞色素p450型胡萝卜素羟化酶。在本研究中,四个胡萝卜素羟化酶基因(CitHYb,CitCYP97A,CitCYP97B,CitCYP97C)对柑桔果实中叶黄素合成的调节作用进行了研究。如图所示。24个胡萝卜素羟化酶基因聚在不同的组中。CitHYb为非血红素二铁胡萝卜素羟化酶,而CitCYP97A、CitCYP97B和CitCYP97C为含血红素的细胞色素p450型胡萝卜素羟化酶。据报道,有两个或更多HYb基因存在于一些植物物种中,如辣椒、番茄和拟南芥[23,25,40- - - - - -42].然而,只有一个HYb从柑橘类水果中分离鉴定得到的拟南芥,与拟南芥的同源性约为70%BCH1而且BCH2在氨基酸水平上。在以往的研究中,表达的变化HYb在不同的环境条件下对柑橘果实的成熟过程进行了广泛的研究[11,34,35,43,44].在果汁囊中,不同的表达水平CitHYb导致萨摩蜜橘和瓦伦西亚橙的类胡萝卜素成分不同[34].相比CitHYb目前,含血红素的细胞色素p450型胡萝卜素羟化酶在调控柑橘类胡萝卜素积累中的作用完全未知。本研究首次将其分离CitCYP97A,CitCYP97B,CitCYP97C柑橘类水果。系统发育分析表明,CitCYP97A与CitCYP97C的亲缘关系高于与CitCYP97B的亲缘关系。与CitCYP97A和CitCYP97C相比,CitCYP97B在氨基酸序列中有3个插入位点,与CitCYP97A和CitCYP97C的氨基酸同源性约为42%(附加文件)1:图S1)。据报道,拟南芥中的CYP97B3是一个未被鉴定的细胞色素P450单加氧酶,三个氨基酸插入段将CYP97B从CYP97A和CYP97C中分化出来[33,45].此外,预测了一个过境肽在n端支配的蛋白质编码CitHYb,CitCYP97A,CitCYP97B,CitCYP97C,表明柑橘类胡萝卜素羟化酶的4种酶均能导入质体中。由于大多数类胡萝卜素是在质体中合成和储存的,因此其位置CitHYb,CitCYP97A,CitCYP97B,CitCYP97C在质体内可以催化胡萝卜素羟基化反应。
柑橘果实成熟过程中类胡萝卜素含量及羟化酶基因表达的变化
在以往的研究中,从不同的植物中分离出了非血红素二铁胡萝卜素羟化酶,并对其在类胡萝卜素生物合成中的作用进行了表征[23- - - - - -25,46].在拟南芥中,BCH1和BCH2主要催化β-胡萝卜素β-环的羟基化[22,47].Du等人[48]报道了DSM2基因(BCH)控制玉米黄质和ABA的生物合成,赋予水稻抗旱和抗氧化胁迫能力。柑橘果实在成熟过程中积累大量叶黄素,尤其是β、β-叶黄素。在本研究中,结果显示CitHYb在成熟过程中,黄皮囊和汁囊逐渐增多。4).表达的增加CitHYb与黄酮类物质β、β-叶黄素在黄酮类物质和汁囊中的积累密切相关(图3)。3.).这一结果与Pons等人的研究结果一致[49],在其中抑制表达Csβ-CHX(HYb)诱导甜橙中β-胡萝卜素含量显著增加(高达36倍),β、β-叶黄素含量显著降低。因此,有人建议CitHYb是柑橘果实中β、β-叶黄素合成的关键基因。
与非血红素二铁胡萝卜素羟化酶相比,含血红素的细胞色素p450型胡萝卜素羟化酶优先羟基化α-胡萝卜素的β-和α-环,在拟南芥中产生叶黄素[30.].Quinlan等[31研究发现水稻OsCYP97A4与OsCYP97C2之间存在协同作用,这一协同作用需要驱动叶黄素的生物合成。在本研究中,基因表达结果显示,表达量为CitCYP97A而且CitCYP97C11月汁囊中叶黄素含量增加,这可能导致叶黄素在成熟过程中增加。3 c而且4 b).在flavedo中,表达CitCYP97A从8月开始迅速下降,这与青绿期叶黄素的减少是平行的。在橙色阶段(10月起),表达CitCYP97A而且CitCYP97C黄酮类化合物的含量在11月最高,黄酮类化合物的叶黄素含量在11月最低。3 b而且4).在柑橘果实中,β、ε-类胡萝卜素积累(α-胡萝卜素和叶黄素)转变为β、β-类胡萝卜素积累(β-胡萝卜素、β-隐黄质、玉米黄质、全-)反式黄质,独联体-violaxanthin)在成熟过程中在黄酮类化合物中出现,伴随有CitLCYe转录和增加CitLCYb记录。我们之前报道过的表达CitLCYe在萨摩柑黄酮的橙期迅速下降到较低水平[34,39].由此可见,柑桔期叶黄素水平主要受CitLCYe而不是CitCYP97A而且CitCYP97C橙皮。
CYP97B是CYP97家族中另一个具有胡萝卜素羟基化活性的成员。拟南芥CYP97B3对β-胡萝卜素和α-胡萝卜素具有潜在的羟基化活性[32,33].然而,CYP97B是否参与了叶黄素的生物合成仍然存在争议,因为拟南芥四重突变体(bch1,bch2,cyp97c1,cyp97a3)只含CYP97B3 [8,24].在本研究中,结果显示CitCYP97B在果汁囊内的含量远低于对照组CitHYb,CitCYP97A,CitCYP97C,这表明CitCYP97B可能不是柑橘果汁囊中胡萝卜素羟基化的关键基因。4 b).
胡萝卜素羟化酶基因的功能分析大肠杆菌细胞
在柑橘中,转基因果实的幼年期较长,可延迟5-15年出果,因此很难研究其基因功能[50].作为一种替代方法,大肠杆菌积累不同类胡萝卜素的细胞已被确定为研究柑橘类胡萝卜素代谢基因功能的有效平台[11,39,43].在本研究中,我们使用β-胡萝卜素积累大肠杆菌BL21 (DE3)细胞和α-胡萝卜素和β-胡萝卜素积累大肠杆菌用BL21 (DE3)细胞对柑橘4个胡萝卜素羟化酶基因的功能进行了研究。结果表明,CitHYb能催化β-胡萝卜素和α-胡萝卜素的β-环羟基化大肠杆菌BL21 (DE3)细胞。当CitHYb表达于β-胡萝卜素积累时大肠杆菌在BL21 (DE3)细胞中,β-胡萝卜素转化为β-隐黄质和玉米黄质,支持了这一发现CitHYb为β的关键基因,β-叶黄素积累柑橘果实(图。5 b).在拟南芥中,有报道称CYP97A3和CYP97C1分别通过羟基化α-胡萝卜素β-和ε-环参与叶黄素的生物合成[24,31].然而,在没有CYP97A的情况下,叶黄素的生物合成并没有完全被阻断。在拟南芥和水稻中,与野生型相比,CYP97A突变体只减少了约20%的叶黄素,这表明其他胡萝卜素羟化酶也一定能够催化α-胡萝卜素在β-环上的羟化[30.,51].在本研究中,我们发现CitHYb参与叶黄素的生物合成。它将α-胡萝卜素转化为玉米黄质,玉米黄质进一步被CitCYP97C羟基化产生叶黄素。有趣的是,CitCYP97C只有在与CitHYb共表达时才表现出ε-环羟基化活性。此外,玉米黄质是CitCYP97C的底物,而不是α-胡萝卜素,因为α-隐黄质,ε-环上的单羟基化α-胡萝卜素,在CitCYP97C中没有检测到大肠杆菌转化的细胞CitCYP97C(无花果。6 e).结果表明,柑橘果实中α-胡萝卜素在β-环和ε-环上依次羟基化产生叶黄素。在拟南芥、番茄和地苔中也有类似的结果[29,30.,52].
与CitHYb相比,CitCYP97A和CitCYP97B的胡萝卜素羟基化活性未被检测到大肠杆菌BL21 (DE3)细胞。在高等植物中,只有水稻OsCYP97A4表现出β-环羟基化活性大肠杆菌细胞(31].氨基酸序列分析显示,CitCYP97A与OsCYP97A4具有70%的相似性,且与OsCYP97A4具有相同的保守氧结合结构域和血红素结合结构域(附加文件)2:图S2)。此外,我们还检测了全长CitCYP97A的活性,并根据Quinlan[研究建议优化了培养温度和IPTG浓度]。45](数据未显示)。遗憾的是,我们无法检测到CitCYP97A的任何羟基化活性大肠杆菌细胞。类似地,尝试测定拟南芥CYP97A3和苔草MpCYP97A的胡萝卜素羟基化活性大肠杆菌细胞也失败了[30.,52].然而,突变体研究表明拟南芥CYP97A3 (LUT5基因座)对β-胡萝卜素的β-环有较大的羟基化活性,对β-胡萝卜素的β-环有较小的羟基化活性[30.].在橙色胡萝卜,一个缺陷CYP97A3等位基因导致α-胡萝卜素积累和高α-/β-胡萝卜素比值[53].Pons等人的研究[49]提示甜橙中可能存在第二种胡萝卜素羟化酶,因为它抑制了Csβ-CHX(HYb)只引起叶黄素含量的轻微下降。在我们的研究中,基因表达结果表明CitCYP97A在成熟过程中表现在黄皮囊和汁囊中。与此同时,变化CitCYP97A与叶黄素在果汁囊(成熟期)和黄酮类(绿色期)中的积累一致,说明CitCYP97A可能参与了柑橘果实叶黄素的生物合成。然而,CitCYP97A调控柑橘果实叶黄素生物合成的机制似乎更为复杂,一些辅助因子在柑橘果实中缺失大肠杆菌CitCYP97A可能需要细胞才能发挥其活性。在未来的研究中,进一步鉴定含血红素细胞色素p450型胡萝卜素羟化酶的辅助因子将有助于阐明其作用CitCYP97A在类胡萝卜素的积累。
结论
在本研究中,四个胡萝卜素羟化酶基因(CitHYb,CitCYP97A,CitCYP97B,CitCYP97C)对柑橘果实中叶黄素合成的调节作用进行了研究。结果表明CitHYb是柑橘果实中β、β-叶黄素合成的关键基因。功能分析表明,CitHYb能羟基化β-胡萝卜素和α-胡萝卜素的β-环大肠杆菌BL21 (DE3)细胞。同时,当CitHYb与CitCYP97C共表达时,β-环和ε-环上α-胡萝卜素依次发生羟基化,产生叶黄素。此外,我们还检测了CitCYP97A在柑橘果实成熟过程中,其表达的变化与叶黄素在果汁囊(成熟期)和黄酮类(绿色期)中的积累一致,说明CitCYP97A可能参与了柑橘果实叶黄素的生物合成。本研究结果将有助于进一步阐明柑橘类胡萝卜素生物合成机制,并为改善柑橘类胡萝卜素成分提供新的策略。
方法
植物材料
无核小蜜橘普通话(柑橘unshiuMarc.)种植于静冈县大学藤田农场(日本静冈县)。每年8月至12月定期采集水果样本。从取样的水果中分离出黄皮囊和果汁囊,立即用液氮冷冻,并保存在- 80°C直至使用。
类胡萝卜素的提取和测定
类胡萝卜素的鉴定和定量方法参照Ma等[11].用含0.1% (w/v) 2,6-二-的正己烷:丙酮:乙醇(2:1:1 [v/v])溶液从样品中提取色素叔-丁基-4-甲基苯酚和10% (w/v)碳酸镁碱。待有机溶剂完全蒸发后,用20% (w/v)甲醇KOH皂化含有酯化为脂肪酸的类胡萝卜素的提取物。然后加入nacl饱和水去除水溶性提取物。重新分配到二乙醚相的色素被回收并蒸发干燥。随后,将残留物重新溶解在5 mL的TBME:甲醇(1:1 [v/v])溶液中。色谱柱为YMC类胡萝卜素S-5,色谱柱为250- × 4.6 mm-i.d,反相高效液相色谱(Jasco, Tokyo, Japan),色谱柱为20 μL。(Waters, Milford, MA),流速为1ml min−1.洗脱液由光电二极管阵列检测器(MD-2015, Jasco)监测。类胡萝卜素浓度由标准曲线估计,并以每克新鲜体重毫克数表示[34].在3个重复中进行类胡萝卜素定量。
胡萝卜素羟化酶基因的分离与序列分析
按照Ikoma等人的方法从萨摩蜜橘黄中提取总RNA [54].用TaqMan逆转录试剂(Applied Biosystems)从总RNA中提取2 μg合成第一链cDNA。的全长cdnaCitCYP97A,CitCYP97B,CitCYP97C根据柑橘基因组数据库中5′和3′区间的序列设计引物进行RT-PCR扩增(附加文件3.:表S1)。扩增的cdna被克隆到TOPO TA载体中,使用BigDye Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems, Foster City, CA, USA)和ABI PRISM 3100基因分析仪(Applied Biosystems)进行测序。
的一致性CitHYb,CitCYP97A,CitCYP97B,CitCYP97C使用CLUSTAL W (http://www.clustal.org).利用MEGA6软件对推导的胡萝卜素羟化酶氨基酸序列进行比对,构建Neighbor-joining系统进化树[55].Accession number:拟南芥AtBCH1, AY113923;拟南芥AtBCH2 AY117225;甘蓝型油菜BnBCH EF026098;caffea canephora CcBCHY, DQ157165;柑橘CitHYb1 AB114653;番红花CsBCH2, AY579207;番茄SICrtR-b1, Y14809;番茄SICrtR-b2, Y14810;马钱子MpBHY, AB981062; Narcissus tazetta var. chinensis NcBCH, JN625263; Zea mays ZmBCH1, GQ131287; Zea mays ZmHYD3, AY844958; Zea mays ZmHYD4, AY844956; Arabidopsis AtCYP97A3, NM_102914; Chlamydomonas reinhardtii CrCYP97A5, EF587911; Citrus CitCYP97A, LC143646; Daucus carota DcCYP97A3, JQ655297; Haematococcus pluvialis HpCYP97A, JX308236; Lycopersicon esculentum SlCYP97A29, EU849605; Lycium ruthenicum LrCYP97A, KF957714; Marchantia polymorpha MpCYP97A, AB981063; Oryza sativa OsCYP97A4, AK068163; Vitis vinifera VvCYP97A, XP_002279984; Arabidopsis AtCYP97C1, AY424805; Citrus CitCYP97C, LC143648; Chlamydomonas reinhardtii CrCYP97C3, EF587910; Daucus carota DcCYP97C, ABB52076; Lycopersicon esculentum SlCYP97C11, EU849604; Medicago truncatula MtCYP97C10, ABC59096; Marchantia polymorpha MpCYP97C, AB981065; Oryza sativa OsCYP97C2, AK065689; Arabidopsis AtCYP97B3, NM_117600; Citrus CitCYP97B, LC143647; Haematococcus pluvialis HpCYP97B, JX272918; Marchantia polymorpha MpCYP97B, AB981064; Oryza sativa OsCYP97B2, XM_015771315; Ricinus communis RcCYP97B, XP_002520583; Sorghum bicolor SbCYP97B, XP_002451628; Vitis vinifera VvCYP97B, XP_002266883. Predictions of transit peptides ofCitHYb,CitCYP97A,CitCYP97B,CitCYP97C使用TargetP进行。
总RNA提取和实时定量RT-PCR
按照Ikoma等人的方法从不同发育阶段的柑橘黄囊和汁囊中提取总RNA [54].使用RNeasy Mini Kit (Qiagen)进行柱上dna酶消化,清除总RNA。使用TaqMan逆转录试剂(Applied Biosystems), 2 μg纯化RNA和随机六聚体在37℃下进行60分钟的逆转录反应。
TaqMan MGB探针和引物集CitHYb,CitCYP97A,CitCYP97B,CitCYP97C是用Primer Express软件设计的(附加文件4:表S2)。内源对照采用TaqMan核糖体RNA对照试剂VIC探针(Applied Biosystems)。根据制造商的说明书,使用ABI PRISM 7300(应用生物系统公司)的TaqMan通用PCR Master Mix(应用生物系统公司)进行TaqMan实时PCR。每个反应包含900 nM的引物,250 nM的TaqMan MGB探针和模板cDNA。热循环条件为95°C 10 min,然后是95°C 15 s和60°C 60 s的40个循环。用ABI PRISM 7300序列检测系统软件(Applied Biosystems)分析基因表达水平,并与18S核糖体RNA结果进行归一化。每个样品在3个重复中进行实时定量RT-PCR。
胡萝卜素羟化酶的功能分析大肠杆菌细胞
的互补CitHYb,CitCYP97A,CitCYP97B,CitCYP97C分别克隆到pRSF-2 Ek/LIC载体和pCDF-2 Ek/LIC载体。在以往的研究中,有两个重组质粒pET-CitLCYb1和宠物,CitLCYb1+CitLCYe被构造,并改造成大肠杆菌BL21 (DE3)细胞携带番茄红素生物合成棕榈素pACCRT-欧洲投资银行分别为(39,56].pACCRT-的协变换欧洲投资银行与宠物CitLCYb1或宠物,CitLCYb1+CitLCYe导致β-胡萝卜素的积累或α-胡萝卜素和β-胡萝卜素的积累大肠杆菌BL21 (DE3)细胞。在本研究中,重组质粒pRSF-2-CitHYbpRSF-2 -CitCYP97ApRSF-2 -CitCYP97B, pRSF-2CitCYP97C分别转化为β-胡萝卜素积累,以及α-胡萝卜素和β-胡萝卜素积累大肠杆菌BL21 (DE3)细胞。为了研究柑橘类胡萝卜素羟化酶之间的相互作用,我们共表达了pCDF-2-CitCYP97CpRSF-2 -CitHYbpRSF-2 -CitCYP97A, pRSF-2CitCYP97B在α-胡萝卜素和β-胡萝卜素的积累大肠杆菌分别为BL21 (DE3)细胞。用0.05 M异丙基β- d -硫半乳糖苷(IPTG)在27℃下诱导2 d,可提取类胡萝卜素大肠杆菌细胞。文化的大肠杆菌5000 g离心10 min,用Tris-HCl (pH 8.0)洗涤细菌球2次。颗粒使用真空冷冻干燥,并保存在−20°C,直到HPLC分析。用氯仿和甲醇的混合物(2:1 [v/v])提取冷冻研磨的材料,直到所有的颜色从大肠杆菌细胞。将类胡萝卜素提取液旋转蒸发至干燥,然后溶于甲基叔-丁基醚:甲醇(1:1 [v/v])溶液,含0.1%的丁基羟基甲苯。α-胡萝卜素、β-胡萝卜素、β-隐黄质、玉米黄质和叶黄素通过与正宗标准品的特定保留时间和吸收光谱进行比较进行鉴定(Kato et al. 2004)。zeinoxanthin的鉴定方法采用Meléndez-Martínez等[57].对每个胡萝卜素羟化酶基因,采用不同菌落进行3次重复,进行功能分析大肠杆菌细胞。
统计分析
所有值显示为三次重复的平均值±标准差。对数据进行分析,并对Tukey的HSD测试(atP< 0.05)比较治疗方式。
缩写
细胞色素P450 CYP;HYb羟化酶β型环;LCYb,番茄红素β环化酶;LCYe,番茄红素ε环化酶;齐柏林飞艇,玉米黄质expoxidase。
参考文献
植物类胡萝卜素生物合成的基因和酶。植物生理化学。1998;49:557-83。
类胡萝卜素作为叶绿体膜稳定剂。植物学报1998;3:147 - 151。
Cazzonelli CI, Pogson BJ。从源到库:植物类胡萝卜素生物合成的调控。植物学报。2010;15(3):393 - 393。
李丽,卢松,李丽娟,李丽娟,李丽娟。植物类胡萝卜素代谢。摩尔。2015;8:68 - 82。
Niyogi KK, Björkman O, Grossman AR.特定叶黄素在光保护中的作用。中国科学(d辑)1997;
黄晓燕,王晓燕,王晓燕,等。高等植物主要捕光复合体II类胡萝卜素结合位点研究。生物化学。1999;274:29613-23。
刘震,颜辉,王凯,匡涛,张杰,桂林,等。2.72 A分辨率下菠菜主捕光复合体的晶体结构。大自然。2004;428:287 - 92。
Fiore A, Dall’osto L, Cazzaniga S, Diretto G, Giuliano G, Bassi R.拟南芥四重突变体的LUT1/CYP97C1具有β-胡萝卜素羟基化活性,叶黄素对PSI/PSII比值的测定具有调节作用。植物生物学。2012;12:50。
Kato M, Matsumoto H, Ikoma Y, Okuda H, Yano M.类胡萝卜素切割双加氧酶在柑橘果实成熟过程中类胡萝卜素谱调控中的作用。中国地质大学学报(自然科学版)2006;
罗麻素:激素,菌根代谢物和香气挥发物。足底。2010;232:1-17。
马刚,张lc, Matsuta A, Matsutani K, Yamawaki K, Yahata M,等。类胡萝卜素裂解双加氧酶4催化β-隐黄质和玉米黄质生成β-柠檬黄苷的研究。植物杂志。2013;163:682 - 95。
Rodrigo MJ, Alquézar B, Alós E, Lado J, Zacarías L.柑橘果皮色素沉积的生化基础和分子调控。Sci Hortic。2013;163:46 - 62。
Ahrazem O, Rubio-Moraga A, Berman J, Capell T, Christou P, Zhu C, Gómez-Gómez L.春季番红花和藏红花类胡萝卜素切割双加氧酶CCD2催化藏红花素合成是一种可塑酶。新植醇。2016;209:650 - 63。
Cerhan JR, Saag KG, Merlino LA, Mikuls TR, Criswell LA。抗氧化微量营养素与老年妇女类风湿关节炎的风险流行病学杂志。2003;157:345-54。
刘志强,刘志强,刘志强,刘志强,等。雌性恒河猴慢性摄入(3R, 3'R, 6'R)-叶黄素和(3R, 3'R)-玉米黄质。眼科科学。2006;47:5476-86。
Yamaguchi M, Hamamoto R, Uchiyama S, Ishiyama K, Hashimoto K.蜂花粉枳实提取物对离体和体内大鼠股骨干和干骺端组织骨成分的合成代谢作用卫生科学杂志,2006;52:43-9。
Sugiura M, Nakamura M, Ogawa K, Ikoma Y, Ando F, Shimokata H, Yano M.与骨密度相关的抗氧化维生素和类胡萝卜素摄入的饮食模式:来自绝经后日本女性受试者的研究结果。现代康复。2011;22:143-52。
高永木,森本S,白仓Y, Mukai K, Sugiyama T, Tokuji Y, Ohnishi M. o .灌胃柑橘β隐黄质对肥胖、糖尿病小鼠内脏脂肪减少的作用机制柑橘unshiu马克)。农业食品化学学报。2011;59:12342-51。
类胡萝卜素β-隐黄质在骨稳态中的作用。生物医学进展。2012;19:36。
刘超,德史密斯,胡国强,蔡文伟,王晓东。β-隐黄质恢复尼古丁减少的肺SIRT1到正常水平,并抑制尼古丁促进的肺肿瘤和肺气肿A/J小鼠。癌症预防研究(Phila)。2013; 6:309-20。
ppouchieu C, Galan P, Ducros V, Latino-Martel P, Hercberg S, Touvier M.血浆类胡萝卜素和视黄醇与整体乳腺癌风险:一项嵌套病例对照研究。减轻癌症。2014;66:980-8。
田丽萍,李晓萍,李晓萍。拟南芥类胡萝卜素β -羟化酶基因的克隆及表达分析LUT1轨迹。植物化学。2001;47:379 - 379。
Galpaz N, Ronen G, Khalfa Z, Zamir D, Hirschberg J.通过克隆番茄白花基因座,揭示了一条染色体特异性类胡萝卜素合成途径。植物细胞。2006;18:1947-60。
张建军,张建军,张建军,张建军。拟南芥类胡萝卜素羟化酶基因的克隆与表达。植物学报。2009;50:463 - 479。
D 'Ambrosio C, Stigliani AL, Giorio G.CrtR-b2(胡萝卜素-羟化酶2)来自美国lycopersicuml对转基因番茄植株叶黄素合成和积累的差异影响。转基因研究》2011;20:47-60。
张建平,李建平,张建平,等。拟南芥β -环类胡萝卜素羟化酶的功能分析。植物细胞。2003;15:1320-32。
Tian L, Musetti V, Kim J, magallanese - lundback M, DellaPenna D.拟南芥LUT1基因座编码细胞色素p450家族的一个成员,是类胡萝卜素环羟基化活性所必需的。中国科学(d辑)2004;101:402-7。
Fiore A, Dall’osto L, Fraser PD, Bassi R, Giuliano G.对β -胡萝卜素羟基化途径的研究拟南芥.2月。2006;580:4718-22。
叶黄素- β -羟化酶和β -羟化酶对番茄根、叶、花瓣和果实中叶黄素合成的调控。植物细胞物理学报。2011;52:851-65。
确定植物合成叶黄素的主要途径:拟南芥类胡萝卜素β环羟化酶CYP97A3的作用。中国科学:地球科学,2006;
刘志强,刘志强,刘志强,等。胡萝卜素环羟化酶在植物类胡萝卜素合成中的协同作用。植物杂志。2012;160:204-14。
Kim JE, Punja ZK, Douglas CJ。Co-expression的拟南芥细胞色素P450酶和nadph -细胞色素P450还原酶大肠杆菌:检测候选β-胡萝卜素羟化酶的功能。第14届细胞色素P450国际会议论文集,意大利德克萨斯州达拉斯:Medimond S.r.l;2005.115 - 20页。
Kim JE, Cheng KM, Craft NE, Hamberger B, Douglas CJ。表达的拟南芥单独的类胡萝卜素羟化酶以及与β-胡萝卜素酮醇酶结合提供了体内功能的深入了解。植物化学,2010;71:168 - 78。
黄晓燕,杨玉玲,杨玉玲,杨玉玲,杨玉玲。柑橘果实成熟过程中类胡萝卜素积累及类胡萝卜素生物合成基因的表达。植物杂志。2004;134:824-37。
罗瑞戈·MJ,马科斯·JF, Zacarías L.柑橘黄烷类胡萝卜素生物合成的生化和分子分析(素类L.)在果实发育成熟期间。农业食品化学。2004;52:6724-31。
乙烯处理对柑橘采后类胡萝卜素积累及类胡萝卜素生物合成基因表达的影响(素类l .水果等)。采后生物技术。2007;43:14-22。
Ríos G, Naranjo MA, Rodrigo MJ, Alós E, Zacarías L, Cercós M, Talón M.通过两个突变体的转录组分析鉴定一个GCC转录因子对柑橘果实颜色变化事件的响应。植物学报。2010;10:393。
魏晓霞,陈晨,于倩,杨晓燕,梁国强,陈晓燕。瓦伦西亚甜橙与罗德红瓦伦西亚甜橙类胡萝卜素积累及生物合成基因表达的比较。植物科学。2014;227:28-36。
张玲,马国刚,杨白井,张志明,张志明,张志明,张志明。两种番茄红素β-环化酶在柑橘中的表达及功能分析。足底。2012;236:1315-25。
Bouvier F, Keller Y, d’harlingue A, Camara B.叶黄素生物合成:辣椒果实类胡萝卜素羟化酶的分子和功能表征(甜椒l .)。生物化学。1998;1391:320-8。
Diretto G, Welsch R, Tavazza R, Mourgues F, Pizzichini D, Beyer P, Giuliano G.沉默β -胡萝卜素羟化酶可增加马铃薯块茎中总类胡萝卜素和β -胡萝卜素水平。植物生物学。2007;7:11。
李志强,李志强,李志强,李志强,李志强,等。玉米类胡萝卜素异构酶和β-胡萝卜素羟化酶基因的克隆及其在胚乳成熟中的调控作用。转基因研究》2010;19:1053 - 68。
Alquézar B, Zacarías L, Rodrigo MJ。柑橘中一种新的番茄红素β-环化酶的分子和功能特征及其与番茄红素积累的关系。中国地质大学学报(自然科学版)2009;
张玲,马刚,Kato M, Yamawaki K, Takagi T, Kiriiwa Y, Ikoma Y, Matsumoto H, Yoshioka T, Nesumi H.体外柑橘汁囊中类胡萝卜素积累和类胡萝卜素代谢基因表达的调控。中国生物医学工程学报。2012;33(3):391 - 396。
Quinlan RF, Jaradat TT, Wurtzel ET。大肠杆菌作为植物胡萝卜素羟化酶P450的功能性表达平台。生物化学。2007;458:146-57。
王红梅,杜锦英,赖红梅,郑圣。抑制β-环类胡萝卜素羟化酶基因对花色泽的影响金蝶兰属植物.植物生物(Stuttg)。2016; 18:220-9。
Sun Z, Gantt E, Cunningham Jr FX。β-胡萝卜素羟化酶的克隆及功能分析拟南芥.生物化学。1996;271:24349-52。
杜慧,王宁,崔峰,李欣,肖军,熊玲。通过增加水稻叶黄素和脱落酸合成β -胡萝卜素羟化酶基因DSM2对干旱和氧化胁迫抗性的研究。植物杂志。2010;154:1304-18。
Pons E, Alquézar B, Rodríguez A, Martorell P, Genovés S, Ramón D, Rodrigo MJ, Zacarías L, Peña L.通过代谢工程提高橙子果实中β-胡萝卜素的体内抗氧化性能。植物学报。2014;12:17-27。
Peña L, Cervera M, Fagoaga C, Romero J, Ballester A, Soler N, Pons E, Rodríguez A, Peris J, Juárez J, Navarro L. Citrus。在C科尔,TC大厅。柑橘类。中:科尔C、霍尔TC、编辑。转基因作物植物纲要:热带和亚热带水果和坚果。英国牛津:布莱克威尔出版社;2008.1 - 62页。
吕茂泽,晁东元,单建新,朱茂泽,史明,高太平,林红霞。水稻类胡萝卜素β环羟化酶CYP97A4参与叶黄素的生物合成。植物细胞物理学报。2012;53:987-1002。
黄志明,李志刚,李志刚,等。羟基类胡萝卜素的生物合成研究进展Marchantia polymorpha途径工程技术生产新型稀有叶黄素大肠杆菌.足底。2015;241:699 - 710。
Arango J, Jourdan M, Geoffriau E, Beyer P, Welsch R.胡萝卜素羟化酶活性决定了橙胡萝卜中α-胡萝卜素和总类胡萝卜素的含量。植物细胞。2014;26:2223-33。
徐志昌,田文昌,大村M,森口T。利用cDNA文库构建和RT-PCR技术从水果多糖丰富组织中提取RNA并评价其品质。中国生物医学工程学报。1996;24(4):329 - 331。
Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析6.0版本。《生物学报》2013;30:2725-9。
非胡萝卜素产生菌和酵母中类胡萝卜素的代谢工程研究。生物技术学报。1998;59:169-81。
Meléndez-Martínez AJ, Britton G, Vicario IM, Heredia FJ。橙汁中玉米黄质的鉴定。中国食品化学杂志。2005;53:6362-7。
致谢
感谢三泽Norihiko教授提供pACCRT-EIB质粒(日本石川县立大学生物资源与生物技术研究所)。
资金
这项工作得到了青年科学家资助项目B (16 K18649)的资助。
数据和材料的可用性
支持本文结果的数据集包含在本文及其附加文件中。
作者的贡献
GM和MK公司构思和设计了这项研究。WY和IT进行了实验并收集了数据。NI和MO对数据进行了分析。KY和MY提供了植物材料和试剂。LZ和MK准备了手稿。所有作者阅读并批准稿件。
完成利益
作者声明他们没有完全的利益。
同意出版
不适用。
伦理认可和同意参与
不适用。
作者信息
从属关系
相应的作者
附加文件
附加文件1:图S1。
与CitCYP97A和CitCYP97C相比,CitCYP97B有3个序列插入。(多克斯38 kb)
附加文件2:图S2。
CitCYP97A和OsCYP97A4氨基酸序列的比对。使用CLUSTAL W (http://www.clustal.org).多克斯(153 kb)
附加文件3:表S1。
引物序列用于分离的全长cdnaCitCYP97A,CitCYP97B,CitCYP97C.(多克斯12 kb)
附加文件4:表S2。
引物序列和TaqMan MGB探针用于胡萝卜素羟化酶基因的定量rt - pcr。(多克斯38 kb)
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许不受限制地在任何媒体上使用、分发和复制,前提是您要适当地注明原作者和来源,提供创作共用许可的链接,并说明是否进行了更改。知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
马国强,张玲,张永源,魏伟。et al。柑橘类胡萝卜素羟化酶的表达与功能分析:揭示柑橘类果实中叶黄素的生物合成。BMC植物杂志16,148(2016)。https://doi.org/10.1186/s12870-016-0840-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-016-0840-2
关键字
- β隐黄质
- 橙皮
- 汁囊
- 叶黄素
- 无核小蜜橘普通话