- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发表:GydF4y2Ba
一个新的角色GydF4y2Ba气孔木匠1GydF4y2Ba在气孔模式GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba16.GydF4y2Ba文章编号:GydF4y2Ba172GydF4y2Ba(GydF4y2Ba2016年GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
保护细胞(GCS)是植物表皮内的专用细胞,其形成气孔孔,通过该孔隙可以发生气体交换。GCS通过由转录因子指定的细胞划分的专门谱系GydF4y2Ba说不出话来GydF4y2Ba(GydF4y2BaSPCHGydF4y2Ba),在不对称分裂前未分化的表皮细胞中可检测到表达。其他转录因子可能在GC规范之前起作用,并且对正确的GC模式是必需的。以前,是DOF转录因子GydF4y2Ba气孔木匠1GydF4y2Ba(GydF4y2BaSCAP1GydF4y2Ba)被证明参与了GC功能,通过激活一组GC成熟和活性所需的GC特异性基因。目前尚不清楚SCAP1是否也影响气孔发育。GydF4y2Ba
结果GydF4y2Ba
在这里,我们展示了这一点GydF4y2BaSCAP1GydF4y2Ba在任何GC分化发生之前,也可以在幼叶原基中观察到表达。转基因植物的研究GydF4y2BaproSCAP1:GUS-GFPGydF4y2Ba转录融合结合qPCR分析表明GydF4y2BaSCAP1GydF4y2Ba表达高峰出现在一个时间窗口,这与气孔模式基因的表达一致。独立的GydF4y2Bascap1GydF4y2Ba功能突变突变体的损失突变数量减少了GCSGydF4y2BaSCAP1GydF4y2Ba除了改变GC分布和间距模式外,过表达行GC数量增加。功能获得等位基因背景下气孔细胞系早期标记的研究GydF4y2BaSCAP1GydF4y2Ba结果显示,与野生型相比,GC谱系中募集的原皮细胞数量增加,这反映在分生组织类细胞数量增加。GydF4y2Ba
结论GydF4y2Ba
我们的结果表明了早期的作用GydF4y2BaSCAP1GydF4y2Ba在gc差异化。我们提出了一种功能GydF4y2BaSCAP1GydF4y2Ba是整合GC生物学的不同方面,包括规范、间隔、成熟和功能。GydF4y2Ba
背景GydF4y2Ba
保卫细胞(GCs)是一种特化的表皮细胞,形成气孔,通过气孔进行气体交换。由于蒸腾作用与植物的生长和存活有关,因此对气相色谱数量、分布和活性的控制受到严格的调控。成熟的GC成对形成于表皮细胞层,起源于单个未分化的原皮细胞(PDC)。每个PDC经历一系列的细胞分裂和连续的细胞状态转换。这些过渡状态以细胞形态的变化为特征,并与转录组特征的改变有关[GydF4y2Ba1GydF4y2Ba–GydF4y2Ba3.GydF4y2Ba]。pdc的一个子集,称为分生组织母细胞- MMCs -,能够启动气孔细胞系。mmc不对称分裂产生一个小的三角形细胞,即分生组织(meristemoid),它是气孔保卫细胞的前体,而一个较大的细胞被称为气孔系基细胞(SLGC)。SLGC具有直接分化为浅裂铺装细胞或不对称分裂产生卫星分生组织的潜力。根据单细胞间距规则,所有新的分生组织与现有的分生组织至少分开一个细胞[GydF4y2Ba3.GydF4y2Ba–GydF4y2Ba7.GydF4y2Ba]。在最多三轮放大分裂后,寄入到防护母细胞(GMC)的寄入圆形的圆形形状。GMC对称地分裂以产生两个配对的保护单元,形成气孔孔。负责GC规范和发育的基因已经表征:BHLH型转录因子(TFS)GydF4y2Ba说不出话来GydF4y2Ba(GydF4y2BaSPCHGydF4y2Ba),GydF4y2Ba沉默的GydF4y2Ba, 和GydF4y2Ba法玛GydF4y2Ba按顺序起作用分别调节融资,GMCS和GCS的形成[GydF4y2Ba8.GydF4y2Ba–GydF4y2Ba10.GydF4y2Ba]。除了上述基因旁边,另一类BHLH型TFS,GydF4y2Ba尖叫/ ice1.GydF4y2Ba和GydF4y2BaSCREAM2GydF4y2Ba减少影响活动GydF4y2BaSPCHGydF4y2Ba,GydF4y2Ba沉默的GydF4y2Ba和FAMA通过异源二聚[GydF4y2Ba11.GydF4y2Ba]。先前的研究表明GydF4y2BaSPCHGydF4y2Ba细胞需要进入气孔细胞谱系,并促进分组的放大分裂[GydF4y2Ba9GydF4y2Ba,GydF4y2Ba10.GydF4y2Ba,GydF4y2Ba12.GydF4y2Ba]。实验利用GydF4y2BaSPCHGydF4y2Ba启动子 - 记者转录融合揭示了这一点GydF4y2BaSPCHGydF4y2Ba在发育中的叶表皮中表达,并在GMC和GCs中持续存在。然而,SPCH蛋白仅在未分化的PDCs、mmc和年轻的分生组织中检测到,提示GydF4y2BaSPCHGydF4y2Ba在转录后水平调节[GydF4y2Ba9GydF4y2Ba]。SPCH蛋白的活性由信号级联负调节,其包括分泌肽表皮图案化因子1和2(EPF1 / 2),富含亮氨酸的重复(LRR)受体样激酶erecta和太多的嘴巴(GydF4y2BaTMMGydF4y2Ba)[GydF4y2Ba3.GydF4y2Ba–GydF4y2Ba5.GydF4y2Ba,GydF4y2Ba7.GydF4y2Ba,GydF4y2Ba13.GydF4y2Ba,GydF4y2Ba14.GydF4y2Ba]。这个GydF4y2Ba有丝分裂原活化激酶GydF4y2Ba(GydF4y2BaMAPKGydF4y2Ba)基因作用于LRR受体的下游,包括GydF4y2Ba尤达GydF4y2Ba,GydF4y2BaMKK4GydF4y2Ba/GydF4y2BaMKK5GydF4y2Ba和GydF4y2BaMPK3.GydF4y2Ba/GydF4y2BaMPK6.GydF4y2Ba[GydF4y2Ba15.GydF4y2Ba–GydF4y2Ba17.GydF4y2Ba]。MAPK的刺激导致SPCH通过蛋白酶体降解磷酸化和失活[GydF4y2Ba1GydF4y2Ba–GydF4y2Ba3.GydF4y2Ba,GydF4y2Ba15.GydF4y2Ba,GydF4y2Ba18.GydF4y2Ba]。GydF4y2Ba
几种信号汇合来调节SPCH蛋白的稳定性,包括植物激素油菜素内酯和COGydF4y2Ba2.GydF4y2Ba[GydF4y2Ba19.GydF4y2Ba,GydF4y2Ba20.GydF4y2Ba]。SPCH蛋白在原皮细胞中的稳定是触发其转录活性和随后GC谱系进入的关键。SPCH的直接目标是GydF4y2BaEPF2.GydF4y2Ba编码肽的基因,该肽激活调节反馈回路,促进SPCH蛋白的不稳定[GydF4y2Ba21.GydF4y2Ba]。因此SPCH活性的调节将多种环境和内源性发育信号转换为不同的GC模式[GydF4y2Ba8.GydF4y2Ba–GydF4y2Ba10.GydF4y2Ba,GydF4y2Ba22.GydF4y2Ba]。GydF4y2Ba
除bhlh外,其他转录因子可能在GC规范中发挥重要作用。单指DNA结合蛋白(DOF)是一类重要的转录调控因子GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba包括37个成员[GydF4y2Ba11.GydF4y2Ba,GydF4y2Ba23.GydF4y2Ba]。已显示这些蛋白质参与植物发育的若干方面,包括生长,萌发和非生物应激反应[GydF4y2Ba9GydF4y2Ba,GydF4y2Ba10.GydF4y2Ba,GydF4y2Ba12.GydF4y2Ba,GydF4y2Ba24.GydF4y2Ba]。此外,dof类型因子与细胞周期控制有关[GydF4y2Ba9GydF4y2Ba,GydF4y2Ba25.GydF4y2Ba]。在气孔发育过程中,dof已经被假设在GC成熟中发挥作用[GydF4y2Ba3.GydF4y2Ba–GydF4y2Ba5.GydF4y2Ba,GydF4y2Ba7.GydF4y2Ba,GydF4y2Ba13.GydF4y2Ba,GydF4y2Ba14.GydF4y2Ba,GydF4y2Ba26.GydF4y2Ba,GydF4y2Ba27.GydF4y2Ba]。最近DOF转录因子GydF4y2Ba气孔木匠1GydF4y2Ba(GydF4y2BaSCAP1GydF4y2Ba已经显示出直接调节与防护细胞成熟和功能相关的基本过程。突变体GydF4y2Bascap1GydF4y2Ba显示出直接参与气孔运动的多种基因的转录物的改变水平,并且在GC细胞壁的某些机械性能下有缺陷[GydF4y2Ba28.GydF4y2Ba]。潜在的作用GydF4y2BaSCAP1GydF4y2Ba以前没有调查踩踏图案。在这项研究中,我们提供了证据GydF4y2BaSCAP1GydF4y2Ba在GC模式中起关键作用,其方式在时间和空间上都不同于其在GC成熟中的作用。我们观察到GydF4y2BaSCAP1GydF4y2Ba在发育早期,原基仅由未分化的细胞组成时,整个叶片的表达。突变体GydF4y2Bascap1GydF4y2Ba气孔密度和气孔指数均显著低于野生型。反之,过度表达GydF4y2BaSCAP1GydF4y2Ba导致气孔密度和气孔指数增加。此外GydF4y2BaSCAP1GydF4y2Ba表达暂时重叠了几种调节气孔图案化的其他几种基因的表达,与GydF4y2BaSCAP1GydF4y2Ba在气孔模式形成中起作用。通过糖皮质激素系统诱导SCAP1活性,可以抑制多种早期气孔模式基因,包括GydF4y2BaSPCHGydF4y2Ba,GydF4y2Ba沉默的GydF4y2Ba和GydF4y2BaEPF2.GydF4y2Ba,异位产生的gc改变间距和形态。根据这些表型,对扩展叶原基标记系的详细共聚焦显微镜分析表明,高水平的SCAP1与分生组织的数量和未分化的PDCs数量的增加相关。因此,我们的工作为GydF4y2BaSCAP1GydF4y2Ba在气孔模式GydF4y2Ba
结果GydF4y2Ba
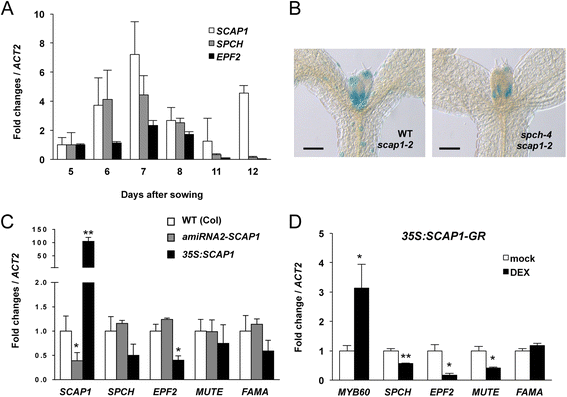
SCAP1GydF4y2Ba叶子中的表达式在GC规范之前GydF4y2Ba
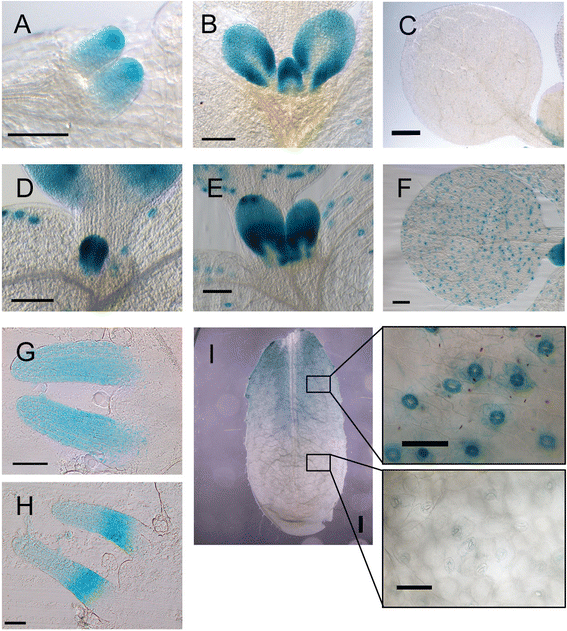
进一步阐明的作用GydF4y2BaSCAP1GydF4y2Ba在气孔发育过程中,我们描述了气孔发育的特征GydF4y2Bascap1GydF4y2Ba转座子插入突变体在冷泉港收集。这个等位基因(被称为GydF4y2Bascap1-2GydF4y2Ba)携带一个基因陷阱结构,可以通过GUS染色显示被困基因的内源性表达模式。我们的特征GydF4y2Bascap1-2GydF4y2Ba在不同发育阶段的植物,揭示了叶片发育过程中基因表达的两个不同模式(图。GydF4y2Ba1GydF4y2Ba).在发育的早期(GC形成之前),GUS染色存在于整个出现的叶原基(图。GydF4y2Ba1AGydF4y2Ba).在原始的后期发育阶段,在薄层的侧翼处的GUS染色水平最高,中蛋白区域大大降低(图。GydF4y2Ba1B.GydF4y2Ba).在成熟器官(如叶和子叶)中,GUS信号主要局限于成熟的GCs(图2)。GydF4y2Ba1CGydF4y2Ba).GC-specificGydF4y2BaSCAP1GydF4y2Ba表达非常晕倒GydF4y2Bascap1-2GydF4y2Ba突变体与转基因的比较GydF4y2BaproSCAP1:GUS-GFPGydF4y2Ba线条(图。GydF4y2Ba1F.GydF4y2Ba) (见下文)。GydF4y2Ba
SCAP1GydF4y2Ba出现叶片的表达模式。(GydF4y2BaA.GydF4y2Ba-GydF4y2BaCGydF4y2Ba)GUS染色GydF4y2Bascap1-2GydF4y2Ba线和,(GydF4y2BaDGydF4y2Ba-GydF4y2Ba我GydF4y2Ba), 一个代表GydF4y2BaproSCAP1:GUS-GFPGydF4y2Ba转基因线。从第5天开始拍摄叶片发育不同阶段的照片(GydF4y2BaA.GydF4y2Ba,GydF4y2BaDGydF4y2Ba)至7(GydF4y2BaBGydF4y2Ba,GydF4y2BaEGydF4y2Ba).(GydF4y2BaGGydF4y2Ba,GydF4y2BaHGydF4y2Ba)叶原基横切面GydF4y2BaproSCAP1:GUS-GFPGydF4y2Ba苗期第5天,(GydF4y2BaGGydF4y2Ba)和7(GydF4y2BaHGydF4y2Ba).(GydF4y2Ba我GydF4y2Ba6 . 3周龄不同成熟阶段GCs特异性GUS染色GydF4y2BaTH.GydF4y2Ba叶子。柱= 50 μm (GydF4y2BaA.GydF4y2Ba,GydF4y2BaBGydF4y2Ba,GydF4y2BaGGydF4y2Ba,GydF4y2BaHGydF4y2Ba);500μm (GydF4y2BaCGydF4y2Ba,GydF4y2BaFGydF4y2Ba);100μm (GydF4y2BaDGydF4y2Ba,GydF4y2BaEGydF4y2Ba,GydF4y2BaFGydF4y2Ba);1毫米(GydF4y2Ba我GydF4y2Ba)GydF4y2Ba
这个GydF4y2Bascap1-2GydF4y2Ba突变有GydF4y2Ba格斯GydF4y2Ba报告基因的反义定位GydF4y2BaSCAP1GydF4y2Ba打开读取帧(附加文件GydF4y2Ba1GydF4y2Ba).为了验证在GydF4y2Bascap1-2GydF4y2Ba等位基因反映了内源性GydF4y2BaSCAP1GydF4y2Ba启动子活动我们融合了2977个基对基因组区域的上游GydF4y2BaSCAP1GydF4y2Ba编码序列GydF4y2Ba格斯GydF4y2Ba和GydF4y2Ba绿色荧光蛋白GydF4y2Ba和生成的独立GydF4y2Ba拟南芥GydF4y2Ba稳定的转化体。这些转基因植物(GydF4y2BaproSCAP1:GUS-GFPGydF4y2Ba)的幼叶原基中GUS酶活性与叶原基中GUS酶活性相似GydF4y2Bascap1-2GydF4y2Ba植物(图。GydF4y2Ba1 d, e, fGydF4y2Ba).在发育后期,GUS基因在植株中积累的规律GydF4y2BaproSCAP1:GUS-GFPGydF4y2Ba线与在GydF4y2Bascap1-2GydF4y2Ba。随着叶原基的扩展,中脉区GUS染色逐渐消失(图2)。GydF4y2Ba1EGydF4y2Ba).在幼叶原基中,GydF4y2BaSCAP1GydF4y2Ba启动子活性在叶片的近端区域表现出更强的活性。通过分析GUS染色的横截面证实了这一观察结果GydF4y2BaproSCAP1:GUS-GFPGydF4y2Ba在原基分化的早期阶段GydF4y2BaSCAP1GydF4y2Ba启动子在叶原基的叶肉和表皮中均有活性(图。GydF4y2Ba1GGydF4y2Ba).随后我们观察到GUS累积的尖锐型梯度梯度,叶原始近端部分中的信号增加(图。GydF4y2Ba1小时GydF4y2Ba).GydF4y2BaSCAP1GydF4y2Ba最初在GCs中表达强烈,但随着GCs的成熟,在远端到近端梯度中表达趋于下降(图)。GydF4y2Ba1I.GydF4y2Ba).这些数据揭示了一种之前未披露的模式GydF4y2BaSCAP1GydF4y2Ba早期叶发育中的表达,这可能表明了额外的作用GydF4y2BaSCAP1GydF4y2Ba以及它在GC成熟和功能中的已知功能。GydF4y2Ba
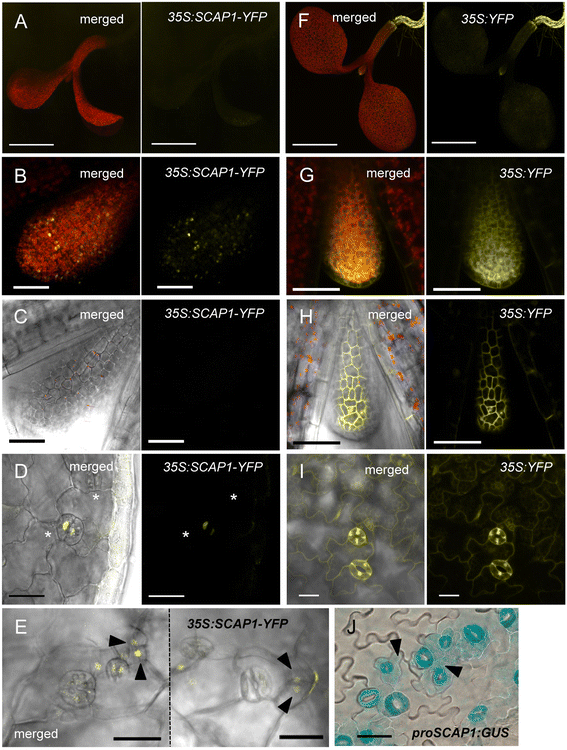
为了获得SCAP1蛋白质细胞定位的见解,我们产生了拟南芥过表达的线GydF4y2BaSCAP1GydF4y2Ba(GydF4y2BaNGydF4y2Ba= 15)。这个GydF4y2BaSCAP1GydF4y2Ba编码序列融合到GydF4y2Ba黄色荧光蛋白GydF4y2Ba(GydF4y2BaYFPGydF4y2Ba)基因在组成启动子的控制下GydF4y2BaCaMV35SGydF4y2Ba(GydF4y2Bapro35S SCAP1-YFP):GydF4y2Ba。我们预计这个结构会在所有植物组织中产生异位表达SCAP1,然而我们只能在植物组织的一个子集中观察到YFP。SCAP1-YFP蛋白来源的信号在根中缺失(图。GydF4y2Ba2AGydF4y2Ba),而过表达可溶性YFP的对照植物在所有组织中均显示异位信号(图。GydF4y2Ba2外:我GydF4y2Ba).我们观察到SCAP1-YFP在幼叶原基的叶肉细胞核中积累(图。GydF4y2Ba2B.GydF4y2Ba),虽然在相邻表皮细胞中观察到任何SCAP1-YFP信号(图。GydF4y2Ba2CGydF4y2Ba).GydF4y2Ba
SCAP1蛋白在植物组织中有差异积累。(GydF4y2BaA.GydF4y2Ba-GydF4y2BaEGydF4y2Ba共焦图像GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba(GydF4y2Ba35S:SCAP1-YFPGydF4y2Ba)以及(GydF4y2BaFGydF4y2Ba-GydF4y2Ba我GydF4y2Ba),GydF4y2Bapro35S: YFPGydF4y2Ba(GydF4y2Ba35 s: YFPGydF4y2Ba)不同阶段的植物。(GydF4y2BaA.GydF4y2Ba,GydF4y2BaFGydF4y2Ba)整个幼苗。(GydF4y2BaBGydF4y2Ba,GydF4y2BaGGydF4y2Ba)第一叶原序(5 das)。(GydF4y2BaCGydF4y2Ba,GydF4y2BaHGydF4y2Ba)第一叶原叶(5 das)的表皮。(GydF4y2BaDGydF4y2Ba,GydF4y2Ba我GydF4y2Ba子叶的GCs (7das)。(GydF4y2BaEGydF4y2Ba)子叶(7 das)的表皮。星号标记表皮细胞,箭头标记分隔细胞。图片GydF4y2BaA.GydF4y2Ba,GydF4y2BaBGydF4y2Ba,GydF4y2BaFGydF4y2Ba和GydF4y2BaGGydF4y2Ba是在整个样品厚度上得到的所有z堆的总和。图片GydF4y2BaCGydF4y2Ba-GydF4y2BaEGydF4y2Ba和GydF4y2BaHGydF4y2Ba-GydF4y2Ba我GydF4y2Ba是对应于表皮的z堆的总和。条= 1毫米(GydF4y2BaA.GydF4y2Ba,GydF4y2BaFGydF4y2Ba);50μm(GydF4y2BaBGydF4y2Ba-GydF4y2BaEGydF4y2Ba,GydF4y2BaGGydF4y2Ba-GydF4y2Ba我GydF4y2Ba).SCAP1-YFP/YFP蛋白信号为黄色,自身荧光(叶绿素)为红色。(GydF4y2BaJGydF4y2Bagus的子叶表皮染色GydF4y2BaproSCAP1:GUS-GFPGydF4y2Ba植物(7 das)。棒= 100 μmGydF4y2Ba
在以后的阶段,我们观察到GCS中的SCAP1-YFP,这与已知功能一致GydF4y2BaSCAP1GydF4y2Ba在GC成熟中(图。GydF4y2Ba2DGydF4y2Ba).表皮层的详细分析GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba子叶揭示了邻近分化的GCs附近的(或最近分开的)表皮细胞的低水平的核粘液1-YFP蛋白(图。GydF4y2Ba2eGydF4y2Ba).总之,SCAP1-YFP的表达似乎仅限于早期叶原叶中的子表皮层,并且仅在叶片发育的后期阶段,表达在成熟的GC和相邻的细胞中可见。在以后阶段的SCAP1蛋白质积累的模式类似于域名GydF4y2BaSCAP1GydF4y2Ba促进剂如Gus染色所示的转录转录活性GydF4y2BaproSCAP1:GUS-GFPGydF4y2Ba植物(图。GydF4y2Ba2J.GydF4y2Ba).我们的结论是SCAP1蛋白受到强烈的转录后调控,并且SCAP1蛋白的积累位点仅与部分的模式重叠GydF4y2BaSCAP1GydF4y2Ba基因表达。GydF4y2Ba
SCAP1GydF4y2Ba调节GC开发GydF4y2Ba
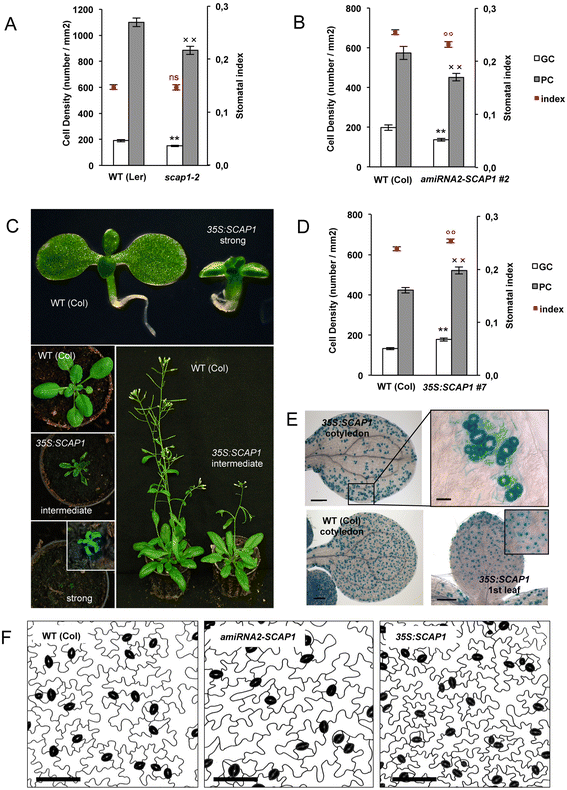
这个GydF4y2Bascap1-2GydF4y2Ba等位基因可能是无效的,因为它不能产生任何可检测到的全长GydF4y2BaSCAP1GydF4y2Ba成绩单(附加文件GydF4y2Ba1GydF4y2Ba).进一步调查角色GydF4y2BaSCAP1GydF4y2Ba在气孔发育的过程中,我们比较了黄杨木成虫叶片的gc数量GydF4y2Bascap1-2GydF4y2Ba与野生型(生态型Landsberg,LGydF4y2Ba呃GydF4y2Ba).在GydF4y2Bascap1-2GydF4y2Ba气孔密度降低(图。GydF4y2Ba3GydF4y2Ba),但这并没有反映在气孔指数的下降GydF4y2Bascap1-2GydF4y2Ba与野生型相比,植物的路面细胞也显著减少(图。GydF4y2Ba3GydF4y2Ba额外的文件GydF4y2Ba2.GydF4y2Ba).为了证实这些观察结果,我们生成了两种独立的人工microRNA (amiRNA1和2),它们都是专门靶向的GydF4y2BaSCAP1GydF4y2Ba野生型(生态型哥伦比亚,Col)。我们隔离了16到14条独立的T1线GydF4y2BaamiRNA1-SCAP1GydF4y2Ba和GydF4y2BaamiRNA2-SCAP1GydF4y2Ba,并证实T2系降低了GydF4y2BaSCAP1GydF4y2Ba与野生类型相比的副本(附加文件GydF4y2Ba2.GydF4y2Ba).Downregulation的GydF4y2BaSCAP1GydF4y2Ba对植物整体形态没有产生明显的表型效应,类似于GydF4y2Bascap1-2GydF4y2Ba植物。进一步观察发现,叶片在T2处分离GydF4y2Ba氨基核糖核酸-1GydF4y2Ba与野生类型相比,独立行分解产生的gc要少得多(附加文件GydF4y2Ba2.GydF4y2Ba).在纯合子T3GydF4y2Ba氨基核糖核酸-1GydF4y2Ba在细胞系中,我们观察到细胞密度普遍降低,与在细胞系中观察到的结果类似GydF4y2Bascap1-2GydF4y2Ba,并且还原气孔指数。占据这些结果表明GydF4y2BaSCAP1GydF4y2Ba除了在细胞分裂中发挥作用外,还在GCs规范中发挥作用(图。GydF4y2Ba3b,fGydF4y2Ba).GydF4y2Ba
SCAP1GydF4y2Ba控制GCS开发。(GydF4y2BaA.GydF4y2Ba野生型(L .)保卫细胞(GC)、铺装细胞(PC)数量和气孔指数GydF4y2Ba呃GydF4y2Ba),GydF4y2Bascap1-2GydF4y2Ba突变体和,(GydF4y2BaBGydF4y2Ba)、野生型(Col)和T3纯合子GydF4y2BaPRO35S:Amirna2-SCAP1GydF4y2Ba(GydF4y2BaamiRNA2-SCAP1GydF4y2Ba, # 2行)。(GydF4y2BaCGydF4y2Ba)观察到的形态改变GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba(GydF4y2Ba35s:scap1.GydF4y2Ba),不同发育阶段(幼苗、莲座、抽薹植株)。(GydF4y2BaDGydF4y2Ba)野生型(Col)和野生型(Col)和T3纯合的护栏(GC),路面细胞(PC)和气孔指数的数量GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba(GydF4y2Ba35s:scap1.GydF4y2Ba)中间行(第7行)。(GydF4y2BaEGydF4y2Ba)GUS染色的双重GydF4y2BaproAtMYB60:格斯pro35S: SCAP1-YFP (35 s: SCAP1)GydF4y2Ba或单GydF4y2BaproAtMYB60:格斯GydF4y2Ba(wt col)嗜血线。所示是成熟的子叶(INSET,代表子叶面积的较高放大率)和10天老幼苗的第一叶。Bar =200μm(插入,25μm)。(GydF4y2BaFGydF4y2Ba)代表性远轴表皮表型的6GydF4y2BaTH.GydF4y2Ba野生型(Col)的膨胀叶,GydF4y2BaPRO35S:Amirna2-SCAP1GydF4y2Ba(GydF4y2BaamiRNA2-SCAP1,GydF4y2Ba第2行)和GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba(GydF4y2Ba35s:scap1,GydF4y2Ba第7行)突变体。保卫细胞是假的黑色。条=50μm。在GydF4y2BaA.GydF4y2Ba,GydF4y2BaBGydF4y2Ba,GydF4y2BaDGydF4y2Ba,(**),(GydF4y2BaXXGydF4y2Ba)和(°) = P < 0.01(双尾T Student检验),分别比较野生型和突变型等位基因的GC、PC细胞密度或气孔指数。ns = 不重要。错误条 = 标准误差GydF4y2Ba
确定是否过表达GydF4y2BaSCAP1GydF4y2Ba足以改变GC开发,我们分析了上述的表型GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba线条。我们观察到具有改变的表型的T1个体,从强度到温和的严重性范围(图。GydF4y2Ba3 cGydF4y2Ba).植物被归类为强过表达的GydF4y2BaSCAP1GydF4y2Ba(60%)表现出大量发育缺陷,包括萌发减少、生长缓慢和发育不良、叶片向上卷曲和不育。第二类表型(40%)表现出较不严重的表型,在苗期表现出比野生型生长减少。在中等表型的转基因株系中,缺陷似乎在发育后期恢复,因此这些株系最终在大小和叶面积上与野生型相当。鉴于强的表型异常GydF4y2BaSCAP1-YFPGydF4y2Ba过表达系,我们对中间系进行了分析,中间系在植物形态上更接近野生型。中等水平的线GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba与野生型相比,真叶的GCs和pc数量均增加,气孔指数总体上也增加(图2)。GydF4y2Ba3 d, fGydF4y2Ba和额外的文件GydF4y2Ba2.GydF4y2Ba).的表皮表型GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba植物的特征更详细的跨越到一个GC-specific报告线携带GydF4y2BaproAtMYB60:格斯GydF4y2Ba[GydF4y2Ba29.GydF4y2Ba使我们能够检测更细微的GC模式缺陷。子叶的GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba气孔间距发生了显著变化,表现为子叶边缘,尤其是近轴面上存在大量GCs簇(图。GydF4y2Ba3 eGydF4y2Ba).有趣的是,真实的叶子中没有可检测到GCS的簇GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba植物。此外,基于GydF4y2Ba格斯GydF4y2Ba检测,过度表达GydF4y2BaSCAP1GydF4y2Ba没有赋予每种细胞类型的防护细胞同一性,也不能在子叶蛋白蛋白蛋白蛋白蛋白细胞中诱导气孔产生(图。GydF4y2Ba3 eGydF4y2Ba).因此,GydF4y2BaSCAP1GydF4y2Ba至少在子叶中,也在决定气相色谱间隔方面起着重要作用。GydF4y2Ba
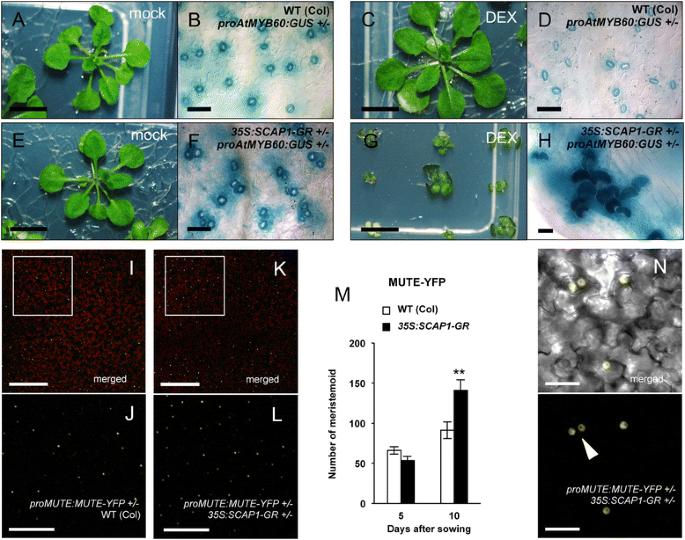
确认这些观察结果我们产生了第二个功能的等位基因GydF4y2BaSCAP1GydF4y2Ba其中构成表达的GydF4y2BaSCAP1GydF4y2Ba融合到了GydF4y2Ba糖皮质激素受体GydF4y2Ba(GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba)[GydF4y2Ba30.GydF4y2Ba]。在这个诱导系统中,融合蛋白通常定位于细胞质,但在应用地塞米松(DEX)后,可以穿梭到细胞核,以触发快速依赖scap1的转录激活[GydF4y2Ba30.GydF4y2Ba]。在诱导之前,植物GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba从野生型中难以区分(图。GydF4y2Ba4 eGydF4y2Ba)尽管积累了高水平GydF4y2BaSCAP1-GRGydF4y2Ba成绩单(附加文件GydF4y2Ba3.GydF4y2Ba).GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba种子在添加DEX的培养基上不发芽,表明高浓度的DEXGydF4y2BaSCAP1GydF4y2Ba可以抑制发芽。因此,我们成长GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba在添加DEX或模拟溶液的培养基上播种后5天,在无DEX培养基上播种种子,并转移幼苗。转移到DEX后20天GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba植物产生了类似的形态改变,以前观察到GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba转基因植物(图。GydF4y2Ba4 gGydF4y2Ba).相比之下,DEX处理对对照植株的形态没有显著影响(图2)。GydF4y2Ba4摄氏度GydF4y2Ba).GydF4y2Ba
SCAP1GydF4y2Ba影响气孔间距并诱导融资生产。(GydF4y2BaA.GydF4y2Ba-GydF4y2BaDGydF4y2Ba) 4周龄野生型(Col)或(GydF4y2BaEGydF4y2Ba-GydF4y2BaHGydF4y2Ba)GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba(GydF4y2Ba35 s: SCAP1-GRGydF4y2Ba)在德克斯的存在下种植的植物(GydF4y2BaCGydF4y2Ba-GydF4y2BaDGydF4y2Ba和GydF4y2BaGGydF4y2Ba-GydF4y2BaHGydF4y2Ba)或模拟(GydF4y2BaA.GydF4y2Ba-GydF4y2BaBGydF4y2Ba和GydF4y2BaEGydF4y2Ba-GydF4y2BaFGydF4y2Ba).(GydF4y2BaFGydF4y2Ba,GydF4y2BaHGydF4y2Ba)GUS染色的双重GydF4y2BaproAtMYB60:格斯pro35S: SCAP1-GRGydF4y2Ba或(b,d)单身GydF4y2BaproAtMYB60:格斯GydF4y2Ba半合的植物。(GydF4y2Ba我GydF4y2Ba-GydF4y2BaJGydF4y2Ba)半合子中MUTE-YFP融合蛋白的共聚焦图像GydF4y2BaproMUTE: MUTE-YFPGydF4y2Ba或(GydF4y2BaKGydF4y2Ba-GydF4y2BaLGydF4y2Ba和GydF4y2BaNGydF4y2Ba)双半合GydF4y2BaproMUTE: MUTE-YFP pro35S: SCAP1-GRGydF4y2Ba转基因植物。插入(GydF4y2BaJGydF4y2Ba和GydF4y2BaLGydF4y2Ba)的放大倍数比(GydF4y2Ba我GydF4y2Ba)及(GydF4y2BaKGydF4y2Ba),分别。白色箭头在(GydF4y2BaNGydF4y2Ba)表示两个相邻的分生组织。(GydF4y2BaMGydF4y2Ba)在半合子中积累MUTE-YFP蛋白的表皮细胞数量GydF4y2BaproMUTE: MUTE-YFPGydF4y2Ba或双半合GydF4y2BaproMUTE: MUTE-YFP pro35S: SCAP1-GRGydF4y2Ba不同发育阶段(5和10 das)的植物。显示是在10个独立1的表皮细胞中表达静音-YFP的平均数量。GydF4y2Ba英石GydF4y2Ba叶子原基。第5阶段的数目指整个原基,第10阶段的数目指562毫米的面积GydF4y2Ba2.GydF4y2Ba。误差柱=标准误差。** = P < 0.01两尾T学生测试。条= 1毫米(GydF4y2BaA.GydF4y2Ba,GydF4y2BaCGydF4y2Ba,GydF4y2BaEGydF4y2Ba,GydF4y2BaGGydF4y2Ba,);200μm(GydF4y2Ba我GydF4y2Ba,GydF4y2BaLGydF4y2Ba);100μm (GydF4y2BaJGydF4y2Ba,GydF4y2BaMGydF4y2Ba);50μm(GydF4y2BaBGydF4y2Ba,GydF4y2BaDGydF4y2Ba,GydF4y2BaFGydF4y2Ba);20μm(GydF4y2BaHGydF4y2Ba,GydF4y2BaoGydF4y2Ba)GydF4y2Ba
为进一步研究其表皮表型GydF4y2BaSCAP1-GRGydF4y2Ba我们分析了GUS在植物中的分布模式GydF4y2Bapro35S: SCAP1-GR proAtMYB60:格斯GydF4y2Ba双半合子的植物。未经处理的显微分析GydF4y2Bapro35S: SCAP1-GR proAtMYB60:格斯GydF4y2Ba植物揭示了子叶和叶中的GCS簇,尽管这些簇通常由少量GCS制成(图。GydF4y2Ba4 fGydF4y2Ba和额外的文件GydF4y2Ba3.GydF4y2Ba).同时,GydF4y2Bapro35S: SCAP1-GR proAtMYB60:格斯GydF4y2Ba植物经常表现出不配对的GCs以及与GCs相邻的分生组织样细胞簇(图。GydF4y2Ba4 fGydF4y2Ba和额外的文件GydF4y2Ba3.GydF4y2Ba).敏捷的待遇GydF4y2Bapro35S: SCAP1-GR proAtMYB60:格斯GydF4y2Ba当我们观察到真叶中产生过多的gc时,与未处理的对照相比,在气孔模式上显示出更强的表型。GydF4y2Ba4 hGydF4y2Ba).同样在这种情况下,GUS检测显示簇通常由未配对的GCS制成(图。GydF4y2Ba4 hGydF4y2Ba).GydF4y2Ba
以确定是否改变的气孔模式GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba可以取决于进入气孔谱系的细胞数量增加,我们产生双重嗜血GydF4y2BaproMUTE: MUTE-YFP pro35S: SCAP1-GRGydF4y2Ba这些植物使我们能够看到分生组织细胞。即使在没有DEX的情况下,原基发育的后期也是如此GydF4y2Bapro35S: SCAP1-GR proMUTE: MUTE-YFPGydF4y2Ba与对照嗜血尼相比,植物显示出增加数量的分泌素数GydF4y2BaproMUTE: MUTE-YFPGydF4y2Ba植物(图。GydF4y2Ba4我GydF4y2Ba到GydF4y2BaLGydF4y2Ba).对表皮的仔细检查发现GydF4y2Bapro35S: SCAP1-GR proMUTE: MUTE-YFPGydF4y2Ba融资细胞通常不遵循正确的间隔,彼此靠近(图。GydF4y2Ba4 nGydF4y2Ba).一起带着GydF4y2BaSCAP1GydF4y2Ba似乎调节气孔开发的不同方面,包括气孔数,分布和间距。GydF4y2Ba
效果GydF4y2BaSCAP1GydF4y2Ba气孔模式基因表达研究GydF4y2Ba
早期激活GydF4y2BaSCAP1GydF4y2Ba在叶丙二叶中加上其在气孔开发中的作用导致我们假设遗传相互作用GydF4y2BaSCAP1GydF4y2Ba和调节气孔图案化的基因。两个基因,GydF4y2BaSPCHGydF4y2Ba和GydF4y2BaEPF2.GydF4y2Ba早期气孔图案所需的是在叶原叶的Protodermal细胞中表达。确定的时间GydF4y2BaSCAP1GydF4y2Ba关于气孔早期图案化基因的激活我们在不同时间点的幼苗中取样了叶子的叶子,代表了不同叶片发育的不同阶段。成绩单丰富GydF4y2BaSCAP1GydF4y2Ba,GydF4y2BaSPCHGydF4y2Ba和GydF4y2BaEPF2.GydF4y2Ba播后7 d达到高峰,随后3 d下降。GydF4y2Ba5GydF4y2Ba).在播种后大约12天,GydF4y2BaSCAP1GydF4y2Ba表达水平重新激活,可能与成熟叶片中GC的形成有关(图。GydF4y2Ba5GydF4y2Ba).测试if.GydF4y2BaSCAP1GydF4y2Ba表达式依赖于GydF4y2BaSPCHGydF4y2Ba,我们穿过GydF4y2Bascap1-2GydF4y2Ba(左GydF4y2Ba呃GydF4y2Ba) 和GydF4y2BaSPCH-4GydF4y2Ba(col)突变体获得纯合GydF4y2BaspchGydF4y2Ba携带转座子标记的突变体GydF4y2BaSCAP1GydF4y2Ba。26.GydF4y2BaspchGydF4y2Ba纯合的植物,两种显示的GUS染色,就野生类型的表达方式类似GydF4y2BaSPCHGydF4y2Ba植物。此基因型的频率降低可能是由于遗传键合GydF4y2BaSPCHGydF4y2Ba和GydF4y2BaSCAP1GydF4y2Ba在5号染色体上GydF4y2BaSPCHGydF4y2Ba因此不需要早期GydF4y2BaSCAP1GydF4y2Ba激活(图。GydF4y2Ba5 bGydF4y2Ba),这与之前的研究一致GydF4y2BaSCAP1GydF4y2Ba并不是SPCH的高可信度目标[GydF4y2Ba21.GydF4y2Ba]。GydF4y2Ba
的角色GydF4y2BaSCAP1GydF4y2Ba气孔基因转录积累研究。(GydF4y2BaA.GydF4y2Ba)模式GydF4y2BaSCAP1GydF4y2Ba,GydF4y2BaSPCHGydF4y2Ba和GydF4y2BaEPF2.GydF4y2Ba用定量PCR方法测定了野生型(Col)幼苗播种后不同天数前2个叶片原基的转录量。值代表三个生物重复(30个叶子/副本)的平均值。(GydF4y2BaBGydF4y2Ba)GUS染色GydF4y2Bascap1-2GydF4y2Ba野生型或GydF4y2BaSPCH-4GydF4y2Ba突变背景在5天老幼苗。酒吧=100μm。(GydF4y2BaCGydF4y2Ba)模式GydF4y2BaSCAP1, SPCHGydF4y2Ba,GydF4y2BaEPF2、静音GydF4y2Ba和GydF4y2Ba法玛GydF4y2Ba通过定量PCR在手动解剖第7天野生型(COL)的前两叶二叶中测定的转录物累积,GydF4y2BaPRO35S:Amirna2-SCAP1GydF4y2Ba(GydF4y2BaamiRNA2-SCAP1GydF4y2Ba),GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba(GydF4y2Ba35s:scap1.GydF4y2Ba) 植物。值代表三个生物重复(30个叶子/副本)的平均值。(GydF4y2BaDGydF4y2Ba)模式GydF4y2BaAtMYB60, SPCHGydF4y2Ba,GydF4y2BaEPF2、静音GydF4y2Ba和GydF4y2Ba法玛GydF4y2Ba用定量PCR检测10天龄的转录物积累GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba(GydF4y2Ba35 s: SCAP1-GRGydF4y2Ba)通过用DEX(或模拟)和整个幼苗处理的植物在处理后八小时被取样。值代表两个生物重复的平均值。在所有定量PCR中GydF4y2Ba施GydF4y2Ba(GydF4y2BaACT2.GydF4y2Ba)用于标准化。在GydF4y2BaCGydF4y2Ba和GydF4y2BaDGydF4y2Ba** = P < 0.01 and * = P < 0.05 and two tails T Student test。误差柱=标准差GydF4y2Ba
我们下次测量以不同剂量的植物中早期气孔图案基因的测量成绩单积累GydF4y2BaSCAP1GydF4y2Ba.成绩单水平GydF4y2BaSPCHGydF4y2Ba,GydF4y2BaEPF2.GydF4y2Ba,GydF4y2Ba沉默的GydF4y2Ba和GydF4y2Ba法玛GydF4y2Ba在7个DAS分析时GydF4y2BaSCAP1GydF4y2Ba,GydF4y2BaSPCHGydF4y2Ba和GydF4y2BaEPF2.GydF4y2Ba在野生型中表达达到峰值(图。GydF4y2Ba5GydF4y2Ba).在功能损失中GydF4y2Bascap1GydF4y2Ba与野生型相比,突变型植物的任何基因转录水平都没有显著变化。GydF4y2Ba5度GydF4y2Ba和额外的文件GydF4y2Ba4 gydF4y2Ba).如果GydF4y2BaSPCHGydF4y2Ba和GydF4y2BaSCAP1GydF4y2Ba基因相互作用,我们可以预测GC产量的增加GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba植物将反映在气孔生产的阳性调节剂的增加和/或活性中,或者对负调节剂的阳性调节。确定是否是我们分析了转录水平的情况GydF4y2BaSPCHGydF4y2Ba,GydF4y2BaEPF2.GydF4y2Ba,GydF4y2Ba沉默的GydF4y2Ba和GydF4y2Ba法玛GydF4y2Ba在GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba过度表达线。我们的分析证实,该转基因赋予了100倍的增加约100倍GydF4y2BaSCAP1GydF4y2Ba与野生型相比,转录物积累(图。GydF4y2Ba5度GydF4y2Ba).7 DAS的分析显示了或者转录物水平没有显着差异GydF4y2Ba沉默的GydF4y2Ba或者GydF4y2Ba法玛GydF4y2Ba与野生型相比(图。GydF4y2Ba5度GydF4y2Ba).但是,我们注意到了下调GydF4y2BaEPF2.GydF4y2Ba并且,略微,GydF4y2BaSPCHGydF4y2Ba与野生型相比(图。GydF4y2Ba5度GydF4y2Ba).GydF4y2Ba
确认这些观察结果,我们分析了气孔图案化基因GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba短DEX诱导后的植株。我们首先检测了SCAP1:GR蛋白激活已知靶基因表达的能力GydF4y2BaAtMYB60GydF4y2Ba[GydF4y2Ba28.GydF4y2Ba]。的确,GydF4y2Bascap1GydF4y2Ba功能丧失突变体表现出降低的基因表达水平GydF4y2BaAtMYB60GydF4y2Ba累积与野生类型相比(附加文件GydF4y2Ba3.GydF4y2Ba).相反,与野生型植物相比,GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba植物表现出对基因的调控GydF4y2BaAtMYB60GydF4y2Ba右美托咪定处理后(图GydF4y2Ba5 dGydF4y2Ba和额外的文件GydF4y2Ba3.GydF4y2Ba).这些数据表明GydF4y2BaSCAP1-GRGydF4y2Ba蛋白质在转录调控的背景下保持其生化功能。GydF4y2Ba
在类似的条件下,诱导8小时后,我们观察到负性气孔调节因子的强烈下调GydF4y2BaEPF2.GydF4y2Ba(无花果。GydF4y2Ba5 dGydF4y2Ba和额外的文件GydF4y2Ba4 gydF4y2Ba).这样的GydF4y2BaEPF2.GydF4y2Ba与模拟处理的植物相比,DEX处理的植物在4小时后可检测到下调,并在整个实验过程中保持不变(附加文件GydF4y2Ba4 gydF4y2Ba).除了GydF4y2BaEPF2.GydF4y2Ba我们还观察到一般的下调GydF4y2BaSPCHGydF4y2Ba转录水平及其直接靶基因GydF4y2Ba沉默的GydF4y2Ba,但不GydF4y2Ba法玛GydF4y2Ba(无花果。GydF4y2Ba5 dGydF4y2Ba).作为对照,DEX处理对野生型植物的气孔模式基因的改变没有影响GydF4y2Ba4 gydF4y2Ba).GydF4y2BaSCAP1GydF4y2Ba因此可以作为一种正的和负的转录调节因子。然而,由于这些实验是在整个幼苗上进行的,它们可能不会完全陶醉于GydF4y2BaSCAP1GydF4y2Ba在叶发育的早期阶段。GydF4y2Ba
SCAP1GydF4y2Ba影响SPCH蛋白积累GydF4y2Ba
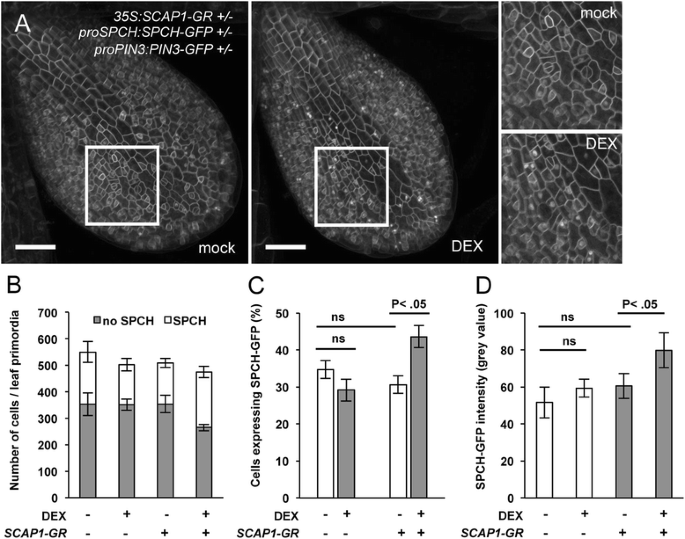
本构表达式GydF4y2BaSCAP1GydF4y2Ba导致几种发育异常,这可以间接改变GC开发。为了避免这种潜在的问题,我们使用DEX快速激活后分析了SCAP1的效果GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba我们通过显微镜共聚焦分析研究了SPCH-GFP融合蛋白在第一片叶子原基(5 das)中的积累模式,通过观察绿色荧光蛋白(GFP)在细胞内的核荧光GydF4y2BaproSPCH: SPCH-GFPGydF4y2Ba线。在5das时,我们没有检测到分生组织数目的变化,这表明SCAP1-GR的表达在这个特定阶段尚未产生可检测的效应(图)。GydF4y2Ba4米GydF4y2Ba).我们推断通过提供一个短脉冲GydF4y2BaSCAP1GydF4y2Ba(通过DEX的应用)我们可以影响细胞进入气孔谱系的能力(通过表达SPCH的细胞数量估计)。我们生成的半合GydF4y2BaproSPCH: SPCH-GFP proPIN3: PIN3-GFP pro35S: SCAP1-GRGydF4y2Ba或嗜血GydF4y2BaproSPCH: SPCH-GFP proPIN3: PIN3-GFPGydF4y2Ba在野生类型的col背景中。PIN3-GFP融合蛋白用作质膜标记物,使我们识别单个表皮细胞。控制双重嗜血GydF4y2BaproSPCH: SPCH-GFP proPIN3: PIN3-GFPGydF4y2Ba植物在DEX处理后的SPCH-GFP的数量中没有发现显着差异(图。GydF4y2Ba6 bGydF4y2Ba和GydF4y2BaCGydF4y2Ba).此外,DEX处理并没有改变SPCH-GFP核荧光的平均强度,这排除了DEX对SPCH-GFP蛋白积累的一般影响(图)。GydF4y2Ba6 dGydF4y2Ba).GydF4y2BaproSPCH: SPCH-GFP proPIN3: PIN3-GFP pro35S: SCAP1-GRGydF4y2Ba嗜血线在该发育阶段在SPCH-GFP积累中显示出明显的缺陷(图。GydF4y2Ba6GydF4y2Ba到GydF4y2BaDGydF4y2Ba).地塞米松治疗6小时后,GydF4y2BaproSPCH: SPCH-GFP proPIN3: PIN3-GFP pro35S: SCAP1-GRGydF4y2Ba植物表达SPCH-GFP蛋白的细胞核比例显著增加(图。GydF4y2Ba6A,B.GydF4y2Ba和GydF4y2BaCGydF4y2Ba).此外,这伴随着平均核GFP荧光强度的一般增加(GydF4y2BaNGydF4y2Ba> 50个核/ 1GydF4y2Ba英石GydF4y2Ba每个基因型/处理组合的叶原基)。GydF4y2Ba6A,DGydF4y2Ba).最有可能增加核GFP信号的增加,因为既不单独的DEX治疗或SCAP1-GR都没有引起核GFP累积的变化(例如,由于来自膜标记PIN3或SPCH的GFP脱离的结果)。因此,Protodermal细胞中的SpCh稳定增加可能导致口气涂抹的改变GydF4y2BaSCAP1GydF4y2Ba在表达植物。GydF4y2Ba
SCAP1GydF4y2Ba促进SPCH蛋白积累。(GydF4y2BaA.GydF4y2Ba)1的代表图片GydF4y2Ba英石GydF4y2Ba模拟或Dex治疗的三重嗜血症的叶子原基GydF4y2BaproPIN3:PIN3-GFP proSPCH:SPCH-GFP pro35S:SCAP1-GRGydF4y2Ba转基因植物。插图显示部分原基的高倍放大。PIN3-GFP融合蛋白标记表皮细胞的质膜。SPCH-GFP融合蛋白定位于表皮细胞核。比例尺= 500 μm。(GydF4y2BaBGydF4y2Ba和GydF4y2BaCGydF4y2Ba)模拟(-)或DEX(+)处理植物叶片原基中SPCH-GFP积累核的定量分析。双半合GydF4y2BaPROP3:PIN3-GFP PROSPCH:SPCH-GFPGydF4y2Ba两组均作为对照(−) 和三重半合子相比GydF4y2BaproPIN3:PIN3-GFP proSPCH:SPCH-GFP pro35S:SCAP1-GRGydF4y2Ba(GydF4y2BaSCAP1-GRGydF4y2Ba,+)。条表示形成1的总表皮细胞的数量GydF4y2Ba英石GydF4y2Ba在5 das成像的叶原始。白色条表示含有SpCh-GFP的核数。灰色棒是没有可检测的SPCH-GFP的核。n = 6-8个独立的第一叶原基。该实验进行了两次以相似的结果进行。(GydF4y2BaCGydF4y2Ba)与(GydF4y2BaBGydF4y2Ba),但显示为表达SPCH-GFP蛋白的细胞核占组成叶原基细胞总数的百分比(GydF4y2BaDGydF4y2Ba)定量核SpCh-GFP蛋白的平均荧光强度在指示的背景/治疗中。从分析到大约的数据。50核表达6-8个独立叶片原基中的SPCH-GFP。在 (GydF4y2BaCGydF4y2Ba)及(GydF4y2BaDGydF4y2Ba) P值分别表示SPCH-GFP核数或SPCH-GFP荧光强度有统计学意义,采用单因素方差分析计算。NS =不显著。误差柱=标准误差GydF4y2Ba
讨论GydF4y2Ba
之前GydF4y2BaSCAP1GydF4y2Ba在发育和完全成熟的气孔中调控GC的形态和活性[GydF4y2Ba28.GydF4y2Ba]。在这里,我们报告了对Spatio-Temportal控制的深入分析GydF4y2BaSCAP1GydF4y2Ba表达叶片发展。我们的结果表明早期激活GydF4y2BaSCAP1GydF4y2Ba在叶原基中的表达与控制气孔细胞系的基因表达一致,因此在GC分化之前[GydF4y2Ba6.GydF4y2Ba,GydF4y2Ba7.GydF4y2Ba,GydF4y2Ba10.GydF4y2Ba,GydF4y2Ba31.GydF4y2Ba].这种模式GydF4y2BaSCAP1GydF4y2Ba基因表达维持在GydF4y2BaspchGydF4y2Ba突变体证明GydF4y2BaSCAP1GydF4y2Ba早期表达是独立于GC谱系规范的。除了转录规范,GydF4y2BaSCAP1GydF4y2Ba正如组成型表达的那样受到转录后的水平GydF4y2BaSCAP1GydF4y2Ba-GydF4y2BaYFPGydF4y2Ba融合并没有在所有的植物组织中积累,尽管高水平的表达。在叶原基中GydF4y2BaSCAP1GydF4y2Ba启动子在表皮和叶肉中都有活性,SCAP1-YFP蛋白主要存在于叶肉和GCs中。这一观察结果可能表明SCAP1在GC发育中的作用是间接的(例如,促进信号从叶肉细胞传递到表皮)[GydF4y2Ba32.GydF4y2Ba–GydF4y2Ba35.GydF4y2Ba[表皮中SCAP1的活性由于快速蛋白质翻过来而受到紧密调节。因此,SCAP1蛋白可以在一些细胞类型或某些阶段中积聚在表皮中。未来的实验,涉及使用组织/细胞特异性启动子来驱动GydF4y2BaSCAP1GydF4y2Ba表达可能有助于阐明SCAP1稳定的精确细胞/组织特异性模式,并为其作用模式提供线索GydF4y2BaSCAP1GydF4y2Ba在gc patterning中。GydF4y2Ba
我们的研究产生了一个问题,SCAP1在气孔模式形成中的作用是直接的还是间接的。例如,CO的变化GydF4y2Ba2.GydF4y2Ba一个叶片感知到的GC会影响后续叶片GC的模式,这意味着存在一个根据环境条件优化GC数量和模式的信号网络[GydF4y2Ba36.GydF4y2Ba–GydF4y2Ba38.GydF4y2Ba].自从GydF4y2Bascap1GydF4y2Ba突变体在GC功能中受到损害,可以假设气孔活动的这种改变可能影响全球GC发展。虽然我们不能排除这种可能性,但我们也表明了这一点GydF4y2BaSCAP1GydF4y2Ba过度抑制植物在胚胎组织如子叶(我们观察到GCS簇)中具有GC改变。GydF4y2BaSCAP1-GRGydF4y2Ba植物真叶的气孔细胞密度也增加,这表明SCAP1在气孔模式形成中起着直接作用。进一步,详细分析GydF4y2BaSCAP1-GRGydF4y2Ba植物揭示了GydF4y2BaSCAP1GydF4y2Ba在促进GCS生产并在气孔细胞谱图规范的早期阶段引导夹石间距(图。GydF4y2Ba4我GydF4y2Ba到GydF4y2BaNGydF4y2Ba).这些观察表明了……的作用GydF4y2BaSCAP1GydF4y2Ba在GC模式中,它与GC成熟的一般功能无关GydF4y2BaSCAP1GydF4y2Ba幼叶原基中的转录本与基因的早期作用一致GydF4y2BaSCAP1GydF4y2Ba控制GC开发。GydF4y2BaSCAP1GydF4y2Ba在叶片发育后期的GCs规范中也可以发挥额外的作用,例如通过控制卫星分生组织细胞,因为GydF4y2BaSCAP1GydF4y2Ba可以在划分(或最近分割的)表皮细胞附近的较旧组织中的分化GCs附近的表皮细胞来瞬时检测表达(图。GydF4y2Ba2eGydF4y2Ba).GydF4y2Ba
整体细胞密度增加GydF4y2BaSCAP1GydF4y2Ba过度表达植物让人想起GydF4y2BaSPCHGydF4y2Ba超表达或GydF4y2BaEPF2.GydF4y2Ba突变体植物(GydF4y2Ba6.GydF4y2Ba,GydF4y2Ba7.GydF4y2Ba,GydF4y2Ba9GydF4y2Ba,GydF4y2Ba15.GydF4y2Ba]。异位表达GydF4y2BaSCAP1GydF4y2Ba不能启动子叶或叶片内层的gc发育,说明GydF4y2BaSCAP1GydF4y2Ba与气孔细胞系途径的已知元素(例如:GydF4y2BaSPCHGydF4y2Ba,GydF4y2Ba沉默的GydF4y2Ba和GydF4y2Ba法玛GydF4y2Ba).因此,从这些观察中产生的一个有吸引力的假设是GydF4y2BaSCAP1GydF4y2Ba参与相同的GC开发遗传途径GydF4y2BaSPCHGydF4y2Ba及其监管机构。对此的一些证据是通过表现出表达的实验提供的GydF4y2BaSPCHGydF4y2Ba,GydF4y2BaEPF2.GydF4y2Ba和GydF4y2BaSCAP1GydF4y2Ba在开发期间暂时重叠。突变体GydF4y2Bascap1GydF4y2Ba在全球没有缺陷GydF4y2BaSPCHGydF4y2Ba或者GydF4y2BaEPF2.GydF4y2Ba基因表达水平,虽然我们还没有测试的可能性,空间分布的基因GydF4y2BaSPCHGydF4y2Ba或者GydF4y2BaEPF2.GydF4y2Ba基因可能会改变GydF4y2Bascap1GydF4y2Ba突变植物。此外,表皮表型相对较弱GydF4y2Bascap1GydF4y2Ba变种人可能被未知的东西掩盖了GydF4y2BaSCAP1类似GydF4y2Ba函数。GydF4y2Ba
SCAP1不仅影响气孔数量,而且影响气孔间距。在胚胎后期组织中发现成群的GCsGydF4y2Bapro35S: SCAP1-GRGydF4y2Ba施用地塞米松后,这一表型进一步恶化。令人惊讶的是,这种表型在GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba植物(其中该间距缺陷被限制在子叶中)。原因GydF4y2BaSCAP1-GRGydF4y2Ba核聚变比GydF4y2BaSCAP1-YFPGydF4y2Ba目前未知。由于SCAP1的积累在转录后水平受到严格控制,一种可能是GR部分保护它不被降解。GydF4y2Ba
SCAP1GydF4y2Ba过度表达造成的GydF4y2BaEPF2.GydF4y2Ba下调,可以考虑间隔缺陷。信号肽EPF2在气孔谱系中起作用于控制不对称细胞分裂,从而调节气孔密度[GydF4y2Ba7.GydF4y2Ba]。之前,在突变体的气孔密度和气孔间距方面也有类似的缺陷GydF4y2Baepf2, epf1GydF4y2Ba和GydF4y2BatmmGydF4y2Ba[GydF4y2Ba3.GydF4y2Ba,GydF4y2Ba5.GydF4y2Ba–GydF4y2Ba7.GydF4y2Ba,GydF4y2Ba31.GydF4y2Ba或在转基因植物中过度表达GydF4y2BaSPCHGydF4y2Ba,GydF4y2Ba沉默的GydF4y2Ba或者GydF4y2Ba法玛GydF4y2Ba[GydF4y2Ba8.GydF4y2Ba,GydF4y2Ba9GydF4y2Ba,GydF4y2Ba15.GydF4y2Ba]GydF4y2Ba。GydF4y2BaSPCH蛋白直接结合并积极调节几种气孔图案化基因的转录,包括GydF4y2BaEPF2.GydF4y2Ba,GydF4y2Ba沉默的GydF4y2Ba和GydF4y2BaTMMGydF4y2Ba以及自己的转录[GydF4y2Ba21.GydF4y2Ba]。我们的数据表明,一些直接的目标GydF4y2BaSPCHGydF4y2Ba是负压的GydF4y2BaSCAP1GydF4y2Ba,这意味着一场竞争GydF4y2BaSPCHGydF4y2Ba和GydF4y2BaSCAP1GydF4y2Ba在转录水平上对这些基因的调控。在这个模型中,GydF4y2BaSCAP1GydF4y2Ba由于下调调节,通过提高SPCH蛋白质积累来促进气孔产生并提高细胞部门GydF4y2BaEPF2.GydF4y2Ba成绩单。无论何种竞争是否发生在同一细胞中,和/或直接应该通过进一步的实验阐明。GydF4y2Ba
结论GydF4y2Ba
我们的结果突出了以前未被覆富的角色GydF4y2BaSCAP1GydF4y2Ba在气孔开发中。我们建议GydF4y2BaSCAP1GydF4y2Ba是精细调节植物气孔产生的遗传途径的重要组成部分GydF4y2Ba拟南芥GydF4y2Ba。该循环的一个关键控制机制可能涉及aGydF4y2BaSCAP1GydF4y2Ba的差别介导对这些GydF4y2BaEPF2.GydF4y2Ba抵消之前证明的spch介导的激活GydF4y2BaEPF2.GydF4y2Ba[GydF4y2Ba21.GydF4y2Ba]。已经提出了DOF型因子在GC成熟和功能中起重要作用,基于GC特异性基因中的DOF结合基序的富集[GydF4y2Ba26.GydF4y2Ba,GydF4y2Ba27.GydF4y2Ba]。这将是有趣的测试,这一观察是否也可以扩展到参与GC谱系规范的早期事件的基因。从这个意义上说,GydF4y2BaSCAP1GydF4y2Ba可以连接GC模式和功能。GydF4y2Ba
方法GydF4y2Ba
植物材料及生长条件GydF4y2Ba
在我们的研究中GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba生态型Columbia (Col)和LandsbergGydF4y2BaerectaGydF4y2Ba(左GydF4y2Ba呃GydF4y2Ba).种子在一个温度为20°C至23°C、相对湿度为65%、白天长时间(光照16小时/黑暗8小时)的受控环境箱中发芽和生长。光为冷白色荧光灯管(欧司朗;120至150 μE(光合有效辐射)。这个GydF4y2Bascap1-2GydF4y2Ba等位基因是一种转座子插入(GT-23689,LGydF4y2Ba呃GydF4y2Ba背景)从冷泉港基因陷阱收集获得(GydF4y2Bahttp://genetrap.cshl.edu.GydF4y2Ba).这个GydF4y2BaSPCH-4GydF4y2Ba敲除等位基因GydF4y2BaproSPCH: SPCH-GFP proPIN3: PIN3-GFPGydF4y2Ba和GydF4y2BaproMUTE: MUTE-YFPGydF4y2Ba以前详细的线条[GydF4y2Ba9GydF4y2Ba,GydF4y2Ba12.GydF4y2Ba,GydF4y2Ba39.GydF4y2Ba]。这个GydF4y2BaproAtMYB60:格斯GydF4y2Baline (Col background)已在前面描述[GydF4y2Ba29.GydF4y2Ba]。这个GydF4y2BaproSCAP1:GUS-GFPGydF4y2Ba,GydF4y2Bapro35S: amiRNA-SCAP1GydF4y2Ba,GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba和GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba在野生型Col背景中的这项研究中生成了线条,除了GydF4y2BaproSCAP1:GUS-GFPGydF4y2Ba是在L区吗GydF4y2Ba呃GydF4y2Ba背景。利用花浸法获得转基因株系[GydF4y2Ba40GydF4y2Ba]。在Murashige和Skoog(MS)培养基上选择转基因幼苗(50μg/ ml)(GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba)或巴斯塔(25μm)(GydF4y2BaproSCAP1:GUS-GFPGydF4y2Ba,GydF4y2BaPRO35S:Amirna-SCAP1,PRO35S:SCAP1-YFPGydF4y2Ba和GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba).对于每个构造,产生几根T1独立线,基于抗性基因的偏析分离单个插入转基因植物。本研究分析的独立纯合T3系是:GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba(# 4和# 7),GydF4y2Bapro35S: amiRNA-SCAP1GydF4y2Ba(amiRNA1-2, amiRNA2-2和amiRNA2-5),GydF4y2BaproSCAP1:GUS-GFPGydF4y2Ba(# 8 # 2),GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba(34 #和# 26)。GydF4y2Ba
通过喷洒(用于表达分析)或通过在含有DEX的MS培养基中浸泡幼苗(用于共聚焦和GUS实验)来通过喷洒(用于表达分析)或通过浸泡幼苗来完成糖皮质激素应用。分层GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba在用含有DEX的MS含有DEX的MS培养基中,在含有DEX的MS培养基(Sigma-Aldrich)的DEX或模拟之前,将种子萌发在MS板上5至7天。GydF4y2Ba
分子克隆GydF4y2Ba
生成GydF4y2BaproSCAP1:GUS-GFPGydF4y2Ba构造一个2977bp的区域GydF4y2BaSCAP1GydF4y2Ba用PCR方法从基因组DNA中扩增出起始密码子attB1-SCAP1和attB2-SCAP1寡聚体GydF4y2BaATTB.GydF4y2Ba适配器用于网关介导的克隆。将PCR产物克隆到GydF4y2BapDONR207GydF4y2Ba后来被转到GydF4y2BapBGWFS7GydF4y2Ba目的地矢量[GydF4y2Ba41.GydF4y2Ba根据Gateway协议(Life Technologies)中详细的指南。这个GydF4y2Bapro35S: amiRNA-SCAP1GydF4y2Ba构造经过详细的设计GydF4y2Bahttp://wmd3.weigelworld.orgGydF4y2Ba[GydF4y2Ba42.GydF4y2Ba引物I、II、III、IV。PCR产物包含GydF4y2BaSCAP1GydF4y2Ba-特异性amiRNA在pENTR-DTOPO载体(Life Technologies)中克隆,并转移到目的载体pEarleyGate 100 [GydF4y2Ba43.GydF4y2Ba通过lr介导的重组。生成GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba,GydF4y2BaSCAP1GydF4y2Ba通过拟南芥DNA的PCR扩增开放阅读框(没有停止密码子),引物SCAP1-FW,SCAP1-RE2并克隆到PENTR-D Topo载体(寿命技术)中并与网关目的地矢量PearleyGate重新组合[GydF4y2Ba43.GydF4y2Ba]。的DEX-inducibleGydF4y2BaSCAP1GydF4y2Ba构造(GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba)由riken植物功能基因组Minami Matsui实验室提供。引物的序列在附加文件中详述GydF4y2Ba5.GydF4y2Ba。GydF4y2Ba
基因分型和转录本分析GydF4y2Ba
用于基因分型的引物的序列在附加文件中提供GydF4y2Ba5.GydF4y2Ba。通过遵循制造商的指示(Life Technologies),用Trizol试剂提取总RNA。使用上标VILO逆转录酶试剂盒(Life Technologies),用500ng总RNA合成第一链cDNA。用快速Sybr Green Master混合物(应用生物系统)进行定量实时PCR,并在7900 HT快速实时PCR系统(应用生物系统)上实时监测扩增。相对于的基因表达的变化GydF4y2BaACT2.GydF4y2Ba使用ΔΔCt方法[GydF4y2Ba44.GydF4y2Ba]。qPCR引物进行检测GydF4y2BaSCAP1GydF4y2Ba,GydF4y2BaAtMYB60GydF4y2Ba,GydF4y2BaSPCHGydF4y2Ba,GydF4y2BaEPF2.GydF4y2Ba,GydF4y2Ba沉默的GydF4y2Ba,GydF4y2Ba法玛GydF4y2Ba和GydF4y2Ba施GydF4y2Ba成绩单在附加文件中有详细说明GydF4y2Ba5.GydF4y2Ba。GydF4y2Ba
β-葡萄糖醛酸酶(GUS)的组织化学分析和组织学程序GydF4y2Ba
如前所述进行GUS染色[GydF4y2Ba26.GydF4y2Ba]。根据不同的实验,在37℃下孵育时间为4至12小时。为了检测薄树脂切片上的GUS染色,染色后,样品在70% (v/v)乙醇中脱水,在4°C FAE (50% [v/v]乙醇,5% [v/v]甲醛,10% [v/v]乙酸)中固定过夜,进一步在85%,95%和100% (v/v) EtOH和嵌入Technovit 7100树脂根据制造商的说明(贺利氏古莎)。用装有7 μM厚度不锈钢刀片的切片机对样品进行切片。GydF4y2Ba
荧光发射的显微镜和定量分析GydF4y2Ba
气孔形态分析采用6GydF4y2BaTH.GydF4y2Ba将一个月大的植株(花序约3-4厘米)展开的叶片置于70%乙醇中培养。剥去表皮,透射光显微镜(DM2500,徕卡)观察。为测定平均气孔指数和密度,一个平方面积(0.2 mmGydF4y2Ba2.GydF4y2Ba)进行了显微照相,并对细胞参数进行了评分。用Care法从6个叶片中选择一个相似的叶区GydF4y2BaTH.GydF4y2Ba在独立实验中为每种基因型的至少12种独立植物叶。对于共聚焦激光扫描显微镜,在Leica TCS SP5共聚焦显微镜下分析了表达5日幼苗的第一个叶片原叶的第一个叶片原基的轴向侧。使用氩气激光(488nm和514nm激发的GFP和YFP的514nm激发)激发荧光染料,分别在500-570nm和525-600nm处收集的发射,用于GFP和YFP。当比较独立的样品时,采集参数(包括Z步尺寸)保持恒定,以使不同的原始基金和不同治疗中的GFP强度测量。用ImageJ软件分析核SpCH-GFP蛋白的荧光强度(GydF4y2Bahttp://imagej.nih.gov/ij/GydF4y2Ba).从个体核(每个原始原始)测量GFP荧光强度。利益区域(ROI)工具被叠加到所选核,因此包括单光平面(Z堆叠)中最大可能的核区域。使用相同的ROI大小来处理所有图像,以便最小化背景荧光的检测。GydF4y2Ba
缩写GydF4y2Ba
Dex,地塞米松;DOF,DNA与一个手指结合;GC,防护细胞;GMC,Guard Mother Cell;GR,糖皮质激素受体;MMC,融资母细胞;PC,路面细胞;PDC,Protodermal Cell;SLGC,气孔谱系地面细胞;TF,转录因子。GydF4y2Ba
参考文献GydF4y2Ba
- 1。GydF4y2Ba
董建军,李国栋,李国栋。BASL控制拟南芥的不对称细胞分裂。细胞。2009;137:1320-30。GydF4y2Ba
- 2。GydF4y2Ba
董军。拟南芥气孔发育的研究进展。拟南芥的书。2013;11:e0162。GydF4y2Ba
- 3.GydF4y2Ba
Geisler M,Nadeau J,Sack FD。导向的非对称部门产生拟南芥气孔间距模式被太多嘴巴突变破坏。植物细胞。2000; 12:2075-86。GydF4y2Ba
- 4.GydF4y2Ba
Shpak ED, McAbee JM, Pillitteri LJ, Torii KU。受体激酶协同作用下的气孔模式和分化。科学。2005;309:290-3。GydF4y2Ba
- 5.GydF4y2Ba
分泌肽基因EPF1执行气孔的单细胞间距规则。基因Dev。2007;21:1720-5。GydF4y2Ba
- 6.GydF4y2Ba
Hara K,Yokoo T,Kajita R,OniShi T,Yahata S,Peterson Km,Torii Ku,Kakimoto T.表皮细胞密度通过分泌肽进行自造,拟南芥的表皮图案化因子2。植物细胞生理。2009; 50:1019-31。GydF4y2Ba
- 7.GydF4y2Ba
狩猎l,灰色je。信号肽EPF2在气孔发育期间控制不对称细胞分裂。Curr Biol。2009; 19:864-9。GydF4y2Ba
- 8.GydF4y2Ba
Ohashi-Ito K,Bergmann DC。Arabidopsis Fama在气孔发育过程中控制最终的增殖/差异化开关。植物细胞。2006; 18:2493-505。GydF4y2Ba
- 9.GydF4y2Ba
Macalister Ca,Ohashi-Ito K,Bergmann DC。建立气孔谱系的不对称细胞分裂的转录因子控制。自然。2007; 445:537-40。GydF4y2Ba
- 10。GydF4y2Ba
Pillitteri LJ, Sloan DB, Bogenschutz NL, Torii KU。不对称细胞分裂和气孔分化的终止。大自然。2007;445:501-5。GydF4y2Ba
- 11.GydF4y2Ba
Kanaoka MM, Pillitteri LJ, Fujii H, Yoshida Y, Bogenschutz NL, Takabayashi J, Zhu J- k, Torii KU。SCREAM/ICE1和SCREAM2指明了导致拟南芥气孔分化的三个细胞状态过渡步骤。植物细胞。2008;20:1775 - 85。GydF4y2Ba
- 12.GydF4y2Ba
Robinson S,Barbier de Reuille P,Chan J,Bergmann D,Prusinkiewicz P,Coen E.通过细胞极性转换产生空间模式。科学。2011;333:1436–40。GydF4y2Ba
- 13。GydF4y2Ba
亨特L,贝利KJ,格雷JE。信号转导肽EPFL9是气孔发育的正调控因子。新植醇。2010;186:609-14。GydF4y2Ba
- 14。GydF4y2Ba
Lee JS,Kuroha T,Hnilova M,Khatayevich D,Kanaoka MM,McAbee JM,Sarikaya M,Tamerler C,Torii KU.指定气孔模式的配体-受体对的直接相互作用.基因发展.2012;26:126-36。GydF4y2Ba
- 15.GydF4y2Ba
兰帕德GR,Macalister Ca,Bergmann DC。拟南芥气孔引发由MAPK介导的BHLH术语调节控制。科学。2008; 322:1113-6。GydF4y2Ba
- 16.GydF4y2Ba
Lampard Gr,Lukowitz W,Ellis,Bergmann DC。拟南芥气孔细胞命运中MAPK信号传导的新颖和扩展作用,所述细胞类型特异性操纵揭示。植物细胞。2009; 21:3506-17。GydF4y2Ba
- 17.GydF4y2Ba
Bergmann DC,Lukowitz W,Somerville Cr。MAPKK激酶控制的气孔发育和模式。科学。2004; 304:1494-7。GydF4y2Ba
- 18.GydF4y2Ba
Stomagen, EPF1和EPF2对MAP激酶MPK6激活和SPCH蛋白水平的差异影响acta botanica yunnanica(云南植物研究). 2013;54:1253-62。GydF4y2Ba
- 19.GydF4y2Ba
Gudesblat GE、Schneider PizonńJ、Betti C、Mayerhofer J、Vanhoutte I、van Dongen W、Boeren S、Zhiponova M、de Vries S、Jonak C、Russinova E.SPEECHLESS整合了油菜素类固醇和气孔信号通路。自然细胞生物学。2012;14:548–54.GydF4y2Ba
- 20。GydF4y2Ba
工程师CB, Ghassemian M, Anderson JC, Peck SC, Hu H, Schroeder JI。碳酸酐酶、EPF2和一种新型蛋白酶介导CO2对气孔发育的控制。大自然。2014;513:246-50。GydF4y2Ba
- 21。GydF4y2Ba
刘奥斯,戴维斯·卡,张杰,阿德里安·J,罗文·MH,巴林格·CE,伯格曼DC.无语在气孔自我更新细胞规范中的直接作用.科学.2014;345:1605-9。GydF4y2Ba
- 22。GydF4y2Ba
Wang H ., Ngwenyama N ., Liu Y ., Walker JC ., Zhang S. .植物细胞。2007;19:63 - 73。GydF4y2Ba
- 23。GydF4y2Ba
拟南芥转录因子在真核生物中的全基因组比较分析科学。2000;290:2105-10。GydF4y2Ba
- 24。GydF4y2Ba
植物转录因子Dof家族。植物科学进展。2002;7:555-60。GydF4y2Ba
- 25。GydF4y2Ba
Skirycz A, Radziejwoski A, Busch W, Hannah MA, Czeszejko J, Kwaśniewski M, Zanor M-I, Lohmann JU, De Veylder L, Witt I, muller - roeber B.拟南芥DOF转录因子OBP1参与细胞周期调控。植物j . 2008; 56:779 - 92。GydF4y2Ba
- 26。GydF4y2Ba
Galbiati M,Simoni L,Pavesi G,Cominelli E,Francia P,Vavasseur A,Nelson T,Bevan M,Tonelli C. Gene Trap系列识别在气孔保护细胞中表达的拟南芥基因。工厂J. 2008; 53:750-62。GydF4y2Ba
- 27。GydF4y2Ba
Cominelli E, Galbiati M, Albertini A, Fornara F, Conti L, Coupland G, Tonelli C. dof结合位点额外有助于保护AtMYB60启动子的细胞特异性。BMC Plant Biol. 2011;11:162。GydF4y2Ba
- 28。GydF4y2Ba
Negi J,Moriwaki K,Konishi M,Yokoyama R,Nakano T,Kusumi K,Hashimoto-Sugimoto M,Schroeder Ji,Nishitani K,Yanagisawa S,IBA K. A DOF转录因子SCAP1,对功能性气孔的发展至关重要在拟南芥中。Curr Biol。2013; 23:479-84。GydF4y2Ba
- 29。GydF4y2Ba
MYB转录因子是一种保护细胞特异性的转录因子,它调节气孔运动和植物抗旱性。咕咕叫医学杂志。2005;15:1196 - 200。GydF4y2Ba
- 30.GydF4y2Ba
蔡玉山。转基因植物中糖皮质激素介导的转录诱导系统。植物j . 1997; 11:605-12。GydF4y2Ba
- 31。GydF4y2Ba
Nadeau JA,Sack FD.拟南芥叶表面气孔分布的控制.科学.2002;296:1697-700。GydF4y2Ba
- 32。GydF4y2Ba
Kondo T,Kajita R,Miyazaki A,Hokoyama M,Nakamura-Miura T,Mizuno S,Masuda Y,Irie K,Tanaka Y,Takada S,Kakimoto T,Sakagami Y.气孔密度由叶蛋白衍生的信号传导分子控制。植物细胞生理。2010; 51:1-8。GydF4y2Ba
- 33。GydF4y2Ba
Sugano SS, Shimada T, Imai Y, Okawa K, Tamai A, Mori M, Hara-Nishimura I.气孔agen正调节拟南芥的气孔密度。大自然。2010;463:241-4。GydF4y2Ba
- 34。GydF4y2Ba
Abrash EB,Bergmann DC。推定配体挑战的区域规范。发展。2010; 137:447-55。GydF4y2Ba
- 35。GydF4y2Ba
李JS, Hnilova M, Maes M, Lin Y-CL, Putarjunan A, Han S-K, Avila J, Torii KU。竞争性结合拮抗肽微调气孔模式。大自然。2015;522:439-43。GydF4y2Ba
- 36。GydF4y2Ba
Lake JA, Quick WP, Beerling DJ, Woodward FI。植物发育:从成熟到新叶的信号。大自然。2001;411:154 - 154。GydF4y2Ba
- 37。GydF4y2Ba
Lake JA, Woodward FI, Quick WP。植物中的长距离CO2信号。中国农业大学学报2002;53:183-93。GydF4y2Ba
- 38。GydF4y2Ba
Coupe SA, Palmer BG, Lake JA, Overy SA, Oxborough K, Woodward FI, Gray JE, Quick WP。拟南芥叶片中环境信号的系统信号传递。J Exp Bot. 2006; 57:329-41。GydF4y2Ba
- 39。GydF4y2Ba
Davies KA, Bergmann DC。通过修饰dna结合和磷调节电位实现气孔bHLHs的功能专门化。中国科学(d辑:地球科学)2014;GydF4y2Ba
- 40.GydF4y2Ba
阵伤SJ,弯曲AF。花卉浸:农杆菌介导的拟南芥转化的简化方法。工厂J. 1998; 16:735-43。GydF4y2Ba
- 41.GydF4y2Ba
农杆菌介导的植物转化载体。植物科学进展。2002;7:193-5。GydF4y2Ba
- 42.GydF4y2Ba
奥塞尔奇S,Schwab R,Weigel D.使用人造小罗车和其他小RNA植物中的基因。工厂J. 2008; 53:674-90。GydF4y2Ba
- 43。GydF4y2Ba
Earley Kw,Haag Jr,Pontes O,Opper K,Juehne T,Song K,Pikaard CS。植物功能基因组和蛋白质组学的网关兼容载体。植物J. 2006; 45:616-29。GydF4y2Ba
- 44。GydF4y2Ba
Livak KJ,Schmittgen TD.使用实时定量PCR和2(−δδC(T))方法。方法。2001;25:402-8。GydF4y2Ba
致谢GydF4y2Ba
我们要感谢Enrico Coen教授进行建议,诺丁汉拟南芥和冷泉港股票中心,用于提供T-DNA和Transposon标签线,Matsui博士(riken植物功能基因组)的礼物GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba构造。所有作者没有利益冲突声明。GydF4y2Ba
资金GydF4y2Ba
GC得到了米兰大学的博士奖学金和伊拉斯谟大学学生实习计划的部分支持。这项工作得到了米兰Umberto Veronesi基金会(AGRISOST项目)和MIUR PRIN项目(2010-2011年prot)的部分支持。2010HEBBB8_006)(至MG和CT)。GydF4y2Ba
可用性数据和材料GydF4y2Ba
所有支持数据都包含在附加文件中。在此作品中描述的转基因素,突变体和构建体可根据要求提供。GydF4y2Ba
作者的贡献GydF4y2Ba
GC进行了转基因植物的构建、植物转化和表达研究。GC和SF进行共聚焦研究。CT、MG和LC构思了这项研究,参与了设计和协调。手稿由GC、CT、MG、LC撰写。所有作者阅读并批准了最终的手稿。GydF4y2Ba
相互竞争的利益GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
同意出版GydF4y2Ba
不适用。GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
作者信息GydF4y2Ba
隶属关系GydF4y2Ba
相应的作者GydF4y2Ba
额外的信息GydF4y2Ba
这篇文章的勘误表载于GydF4y2Bahttp://dx.doi.org/10.1186/s12870-016-0948-4GydF4y2Ba。GydF4y2Ba
附加文件GydF4y2Ba
附加文件1:GydF4y2Ba
描述的GydF4y2Bascap1GydF4y2Ba突变等位基因。(a)示意图GydF4y2BaSCAP1GydF4y2Ba位点。灰色盒子代表amiRNAs靶区,三角形代表转座子基因组插入点GydF4y2Bascap1-2GydF4y2Ba。(b)逆转转录酶-PCR分析GydF4y2BaSCAP1GydF4y2Ba在野生类型(lGydF4y2Ba呃GydF4y2Ba),GydF4y2Bascap1-2GydF4y2Ba植物。从2周龄幼苗中分离出总RNA,并进行35个循环的PCR。以肌动蛋白作为阳性对照,扩增25个周期。(JPG 97 KB)GydF4y2Ba
附加文件2:GydF4y2Ba
SCAP1GydF4y2Ba影响GCS开发。(a)代表性的axaxial表皮表型为6GydF4y2BaTH.GydF4y2Ba野生型(LGydF4y2Ba呃GydF4y2Ba),GydF4y2Bascap1-2GydF4y2Ba突变体。保卫细胞是假的黑色。比例尺= 50 μm。(B)的模式GydF4y2BaSCAP1GydF4y2Ba通过定量PCR检测成熟叶片中独立T1 BASTA抗性的转录本积累GydF4y2Bapro35S: amiRNA-SCAP1GydF4y2Ba(GydF4y2Ba氨基核糖核酸-1GydF4y2Ba)转基因系,与野生型(COL-0)进行比较。GydF4y2Ba施GydF4y2Ba(GydF4y2BaACT2.GydF4y2Ba)用于标准化。值表示两个技术复制的平均值。误差栏=标准偏差。(c)野生型(Col)或Basta中的防护细胞(GC),路面细胞(PC)和气孔指数的数量选择T2GydF4y2Bapro35S: amiRNA-SCAP1GydF4y2Ba(GydF4y2Ba氨基核糖核酸-1GydF4y2Ba)线。用空载体(载体)转化的转基因系作为进一步的对照,以考虑Basta治疗。在该实验中测试的线在(b)中标记为填充箭头。第2行,(b)中的白色箭头未包含在此特定实验中。(d)野生型(Col)或野生型(Col)或Basta中的防护细胞(GC),路面细胞(PC)和气孔指数的数量GydF4y2BaPRO35S:SCAP1-YFPGydF4y2Ba(GydF4y2Ba35s:scap1.GydF4y2Ba)线。在C和D中(**)(GydF4y2BaXXGydF4y2Ba)和(°) = P < 0.01(双尾T Student检验),分别比较野生型和突变型等位基因的GC、PC细胞密度或气孔指数。ns = 不显著。与野生型或矢量相比,(C)中的PC值均无显著差异。误差条 = 标准错误。(JPG 382 kb)GydF4y2Ba
附加文件3:GydF4y2Ba
SCAP1GydF4y2Ba管理GydF4y2BaAtMYB60GydF4y2Ba表达式。(一)GydF4y2BaAtMYB60GydF4y2Ba通过定量PCR在手动解剖第一个野生型(WT)中的第一双叶原叶测定的积累GydF4y2Bascap1-2GydF4y2Ba和GydF4y2Bapro35S: amiRNA-SCAP1GydF4y2Ba(GydF4y2BaamiRNA2-SCAP1GydF4y2Ba)不同时间点的幼苗。值代表三个生物重复(30个叶子/副本)的平均值。(b)GydF4y2BaSCAP1GydF4y2BaRT-PCR检测转录本积累GydF4y2Bapro35S: SCAP1-GRGydF4y2BaT1线路。从2周龄幼苗中分离总RNA, PCR 30个周期。以肌动蛋白作为阳性对照,扩增25个周期。(C)转录本积累GydF4y2BaAtMYB60GydF4y2Ba通过定量PCR在DEX(或模拟)处理的野生型(Col)和GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba(GydF4y2Ba35 s: SCAP1-GRGydF4y2Ba)的转基因植物。值代表两个生物重复的平均值。在所有定量PCR中GydF4y2Ba施GydF4y2Ba(GydF4y2BaACT2.GydF4y2Ba)用于标准化。在A和C,** = P <0.01和* = P <0.05和两个尾部T学生测试中。误差栏=标准偏差。(d)GUS子叶中气孔的形态改变染色4周龄单身GydF4y2BaproAtMYB60:格斯GydF4y2BaWT (Col)或双GydF4y2BaproAtMYB60:格斯pro35S: SCAP1-GRGydF4y2Ba(GydF4y2Ba35 s: SCAP1-GRGydF4y2Ba)半合子的植物。Bar = 20 μm。(E) DEX处理二倍后,子叶中被间隔改变的分生组织簇包围的GCs闭合GydF4y2BaproAtMYB60:格斯pro35S: SCAP1-GRGydF4y2Ba(GydF4y2Ba35 s: SCAP1-GRGydF4y2Ba)半合子植株(本株未进行GUS染色)Bar = 10 μm。(JPG 370 kb)GydF4y2Ba
额外的文件4:GydF4y2Ba
的角色GydF4y2BaSCAP1GydF4y2Ba气孔基因转录积累研究。(A)气孔标记的转录本积累GydF4y2BaSPCHGydF4y2Ba,GydF4y2BaEPF2、静音GydF4y2Ba和GydF4y2Ba法玛GydF4y2Ba在人工解剖7日龄野生型(LGydF4y2Ba呃GydF4y2Ba),GydF4y2Bascap1-2GydF4y2Ba植物。值代表三个生物重复(30个叶子/副本)的平均值。(B-E)气孔标记的转录本积累GydF4y2BaEPF2.GydF4y2Ba,GydF4y2BaSPCHGydF4y2Ba,GydF4y2Ba沉默的GydF4y2Ba和GydF4y2Ba法玛GydF4y2Ba通过定量PCR在10天龄DEX(或模拟)处理的野生型(COL)和(F-I)中确定的基因GydF4y2Bapro35S: SCAP1-GRGydF4y2Ba(GydF4y2Ba35 s: SCAP1-GRGydF4y2Ba)在治疗后不同时间点的转基因植物。值代表两个生物重复的平均值。在所有定量PCR中GydF4y2Ba施GydF4y2Ba(GydF4y2BaACT2.GydF4y2Ba)用于标准化。误差栏=标准偏差。** = P < 0.01 and * = P < 0.05 and two tails T Student test。与野生类型相比,(a)中的值并没有显着差异。(JPG 348 KB)GydF4y2Ba
额外的文件5:GydF4y2Ba
本研究中使用的引物。(PDF 1736 KB)GydF4y2Ba
权利和权限GydF4y2Ba
开放访问GydF4y2Ba本文根据知识共享署名4.0国际许可的条款分发(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
Castorina,G.,Fox,S.,Tonelli,C.GydF4y2Baet al。GydF4y2Ba一个新的角色GydF4y2Ba气孔木匠1GydF4y2Ba在气孔模式。GydF4y2BaBMC植物杂志GydF4y2Ba16,GydF4y2Ba172(2016)。https://doi.org/10.1186/s12870-016-0851-zGydF4y2Ba
已收到GydF4y2Ba:GydF4y2Ba
认可的GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-016-0851-zGydF4y2Ba
关键字GydF4y2Ba
- 拟南芥GydF4y2Ba
- SCAP1GydF4y2Ba(AT5G65590)GydF4y2Ba
- 保卫细胞的发展GydF4y2Ba
- DOF型转录因子GydF4y2Ba
- SPCHGydF4y2Ba(AT5G53210)GydF4y2Ba
- AtMYB60GydF4y2Ba(AT1G08810)GydF4y2Ba