摘要
背景
黄龙病(HLB)仍然是世界柑桔农业的最大威胁。虽然没有任何阻力源在柑橘类种质上,存在一定程度的适度耐受性。蛋白质组学反应的大规模分析柑橘类可能有助于:1)阐明疾病进展的生理和分子效应,2)在转录组水平上验证之前的数据,3)识别生物标志物,以开发早期诊断、短期治疗和长期遗传耐药性。
结果
在这项工作中,我们对两个成熟叶片进行了蛋白质组学分析柑橘类对HLB具有不同耐受性的基因型:脐橙(高度易感)和Volkameriana(中等耐受性)。途径富集分析表明,氨基酸在脐橙中发生了较大程度的降解。两种基因型之间的主要代谢途径没有明显差异。最重要的发现是四种谷胱甘肽- s转移酶在Volkameriana中上调,而在脐橙中没有。这些蛋白质参与自由基离子解毒。
结论
参与自由基离子解毒的蛋白的上调应该被认为是对HLB耐受性增加的重要机制。
背景
黄龙病目前威胁地区柑橘类在东亚、中东和美洲等农业经济中,种植是重要的。黄龙病由三种黄龙病引起Candidatus亚洲自由杆菌、美洲自由杆菌及非洲自由杆菌[1].病原体由两种木虱传播:柑橘木虱(Diaphorina citri)和三叶木虱(Trioza erytreae)。最近,在欧洲(西班牙加利西亚)首次发现了Trioza erytreae。黄龙病叶片的典型症状是嫩芽变黄,叶片斑驳。尽管大多数果实仍然具有商业质量,但严重受影响的分支的果实无法销售:小,不平衡,绿色,酸性,许多种子流产。CaLas感染过程中,叶片积累淀粉,韧皮部受损,细胞壁片层肿胀[1,2].Candidatus liberibacter根据核糖体区域序列资料,属变形菌门α亚群[3.].尽管已尝试对细菌进行明确培养,但这种细菌尚未得到完全培养[4].对于这种疾病,科赫的假设还没有得到满足,因此不能排除与其他微生物相互作用的可能性。病原体生活在昆虫和韧皮部柑橘类树。一旦获得,它通常会持续宿主的其余生命。杀虫剂可以减少木虱的数量,但由于病原体仍然存在于病媒中,果园中只要有少数受感染的木虱,疾病就会传播。属内的所有基因型柑橘类对HLB有不同程度的敏感性,尽管其他近亲属的物种表现出某种抗性[5].患者的疾病严重程度和症状存在差异柑橘类基因型(6].九里香(橙茉莉),一种观赏植物柑橘类近亲植物,表现出较少的疾病症状[7].一项研究检查了30种基因型对HLB疾病的反应,根据诱导症状的表型分析对它们进行了分组[5].最近的另一项研究评估了65柑橘类隶属其他近缘属的品系33个。据报道,在不属于柑橘类属(8].另一项工作是通过分析16个柑桔基因型筛选出柑桔种质对HLB的敏感性[9].结果显示柑橘macrophylla和c .》是最易受影响的,而复杂的遗传杂交品种“US 1-4-59”和“Fallglo”最不受影响。进行了一项代谢组学研究,比较了五个不同的耐受性杂交品种和一个高度敏感的品种,以确定与不同反应相关的潜在代谢物[10].已经使用不同的“组学”方法研究了疾病的原因,以确定哪些基因、蛋白质和代谢物可能是创新诊断和治疗方法的靶点。使用宏基因组方法对病原体的基因组进行测序,均来自受感染的植物[11]和昆虫媒介[12].没有毒素或其他分泌蛋白与这种疾病有关,其病理机制仍不清楚。大规模微阵列分析揭示了与转运、细胞防御和碳水化合物代谢相关的基因的显著调节[13,14].幼叶和成熟叶的光合作用都减弱,但在受感染的果实中光合作用上调[14].淀粉积累与葡萄糖输入到叶绿体和淀粉生物合成相关基因的上调有关[15,16].调节茉莉(JA)-水杨酸(SA)的先天反应串音可能导致错误的防御反应。2-DE和质谱的综合方法表明,参与光合作用和蛋白质合成的几种蛋白质水平的变化与受感染的葡萄柚叶片中Ca、Mg、Fe、Zn、Mn和Cu浓度的降低有关[17].感染样品中上调的蛋白参与氧化还原阶段和细胞防御,如Cu/Zn超氧化物歧化酶、过氧化物酶、几丁质酶和凝集素相关蛋白[18].被CaLas感染的‘Madam Vinous’甜橙植株表现出奇迹般蛋白、几丁质酶、Cu/Zn超氧化物歧化酶和脂氧合酶的增加。HLB调节的一些关键代谢产物包括脯氨酸、β-榄香烯、(−)-反式石竹烯和α-葎草烯[19].一些氨基酸(l -脯氨酸、l -丝氨酸和l -天冬氨酸)和有机酸的积累增加与‘酒夫人’甜橙比柑橘卡瑞索更敏感有关[20.].然而,值得注意的是,这些树木受到了许多次要影响的高度感染,因此有必要用新感染的树木来确认这些结果。在耐受品种中观察到,大多数参与植物对病原体防御的氨基酸数量增加,如苯丙氨酸、酪氨酸、色氨酸、赖氨酸和天冬酰胺[21].
本研究检测了完全光合作用叶片的蛋白质组学变化,以确定两者之间的疾病机制和易感性如何变化柑橘类基因型,采用主成分分析(PCA)、基因集和途径富集分析的综合方法。目的是鉴定不同基因的关键蛋白和转录后调控通路柑橘类HLB症状晚期的基因型。
结果与讨论
脐橙(柑橘类sinensis (L.))是对hlb敏感的品种,而Volkameriana是中等耐受性的品种[5].不同的技术(2-DE,质谱和ICP质谱)已经被用于识别HLB在蛋白质中差异调控的关键蛋白柑橘类叶子(19,20.].使用等压标签进行相对和绝对定量(iTRAQ)分析了两种基因型(Volkameriana的4557和Navel orange的4521)的4000多个蛋白质。在脐橙中,599个蛋白质在感染组织和健康组织之间被差异调节(p值< 0.05和Log2FD > 0.5 and <−0.5)(附加文件1:表S1)。在Volkameriana中,在感染组织和健康组织之间发现了411个差异调节蛋白(附加文件)2:表S2)。
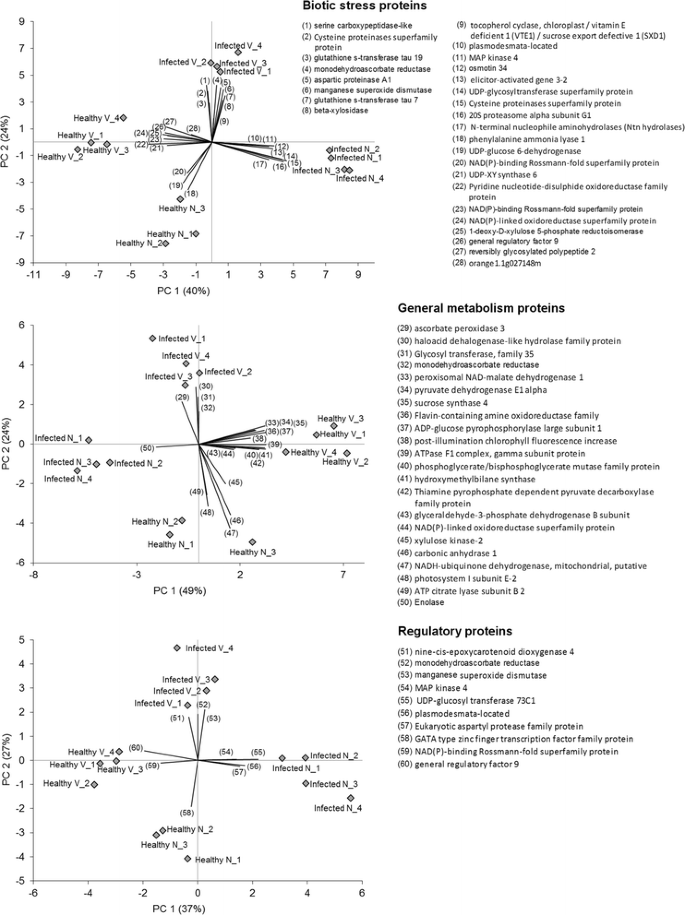
PCA分析
PCA被用来可视化四种被分析的基因型x疾病状态之间的差异,将整个蛋白质组学剖面细分为三个重要的亚类:生物应激反应、整体细胞代谢和转录调控途径(图2)。1).所有属于这些重要功能类别的识别蛋白都用于PCA图。在3个PCA图中,健康V、健康N、感染V和感染N 4类样本均被明显分离,这意味着与物种和健康状况相关的3个基因类别均发生了显著的蛋白质变化。对于生物应激相关蛋白,PC1和PC2分别占数据变异性的40%和24%。图中列出了与每个功能类别相关的重要蛋白质,这些蛋白质有助于样品类型之间的分离(由向量方向表示)。1。一些参与氧化还原状态的关键蛋白在感染V与其他类别的分离中起着重要作用。在一般代谢PCA图中,PC1和PC2分别占数据变异性的49%和24%。与健康V与感染V分离相关的初级代谢的关键蛋白质包括苹果酸脱氢酶和丙酮酸脱氢酶(TCA循环糖酵解)、蔗糖合成酶和AGPase(蔗糖和淀粉代谢)。根据参与转录调节、信号、激素和氧化还原状态的蛋白表达,生成第三个PCA图。PC1和PC2分别占数据变异性的37%和27%。有趣的是,少数重要蛋白质的调节似乎特别表征脐橙的感染和健康状态。这些包括MAP激酶4,udp -葡萄糖转移酶和天冬氨酸蛋白酶。MAPK6没有观察到变化。在三个PCA图中出现的蛋白质在感染和对照组的比较中都是高度调控的柑橘类基因型。事实上,它们可以被认为是一种明确症状状态的假定候选生物标志物柑橘类在蛋白质组学水平上。它们的hlb调控的表达模式在区分四种不同的叶片样本类型方面发挥了重要作用。需要进一步的分析来验证这些数据,并确认其在HLB疾病发病机制中的作用。
基因集及途径富集分析
Pageman网络工具突出显示了在每一对比较中哪些基因类别上调或下调(图。2).两种感染基因型均表现出抑制氨基酸生物合成和蛋白质合成。在脐橙中,HLB显著抑制光合作用、异黄酮途径、四吡啶合成和半乳糖代谢。在Volkameriana中,s同化、类异戊二烯、RNA结合和氨基酸激活被特异性降低。在两种基因型中,HLB增强了淀粉相关途径、生物应激相关蛋白、β 1,3葡聚糖水解酶和蛋白质降解途径。HLB反应在基因型间存在明显差异。在Volkameriana中,细胞壁修饰、半乳糖代谢和热休克蛋白上调。在脐橙中,氨基酸降解、脂质代谢、茉莉酸盐和pr蛋白上调。
利用DAVID生物信息学资源进行通路富集分析,以确定在这两种基因型中,哪些代谢通路普遍或特别受到HLB疾病的影响(表2)1).HLB改变了两个物种的一些代谢途径。氨基酸代谢(甘氨酸、丝氨酸、苏氨酸、苯丙氨酸和色氨酸)明显下调。其他关键的抑制途径包括植物激素、萜类化合物和苯丙类化合物的生物合成。另一方面,两种基因型的酪氨酸代谢均上调。脐橙中脂肪酸生物合成和氮代谢减少,α -亚麻酸代谢增强。在Volkameriana中,生物碱和丙酮酸代谢相关蛋白被抑制,而半乳糖代谢和脂肪酸代谢被上调。
初级代谢
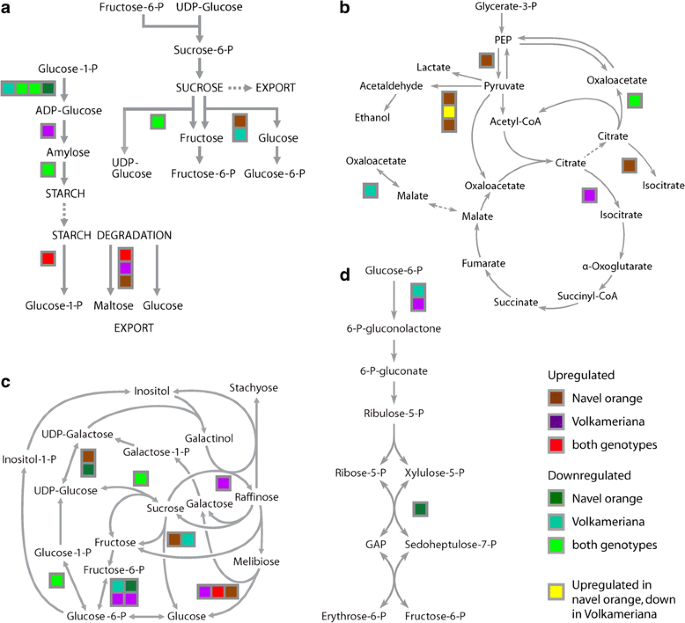
将两种成对比较整合到统一的Mapman可视化中,使我们能够识别两个物种中通常或特定地对HLB反应进行调节的蛋白质。一些参与细胞壁修饰的蛋白仅在Volkameriana中被HLB上调:扩张蛋白A1,扩张蛋白A8,扩张蛋白样B1,木葡聚糖内转糖基酶6和木葡聚糖羧糖基转移酶(TCH4)(附加文件)3.:图S1)。在脐橙中,参与脂肪酸生物合成和延伸的蛋白质普遍被抑制,而参与氨基酸降解的几个关键蛋白质被上调:精氨酸酶、吡罗林-5-羧化酶还原酶、乳酸谷胱甘肽裂解酶和3-羟甲基戊二酰辅酶a裂解酶。蛋白质降解量的增加表明,与普通脐橙相比,hlb病脐橙的衰老过程可能更加活跃。
HLB仅在蛋白质水平上对蔗糖代谢有轻微影响;只有蔗糖合酶被抑制。淀粉代谢变化更大(图;3).两种基因型中淀粉生物合成的第一个酶adp -葡萄糖焦磷酸化酶均被HLB抑制。在Volkameriana中,淀粉合酶表达上调,1,4- α -葡聚糖淀粉分支酶表达小幅下调。在淀粉降解酶中,葡聚糖磷酸化酶和异糖基葡萄糖苷酶1在两种基因型中均上调。α -淀粉酶在人民蕉中表达上调,β -淀粉酶6在脐橙中表达上调。综上所述,这些发现表明,在蛋白质水平上,两种基因型的淀粉代谢都受到高度影响。对HLB的不同易感性之间没有明显的关联,仅从淀粉途径调节是明显的。
在hlb感染的样本中,参与光合反应的蛋白质被观察到显著下调[17].HLB引起糖和淀粉代谢基因转录的改变[16]大多数人都同意本研究中提出的相应的蛋白质变化。观察到的淀粉相关通路的变化与转录组分析一致[16].观察到淀粉降解的增加可能是由于感染叶组织中淀粉浓度的增加。ADP葡萄糖焦磷酸酶(ADPase)在两种感染种中均被抑制。该酶是淀粉生物合成的限速酶,催化葡萄糖-1-磷酸转化为adp -葡萄糖,adp -葡萄糖再聚合成支链淀粉或直链淀粉[22].感染叶中淀粉积累是HLB的典型症状[1].然而,这一过程的最大发生可能发生在早期,无症状阶段。事实上,我们可以推测淀粉的积累可能是疾病的次要影响,而不是症状的原因。当症状已经明显且呈黄色时,淀粉的生物合成可能会减慢,淀粉降解有望作为植物的一种反应被激活,以限制对细胞结构的损害。然而,在转录组和蛋白质组方法之间观察到初级代谢的一些差异。观察到转化酶基因表达的变化[16],而不是蛋白质水平。蔗糖是转化酶的底物,在叶片中通过光合作用产生,然后通过韧皮部运输到下沉组织(未成熟的果实和嫩叶)。蔗糖参与先天反应的信号传导最近已被描述[23].转化酶在植物胁迫反应中发挥重要作用,可能是病原体攻击的细胞外信号[24].该基因对HLB反应的表达可能取决于基因型、植物生理条件和年龄、组织发育条件、感染类型(木虱接种或移植物介导)和/或环境条件(田间或受控环境)。综上所述,所有这些初级代谢结果与先前的研究结果一致,表明在轻度碳水化合物代谢中转录物丰度有显著改变[16],但并没有表明这与两种基因型之间众所周知的耐受性差异有明确的联系。
GPT2与HLB疾病有关:该基因负责葡萄糖输入到叶绿体,从而导致淀粉积累[13,16].在iTRAQ提取和鉴定的蛋白质中未发现该蛋白,因此不能得出关于HLB引起的蛋白质水平变化的结论。但是,该协议用于分析柑橘类蛋白质组学倾向于可溶性细胞蛋白的检测,而不是膜蛋白如GPT2。
HLB影响TCA循环和PEP代谢关键蛋白的表达。atp -柠檬酸裂解酶亚基B2在两个物种中都被抑制(图。3 b).将乙醛转化为乙醇的乙醇脱氢酶1在两种基因型中都被上调。在感染脐橙中,苹果酸异丙酯异构酶(将柠檬酸转化为异柠檬酸和参与发酵的丙酮酸脱羧酶)比健康组织中含量更高。在Volkameriana中,丙酮酸脱羧酶被抑制,而参与TCA循环的乌酸水合酶被上调。
棉子糖代谢被疾病彻底改变(图。3 c).在脐橙中,HLB增强了α -半乳糖苷酶1、udp -葡萄糖-4-表皮素酶、葡萄糖-6-磷酸异构酶和α -半乳糖苷酶1的表达。在Volkameriana中,棉子糖合成酶、磷酸果糖激酶3和磷酸葡萄糖合成酶上调。蔗糖合酶4和磷酸甘油酸突变酶在两种基因型中均受调控。将木酮糖-5- p转化为sedoheptuose -7- p的转酮醇酶在受感染的脐橙中被抑制。3 d).
感染脐橙叶片的天门冬氨酸生物合成和丝氨酸代谢明显受到抑制。这与先前描述的在无症状期和有症状期丝氨酸型肽酶下调一致[18].在受感染的脐橙中,参与氨基酸生物合成的17个蛋白质被下调。在受感染的Volkameriana中,蛋白下调较少。另一方面,一些参与氨基酸降解的上调蛋白仅在感染脐橙中发现。综上所述,这些结果表明,在HLB感染期间,脐橙的氨基酸代谢比Volkameriana更容易降解。
次生代谢
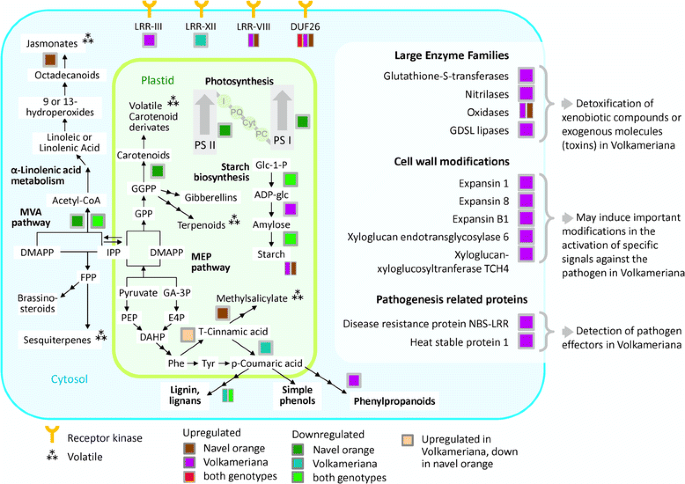
在CaLas感染的反应中,在两个栽培品种中观察到参与次生代谢产物生物合成的关键蛋白的普遍抑制(附加文件)4:图S2)。参与非mva途径的香叶酰香叶基还原酶和1-脱氧-d -木酮糖5-磷酸还原异构酶被抑制。其他通常参与莽草酸途径的hlb下调蛋白包括2-脱氢-3-脱氧磷酸庚酸醛缩酶、3-脱氢喹酸合成酶、3-磷酸莽草酸1-羧乙烯基转移酶和甲丙酸二磷酸脱羧酶。苯丙氨酸解氨酶和芳基醇脱氢酶这两种与苯丙氨酸有关的关键蛋白在HLB反应中含量更高,而肉桂醇脱氢酶9则被抑制。两种参与生物碱生物合成的蛋白质,肌松还原酶和strictosidine synthase-like 4,在感染的Volkameriana中表达上调。
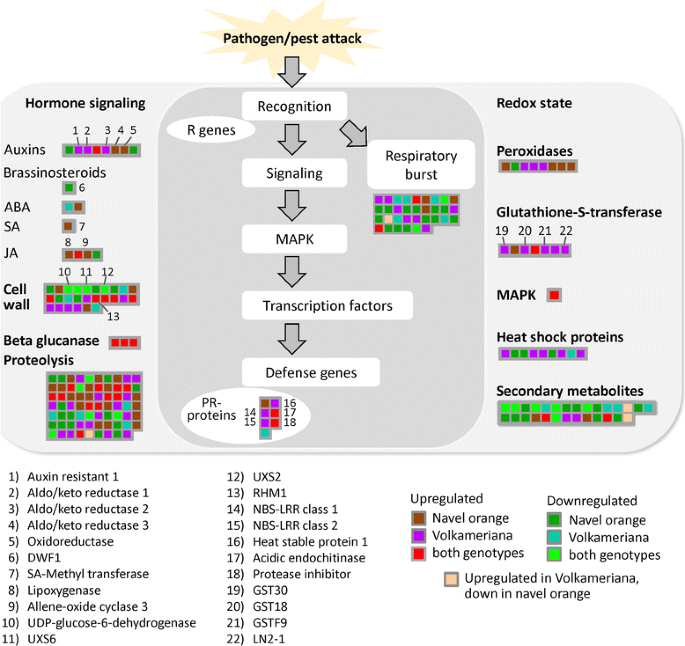
调查结果涉及柑橘类CaLas感染激活的防御反应如图所示。4).3种生长素信号转导蛋白被激活:生长素抗性1和两个aldo/keto还原酶。一个aldo/keto还原酶在两种基因型中都受到hlb的调控。在脐橙中诱导了三种与茉莉和水杨酸反应有关的蛋白质,而在人民菊中没有。脂氧合酶2在两种基因型中均上调。一些参与细胞壁修饰的关键蛋白通常由两种基因型调节:udp -葡萄糖-6-脱氢酶,UXS6, UXS2和RHM1。两种基因型的蛋白水解相关蛋白均发生改变。综上所述,这些发现并不表明两种基因型和激素串扰、细胞壁和蛋白水解途径的蛋白质组学变化之间存在任何明确的联系。
在本研究中,一些通过苯丙烷和类胡萝卜素途径合成挥发物的蛋白质受到了影响(图。5).两个物种之间的显著差异表明,任何基于诱导挥发物的创新hlb检测系统都必须是品种特异性的。
植物酚不仅能拮抗活性氧和病原体分泌的毒素,而且在转运和信号转导通路中发挥作用。多酚化学对植物适应环境压力至关重要,包括病原体[25].苯丙氨酸解氨酶(PAL)被HLB感染下调(附加文件)4:图S2)。这种酶是整个苯丙烷通路的关键调节点。其转录丰度的增强与植物病原体攻击有关[26].另一个编码异黄酮还原酶和参与抗氧化反应的重要蛋白质在两个受感染物种中都被抑制,这与之前的蛋白质组学分析一致[18].总的来说,RNA-seq分析表明,在田间生长的成熟树木中,苯丙类途径在年轻和成熟的感染叶片中都受到HLB的转录影响[16].这些先前的发现与目前的蛋白质组学数据并不完全一致。基因集富集分析显示,两种基因型的次级代谢普遍下调,尽管一些关键蛋白在疾病反应中上调。这些不同的发现可能反映了两项研究中所分析的植物发育和生理阶段的差异,也可能反映了环境和农艺条件的差异。虽然苯丙类化合物在感染的早期阶段可能被激活,但当症状严重时它们可能被抑制。属于苯丙类途径的代谢产物的大量和复杂性使得澄清它们在宿主-病原体战斗中的许多作用变得困难。
荷尔蒙的相声
植物的先天反应是由激素的相互作用控制的,特别是在JA和SA信号之间。异丙烯氧化物环化酶在染病脐橙中的诱导作用(图。4)是有趣的,因为茉莉酸信号转导是一个关键的途径激活响应necrotroph和草食动物的攻击。赤霉素信号通路(gaa1和赤霉素-2-氧化酶)和生长素信号通路(CYP711A1和sar样蛋白)在瓦伦西亚橙成熟感染叶中表达上调[16].因为CaLas是一种生物营养体,JA的激活可能对宿主有害,如前所述[16].油菜素内酯影响植物抗病性[27]可能是由于BAK1的诱导,它与细菌鞭毛蛋白等PAMP受体相互作用以激活免疫反应[28].ST1基因在hlb感染叶片中被抑制[16].然而,油菜素内酯与SA-ET-JA串扰和植物免疫之间的联系仍然不明确。另一方面,两种植物的生长素相关蛋白均被HLB上调柑橘类基因型。由于生长素对SA反应的拮抗作用[29],我们可以推测这些影响对受感染的宿主是有害的。
蛋白质组学研究揭示了参与关键途径的基因的转录后调控,这可能是导致HLB表型反应变化的原因。在症状期,碳水化合物代谢(蔗糖、淀粉和棉子糖代谢)的调节在转录物和蛋白质水平上都明显改变。信号传导机制和激素介导的防御反应的差异也可能导致对HLB的耐受范围柑橘类种质。最引人注目的发现是,与脐橙相比,Volkameriana中参与氧化还原途径和防御异种生物(特别是GSTS)的蛋白质更丰富,这可能与前者更强的耐受性有关。4种GSTs在感染的Volkameriana中显著上调,而在感染的脐橙中没有显著上调:GST18, GST19, GHST30, LN2-1。这些对蛋白质组的影响可能解释了脐橙相对于Volkameriana更大的敏感性。而这些关于柑橘类应对措施在抗击这一致命疾病的持续努力中是有价值的,仍需要进一步的研究来验证这些发现,并提供有效的靶标,以制定新的治疗策略。
信号和防御反应途径
部分编码LRR型受体激酶的蛋白受到hlb的调控:一个在Volkameriana中上调,一个在Navel orange中被抑制,两个不同的LRR- viii蛋白被上调(一个在Volkameriana中,一个在Navel orange中)。富亮氨酸重复受体激酶是植物中最大的一类受体激酶,介导植物防御反应的信号转导。其他受体激酶(VIII和DUF26)在两者中均上调柑橘类基因型。属于未知功能域26的蛋白在HLB反应中上调:一个在Volkameriana中,一个在Navel orange中,一个在一般调控中。DUF26是受体样激酶(rlk)中最大的一类。这些蛋白在调节病原体防御和程序性细胞死亡中发挥重要作用[30.].基于本研究的蛋白质组学结果,我们推测不同的信号机制发生取决于柑橘类基因型。易感性的可变性是可能的柑橘类可能是由于不同受体的激活而引起的病原体感知,这些受体反过来激活了速度和强度不同的防御反应。关于哪个受体家族参与对HLB的敏感或耐药反应,仍有许多有待了解。
在脐橙侵染叶中,钙调素结合酶和钙转运atp酶等几种钙调节蛋白含量较低。这与在有症状的叶片中观察到的钙浓度的显著下降是一致的[17].脐橙中也有3个14-3-3蛋白被hlb下调,而在Volkameriana中则没有。这些是存在于所有真核生物中的一个庞大的蛋白质家族,通过结合其他蛋白质,如激酶、磷酸酶和受体(即p型H+ atp酶)来辅助信号传递[31].
Volkameriana表现出明显的呼吸爆发刺激和随之而来的氧化还原状态,这是致病相关蛋白上调的前提条件。在两种基因型中,参与控制活性氧的酶在CaLas感染时普遍增强,尽管Volkameriana显示出更高的谷胱甘肽- s转移酶(GST30, GST18, GSTF9, LN2-1)的激活。与脐橙相比,这些重要的解毒蛋白的上调可能与Volkameriana的耐受性增加有关。在无症状期和有症状期,参与过氧还蛋白、Cu/Zn超氧化物歧化酶和2Fe-2S铁还蛋白样蛋白生物合成的酶均出现上调[18].谷胱甘肽s -转移酶家族蛋白质包括几种帮助解毒异种化合物的同工酶[32].植物gst将谷胱甘肽添加到亲电的异种生物分子中,将它们推入细胞液泡。环境压力刺激对这些蛋白质的调节表明它们在抵御任何有害事件中起着保护作用[33].GSTs与激素稳态有关,它们对生长素的高亲和力表明它们的上调是应激反应的一般信号[34].应激诱导的GSTs结合氧化损伤引起的有害代谢物。可诱导的GSTs可能在解毒病原体攻击产生的外源分子如植物毒素方面发挥重要作用。人民ameriana体内较高水平的GSTs强化了这一假设,即它们可以抵御CaLas攻击产生的危险分子。的确,GSTs的不同激活可能解释了某些疾病的可变性柑橘类HLB反应。在两种基因型中,一些过氧化物酶也上调。这些酶能解毒过量的H2O2[35],并根据它们的亚细胞定位进行分组[36].如前所述[37, 174],更大柑橘类对HLB的易感性可能与未能迅速诱导抗氧化成分以减轻CaLas产生的ROS的破坏性影响有关。有人建议[38这类蛋白质可能被认为是在田间种植中用于检测葡萄破坏性疾病“Esca”的候选标记。同样地,高表达的GSTs是对HLB有效耐受的基因型的潜在候选标记。需要对大量的基因型进行进一步的研究。
病原相关(PR)蛋白是植物抵御生物攻击的防御蛋白[39].与脐橙相比,人民蕉诱导的pr蛋白更多,与不同的耐受性相一致。抗性(R)基因特别激活对特定病原体的抗性反应。NBS-LRR蛋白是数量最多的r基因类。NBS-LRR基因受到调控机制的精细控制,仅在生物攻击发生时允许其表达,在不需要时限制其代谢成本[40].这两种NBS-LRR蛋白在Volkameriana中上调可能有助于增强HLB疾病的耐受性。热休克蛋白(Heat shock proteins, HSP)是一种分子伴侣蛋白,在非共价蛋白的折叠或展开、组装和修饰中具有重要功能。HLB病中,编码HSP70、HSP82等小热休克蛋白的基因在果实和叶片组织中表达较低[16,41].HSP70、伴侣蛋白- 60kd和伴侣蛋白-60 α在感染葡萄柚中也出现下调[17].在本研究中,HSP81、HSP21和HSP23蛋白被诱导产生,而脐橙中几种HSP蛋白被抑制。综上所述,我们得出结论,在Volkameriana中观察到的一些HSPs的上调可能有助于增加对HLB疾病的耐受性。
整体的新陈代谢
参与光合光反应的关键蛋白质的抑制与淀粉相关途径的上调有关。感染的Volkameriana表现出硝化酶、氧化酶、谷胱甘肽- s转移酶和其他参与氧化还原状态的蛋白的上调。受感染的Volkameriana还表现出扩张素和木葡聚糖内转糖基酶的增强生产。
在两种基因型中HLB通常改变的蛋白质在蛋白质组学水平上加强了数据。WD40重复样蛋白与一些参与蛋白质靶向、降解和糖基化的酶一起上调,如半胱氨酸肽酶3、蛋白酶A1和半胱氨酸蛋白酶。额外的文件5:图S3给出了一个完整的常见调控蛋白列表及其在四种检测蛋白中的丰度柑橘类样本的类别。
方法
材料与实验设计
本研究中使用的柑橘植物材料是从加州柑橘克隆保护计划(CCPP)获得的无病芽材中繁殖的。两岁的Volkameriana (V) (柑橘类×volkameriana)及脐橙(N) (柑橘类×中国)嫁接于柑桔卡里佐砧木(素类(L。[英语泛读材料枳壳trifoliata(L。] Raf)。在加州大学戴维斯分校的封闭研究设施(CRF)中,在17至25°C的自然光下,在温室的花盆中种植树木。每个基因型大约有10棵树被CaLas感染,通过采用标准的倒“T”芽接技术对里斯本柠檬(Lisbon Lemon) (柠檬Burm.f.),以未接种的树木作为未感染的对照。从出芽后3个月开始,每株植物每月使用定量RT-PCR对CaLas种进行检测,如所述[43].选择3 - 4个健康和感染症状树的生物重复,根据健康状况、表型和症状严重程度进行蛋白质组学分析。在8个月时,从每棵树中抽取5到7个处于相同发育阶段的完全展开的叶子,构成生物复制。从受感染的树木中,采集了具有特征的黄色和斑点斑驳外观的叶子。从未感染的对照树中收获相同发育阶段的健康叶片。在采集时,从每棵树的不同部位采集4至6片叶柄,用PCR方法检测CaLas的存在。切下中脉和叶柄,在液氮中冷冻,并在−80°C保存,用于蛋白质提取和iTRAQ分析。叶子的其他部分被用来检测病原体的存在。感染株Ct值< 30,对照组无扩增产物。
蛋白质的提取
使用先前描述的基于苯酚的程序提取蛋白质[44].将叶片置于含有1% (w/w) PVPP的液氮中,用研钵和杵研磨。100 mg植物材料在600 μL提取缓冲液(0.7 M蔗糖、0.1 M KCl、0.5 M Tris-HCl pH7.5、0.5 M EDTA、1 mM PMSF和2% β-巯基乙醇)中重悬。用MM300 TissueLyser (Qiagen)均质两次(每次1分钟)。加入等量的超纯缓冲饱和苯酚(Invitrogen),并按上述方法对混合物进行再均质。在4℃、12000 × g离心15 min后,去除上层苯酚相,在相同的缓冲液中进行再提取。使用5体积饱和醋酸铵(100 mM)在甲醇中在−20℃下过夜,然后在4℃下以12000 × g离心15分钟,从苯酚相中沉淀蛋白质。用4 mL饱和醋酸铵(100 mM)在甲醇中洗涤四次,并干燥10分钟。蛋白质溶解在尿素缓冲液(7 M尿素,2 M硫脲,40 mM Tris, 2% Chaps和18 mM DTT)中。以BSA为标准,Bradford法测定蛋白浓度。
蛋白质样品制备和消化
使用ProteoExtract Protein Precipitation Kit (CalBiochem)对样品进行沉淀。将得到的蛋白颗粒溶于50 mM的三乙基碳酸氢铵(TEAB) 400 μL中,取100 μL进行消化。将500 mM三(2-羧乙基)-磷化氢(TCEP) (Pierce, Rockford, IL)添加到最终浓度为10 mM,样品在90°C下孵卵10分钟以减少二硫键。再加入110 mM碘乙酰胺(IAA),终浓度为15 mM,室温孵育1 h,加入20 μL DTT灭IAA反应。接着以1:25的比例(酶:蛋白质)加入胰蛋白酶(Promega),在37°C下孵育过夜。第二天,样品用C18 Macro Spin柱(Nest Group)脱盐,真空离心干燥。
串联质量标签
脱盐和冻干的样品在50 mM TEAB中重悬,取~30ug胰蛋白酶消化肽进行TMT标记。分别以报告离子m/z = 126.1、127.1、128.1、129.1在41 μL乙醇中进行TMT标记,室温孵卵60min。加入8 μL 5%羟胺(v:v)淬灭反应,真空离心,C18 Macro Spin柱(Nest Group)脱盐。在强阳离子交换分馏之前,样品再次真空离心。
汇总tmt标记样品的SCX分馏
强阳离子交换(SCX)使用SCX SpinTips Sample Prep Kit (ProteaBio)进行。每个样品在50 μL指定的缓冲液中重悬,每个样品在SCX分离前收集~10 μg。通过在10%乙腈中逐步加入20、40、60、80、100、150、250和500 mM甲酸铵对样品进行分馏。所有八个组分,包括最初的结合流,都被真空离心以去除任何乙腈,并使用C18 Macro Spin柱(Nest Group)脱盐。
质/ MS分析
LC分离采用Waters Nano Acquity UHPLC (Waters Corporation), Proxeon纳米喷雾源。每个SCX馏分(共9个)在2%乙腈/ 0.1%三氟乙酸中重构,加载到100 μm × 25 mm Magic C18 100 Å 5U反相阱上。用0.1甲酸(a)和100%乙腈(B)梯度洗脱肽,流速为300 nL/min。在60分钟的梯度下,5 - 35b持续50分钟,35 - 80b持续3分钟,80b持续1分钟,80 - 5b持续1分钟,最后保持5% B持续5分钟。
质谱采集于Orbitrap Q Exactive Plus质谱仪(赛默飞世尔科学公司)。动态排除15秒。获得的MS光谱分辨率为70000,目标离子为1 × 106个或最大注入时间为30 MS。获得的MS/MS光谱分辨率为17500,目标离子为5 × 104个或最大注入时间为50 MS,固定第一质量为110 m/z。采用高能量碰撞解离进行肽片段拆分,归一化碰撞能值为30。未分配电荷态以及+1和离子> +5被排除在MS/MS碎片之外。
数据分析
提取串联质谱,并对电荷态进行反卷积和脱同位素。所有MS/MS样品均使用X!Tandem (The GPM, thegpm.org;X版本!双人大锤(2013.09.01.1))。X !小组被安排去搜查素类基因组(http://www.ncbi.nlm.nih.gov/protein/?term=txid2706(2014年3月)和NCBInr柑橘数据库(155,237个条目,2014年3月)假设消化酶胰蛋白酶。X !串列的片段离子质量耐受性为20ppm,母体离子耐受性为20ppm。赖氨酸的TMT6plex和n端在X!串联作为固定改装。
使用Scaffold Q+(版本Scaffold_4.4.0, Proteome Software Inc., Portland, OR)定量基于标签的定量(iTRAQ, TMT, SILAC等)肽和蛋白质鉴定。如果通过Scaffold Local FDR算法能够以99.0%的概率建立肽识别,则可以接受肽识别,该算法对应于0.20的光谱诱饵FDR和5.0%的蛋白质诱饵FDR,每个蛋白质有1个识别肽。蛋白质概率由蛋白质先知算法分配[45].含有相似多肽且不能单独根据MS/MS分析进行区分的蛋白质被分组以满足简约原则。具有显著肽证据的蛋白质被分组成簇。根据i-Tracker中描述的算法将具有显著肽证据的蛋白质分组为簇[46].在每次采集过程中对单个定量样本进行归一化处理。每个肽鉴定的强度在指定的蛋白质内被归一化。所有归一化计算均使用中位数对数据进行乘法归一化。差异表达蛋白采用排列试验分析。
统计和功能数据挖掘
使用Scaffold 4对蛋白质组学数据进行首次功能、注释和定量分析。为每个测序和鉴定的肽确定拟南芥的同源物、注释、独特的肽段和谱计数以及标准化定量值。数据被猛烈抨击柑橘(l)和Candidatus亚洲自由杆菌(菌株psy62)基因组。通过blastx将每个测序肽段的同源物(e值< 10-4)确定到拟南芥预测蛋白的TAIR数据库(TAIR10_- pep_20101028;[47])。Blastx输出使用自定义脚本来计算单个柑橘肽序列和拟南芥蛋白质之间的最佳对应关系,基于每个序列的整个长度的比对。显着差异表达蛋白的列表(p各基因型(感染/健康)两两比较,确定log2倍变化> 0.5或< - 0.5的绝对值< 0.05。使用MeV软件进行统计分析。差异调控蛋白(拟南芥直系植物)的功能使用MapMan可视化[48].利用DAVID Bioinformatics资源6.7基于KEGG map进行基因集富集分析。将各基因型在感染过程中上调或下调的各蛋白对应的拟南芥同源基因作为基因列表载入DAVID (p< 0.05)。为每种柑橘蛋白确定拟南芥同源物,并将差异调控蛋白列表与蛋白质组学分析鉴定的所有蛋白进行比较,获得基因集富集分析。
GSEA使用PageMan可视化工具进行Wilcoxon检验(无校正,ORA截断值为1.0)。主成分分析(PCA)使用SAS II (2008) SAS/STAT软件(SAS Institute)进行。对基因表达数据的比值矩阵进行主成分分析,考察各靶基因对样本类分离的贡献。基于前两个主成分构建了一个双标图。
缩写
2-DE,双向电泳;ABC转运蛋白,atp结合盒式转运蛋白;ADPase, ADP葡萄糖焦磷酸酶;BAK1, bcl2拮抗剂/杀手1;写到,CandidatusLiberibacter asiaticus;柑橘克隆保护计划(CCPP);密闭研究设施;CYP711A1,细胞色素P450, 711家族,A亚家族,多肽1;DMAPP,二甲基烯丙基焦磷酸盐;DUF26,未知函数域26;乙烯等;GASA1, GAST1蛋白同源物1;GPT2,葡萄糖-磷酸转运蛋白2;谷胱甘肽s转移酶; HLB, Huanglongbing; HSP, Heat shock proteins; IAA, Indole 3 acetic acid; ICP-MS, Inductively coupled plasma mass spectrometry; IPP, Isopentenyl pyrophosphate; iTRAQ, Isobaric tags for relative and absolute quantitation; JA, Jasmonic acid; LRR, Leucine rich repeats; MVA, mevalonate pathway; N, Navel orange; NBS-LRR, Nucleotide-binding site–leucine-rich repeat; PAL, Phenylammonialyase; PAMP, Pathogen-associated molecular patterns; PCA, Principal component analysis; PEP, phospho-enol-pyruvate; PPM, Parts-per-million; RHM1, UDP-L-rhamnose synthase; RLKs, receptor-like kinases; SA, Salicilic acid; SAUR, small auxin-up RNA; SCX, Strong cation exchange; TCA cycle, Tricarboxylic acid cycle; TCEP, Tris (2-carboxyethyl)-phosphine; TCH4, xyloglucanxyloglucosyltransferase; TEAB, Triethyl ammonium bicarbonate; TMT labeling, Tandem mass tags; UXS2, UDP-glucuronic acid decarboxylase 2; UXS6, UDP-glucuronic acid decarboxylase 6; V, Volkameriana
参考文献
- 1.
Bove JM。黄龙病:一种破坏性的、新出现的、百年的柑橘病害。植物病理学杂志。2006;88:7-37。
- 2.
黄龙冰病早期超微结构发育的研究。细菌学。2010;100:949-58。
- 3.
Jagoueix S, Bové JM, Garnier M.柑桔黄化病韧皮部限制菌是变形菌门α亚群的成员。中华微生物学杂志,1994;44:397-86。
- 4.
Sechler A, Schuenzel EL, Cooke P, Donnua S, Thaveechai N, Postnikova E, Stone AL, Schneider WL, Damsteegt VD, Schaad NW。与黄龙冰相关的“亚洲自由念珠菌”、“非洲念珠菌”和“美洲念珠菌”的培养。植物病理学。2009;99:480 - 86。
- 5.
Folimonova SY, Robertson CJ, Garnsey SM, Gowda S, Dawson WO。不同基因型柑桔在不同条件下对黄龙病的反应研究。植物病理学。2009;99:1346-54。
- 6.
弗雷泽LR,辛格D.印度柑橘品种对绿化病毒的反应。进:查普曼HD,编辑。Proc. 1 Int。柑橘协会。第一卷,加州大学河滨分校,1969年。365 - 6页。
- 7.
Manjunath KL, Halbert SE, Ramadugu C, Webb S, Lee RF。佛罗里达黄龙冰柑橘中“亚洲自由念珠菌”的检测及其在柑橘管理中的重要性。植物病理学。2008;98:387 - 96。
- 8.
Ramadugu C, Keremane ML, Halbert SE, Duan Y, Roose M, Stover E, Lee RF。长期的田间评价显示HLB抗性柑橘类不相关的亲戚(联系)。工厂说。http://dx.doi.org/10.1094/PDIS-03-16-0271-RE。
- 9.
黄志刚,李志刚。柑桔16个基因型对' '的易感性CandidatusLiberibacter asiaticus”。植物科学,2016;100:1080-6。
- 10.
阿尔布雷希特U,费恩O,鲍曼KD。不同柑桔砧木品种代谢变化与对黄龙冰的不同反应有关。植物杂志。物化学。2016;107:33-44。
- 11.
Tyler HL, Roesch LFW, Gowda S, Dawson WO, Triplett EW。用宏基因组方法确定黄龙冰感染的柑橘韧皮部“自由念珠菌”序列及微生物多样性。植物微生物学报。2009;22:1624-34。
- 12.
段y,周l, Hall DG, Li W, Doddapaneni H, Lin H, Liu L, Vahling CM, Gabriel DW, Williams KP, Dickerman A, Sun Y, Gottwald T.通过宏基因组学获得柑橘黄龙冰细菌“Candidatus Liberibacter asiaticus”的全基因组序列。MPMI。2009; 22:1011-20。
- 13.
阿尔布雷希特U,鲍曼KD。柑桔(Citrus sinensis, L.)基因表达奥斯贝克(Osbeck)在感染细菌病原体亚洲自由念珠菌(Candidatus Liberibacter asiaticus)后,在佛罗里达州引起黄龙冰。植物科学进展,2008;
- 14.
金建生,李建林,王宁。甜橙对亚洲自由念珠菌感染的反应:显微和微阵列分析。植物病理学。2009;99:50-7。
- 15.
Martinelli F, Uratsu SL, Albrecht U, Reagan RL, Phu ML, Britton M, Buffalo V, Fass J, Leicht E, Zhao W, Lin D, D 'Souza R, Davis CE, Bowman KD, Dandekar AM。柑桔果实对黄龙病反应的转录组分析。科学通报。2012;7:e38039。
- 16.
Martinelli F, Reagan RL, Uratsu SL, Phu ML, Albrecht U, Zhao W, Davis CE, Bowman KD, Dandekar AM。阐明黄龙病发病机制的基因调控网络。科学通报。2013;8:e74256。
- 17.
宁戈,林华,段勇,李志强。“亚洲自由念珠菌”感染对症状前和症状葡萄柚(柑橘)植物蛋白质组学特征和营养状况的影响。BMC植物生物学,2013;13:59。
- 18.
范杰,陈超,余强,Brlansky RH,李志刚,Gmitter FG。“亚洲自由念珠菌”侵染甜橙的iTRAQ蛋白质组和转录组比较分析。植物科学学报。2011;43(3):344 - 344。
- 19.
Cevallos-Cevallos JM, García-Torres R, Etxeberria E, reye - de - corcuera JI。气相色谱-质谱(GC-MS)分析黄龙冰柑橘顶空和液体提取物的代谢组学差异及“瓦伦西亚”甜橙叶片缺锌。植物化学学报,2011;22:236-46。
- 20.
Cevallos-Cevallos JM, Futch DB, Shilts T, Folimonova SY, reye - de - corcuera JI。黄龙冰不同敏感性柑橘品种的GC-MS代谢组学鉴别植物化学学报,2012;
- 21.
在耐受亚洲自由念珠菌的柑橘品种中,与植物防御有关的氨基酸含量较高。植物信号行为研究。2016;4:e1171449。
- 22.
Nakamura T, Yamamori M, Hirano H, Hidaka S, Nagamine T.蜡质(无直链淀粉)小麦的生产。MGG Mol Gen Gen 1995; 248:253-59。
- 23.
Tauzin AS, Giardina T.蔗糖和转化酶,植物防御生物胁迫反应的一部分。植物科学进展(英文版);
- 24.
赫伯斯K,高畑Y, Melzer M, Mock HP, Hajirezaei M, Sonnewald U.马铃薯病毒Y与烟草相互作用过程中碳水化合物分配的调控。植物病理学杂志2000;1:51-9。
- 25.
Cheynier V, Comte G, Davies KM, Lattanzio V, Martens S.植物酚类物质:生物合成、遗传学和生态生理学的最新进展。植物化学学报,2013;
- 26.
杨晓明,杨晓明,杨晓明,杨晓明,Argüello杨晓明。花生苯丙氨酸解氨酶基因序列分析及其对菌核菌抗性的影响。中国植物病理学杂志,2013;
- 27.
Nakashita H, Yasuda M, Nitta T, Asami T, Fujioka S, Arai Y, Sekimata K, Takatsuto S, Yamaguchi I, Yoshida S.油菜素类固醇在烟草和水稻的广泛抗病力中发挥作用。植物J. 2003; 33:887-98。
- 28.
Chinchilla D, Zipfel C, Robatzek S, Kemmerling B, Nürnberger T, Jones JDG, Felix G, Bolle T.鞭毛蛋白诱导的受体FLS2和BAK1复合物启动植物防御。大自然。2007;448:497 - 500。
- 29.
Pieterse CMJ, Leon-Reyes A, Van der Ent S, Van wes SCM。植物免疫中的小分子激素网络。生物化学学报,2009;5:308-16。
- 30.
王晓明,王晓明,王晓明,等。小麦抗病基因Lr10的克隆及分子生物学特性研究。植物J. 1997; 11:45-52。
- 31.
Jahn T, Fuglsang AT, Olsson A, Brüntrup IM, Collinge DB, Volkmann D, Sommarin M, Palmgren MG, Larsson C. 14-3-3蛋白直接与植物质膜hc - atp酶c端区相互作用。《植物细胞》1997;9:1805-14。
- 32.
王丽娟,王志强,王志强,等。谷胱甘肽转移酶的结构、功能和演化及其对古酶超家族非哺乳动物成员的影响。生物化学学报,2001;36:1 - 16。
- 33.
Edwards R, Dixon DP, Walbot V.植物谷胱甘肽s转移酶:在疾病和健康中具有多种功能的酶。植物科学进展2000;5:193-98。
- 34.
马斯卡。谷胱甘肽s -转移酶在植物中的功能与调控。植物物理学报。1996;47:127-58。
- 35.
Shigeoka S, Ishikawa T, Tamoi M, Miyagawa Y, Takeda T, Yabuta Y, Yoshimura K.抗坏血酸过氧化物酶同工酶的调控与功能。中国科学(d辑),2002;
- 36.
Teixeira FK, Menezes-Benavente L, Galvão VC, Margis R, Margis- pinheiro M.水稻抗坏血酸过氧化物酶基因家族编码在不同亚细胞区室的功能不同的异构体。足底。2006;224:300-14。
- 37.
阿尔布雷希特U,鲍曼KD。易感和耐受柑橘对“亚洲自由念珠菌”感染的转录反应。植物科学进展(英文版);
- 38.
陈志伟,陈志伟,陈志伟,等。葡萄枯萎病中衣原孢Phaeomoniella chlamydospora和Phaeoacremonium aleophilum发育和超微结构特征与木质部退化的关系。中国植物病理学杂志,2009;
- 39.
Lionetti V. PECTOPLATE:植物在生物胁迫期间果胶甲基酯酶、果胶酶和低聚半乳糖醛酸酯的同时表型。前沿植物学报2015;6:1-8。
- 40.
Marone D, Russo MA, Laidò G, De Leonardis AM, Mastrangelo AM。植物核苷酸结合位点-富亮氨酸重复序列(NBS-LRR)基因:宿主防御反应的积极守护者。中国生物化学杂志,2013;
- 41.
Martinelli F, Ibanez AM, Reagan RL, Phu M, Dandekar AM。柑桔果皮胁迫反应:黄龙冰病和膨化症宿主反应的比较分析。科学通报。2015b; 192:409-20。
- 42.
Dandekar AM, Martinelli F, Davis CE, Bhushan A, Zhao W, Fiehn O, Skogerson K, Wohlgemuth G, D’souza R, Roy S, Reagan RL, Lin D, Cary RB, Pardington P, Gupta G.特色作物无症状病检测和管理的早期寄主反应分析。中华医学杂志,2010;30:277-89。
- 43.
李伟,Hartung JS, Levy L.柑橘黄龙冰相关自由念珠菌的实时荧光定量PCR检测与鉴定。微生物学杂志。2006;66:104-15。
- 44.
许志刚,李志刚,李志刚,等。豌豆上胚轴核糖核酸和蛋白质代谢的研究。植物物理学报。1983;73:817-21。
- 45.
Shadforth IP, Dunkley TP, Lilley KS, Bessant C. i-Tracker:用于使用iTRAQTM的定量蛋白质组学。BMC基因组学,2005;6:145。
- 46.
Nesvizhskii A, Keller A, Kolker E, Aebersold R, Nesvizhskii AI, Keller A, Kolker E, Aebersold R.通过串联质谱识别蛋白质的统计模型。化学学报。2003;25:446 - 58。
- 47.
Lamesch P, Berardini TZ, Li D, Swarbreck D, Wilks C, Sasidharan R, Muller R, Dreher K, Alexander DL, Garcia-Hernandez M, Karthikeyan AS, Lee CH, Nelson WD, Ploetz L, Singh S, Wensel A, Huala E.拟南芥信息资源:改进的基因注释和新工具。核酸决议2012;40(数据库issue): D1202-10。
- 48.
Thimm O, Bläsing O, Gibon Y, Nagel A, Meyer S, Krüger P, Selbig J, Müller LA, Rhee SY, Stitt M. MAPMAN:一个用户驱动的工具,将基因组学数据集显示在代谢途径和其他生物过程的图表上。植物学报,2004;37:914-39。
确认
作者希望感谢包含研究设施的Kristine Godfrey对受感染植物材料的帮助,蛋白质组学核心设施UCD基因组中心的Brett S Phinney和Darren Webber进行蛋白质组学分析,Ana Maria Ibanez, UCD植物科学系在蛋白质提取阶段的建议和Mary Lou Mendum对手稿的编辑审查。
资金
这项工作得到了柑橘研究与发展基金会的资助。
数据和材料的可用性
作者的贡献
AMD和FM构思并设计了这项研究。DD开发了植物材料。FM和DD进行蛋白质组学实验。FM, RLR和VF设计了这些数据,并对统计分析做出了贡献。AMD负责协调所有工作。所有作者都阅读并批准了最终的手稿。
相互竞争的利益
作者声明他们没有相互竞争的利益。
发表同意书
所有作者同意发表本作品的所有内容。我们的稿件不包含任何个人数据,因此属于“不适用”类别。
伦理批准并同意参与
这项工作不涉及对人类或动物的任何研究。这里报告的实验研究符合机构、国家或国际准则。该研究的样本在加州大学戴维斯分校的封闭研究设施中进行,该隔离设施遵循所有相关的联邦和地方指导方针,并获得了联邦机构的批准和许可,并获得了当地机构生物安全委员会的项目批准。
我们已获得适当的许可和/或许可证进行这项研究,它不涉及《濒危野生动植物种贸易公约》所包括的物种。
作者信息
从属关系
相应的作者
附加文件
附加文件1:表S1。
对照组和侵染脐橙叶片组织中宿主蛋白的差异调节(p值< 0.05)。拟南芥直系同源物和对数折叠比。(xls67kb)
附加文件2:表S2。
对照和侵染的Volkameriana叶片组织中宿主蛋白的差异调节(p值< 0.05)。拟南芥直系同源物和对数折叠比。(xls55kb)
附加文件3:图S1。
HLB疾病对蛋白质组变化的代谢概述,比较两种柑橘基因型的影响。(PDF 115kb)
附加文件4:图S2。
两个柑橘基因型中hlb差异调节蛋白参与次级代谢。每个彩色的正方形表示与生物合成途径相关的蛋白质的表达变化(见颜色键)。(TIF 268kb)
附加文件5:图S3。
HLB通常调节的蛋白质列表,比较两个柑橘基因型的影响。VC = Volkameriana对照(健康),VI = Volkameriana感染,NC =脐橙对照(健康),NI =脐橙感染。标注和Citrus ID。(PDF 121kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
马丁内利,F.,里根,R.L.,多兰,D.。et al。蛋白质组学分析强调了解毒途径在增加黄龙病耐受性中的作用。BMC植物生物学16日,167(2016)。https://doi.org/10.1186/s12870-016-0858-5
收到了:
接受:
发表:
关键字
- 柑橘类
- Huanglongbing
- Candidatus liberibacter
- iTRAQ
- 蛋白质组
- 蛋白质组学