- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
BngydF4y2Ba中外职业gydF4y2Ba小孢子重编程后是否逐步诱导胚胎发生,与果胶去酯化和细胞分化有关gydF4y2Ba芸苔属植物显著gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba16gydF4y2Ba,文章号:gydF4y2Ba176gydF4y2Ba(gydF4y2Ba2016gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
果胶是植物细胞壁的主要成分之一。它们以高度甲基化的形式分泌到细胞壁,可以被果胶甲基酯酶(PMEs)去酯化。果胶甲基酯化程度在植物发育过程中发生变化,PMEs参与了不同植物发育过程中的细胞壁重塑。然而,果胶相关的壁重塑在不同细胞类型和过程中的功能意义尚不清楚。在体内,小孢子遵循配子体途径并分化形成花粉粒。在体外,小孢子可以通过胁迫处理重新编程,成为一个全能细胞,开始增殖并遵循胚胎发生途径,这一过程被称为小孢子胚胎发生。gydF4y2Ba
结果gydF4y2Ba
为了研究小孢子胚胎发生过程中果胶酯化水平的改变是否与小孢子胚胎发生过程中果胶酯化水平的改变有关,从而导致细胞壁重塑,本研究分析了小孢子胚胎发生过程中PME的表达和果胶酯化程度的动态变化,并与配子体发育过程进行了比较gydF4y2Ba芸苔属植物显著gydF4y2Ba.采用了包括Bn在内的多学科方法gydF4y2Ba中外职业gydF4y2Ba采用定量RT-PCR、荧光原位杂交、免疫斑点杂交和JIM5和JIM7抗体免疫荧光技术对果胶进行基因表达分析,发现低甲基化和高甲基化果胶。结果表明,在发育后期,细胞分化涉及到Bn的诱导gydF4y2Ba中外职业gydF4y2Ba在合子胚胎中也检测到表达和果胶去酯化过程,为小孢子胚胎发生模拟合子胚胎发生提供了额外的证据。相比之下,早期小孢子胚胎发生、全能性和增殖与低表达Bn有关gydF4y2Ba中外职业gydF4y2Ba还有大量的酯化果胶。gydF4y2Ba
结论gydF4y2Ba
结果表明,小孢子发育过程的变化涉及果胶酯化过程的变化,果胶酯化过程与增殖、分化过程相关,可能导致细胞壁重塑。研究结果表明,果胶酯化和细胞壁构型在小孢子全能性、胚胎发生诱导和进展中的作用与果胶相关。gydF4y2Ba
背景gydF4y2Ba
细胞壁作为植物细胞的最外层,参与许多功能,如与环境的相互作用,生长和发育,细胞间通信,以及决定细胞的大小和形状。植物细胞壁是高度复杂的结构,由多种多糖(纤维素、半纤维素和果胶)、酶和结构蛋白组成,它们在植物生长和适应过程中改变其组成[gydF4y2Ba1克ydF4y2Ba].果胶是原代植物细胞壁的主要成分;它们以高度甲基化的形式分泌到细胞壁中,并且可以去酯化gydF4y2Ba在murogydF4y2Ba通过果胶甲基酯酶或PMEs [gydF4y2Ba2gydF4y2Ba].果胶的甲基酯化作用影响其均半乳糖醛酸结构域(HGA),并在植物生长发育过程中发生显著变化[gydF4y2Ba3.gydF4y2Ba].PMEs参与重要的生理过程,如小孢子发生、花粉生长、种子萌发、根发育、叶生长极性、茎伸长、果实成熟和组织完整性丧失[gydF4y2Ba4gydF4y2Ba- - - - - -gydF4y2Ba14gydF4y2Ba].gydF4y2Ba
小孢子胚胎发生是一种广泛使用的方法,通过获得小孢子胚胎和双单倍体植物来产生遗传变异,在植物育种中有许多应用[gydF4y2Ba15gydF4y2Ba].这一过程包括对未成熟花粉(小孢子)进行重编程,使其朝着不同的发育途径发展,并开始增殖和分化事件,最终导致胚的形成以及单倍体和双单倍体植物的再生[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba].据报道,在一些草本和木质物种中,伴随小孢子重编程过程的是各种细胞活动和亚细胞区室结构组织的变化[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba18gydF4y2Ba- - - - - -gydF4y2Ba23gydF4y2Ba].不同的研究表明,体细胞胚胎发生伴随着细胞壁结构和分子组成的改变[gydF4y2Ba24gydF4y2Ba].此外,体细胞胚胎发生和器官发生的许多分子标记已在细胞壁中被发现[gydF4y2Ba25gydF4y2Ba- - - - - -gydF4y2Ba28gydF4y2Ba].具体来说,研究gydF4y2Ba甜椒gydF4y2Ba已经报道了主要细胞壁聚合物木葡聚糖和鼠李糖半乳糖酸II果胶结构域的分布模式,以及酯化和非酯化果胶在配子体和胚胎发育中的比例的差异[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].在其他几个物种的小孢子胚胎发生的早期阶段,胚胎发生的小孢子和原胚胎中,外壁下有异常厚的细胞壁[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].尽管一些植物细胞壁聚合物在植物发育过程中受到调控,但不同细胞类型和过程中细胞壁变化的功能意义尚不清楚。gydF4y2Ba
果胶甲基酯酶(PMEs, EC 3.1.1.11)催化植物细胞壁内果胶的线性均半乳糖醛酸(HGA)主干中甲基酯的特异性去除[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].去甲基化的HGA既可以形成Ca2+键,也可以成为果胶降解酶(如聚半乳糖醛酸酶)的靶点,影响细胞壁的质地和硬度[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].PMEs是无处不在的酶[gydF4y2Ba2gydF4y2Ba]在所有植物组织和器官,如果实、叶子、花、茎和根中均已发现[gydF4y2Ba33gydF4y2Ba- - - - - -gydF4y2Ba35gydF4y2Ba]以及一些能降解植物细胞壁的微生物或昆虫[gydF4y2Ba36gydF4y2Ba].然而,关于pme作用的实验数据gydF4y2Ba在足底gydF4y2Ba是有限的,许多方面的功能和调节仍有待阐明。在香蕉、栎树、橄榄和胡椒等多种植物中,最近的数据提供了果胶在体细胞胚胎发生过程中发生变化的证据[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba37gydF4y2Ba]和小孢子胚胎发生[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba37gydF4y2Ba];然而,花粉发育和小孢子胚胎发生过程中PME的研究尚未见报道。测序项目产生的数据显示,几种植物物种中存在几种均半乳糖醛酸修饰酶的基因家族,包括果胶甲基酯酶(在[gydF4y2Ba38gydF4y2Ba])。然而,关于PME基因的信息很少gydF4y2Ba芸苔属植物gydF4y2Ba.在gydF4y2Ba芸苔属植物定gydF4y2Ba在美国,只有少数推定的PME异构体序列被注释(NBCI登录号KF268317, KF268318),迄今为止没有任何功能或表达信息。在gydF4y2Ba芸苔属植物olearaceagydF4y2Ba,最近发现了一种新的PMEI (PME抑制剂)基因[gydF4y2Ba39gydF4y2Ba].在gydF4y2Ba芸苔属植物显著gydF4y2Ba,据我们所知,只有一个BngydF4y2Ba中外职业gydF4y2Ba基因序列已被鉴定和鉴定[gydF4y2Ba40gydF4y2Ba],在目前的工作中,正是该基因序列被用于表达分析。gydF4y2Ba
JIM5和JIM7单克隆抗体已被报道在揭示果胶酯化模式方面特别有用[gydF4y2Ba41gydF4y2Ba].JIM5较好地结合到至少四个连续的非酯化GalA残基上,并标记相对非酯化的果胶表位。相比之下,JIM7与邻近或侧边非酯化GalA残基的甲基化残基结合,因此显示出相对高度甲基化的果胶表位的存在[gydF4y2Ba42gydF4y2Ba].几项关于抗体JIM5和JIM7在不同植物组织和器官中检测到的抗原分布的研究提供了证据,证明果胶的去酯化参与了特定的发育过程,特别是酯化与非酯化果胶比例的变化,以及两种形式果胶在细胞壁中的差异分布[gydF4y2Ba43gydF4y2Ba- - - - - -gydF4y2Ba45gydF4y2Ba].gydF4y2Ba
为了研究小孢子胚胎发生的发育过程是否涉及PMEs完成的果胶酯化水平的变化,这表明在这一过程中细胞壁的重塑,我们分析了Bn的动力学gydF4y2Ba中外职业gydF4y2Ba配子体发育和胁迫诱导小孢子胚胎发生两个发育过程中果胶酯化的基因表达和程度gydF4y2Ba芸苔属植物显著gydF4y2Ba使用多学科方法。Bn的表达谱gydF4y2Ba中外职业gydF4y2Ba采用qRT-PCR和荧光原位杂交(FISH)技术进行研究。通过gfp标记PME在转化烟叶中的体内定位进行评估。JIM5和JIM7抗体分别识别低甲基化程度和高甲基化程度的果胶,用于免疫斑点-印迹和免疫荧光分析,通过共聚焦显微镜分析,在两个发育途径的特定阶段。结果表明,Bn含量增加gydF4y2Ba中外职业gydF4y2Ba果胶在小孢子胚胎发生和配子体发育过程中甲基酯化状态的表达及发育调控。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
芸苔属植物显著gydF4y2Bal .简历。Topas供体植物由生物研究中心(CSIC,马德里)温室产生的种子生长而成[gydF4y2Ba17gydF4y2Ba].供体植物在受控条件下生长,白天15°C,光周期16 h,晚上10°C。从相应发育阶段的花药中分离出空泡小孢子和分化的花粉粒。在离体小孢子培养物中,通过32°C处理诱导小孢子胚胎发生,如所述[gydF4y2Ba17gydF4y2Ba].体外培养的小孢子是在空泡小孢子发育阶段的供体植物中选择的,这是诱导胚胎发生反应最灵敏的阶段[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].gydF4y2Ba
用于显微分析的固定和冷冻处理gydF4y2Ba
收集新鲜分离的小孢子、花粉粒和不同培养时间的体外样品,在4°C用4%多聚甲醛在磷酸盐缓冲盐水(PBS)中固定过夜。固定后的样品主要通过三种方法进行处理:半薄树脂切片、半薄冷冻切片和低温恒温切片。gydF4y2Ba
为了进行结构分析和免疫荧光,固定样品在4℃下脱水并嵌入Historesin树脂中。在载玻片上收集半薄片;有的用甲苯胺蓝染色,用于结构分析,有的用碘离子细胞化学染色,用于淀粉的优先染色[gydF4y2Ba26gydF4y2Ba],并在亮场显微镜下观察。其他树脂切片用于免疫荧光。gydF4y2Ba
对于免疫荧光和FISH分析,固定样品通过两种主要方法处理。从第一个培养阶段分离出的小孢子、花粉粒和小样本在2.3 M蔗糖中冷冻保护,在液态丙烷中冷冻,并在冷冻微生物室中冷冻切片(Ultracut E Reichert配备FC4 cryounit),而从种子中切除的晚期胚胎发育阶段的固定大培养样本和合子胚胎被嵌入OTC,在干冰上冷冻,并在低温恒温器中切片(Leica Cm 1800)。最后,将标本安装在涂有APTES(3-氨基丙基三乙氧基硅烷,Sigma)的载玻片上,保存于4℃,直到用于免疫荧光和FISH。gydF4y2Ba
抗体gydF4y2Ba
本研究使用的抗体为JIM7和JIM5大鼠单克隆抗体(PlantProbes, Leeds, UK),分别识别高甲基化和低甲基化果胶[gydF4y2Ba41gydF4y2Ba].JIM7与邻近或侧面的非酯化GalA残基的均半乳糖醛酸甲基化残基结合,但不与非酯化均半乳糖醛酸甲基化残基结合,因此显示出相对高度甲基化的果胶表位的存在。JIM5单克隆抗体优选地与至少四个相邻的非酯化GalA残基结合,因此它识别部分甲基酯化的均半乳糖醛酸表位和非酯化的均半乳糖醛酸表位。gydF4y2Ba
免疫荧光gydF4y2Ba
低温切片(厚度20 ~ 40 μm)经甲醇系列脱水-复水渗透,用2%纤维素(Ozonuka R-10)在室温下处理1小时,PBS洗涤,5%牛血清白蛋白(BSA)在PBS中孵育10分钟。相比之下,半薄切片(2 ~ 3 μm厚度)直接用PBS洗涤,5% BSA堵塞。然后,如前所述,对两种类型的切片进行同样的免疫荧光处理[gydF4y2Ba47gydF4y2Ba].切片用相应的初级未稀释抗体孵育,在PBS中洗涤三次(每次5分钟)后,用Alexa Fluor 488标记的抗大鼠抗体(Molecular Probes, Cat。不。A-11001)在PBS中1:25稀释,在黑暗中45分钟。最后,用1 mg/ml DAPI(4 ', 6-二氨基-2-苯基吲哚;Fluka)溶液10分钟,在共聚焦显微镜(徕卡TCS-SP5)中分析。阴性对照用PBS代替一抗。gydF4y2Ba
Immuno-dot-blot化验gydF4y2Ba
该测定方法基本上与前面描述的一样,只是进行了少量修改[gydF4y2Ba29gydF4y2Ba].使用新鲜分离的小孢子、花粉粒和不同培养时间的体外样品。从配子体和胚胎发育的不同时间点采集的25 mg样品中提取提取物;在液氮中均质,然后在50 ml含有50 mM Tris-HCl pH 7.2, 50 mM 1,2-环己基二硝基四乙酸(CDTA)和25 mM二硫苏糖醇的缓冲溶液中均质,并在4°C下以7000 rpm离心10分钟。测定所得上清液的浓度,并将所有样品的浓度调整为1 mg/ml。使用JIM5和JIM7抗体进行免疫点印迹试验时,将调整后的上清液按5 μl等份涂抹在硝化纤维膜(Millipore;并用Ponceau红染色检测总蛋白,作为负载对照。最后,用硝基蓝四氮唑、溴氯吲哚酰磷酸(NBT-BCIP)混合物处理后,抗体识别的表位显露出来。gydF4y2Ba
逆转录聚合酶链反应gydF4y2Ba
从花药中收集新鲜分离的空泡小孢子和花粉粒,以及不同时间点和不同发育阶段(原胚、球状胚和子叶胚)的体外胚胎发生样品。根据制造商的说明,使用RNeasy®Plant Minikit (Qiagen)分离样品中的总RNA。1微克总RNA使用Superscript™II逆转录酶(Invitrogen)进行RT反应。用于Bn的寡核苷酸gydF4y2Ba中外职业gydF4y2Ba表达分析为:5′GGAGCGTCGTTGATGGATGG 3′和3′GTAACCTCGTTCGCCTGACC 5′(accession AY036606)gydF4y2Ba芸苔属植物显著gydF4y2Ba果胶甲酯酶样基因[gydF4y2Ba40gydF4y2Ba].利用HotMaster™Taq DNA聚合酶(Eppendorf) PCR扩增cDNA。PCR产物在1%琼脂糖凝胶上用溴化乙锭染色。带强以相对吸光度单位表示。每个条带密度首先通过将其除以同一通道中的肌动蛋白II条带密度来归一化(以补偿装载到凝胶上的cDNA的变化)。以空泡小孢子为参考,用各发育阶段归一化条带密度除以空泡小孢子归一化条带密度,计算各发育阶段基因表达的相对增减。因此,空泡小孢子带的相对密度表示为1。gydF4y2Ba
实时定量PCR (qRT-PCR)gydF4y2Ba
采用体外培养的小孢子胚胎发生发育阶段(空泡小孢子(诱导过程的起点)、前胚(早期胚胎发生阶段)和球状胚(胚胎发生晚期,胚胎分化开始阶段)的基因表达量进行定量分析。果胶甲基酯酶基因表达分析(gydF4y2BaBnPMEgydF4y2Ba)在iQ™5实时PCR检测系统(Biorad)上使用SsoAdvanced™Universal SYBR®Green Supermix进行实时定量PCR。cDNA作为PCR模板,使用Superscript™II逆转录酶(Invitrogen)从分析阶段的不同培养样品中分离出的总RNA生成,根据[gydF4y2Ba48gydF4y2Ba].gydF4y2Ba
所使用的寡核苷酸为:5 ' GGAGCGTCGTTGATGGATGG 3 '和3 ' GTAACCTCGTTCGCCTGACC 5 'gydF4y2Ba中外职业gydF4y2Ba基因的gydF4y2Ba芸苔属植物显著gydF4y2Ba(AY036606),该基因编码果胶甲基酯酶样基因[gydF4y2Ba40gydF4y2Ba].所有qPCR反应均重复3次。热循环设置如下:在95℃初始变性30秒,然后进行40次循环,每次95℃为5秒,56℃为30秒。每次运行后,通过将样品从65°C加热到95°C,获得解离曲线以检查扩增特异性。采用cDNA序列稀释法,根据[gydF4y2Ba49gydF4y2Ba].肌动蛋白II (gydF4y2Ba行为gydF4y2Ba)作为内参基因。PCR循环结束时,采用Bio-Rad CFX Manager 3.0 (3.0.1224.1015) (Biorad)软件对数据进行分析,采用Livak计算方法[gydF4y2Ba50gydF4y2Ba].gydF4y2Ba
荧光gydF4y2Ba原位gydF4y2Ba杂交(鱼)gydF4y2Ba
如前所述,通过使用Superscript™II逆转录酶(Invitrogen)进行RT反应,从样品的总RNA中获得总cDNA。cDNA的扩增gydF4y2Ba甘蓝型油菜PMEgydF4y2Ba-gydF4y2Ba就像gydF4y2Ba用相同的Bn进行PCR扩增,得到完整的cds序列gydF4y2Ba中外职业gydF4y2BaRT-PCR检测采用上述引物。从琼脂糖凝胶中分离出约500 bp的扩增片段,并使用pGEM®T-Easy克隆系统(Promega)克隆。digg - rna - pme探针使用digg - rna标记试剂盒(Roche)体外转录生成。gydF4y2Ba
低温器切片通过甲醇系列脱水-再水化渗透,用2%纤维素(Ozonuka R-10)处理1小时,清洗并干燥。半薄冷冻切片在PBS中清洗以去除蔗糖并干燥。gydF4y2Ba
RNA/RNA原位杂交如所述[gydF4y2Ba48gydF4y2Ba]使用dig-PME RNA探针稀释1/50的杂交缓冲液,在50°C,过夜。杂交后洗涤分别在4xSSC、2xSSC和0,1 xssc中进行。如前所述,用抗地高辛抗体的免疫荧光检测杂交信号[gydF4y2Ba48gydF4y2Ba].PBS洗涤后,切片用DAPI反染色,在Mowiol中安装,并在共聚焦显微镜下观察(徕卡TCS-SP5)。用传感探头进行控制。gydF4y2Ba
PME的体内亚细胞定位gydF4y2Ba
PME-GFP融合蛋白使用Invitrogen (Carlsbad, CA, USA)开发的Gateway™克隆技术生成。引物由罗氏应用生物系统公司合成。该构建物在35S启动子的控制下表达。见面gydF4y2Ba烟草gydF4y2Ba(简历。小哈瓦那)生长在25°C的植物用于gydF4y2Ba根癌土壤杆菌gydF4y2Ba(菌株GV3101)介导的稳定DNA整合[gydF4y2Ba51gydF4y2Ba].用于植物转化的细菌光密度(OD 600)为0.05。在侵染后48 ~ 72 h对转化叶片下表皮进行分析。与野生型植物平行进行适当的控制,并使用不含PME的GFP结构渗透烟叶。图像分析采用共聚焦激光扫描显微镜(Leica TCS-SP5)在Ar激光激发线488 nm下检测GFP的荧光信号,在633 nm处激发检测叶绿素的自身荧光。gydF4y2Ba
结果gydF4y2Ba
BngydF4y2Ba中外职业gydF4y2Ba配子体和胚胎发生两种小孢子发育途径及合子胚胎的表达模式gydF4y2Ba
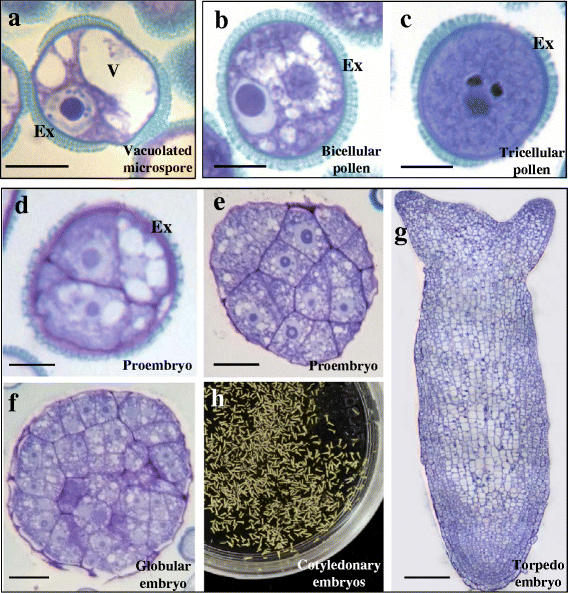
空泡小孢子是诱导胚胎发生的反应性发育阶段[gydF4y2Ba46gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].其特征是巨大的细胞质液泡将细胞核推向外周位置(图。gydF4y2Ba1gydF4y2Ba)。在此阶段,小孢子呈内薄壁,即内壁,外壁为孢粉素花粉壁。当配子体发育之后,空泡小孢子经历了不对称分裂,形成了双细胞花粉粒,其中含有较大营养细胞的细胞质内的小生殖细胞(图2)。gydF4y2Ba1 bgydF4y2Ba)。后来,生殖细胞分裂形成精细胞,产生三细胞花粉(图。gydF4y2Ba1 cgydF4y2Ba)。然而,体外热处理(32°C)诱导胚胎发生后,空泡小孢子对称分裂形成两个细胞的前胚胎,其细胞和核的大小和组织相似(图2)。gydF4y2Ba1 dgydF4y2Ba)。在随后的分裂后,形成多细胞原胚胎(图。gydF4y2Ba1 egydF4y2Ba)。在后期,在外膜破裂和细胞增殖增加后,形成球状胚胎(图2)。gydF4y2Ba1 fgydF4y2Ba)。随着胚胎发生的进展,胚胎拉长,形成心形胚胎和鱼雷胚胎(图2)。gydF4y2Ba1克gydF4y2Ba),最终增大并分化形成成熟的子叶胚(图。gydF4y2Ba1 hgydF4y2Ba)。gydF4y2Ba
两种小孢子途径的主要阶段:配子体发育和小孢子胚胎发生。gydF4y2Ba一个gydF4y2Ba-gydF4y2BaggydF4y2Ba半薄切片,甲苯胺蓝染色。gydF4y2Ba一个gydF4y2Ba有液泡的小孢子。gydF4y2BabgydF4y2Ba-gydF4y2BacgydF4y2Ba配子体发育,在体内。gydF4y2BabgydF4y2Ba双细胞的花粉。gydF4y2BacgydF4y2Ba三细胞成熟花粉。gydF4y2BadgydF4y2Ba-gydF4y2BahgydF4y2Ba体外小孢子胚胎发生。gydF4y2BadgydF4y2Ba两个原胚。gydF4y2BaegydF4y2Ba多细胞原胚。gydF4y2BafgydF4y2Ba球状胚胎。gydF4y2BaggydF4y2Ba晚期鱼雷胚胎。gydF4y2BahgydF4y2Ba培养皿中子叶胚胎的全景图。例:外核,V:液泡。酒吧:gydF4y2Ba一个gydF4y2Ba-gydF4y2BadgydF4y2Ba, 10 μm;gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba, 20 μm;G, 50 μmgydF4y2Ba
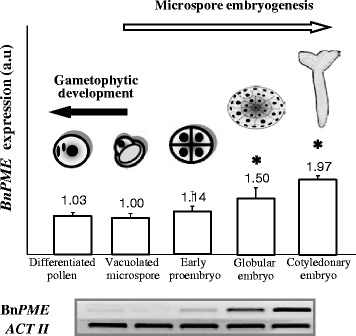
的时态表达模式gydF4y2Ba芸苔属植物显著gydF4y2Ba果胶甲基酯酶(BngydF4y2Ba中外职业gydF4y2Ba),在花粉发育和小孢子胚胎发生的不同阶段进行RT-PCR分析;BngydF4y2Ba中外职业gydF4y2Ba为细胞壁内负责果胶HGA去甲基酯化的酶之一编码。RT-PCR选择“空泡小孢子”作为两种发育途径的起始阶段,“分化花粉”作为配子体发育途径,“早期原胚”、“球状胚”和“子叶胚”作为小孢子胚胎发生途径的起始阶段。RT-PCR分析显示BngydF4y2Ba中外职业gydF4y2Ba在小孢子胚胎发生的晚期,其表达上调,而在小孢子重编程和胚胎发生启动后,在早期原胚以及花粉发育过程中,其表达降低(图2)。gydF4y2Ba2gydF4y2Ba)。以空泡小孢子的表达量为单位,与其他阶段进行比较。BngydF4y2Ba中外职业gydF4y2Ba表达在小孢子胚胎发生过程中逐步诱导;球形胚胎和鱼雷胚胎的表达水平高于空泡小孢子,子叶胚胎的表达水平最高(图。gydF4y2Ba2gydF4y2Ba)。gydF4y2Ba
Bn的表达分析gydF4y2Ba中外职业gydF4y2Ba在配子体发育和小孢子胚胎发生过程中,通过RT-PCR检测到基因。半定量RT-PCR扩增产物的代表性琼脂糖电泳凝胶。的相对变化gydF4y2Ba中外职业gydF4y2Ba不同发育阶段的条带强度:小孢子空泡化、花粉分化(配子体发育)、早期原胚、球状胚、子叶胚(小孢子胚胎发生)。列表示Bn mRNA表达的平均值gydF4y2Ba中外职业gydF4y2Ba±SE (bar)为三个独立实验,每个实验重复三个,单位为任意单位(a.u)。星号表示与空泡小孢子的显著差异(学生的gydF4y2BatgydF4y2Ba以及在gydF4y2BaPgydF4y2Ba≤0.05)gydF4y2Ba
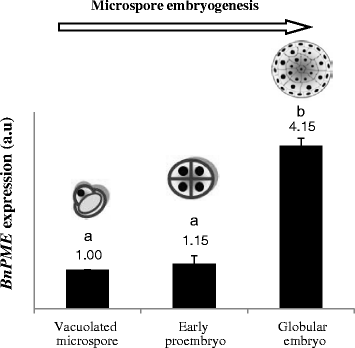
为了更准确、定量地分析小孢子胚胎发生过程中基因表达的变化,选择“空泡化小孢子”(诱导过程的起点)、“早期前胚胎”(早期胚胎发生阶段)和“球状胚胎”(胚胎分化开始的晚期胚胎发生阶段)进行qRT-PCR检测。定量PCR结果与半定量RT-PCR结果一致,Bn含量无显著差异gydF4y2Ba中外职业gydF4y2Ba重编程前液泡化小孢子与早期原胚胎之间的表达(图。gydF4y2Ba3.gydF4y2Ba)。而在球状胚发育后期,该基因表达高度上调;球形胚胎的表达与空泡小孢子的表达相比增加了4倍(图2)。gydF4y2Ba3.gydF4y2Ba)。gydF4y2Ba
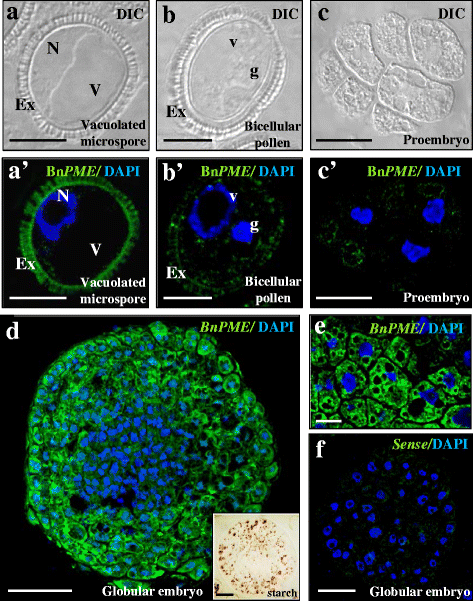
分析Bn的空间表达模式及亚细胞分布gydF4y2Ba中外职业gydF4y2Ba进行荧光原位杂交(FISH),然后进行共聚焦显微镜分析。在配子体途径中,FISH实验结果显示,在小孢子空泡化阶段,细胞质中的杂交信号非常低。gydF4y2Ba4,“gydF4y2Ba)、双细胞花粉(图;gydF4y2Ba4 b, bgydF4y2Ba’)和三细胞花粉。在胚胎发生途径中,胚胎发生诱导后,早期原胚胎在细胞质中也表现出较低的杂交信号。gydF4y2Ba4 c, cgydF4y2Ba”)。在一些样品中,外膜表现出非特异性的自体荧光(图。gydF4y2Ba4 a, b的gydF4y2Ba)。在胚胎发生途径的后期发育阶段,FISH信号逐渐升高,特别是在晚期球状胚胎外层的细胞中(图2)。gydF4y2Ba4 dgydF4y2Ba)。杂交信号主要在转录本定位的细胞质中发现,而在细胞核、液泡或细胞壁中没有发现杂交信号(图2)。gydF4y2Ba4 d, egydF4y2Ba)。球形胚胎表现为两个不同细胞类型的区域:内部区域为细胞质致密、细胞核大、液泡小的细胞,这是典型的增殖细胞组织,类似于早期的原胚细胞;外部区域为大细胞,有大液泡和淀粉沉积,碘化物特异性染色可见(图中所示)。gydF4y2Ba4 dgydF4y2Ba),是细胞分化过程中典型的细胞质组织。在鱼雷胚胎中,一种不同的BngydF4y2Ba中外职业gydF4y2Ba也发现了表达模式;外周区分化细胞比内胚区增殖细胞表现出更高的杂交信号。用感觉探针进行的对照FISH实验在任何样品的任何细胞区域都没有显示出荧光(图。gydF4y2Ba4 fgydF4y2Ba)。gydF4y2Ba
原位gydF4y2BaBngydF4y2Ba中外职业gydF4y2BaFISH在配子体发育和小孢子胚胎发生过程中的表达。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba和里面的结构一样吗gydF4y2Ba一个gydF4y2Ba”,gydF4y2BabgydF4y2Ba”,gydF4y2BacgydF4y2Ba”。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2BaDIC图像(差分干涉对比,Nomarsky)。gydF4y2Ba一个gydF4y2Ba”,gydF4y2BabgydF4y2Ba”,gydF4y2BacgydF4y2Ba”,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba由核(蓝色)DAPI染色和原位Bn荧光提供的荧光共聚焦合并图像gydF4y2Ba中外职业gydF4y2Ba杂交信号(绿色)。gydF4y2Ba一个gydF4y2Ba,gydF4y2Ba一个gydF4y2Ba空泡小孢子。gydF4y2BabgydF4y2Ba,gydF4y2BabgydF4y2Ba配子体发育,体内双细胞花粉。gydF4y2BacgydF4y2Ba,gydF4y2BacgydF4y2Ba”,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba体外小孢子胚胎发生。gydF4y2BacgydF4y2Ba-gydF4y2BacgydF4y2Ba原胚。gydF4y2BadgydF4y2Ba球状胚胎。(图d) I染色的球状胚胎gydF4y2Ba2gydF4y2Ba淀粉IK。gydF4y2BaegydF4y2Ba高倍镜下球形胚胎周围细胞的细节。gydF4y2BafgydF4y2Ba球状胚中FISH的感觉探针对照。例:外核,N:核,V:液泡,g:生殖核,V:营养核。酒吧:gydF4y2Ba一个gydF4y2Ba,gydF4y2Ba一个gydF4y2Ba”,gydF4y2BabgydF4y2Ba,gydF4y2BabgydF4y2Ba”,gydF4y2BacgydF4y2Ba,gydF4y2BacgydF4y2Ba, 10 μm;gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba, 20 μmgydF4y2Ba
原位gydF4y2Ba并对种子获得的子叶小孢子胚和合子胚进行了表达分析。FISH结果显示BngydF4y2Ba中外职业gydF4y2Ba在两种类型的胚胎中表达相似(图;gydF4y2Ba5gydF4y2Ba)。两种来源的胚、小孢子均出现高荧光杂交信号。gydF4y2Ba5 a, cgydF4y2Ba)和受精卵(图。gydF4y2Ba5 b, dgydF4y2Ba),特别是在子叶和神经根区分化细胞的细胞质中,以碘化物特异性染色显示的淀粉堆积为特征(图中所示)。gydF4y2Ba5 a, cgydF4y2Ba),子叶内侧和根尖部分胚细胞的荧光杂交信号较低,且无淀粉沉积(图2)。gydF4y2Ba5a, b, c, dgydF4y2Ba和insets)。位于子叶外层和胚胎根冠的细胞没有显示FISH信号(图2)。gydF4y2Ba5gydF4y2Ba)。gydF4y2Ba
原位gydF4y2Ba中外职业gydF4y2BaFISH在子叶小孢子胚和合子胚中的表达。由细胞核DAPI染色(蓝色)和荧光原位杂交信号(绿色)提供的荧光共聚焦合并图像。gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba小孢子胚胎。gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba合子的胚胎。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba胚胎的子叶区域,如正方形所示。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba胚胎的根状区域,如正方形所示。Insets的gydF4y2Ba一个gydF4y2Ba而且gydF4y2BacgydF4y2Ba:对淀粉、类似子叶区和胚根区进行碘化物特异性染色,如“gydF4y2Ba一个gydF4y2Ba"和"gydF4y2BacgydF4y2Ba”。棒材:50 μmgydF4y2Ba
PME: GFP在体内亚细胞定位gydF4y2Ba
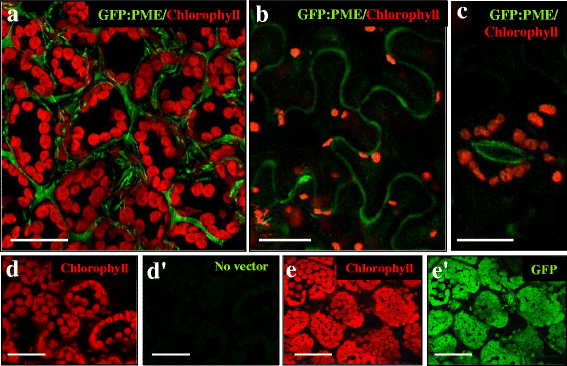
分析Bn的亚细胞定位gydF4y2Ba中外职业gydF4y2Ba在体内,其基因在异源系统中表达。将PME基因翻译融合到GFP上,在本构35S启动子的控制下克隆GFP,用于转化后的瞬态表达实验gydF4y2Ba烟草gydF4y2Ba叶子。用PME-GFP构建物对转化烟叶的共聚焦体内分析显示,叶肉细胞细胞壁中有强烈的绿色荧光信号(图2)。gydF4y2Ba6gydF4y2Ba),说明PME经过转译加工后,被导向果胶修饰发生的细胞壁gydF4y2Ba在murogydF4y2Ba.无PME:在叶肉细胞内发现了GFP信号,只有大量的叶绿体表现出与叶绿素自身荧光相对应的强烈红色信号(图。gydF4y2Ba6gydF4y2Ba)。PME:在路面表皮细胞的薄细胞壁中也发现了GFP信号,勾勒出这些细胞的典型形状(图。gydF4y2Ba6 bgydF4y2Ba)。PME: GFP也定位于表皮气孔周围的保护细胞壁(图2)。gydF4y2Ba6摄氏度gydF4y2Ba),表现出强烈的荧光信号,特别是在面向孔侧的内壁(这些壁区通常比其他守卫细胞壁厚)。相比之下,野生型烟叶作为实验的阴性对照,没有显示任何绿色荧光信号(图。gydF4y2Ba6 d, dgydF4y2Ba”)。相反,没有PME的GFP结构的浸润提供了遍布叶肉细胞的非特异性绿色荧光信号,甚至在叶绿体内部(图2)。gydF4y2Ba6 e, egydF4y2Ba’),支持PME信号的特异性:GFP和由Bn编码的PME蛋白在细胞壁中的定位gydF4y2Ba中外职业gydF4y2Ba基因分析。gydF4y2Ba
体内GFP: PME在转化烟叶中的亚细胞定位。由叶绿素自发荧光(红色)和GFP荧光(绿色)提供的荧光共聚焦图像。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2BaGFP: PME转化叶片,叶肉红色通道和绿色通道合并图像gydF4y2Ba一个gydF4y2Ba,路面表皮gydF4y2BabgydF4y2Ba和气孔保护gydF4y2BaegydF4y2Ba细胞。gydF4y2BadgydF4y2Ba,gydF4y2BadgydF4y2Ba野生型叶子。gydF4y2BaegydF4y2Ba,gydF4y2BaegydF4y2Ba“绿色荧光蛋白转化的叶子。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba红色通道。gydF4y2BadgydF4y2Ba”,gydF4y2BaegydF4y2Ba“绿色通道。棒材:25 μmgydF4y2Ba
果胶酯化在配子体和胚生两种小孢子发育途径中的时间模式gydF4y2Ba
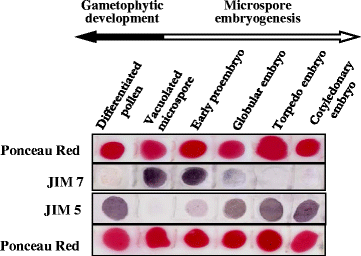
用抗体JIM7和JIM5分别识别高甲基化和低甲基化果胶,进行免疫点印迹试验,以确定在两个发育过程中两种形式果胶的存在差异。在前面描述的阶段进行点印迹分析,“空泡小孢子”是两种途径的起始阶段,“分化花粉”是配子体发育的阶段,“早期原胚胎”、“球状胚胎”、“鱼雷胚胎”和“子叶胚胎”是小孢子胚胎发生的阶段。通过膜的Ponceau红染色显示,在所有发育阶段都使用了等量的样本量。gydF4y2Ba7gydF4y2Ba)。结果表明,酯化果胶和非酯化果胶在两种发育途径中的分布模式不同。gydF4y2Ba7gydF4y2Ba)。JIM7免疫斑点标记信号显示,在空泡小孢子和早期原胚中,果胶酯化水平较高,而在小孢子胚胎发生后期,果胶酯化水平下降。配子体发育过程中JIM7信号减弱,成熟花粉中JIM7信号尤其低。相反,与未酯化果胶相对应的JIM5信号在空泡化小孢子中较低,并随着花粉分化和小孢子胚胎发生的进展而逐渐升高(图2)。gydF4y2Ba7gydF4y2Ba)。JIM5信号在子叶胚和分化后的花粉中达到最大。gydF4y2Ba7gydF4y2Ba)。gydF4y2Ba
在各个发育阶段,酯化果胶和非酯化果胶的比例,空泡化小孢子和早期原胚表现出非常相似的斑点斑点模式,高JIM7和低JIM5信号(图5)。gydF4y2Ba7gydF4y2Ba)。球形胚胎显示非酯化果胶(JIM5)显著增加,同时酯化果胶(JIM7)水平下降(图7)。gydF4y2Ba7gydF4y2Ba)。在随后的胚胎发育阶段,非酯化果胶和酯化果胶之间的差异变得更大,JIM5信号显著增加,JIM7信号在胚胎发育后期显著降低(图2)。gydF4y2Ba7gydF4y2Ba)。gydF4y2Ba
原位gydF4y2Ba酯化果胶和非酯化果胶在配子体和胚生两种小孢子发育途径中的定位gydF4y2Ba
用JIM7和JIM5抗体免疫荧光分析了酯化和非酯化果胶在两种发育途径的不同阶段的分布规律。对JIM5和JIM7免疫荧光分析的共聚焦显微镜分析显示,在所分析的发育过程中,酯化和非酯化果胶在细胞壁中的分布模式发生了特定的变化。gydF4y2Ba
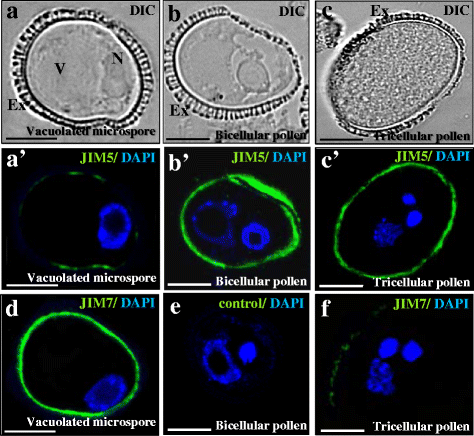
在空泡化的小孢子中(图;gydF4y2Ba8a a ' dgydF4y2Ba),免疫荧光分析在肠壁(外壁下的内壁)上提供了强烈的JIM7信号(图。gydF4y2Ba8 dgydF4y2Ba),表明果胶的酯化含量较高。然而,JIM5抗体在空泡化的小孢子中没有检测到信号。gydF4y2Ba8gydF4y2Ba”)。在配子体途径的双细胞和三细胞花粉阶段,JIM7和JIM5信号的分布模式与空泡小孢子相反(图2)。gydF4y2Ba8b b ' c c ' fgydF4y2Ba)。JIM5显示,在肠内发现了强烈的非酯化果胶信号(图5)。gydF4y2Ba8 b, c 'gydF4y2Ba),而JIM7的免疫荧光信号很低(图。gydF4y2Ba8 fgydF4y2Ba),在两细胞和三细胞花粉阶段。在所有病例中,荧光信号均定位于内膜层,而在外膜或任何其他细胞室中均无荧光信号(图2)。gydF4y2Ba8gydF4y2Ba)。在任何发育阶段,避免第一个抗体的对照免疫荧光实验都不提供信号(图。gydF4y2Ba8 egydF4y2Ba)。gydF4y2Ba
在配子体发育过程中酯化和非酯化果胶的免疫定位。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba是相同的结构,DIC(差分干涉对比,Nomarsky)显示在gydF4y2Ba一个gydF4y2Ba”,gydF4y2BabgydF4y2Ba”,gydF4y2BacgydF4y2Ba”。gydF4y2Ba一个gydF4y2Ba”,gydF4y2BabgydF4y2Ba”,gydF4y2BacgydF4y2Ba“在配子体发育过程中,酯化(JIM7抗体)和非酯化(JIM5抗体)果胶的免疫荧光。gydF4y2Ba一个gydF4y2Ba,gydF4y2Ba一个gydF4y2Ba”,gydF4y2BadgydF4y2Ba有液泡的小孢子;gydF4y2BabgydF4y2Ba,gydF4y2BabgydF4y2Ba”,gydF4y2BaegydF4y2Ba双细胞的花粉;gydF4y2BacgydF4y2Ba,gydF4y2BacgydF4y2Ba”,gydF4y2BafgydF4y2Ba三细胞成熟花粉。gydF4y2Ba一个gydF4y2Ba”,gydF4y2BabgydF4y2Ba”,gydF4y2BacgydF4y2Ba由细胞核DAPI染色(蓝色)和JIM5免疫荧光信号(绿色)提供的荧光合并图像。gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba由细胞核DAPI染色(蓝色)和JIM7免疫荧光信号(绿色)提供的荧光合并图像。gydF4y2BaegydF4y2Ba对照免疫荧光实验避免第一抗体。例:外核,N:核,V:液泡。棒材:10 μmgydF4y2Ba
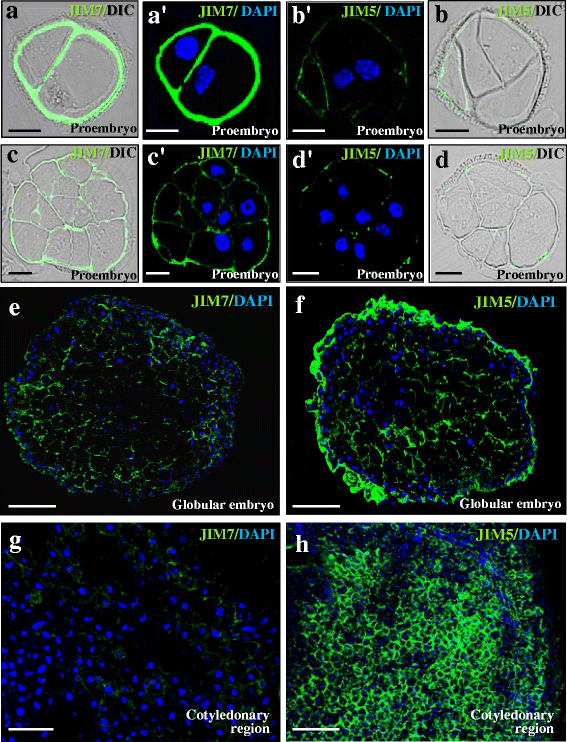
小孢子胚胎发生诱导后,含有两个或几个细胞的早期原胚呈薄壁,JIM7抗体显示高荧光信号(图5)。gydF4y2Ba9a a ' c c 'gydF4y2Ba);相反,JIM5抗体在早期原胚细胞壁观察到非常低的信号(或根本没有信号)(图5)。gydF4y2Ba9b b ' d d 'gydF4y2Ba)。在小的原胚胎中,仍被外壁包围,内膜也显示出强烈的JIM7信号(图2)。gydF4y2Ba9日,“gydF4y2Ba)。在发育后期,在球状胚胎和鱼雷胚胎中,在外部分化细胞的细胞壁中检测到更强的JIM5信号(图2)。gydF4y2Ba9 fgydF4y2Ba);相比之下,在内部增殖细胞的细胞壁中观察到微弱的信号(或根本没有信号)。gydF4y2Ba9 fgydF4y2Ba)。JIM7抗体标记在晚期球状胚胎和鱼雷胚胎细胞壁中较低(图2)。gydF4y2Ba8 egydF4y2Ba)。在子叶胚胎中,两种抗体的免疫荧光信号差异更大。JIM5在细胞壁上标记强烈,特别是在子叶尖端等分化区域(图2)。gydF4y2Ba9小时gydF4y2Ba),而JIM7信号在子叶细胞中很低(图;gydF4y2Ba9克gydF4y2Ba)。在没有一抗的对照组中,在任何发育阶段都没有检测到任何信号。这些分布模式与上面报道的免疫斑点分析结果明显相关。gydF4y2Ba
小孢子胚胎发生过程中酯化和非酯化果胶的免疫定位。免疫荧光信号(绿色)和细胞核DAPI染色(蓝色)共聚焦合并图像。对于某些阶段,显示相同切片的DIC图像(差分干涉对比度,Nomarsky)来揭示结构(每对图像的左侧)。gydF4y2Ba一个gydF4y2Ba,gydF4y2Ba一个gydF4y2Ba”,gydF4y2BacgydF4y2Ba,gydF4y2BacgydF4y2Ba”,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2BaJIM7免疫荧光。gydF4y2BabgydF4y2Ba,gydF4y2BabgydF4y2Ba”,gydF4y2BadgydF4y2Ba,gydF4y2BadgydF4y2Ba”,gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2BaJIM5免疫荧光。gydF4y2Ba一个gydF4y2Ba-gydF4y2BadgydF4y2Ba双细胞和早期原胚胎。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba球状胚胎。gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba子叶的胚胎。酒吧:gydF4y2Ba一个gydF4y2Ba-gydF4y2BadgydF4y2Ba) 10 μm;gydF4y2BaegydF4y2Ba-gydF4y2BahgydF4y2Ba) 25 μmgydF4y2Ba
讨论gydF4y2Ba
小孢子胚胎发生过程涉及Bn的诱导gydF4y2Ba中外职业gydF4y2Ba果胶去酯化水平在细胞壁的表达和增加gydF4y2Ba
在本研究中,我们研究了小孢子胚胎发生的发育过程是否与果胶酯化水平的变化有关,而果胶酯化水平的变化是由PME活性完成的,这可能表明在此过程中细胞壁发生了重塑。Bn的表达分析gydF4y2Ba中外职业gydF4y2Ba,通过不同和互补的方法- qRT-PCR和荧光法进行gydF4y2Ba原位gydF4y2Ba杂交(FISH) -表明BngydF4y2Ba中外职业gydF4y2Ba在小孢子胚胎发生过程中诱导,特别是在以淀粉积累为特征的胚胎分化细胞中诱导。这BngydF4y2Ba中外职业gydF4y2Ba表达模式与JIM5抗体显示的细胞壁非酯化果胶的增加完全相关。gydF4y2Ba
有趣的是,类似的gydF4y2Ba原位gydF4y2BaBngydF4y2Ba中外职业gydF4y2Ba在合子胚中也发现了与小孢子胚相似的表达模式。少量先前的研究报告了来自两个来源的胚胎,小孢子和合子之间的结构和基因表达的相似性gydF4y2Ba甜椒gydF4y2Ba,gydF4y2BaQuercus木栓gydF4y2Ba而且gydF4y2Ba芸苔属植物显著gydF4y2Ba[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba52gydF4y2Ba].目前的PME结果为小孢子胚胎发生模拟合子胚胎发生提供了额外的证据。gydF4y2Ba
在PMEs的作用下,细胞壁均半乳糖醛酸(HGA)的甲基酯化状态影响植物细胞壁的生物物理特性,而植物细胞壁的生物物理特性是分化事件中细胞伸长和生长的重要参数[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].的微分时空表达gydF4y2Ba中外职业gydF4y2Ba基因被认为是调节内源性PME活性的主要机制[gydF4y2Ba34gydF4y2Ba].在生长/增殖到成熟/分化的组织中,HGA甲基化水平逐渐降低,PME活性逐渐增加[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba].同样在胚胎发生过程中,一些PMEs在水稻角果发育过程中表达gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba55gydF4y2Ba],其中一些特别存在于胚、胚乳或种皮中[gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba].高BngydF4y2Ba中外职业gydF4y2Ba我们在小孢子衍生胚胎和合子胚胎后期观察到的表达可能导致更高的PME活性和果胶去酯化,改变胚胎分化的细胞壁特性。有人认为,PME的活动gydF4y2Ba高度甲基酯化的种子gydF4y2Ba(gydF4y2BaHMSgydF4y2Ba)在胚胎发生过程中促进细胞扩张,而突变体gydF4y2Bahms1gydF4y2Ba导致胚胎形态改变[gydF4y2Ba57gydF4y2Ba].我们的结果表明,在小孢子向胚胎发生重编程后,pme介导的果胶结构可能是一个关键因素,可能有助于通过高酯化和低酯化果胶之间的平衡来调节细胞壁生物力学特性。gydF4y2Ba
最近的研究表明,生长素等因素有助于器官发生和生长过程中的细胞壁重塑,这一过程需要果胶的去酯化[gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba].植物胚胎发生的进程与生长素的极性积累有关[gydF4y2Ba60gydF4y2Ba],最近的报道表明,增加生长素的生物合成、作用和极性运输是小孢子胚胎发生、起始和进展所必需的gydF4y2Ba芸苔属植物显著gydF4y2Ba[gydF4y2Ba61gydF4y2Ba].在小孢子胚胎发生过程中,生长素是否通过增加PME表达参与细胞壁重塑还需要进一步的研究。gydF4y2Ba
PME蛋白定位于细胞壁gydF4y2Ba
目的:阐明由Bn编码的PME蛋白的原位亚细胞定位gydF4y2Ba中外职业gydF4y2Ba本研究对基因进行了分析gydF4y2BaBnPMEgydF4y2Ba:gydF4y2Ba绿色荧光蛋白gydF4y2Ba对融合结构进行了分析gydF4y2Ba烟草gydF4y2Ba叶子。在共聚焦激光显微镜下对PME: GFP构建物的体内分析表明,PME蛋白只定位于烟草叶片叶肉和表皮细胞的细胞壁,以及气孔保护细胞的细胞壁。首次使用免疫荧光显微镜定位PME的尝试表明,在组织水平上,PME主要位于表皮和皮层实质的细胞连接处,这表明PME是分化的早期标记物[gydF4y2Ba62gydF4y2Ba].我们关于Bn的分布模式的结果gydF4y2Ba中外职业gydF4y2Ba-gydF4y2Ba绿色荧光蛋白gydF4y2Ba融合蛋白显示,第一次在gydF4y2Ba芸苔属植物显著gydF4y2Ba,即PME蛋白由Bn编码gydF4y2Ba中外职业gydF4y2Ba在这项工作中使用的基因序列是指向细胞壁,在那里它可能发挥其酶活性果胶gydF4y2Ba在murogydF4y2Ba.gydF4y2Ba
果胶酯化程度高,氮含量低gydF4y2Ba中外职业gydF4y2Ba表达与胚胎发生途径中的细胞全能性和增殖相关gydF4y2Ba
液泡小孢子是一种非常活跃的细胞,能够通过配子体途径形成花粉粒,或通过胚胎发生途径被重新编程,成为一种全能细胞,增殖并形成前胚胎和胚胎[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba63gydF4y2Ba].空泡小孢子和早期原胚细胞均表现出低水平的BngydF4y2Ba中外职业gydF4y2Ba通过JIM7抗体免疫斑点和免疫荧光检测,表达以及高水平的酯化果胶。gydF4y2Ba
近年来,一些报道表明果胶通过PME活性的酯化状态控制的细胞壁力学变化是果胶器官发生起始和叶向化的基础gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba59gydF4y2Ba,gydF4y2Ba64gydF4y2Ba].此外,在胚胎早期阶段,细胞壁中促进其松动的生化变化已被报道,细胞壁重塑似乎对正常胚胎生长和胚胎发生进程至关重要[gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba].因此,低水平的BngydF4y2Ba中外职业gydF4y2Ba我们在胚胎早期阶段发现的表达可能是细胞壁松动以促进必要的生长突增的关键,这是这一阶段的特征。gydF4y2Ba
我们小组以前的研究已经报道了在各种植物的小孢子和小孢子来源的胚胎中果胶酯化的变化,如gydF4y2Ba甜椒gydF4y2Ba,gydF4y2BaQuercus木栓gydF4y2Ba,gydF4y2Ba柑橘克莱门蒂娜gydF4y2Ba而且gydF4y2Ba齐墩果欧洲公司gydF4y2Ba,以及分生细胞和分化细胞gydF4y2Ba洋葱gydF4y2Ba根尖[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba65gydF4y2Ba].在本研究中,通过对体内花粉发育和体外小孢子胚胎发生途径的比较分析,发现了胁迫诱导小孢子胚胎发生重编程的一个新的差异细胞壁特征。这一特征是液泡小孢子和原胚细胞的细胞壁中存在高水平的果胶酯化——因此与细胞全能性和胚胎发生启动有关——但在遵循配子体程序的细胞中不存在(分化花粉)。据报道,细胞壁组分和果胶残基的修饰对于启动与细胞命运和发育有关的细胞反应至关重要[gydF4y2Ba66gydF4y2Ba].在胡椒、栎树和橄榄中,胚胎发生小孢子和早期原胚的外壁下有异常厚的细胞壁[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].此外,据报道,在橄榄的胚性小孢子和早期原胚中,特别是在内壁(外壁下的内壁层),钙荧光白染色的不同反应性(优先于纤维素成分)表明,胚性诱导后,纤维素成分的结构、排列和/或数量发生了改变[gydF4y2Ba26gydF4y2Ba].从这个意义上说,目前的结果表明,细胞壁中酯化果胶的高比例不仅可能是增殖的标志,而且可能是发育程序和全能性转换的标志。换句话说,高水平的非酯化果胶可以被认为是配子体途径的特定标记,而酯化果胶可以被认为是全能性获得和早期胚胎发生发育的标记。gydF4y2Ba
在配子体途径中,分化的花粉表现出低氮gydF4y2Ba中外职业gydF4y2BaJIM5抗体的免疫斑点和免疫荧光分析显示,二细胞和三细胞花粉的细胞壁中含有大量的非酯化果胶。先前的研究报道PME基因的表达以一种组织特异性的方式受到强烈调控[gydF4y2Ba67gydF4y2Ba].在许多植物中,发现了由大的多基因家族编码的PME的多个同工型,它们都催化相同的反应;此外,一些PME亚型是组成型表达,而其他PME亚型仅在某些组织/器官和/或特定发育阶段表达(综述于[gydF4y2Ba34gydF4y2Ba])。此外,一些研究报告了在一些物种花粉萌发过程中,与花粉管发射有关的花粉分化后期PME表达水平的增加[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba68gydF4y2Ba),就像……一样gydF4y2BaPME48gydF4y2Ba的gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba69gydF4y2Ba];事实上,在某些情况下,gydF4y2Ba中外职业gydF4y2Ba甚至在花粉管中继续表达[gydF4y2Ba8gydF4y2Ba].在本研究中,分析了BngydF4y2Ba中外职业gydF4y2Ba利用中所描述的乳头状细胞pme样基因的序列对基因进行了分析gydF4y2Ba芸苔属植物显著gydF4y2Ba[gydF4y2Ba40gydF4y2Ba],是该物种中发现的少数PME基因序列之一,在分化后的花粉中没有表达。因此,可能存在另一种PME基因,可能是花粉特异性的PME基因,在花粉分化阶段表达并起作用gydF4y2Ba芸苔属植物显著gydF4y2Ba.gydF4y2Ba
结论gydF4y2Ba
总之,通过配子体和胚生两种发育途径的比较发现,小孢子发育程序的变化涉及果胶酯化水平和Bn的变化gydF4y2Ba中外职业gydF4y2Ba在此过程中可能引起细胞壁重塑的表达。我们的结果允许原位鉴定与细胞全能性、增殖和分化相关的果胶酯化作用的细胞壁分布模式。gydF4y2Ba
我们通过几种互补方法获得的结果表明,在小孢子胚胎发生的晚期阶段,细胞分化涉及Bn的增加gydF4y2Ba中外职业gydF4y2Ba表达,也检测到合子胚胎,以及高果胶去酯化。相比之下,在胁迫诱导小孢子胚胎发生的早期阶段发生的全能性获得和进入增殖与低水平的Bn有关gydF4y2Ba中外职业gydF4y2Ba果胶在细胞壁中的表达和高水平的酯化。综上所述,我们的结果表明,PME在小孢子胚胎发生诱导和发展过程中受到转录调控,与果胶的去酯化有关,并表明PME在这一过程中可能在细胞壁重塑中发挥作用。果胶的PME诱导和去酯化可能有助于胚胎细胞壁力学特性的时间调节,这一过程与胚胎细胞分化有关。这一发现为果胶酯化修饰在小孢子全能性、胚胎发生诱导和进展中的作用提供了新的见解,果胶酯化修饰可能有助于细胞壁重塑。gydF4y2Ba
缩写gydF4y2Ba
差分干涉对比度;鱼,荧光gydF4y2Ba原位gydF4y2Ba杂化;GFP,绿色荧光蛋白;近半年,Homogalacturonan;JIM, John Innes单克隆;PME(果胶甲基酯酶);PMEI,果胶甲基酯酶抑制剂gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
诺克斯JP。揭示植物细胞壁结构和功能的多样性。植物学报,2008;11:308-13。gydF4y2Ba
- 2.gydF4y2Ba
王晓明,王晓明,王晓明。果胶甲基酯酶结构与功能的新认识。植物科学进展,2007;gydF4y2Ba
- 3.gydF4y2Ba
Willats WGT, Orfila C, Limberg G, Buchholt HC, Van Alebeek G, Voragen AGJ, Marcus SE, Christensen T, Mikkelsen JD, Murray BS,等。植物细胞壁中果胶均半乳糖醛酸甲基酯化程度和模式的调控——果胶甲酯酶作用、基质性质和细胞粘附的影响。生物化学学报。2001;276:19404-13。gydF4y2Ba
- 4.gydF4y2Ba
铁门DM,汉达AK。果胶甲基酯酶活性的降低会改变成熟番茄的组织完整性和阳离子水平(gydF4y2BaLycopersicongydF4y2Ba-gydF4y2BaEsculentumgydF4y2Ba水果机)。植物物理学报,1994;106:429-36。gydF4y2Ba
- 5.gydF4y2Ba
温福生,朱玉梅,霍斯。果胶甲基酯酶基因表达对豌豆根系发育的影响。植物学报。1999;11:1129-40。gydF4y2Ba
- 6.gydF4y2Ba
李志强,李志强,李志强,等。杂交白杨活性和休眠形成层果胶甲基酯酶的径向分布特征。植物物理学报,2000;124:191-9。gydF4y2Ba
- 7.gydF4y2Ba
果胶甲基酯酶:在植物生理中起重要作用的细胞壁酶。植物科学进展,2001;6:414-9。gydF4y2Ba
- 8.gydF4y2Ba
博世M,张AY, Hepler PK.果胶甲基酯酶,花粉管生长调节剂。植物物理学报2005;138:1334-46。gydF4y2Ba
- 9.gydF4y2Ba
田国文,陈明华,Zaltsman A, Citovsky V.花粉管生长过程中果胶甲基酯酶的研究。Dev Biol, 2006; 294:83-91。gydF4y2Ba
- 10.gydF4y2Ba
杨晓明,王志强,王志强,等。矮牵牛花果胶甲酯酶的表达gydF4y2Ba茄属植物tuberosumgydF4y2BaL.增强茎伸长并改变其分布。足底。2000;210:391-9。gydF4y2Ba
- 11.gydF4y2Ba
Pilling J, Willmitzer L, Bucking H, Fisahn J.一种普遍表达的果胶甲酯酶的抑制gydF4y2Ba茄属植物tuberosumgydF4y2Bal影响植物生长、叶片生长极性和离子分配。足底。2004;219:32-40。gydF4y2Ba
- 12.gydF4y2Ba
蒋玲,杨世林,谢丽芬,张晓强,杨伟强,孙达山V,叶东。花粉管生长的果胶甲基酯酶(VANGUARD1)编码gydF4y2Ba拟南芥gydF4y2Ba风格和传播途径。《植物科学》2005;17:584-96。gydF4y2Ba
- 13.gydF4y2Ba
王志强,王志强,王志强。烟草花粉果胶甲基酯酶Nt的沉默gydF4y2BaPPME1gydF4y2Ba结果:体内花粉管生长迟缓。足底。2006;223:736-45。gydF4y2Ba
- 14.gydF4y2Ba
Francis KE, Lam SY,哥本哈根GP。拟南芥花粉四分体的分离受果胶甲基酯酶基因QUARTET1调控。植物物理学报,2006;gydF4y2Ba
- 15.gydF4y2Ba
Maluszynski M, Kasha K, Forster B, Szarejko I.作物单倍体产量加倍:手册。提供:多德雷赫特;2003.gydF4y2Ba
- 16.gydF4y2Ba
Bárány I, González-Melendi P, Fadón B, Mityko J, Risueño MC, Testillano PS.辣椒小孢子胚胎发生(gydF4y2Ba甜椒gydF4y2BaL.):发育过程中的亚细胞重排。生物细胞。2005;97:709-22。gydF4y2Ba
- 17.gydF4y2Ba
Prem D, Solís MT, Bárány I, Rodríguez-Sánz H, Risueño MC, Testillano PS.一个模拟合子胚胎发生首字母,表达生长素并高效再生双单倍体植物的低温小孢子胚胎发生新系统gydF4y2Ba芸苔属植物显著gydF4y2Ba.BMC植物生物学2012;12:127。gydF4y2Ba
- 18.gydF4y2Ba
tesllano PS, Coronado MJ, Seguí JM, Domenech J, González-Melendi P, Raska I, Risueño MC.小孢子向胚胎发生的重编程伴随着明确的核变化。中国生物医学工程学报,2000;29(2):344 - 344。gydF4y2Ba
- 19.gydF4y2Ba
Testillano PS, Ramírez C, Domenech J, Coronado MJ, Vergne P, Matthys-Rochon E, Risueño MC.玉米小孢子衍生的年轻胚胎显示两个具有明确特征的结构域,也存在于合子胚胎发生中。中国生物医学工程学报(英文版),2002;gydF4y2Ba
- 20.gydF4y2Ba
Seguí-Simarro J, terestilano P, Jouannic S, Henry Y, Risueño M.胁迫诱导小孢子胚胎发生过程中丝裂原活化蛋白激酶的发育调控gydF4y2Ba芸苔属植物显著gydF4y2Ba中国生物医学工程学报(英文版),2005;gydF4y2Ba
- 21.gydF4y2Ba
El-Tantawy AA, Solís MT, Risueño MC, tesllano PS.大麦小孢子重编程胚胎发生过程中DNA甲基化水平和核分布模式的变化。细胞基因基因组,2014;143:200-208。gydF4y2Ba
- 22.gydF4y2Ba
Coronado MJ, González-Melendi P, Seguí JM, Ramírez C, Barany I, Testillano PS, Risueño MC. MAPKs在植物分化和增殖过程中的特定染色质结构域进入细胞核。中国生物医学工程杂志,2002;gydF4y2Ba
- 23.gydF4y2Ba
睾丸菌PS, Risueño MC.用共聚焦激光扫描显微镜跟踪小孢子胚胎发生过程中的基因和蛋白质表达。在:图拉耶夫A,福斯特BP,莫汉Jain S,编辑。高等植物单倍体产生研究进展。英国:施普林格Science and business Media B.V;2009.339 - 47页。gydF4y2Ba
- 24.gydF4y2Ba
李志刚,李志刚。细胞壁在植物胚胎发生中的作用。细胞生物学杂志,2002;7:1137-51。gydF4y2Ba
- 25.gydF4y2Ba
Fortes AM, testllano PS, Risueño MD, Pais MS.软骨细胞和角质层在表达能力和决定器官性结节形成过程中的研究gydF4y2Ba忽花布gydF4y2Ba金块植物生理学,2002;116:113-20。gydF4y2Ba
- 26.gydF4y2Ba
Solís MT, Pintos B, Prado MJ, Bueno MA, Raska I, Risueño MC, Testillano PS.橄榄离体小孢子重编程胚胎发生的早期标记物(gydF4y2Ba齐墩果欧洲公司gydF4y2Bal .)。植物科学进展,2008;gydF4y2Ba
- 27.gydF4y2Ba
Bárány I, Fadón B, Risueño MC,睾丸菊PS.细胞壁组分和果胶酯化水平作为花粉发育和花粉胚胎发生过程中增殖分化事件的标记gydF4y2Ba甜椒gydF4y2Ba中国科学(d辑),2010;gydF4y2Ba
- 28.gydF4y2Ba
El-Tantawy AA, Solís MT, Da Costa ML, Coimbra S, Risueño MC, Testillano PS.小孢子胚胎发育和花粉发育过程中阿拉伯半乳聚糖蛋白的分布特征gydF4y2Ba芸苔属植物显著gydF4y2Ba.植物学报。2013;26:231-43。gydF4y2Ba
- 29.gydF4y2Ba
Bárány I, Fadón B, Risueño MC, tesllano PS.小孢子重编程诱导细胞壁和淀粉积累动态变化与增殖和分化事件相关。植物学报。2010;5:341-5。gydF4y2Ba
- 30.gydF4y2Ba
Ramírez C, Testillano PS, Pintos B, Moreno-Risueño MA, Bueno MA, Risueño MC.在小孢子胚胎发生早期与细胞发育相关的果胶和MAPKs的变化gydF4y2BaQuercus木栓gydF4y2Ba中国生物医学工程学报(英文版);2004;gydF4y2Ba
- 31.gydF4y2Ba
Coutinho PM, Starn M, Blanc E, Henrissat B.为什么植物中有这么多碳水化合物活性酶相关基因?植物科学进展,2003;8:563-5。gydF4y2Ba
- 32.gydF4y2Ba
Gómez MD, Renau-Morata B, Roque E, Polaina J, Beltran JP, Cañas LA。PsgydF4y2BaPMEPgydF4y2Ba,是豌豆花粉特有的果胶甲基酯酶(gydF4y2BaPisum一gydF4y2Bal .)。植物学报。2013;26(4):344 - 344。gydF4y2Ba
- 33.gydF4y2Ba
Rexova-Benkova L, Markovic o。生物化学。1976;33:323-85。gydF4y2Ba
- 34.gydF4y2Ba
朱莉RP, Duvetter T, Van Loey AM, Hendrickx ME。果胶甲基酯酶及其蛋白抑制剂的研究进展。碳水化合物决议2010;345:2583-95。gydF4y2Ba
- 35.gydF4y2Ba
徐超,赵玲,潘晓霞,孙丽娟。香蕉体细胞胚胎发生过程中果胶表位的发育定位和甲基酯化(gydF4y2Ba穆萨sppgydF4y2Ba.AAA)。PLoS ONE。2011; 6: e22992。gydF4y2Ba
- 36.gydF4y2Ba
Christgau S, Kofod LV, Halkier T, Andersen LN, Hockauf M, Dorreich K, Dalboge H, Kauppinen S.果胶甲酯酶gydF4y2Ba曲霉属真菌aculeatusgydF4y2Ba:酵母中表达的克隆及重组酶的表征。生物化学学报,1996;29(3):342 - 344。gydF4y2Ba
- 37.gydF4y2Ba
Rodríguez-Sanz H, Manzanera JA, Solís MT, Gómez-Garay A, Pintos B, Risueño MC, Testillano PS.软木橡树小孢子胚胎发生途径和未成熟合子胚胎早期标记均存在,栎树,BMC植物生物学,2014;14:224。gydF4y2Ba
- 38.gydF4y2Ba
杨晓明,王晓明,王晓明,等。植物半乳糖醛酸修饰酶的结构、表达及其在植物中的作用。中国科学(d辑),2014;gydF4y2Ba
- 39.gydF4y2Ba
张广元,冯杰,吴军,王小伟。薄gydF4y2BaPMEI1gydF4y2Ba果胶甲基酯酶抑制剂是一种花粉特异性的果胶甲基酯酶抑制剂,在花粉管生长中起重要作用。足底。2010;231:1323-34。gydF4y2Ba
- 40.gydF4y2Ba
姜艳,Nasrallah J.利用遗传消融柱头分离在柱头表皮特异性表达的基因。性植物,2001;14:85-94。gydF4y2Ba
- 41.gydF4y2Ba
Knox JP, Linstead PJ, King J, Cooper C, Roberts K.果胶酯化在细胞壁内和根尖发育组织之间受到空间调控。足底。1990;181:512-21。gydF4y2Ba
- 42.gydF4y2Ba
Clausen MH, Willats WG, Knox JP。合成抗同半乳糖酸单克隆抗体LM7, JIM5和JIM7的六乳糖酸甲酯半抗原抑制剂。碳水化合物决议2003;338:1797-800。gydF4y2Ba
- 43.gydF4y2Ba
Goldberg R, Morvan C, Roland JC。绿豆下胚轴年轻和成熟细胞中果胶的组成、性质和定位。植物细胞物理学报,1986;27:17 - 29。gydF4y2Ba
- 44.gydF4y2Ba
李志强,李志强,李志强,等。枸杞根分生组织中果胶多糖的发育调控gydF4y2Ba拟南芥gydF4y2Ba.中国科学(d辑),2001;gydF4y2Ba
- 45.gydF4y2Ba
长谷川Y,中村S, Uheda E,中村N.果胶在被子植物花粉生长和胼胝体塞形成过程中的免疫定位和可能的作用。基粒。2000;39:46-55。gydF4y2Ba
- 46.gydF4y2Ba
González-Melendi P, Testillano PS, Ahmadian P, Fadón B, Vicente O, Risueño MC.晚期液泡小孢子作为诱导胚胎发生的便利阶段的原位表征gydF4y2Ba辣椒gydF4y2Ba.原生质。1995;187:60 - 71。gydF4y2Ba
- 47.gydF4y2Ba
tesllano PS, González-Melendi P, Coronado MJ, Seguí-Simarro JM, Moreno-Risueño MA, Risueño MC.分化植物细胞转变为增殖重构核结构域的功能组织。细胞原基因组,2005;109:166-74。gydF4y2Ba
- 48.gydF4y2Ba
Solís MT, Rodríguez-Serrano M, Meijón M, Cañal MJ, Cifuentes A, Risueño MC, testllano PS. DNA甲基化动力学和gydF4y2BaMET1agydF4y2Ba-gydF4y2Ba就像gydF4y2Ba胁迫诱导花粉胚胎发生重编程过程中的基因表达变化。中国科学(d辑),2012;gydF4y2Ba
- 49.gydF4y2Ba
Costa M, Nobre MS, Becker JD, Masiero S, Amorim MI, Pereira LG, Coimbra SgydF4y2Ba拟南芥gydF4y2Ba花粉和花粉管。BMC植物生物学,2013;13:7。gydF4y2Ba
- 50.gydF4y2Ba
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C (T))方法分析相关基因表达数据。方法。2001;25:402-8。gydF4y2Ba
- 51.gydF4y2Ba
Batoko H, Zheng HQ, Hawes C, Moore I. rab1 GTPase在植物内质网和高尔基体之间的运输和正常的高尔基体运动中是必需的。植物科学。2000;12:21 1 - 18。gydF4y2Ba
- 52.gydF4y2Ba
Bueno MA, Gomez A, Sepulveda F, Segui JM, testllano PS, Manzanera JA, Risueno MCgydF4y2BaQuercus木栓gydF4y2Ba花药模仿合子胚,在长期花药培养中保持单倍体。中国植物科学,2003;29(3):344 - 344。gydF4y2Ba
- 53.gydF4y2Ba
Guglielmino N, Liberman M, Catesson AM, Mareck A, Prat R, Mutaftschiev S, Goldberg R.杨树形成层和内树皮果胶甲基酯酶的定位、性质和季节变化。足底。1997;202:70-5。gydF4y2Ba
- 54.gydF4y2Ba
果胶与细胞壁物理性质在花粉管生长中的作用gydF4y2Ba茄属植物chacoensegydF4y2Ba.足底。2005;220:582 - 92。gydF4y2Ba
- 55.gydF4y2Ba
Louvet R, Cavel E, Gutierrez L, Guenin S, Roger D, Gillet F, Guerineau F, Pelloux J.硅果发育过程中果胶甲基酯酶基因家族的综合表达分析gydF4y2Ba拟南芥gydF4y2Ba.足底。2006;224:782 - 91。gydF4y2Ba
- 56.gydF4y2Ba
王志强,王志强,王志强,等。半乳糖醛酸甲基酯化反应的研究进展。植物学报。2009;2:851-60。gydF4y2Ba
- 57.gydF4y2Ba
莱维斯克-特伦布莱G,穆勒K,曼斯菲尔德SD,霍恩GW。高度甲基酯化种子是一种参与胚胎发育的果胶甲酯酶。植物物理学报,2015;gydF4y2Ba
- 58.gydF4y2Ba
Braybrook SA, Peaucelle A.器官形成的机械化学方面gydF4y2Ba拟南芥gydF4y2Ba:生长素与果胶的关系。PLoS ONE。2013; 8: e57813。gydF4y2Ba
- 59.gydF4y2Ba
Peaucelle A, Braybrook SA, Le Guillou L, Bron E, Kuhlemeier C, Hofte H.果胶诱导的细胞壁力学变化是器官启动的基础gydF4y2Ba拟南芥gydF4y2Ba.现代生物学报,2011;21:1720-6。gydF4y2Ba
- 60.gydF4y2Ba
莫勒B,魏杰斯D.生长素对胚胎格局的控制。中国生物医学工程学报。2009;1:a001545。gydF4y2Ba
- 61.gydF4y2Ba
Rodriguez-Sanz H, Solis MT, Lopez MF, Gomez-Cadenas A, Risueno MC, Testillano PS.胁迫诱导小孢子胚胎发生、起始和进展中生长素的生物合成、积累、作用和转运gydF4y2Ba芸苔属植物显著gydF4y2Ba.植物物理学报,2015;gydF4y2Ba
- 62.gydF4y2Ba
昆汀M,黄诺A, Morvan O, Morvan C.亚麻下胚轴组织中果胶甲基化蛋白的免疫定位。植物物理与生物化学。1997;35:475-82。gydF4y2Ba
- 63.gydF4y2Ba
Rodriguez-Sanz H, Moreno-Romero J, Solis MT, Kohler C, Risueno MC, Testillano PS.小孢子重编程胚胎发生过程中组蛋白甲基化和乙酰化的变化与Bn同时发生gydF4y2BaHKMTgydF4y2Ba和BngydF4y2Ba帽子gydF4y2Ba表达和与细胞全能性、增殖和分化相关gydF4y2Ba芸苔属植物显著gydF4y2Ba.Cytogen Genome res 2014; 143:209-18。gydF4y2Ba
- 64.gydF4y2Ba
Peaucelle A, Louvet R, Johansen JN, Hofte H, Laufs P, Pelloux J, Mouille G.拟南芥的成叶性受细胞壁果胶甲基酯化状态的控制。当代生物学,2008;18:43 - 8。gydF4y2Ba
- 65.gydF4y2Ba
Ramírez C, Chiancone B, tesllano PS, García-Fojeda B, Germana MA, Risueño MCgydF4y2Ba柑橘类gydF4y2Bamicrospore-derived胚胎。生物学报2003;45:53-8。gydF4y2Ba
- 66.gydF4y2Ba
Willats WGT, McCartney L, Mackie W, Knox JP。果胶:细胞生物学及功能分析展望。植物分子生物学,2001;47:9-27。gydF4y2Ba
- 67.gydF4y2Ba
李永强,Mareck A, Faleri C, Moscatelli A,刘强,Cresti M.花粉管果胶甲基酯酶异构体的检测与定位gydF4y2Ba烟草gydF4y2Ba中国植物学报。2002;26(2):344 - 344。gydF4y2Ba
- 68.gydF4y2Ba
陈建平,陈建平,陈建平。花粉管中果胶甲基酯酶与果胶动力学。植物学报。2005;17:3219-26。gydF4y2Ba
- 69.gydF4y2Ba
Leroux C, Bouton S, Kiefer-Meyer MC, Fabrice TN, Mareck A, Guenin S, Fournet F, Ringli C, peloux J, Driouich A,等。果胶甲基酯48参与gydF4y2Ba拟南芥gydF4y2Ba花粉粒萌发。植物物理学报,2015;gydF4y2Ba
确认gydF4y2Ba
我们感谢CSIC开放获取出版支持计划通过其信息资源研究单位(URICI)对出版费用的支持。gydF4y2Ba
资金gydF4y2Ba
由西班牙经济和竞争力部(MINECO)和欧洲区域发展基金(ERDF/FEDER)资助的项目(BFU2011-23752, AGL2014-52028-R)支持的工作。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
所有支持研究结果的数据都包含在手稿中。gydF4y2Ba
作者的贡献gydF4y2Ba
MTS完成了大部分的实验工作,体外培养、RT-PCR表达分析、FISH、免疫荧光和点印迹分析;她准备了初稿和数字。EB通过定量PCR进行表达分析。MCR参与了工作的设计和结果的讨论。PST设计并指导实验工作,分析结果,阐述结论并撰写稿件。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Solís, MT., Berenguer, E., Risueño, M.C.gydF4y2Baet al。gydF4y2BaBngydF4y2Ba中外职业gydF4y2Ba小孢子重编程后是否逐步诱导胚胎发生,与果胶去酯化和细胞分化有关gydF4y2Ba芸苔属植物显著gydF4y2Ba.gydF4y2BaBMC植物生物学gydF4y2Ba16日,gydF4y2Ba176(2016)。https://doi.org/10.1186/s12870-016-0863-8gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-016-0863-8gydF4y2Ba
关键字gydF4y2Ba
- 果胶methylesterasegydF4y2Ba
- 果胶酯化gydF4y2Ba
- 细胞壁重塑gydF4y2Ba
- 细胞重新编程gydF4y2Ba
- 小孢子胚胎发生gydF4y2Ba
- 花粉gydF4y2Ba
- 配子体发育gydF4y2Ba
- 全能性gydF4y2Ba
- 分化gydF4y2Ba
- 扩散gydF4y2Ba