- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发表:gydF4y2Ba
拟南芥蛋白二硫异构酶8是一种具有巯基二硫氧化酶活性的I型内质网跨膜蛋白gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba16.gydF4y2Ba, 文章编号:gydF4y2Ba181gydF4y2Ba(gydF4y2Ba2016gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
在真核生物中,经典的蛋白二硫键异构酶(pdi)通过催化二硫键的形成、断裂和重排,促进内质网中新生分泌蛋白的氧化折叠。陆生植物编码6个结构上不同的PDIs亚科。PDI-B亚科是陆生植物特有的,在拟南芥中只有一个成员PDI8。与传统的pdiis(缺乏跨膜结构域(TMD))不同,PDI8的独特之处在于它有一个c端TMD和一个单一的n端硫氧还蛋白结构域(而不是两个)。迄今为止,还没有PDI8异构体的实验特征。在这里,我们描述了这个PDI家族的新成员的膜方向、表达、亚细胞定位和生化功能的特性。gydF4y2Ba
结果gydF4y2Ba
植物窝藏组织化学染色gydF4y2BaPDI8.gydF4y2Ba启动子:β-葡萄糖醛酸酶(GUS)融合显示gydF4y2BaPDI8.gydF4y2Ba启动子在年轻,膨胀的叶子,子叶的护卫细胞和几个器官的血管系统中具有高度活性,包括根,叶子,子叶和花。免疫电解显微镜研究使用根部和芽顶部细胞的PDI8特异性抗体显示PDI8定位成内质网(ER)。两种PDI8融合到绿色荧光蛋白(SPGFP-PDI8和PDI8-GFP-KKED)的瞬时表达也导致ER标记。蛋白酶保护免疫斑分析表明,PDI8是I型膜蛋白,其催化结构域面临ER腔。PDI8的腔部分能够在功能上补充原核蛋白质复合酶,二硫化物酶(DSBA)的损失,如通过所述周质碱性磷酸酶的重构所证明的所述gydF4y2Ba大肠杆菌gydF4y2Ba.gydF4y2Ba
结论gydF4y2Ba
结果表明,PDI8是I型跨膜蛋白,其催化结构域面临着ER的内腔和在半胱氨酸氧化中以产生二硫键。在折叠新合成的分泌蛋白时可能发挥作用,因为它们将横跨ER膜翻译成腔。这些基础结果打开了识别PDI8的基板的门,以便更彻底地了解其在植物中的功能。gydF4y2Ba
背景gydF4y2Ba
过境通过分泌途径要求二硫键许多蛋白质,以稳定他们的原生功能形态。在分泌蛋白二硫键形成的内质网(ER)中主要发生,并且由蛋白质二硫键异构酶(PDI)家族的成员介导的。经典的PDI(由PDIA1哺乳动物表示,并且在PDI1gydF4y2Ba酿酒酵母酿酒酵母gydF4y2Ba)是一种多功能酶,能够催化氧化,还原,或二硫键异构化在广泛的底物蛋白gydF4y2Ba在体外gydF4y2Ba[gydF4y2Ba5gydF4y2Ba],还可以帮助蛋白质折叠作为分子伴侣[gydF4y2Ba21.gydF4y2Ba,gydF4y2Ba32.gydF4y2Ba].经典的PDI结构由布置中的四个模块化域组成gydF4y2Baa-b-b'-a'gydF4y2Ba, 在哪里gydF4y2Ba一个gydF4y2Ba和gydF4y2Ba一种'gydF4y2Ba是催化结构域共享同源性的硫氧还蛋白[gydF4y2Ba9gydF4y2Ba].催化结构域含有由两个氨基酸(CXXC)分离的两个半胱氨酸组成的氧化还原活性的静脉二硫醇。相比之下,gydF4y2BabgydF4y2Ba和gydF4y2BaB'gydF4y2Ba域缺乏的序列同源性硫氧还蛋白,但具备βαβαβαββα硫氧还蛋白结构折叠[gydF4y2Ba16.gydF4y2Ba[有着gydF4y2BaB'gydF4y2Ba作为错误折叠蛋白的原理结合位点用作域的域[gydF4y2Ba15.gydF4y2Ba].在胰腺特异性人类PDI同系物PDIA2的情况下gydF4y2Bab”gydF4y2Ba区域与伴侣活动有关[gydF4y2Ba11.gydF4y2Ba].gydF4y2Ba
虽然PDIS与gydF4y2Baa-b-b'-a'gydF4y2Ba结构在动物,植物和酵母上保守,各种各样的Pdi样蛋白质偏离这种布置。陆地植物编码六个结构性分歧的PDI亚属,指定为A,B,C,L,M和S [gydF4y2Ba26.gydF4y2Ba].dicot模型总共14个PDI,gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba,包括六种PDI-1,三种同种型的PDI-C,两种同种型PDI-M,以及每种PDI-A,PDI-B和PDI-S的单同种型。虽然尚未阐明大多数拟南芥PDI蛋白的功能,但越来越多的证据表明,几种PDIS已经演变为植物生长和发育中的不同作用。PDI-L子类的成员(PDI1,PDI2,PDI3,PDI4,PDI5和PDI6)分享gydF4y2Baa-b-b'-a'gydF4y2Ba经典PDI的排列,主要定位于ER[gydF4y2Ba37.gydF4y2Ba],尽管PDI5也存在于蛋白质贮藏液泡中[gydF4y2Ba2GydF4y2Ba]叶绿体中的PDI6[gydF4y2Ba34.gydF4y2Ba[两种液泡和核中的PDI2 [gydF4y2Ba6gydF4y2Ba,gydF4y2Ba24.gydF4y2Ba].虽然PDI5对副驾驶和抑制涉及编程细胞死亡的半胱氨酸(Cys)蛋白酶影响胚胎发育[gydF4y2Ba2GydF4y2Ba],它的姐妹旁系同源PDI6被牵连作为光抑制的调节剂[gydF4y2Ba34.gydF4y2Ba].PDI2与雌激素受体伴侣BiP和核转录因子MEE8(母效胚胎阻滞8)相互作用,并在种子中高度表达,提示参与胚胎/种子发育[gydF4y2Ba6gydF4y2Ba].gydF4y2Ba
PDI-M和PDI-S同种型含有两种催化剂gydF4y2Ba一个gydF4y2Ba-type域,但没有中间氧化还原活动gydF4y2BabgydF4y2Ba型结构域在PDI-L亚型实测值[gydF4y2Ba20.gydF4y2Ba].PDI-M同种型有一个gydF4y2Ba一个gydF4y2Ba0gydF4y2Ba-A-BgydF4y2Ba和哺乳动物PDIA6的同系物[gydF4y2Ba26.gydF4y2Ba],而PDI-S同种型有一个gydF4y2Ba一个gydF4y2Ba0gydF4y2Ba-广告gydF4y2Ba安排,gydF4y2BaDgydF4y2Ba代表了一个未知功能的所有α - 螺旋结构域[gydF4y2Ba10.gydF4y2Ba].PDI-M(PDI9和PDI10)和PDI-S(PDI11)都定位于ER [拟南芥同种型gydF4y2Ba31.gydF4y2Ba,gydF4y2Ba37.gydF4y2Ba],PDI-M同种型积累在被称为ER主体的ER的微粒子内[gydF4y2Ba37.gydF4y2Ba].在拟南芥中,PDI11的截短版本的表达扰乱了花粉管引导和胚胎囊发育[gydF4y2Ba31.gydF4y2Ba].gydF4y2Ba
偏离古典的PDI的两个引人注目的例子gydF4y2Baa-b-b'-a'gydF4y2Ba域排列是PDI-B和PDI-C子系列。与大多数PDI系列不同,预计PDI-B和PDI-C分别包含一个或两个跨膜域(TMD)[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba].虽然PDI-B和PDI-C都有推定的跨膜PDI,但它们含有独特的结构特征,使其彼此分开。PDI-C同种型具有单一催化剂gydF4y2Ba一个gydF4y2Ba结构域,两端通过与酵母ERV41P和ERV46P同源的序列两端[gydF4y2Ba38.gydF4y2Ba]最近涉及作为缺乏传统酵母ER保留信号的ER蛋白质的货物受体涉及货物受体,HDEL [gydF4y2Ba27.gydF4y2Ba].相比之下,PDI-B同种型具有gydF4y2Baa-b-b”gydF4y2Ba结构域排列使人联想到经典的PDI结构,但PDI- b亚型缺乏第二催化(gydF4y2Ba一种'gydF4y2Ba)域,而是拥有C终端TMD [gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba].PDI-B和PDI-C同种型尚未进行实验表征。PDI-B亚家族用拟南芥,PDI8(Arabidopsis Genome标识符AT1G35620)中的单个构件表示。在这里,我们描述了这个PDI家族的新成员的膜方向、表达、亚细胞定位和生化功能的特性。gydF4y2Ba
结果gydF4y2Ba
PDI8的结构域结构和序列特征gydF4y2Ba
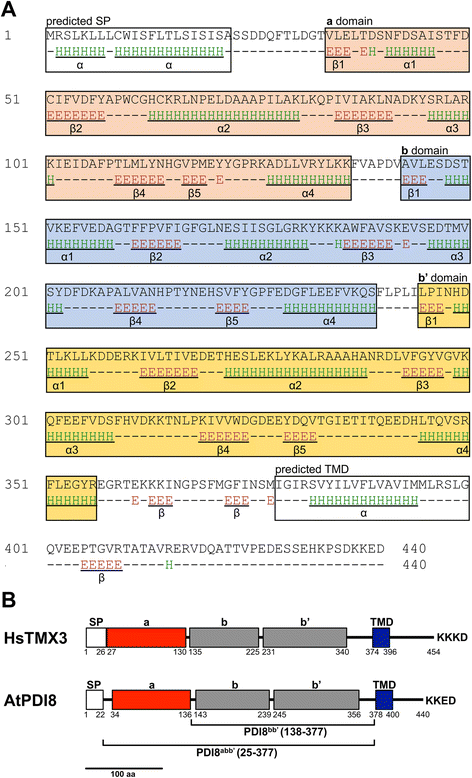
拟南芥的gydF4y2BaPDI8.gydF4y2Ba基因含有五个外显子并编码440氨基酸的推导多肽[gydF4y2Ba20.gydF4y2Ba].根据SignalP-4.1的预测,PDI8序列的前22个氨基酸是一个可剪切的信号肽(S均值= 0.936),得到的成熟PDI8蛋白的计算分子量为47.4 kDa,理论pI为5.01。据TMHMM v. 2.0预测,PDI8包含一个单一的TMD,跨越PDI8前蛋白序列的378-400个残基。通过SPIDER2对PDI8前蛋白的二级结构预测,发现α-螺旋和β-链的交替模式,包括三个与硫氧还蛋白结构褶皱的间隔,βαβαββα(图)。gydF4y2Ba1AgydF4y2Ba).属于硫氧还蛋白折叠类的蛋白质结构域是根据它们的二级结构元素识别的,而不是与细胞质氧化还原蛋白硫氧还蛋白的实际序列同源[gydF4y2Ba4gydF4y2Ba].尽管它们对硫昔林预测的结构相似之处,PDI8的三个硫氧嘧啶末端域不会彼此共享显着的序列同源性,而且只有第一域(域名gydF4y2Ba一个gydF4y2Ba在图中。gydF4y2Ba1AgydF4y2Ba)与规范硫昔林蛋白分享同源性。gydF4y2Ba
PDI8的域装置。gydF4y2Ba一个gydF4y2BaPDI8的二级结构。α-螺旋(E)和β-链(H)的位置基于Spider2的预测。硫昔林折叠域(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba和gydF4y2BaB'gydF4y2Ba),盒装预测信号肽(SP)和PDI8的TMD。每个嗜肺素折叠由5β股和4α-螺旋(下划线)组成,在安排β中gydF4y2Ba1gydF4y2Ba-αgydF4y2Ba1gydF4y2Ba-βgydF4y2Ba2GydF4y2Ba-αgydF4y2Ba2GydF4y2Ba-βgydF4y2Ba3.gydF4y2Ba-αgydF4y2Ba3.gydF4y2Ba-βgydF4y2Ba4gydF4y2Ba-βgydF4y2Ba5gydF4y2Ba-αgydF4y2Ba4gydF4y2Ba.gydF4y2BabgydF4y2Ba域组织的比较gydF4y2BaHOMO SAPIENS.gydF4y2BaTMX3和拟南芥PDI8,表示SP,TMD,和结构域的相对位置gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba和gydF4y2BaB'gydF4y2Ba.PDI8.gydF4y2BaABB'gydF4y2Ba和PDI8gydF4y2BaBB'gydF4y2Ba代表本研究中使用的PDI8的截短形式gydF4y2Ba
按照惯例,PDI氧化还原活性的硫氧嘧啶末端框架被称为gydF4y2Ba一个gydF4y2Ba域,而氧化还原活性硫氧还蛋白折叠结构域被称为gydF4y2BabgydF4y2Ba域[gydF4y2Ba3.gydF4y2Ba].PDI8的N-末端最常毒素折叠域是一个gydF4y2Ba一个gydF4y2Ba- 域域共享42%和35%的序列标识gydF4y2Ba一个gydF4y2Ba和gydF4y2Ba一种'gydF4y2Ba人类PDI结构域分别含有CGHC氧化还原活性位点基质gydF4y2Ba一个gydF4y2Ba和gydF4y2Ba一种'gydF4y2Ba来自人和酵母经典PDI的结构域。PDI8的其它两个硫氧还蛋白折叠结构域不含有任何可能的氧化还原活性的Cys残基,并因此命名为gydF4y2BabgydF4y2Ba-type域名(gydF4y2BabgydF4y2Ba,gydF4y2Bab”)的gydF4y2Ba.拟南芥TAIR10蛋白数据库的BLAST搜索结果表明,拟南芥的TAIR10蛋白与拟南芥的TAIR10蛋白存在一定的相关性gydF4y2BabgydF4y2Ba和gydF4y2BaB'gydF4y2BaPDI8的域不从拟南芥共享显著同源性的其他蛋白质,包括gydF4y2BabgydF4y2Ba和gydF4y2BaB'gydF4y2BaPDI家庭其他成员的域名。此外,尽管PDI8与人硫氧嗪相关膜蛋白3(TMX3;图。gydF4y2Ba1B.gydF4y2Ba),在氨基酸水平之间没有发现同源性gydF4y2BabgydF4y2Ba使用BLAST算法的成对序列相似性比较的PDI8和TMX3的型号。gydF4y2Ba
与植物PDI家族的先前基因组分析一致[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba[我们在调查的所有单子叶和单萝卜物种中鉴定了至少一种PDI8,以及模型苔藓gydF4y2BaPhyscomitrella patens.gydF4y2Ba和淋巴结gydF4y2Ba卷柏moellendorffiigydF4y2Ba,而没有PDI8同源基因代表绿藻绿藻物种的基因组中是明显的(表gydF4y2Ba1gydF4y2Ba).BLAST搜索使用唯一gydF4y2BaBB'gydF4y2Ba拟南芥PDI8区域也未能在非植物物种中识别出PDI8的同源性,表明PDI-B亚科是植物特有的。几乎所有单子叶和双子叶PDI8同源基因都具有经典的PDI二硫醇活性位点序列CGHC,尽管这两个PDI8同源基因中有一个来自gydF4y2BaPopulus Trichocarpa.gydF4y2Ba包含非经典变型CTHC。在PDI8同源基因中只有非经典的CxxC基序变异存在gydF4y2BaPhyscomatrella.gydF4y2Ba(CKHC,CGFC)和gydF4y2BaSelaginella.gydF4y2Ba(CSHC)。Arabidopsis PDI8的C-末端以kked序列结束[gydF4y2Ba20.gydF4y2Ba],类似于KKxx或xKxx四肽信号,用于通过COPI包衣囊泡内质网检索跨膜蛋白。对PDI8同源物的C-末端进行比较,发现所有双子叶同源物和来自gydF4y2BaPhyscomatrella.gydF4y2Ba共用C型终端图案,XKXD,而单码PDI8 Orthologs拥有C末端图案XHX(E / D)。gydF4y2Ba
PDI8.gydF4y2Ba使用GUS记者系统的启动子表达分析gydF4y2Ba
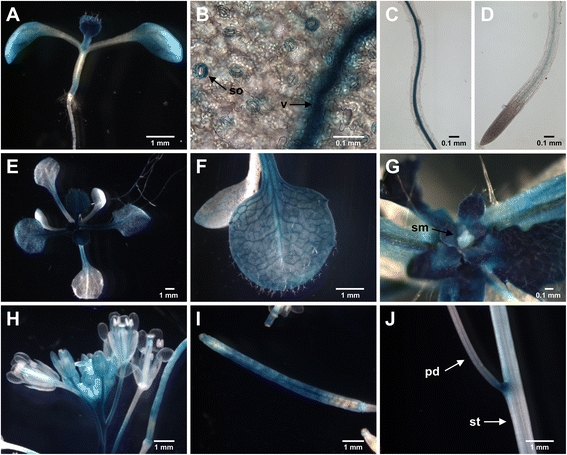
检查空间表达式模式gydF4y2Ba足底PDI8gydF4y2Ba,我们产生的转基因拟南芥植物患上〜2.3-kB区域的立即上游gydF4y2BaPDI8.gydF4y2Ba起始密码子(包括gydF4y2BaPDI8.gydF4y2Ba启动子和5’非翻译区域)转录融合到报告基因,β-葡萄糖醛酸酶(GUS)。对11个独立的转基因株系进行分析,建立其一致表达模式gydF4y2BaPDI8.gydF4y2BaprogydF4y2Ba:Gus.gydF4y2Ba融合在幼苗和开花植物。的7天龄的幼苗的组织学染色显示在新兴的第一片真叶,子叶,根的GUS转基因的强表达,和胚轴的基部(图gydF4y2Ba2AgydF4y2Ba).在子叶中,GUS染色主要检测在脉管系统和防护细胞中(图。gydF4y2Ba2B.gydF4y2Ba).在根中,在成熟区的脉管系统中仅在脉管系统中观察到GUS染色(图。gydF4y2Ba2CgydF4y2Ba)和根尖(图。gydF4y2Ba2DgydF4y2Ba).14天大的染色模式gydF4y2BaPDI8.gydF4y2BaprogydF4y2Ba:Gus.gydF4y2Ba植物(图。gydF4y2Ba2EgydF4y2Ba)与7天幼苗的幼苗类似,尽管较旧的(膨胀的)叶子染色主要被限制在脉管系统(图。gydF4y2Ba2FgydF4y2Ba),而在较小的(新兴)叶片中观察到强大的GUS染色(图。gydF4y2Ba2GgydF4y2Ba).但是,我们没有观察到拍摄顶端公司的重要GUS染色(图。gydF4y2Ba2GgydF4y2Ba).gydF4y2Ba
表达模式的gydF4y2BaPDI8.gydF4y2BaprogydF4y2Ba:Gus.gydF4y2Ba幼苗和开花植物中的记者构建。Gus染色模式为7天幼苗(gydF4y2Ba一个gydF4y2Ba),带子叶气孔(SO)和脉管系统(V)的特写图像(gydF4y2BabgydF4y2Ba)、根成熟区(gydF4y2BacgydF4y2Ba)和根尖(gydF4y2BadgydF4y2Ba).Gus染色图案为14天幼苗(gydF4y2BaegydF4y2Ba),具有膨胀叶的特写图像(gydF4y2BafgydF4y2Ba)和拍摄顶点(gydF4y2BaggydF4y2Ba).在面板gydF4y2BaggydF4y2Ba,新兴的叶子拉回到暴露茎尖分生组织(SM)。在鲜花GUS染色6周龄的植物图案(gydF4y2BahgydF4y2Ba),膨胀长角果(gydF4y2Ba我gydF4y2Ba)、花序茎(gydF4y2BajgydF4y2Ba).在gydF4y2BajgydF4y2Ba,染色显示在茎(st)和花梗(pd)的连接处gydF4y2Ba
在6周龄的生殖期植物中gydF4y2BaPDI8.gydF4y2BaprogydF4y2Ba:Gus.gydF4y2Ba在花柱、花瓣、萼片和雄蕊花丝的脉管系统中检测到转基因。gydF4y2Ba2hgydF4y2Ba).花梗中也有较强的GUS表达,但在花梗/花连接处附近的GUS染色降低(图2)。gydF4y2Ba2hgydF4y2Ba).我们还检测到在长角果(显著GUS表达图。gydF4y2Ba2IgydF4y2Ba)和花梗/干结(图。gydF4y2Ba2JgydF4y2Ba).gydF4y2Ba
的表达模式gydF4y2BaPDI8.gydF4y2Ba还通过在生物分析资源ePlant浏览器采公开可用的微阵列数据(检查gydF4y2Bahttps://bar.utoronto.ca/eplant/gydF4y2Ba;[gydF4y2Ba33.gydF4y2Ba])。与我们的GUS报告表达分析一致,gydF4y2BaPDI8.gydF4y2Ba在许多植物组织中检测到转录本,包括根、叶、花和角果(附加文件gydF4y2Ba1gydF4y2Ba).膨大的角果、心胚、球形胚、花梗、24 h浸种和2gydF4y2BangydF4y2Ba花序茎的节间,而最低的平均表达值对应于成熟花粉。gydF4y2Ba
PDI8主要定位于ergydF4y2Ba
使用两种不同的方法检测PDI8的亚细胞定位模式:1)在拟南芥叶原生质体中瞬时表达PDI8与绿色荧光蛋白变体GFP(S65T)的融合;2)通过透射免疫电子显微镜检测野生型拟南芥超薄切片中的天然PDI8。对于第一种方法,由于PDI8在其N端可能包含一个信号肽,在其C端可能包含一个内质网恢复信号,因此我们生成了两个表达GFP(S65T)的结构体,它们位于与DNA相对的不同位置gydF4y2BaPDI8.gydF4y2Ba开放阅读框(图gydF4y2Ba3AgydF4y2Ba).在SPGFP-PDI8融合中,GFP(S65T)在内部定位在信号肽和PDI8的成熟肽序列之间。在PDI8-GFP-KKED中,GFP(S65T)位于PDI8的C末端,用GFP(S65T)的C末端改性以包括PDI8,KKED的推定的ER保留序列。当在具有ER的标记物的原生质体中瞬时表达时,SPGFP-PDI8和PDI8-GFP-KKED融合件都表现出亚细胞分布模式,其强烈地与ER-MCHERRY的网络状定位模式的亚细胞分布图案。未使用的GFP(S65T)显示出明显的分布图案,其比ER-MCHERRY标记更加漫射(图。gydF4y2Ba3B.gydF4y2Ba).gydF4y2Ba
为了促进PDI8的更高分辨率亚细胞定位,在兔子体内针对含有gydF4y2Bab”gydF4y2Ba区(PDI8gydF4y2BaBB'gydF4y2Ba;无花果。gydF4y2Ba1B.gydF4y2Ba)蛋白质。通过针对重组PDI8的免疫印迹分析检查抗PDI8抗血清的反应性和特异性gydF4y2BaBB'gydF4y2Ba,并针对从7天古老的野生型(WT)拟南芥幼苗和表达的转基因植物中提取的总蛋白质样品gydF4y2BaPDI8.gydF4y2Ba强括号CAMV 35S启动子的cDNA以义语取向(gydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba)或反义方向。抗PDI8抗血清强烈检测到重组PDI8gydF4y2BaBB'gydF4y2Ba蛋白质(附加文件gydF4y2Ba2GydF4y2Baa),并且在wt和wt和mw中的蛋白质〜54kdagydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba行(附加文件)gydF4y2Ba2GydF4y2Bab)。将54-kda蛋白在非常强烈地检测到gydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba相对于WT的过度表达线,表明该蛋白质对应于植物中的PDI8。我们没有观察到与过表达或反义抑制相关的任何表型gydF4y2BaPDI8.gydF4y2Ba.然而,对转录水平的分析gydF4y2BaPDI8.gydF4y2Ba通过定量逆转录PCR(RT-QPCR)反义线显示内源性gydF4y2BaPDI8.gydF4y2Ba基因仅在这些线(40-50%)部分抑制,表明所获得的反义线不是真正的敲除(数据未显示)。gydF4y2Ba
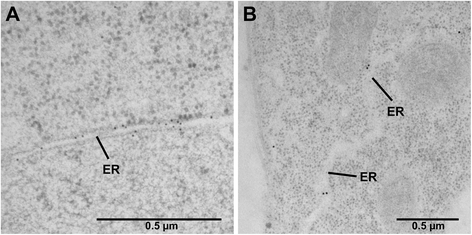
对于原生PDI8的定位模式的高分辨率分析,我们采用高压冷冻并冷冻干燥,替代制备的试样用于从野生型拟南芥幼苗的枝条和根顶点免疫金标记。切片试样后,将它们标记与抗PDI8抗血清,接着用金 - 偶联的抗兔抗血清标记二次。在枝条顶端细胞中,由防PDI8抗血清的ER的突出标记,观察到(图gydF4y2Ba4AgydF4y2Ba).这种抗血清也在根尖细胞中标记ER(图。gydF4y2Ba4BgydF4y2Ba).我们没有检测到显著的抗pdi8标记任何其他亚细胞结构。在野生型幼苗切片上使用预免疫血清或在反义线上使用抗pdi8抗血清均未观察到标记(附加文件)gydF4y2Ba3.gydF4y2BaA,B,C)。因此,使用抗PDI8抗血清观察ER标记(图。gydF4y2Ba4AgydF4y2Ba)专门检测PDI8。从部分gydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba用抗PDI8抗血清标记的过度表达线显示出ER的强烈标记,表明植物中PDI8的过度表达不会导致蛋白质的错误分析(附加文件gydF4y2Ba3.gydF4y2Bad)。gydF4y2Ba
PDI8是I型整体膜蛋白gydF4y2Ba
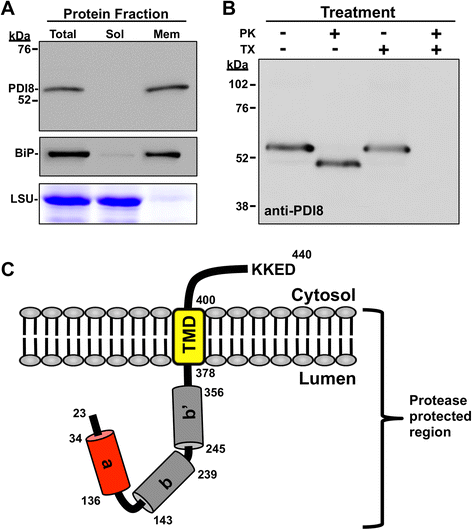
为了进一步研究PDI8的分子特性,研究了PDI8蛋白在微粒体膜中的取向。由于PDI8在CaMV 35S启动子下的过度表达不会导致PDI8在稳定转化植物中的错误定位(补充文件gydF4y2Ba3.gydF4y2Bad),或者在SPGFP-PDI8或PDI8-GFP-KKED融合形式的叶片原生质体中瞬时表达时(图gydF4y2Ba3B.gydF4y2Ba),微粒体由gydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba由于强大的PDI8信号引起的植物这些线在免疫印迹上呈现。分离gydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba蛋白质样品变成可溶性和微粒体膜蛋白级分,显示PDI8专门与微粒体膜馏分相关(图。gydF4y2Ba5gydF4y2Ba,左上面板,车道2和3)。通过使用多克隆抗体识别BIP,还测试微粒体的存在,用于通过使用多克隆抗体的微克抗体的微克抗体。BIP主要在微粒体馏分中发现(图。gydF4y2Ba5gydF4y2Ba,中图),但的BiP少量在可溶性蛋白质级分,这大概的ER网络以产生微粒体的机械破碎期间从内质网腔一些蛋白质的逸出是由于也进行检测。考马斯染色的SDS-PAGE凝胶的装载总蛋白的等效体积,可溶性蛋白,并证明了的Rubisco(其用作用于可溶性蛋白的标记物)的大亚基存在于总蛋白和可溶性两个微粒体蛋白的级分蛋白质级分中相似量的,但在微粒体部分(图不存在。gydF4y2Ba5gydF4y2Ba,下图)。gydF4y2Ba
PDI8的膜取向。gydF4y2Ba一个gydF4y2Ba免疫印迹分析提取的蛋白质gydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba植物。的gydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba通过离心分离总蛋白质匀浆成可溶性(溶胶)和微粒体膜(MEM)级分。将免疫印迹与亲和纯化的抗PDI8抗血清(上图)一起温育。使用多克隆山羊抗BIP抗体作为微粒体的标记物(中间组)。用COMASSIE(下图)染色的SDS-PAGE凝胶中的SDS-PAGE凝胶中的大量亚基(LSU)用作可溶性相的标志物。gydF4y2BabgydF4y2Ba用蛋白酶保护测定进行gydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba微粒子。用50μg/ ml蛋白酶K(PK)和0.1%Triton X-100(Tx)处理样品或未处理( - ),使用抗PDI8抗血清进行免疫印迹分析。gydF4y2BacgydF4y2Ba在ER膜中取向的PDI8多肽的模型gydF4y2Ba
由于PDI8被预测含有靠近其C末端的单TMD,我们试图地址是否N-末端gydF4y2Baa-b-b”gydF4y2BaPDI8区为管腔型(I型膜蛋白)或胞质型(II型)。gydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba用蛋白酶K处理微粒体膜,以确定PDI8 N-末端区域是否位于微粒体内部内,因此将保护免于降解。如图1所示。gydF4y2Ba5 bgydF4y2Ba,治疗gydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba含有蛋白酶的微粒体使PDI8的表观MW下降到~48 kDa(比较通道1和通道2),虽然治疗蛋白酶和洗涤剂(Triton x - 100)扰乱微粒体膜完全退化了PDI8(巷4)。用洗涤剂单独治疗没有影响明显MW PDI8(巷3)。因为PDI8 c端尾部的(401 - 440)残留贡献理论~ 5 kDa PDI8总兆瓦,蛋白酶K处理后PDI8的分子量轻微下降与c端尾部位于微粒体外侧一致。图中所示为面向ER膜的PDI8多肽模型。gydF4y2Ba5度gydF4y2Ba,表明催化结构域(a”)和硫氧还蛋白折叠结构域(B,B”)定向到ER的内腔中。gydF4y2Ba
PDI8的异源表达功能互补gydF4y2BadsbAgydF4y2Ba-gydF4y2Ba突变gydF4y2Ba大肠杆菌gydF4y2Ba通过重构碱性磷酸酶活性gydF4y2Ba
为了进一步了解PDI8的分子功能,我们检查了PDI8功能是否可以补充gydF4y2Ba大肠杆菌gydF4y2Ba氧化蛋白折叠突变体,gydF4y2BadsbAgydF4y2Ba-gydF4y2Ba.的gydF4y2Ba大肠杆菌gydF4y2Ba通过催化蛋白质二硫键的形成(二硫醇氧化),硫氧嘧啶折叠蛋白DSBA在细菌周质内的蛋白质氧化折叠中起着至关重要的作用。函数损失gydF4y2BadsbAgydF4y2Ba扰乱的几种蛋白质,包括碱性磷酸酶(PhoA的),它在其天然状态是包含在其每个亚基[的两个二硫键同二聚体的正确折叠gydF4y2Ba28.gydF4y2Ba].Phoa活性在a中显着减少gydF4y2BadsbAgydF4y2Ba-gydF4y2Ba缺失突变背景,但可以通过在外周血浆中表达人PDI恢复gydF4y2BadsbAgydF4y2Ba-gydF4y2Ba细胞(gydF4y2Ba14.gydF4y2Ba].gydF4y2Ba
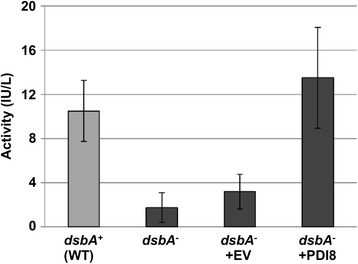
确定PDI8是否同样可以恢复Phoa活动gydF4y2BadsbAgydF4y2Ba-gydF4y2Ba突变体细胞,PDI8的腔部分的编码序列(PDI8gydF4y2BaABB'gydF4y2Ba;无花果。gydF4y2Ba1B.gydF4y2Ba)克隆到细菌表达载体,质粒pFLAG-CTS,编码OmpA信号肽的载体序列之间(用于细菌周质定位)和C末端FLAG表位标签。所得的质粒,质粒pFLAG-PDI8gydF4y2BaABB'gydF4y2Ba,被转化为gydF4y2Ba大肠杆菌gydF4y2Ba菌株RI90,其中含有gydF4y2BadsbAgydF4y2Ba零突变,gydF4y2BaDSBAA1 :: Kan1.gydF4y2Ba.如图1所示。gydF4y2Ba6gydF4y2Ba, PhoA的活动gydF4y2BadsbAgydF4y2Ba-gydF4y2Ba菌株(第2栏)或gydF4y2BadsbAgydF4y2Ba-gydF4y2Ba用PFLAG-CTS空载体(柱3)转化的菌株相对于等源性野生型基本上减小(gydF4y2BadsbAgydF4y2Ba+gydF4y2Ba)父母控制应变RI89(第1栏),而gydF4y2BadsbAgydF4y2Ba-gydF4y2Ba表达PDI8的细胞gydF4y2BaABB'gydF4y2Ba显示出与野生型相似的PhoA活性水平gydF4y2BadsbAgydF4y2Ba+gydF4y2Ba因此,PDI8的管腔部分可以在功能上替代DsbA的二硫化物氧化酶作用gydF4y2Bae Coli.gydF4y2Ba.gydF4y2Ba
讨论gydF4y2Ba
由于它们在真核节上的保守结构,很多研究的注意力集中在含有的古典型PDI上gydF4y2Baa-b-b'-a'gydF4y2Ba域组织。在拟南芥中有六个PDI的与经典的PDI域排列顺序,各已显示定位于内质网腔[gydF4y2Ba2GydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba37.gydF4y2Ba],尽管一些经典型PDI亚型已被证明也定位于其他细胞结构,包括蛋白质储存液泡、叶绿体和细胞核,并作为伴侣和蛋白质折叠酶表现出不同的功能[gydF4y2Ba2GydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba34.gydF4y2Ba].此外,还有一些偏离的PDIgydF4y2Baa-b-b'-a'gydF4y2Ba安排,虽然这些PDI如何从经典PDI中功能差异仍然很差。gydF4y2Ba
在本报告中,我们描述了PDI8,这是拟南芥新型PDI-B亚家族的孤独成员。PDI8拥有三个醒目的差异,将其与古典PDIS区分开来。首先,虽然古典PDI拥有N-Proximal(gydF4y2Ba一个gydF4y2Ba)和c-proximal(gydF4y2Ba一种'gydF4y2Ba)PDI8的肝细毒素催化结构域仅具有单个N近端gydF4y2Ba一个gydF4y2Ba类型域。第二,尽管PDI8包含两个中枢氧化还原不活性gydF4y2BabgydF4y2Ba-类型硫氧还蛋白折叠结构域gydF4y2BaBB'gydF4y2BaPDI8的区域不具有相同的序列同源性gydF4y2BaBB'gydF4y2Ba古典PDI的地区。最后,虽然古典PDI是可溶性ER腔蛋白,PDI8含有位于其C-末端附近的TMD。尽管PDI8的域排列类似于哺乳动物TMX3的域排列,但两种蛋白质之间的序列相似性仅限于它们的催化剂gydF4y2Ba一个gydF4y2Ba仅限域名,暗示它们不是直观的,而是通过单独的进化事件来源。实际上,蛋白质分享同源性gydF4y2BaBB'gydF4y2BaPDI8的区域仅在陆生植物中鉴定,而不是代表性叶绿素绿藻或非植物物种,表明PDI-B亚家族最可能在叶绿素和链光瘤之间的进化分裂后出现(野性藻类+陆生植物)。gydF4y2Ba
基于这一点gydF4y2BaPDI8.gydF4y2BaprogydF4y2Ba:Gus.gydF4y2Ba融合分析,PDI8预计在年轻的时候,新兴的叶子在蛋白质折叠的作用,气孔,并在老叶,根,花器官的血管(图gydF4y2Ba2GydF4y2Ba).最近,gydF4y2BaPDI8.gydF4y2Ba在转录组科的转录组调查中鉴定了转录MRNA的转录,该调查从射击到根部进行长途运输[gydF4y2Ba29.gydF4y2Ba]因此,PDI8蛋白可能在植物组织中产生,而不是在gydF4y2BaPDI8.gydF4y2Ba主动表达启动子。的确,这是gydF4y2BaPDI8.gydF4y2Ba启动子表达模式提出了一种有趣的可能性gydF4y2BaPDI8.gydF4y2Ba在血管系统中表达专门用于动员的目的gydF4y2BaPDI8.gydF4y2Ba的mRNA通过工厂血管系统远处组织,可能以用作生长过程的协调或用于适应在遥远植物器官环境胁迫[信号分子gydF4y2Ba29.gydF4y2Ba].本研究开发的PDI8抗血清,与蛋白质组学方法相结合,提供了调查该假设的机会,并阐明植物中的细胞特异性表达谱。gydF4y2Ba
为了进一步了解其功能,我们测定了PDI8的亚细胞位置。使用两种不同的方法,我们演示了PDI8本地化到ER。在免疫电镜实验中利用pdi8特异性抗血清直接对抗gydF4y2Bab”gydF4y2Ba区域,我们观察到在从野生型拟南芥幼苗的茎尖(图获得部分中的ER的明显标记。gydF4y2Ba4AgydF4y2Ba),在根顶部取出的部分中具有较少标记的标记(图。gydF4y2Ba4BgydF4y2Ba)这种免疫标记模式与报告构建体的表达模式一致gydF4y2BaPDI8.gydF4y2BaprogydF4y2Ba:Gus.gydF4y2Ba,其显示附近的茎尖强表达(图gydF4y2Ba2a,E.gydF4y2Ba),但没有在根尖细胞中可检测的水平表达(图gydF4y2Ba2DgydF4y2Ba).此外,我们在原生质体spGFP-PDI8和PDI8-GFP-KKED的亚细胞分布模式的分析表明,在ER蓄积两种融合蛋白以及(图gydF4y2Ba3B.gydF4y2Ba).鉴于PDI8包含一个潜在的kkxx型ER检索序列,它的功能很可能局限于ER,因为任何逃脱ER膜的PDI8都会通过COPI逆行途径被检索。有趣的是,PDI-B亚家族的所有双子叶家族成员在其c端都具有假定的KKxx或xKxx copi结合信号,而所有单子叶家族的同源基因都含有c端motif xHxx。这与完整膜植物pdi的另一个亚科PDI-C形成了对比,其中单子叶和双子叶成员都具有c端xKxx基序[gydF4y2Ba38.gydF4y2Ba].如果有的话,c端xHxx序列的存在对PDI-B亚家族单子叶细胞成员与双子叶细胞成员的ER保留效率有什么影响,目前还不清楚。gydF4y2Ba
蛋白酶保护实验表明PDI8是I型膜蛋白,其催化剂gydF4y2Ba一个gydF4y2Ba域导向ER腔(图。gydF4y2Ba5 bgydF4y2Ba).由于PDI-L,PDI-M和PDI-S Subfamilies的成员也定位于拟南芥中的ER [gydF4y2Ba37.gydF4y2Ba],膜结合的PDI8在蛋白质折叠中用于蛋白质的特定作用?有越来越多的证据表明,不同的PDI类,同时能够催化类似的反应gydF4y2Ba在体外gydF4y2Ba,扮演专门的角色gydF4y2Ba在活的有机体内gydF4y2Ba在氧化蛋白折叠中。例如,虽然哺乳动物经典PDI成员PDIA1可以催化过氧化氧还蛋白4驱动的氧化蛋白折叠中的二硫键氧化和二硫键异构化,但非经典PDIA6(也称为P5)和TXNDC5(含硫还蛋白结构域蛋白5;也被称为ERp46)作为快速但混杂的二硫氧化酶。相反,PDIA1也作为异构酶来纠正非天然二硫键[gydF4y2Ba25.gydF4y2Ba].这使人想起在氧化蛋白质折叠的gydF4y2Ba大肠杆菌gydF4y2Ba,其中DsbA作为主要的二硫氧化酶,而DsbC作为异构酶[gydF4y2Ba22.gydF4y2Ba].在这里,我们已经表明,gydF4y2BaABB'gydF4y2BaPDI8的区域可以在功能上弥补gydF4y2Ba大肠杆菌Dsba.gydF4y2Ba-gydF4y2Ba突变,表明gydF4y2Ba一个gydF4y2Ba当PDI8结构域在细菌胞质中异质表达时,可以催化二硫键的形成(氧化)。gydF4y2Ba
错误折叠的蛋白可以以各种方式削弱细胞过程,从而导致未折叠蛋白应答(UPR)和ER应力[gydF4y2Ba19.gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].由于PDI在催化蛋白质折叠中起重要作用,ER中错误折叠蛋白的异常积累伴随着PDI表达和活性的增加[gydF4y2Ba12.gydF4y2Ba].然而,在拟南芥中,只有PDI家族成员的一个子集被内质网胁迫的化学诱导剂上调[gydF4y2Ba20.gydF4y2Ba].这些包括一半的PDI-L亚型(PDI1, PDI5和PDI6),以及PDI-M亚型(PDI9和PDI10)和PDI-S亚型(PDI11)。PDI8在内质网应激反应中没有上调,再加上其不典型的内质网膜定位,表明PDI8的功能与经典pdiis不同。一种可能是PDI8定位于内质网膜,因此当新合成的分泌蛋白转运到内质网腔时,它可以迅速地将二硫键引入到这些蛋白中。或者,跨膜PDI8的作用可能是催化二硫化物键的形成和异构化,特别是在ER跨膜或膜锚定蛋白。具有相对较少二硫键的底物蛋白具有较高的概率处于适当的构型,而具有多个二硫键的蛋白具有较高的概率包含非天然二硫键,这些非天然二硫键随后被不同的PDI物种异构化。自gydF4y2BaB'gydF4y2Ba区域作为在人类PDIA1基板,独特的原则,结合位点gydF4y2BaBB'gydF4y2BaPDI8的序列可能允许内源性底物的结合,这与经典真核PDI8不同。gydF4y2Ba
结论gydF4y2Ba
PDI8对陆生物植物是独一无二的,由拟南芥中的单个基因编码,并且是偏离古典的PDI的引人注目的例子gydF4y2Baa-b-b'-a'gydF4y2Ba域的安排。与大多数PDI家族不同,PDI8含有TMD,缺乏第二催化(gydF4y2Ba一种'gydF4y2Ba) 领域。我们证明PDI8是I型内质网跨膜蛋白和巯基二硫化物氧化酶。这项工作铺平了研究,将确定PDI8的氧化还原调控的底物并阐明其独特的功能在子叶保卫细胞,新扩大的叶子和植物的脉管系统的方式。gydF4y2Ba
方法gydF4y2Ba
生物信息分析和鉴定PDI8同源物gydF4y2Ba
为了识别PDI8的同源物,对国家生物技术信息(NCBI)非冗余(NR)蛋白序列数据库(gydF4y2Bahttp://blast.ncbi.nlm.nih.gov/blast.cgi.gydF4y2Ba)和植物血统v10(gydF4y2Bahttp:///phytozome.jgi.doe.gov.gydF4y2Ba),使用gydF4y2BaBB'gydF4y2Ba由于其从拟南芥的其他13个PDI没有同源性,因此PDI8作为搜索查询序列。基于可用的表达的序列标签(EST)序列,校正不完全或不正确的注释蛋白质序列。所有序列及其相应的登录号都在附加文件中提供gydF4y2Ba4gydF4y2Ba与改建以黄色突出显示原始源序列。gydF4y2Ba
使用SignalP程序(4.1)对PDI8进行信号肽切割位点预测(gydF4y2Bahttp://www.cbs.dtu.dk/services/SignalP/gydF4y2Ba;[gydF4y2Ba23.gydF4y2Ba]). 使用基于隐马尔可夫模型的膜蛋白拓扑预测程序TMHMM(v.2.0)获得TMD的预测位置(gydF4y2Bahttp://www.cbs.dtu.dk/services/tmmm/gydF4y2Ba;[gydF4y2Ba18.gydF4y2Ba])。使用Program Spider2获得α-螺旋和β-链的蛋白质二次结构预测(gydF4y2Bahttp://sparks-lab.org/yueyang/server/SPIDER2/gydF4y2Ba;[gydF4y2Ba13.gydF4y2Ba])。gydF4y2Ba
拟南芥转基因植物gydF4y2Ba
包含gydF4y2BaPDI8.gydF4y2Ba在花椰菜马赛克病毒(CAMV)35s启动子和Nopaline合成酶之间插入编码序列(gydF4y2BangydF4y2Ba二元载体的)终止子序列gydF4y2BaPCAMBIA1302gydF4y2Ba创建gydF4y2BaPDI8.gydF4y2Ba过表达构建体,gydF4y2BapC1302 [35gydF4y2BaprogydF4y2BaPDI8):gydF4y2Ba.的gydF4y2BaPDI8.gydF4y2Ba使用由含有工程的SPHI限制性位点的前底底(5'-TCG)的前底底(5'-TCG)从由7天古拟南芥生态型肠胃蛋白酶-0(COL-0)幼苗制备的第一链cDNA扩增编码序列。gydF4y2BaGCA TGCgydF4y2BaGTT CGT TAA AGT TAC TCC TTT G-3')和含有BSTEII位点的反向引物(5'-aaggydF4y2BaGGT CACÇgydF4y2BaAA ACT AGT CCT CTT TTT CAC-3')。这些引物序列中的掺入限制位点(以及本报告中描述的所有后续引物)都加下划线。的gydF4y2BaPDI8.gydF4y2Ba在NCOI和BSTEII限制性位点之间连接cDNA片段gydF4y2BaPCAMBIA1302gydF4y2Ba.用于反义表达gydF4y2BaPDI8.gydF4y2Ba,使用含有BsteII限制部位的前底引物(5'-AAA T.)从cDNA(如上)扩增PDI8 cDNA片段(如上所述)gydF4y2BaGG TGA CCgydF4y2BaT Cat Gag ATC GTT AAA GTT ACT CCT TTG TTG-3'),以及带有Spei网站的反向底漆(5'-AAG TGG GTC AACgydF4y2BaAGT行动gydF4y2BaCCT CTT TTT TGT cac t-3 ')。cDNA片段以反义方向连接在SpeI和BstEII克隆位点之间gydF4y2BaPCAMBIA1302gydF4y2Ba生成构造gydF4y2BapC1302 [35gydF4y2BaprogydF4y2Ba:反义PDI8gydF4y2Ba].gydF4y2Ba
使用储备构建体的稳定转化的转基因型进行启动子表达研究gydF4y2BaPDI8.gydF4y2BaprogydF4y2Ba:Gus.gydF4y2Ba,其中包含一个2.3KB的gydF4y2BaPDI8.gydF4y2Ba转录融合到β-葡糖醛酸酶(GUS)报告基因的启动子片段,gydF4y2BaGusa.gydF4y2Ba.的gydF4y2BaPDI8.gydF4y2Ba利用具有SacI位点(5 ' - TTT)的正向引物,从拟南芥(Col-0)基因组DNA中扩增启动子片段gydF4y2BaGAG CTCgydF4y2BaGTA Gaa GTT TGC TTG AAT ATT CA-3')和NCOI位点的反向底漆(5'-AACgydF4y2BaCCA TGGgydF4y2BaCGA TCT gat TTT cag acc aaa c-3 ')。的gydF4y2BaGusa.gydF4y2Ba基因从中扩增gydF4y2BaPCAMBIA1304gydF4y2Ba使用与NCOI网站的前底漆(5'-TGAgydF4y2BaCCA TGGgydF4y2Ba标签ATC TGA CTA GTT TAC GTC-3')和BSTEII位点的反向底漆(5'-CTC C.gydF4y2BaGG TCA CC.gydF4y2BaŤATT GTT TGC CTC CCT GCT GCG-3')。的gydF4y2BaPDI8.gydF4y2BaprogydF4y2Ba:Gus.gydF4y2Ba融合组装gydF4y2BaPCAMBIA1302gydF4y2Ba通过克隆gydF4y2BaGusa.gydF4y2Ba在载体的NcoI和BstEII位点之间的PCR片段,以创建中间结构gydF4y2BapC1302 [35gydF4y2BaprogydF4y2Ba格斯):gydF4y2Ba.的gydF4y2BaPDI8.gydF4y2Ba然后在SacI和NCOI位点之间克隆启动子片段gydF4y2BapC1302 [35gydF4y2BaprogydF4y2Ba格斯):gydF4y2Ba生产最终的构造,gydF4y2BapC1302 [PDI8gydF4y2BaprogydF4y2Ba格斯):gydF4y2Ba.gydF4y2Ba
的gydF4y2BapC1302 [35gydF4y2BaprogydF4y2BaPDI8):gydF4y2Ba和gydF4y2BapC1302 [PDI8gydF4y2BaprogydF4y2Ba格斯):gydF4y2Ba通过农杆菌介导的转化,使用花浸法将构建物导入野生型拟南芥(Col-0)植物[gydF4y2Ba7gydF4y2Ba].通过对湿霉素抗性的筛选,获得了初步转化子gydF4y2Ba1gydF4y2Ba一代和通过PCR确定的完整转基因的存在。随后通过筛选纯合的转基因系来筛选在T中的100%潮霉素抗性gydF4y2Ba3.gydF4y2Ba的一代。gydF4y2Ba
GUS表达分析gydF4y2Ba
PDI8.gydF4y2BaprogydF4y2Ba:Gus.gydF4y2Ba幼苗在1/2× LS琼脂平板[0.8% (w/v)结冷胶(Sigma-Aldrich, St. Louis, MO), 1/2x Linsmaier & Skoog培养基(Caisson Laboratories, Smithfield, UT)和1.5% (w/v)蔗糖]上垂直生长7或14天,温度为22℃,16 h-light/8 h-dark循环。茎部花序在6周龄时获得gydF4y2BaPDI8.gydF4y2BaprogydF4y2Ba:Gus.gydF4y2Ba在25℃下在16 H光/ 8 H黑暗循环下在Farfard超细发芽混合物(Sun Gro园艺,agawam,mA)上生长的植物。如上所述进行GUS染色[gydF4y2Ba17.gydF4y2Ba].简单地说,组织样品在25°C的90%冰冷丙酮中固定20分钟,然后用染色缓冲液(50 mM磷酸钠缓冲液(pH 7.0), 0.2% Triton X-100, 2 mM铁氰化钾和2 mM铁氰化钾)在冰上洗涤三次,然后浸入含有1 mM 5-溴-4-氯-3-吲哚基-β- d -葡萄糖醛酸环己基铵盐(X-gluc)的染色缓冲液中。将组织真空浸润,37℃O/N孵育。染色后,在70%乙醇中培养,提取可溶性色素,必要时用新鲜的70%乙醇重复。在Olympus BX-51垂直显微镜下获得根和气孔的GUS染色图像,将样品置于50%甘油的玻片上。所有其他图像都是在奥林巴斯SZX-12立体显微镜上拍摄的,样本浸泡在培养皿中70%的乙醇中。gydF4y2Ba
在原生质体spGFP-PDI8的瞬时表达gydF4y2Ba
创建ER标记构建gydF4y2BapBL(35SgydF4y2BaprogydF4y2Ba:ER mCherry)gydF4y2Ba,以及未融合的绿色荧光蛋白(GFP)对照构建物gydF4y2BapBL(35SgydF4y2BaprogydF4y2Ba:GFP(S65T))gydF4y2Ba,之前描述了[gydF4y2Ba6gydF4y2Ba].的构造gydF4y2BapBL(35SgydF4y2BaprogydF4y2Ba:SPGFP-PDI8)gydF4y2Ba通过克隆的KpnI和BstEII位位点之间的DNA序列的下面排列生成gydF4y2BapBL(35SgydF4y2BaprogydF4y2Ba:GFP(S65T))gydF4y2Ba: 一种gydF4y2BaCamv 35s.gydF4y2Ba启动子片段(KPNI / XHOI),PDI8信号肽编码序列 -gydF4y2BaGFP (S65T)gydF4y2Ba片段(XhoI位/ XmaI位),和一个PDI8成熟蛋白质cDNA片段(XmaI位/ BstEII位)。的gydF4y2BaCamv 35s.gydF4y2Ba启动子片段从细胞中扩增gydF4y2BaPCAMBIA1302gydF4y2Ba使用正向引物具有KpnI位点(5'-TTC AGgydF4y2Ba摹GTA CCgydF4y2BaTCA TGG AGT CAA AGA TTC A-3')和带有XHOI网站的反向底漆(5'-ATC TAgydF4y2BaC TCG AGgydF4y2BaŤCAA GAG TCC CCC GTG-3’ )。的gydF4y2BaGFP (S65T)gydF4y2Ba片段,修饰为包含GFP n端信号肽序列,从质粒中扩增gydF4y2BaHBT95 :: SGFP(S65T)-NOSgydF4y2Ba使用正向引物与XhoI位点(5'-TTTgydF4y2BaCTC呕吐gydF4y2BaATG CGT TCG TTA AAG TTA CTC CTT TGT TGG ATC TCG TTT CTT ACG TTA TCA ATC TCA ATC TCT GCA TCG TCA ATG GTG AGC AAG GGC GAG GAG CTG-3 '),以及带有XmaI位点的反向引物(5 ' -AAA)gydF4y2Baccc ggg.gydF4y2BaCTT GTA CAG CTC GTC CAT GC-3’ )。所述PDI8成熟蛋白质cDNA片段从全长扩增gydF4y2BaPDI8.gydF4y2Ba利用带有XmaI位点(5 ' -ATA)的正向引物克隆cDNAgydF4y2Baccc ggg.gydF4y2BaTCG TCA GAT GAT CAA TTC ACC CTC-3’ ),并用BstEII位点的反向引物(5'-AAGgydF4y2BaGGT CACÇgydF4y2BaAA法案AGT CCT CTT TTT TGT CAC标签-3')。构造gydF4y2BapBL(35SgydF4y2BaprogydF4y2Ba: PDI8-GFP-KKED)gydF4y2Ba通过替换所生成的gydF4y2BaSPGFP-PDI8.gydF4y2Ba编码序列gydF4y2BapBL(35SgydF4y2BaprogydF4y2Ba:SPGFP-PDI8)gydF4y2Ba,限制性位点xhoi和bsteii之间,具有全长gydF4y2BaPDI8.gydF4y2BacDNA片段(XHOI / XMAI)和AgydF4y2BaGFP (S65T) - kgydF4y2Ba片段(XmaI / BstEII)。的gydF4y2BaPDI8.gydF4y2BacDNA片段从a扩增gydF4y2BaPDI8.gydF4y2Ba利用带有XhoI位点(5 ' -CAG)的正向引物克隆cDNAgydF4y2BaCTC呕吐gydF4y2BaATG CGT TCG TTA AAG TTA C-3')和具有XMAI网站的反向底漆(5'-ACAgydF4y2Baccc ggg.gydF4y2BaGTC CTC TTT TTT GTC ACT AGG CT-3’ )。的gydF4y2BaGFP (S65T)gydF4y2Ba片段从质粒中扩增,修饰为包含PDI8的KKED推定保留信号gydF4y2BaHBT95 :: SGFP(S65T)-NOSgydF4y2Ba使用带有XmaI位点的正向引物(5 ' -TAG TgydF4y2BaCC CGG G.gydF4y2BaAT GGT GAG CAA GGG CGA GGA-3 ')和具有BstEII位点的反向引物(5 ' -AGG ATgydF4y2BaG GTC ACCgydF4y2BaTAA TCC TCT TTT TTG CCG TGA GTG ATC-3')。gydF4y2Ba
分离和转染原生质体的过程改编自Yoo等人[gydF4y2Ba36.gydF4y2Ba和Wu等人[gydF4y2Ba35.gydF4y2Ba].莲座丛的厌恶表皮从四周留下了gydF4y2Ba拟南芥gydF4y2Ba用胶带夹层法移走植物[gydF4y2Ba35.gydF4y2Ba]叶肉细胞释放的方法是:将去皮的叶片在10mL酶溶液(1.5%纤维素酶R10,0.4%马其顿酶R10,0.4M甘露醇,20mM KCl,20mM MES,pH 5.7)中培养3h,然后与10mL W5溶液(154 nM NaCl,125mM CaCl2,5mM KCl,2mM MES,pH 5.7)轻轻混合。原生质体在100℃下轻轻离心 gydF4y2BaggydF4y2Ba用新鲜W5溶液重悬2分钟,浓度为2 × 10gydF4y2Ba5gydF4y2Ba去除W5溶液,将原生质体重悬于MMg溶液(0.4 M甘露醇,15 mM MgCl .)中gydF4y2Ba2GydF4y2Ba, 4 mM MES, pH 5.7)的密度为2 × 10gydF4y2Ba5gydF4y2Ba/ ml。通过用20μl质粒DNA溶液(含有约20μg的H中的MMG溶液中的200μl原生质体(在H中含有〜20μg的每个构建体)来转染原生质体gydF4y2Ba2GydF4y2Ba的PEG溶液O),和220μL(40%PEG,0.2M甘露糖醇,100mM的氯化钙gydF4y2Ba2GydF4y2Ba).25℃孵育5-10分钟后,加入0.8 mL W5溶液停止转染。原生质体在100℃离心gydF4y2BaggydF4y2Ba2分钟,然后重悬于1ml Wi溶液(0.5M甘露醇,20mM KCl,4mM MES,pH 5.7)中。将转染的原生质体在22℃下在黑暗中孵育18小时,以允许转基因表达。使用奥林巴斯FV-1000激光扫描共聚焦显微镜在生物电子显微镜设施(Manoa,Manoa,檀香山大学,HI)中使用荧光进行可视化。用于荧光检测的激发/发射滤光器用于GFP(S65T)和543 / 585-615nm的488 / 505-525nm,用于MCHERRY。gydF4y2Ba
Anti-PDI8抗体生产gydF4y2Ba
亲和纯化的识别PDI8的兔多克隆抗体通过y酶抗体有限责任公司(旧金山,CA)商业化生产,使用重组PDI8的截短形式作为兔免疫和抗血清亲和纯化的抗原。PDI8蛋白是一种编码中枢的cDNA片段,用于产生截断的PDI8蛋白gydF4y2Bab”gydF4y2BaPDI8的区域(PDI8gydF4y2BaBB'gydF4y2Ba利用NdeI位点(5 ' -GCC TAC G)正向引物,RT-PCR扩增PDI8前蛋白序列138-377位gydF4y2BaCa Tat G.gydF4y2BaGT TGC TCC AGA TGT GCG G-3')和BamHI位点的反向底漆(5'-CGTgydF4y2BaGGA TCC.gydF4y2BaCTA TGA GTT GAT AAA TCC CAT GAA-3')。的gydF4y2BaPDI8.gydF4y2BaBB'gydF4y2Ba在细菌表达载体PET-15B(EMD Millipore,Billerica,MA)之间的Ndei和BamHI位点之间连接cDNA片段,放置gydF4y2BaPDI8.gydF4y2BaBB'gydF4y2Ba序列与pET-15b的6xHis-tag在帧内。表达PDI8gydF4y2BaBB'gydF4y2Ba被诱发了gydF4y2Ba大肠杆菌gydF4y2Ba通过添加0.2 mM IPTG,在28°C下将BL21(DE3)应变5 h。诱导后,患者gydF4y2Ba大肠杆菌gydF4y2Ba通过离心收获细胞并使用Bugbuster蛋白提取试剂(EMD Millipore)裂解。他标记的pdi8gydF4y2BaBB'gydF4y2Ba蛋白从通过镍亲和层析的细菌裂解物纯化。gydF4y2Ba
透射电子显微镜和免疫标记gydF4y2Ba
对于免疫金标记分析,如中所述,通过高压冷冻/冷冻替代技术保存发育中的根和顶芽[gydF4y2Ba6gydF4y2Ba].immunolabeling 80 nm厚的部分从Lowicryl HM20树脂嵌入式标本放在formvar-coated黄金或镍槽网格和阻塞为30分钟2% (w / v)脱脂奶粉7.2溶液pH值在0.01 M磷酸盐含0.1% Tween-20 (PBST)。切片洗涤,然后在rt时用稀释10倍的一抗anti-PD8孵育2小时。切片洗涤后,转移到稀释25倍的二抗山羊抗兔igg,该二抗与10或15 nm金颗粒(Ted Pella,切片被洗涤,然后用醋酸铀酯溶液染色2分钟,柠檬酸铅染色4分钟。所有观察均使用80 KV的日立h -7000透射电子显微镜(日立美国,OH)进行。gydF4y2Ba
制备微粒体膜和蛋白酶保护分析gydF4y2Ba
用于提取微粒体膜,gydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba拟南芥幼苗在22上的16小时光照/ 8小时黑暗周期在1/2×LS琼脂平板垂直生长℃。7天龄的幼苗用冰冷的提取缓冲液[40 mM的HEPES pH为7.5,0.4%聚乙烯聚吡咯烷酮(PVP),1毫摩尔MgCl冷研钵和杵均化gydF4y2Ba2GydF4y2Ba以1.5 μL提取缓冲液/ 1 mg植物组织为比例。为了去除不溶性碎屑,匀浆在1000度离心两次gydF4y2BaggydF4y2Ba和4°C 3分钟,每次旋转后收集上清液。通过以21,000离心为150μL等分试样将总蛋白质匀浆分离成微粒体和可溶性蛋白质级分 ggydF4y2Ba和4°C for 1.5 h [gydF4y2Ba1gydF4y2Ba].用150μl新鲜萃取缓冲液洗涤微粒体粒料一次,通过纺丝以21,000旋转微粒体 ggydF4y2Ba4℃45分钟并除去上清液。最后,将微粒体粒料重悬于当量的新鲜提取缓冲液的体积中,其等于原始样品体积(即150μl)。gydF4y2Ba
对于PDI8和BIP的免疫印迹检测,通过SDS-PAGE(10%聚丙烯酰胺凝胶)分离蛋白质样品并转移到硝酸纤维素膜上。相当数量(按体积)gydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba装载总蛋白和分馏蛋白样品,未分离的匀浆中含有~20 μg蛋白,可溶性部分含有~14 μg蛋白,微粒体部分含有~7 μg蛋白。PDI8的免疫印迹分析采用1:100稀释的抗PDI8抗血清和1:200稀释的抗兔辣根过氧化物酶(HRP)标记的二抗,由Amersham ECL Western Blotting Detection Kit (GE Healthcare Bio-Sciences, Pittsburgh, PA)提供。采用1:1000稀释的山羊抗BiP一抗aC-19 (Santa Cruz Biotechnology, Inc, Dallas, Tx)和1:3000稀释的驴抗山羊酶标二抗(Santa Cruz Biotechnology, Inc)检测BiP。gydF4y2Ba
为了确定PDI8的膜拓扑结构,gydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba将重悬的微粒体在37℃下在萃取缓冲液(阴性对照)中孵育30分钟,或用50μg/ ml蛋白酶K和/或0.1%Triton X-100。每种反应含有〜0.36μg/μl的微粒蛋白,总体积为60μl。通过向所有样品中加入5mm PMSF来停止蛋白酶K消化。如上所述进行PDI8的SDS-PAGE和免疫印迹检测,每个车道加载20μL样品(〜7.2μg微粒体蛋白)。gydF4y2Ba
碱性磷酸酶活性测定gydF4y2Ba
PDI8异源表达的构建体gydF4y2Ba大肠杆菌gydF4y2Ba是通过克隆PDI8的管腔部分编码序列,包含催化gydF4y2Ba一个gydF4y2Ba域和氧化还原活动gydF4y2BabgydF4y2Ba和gydF4y2BaB'gydF4y2Ba域名(PDI8.gydF4y2BaABB'gydF4y2Ba,无花果。gydF4y2Ba1gydF4y2Ba)在细菌表达载体pFLAG-CTS的XmaI和SalI酶切位点之间(Sigma-Aldrich, St. Louis, MO)。的gydF4y2BaPDI8.gydF4y2BaABB'gydF4y2Ba基因片段从全长扩增gydF4y2BaPDI8.gydF4y2Ba用XMAI网站使用正向底漆的cDNA(5'-TGTgydF4y2Baccc ggg.gydF4y2BaAGA TGA TCA ATT CAC CCT CGA C-3')和具有SalI位点(5'-AAT)的反向引物gydF4y2BaGTC GACgydF4y2BaCAT TGA GTT GAT AAA TCC CAT G-3')。gydF4y2Ba
的gydF4y2Ba大肠杆菌gydF4y2Ba菌株Ri89(gydF4y2BadsbAgydF4y2Ba+gydF4y2Ba)和RI90(gydF4y2BaDsbA的:: kan1gydF4y2Ba;从中获得RI89遗传背景)gydF4y2Ba大肠杆菌gydF4y2Ba遗传股票中心(耶鲁大学,新避风港,CT)。pflag-pdi8gydF4y2BaABB'gydF4y2Ba构建体和质粒pFLAG-CTS空载体转化到菌株RI90。为了测量碱性磷酸酶(PhoA启动)的活性,将细胞在M9基本培养基中于37℃下生长至ODgydF4y2Ba600gydF4y2Ba通过离心收获的0.4-0.6,用50mM Tris-HCl(pH8.0)洗涤一次,并用0.2%Triton X-100裂解。使用Quantichrom碱性磷酸酶测定试剂盒(生物测定系统,Hayward,Ca)测定PhOA活性。简而言之,150μl的工作溶液(5mm乙酸镁,10毫米gydF4y2BapgydF4y2Ba-硝基苯基磷酸盐(pH 10.5)加入50 μL的裂解细胞。经过快速搅拌,初始ODgydF4y2Ba405gydF4y2Ba(t = 0),然后在4分钟后重新测量(t = 4) .根据OD计算PhoA活性(IU/L)gydF4y2Ba405gydF4y2Ba值在试剂盒中所描述的。报告的活动是来自三个独立试验的平均值导出的(±标准偏差)。gydF4y2Ba
缩写gydF4y2Ba
- BIP:gydF4y2Ba
-
结合免疫球蛋白的蛋白质gydF4y2Ba
- 爆破:gydF4y2Ba
-
基本的局部比对搜索工具gydF4y2Ba
- CaMV:gydF4y2Ba
-
花椰菜马赛克病毒gydF4y2Ba
- COPI:gydF4y2Ba
-
外套蛋白质I.gydF4y2Ba
- Dsb:gydF4y2Ba
-
二硫键形成蛋白gydF4y2Ba
- EFP:gydF4y2Ba
-
电子荧光象形文字gydF4y2Ba
- 呃:gydF4y2Ba
-
内质网gydF4y2Ba
- Erv:gydF4y2Ba
-
内质网囊泡蛋白gydF4y2Ba
- 美东时间:gydF4y2Ba
-
表达序列标签gydF4y2Ba
- 绿色荧光蛋白:gydF4y2Ba
-
绿色荧光蛋白gydF4y2Ba
- GUS:gydF4y2Ba
-
β-葡萄糖醛酸酶gydF4y2Ba
- 合:gydF4y2Ba
-
辣根过氧化物酶gydF4y2Ba
- 会议8:gydF4y2Ba
-
母效胚胎阻滞gydF4y2Ba
- MW:gydF4y2Ba
-
分子量gydF4y2Ba
- NCBI:gydF4y2Ba
-
国家生物技术信息中心gydF4y2Ba
- nos:gydF4y2Ba
-
诺肝素合酶gydF4y2Ba
- 奥帕:gydF4y2Ba
-
外膜蛋白AgydF4y2Ba
- PDI:gydF4y2Ba
-
蛋白质二硫键异构酶gydF4y2Ba
- 挂钩:gydF4y2Ba
-
聚乙二醇gydF4y2Ba
- PhoA的:gydF4y2Ba
-
碱性磷酸酶gydF4y2Ba
- PMSF:gydF4y2Ba
-
氟甲基磺酰氟乙烯gydF4y2Ba
- RT-QPCR:gydF4y2Ba
-
定量逆转录聚合酶链反应gydF4y2Ba
- Rubisco:gydF4y2Ba
-
核糖糖-1,5-双磷酸羧酶/氧酶gydF4y2Ba
- SDS-PAGE:gydF4y2Ba
-
十二烷基硫酸钠聚丙烯酰胺凝胶电泳gydF4y2Ba
- TAIR:gydF4y2Ba
-
拟南芥信息资源gydF4y2Ba
- 战区导弹防御系统:gydF4y2Ba
-
跨膜域gydF4y2Ba
- TMX3:gydF4y2Ba
-
硫氧还蛋白相关的膜蛋白3gydF4y2Ba
- TXNDC5:gydF4y2Ba
-
含毒素含域的蛋白5gydF4y2Ba
- UPR:gydF4y2Ba
-
未折叠蛋白反应gydF4y2Ba
- WT:gydF4y2Ba
-
野生型gydF4y2Ba
- X-GLUC:gydF4y2Ba
-
5-bromo-4-chloro-3-indoxyl -β-D-glucuronide cyclohexylammonium盐。gydF4y2Ba
参考gydF4y2Ba
- 1。gydF4y2Ba
ABAS L,Luschnig C.从少量植物材料中最大的微粒体型膜的产率而不需要超速离心。肛门生物化学。2010; 401:217-27。gydF4y2Ba
- 2。gydF4y2Ba
andèmeondzighi c,克里斯托弗·达,町ej,chang sc,Staehelin La。拟南芥蛋白二硫化物异构酶-5在贩运过程中抑制半胱氨酸蛋白酶在制育种子的细胞死亡中的贩运前。植物细胞。2008; 20:2205-20。gydF4y2Ba
- 3。gydF4y2Ba
阿彭策勒-赫尔佐格C,埃尔加德L.人类PDI家族:多功能性包装成一个单一折叠。Acta botanica sinica; 2008; 37(3): 534 - 534。gydF4y2Ba
- 4.gydF4y2Ba
Atkinson HJ,Babbitt PC。Thiroedoxin折叠类的地图集揭示了功能支持适应的复杂性。PLOS计算BIOL。2009; 5(10):E1000541。gydF4y2Ba
- 5。gydF4y2Ba
Chivers PT,Laboissiere MCA,雷恩斯RT。二硫键异构酶:在CXXC结构的细胞酶学。在:古斯曼N,编辑。脯氨酰羟化酶,蛋白质二硫键异构酶,和其他结构相关的蛋白质。纽约:Marcel Dekker;1998. p。487-505。gydF4y2Ba
- 6。gydF4y2Ba
Cho EJ,Yuen Cy,康BH,ondzighi Ca,Staehelin La,Christopher Da。蛋白质二硫化物异构酶-2拟南芥介导蛋白质折叠并定位于分泌途径和细胞核,其中它与母体效果胚胎抑制因子相互作用。mol细胞。2011; 32:459-75。gydF4y2Ba
- 7.gydF4y2Ba
花浸:农杆菌介导的植物转化的一种简化方法gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.工厂J. 1998; 16:735-43。gydF4y2Ba
- 8.gydF4y2Ba
D'Aloisio E,Paolacci Ar,Dhanapal Ap,Tanzarella OA,Porceddu E,Ciaffi M.蛋白质二硫化物异构酶基因家族在面包小麦(gydF4y2Bat . aestivum L。gydF4y2Ba).BMC Plant Biol. 2010;10:101。gydF4y2Ba
- 9.gydF4y2Ba
Edman JC,Ellis L,Blacher RW,Roth Ra,Rutter WJ。蛋白质二硫化物异构酶的序列和其与肝癌的关系的含义。自然。1985年; 317:267-70。gydF4y2Ba
- 10。gydF4y2Ba
法拉利DM,SölingHD。蛋白质二硫化物 - 异构酶家族:解开一串折叠。Biochem J. 1999; 339:1-10。gydF4y2Ba
- 11.gydF4y2Ba
傅XM,朱BT。人胰腺特异性蛋白质二硫键异构酶(PDIP)可以用作通过与变性的底物蛋白稳定的复合物伴侣独立地其酶活性的。生物化学杂志2010; 429:157-69。gydF4y2Ba
- 12.gydF4y2Ba
HAD HP,Calfon M,urano F,NovoA I,Ron D.在哺乳动物展开蛋白反应中转录和翻译控制。Annu Rev Cell Dev Biol。2002; 18:575-99。gydF4y2Ba
- 13。gydF4y2Ba
Heffernan R,Paliwal K,Lyons J,Dehzangi A,Sharma A,Wang J,Sattar A,Yang Y,Zhou Y.通过迭代深度学习提高二级结构,局部骨干角和溶剂可进入表面积的预测。SCI批准。2015; 5:11476。gydF4y2Ba
- 14。gydF4y2Ba
Humphreys DP,Weir N,Mountain A,Lund Pa。人蛋白二硫化物异构酶功能齐全地补充A.gydF4y2BadsbAgydF4y2Ba突变并增强果胶酶C的产率gydF4y2Ba大肠杆菌gydF4y2Ba.J Biol Chem。1995; 270:28210-5。gydF4y2Ba
- 15。gydF4y2Ba
Klappa P, Ruddock LW, Darby NJ, Freedman RB。b '结构域是蛋白质二硫异构酶的主要肽结合位点,但所有结构域都有助于错误折叠蛋白的结合。EMBO j . 1998; 17:927-35。gydF4y2Ba
- 16。gydF4y2Ba
Kemmink J, Darby NJ, Dijkstra K, Nilges M, Creighton TE。折叠催化剂蛋白二硫异构酶由活性和非活性硫氧还蛋白模块组成。咕咕叫医学杂志。1997;7:239-45。gydF4y2Ba
- 17.gydF4y2Ba
Kim K-W,Franceschi VR,Davin LB,Lewis NG。β-葡萄糖醛酸酶作为报告基因的优势和局限性。作者:Salinas J,Sanchez Serrano JJ,编辑。拟南芥议定书。新泽西州托托瓦:Humana出版社;2006P263–73.gydF4y2Ba
- 18.gydF4y2Ba
冯海因,张海峰,宋海默。用隐马尔可夫模型预测跨膜蛋白质拓扑结构:在全基因组中的应用。中华医学杂志。2001;305:567-80。gydF4y2Ba
- 19.gydF4y2Ba
Liu JX,Howell SH.管理植物内质网中的蛋白质折叠需求。新植物醇。2016;211:418–28.gydF4y2Ba
- 20.gydF4y2Ba
Lu DP,Christopher Da。内质网应激激活蛋白二硫化物异构酶基因和Atbzip60的亚组的表达调节响应gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.基因组学杂志。2008;280:199-210。gydF4y2Ba
- 21。gydF4y2Ba
Mares RE,Meléndez-López SG,Ramos MA.酸变性绿色荧光蛋白(GFP)作为研究蛋白质二硫化物异构酶伴侣活性的模型底物.国际分子科学杂志.2011;12:4625–36。gydF4y2Ba
- 22。gydF4y2Ba
Nakamoto H,Bardwell JC。二硫键形成和异构化的催化分析gydF4y2Ba大肠杆菌gydF4y2Baperiplasms。Biochim Biophys Acta。2004; 1694:111-9。gydF4y2Ba
- 23。gydF4y2Ba
Petersen Tn,Brunak S,Von Heijne G,Nielsen H. SignalP 4.0:识别跨膜区域的信号肽。NAT方法。2011; 8:785-6。gydF4y2Ba
- 24。gydF4y2Ba
波特BW,Yuen Cy,Christopher da。双蛋白贩运分泌物和非分泌细胞隔室:清晰或双重视觉?植物SCI。2015; 234:174-9。gydF4y2Ba
- 25。gydF4y2Ba
Sato Y,Kojima R,Okumura M,Hagiwara M,Masui S,Maegawa K,Saiki M,Horibe T,Suzuki M,Inaba K. PDI家族成员在过氧杂志4-驱动的氧化蛋白折叠中协同合作。SCI批准。2013; 3:2456。gydF4y2Ba
- 26。gydF4y2Ba
王志强,王志强,王志强,等。光合生物蛋白质二硫异构酶的基因组学研究。基因组学。2011;97:37-50。gydF4y2Ba
- 27。gydF4y2Ba
Shibuya A,Margulis N,Christiano R,Walther TC,Barlowe C. ERV41-ERV46复合物用作逆行受体,以检索逃离ER蛋白。J细胞BIOL。2015; 208:197-209。gydF4y2Ba
- 28。gydF4y2Ba
SONE M,Kishigami S,Yoshihisa T,ITO K.二硫键在细菌碱性磷酸酶中的作用。J Biol Chem。1997年; 272:6174-8。gydF4y2Ba
- 29。gydF4y2Ba
Thieme CJ, Rojas-Triana M, Stecyk E, Schudoma C, Zhang W, Yang L, Miñambres M, Walther D, Schulze WX, Paz-Ares J, Scheible W-R, Kragler F (2015) Endogenous Arabidopsis messenger RNAs transported to distant tissues. Nat Plants 1:doi:10.1038 / lepplants.2015.25gydF4y2Ba
- 30.gydF4y2Ba
瓦斯塔安JS,Lindquist S.蛋白质折叠疾病的机制一目了然。DIS MODEM MECH。2014; 7:9-14。gydF4y2Ba
- 31。gydF4y2Ba
Wang H,Boavida LC,Ron M,McCormick S.拟南芥中蛋白质二硫化物异构酶p DIL2–1的截短延迟胚囊成熟并破坏花粉管的引导。植物细胞。2008;20:3300–11.gydF4y2Ba
- 32。gydF4y2Ba
王聪,祖创林。蛋白质二硫异构酶既是一种酶又是一种伴侣。美国实验生物学学会联合会j . 1993; 7:1515-7。gydF4y2Ba
- 33。gydF4y2Ba
冬季d,醋B,干河H,阿马尔R,威尔逊GV,Provart NJ。“电子荧光象形文字”浏览器的探讨和分析大型生物数据集。Plos一个。2007; 2:E718。gydF4y2Ba
- 34。gydF4y2Ba
Wittenberg G,Levitan A,Klein T,Dangoor I,Keren N,Danon A.敲低了gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba叶绿体蛋白二硫化物异构酶6导致光抑制水平降低,并且在高光中增加了D1合成。工厂J. 2014; 78:1003-13。gydF4y2Ba
- 35。gydF4y2Ba
吴福华,沈思聪,李莉,李淑,陈敏,林聪.一种简单的拟南芥原生质体分离方法.植物方法.2009;5:16。gydF4y2Ba
- 36。gydF4y2Ba
刘志强,赵永华,王志强。拟南芥叶肉原生质体的瞬时基因表达分析。Nat Protoc。2007;2:1565 - 72。gydF4y2Ba
- 37。gydF4y2Ba
袁CY,松本子,DA。亚细胞定位和蛋白质折叠活性的差异gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba蛋白质二硫化物异构酶的同源物。生物分子。2013; 3:848-69。gydF4y2Ba
- 38。gydF4y2Ba
Yuen Cyl,Wong K,Christopher DA(2015)新型杂交蛋白二硫化物异构酶/货物受体植物和染色体特征的系统发育表征和启动子表达分析。Mol Genet Genomics Doi:gydF4y2Ba10.1007 / s00438-015-1106-7gydF4y2Ba
致谢gydF4y2Ba
作者用共聚焦显微镜在夏威夷生物显微镜大学的设施。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了国家科学基金会拨款,MCB-0958107和美国联邦孵化项目507H和5030H至DAC。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中使用的所有数据都包含在此本书中,可在本手稿中和提供的补充材料中获得。根据资金的可用性,可以提供所描述的任何研究材料。gydF4y2Ba
作者的贡献gydF4y2Ba
涂层和DAC设计了实验。涂层,rs,bhk,km和ejc进行了实验。涂层,BHK和DAC分析了数据。幕后和DAC写下并编辑了BHK的帮助。所有作者都已经阅读并赞成最终的手稿。gydF4y2Ba
利益争夺gydF4y2Ba
两位作者宣称他们没有相互竞争的利益。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
通讯作者gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:在线资源2。gydF4y2Ba
拟南芥不同植物器官PDI8转录本的相对水平。表示…的相对表达水平的电子荧光象形文字gydF4y2BaPDI8.gydF4y2Ba基于公开可用的微阵列数据跨越不同的拟南芥组织。(JPG 587 KB)gydF4y2Ba
附加文件2:“在线资源”。gydF4y2Ba
抗PDI8抗血清的验证。重组PDI8的免疫印迹检测gydF4y2BaBB'gydF4y2Ba通过抗PDI8抗血清。B在WT和WT中PDI8的免疫印迹检测gydF4y2Ba35SgydF4y2BaprogydF4y2Ba:PDI8.gydF4y2Ba抗PDI8抗血清的过表达株。c免疫检测PDI8在gydF4y2Ba大肠杆菌gydF4y2Ba应变RI89 (gydF4y2BadsbAgydF4y2Ba+gydF4y2Ba突变体)从质粒pFLAG-PDI8gydF4y2BaABB'gydF4y2Ba构造。(TIF 3362 KB)gydF4y2Ba
附加文件3:在线资源4。gydF4y2Ba
在组织的显微镜抗体特异性的验证。从根顶端细胞的第gydF4y2BaPDI8.gydF4y2Ba反义系AS1,用抗pdi8抗血清染色。b AS1茎尖细胞切片,用抗pdi8抗血清染色。c WT根尖细胞切片,用兔预免疫血清标记。d用抗pdi8抗血清标记的细胞系OE1根尖细胞切片。(JPG 9403 kb)gydF4y2Ba
附加文件4:在线资源1。gydF4y2Ba
数据库搜索鉴定的PDI-B亚家族蛋白的序列。汇编推导的产品gydF4y2BaPDI-B.gydF4y2Ba在可用测序植物基因组中发现的基因。(docx 134 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
袁超勇,石锐,康,BH。gydF4y2Baet al。gydF4y2Ba拟南芥蛋白二硫化物异构酶-8是具有硫醇二硫化物氧化酶活性的I型内质网跨膜蛋白。gydF4y2BaBMC植物BIOL.gydF4y2Ba16,gydF4y2Ba181(2016)。https://doi.org/10.1186/s12870-016-0869-2gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-016-0869-2gydF4y2Ba
关键字gydF4y2Ba
- 内质网gydF4y2Ba
- 跨膜gydF4y2Ba
- 蛋白质二硫键异构酶gydF4y2Ba
- 蛋白质折叠gydF4y2Ba