抽象的
背景
对黑腿病的抗性芸苔属植物显著(油菜籽/油菜),由血血脂真菌病原体引起的瘦性的黄瓜,由种族特异性抗性(R.)基因和数量抗性位点(QTL),或成株抗性(APR)。而R.QTL在育种过程中相对简单,常被零星检测到,在育种过程中很难捕捉到。为了在作物品种中有效地利用APR,抗性QTL需要在多种环境中对表型有可靠的影响,并在遗传上得到很好的定义,以实现标记辅助选择(MAS)。
结果
由易感群体产生的双倍单倍体群体显著对黄玉品种和APR品种AG-Castle和AV-Sapphire分别在2个地点进行了3年和4年的抗黑腿病分析。在每个群体中检测到3个稳定的QTL,其中2个位点似乎与两个APR品种相同。3个QTL区域的物理描述足以识别候选的防御相关基因,包括位于A01染色体49个基因QTL区间内的一簇富含半胱氨酸的受体样激酶。个人l . maculans分离物被用来定义个体特异性的物理间隔R.基因Rlm3和Rlm4并鉴定与田间研究和子叶抗性反应共同的QTL。
结论
通过多环境QTL分析,我们鉴定和圈定了4个显著的、稳定的、适合于小麦数量黑腿抗性MAS的QTL显著,并确定候选基因可能在定量防御反应中发挥作用l . maculans.
背景
预防灾难性的作物损失是植物病原体的损失最常通过将抗性遗传掺入商业品种来实现。对植物病原体的宿主响应大致分为两类;由通用病原体信号或称为“病原体相关分子模式”(PAMPs)引起的基底防御反应,导致温和的防御反应共同称为“PAMP触发免疫力”(PTI)和R.基因介导的“效应触发免疫力”(ETI),其中种族特异性病原体aairulence(AVR)蛋白引发强大的防御机制,包括在感染部位的过敏反应(HR)导致宿主细胞死亡[1].在研究叶面植物病原菌时,HR的反应具有小种特异性R.基因通常提供一个可视化的表型,表明不相容的相互作用,并允许确定病原体的毒性。这个区别是用来区分具体的R.通过多个抗性位点的累积作用,可以在作物品种内提供有效的“成株抗性”。在田间试验中,APR通常在生长季末测定。
APR尤为重要对抗疾病芸苔属植物显著L.(油菜/油菜)其中R.基因介导的抗性缺乏,例如核毒素茎腐(sclerotinia sclerotiorum.) [2-4.]和黄萎病(黄萎病longisporum) [5.-7.或病原体种群往往表现出迅速适应的疾病R.由半生物营养型真菌病原体引起的基因介导的抗性,如黑腿病瘦性的黄瓜[8.那9.].
避免R.基因介导的抗性l . maculans当病原体种群受到厚重的选择压力时,可以快速和地理位置的方式发生。Blackleg效率的快速下降R.基因Rlm1在控制欧洲的疾病中强调了病原体的进化潜力[10].高频率的突变和缺失L. Maculan.s airulence基因AVRLM4-7.是在小块区域内连续播种到显著窝藏Rlm7,而在从周围的本地病原体人群中提取的样本中,仍未检测到致病型[11].在澳大利亚的一些地区观察到携带该病毒的油菜籽品种的高感染率R.基因LepR3仅在该材料首次商业发布后三年[12,尽管这种有效耐药性的迅速丧失可能是由于预先接触Rlm1变种,如对LepR3和Rlm1由同一个赋予l . maculans非病原性基因;AVRLM1[13].
显著含4月的栽培品种通常在与易感品种相比时没有显示出叶病变的发展差异,但它们限制了病原体内部茎感染的发展,导致冠状溃疡较低的冠状溃疡形成[14].这是相对的R.基因介导的抗性导致逮捕l . maculans在子叶和叶子上感染遗址的生长。主要R.基因介导的抗性被混合病原体群体中的强毒株所避免,APR减少了作物残茬中强毒株的选择和增殖,并降低了在接下来的季节中作物遭受灾难性损失的可能性[15-17].
而R.通过观察接种后的超敏反应,往往可以快速有效地检测到基因介导的抗性显著子叶与特征明显l . maculans而评估APR则困难得多。需要通过实地研究或在控制条件下通过单一孢子源感染来测量耐药性l . maculans分离生长数月的植物的茎部感染及评估[18那19].考虑到植物-病原体-环境相互作用的复杂性,在实地研究中评估APR可能很困难。的数量l . maculans在大多数疾病苗圃中,由于性别重组而产生的遗传异质性混合物,在试验地点内和试验年份之间都应预料到致病型的变异。同时,由于杂合度引起的宿主反应的变化显著对于抗性的多基因控制,可能会混淆品系[20].这个re has also been a widely-held view that blackleg APR is race non-specific [17]基于法国品种射流Neuf的经验,在欧洲多年来提供了耐用的耐用性耐药性,并且还在早期努力改善澳大利亚种质中的Blackleg抗性[21那22].但是,更新的研究利用单一l . maculans对黑腿APR的“种族非特异性”性质提出了质疑[19那23].
通过基于与抵抗的定量性状基因座(QTL)的分子表征的标志物辅助育种,可以最有效地实现CANOLA品种的强烈APR的维护。17].这个French variety Darmor, derived from Jet Neuf, is the most extensively studied显著具有数量抗性的品种l . maculans.双单倍体(DH)群体,由达莫-杂交产生BZH.利用敏感的韩国品种Yudal (DY)绘制了10个有助于抗黑腿病的QTL,其中4个QTL在两年的田间试验中稳定检测到[24].这个resistance was further analysed in Darmor x Samouraï (DS) DH and F2群体,揭示了DY和DS群体共有的四个QTL[25].对于四种Darmor QTL,还生产了近代源性线(NIL);LMA2.那LMA9.那LMC2.和LMC4.,虽然只是LMA2.完全验证是对减少疾病严重程度的显着影响[26].Blackleg APR也在几个澳大利亚品种中进行了评估,揭示了多个QTL,这些QTL对几个澳大利亚和法国品种可能是共同的[9.那19那27].
目前对其分子基础知之甚少l . maculans感染芸苔属物种。虽然两种种族特异性基因负责etin介导的黑腿耐药性,LepR3和Rlm2都是克隆的显著并显示编码细胞外亮氨酸的重复(ELRR)受体样蛋白识别l . maculans效应子AvrLm1和AvrLm2 [13那28那29]但是没有鉴定过纯度抵抗Blackleg抗性QTL的基因。感染显著通过l . maculans导致宿主试图通过胼胝质沉积对病原菌进行物理限制,同时也有报道称APR品种的木质化反应增强[30那31].l . maculans感染触发水杨酸(SA)信号通路的诱导[31那32在植物防御中起着关键作用[33].可以触发SA信号显著通过纯化l . maculans细胞壁成分[34在ETI过程中,乙烯信号通路和H2O.2积累[31那32那35].然而,这些研究都集中在子叶中的早期感染事件显著幼苗;没有任何众所周知的防御机制可能对侵入菌丝有效,因为它们通过叶柄渐渐地生长[18]和茎[36].
在这项研究中,我们确定了几种稳定的Blackleg电阻QTL,具有抗ag-城堡和Av-Sapphire的阻力等位基因,两个Blackleg抵抗澳大利亚显著分别于2002年和2003年发布。本研究以Topas/AG-Castle (TC)和Topas/AV-Sapphire (TS) DH群体为材料,在两个地点进行了多年的APR测定,进行了单环境和多环境QTL定位,确定了相对于最近发布的QTL的物理位置显著Darmor-BZH.参考基因组[37],允许鉴定候选无保护相关基因。
结果
人口数据
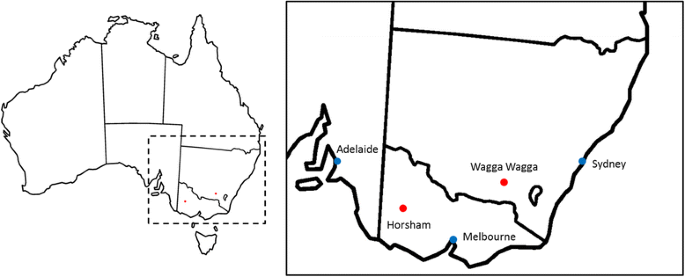
在澳大利亚东南部维多利亚州霍尔沙姆和新南威尔士州瓦加瓦加附近的疾病托儿所进行了现场试验(图。1)。TC人群的平均存活率为25.9%至43.2%,TS人群的平均存活率为11.2%至69.2%,除TS Horsham 2008外,所有测试中的单个条目(每个DH线3至4个条目)的平均存活率为0%至100%,其中单个条目记录的最大存活率为71.1%。平均内部感染百分比(II)TC群体为38.5%至58.6%,TS群体为45%至87.4%。观察到的最低II为4%(TC Wagga Wagga 2010和TS Wagga 2009)所有试验中记录的最大II值均为100%。与Horsham试验点相比,两个群体在Wagga-Wagga试验点的平均存活率始终较高,平均内部感染率始终较低(表1)1额外的文件1:图S1)。遗传度是根据每个得分指标在每个环境中的总条目来计算的;生存(S)和内部感染(II),且普遍较高,各指标的范围相似(S: 0.75-0.9, II: 0.73-0.89)1).
澳大利亚东南部的田间试验地点。破折号在剩下表示突出显示的区域正确的.红点显示试验网站的位置,蓝色小点显示主要城市。从原始图像修改的地图(https://commons.wikimedia.org)
连锁分析
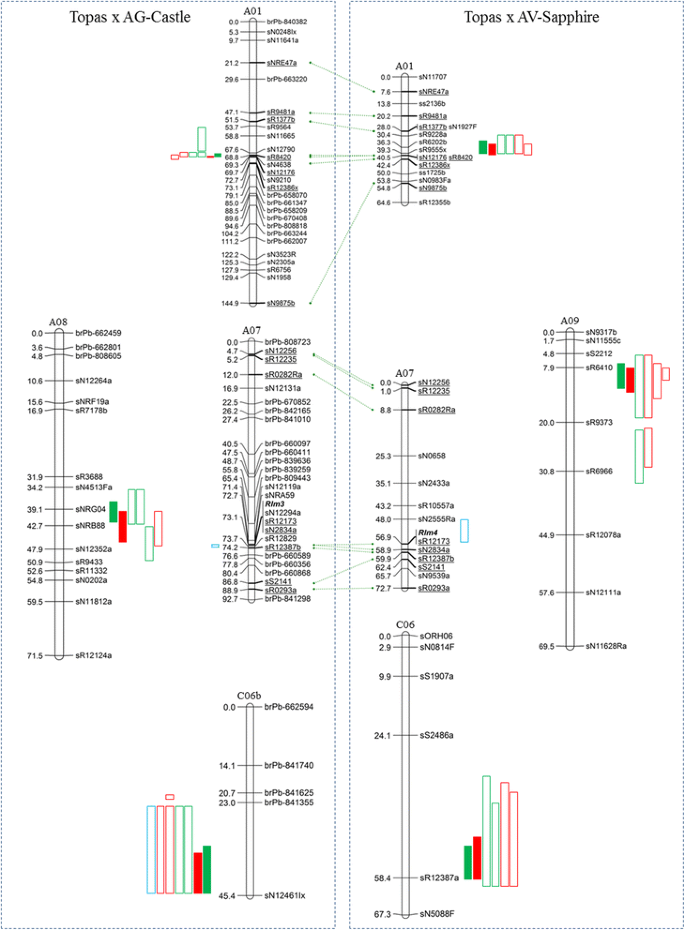
虽然群体杂合度的缺乏表明这些品系产生了真正的双单倍体,但在许多地区检测到标记失真。40%的TC标记箱和20.8%的TS标记箱显示轻微畸变(未符合1:1比例;卡方检验,P.= 0.05 ~ 0.001), 21%的TC标记和6%的TS标记出现严重的偏析(P.< 0.001)。受严重影响的区域一般在染色体的末端;在TC群体中,A02、C01、C03和C09染色体的上部,A05、C01和C06染色体的下部。此外,整个A07染色体被均匀扭曲,所有标记均偏向Topas亲本等位基因,比例约为3:1。TS群体中C03上部、A08下部和C02全部严重畸变。最初为每个人口编制了两份地图草稿;一组包含所有标记,另一组去除所有严重受损的标记位点。利用两份草图进行全基因组QTL分析。QTL的LOD和方差分值均无显著性差异Rlm3轨迹,在“扭曲的”TC地图上定位在A07上,不在“非扭曲的”地图上。以适应A07的映射Rlm3在最终的分析中,TC A07被独立解析并添加到最终的TC图谱中。在最终的地图构建之前,所有其他扭曲的标记都被移除。最终的TC图谱由21个连锁群(LGs)中覆盖2182.3 cM的307个标记箱(共分离标记的集合)组成,代表全部19个连锁群显著染色体。TS群体连锁图谱共产生23个LGs(199个箱,1714.97 cM),分布在19条染色体中的18条染色体上,没有C02染色体。
单一环境QTL
在每个环境中对每个刻度度量,存活率和内部感染(II)百分比进行的置换测试确定了TC群体的2.76和3.07之间的显着LOD阈值,TS人口为2.66-2.95。分析单环境数据产生超过它们各自的洛氏阈值的多个QTL(LOD 3.37-41.47),其定位于Tc群体的七种染色体(A01,A08,CO 3,CO 4,CO 5,C06和C07)和五条染色体TS人口(A01,A03,A09,CO1和C06),占表型方差的2.48和31.77%(附加档案2:表S1)。To identify chromosomal regions harbouring ‘stable’ and significant QTL regions, QTL identified from individual environments were only considered significant if they exceeded both the LOD threshold for each analysis, based on permutation test (1000 permutations, 0.05 error) and accounted for >5 % of the variance. After applying these criteria three significant QTL, each with favorable alleles derived from the respective resistance donor parent (AG-Castle or AV-Sapphire), were identified in each population. These regions consisted of clustered QTL located on chromosomes A01, A08 and C06 of AG-Castle, and A01, A09 and C06 of AV-Sapphire, with the A01 and C06 QTL regions appearing to be common to both resistance donor parent lines (Table2,无花果。2).TC大人口(242行),这三个集群QTL区域被检测到的QTL代表从所有三个单独的环境分析(2009年校规,沃加沃加2009 & 2010),占8.32 - 31.77% (A01), 7.05 - 9.08% (A08)和5.17 (C06)的表型方差的14.08%。对于TS群体(109个品系),只有A09 QTL区域为4个测试环境(Horsham 2008 & 2012, Wagga Wagga 2009 & 2010)中检测到的QTL。TS A01 QTL以两个4区试验(Wagga Wagga 2011, Horsham 2012)中检测到的QTL为代表,占当年方差的9.00 ~ 18.47%。在Wagga Wagga 2009年试验(3区)中还检测到一个额外的A01 QTL(方差11.60%),但未超过LOD显著性阈值。TS C06 QTL区域仅代表两个Horsham苗圃(2008年和2012年)中检测到的QTL,但大部分变异来自该区域(13.63 ~ 22.18%)。
多环境QTL
使用所有环境的S和II数据进行的多环境性状(MET)分析产生了MET QTL,对应于先前通过单环境分析确定的七条染色体中的每一条,TC A10和C07除外。此外,在TS群体中检测到多个低方差MET QTL。多环境方差(σ)的加性遗传(A)和环境(E)分量的估计2)计算狭义遗传力(H2)由于研究中使用了双单倍体群体,因此没有杂合性,因此方差没有显性成分。H2值在0.59 ~ 0.88之间,略高H2在较小的TS群体中QTL值为0.69-0.94(附加文件2:表S1)。多环境性状(MET)被认为是显著的,如果含有MET QTL的相关染色体区域占总方差的5%以上,且遗传力评分为0.5或更高,则认为它们对抗性有稳定的贡献。应用这些标准后,只保留了与之前鉴定的单环境QTL群相关的MET QTL。主要QTL区域解释的TC种群多环境总生存(MET S)和内部感染(MET II)方差分别为30.19和33.64%,TS种群分别为28.59和24.35%2).
Single-isolate描述
TC和TS群体中的每条DH系列的表征通过子叶感染试验存在或不存在过敏反应,因为最初观察到差异表型反应l . maculans分离出WA30(对AG-Castle毒性强,对AV-Sapphire毒性强)和v23.1.3(对AG-Castle毒性强,对AV-Sapphire毒性强)。将表型数据转化为孟德尔化的抗性(+)和易感(-)评分,并将其纳入每个群体的遗传图谱后,确定子叶抗性位点定位于染色体A07,与简单序列重复(SSR)标记sR12173共分离(图)。2).作为染色体A07,已知涉及特异性的Blackleg抗性基因Rlm1那Rlm3那Rlm4那Rlm7和Rlm9[19那38-40]的进一步特征的亲本有差异l . maculans菌株对A07的反应各不相同R.进行基因。只能分离无毒Rlm3或Rlm4分别在AG-Castle和AV-Sapphire上产生抗性反应(表3.).关于存在的额外证据Rlm4在AV-Sapphire中使用转基因分离物3R11:avrlm4-7,这表明了avrlm4-7基因对AV-Sapphire传达的失明(表3.额外的文件3.:图S2)。
这Rlm3TC种群的基因座与三个SSR等位基因共同进行共聚;SR12294A,SR12173和SR2834A(图。2),它跨越了80个基因的区域显著Darmor-BZH.参考基因组[37在染色体A07 (BnaA07g20270D至BnaA07g21070D)上。不幸的是,离他最近的侧翼标记Rlm3聚类为SSR标记sNRA59和sR12829,这两个标记均与目前未纳入基因组的部分序列相匹配显著染色体A07模型(分别匹配' chrUn_random '和' chrA07_random ')。紧随其后的侧翼标记sR12119a(最近基因= BnaA07g17900D)和sR12387b (BnaA07g26220D)代表一个大约4.5 Mb和832个基因的区域显著染色体A07。利用这一点b·拉伯基因组序列[41]我们能够定义跨越Bra003406至Bra004064(658基因)的较小的SNA59-SR12829间隔b·拉伯A07,并推断出等效值显著A07区间不大于BnaA07g18610D至BnaA07g24890D (3.5 Mb, 628个基因)。这表明大约有30多个基因显著时间间隔目前没有被纳入当前显著A07染色体构建[37].
的映射Rlm4TS群体将该基因置于SSR标记sN2555Ra和sN2834a之间,该区域跨越约3.9 Mb,染色体A07(BnaA07g14030D–BNAA07G2107D)上的704个基因,与Rlm3在TC人群中定义的时间间隔。
在用单分离物的映射群体的表型筛选过程中,观察到一些中间表型(0-9级上的4.1和6.9之间的分数)。因此,在用单分离株攻击时,测试影响子叶抗性表型表达的QTLl . maculans,再次分析表型数据,这次作为连续数据(0到9)而不是先前分析的离散的“造型”数据('+'或'')。正如预期的那样,差异的大部分与每个主要抗性基因基因座有关(Rlm3和Rlm4).我们还检测到一个第二显著的QTL,该QTL占TC群体子叶表型变异的9.26%,并与TC C06 QTL群体共定位(见表)2,无花果。2).
QTL定位和候选基因的鉴定
包含TC A01 MET S和MET II位点的0.5 cM图谱区间两侧分别有标记sN12790和sN4638(图1)。2),对应于49的张成空间显著基因(BnaA01g12170D–BnaA01g12660D)。每个指标的峰值MET LOD得分两侧是标记sR8420和sN4638,对应于Darmor的10个基因间隔-BZH.参考显著基因组(BnaA01g12560D–BnaA01g12660D)。TS A01 QTL位点两侧有标记sR9228a和sN12176,代表296个基因的跨度(BnaA01g09950D到BnaA01g12910D),所有QTL的峰值LOD包含在4.2 cM标记间隔sR6202b–sN12176(BnaA01g10980D到BnaA01g12910D),代表193的跨度显著这些基因也封装了TC A01 QTL位点定义的物理区间。
TC群体在A08染色体上产生了一个单环境和多环境QTL的聚类,位于39 ~ 46 cM的QTL均出现了峰值2).多环境分析确定MET S和MET II QTL在13.7 cM的标记区间内重叠,两侧分别为sN4513Fa和sN12352a标记。这个区间对应于Darmor-的396个基因区域BZH.参考基因组(BnaA08g18290D-BnaA08g22250D)。
检测到用于染色体A09上的TS群的QTL簇位于标记间隔SS2212至SR9373内,这对应于1314基因的物理间隔显著参考基因组(BNA09G22470D-BNAA09G35610D)。虽然对于许多QTL的峰值LOD,包括MET S和MET II QTL,但位于较小的SR6410-SR9373标记间隔内,但物理区域无法进一步改进显著参考基因组,因为sR6410被分配到' chrA09_random '分子,该分子没有并入主要的A09染色体构建。然而,通过使用b·拉伯基因组参考序列[41,我们鉴定了sR6410与b·拉伯A09基因Bra006927,并使用相邻基因(Bra006925)确定近似值显著该基因的物理位置相当于BnaA09g32910D的显著.这为约270基因的A09 QTL峰间隔产生了物理描绘(BNA09G32910D-BNAA09G35610D)。
每个群体的C06染色体上也检测到QTL簇,但这些连锁群的分辨率较低,影响了支持区间的精确划分。TS C06 QTL支持区间为2998显著标记sS2486和sN5088F之间的基因组(BnaC06g05190D–BnaC06g35170D),而在TC群体中显著物理间隔不能定义为TC C06支持间隔(DArT标记brPb-841355)的上侧面标记,提供了与未结合的' chrUn_random '分子的匹配。然而,我们能够定义一个共向物理区间b . oleracea参考基因组[42C06基因(1,797,307..10,864,498)约9 Mb,包含1336个预测基因。
对TC A01、TC A08和TS A09 QTL位点的描述产生了足够小的物理间隔,可用于鉴定可能在支持病原菌抗性QTL中发挥作用的候选基因。TC A01 QTL峰LOD区间仅跨越10个基因,跨越8个基因(BnaA01g12580D-12590D、BnaA01g12610D-12630D、BnaA01g12650D-12670D),与富半胱氨酸受体样蛋白激酶(CRK)基因同源A. Thaliana.染色体4(分别为4G23190,AT4G23300和AT4G04570)。克斯是拟南芥中最大的受体激酶之一,有44名成员[43],其中一些已涉及植物防御响应[44-49].TC A08和TS A09峰值QTL区间在参考范围内跨越396和270个基因显著分别基因组。在这些跨度内有几个潜在的抗性相关基因,包括受体样蛋白、受体样激酶和TIR-NB-LRR同源物。
讨论
我们在这里描述了高稳定数量抗性位点的检测和特征显著真菌病原体l . maculans.通过多环境分析,我们确定了在世界上最严酷的测试条件下有效的高遗传抗性位点,并确定了位于物理定义的QTL区域内的假定的抗性相关基因。
在多个环境中执行QTL测试时,我们能够估算遗传力(H2:遗传决定表型的程度)2).传统上可遗传是作为整个人口内方差的函数(表1).虽然这提供了对总体表型变异的遗传影响的估计,但这并不能提供群体内单个QTL位点的环境变异性的信息。通过计算H2对于每个MET QTL的值,我们可以估计环境变异性将如何影响表型变异,特别是在育种计划中针对单个QTL位点时。我们还观察到在较大的TC群体(242个DH系)中H2与内部感染指标相比,当使用存活指标确定MET QTL时,其值始终较高,尽管这对于较小的TS群体(109系)并不成立。这可能是由于现场试验评分中“逃逸”的影响。虽然“易感”Topas和“抗性”亲本品种AG Castle和AV Sapphire之间的存活率存在显著差异,但内部感染指标的差异并不总是明显(补充文件4.:表S2,附加文件1:图S1)。根据澳大利亚现场条件,感染是由性腺刺激的驱使,并且经常导致易感植物的幼苗死亡[50.].这意味着很少有易感植物将保持在生长季节结束时,当内部感染评估。然而,剩余的幸存者因逃逸而富集,即由于延迟或缺乏接触病原体,特别是当幼苗发芽不一致时,没有发生相同程度的疾病的植物。这将导致低估个别品系的内部感染,因为只有一部分站立植物被评估。在计算整个行的生存度量中,同样的效果就不那么显著了。
TC A01 QTL间隔的基因组位置与澳大利亚品种Ag-Spectrum的先前报告的Blackleg Qtl的位置相匹配[19]最近的一份报告详述了欧洲冬油菜群体的QTL定位[51.]将QTL从Grizzly / Bristol和Darmor / Bristol群体放在A01的区域内,跨越我们研究中定义的TC A01 QTL基因座(大约.Bnaa01G08200D-BNAA01G20140D)。染色体A01上的QTL还举报了来自澳大利亚品种的几个DH种群,包括AV-Sapphire [27].来自Ag-Castle A08 QTL基因座(Bnaa08G18290D-BNAA08G22250D)的有利等位基因在Darmor / Bristol群体中先前识别的QLMA8_DB QTL相邻,其在染色体A08上定位在SSR标记BN53449和SR3688(BNAA08G12480D-BNAA08G17050D)之间进行定位[51.],与Darmor中检测到的DY A08 QTL相关-bzh /Yudal人口(26那52.].此外,AV-Sapphire的TS A09 QTL位点与之前报道的同线几乎完全重叠A. Thaliana.区域AT3G25805-AT3G58680(相当于大约BNAA09G19610D到BNAA09G37480D显著基因组),被鉴定为同序LMA9.来自Darmor的QTL区间-bzh /Yudal QTL地图[26].最后,Aviso和Darmor/Bristol群体的qtl也被定位在C06下位的369基因区间(BnaC06g31460D-BnaC06g35150D) [51.],这与在TC和TS群体中检测到的大C06 QTL区域一致。在许多研究中,黑腿QTL的相关性显著品种表明,在全球范围内的CANOLA品种中使用的APR遗传学的整体池可能是相当有限的。
AG Castle的系谱分析表明,该品种近一半的遗传贡献(46.9%)来自日本材料,其余的大部分来自欧洲材料(29.8%)[53.].的研究显著种质多样性表明AG-Spectrum品种与Rainbow密切相关[54.],澳大利亚多种子抗性繁文,也以ag-castle血统谱系中的特征[53.].这个显著品种主要,祖先的法国七种品种Darmor(主要 - >初版 - > Jet Neuf - > Darmor)被分成与彩虹和Ag-Spectrum的不同思考[54.,表明澳大利亚和欧洲QTL研究中APR来源之间的总体基因组关系较低。然而,澳大利亚和法国品种A01、A08、A09和C06 QTL的相关性表明,法国APR种质引入澳大利亚育种计划后,这些QTL的选择和保留程度很高[22,表明这些QTL对澳大利亚小麦品种具有持久的抗性l . maculans人口。然而,在澳大利亚育种计划中观察到“多种子抗性缓慢侵蚀”[53.]并建议今后的工作应集中于从不同的芸苔属种质中检测和导入新的APR基因,而不是继续循环利用过度使用的QTLb . juncea品系BJ168对AG Castle和许多其他澳大利亚品种的系谱也有很小的贡献(6.3%),尽管没有一个主要品种R.基因b . juncea已渗入澳大利亚品种[53.].这个seR.基因,存在于人类的B基因组中b . juncea,是潜在的有价值的抵抗来源显著稳定渗入的育种[55.-57.].然而,对其数量抗性电位的了解甚少b . juncea一种基因组,具有独特的基因组多样性[58.),或者b . juncea一个基因组渐渗为澳大利亚种质资源中利用的黑腿APR库做出了贡献,这在抗性遗传方面仍然是一个潜在的未被充分利用的资源。
通过对TC A01峰值QTL区间定义的基因组区域的研究,发现了一组富含半胱氨酸的受体样激酶基因(CRK)。CRK的特征是一个或多个细胞外C-X8-C-X可能介导蛋白-蛋白相互作用的2-C基元(DUF26/GNK2) [43].CRK基因已被证明在病原菌感染期间在植物中被诱导[44-49],包括感染过程中几种CRKs的上调显著子叶l . maculans[32].在植物防御响应对病原体的响应的早期活动,招标诱导与其他宿主响应基因相似,如EDS1或NPR1[44那45].虽然CRK超家族的一些成员已经证明通过促进过敏反应(HR)和水杨酸(SA)积累来增强对病原体的抗性[44那45],敲除突变体和瞬时基因沉默的使用表明,其他一些CRKs可以以定量的方式对防御反应产生负面影响[47那48].克斯也已被证明在共生植物微生物相互作用中具有作用,其中符号豆类的基因Medicago Truncatula.在共生过程中维持功能结节和抑制宿主防御所必需的[59.].近年来研究表明,一些拟南芥CRKs的过表达增强了PTI对细菌病原体的防御反应,如氧化爆发、气孔关闭和胼胝质沉积两pv。番茄DC3000。此外,这些蛋白被证明与质膜上的模式识别受体鞭毛蛋白SENSING2 (FLS2)有关[60.,是病原菌PAMP反应的重要组成部分[61.].第二项研究,分析了一组接近完整的拟南芥CRK突变体,显示一些CRKs对真菌几丁质(一种常见的PTI激发剂)有反应[62.那63.]并在调节气孔闭合方面发挥作用[64.].这个roles of CRKs in quantitative plant defense responses suggests the cluster of CRK genes co-localised with the TC A01 QTL interval offer viable candidate genes for blackleg APR. Further study of these genes, including their temporal and spatial regulation in response tol . maculans感染正在进行中。虽然本研究中定义的其他QTL区间不够小,不足以进行广泛的候选基因研究,但在TS A09 (BnaA09g23770D)和TS C06 (bac06g31680)区间中发现了其他CRK同源物。
虽然未检测到来自黄玉“感病”亲本的稳定QTL,但值得注意的是,在大多数环境中,黄玉的存活率都高于常用的感病系Westar(附加文件)4.:表S2)。在澳大利亚的疾病苗圃条件下,weststar行显示幼苗几乎完全死亡,通常在生长季节结束时没有留下任何植株,而Topas行仍然产生一些成虫,尽管大多数在评分时已经死亡或严重溃烂。可以想象,黄玉含有一些小程度的APR共同的ag -城堡和av -蓝宝石,也许还有许多其他显著在这些群体中无法检测到QTL。虽然在研究过程中检测到了一些topas衍生的QTL,但这些QTL总是特定于单一的测试环境,通常占不到5%的方差,且与任何显著的MET QTL无关(附加文件)2:表S1)。在Horsham 2012试验的极高疾病压力下,Topas和Westar的存活率均为0%4.:表S2,附加文件1图S1),因此任何可能由Topas表达的微小APR在这些条件下完全无效。
我们对TC和TS种群的单分离特征也界定了主要种群的物理位置R.基因Rlm3和Rlm4在A07染色体上分别为3.5 Mb和3.9 Mb。虽然这些基因在遗传上是聚在一起的Rlm7和Rlm9,在A07上已有十多年[38,这是为该集群定义物理位置的第一个报告显著基因组。以前,拉曼等人。(2012C)定位了Rlm4基因(来自显著各种Skipton),在子叶和成人植物阶段评估为A07的24.8cm间隔使用SNP标记。而物理间隔相对显著在这项研究中没有定义,一些SNPs对应于约15.9–16.9 Mb(~BnaA07g20250D–BnaA07g21900D)的显著A07与Rlm4轨迹(65.].这个地点应该和Rlm4确定了TS群体的物理区间(BnaA07g14030D-BnaA07g21070D),并与SSR标记sR12173共分离(BnaA07g20910D)。
两者都不Rlm3也不Rlm4与田间检测到的QTL相关,表明对两种R.种群中的基因l . maculans感染疾病的苗圃。这个结果是意料之中的,因为高致病性对Rlm3[66.),Rlm4[23在澳大利亚已被报道过l . maculans隔离。分析单身的子叶反应l . maculans孤立于各自的无水植物R.基因产生了与每种基因相关的高LOD,高方差的COTQTL'基因座,如预期。在TC群体中还证明了与分离物WA30的另外的子叶响应相互作用,其占子叶表型变异的9.26%并局限于CO 6 QTL间隔(图。2、表2).在TS群体中没有检测到额外的显着的子叶响应性QTL,其还含有CO 6 QTL基因座,使用分离物V23.1.3。以前的研究发现了显着差异l . maculansAPR与non-APR品种子叶病变发育[18]子叶表达的QTL与我们研究中检测到的QTL相似,之前在SASDH(Skipton/AG谱)中也有定义群体和定位在染色体A01和A10上,但只有A01 QTL与成株的田间抗性相关。通过l . maculans隔离06MGPP041,但不隔离04MGPS021[19].育苗和主持人的成年阶段的Blackleg抗性通常被视为单独的机制;前者由种族特定管辖R.基因在子叶和叶中的相互作用,并且后者通过茎中的非特异性QT1。在幼苗(类曲细胞)和成人植物(场)测试中的常见QTL基因座的检测以及个体的差异相互作用l . maculans分离为QTL,表明这种区别并不总是有效。在宿主和病原体之间的相互作用中可能早期引发相关的电阻响应,在病原体进入植物的干燥组织之前活化。这些QTL的作用可能是损害初始感染过程,而不是积极抵抗成虫组织的侵袭,导致成人植物中的干溃疡症状的延迟发展。如果发现的定量Blackleg电阻显著是真正的“非比赛特定”,那么现场试验中观察到的整体环境方差可归因于影响每次试验的物理环境因素(降雨,温度等)的差异。但是,如果l . maculans分离株差异差异至QTL,然后通过试验中使用的病原体群体的变异来解释环境方差的大量组分,位于地点和年份。或者,如前所述,如前所述显著骗子R.基因需要其他的伴侣蛋白才能成功地触发抗性反应l . maculans[29那67.,子叶检测中检测到的次要QTL可能代表等位变异或转录模式的改变R.基因相互作用蛋白。进一步解剖定量抗性反应的时间和空间效应l . maculans感染以及这些应对措施对许多不同分离株的有效性,将有助于我们更好地全面了解黑腿耐药性反应,以及如何在作物保护中最好地利用现有遗传学。
结论
由于病原体种群富有毒性而富有敌意的毒力R.基因,替代抗性基因需要被纳入作物育种计划,以维持全球农业生产。QTL的鉴定和定位是现代MAS育种中高效导入稳定抗性遗传的必要条件,为数量遗传学在植物保护中的有效应用提供了可能。本研究通过多环境QTL分析,圈定了4个稳定的黑腿抗性QTL。我们已经鉴定了一组与重要的田间衍生QTL相关的富含半胱氨酸的受体样激酶基因,表明这些基因在定量防御应答中发挥了作用l . maculans.本工作所描述的黑腿病有效QTL的基因组圈定,有助于抗病育种工作的开展,并有助于进一步研究黑腿病致病基因的鉴定芸苔属种质。
方法
植物种群
F1幼苗,通过杂交瑞典春型,黑腿易感显著采用Ferrie等人的方法,利用小孢子培养的方法生产DH群体。[68.用蔗糖含量为13%的改良利希特培养基(NLN)。本研究采用的Topas/AG-Castle DH群体(TC)由两个由139和103个DH系组成的亚群体共242个DH系组成,每个亚群体由一个F1工厂。Topas/AV-Sapphire DH居群(TS)共有109个株系,由66个和43个DH亚居群组成。QTL试验中使用的亲本和DH系种子于2007年(TS)和2008年(TC)夏季生长季在加拿大萨斯卡图(Saskatoon)的帐篷样地生产,包装成每个株系100粒的重复,并送往澳大利亚进行田间抗黑腿病试验。Topas的显著这条线来自于AAFC萨斯卡通系列。AG-Castle和AV-Sapphire线由DEDJTR Victoria(前第一产业部)提供。
DH种群的田间特征
亲本系和它们各自的DH种群,以及几个显著品种检查(附加文件4.:表S2)于2008年至2012年5月至11月在位于Wagga Wagga(新南威尔士)和Horsham(维多利亚)南部两个地点(Wonwondah和Green Lake)的黑腿病苗圃中生长(图。1)。在三个试验年内,每个场地的降雨量平均相差103.2 mm/年,Wagga Wagga场地的降雨量平均多38%(其他文件)5.:表S3)。每种试验在随机块设计中种植,每行3至4重复。TC群体在三个单独的环境中进行了测试;Wagga Wagga和Horsham(Wonwondah网站)于2009年(每次试验3次重复),并在2010年在Wagga Wagga(4次重复)。TS人口在四个环境中进行了测试;Horsham(Wonwondah网站),2008年和Wagga Wagga,2009年作为3重复试验和Wagga Wagga,2011和Horsham(绿湖网站),2012年作为4重复试验。播种后4-5周的出现计数。对于霍舍姆地点的试验,在去年收集的当地患病的油菜茬被传播为源头l . maculans而在沃加沃加,试验被播种原位如前所述,上一季的油菜籽残茬[19].在生长季节试验的结束时,使用存活百分比和内部感染(II)指标评估Blackleg病的试验。每行计算S作为(季节常驻植物/出苗计数)* 100,II通过检查茎秆在冠部的茎秆和额定对真菌变色后的内部感染后测定5-20个随机植物。5级(0 =无感染,1 = 1-25%感染,2 = 26-50%感染,3 = 51-75%感染,4 = 76-99%感染,5 = 100%感染/失踪植物)使用Microsoft Excel计算每个条目和度量的中位数分数。使用R软件进行群体分析和分布直方图的绘图[69.].
本研究从TC DH群体中鉴定的3个主要QTL的代表品系,无论是单株还是组合,也分别进入Melfort(2012)和Saskatoon(2013)的萨斯喀彻温病苗圃,试图测试QTL对加拿大群体的抗性效果l . maculans.然而,这两个地点都没有产生足够的疾病压力来评估耐药性,在生长季节结束时,Westar控制入口的平均内部感染低于25%。
Single-isolate描述
TC和TS群体中的每个DH系列的表征在单一孢子衍生的感染期间存在或不存在过敏反应l . maculans通过子叶感染试验分离WA30 (Rimmer Collection, AAFC Saskatoon)或v23.1.3 (INRA-Bioger Collection, France)。按照Larkan等人的描述,在感染后14天,对每个株系进行0-9级评分[13].进一步的鉴别病理学检测,使用分离的l . maculans不同的毒力基因谱(00 - 100,98 - 15,99 - 53,89 - 12,2354 - rimmer Collection, AAFC Saskatoon;3R11- howlett实验室,墨尔本大学,澳大利亚AVRLM1[13])R.基因控制系Topas DH16516(Topas的DH系,没有有效的黑腿抗性),哥伦布(Rlm1那Rlm3)、量子(Rlm3)、新干线(Rlm4),Roxet(Rlm7)和Goeland (Rlm9),以便对可能发生的情况提出一个假设R.每个群体的基因含量(表1)3.).试验用接种物如前所述生产[70].孢子稀释到2 × 107.使用孢子/ ml和10μl接种每种植物上的四个小伤口中的每一个(在每个子叶叶的中心缠绕一个)。
转基因分离物3R11:avrlm4-7由农杆菌转化产生[71.].其中跨越1213 bp的上游和514碱基对的下游:简单地说,一个2205 bp的扩增子来自分离v23.1.3(; GGGGACAAGTTTGTACAAAAAAGCAGGCTTCCTCTGGTAAGGAAGGTTTACCAATTATACACCT,GW-AvrLm47G-RB GGGGACCACTTTGTACAAGAAAGCTGGGTCGGCGGTAGATTTGCTACTAAAAGGTAACTTT GW-AvrLm47G-Fc的引物)中产生L maculans AvrLm4-7CD [72.],并在转化前插入gateway兼容的真菌转化载体pNL11l . maculans如前所述隔离3R11 [13].
图谱构建及QTL鉴定
利用225个SSR标记和212个SSR标记分别对TC和TS群体进行了鉴定,如前所述[73.].TC人群的一个子集之前已经使用279个DArT标记作为共识图谱的一部分显著[74.]此数据还结合到TC图中,以提供额外的分辨率并允许取向到其他地图(总共503个标记,分组为360个箱)。联动地图结构和包容性复合间隔映射(ICIM)[75.使用QTL IciMapping 3.3版(http://www.isbreeding.net.).在最终的地图构建之前,标记严重扭曲(卡方检验,P. < 0.001) were excluded. A threshold of LOD 6 was applied for initial grouping of markers. LGs consisting of > 3 markers were anchored to chromosomes based on BLAST-like alignment tool (BLAT) analysis of SSR marker sequences to the published显著基因组(37,然后在lod3重新计算LGs。用最近邻算法进行标记排序,用相邻重组分数和(SARF)准则进行一次脉动。在QTL鉴定方面,利用软件的' ICIM-ADD '和' ICIM-EPI '功能,研究了加性和遗传上位性QTL [76.那77.]在每个环境中表达和每个评分度量(S和II)。对每个环境中的每个评分度量执行置换测试(1000个排列,95%置信水平,1cm间隔)以确定显着的LOD阈值。然后通过使用所确定的LOD阈值和较小(0.5cm)扫描间隔来改进QTL位置的精度。软件的“多环境试验”(MET)功能还用于确定主要QTL的共识位置,并通过环境(GXE)相互作用评估基因型。如果它们超过LOD意义阈值并占差异的5%,则从各个环境中识别的QTL被认为是显着的。如果他们占差异的5%并具有遗传物,则认为QTL被认为是重要的(H2=σ2(添加剂)/σ2(总))> 0.5。QTL的位置由支持和峰值标记间隔定义,其中支持间隔表示LOD超过计算出的LOD阈值(对于单环境QTL)或LOD-1峰值(对于多环境分析)的地图间隔。每个种群的数据集被作为总种群和它们各自的组成亚种群进行分析。最终地图数字使用地图2.2制作[78.]和Microsoft PowerPoint软件。以确定主QTL相对于显著参考darmor-BZH.基因组(37]侧翼SSR标记的目标序列来自AAFC芸苔属MAST数据库(http://aafc-aac.Usask.ca/Crassicamast/)并用来搜索公众显著基因组数据库(http://www.genosope.cns.fr.),使用默认BLAT搜索设置。
缩写
- 4月:
-
成人植物抵抗力
- blat:
-
爆炸之类的校准工具
- CRK:
-
Cysteine-rich受体激酶
- DH:
-
加倍单倍体
- ELRR:
-
细胞外亮氨酸重复
- eti:
-
Effector-triggered免疫力
- 人力资源:
-
过敏反应
- ICIM:
-
包含复合区间映射
- 2:
-
内部感染
- 格林:
-
连锁群
- LOD:
-
赔率的对数
- 马斯:
-
标记辅助选择
- 满足:
-
多特征
- 零:
-
Near-isogenic线
- PAMP时:
-
其分子模式
- PTI:
-
PAMP时触发免疫
- QTL:
-
数量性状位点
- S:
-
生存
- 山:
-
水杨酸
- SNP:
-
单核苷酸多态性
- 苏维埃社会主义共和国:
-
简单的序列重复
- TC:
-
托帕斯城堡酒店
- TS:
-
Topas / AV-capphire
参考
- 1.
BENT AF,Mackey D. Elictors,Chementors和R基因:新的范式和一生的问题提供。Annu Rev phytopathol。2008; 45:399-436。
- 2.
吴军,蔡刚,涂军,李丽,刘松,罗旭,周磊,范超,周勇。菌核病茎腐病抗性qtl的鉴定BnaC.IGMT5.作为主要抗病QTL的候选基因SRC6.在芸苔属植物显著.PLoS ONE。2013; 8 (7) .e67740。
- 3.
yin x,yi b,chen w,张w,tu j,fernando wgd,fu t.检测到的qtls的映射芸苔属植物显著卫生署人口的抗药性sclerotinia sclerotiorum.在多个环境。Euphytica。2010;173(1):25 - 35。
- 4.
Zhao J, Udall JA, Quijada PA, Grau CR,孟J, Osborn TC。抗性数量性状位点sclerotinia sclerotiorum.以及它与一个同源非互易转位的关联芸苔属植物显著中国科学(d辑:地球科学)2006;
- 5。
obermeier c,hossain ma,snowdon r,knüferj,von tiedemann a,friedt w.苯丙醇丙烷代谢物的遗传分析与抵抗黄萎病longisporum在芸苔属植物显著.摩尔品种。2013;31(2):347 - 61。
- 6。
Rygulla W,Snowdon RJ,Friedt W,Happstadius I,Cheung Wy,Chen D.识别抵抗的定量特质基因座黄萎病longisporum在油菜籽(芸苔属植物显著).植物病理学。2008;98(2):215 - 21所示。
- 7。
Eynck C,Koopmann B,Karlovsky P,Von Tiedemann A.冬季油菜的内部抗性抑制了血管病原体的全身蔓延黄萎病longisporum.植物病理学。2009; 99(7):802-11。
- 8。
豪利特。瘦性的黄瓜是芸苔属黑腿病的致病因子。真菌学报。2001;33(1):1 - 14。
- 9。
拉曼H,拉曼R,Larkan N. Blackleg抗性位于油菜(芸苔属植物显著Andersen SB,编辑。从实验室到田间的植物育种。InTech;2013。内政部:10.5772/53611.可以从:http://www.intechopen.com/books/plant-breeding-from-laboratories-to-fields/genetic-dissection-of-blackleg-resistance-loci-in-rapeSed-brassica-napus -l-.
- 10.
鲁塞尔T、佩诺A、皮诺切特X、布伦H、痛风L、德洛尔姆R、施密特J、巴勒斯登MH.一项对瘦性的黄瓜在法国表示快速适应Rlm1油菜抗性基因。acta botanica sinica(云南植物学报). 2003;109(8):871-81。
- 11.
Daverdin G, Rouxel T, Gout L, Aubertot JN, Fudal I, Meyer M, Parlange F, Carpezat J, Balesdent MH.基因组结构和繁殖行为影响真菌植物病原的进化潜力。公共科学图书馆Pathog。2012;8 .e1003020(11)。
- 12
Sprague SJ, Marcroft SJ, Hayden HL, Howlett BJ。主要基因对黑腿病的抗性芸苔属植物显著三年内,澳大利亚东南部的商业生产就完成了。工厂说。2006;90(2):190 - 8。
- 13
Larkan NJ, Lydiate DJ, Parkin IAP, Nelson MN, Epp DJ, Cowling WA, Rimmer SR, Borhan MH. The芸苔属植物显著骗子耐药基因LepR3编码一种类似受体的蛋白质,由瘦性的黄瓜效应器AVRLM1。新植物。2013; 197(2):595-605。
- 14
Delourme R, Chevre AM, Brun H, Rouxel T, Balesdent MH, Dias JS, Salisbury P, Renard M, Rimmer SR.主要基因和多基因抗性瘦性的黄瓜在油菜籽(芸苔属植物显著)《欧洲植物病理学杂志》,2006;114(1):41-52。
- 15
Brun H, Chèvre AM, Fitt BD, Powers S, Besnard AL, Ermel M, Huteau V, Marquer B, Eber F, Renard M,等。定量电阻增加了质电阻的耐久性瘦性的黄瓜在芸苔属植物显著.新植醇。2010;185(1):285 - 99。
- 16。
Delourme R、Bousset L、Ermel E、DufféP、Besnard AL、Marquer B、Fudal I、Linglin J、Chadœuf J、Brun H.数量抗性影响频率增加的速度,但不影响克服主要抗性基因的毒力等位基因的多样性瘦性的黄瓜在油料强奸。感染Genet Evol. 2014;27:49 - 99。
- 17。
rimmer sr。抗性基因到瘦性的黄瓜在芸苔属植物显著.可以j植物pathol。2006; 28:S288-97。
- 18。
黄怡,齐阿,国王GJ,Fitt BDL。评估定量抵抗瘦性的黄瓜(癌茎溃疡病)芸苔属植物显著(油菜籽)在幼嫩植株中。PLoS ONE。2014; 9 (1) .e84924。
- 19。
Raman R,Taylor B,Marcroft S,Stiller J,Eckermann P,Coombes N,Rehman A,Lindbeck K,Luckett D,Wratten N,等。抗性的定性和定量位点的分子图谱瘦性的黄瓜引起油菜籽黑腿病(芸苔属植物显著l .)。中国科学(d辑:地球科学)2012;
- 20.
黑腿的遗传学[瘦性的黄瓜(DESM。)CES。et de没有。]油菜籽的抗性(芸苔属植物显著L)。二世。幼苗和成株抗性作为数量性状。中国科学(d辑:地球科学)1996;93(5-6):941-9。
- 21.
黄志强,黄志强,黄志强,等。耐药菌株的筛选与鉴定瘦性的黄瓜(抑制溃疡)芸苔属植物显著加入。Euphytica。2003; 133(2):219-31。
- 22.
Salisbury P,Wratten N.芸苔属植物显著《育种》。收录于:宾夕法尼亚州索尔兹伯里,波特TD,麦克唐纳G,格林AG,编者。前三十年澳大利亚的油菜。戈斯福德:区域研究所有限公司;1999年。第29-36页。
- 23。
Marcroft SJ, Elliott VL, Cozijnsen AJ, Salisbury PA, Howlett BJ, Van De Wouw AP瘦性的黄瓜在澳大利亚芸苔属植物显著基于反应的栽培品种与已知的aairulence基因型分离。农作物牧场sci。2012; 63(4):338-50。
- 24。
Pilet ML,Delourme R,Foisset N,雷纳德M.鉴定源于对Blackleg病的定量田间抗性的基因座,因子瘦性的黄瓜(DESM。)CES。et de。那在Winter rapeseed (芸苔属植物显著l .)。Al Appl Genet。1998; 96(1):23-30。
- 25。
Pilet ML, Duplan G, Archipiano M, Barret P, Baron C, Horvais R, Tanguy X, Lucas MO, Renard M, Delourme R.两种遗传背景下油菜抗黑腿病QTL的稳定性。作物科学。2001;41(1):197 - 205。
- 26。
Delourme R,Piel N,Horvais R,Pouilly N,Domin C,ValléeP,Falentin C,Manzanares-Dauleux MJ,雷纳德M. QTL近代近代线的分子和表型表征,用于定量抗性瘦性的黄瓜在油菜籽(芸苔属植物显著l .)。Al Appl Genet。2008; 117(7):1055-67。
- 27.
Kaur S,Cogan NOI,Ye G,Baillie RC,Hand ML,Ling AE,McGearey AK,Kaur J,Hopkins CJ,Todorovic M,等。抗黑腿病的遗传图谱构建和QTL定位(瘦性的黄瓜)澳大利亚油菜病害(芸苔属植物显著l .)品种。应用计算机学报。2009;120(1):71-83。
- 28.
Ghanbarnia K,Fudal I,Larkan NJ,Links Mg,Balesdent M-H,Profotova B,Fernando WGD,Rouxel T,Borhan MH。快速识别瘦性的黄瓜aairulence基因AVRLM2.采用拆放比较基因组学方法。莫尔植物途径。2015; 16(7):699-709。
- 29.
作者简介:马磊(1981 -),男,博士芸苔属植物显著受体样蛋白RLM2由第二个等位基因编码LepR3/Rlm2黑腿抗性位点。植物生物技术杂志,2015;13(7):983-92。
- 30.
李H,Kuo J,Barbetti MJ,Sivasithamparam K.春季茎组织干部响应的差异芸苔属植物显著多基因抗性和单显性基因抗性的品种瘦性的黄瓜.可以j bot。2007; 85:191-203。
- 31。
Šašek V, Nováková M, Jindřichová B, Bóka K, Valentová O, Burketová l无毒基因的识别AVRLM1从hemibiotrophic子囊菌瘦性的黄瓜触发水杨酸和乙烯信号传导芸苔属植物显著.Mol植物微生物相互作用。2012; 25(9):1238-50。
- 32.
Haddadi P,MA L,Wang H,Borhan MH。基因组 - 范围的转录组分析提供了进入生活方式过渡和效应曲目的见解瘦性的黄瓜在殖民化期间显著幼苗。莫尔植物途径。2015.(印刷机)。DOI:10.1111/mpp.12356.
- 33.
Corina Vlot A,Dempsey Da,Klessig DF。水杨酸,一种对抗疾病的多方素激素。Annu Rev phytopathol。2009; 47:177-206。
- 34.
Kim PD,Šašek V,BurkotováL,ČopíkováJ,Synytsya a,JindřichováB等。细胞壁成分瘦性的黄瓜增强抵抗的芸苔属植物显著.中国食品科学。2013;61(22):5207-14。
- 35.
Lowe RGT, Cassin A, Grandaubert J, Clark BL, Van De Wouw AP, Rouxel T, Howlett BJ。油菜植物-真菌相互作用伙伴的基因组和转录组(芸苔属植物显著)和二Leptosphaeria物种。PLoS ONE。2014; 9 (7): e103098。
- 36
Huang Yj,Pirie EJ,Evans N,Delourme R,King GJ,Fitt BDL。对症状生长的定量抗性瘦性的黄瓜(癌茎溃疡病)芸苔属植物显著(油菜)。植物别墅。2009; 58(2):314-23。
- 37
Chalhoub B,Denoeud F,Liu S,Parkin IAP,Tang H,Wang X,Chiquet J,Belcram H,Tong C,Samans B等。早期的全多利多倍进化在新石器时代芸苔属植物显著油料基因组。科学。2014;345(6199):950 - 3。
- 38
Delourme R, Pilet-Nayel ML, Archipiano M, Horvais R, Tanguy X, Rouxel T, Brun H, Renard M, Balesdent MH.一组主要抗性基因瘦性的黄瓜在芸苔属植物显著.植物病理学。2004;94(6):578 - 83。
- 39
R, Taylor B, Lindbeck K, Coombes N, Barbulescu D, Salisbury P, Raman hRlm1抵抗的基因瘦性的黄瓜在油菜(芸苔属植物显著l .)。作物与牧草学报,2012;63(10):1007-17。
- 40
Leflon M, Brun H, Eber F, Delourme R, Lucas MO, Vallée P, Ermel M, Balesdent MH, Chèvre AM。具有特异性抗性的基因的检测、渐渗和定位瘦性的黄瓜从Brassica Rapa.进入显著.应用计算机学报。2007;115(7):897-906。
- 41
王X,王H,王杰,孙R,吴杰,刘S,白Y,门杰,班克罗夫特一世,程F,等。中多倍体作物的基因组Brassica Rapa.Nat Genet.2011;43(10):1035-9。
- 42
刘士,刘义,杨X,桐树,爱德华兹D,Parkin IAP,赵M,MA J,Yu J,Huang S等人。这Brassica oleracea.基因组揭示多倍体基因组的不对称进化。Nat Commun。2014;5:3930。
- 43.
Chen Z.一个具有新的富含半胱氨酸重复序列的蛋白质超家族。植物生理学。2001;126(2):473–6.
- 44.
Acharya BR, Raina S, Maqbool SB, Jagadeeswaran G, Mosher SL, Appel HM, Schultz JC, Klessig DF, Raina R.过表达拟南芥富含半胱氨酸的受体样激酶CRK13导致抗性增强两.植物j . 2007;(3): 488 - 99。
- 45.
陈凯,杜丽丽,陈志强。拟南芥蛋白激酶对拟南芥防御反应的敏感作用及细胞程序性死亡的激活。acta botanica sinica(云南植物学报)2003;53(1-2):61-74。
- 46.
孙威,Savouré A, Deslandes L, Marco Y, Van Montagu M, Verbruggen n拟南芥蒂利亚纳通过氧化应激和病原体发作激活的受体样蛋白激酶基因。工厂J. 1999; 18(3):321-7。
- 47。
Ederli L,Madeo L,Calderini O,Gehring C,Moretti C,Buonaurio R,Paolocci F,Pasqualini S.该拟南芥蒂利亚纳富含半胱氨酸的受体样激酶CRK20调节宿主的反应两pv。番茄DC3000感染。acta botanica yunnanica(云南植物研究). 2011;168(15):1784-94。
- 48。
Rayapuram C, Jensen MK, Maiser F, Shanir JV, Hornshøj H, Rung JH, Gregersen PL, Schweizer P, Collinge DB, lyngkæ r MF。大麦白粉病诱导的富含半胱氨酸受体样蛋白激酶对基础抗性的调控。植物病理学杂志。2012;13(2):135-47。
- 49。
WRZACZEK M,BROSCHÉM,SALOJÄRVIJ,KangasjärviS,Idänheimon,Mersmann S,Robatzeks,KarpińskiS,KangasjärviJ.KangsjärviJ,臭氧和植物激素Crk / Duf26受体样蛋白激酶的转录调控拟南芥。BMC植物BIOL。2010; 10:95。
- 50.
李华,李国强。黄斑钩端螺旋体子囊孢子和孢子对西澳大利亚油菜黑腿病的流行病学具有重要意义。植物学报。2007;36(5):439-44。
- 51。
Jestin C,Bardol N,LodéM,DufféP,Domin C,ValléeP,Mangin B,Manzanares-Dauleux MJ,Delourme R.连接的群体用于检测油菜中Phoma Phoma Phoma Step Canker的定量抗性因素(芸苔属植物显著l .)。摩尔品种。2015;35(8):1 - 16。
- 52。
黄玉杰,Jestin C, Welham SJ, King GJ, Manzanares-Dauleux MJ, Fitt BDL, Delourme R:抗性环境稳定QTL的鉴定瘦性的黄瓜在油菜籽(芸苔属植物显著).Theor Appl Genet. 2015 - 1 - 12。
- 53。
整流罩佤邦。澳大利亚油菜的遗传多样性及其对改变未来环境的作物育种的影响。中国农业科学(英文版);2010 - 03
- 54。
拉曼H,拉曼R,纳尔逊MN,亚斯兰MN,Rajasekaran R,Wratten N,Cowling Wa,Kilian A,Sharpe Ag,Schondelmaier J.多样性阵列技术标志:油菜籽遗传多样性分析和联系地图建设(芸苔属植物显著L.)。DNA Res.2012;19(1):51–65.
- 55。
Brun H,Levivier S,Somda I,Ruer D,Renard M,Chevre Am。一种评估新阻力源潜在耐久性的现场方法:应用于瘦性的黄瓜-芸苔属植物显著pathosystem。植物病理学。2000;90(9):961 - 6。
- 56.
Chen S,Nelson Mn,ChèvreMA,Jenczewski E,Li Z,Mason As,Meng J,Plummer Ja,Pradhan A,Siddique Khm,等。Trigenomic Bridges for Brassica改进。CRIT Rev Plant Sci。2011; 30(6):525-47。
- 57.
Chèvream,brun h,Eber f,Letanneur Jc,Vallee P,Ermel M,Glais I,Li H,Sivasithamparam K,Barbetti MJ。稳定抗性瘦性的黄瓜在芸苔属植物显著-b . juncea重组线及其进入弹簧型芸苔属植物显著.工厂说。2008;92(8):1208 - 14所示。
- 58.
Zou J,Hu D,Liu P,Raman H,Liu Z,Liu X,Parkin IAP,Chalhoub B,Meng J.联合线性和亚基的分歧芸苔属植物juncea与其他相比芸苔属携带不同亚因素的物种。BMC基因组学。2016; 17(1):1-14。
- 59.
Berrabah F、Bourcy M、Eschsruth A、Cayrel A、Guefrachi I、Mergaert P、Wen J、Jean V、Mysore KS、Gourion B等。一种非受体样激酶可防止根瘤早期衰老和共生过程中的防御反应。New Phytol.2014;203(4):1305-14。
- 60.
叶永红,张永红,黄p - y,黄建斌。拟南芥模式触发免疫的半胱氨酸受体样激酶的过度表达。中国农业科学(英文版);2015;
- 61.
gómez-gómezl,瓶子T.FLS2:参与拟南芥细菌Elicitor鞭毛蛋白的感知的LRR受体样激酶。Mol细胞。2000; 5(6):1003-11。
- 62.
Lloyd SR, Schoonbeek HJ, Trick M, Zipfel C, Ridout CJ。方法研究pamp引发的免疫芸苔属物种。Mol植物微生物相互作用。2014; 27(3):286-95。
- 63
Shinya T,Nakagawa T,Kaku H,Shibuya N.甲壳素介导的植物 - 真菌相互作用:捕捉,遮住和握手。CurrOp植物BIOL。2015; 26:64-71。
- 64
Bourdais G,BurdiakPł,Gauthier A,Nitsch L,SalojärviJ,林纳姆兰C,Idänheimon,猎人k,kimura s,merilo e等。大规模表情识别与氧化应激相关的克劳克斯的克斯的主要和微调作用。Plos Genet。2015; 11(7):E1005373。
- 65
基于SNP标记的全基因组图谱构建与连锁分析芸苔属植物显著.植物Biotechnol J. 2014; 12(7):851-60。
- 66
Dilmaghani A、Balesdent MH、Didier JP、Wu C、Davey J、Barbetti MJ、Li H、Moreno Rico O、Phillips D、Despeghel JP等瘦性的黄瓜-大叶钩端螺旋体美洲大陆的复杂物种。植物病理学研究。2009;58(6):1044 - 58。
- 67.
陈志强,王志强,王志强,等芸苔属植物显著lepr3并是必需的瘦性的黄瓜AvrLm1-triggered免疫力。植物学报。2015;6:933。
- 68.
Ferrie AMR,EPP DJ,Keller WA。评估Brassica Rapa.L.用于微孔培养反应的基因型和高胚胎源性线的鉴定。植物细胞代表1995; 14(9):580-4。
- 69.
R:用于统计计算的语言和环境[http://www.R-project.org/]
- 70.
Ferreira ME, Rimmer SR, Williams PH, Osborn TC。映射位点控制芸苔属植物显著抵抗力瘦性的黄瓜在不同的筛选条件下。植物病理学。1995;85(2):213-7。
- 71.
丝状真菌的遗传转化根癌土壤杆菌。在:自然协议交换。自然出版集团;2008年。http://www.nature.com/protocolexchange/protocols/427
- 72.
帕兰格F、达弗丁G、福达尔一世、库恩M-L、巴勒斯登M-H、布莱斯F、灰色贝塞特B、鲁塞尔T。瘦性的黄瓜aairulence基因avrlm4-7具有双重识别特异性Rlm4和Rlm7油菜的抗性基因,并规避Rlm4-通过单一氨基酸变化介导的识别。摩尔微生物学。2009;71(4):851-63。
- 73.
李志强,李志强,李志强。黑腿病抗性基因的共定位研究Rlm2和LepR3在芸苔属植物显著染色体A10。植物生态学报。2014;14(1):1595。
- 74.
Raman, R, Kilian A, Detering F, Long Y, Edwards D, Parkin IAP, Sharpe AG, Nelson MN, Larkan N, et al.;油菜籽分布图(芸苔属植物显著L.)基于多样性阵列技术标志:在定性和定量性状的遗传解剖中的应用。BMC基因组学。2013; 14(1):277。
- 75。
李华,叶国强,王建军。一种改进的复合区间映射算法。遗传学。2007;175(1):361 - 74。
- 76。
李华,李振华,王军。双亲本群体数量性状遗传上位性的包含复合区间作图方法。中国科学(d辑:地球科学)2008;
- 77。
张丽丽,李华,王建军。包含性复合区间映射在检测公共F基因上位性中的统计能力2隔离比率。acta botanica yunnanica(云南植物研究). 2012;54(4):270-9。
- 78。
vooorres重新。MapChart:用于链接地图和QTL的图形演示软件。杂志。2002; 93(1):77-8。
致谢
作者要感谢Sarah Kuzmicz, Kyla Horner, Sigrun Gulden, Christine Hammond, Helen Lui, Catherine Guenther和Stephanie McMillan (AAFC, Saskatoon,加拿大),Ray Cowley和David Roberts, Peter Heffernan, Peter Deane和Brian (NSWDPI, Wagga Wagga,澳大利亚),Shanoor Hossain和Sandra Maybery (DEDJTR, Horsham)(澳大利亚)请求在项目的技术方面提供援助。我们也要感谢Regine Delourme (INRA,法国雷恩)关于blackleg QTL的个人沟通,Thierry Rouxel (INRA- bioger,法国)提供了参考l . maculans隔离v23.1.3和Angela Van de Wouw&Barbara Howlett(澳大利亚墨尔本大学)提供隔离3R11。
资金
这项工作由AAFC-Industry Blackleg Consortium II(成员包括Advanta Seeds Pty Ltd,农业维多利亚服务,拜耳服务,农作物生产服务加拿大,陶氏佐科,KWS Saat Ag和NSW主要产业部)。
数据和材料的可用性
所有支持研究结果的数据都包含在手稿和补充数据部分中。本研究中使用的SSR标记的详细资料可在网上查阅,详见方法部分。研究中使用的DH种群和单个DH系的数据仍然属于加拿大农业和农业食品公司的财产。
作者的贡献
D Lydiate和S rimmer构思了这项研究。D Lydiate,S Rimmer,FY和MB参加了项目协调。NL,HR,DB,D Luckett,WB,NW和PS组织和/或进行现场试验。NL进行了遗传映射和基因组分析。HR和RR提供了DART标记分析。NL和S Robinson进行了统计和QTL分析。NL,MB和HR起草了稿件。除了S RIMMER外的所有作者(已故)阅读并批准了最终手稿。
相互竞争的利益
作者声明,在这里提出的工作没有竞争的利益。
同意出版
不适用。
伦理批准和同意参与
不适用。
作者信息
从属关系
相应的作者
补充资料
作家s·罗杰·里默去世。
附加文件
附加文件1:图S1。
分布中位存活和内部感染百分比。每次试验中每个人群(TC或TS)给予存活(绿色棒)和内部感染(红色棒)的分数的分布。作为位置的环境名称(H = Horsham,W = Wagga Wagga),年份(08-12 = 2008-2012)。绿色和红线分别表示父母线的平均存活率和内部感染百分比。(PNG 127 KB)
附加文件2:表S1。
所有单环境和多环境QTL (LOD >2.5)。(多克斯43 kb)
附加文件3:图S2。
转基因互补Rlm4在AV-Sapphire。分离株表型互作00-100 (avrlm4-7.),v23.1.3(avrlm4-7r11 (3),AVRLM7.)和转基因分离物3R11:avrlm4-7(avrlm4-7),显著线路顶部(无黑腿)R.基因)及AV-Sapphire (Rlm4)(巴布亚新几内亚1656 kb)
附加文件4:表S2。
对照组的存活率和内部感染显著每个环境中的行。(DOCX 16 kb)
附加文件5:表S3。
生长季(5 - 11月)试验点的降雨量(毫米)。(多克斯15 kb)
权利和权限
开放存取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
新泽西州拉坎,H.拉曼,利迪雅特,D.J.et al。多环境QTL研究表明,富半胱氨酸蛋白激酶基因在黑腿病定量抗性中的作用芸苔属植物显著.植物生物学16,183(2016)。https://doi.org/10.1186/s12870-016-0877-2
收到了:
公认:
发表:
关键字
- 芸苔属植物显著
- 瘦性的黄瓜
- Blackleg.
- 定量的阻力
- 几丁质
- CRK