抽象的
背景
在种子,从休眠到发芽的转换由脱落酸(ABA)和赤霉素(GAS)调节,并且涉及染色质重塑。特别地,压制性标记H3K27三甲基化(的H3K27me3)已显示靶向该过渡的许多主调节器。DAG1(DOF - 影响GERMINATION1),是在种子萌发的负调节拟南芥,并直接抑制Ga Biosynthetic基因赤霉素3-β-双加氧酶).我们设定了探讨DAG1在种子休眠和成熟方面相对于表观遗传和激素控制的作用。
结果
我们表明,DAG1通过H3K27me3标记,在种子到幼苗的转化过程中,H3K27me3的表达在表观遗传水平上受到控制DAG1也直接抑制ABA分解代谢基因CYP707A2;总体上,ABA水平较低,GA水平较高dag1突变种子。此外,DAG1表达和蛋白质稳定性都由气体控制。
结论
我们的结果指向DAG1如种子休眠和萌发之间的发展的开关的控制的关键角色。
背景
从生长捕获的种子到发芽种子的转变代表了植物生命周期中的至关重要的发育开关[1].一些一年生植物,包括拟南芥种子在其发展的后期发展休眠:虽然成熟,这些种子不能够即使在有利的环境条件发芽的。事实上,种子休眠一直是种子植物的适应和进化至关重要。
拟南芥胚胎的发展由两阶段组成:胚胎发生(从授粉后的0至6天,甲肾上腺培训)和胚胎生长相(从7至10个DAP)组成。随后,当种子完全发育时,将种子成熟直至21个系列。一旦胚胎开发完成,休眠是建立的[2],它是在几周内发布数月种子收获后,根据不同的生态型[3.那4.].
种子成熟过程中产生的脱落酸(ABA)是必要的,以诱导种子休眠;赤霉素(气)释放休眠和促进发芽,从而抵消ABA的影响,而气体的种子发育过程中的作用尚不清楚。已经显示,在ABA水平的增加是通过成熟适当进展是至关重要的,和ABA对气体的高比率是建立休眠的主要决定因素[3.那5.].
而ABA和气体之间的动态平衡的重要性是显而易见的,到目前为止种子休眠诱导,维持和释放的分子机制仍知之甚少[6.].
遗传分析允许许多种子休眠调控因子的鉴定。在这些之中,DOG1(萌发1 DELAY),由数量性状基因座(QTL)分析分离的,已被确定为一个“种子休眠特异性”因子7.-9.].虽然DOG1的遗传作用已经熟悉了,但其分子功能仍然是未知的。
种子休眠和萌发的表观遗传控制最近被提出[10].事实上,DOG1基因通过的H3K27me3,一个镇压后生性状标记,并且在多梳抑制复合2(PRC2),的损失负责此表观遗传标记被上调[11].PRC2需要从胚胎到营养生长的开关,和缺乏功能性PRC2种子表现出增强的休眠和萌发的缺陷[11].
我们之前已经证明了基因的失活DAG1(景深影响GERMINATION1)减少种子休眠[12].DAG1是拟南芥种子萌发过程的抑制因子:dag1零突变种子需要低于野生型种子的较低的气体和红色光线率发芽[12-14].
我们还证实了DAG1在植物种子萌发光致色素b (phyB)介导的光致色素相互作用因子3 LIKE5 (phytochromeB -mediated pathway, phyB)的下游作用,并负调控GA生物合成基因GA3ox1,直接与其启动子结合[15那16].此外,失活DAG1导致ABA分解基因的增加CYP707A2在发芽突变种子中,表明DAG1可以调节该基因[15].
最近,我们发现DELLA蛋白GAI (GA不敏感)与DAG1相互作用,从而协同抑制GA3ox1[16].
在本研究中,我们指出DAG1在种子休眠和萌发之间的发展的开关中起关键作用,并且在种子到幼苗过渡过程。事实上,DAG1控制气体的种子成熟和休眠通过抑制在水平和ABAGA3ox1和CYP707A2通过直接与它们的启动子结合。一致地,dag1突变体种子ABA水平降低,GAs水平升高。此外,我们的数据表明,气体控制DAG1吸收过程中的表达和DAG1蛋白质稳定性。此外,我们表明表达概况DAG1通过H3K27ME3压制标记在表观遗传水平上控制,这已知是靶向种子育阶段的调节基因。
结果
DAG1在种子成熟和休眠过程中表达,并通过表观遗传调控
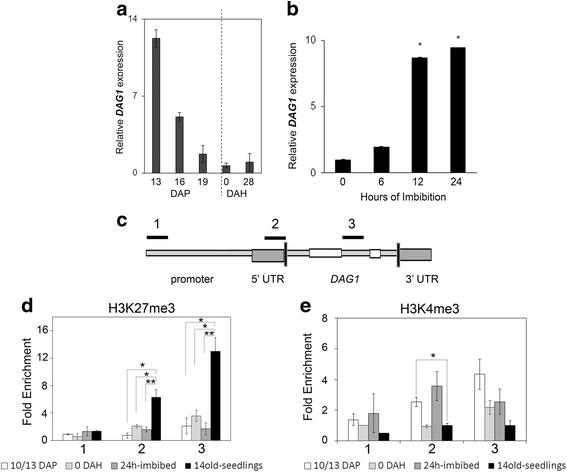
我们之前已经证明了失活DAG1减少种子休眠[12].为了评估是否以及何时DAG1参与建立休眠的,我们分析其表达来自后期熟化到非休眠野生型种子(展开授粉,DAP,并干燥后,在13从长角果解剖16种子,19天在种子收获后0和28天,DAH)通过RT-qPCR的装置。
这一分析表明DAG1高度表达于13个DAP,其表达随后降低(16dAP)以达到19个DAP,在干燥储存期间保留的稳定低水平(图。1).
DAG1表达谱在表观遗传水平下控制。一种相对表达水平DAG1在野生型(WT)在授粉(DAP)后13,16和19天的种子,在收获(DAH)后的0和28天成熟的干燥种子。B.相对表达水平DAG1在WT种子中,在0,6,12和24小时后吸收。相对表达量的值为三个生物重复的平均值,用SD值表示。显著差异用分析T.-测试 (*P. ≤ 0,05). Expression levels were normalized with that of theUBQ10(At4g05320)参考基因。C的图形表示DAG1轨迹。上述以数字标记粗线(1,2,3)被称为用于qPCR的不同的区域,对应于DAG1启动子(1)、5 '端(2)和编码序列(3)。D.和E.从10/13 DAP、0 DAH、24 h吸收的种子和14天龄幼苗中提取的染色质,用针对H3K27me3 (D.)或H3K4me3 (E.表观遗传标记。采用qPCR检测DNA含量。fold enrichment的值归一化到内部控制(相对于输入和PP2A),并且是三个生物重复的平均值,呈现出SD值。显著差异用分析T.-测试 (*P.≤0,05),对0 DAH进行计算
德诺维RNA合成迅速诱导在非休眠种子吸胀以下[17:因此我们进行了分析DAG1与干燥种子相比,在种子中吸收6,12和24小时的种子中的表达。如图所示。1 b, 这DAG1自吸后转录量显著增加,24h后几乎达到干种子的10倍。
全基因组研究表明,主要在种子中表达的基因在幼苗中通过H3K27me3抑制标记在表观遗传水平上受到控制[11].这促使我们分析H3K27me3剖面DAG1在不同的种子发育阶段——成熟(10/13 DAP)、休眠(0 DAH)和萌发(24 h浸种)——以及14天的幼苗,类似于Bouyer等[11].我们用染色质免疫沉淀法(ChIP)检测了H3K27me3的富集,该富集有针对H3K27me3的特异性抗体,或没有抗体作为阴性对照(附加文件)1:图S1),其次是定量PCR(QPCR)的三个区域DAG1基因座:启动子的一个区域(1),一个在5 '端(2),一个在转录区域(3)(图3)。1 c).有趣的是,的H3K27me3水平仅在相比于其他三个发育阶段苗,在区域2和3(图均显著高。1D),这与H3K27me3表观遗传标记通常局限于靶基因的转录区域的概念一致[18].
由于已知多个调控基因的染色质动力学利用两种拮抗标记,即抑制标记H3K27me3和激活标记H3K4me3,我们验证了是否DAG1还承受H3K4ME3,确认其表达可以通过H3甲基化的动态变化来调节。该分析与H3K4ME3特异性抗体进行,没有抗体作为阴性对照(附加文件1:图S1),清楚地揭示了在10/13 DAP的种子成熟期间在种子成熟期间对H3K4ME3活化标记的显着富集,与幼苗相比,在转录区域中DAG1基因(区域2)(图1E),符合高水平DAG1在此阶段表达(图。1和B.).
DAG1作用于ABA和GA的代谢,建立和维持种子休眠
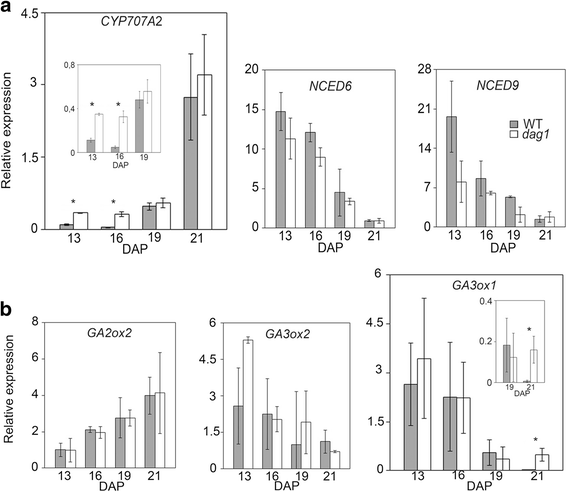
遗传研究表明,控制种子休眠和萌发是ABA和GA水平平衡的结果[19].由于我们之前已经表明灭活了DAG1影响ABA分解代谢基因的表达CYP707A2和GA生物合成基因的GA3ox1在发芽的种子[15[我们通过RT-QPCR测量来延长分析,主要ABA和GA代谢基因的表达 - 分解代谢基因CYP707A2编码ABA 8 ' -羟化酶那生物合成的基因NCED6和NCED9编码9-独联体-epoxycarotenoid dioxygenase用于ABA,分解代谢基因GA2ox1编码GA2氧化酶,所述生物合成基因GA3ox2和GA3ox1编码GA3-氧化酶的GA - INdag1和野生型在13,16,19日和21 DAP发育的种子涵盖月中下旬胚成熟阶段。
如图所示。2A, aba相关基因的表达只有CYP707A2增加了dag1与野生型在13和16个DAP(分别为3.5-和8倍)的野生型相比,但不在较高的成熟阶段(19-21个DAP)相比。
对于遗传算法,表示为GA3ox1类似于dag1野生型在13和16个dap发育种子,并且在显影种子的两个阶段急剧下降时,也在19个dap,而在21 dap中,它在较高的26倍以上dag1比野生型发育中的种子(图2B.).
这些结果证实了的种子DAG1控制ABA和GA途径,并能促进作用于这两种激素的成熟干种子种子休眠的概念提供支持。
为了验证是否DAG1对休眠的收获后控制通过相同的激素和基因作用,我们比较了ABA的和在表达赤霉素代谢基因dag10、14和28 DAH的突变体和野生型干种子。有趣的是,只有ABA分解基因CYP707A2和GA生物合成基因GA3ox1被管制DAG1失活:表达CYP707A2在28dah时增加了4倍,而GA3ox1在0,14和DAH(图28显著上调。3A和B.).
这些结果表明,确实DAG1通过调节GA3ox1和CYP707A2种子成熟和收获后的代谢基因也在种子成熟和收获之后,在种子休眠和发芽之间的发育开关所需的ABA / GA平衡中发挥着关键作用。
缺乏DAG1变造都ABA和GA水平
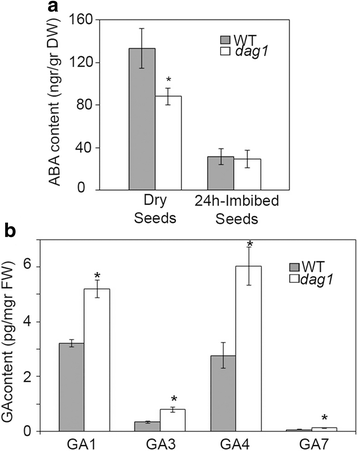
为了证实DAG1实际上控制着ABA和GAs的水平,我们测量了这些激素的含量dag1和野生型种子。成熟期干燥时ABA的含量dag1种子显着降低(图。4A)与在野生型种子中,同意过表达CYP707A2ABA分解代谢基因。正如预期的那样,24小时后,吸收在野生型种子中强烈降低ABA含量[20.];有趣的是,dag1突变体种子表明ABA水平与野生型,这表明DAG1在ABA的积累的作用仅限于成熟干种子(图4A).
接下来,我们测量的气体24小时后吸涨,如在干种子气体不可检测的。与GA生物合成基因的增加的表达水平相一致GA3ox1所有的生物活性气体量是显著较高dag1比野生型种子(图4B).
这些结果对DAG1控制ABA和天然水平的概念提供了进一步的支持,以及休眠表型dag1突变体种子依赖于ABA和GA水平的变化。
DAG1直接调控ABA分解代谢基因CYP707A2
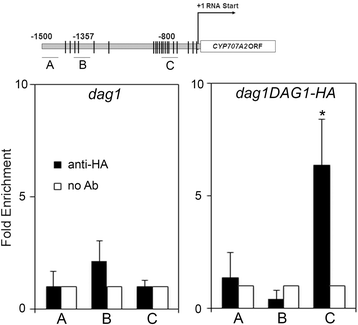
我们表明DAG1负面调节GA Biosynthetic基因GA3ox1通过与它的启动子结合[15那16].
以评估DAG1是否也调节CYP707A2通过直接结合ABA的启动子,我们在体内进行了ChIP检测,使用DAG1DAG1-HA.过表达DAG1-HA嵌合蛋白dag1突变背景(15那16那21].交联和超声蛋白- dna复合物与抗ha抗体沉淀,或无抗体作为阴性对照。作为额外的阴性对照,我们对dag1突变种子(图。5., 左下方)。三个地区CYP707A2分别用qPCR扩增了一个无DOF结合位点(片段A)、一个有两个位点(片段B)和一个有十个位点(片段C)的启动子(图3)。5., 顶部)。
启动子片段C的由DAG1-HA沉淀的相对量高于阴性对照显著高,而沉淀的启动子片段的富集A和B DAG1-HA和在阴性对照(图非常低。5.,右下),因此证实了DAG1直接结合到CYP707A2启动子的种子。
气体控制DAG1表达和DAG1蛋白质稳定性
由于种子吸收过程中生物活性气体的水平随着表达水平的含量增加DAG1而DAG1控制GA和ABA水平,我们想知道是否DAG1种子中的表达可能受这些激素调节。在GA存在下,在种子上进行24小时进行RT-QPCR分析4 + 7.,或ABA,表明DAG1转录物水平被气体(高达4倍)诱导,但不是由ABA诱导。因此,在乌斯巴替尔(PAC)存在下,GA生物合成的抑制剂,DAG1表达量与对照种子水浸后的表达量相当(图。6A).
Ga诱导DAG1表达。一种相对表达水平DAG1在24小时,吸入的野生型(WT)的种子,在水的存在下(H2o),ga4 + 7.(100 μM)、PAC (100 μM)或ABA (3 μM)。相对表达量的值为三个生物重复的平均值,用SD值表示。表达水平与UBQ10(At4g05320)基因。B.和C来自种子的染色质与h一起吸收24小时2O(白条)或GA4 + 7.(100μm)(黑条),用针对H3K27ME3的特异性抗体免疫沉淀(B.)或H3K4me3 (C表观遗传标记。采用qPCR检测DNA含量。这些地区DAG1用于qPCR的位点如图。1.fold enrichment值归一化到内部对照(相对于输入和PP2A),是两个具有SD值的生物重复的平均值。显著差异用分析T.-测试 (*P. ≤ 0,05)
因为我们已经如上所示DAG1在表述中,我们验证了其气体诱导是否通过H3K27ME3和/或HEK4ME3表观遗传标记的变化来介导。这种分析,在GA存在下,用野生型种子进行24小时进行4 + 7.或与水,揭示了GA-吸胀的种子的H3K4me3的激活标记的富集,这表明DAG1表达是由气体通过染色质重塑(图诱导。图6b和c).
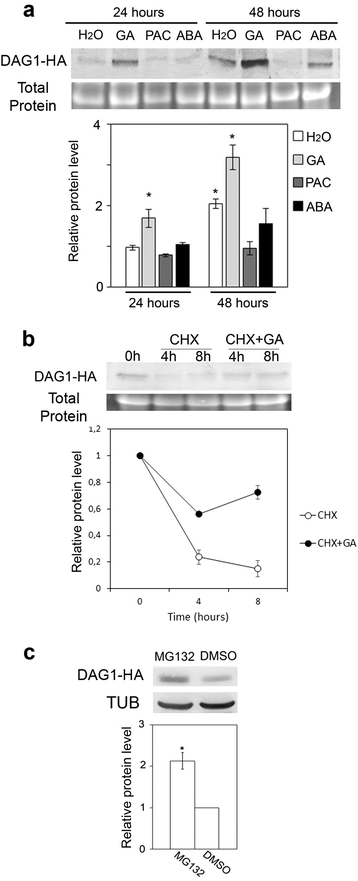
为了研究DAG1蛋白的稳定性是否会受到ABA或GAs的影响,我们利用了dag1过表达35s的突变线:DAG1-HA.翻译融合[15],ABA或天然气不引起谁的转录(附加文件2:图S2)。我们在存在ABA的,GA进行吸胀24和48小时对DAG1-HA种子的免疫印迹分析4 + 7.或与水吸收的对照相比。添加外源气体增加了DAG1-HA的水平,在24和48小时(分别为1.7和1.6倍);始终如一地,PAC的存在将嵌合蛋白的量降低到相应对照的水平(图。7A).有趣的是,由于内源GA水平的增加,在吸收到48小时的吸收期间,DAG1-HA的量增加。相比之下,DAG1-HA的水平不受ABA的影响(图。7A).为了进入潜在的DAG1蛋白的遗传术控制的分子机制,我们对吸收48小时的DAG1-HA种子进行了免疫斑分析,然后用环己酰亚胺(CHX)处理4/8小时,以抑制蛋白质合成,或用chx和天然气。如图所示。7B,DAG1-HA的吸液时的增加主要是由于该蛋白质的新的合成,因为在CHX DAG1-HA的量的存在下显着降低。有趣的是,外源性气体导致增加蛋白质水平,提示使气体通过增加其半衰期(图稳定DAG1-HA。7B).
DAG1蛋白由GA稳定。一种DAG1-HA蛋白水平dag1DAG1:哈种子在水(h2o),ga4 + 7.、多效唑(PAC)或ABA。B.用环己亚胺(CHX)或CHX和GA处理种子4或8 h后,测定种子中DAG1-HA蛋白水平(0)。免疫印迹(前)和密度计量分析(底部).C5日龄的DAG1-HA蛋白质水平dag1DAG1:哈以MG132或DMSO作为对照处理的幼苗。以TUB或总蛋白含量作为加载对照。免疫印迹(前)和密度计量分析(底部).遗传算法4 + 7.(100μM),PAC(100μM),ABA(3μM),CHX(50μM),MG132(50μM)。蛋白质水平是三次生物学重复的平均值,带有SD值。显著差异用分析T.-测试 (*P. ≤ 0,05)
我们还调查是否气DAG1的翻译后控制是通过26S蛋白酶体介导的。我们进行上生长五天幼苗分析,然后用MG132,蛋白酶体特异性抑制剂,或DMSO处理作为对照[22].如图所示。7C., MG132的加入促进了DAG1- ha嵌合蛋白的过度积累,提示DAG1可能是通过26S蛋白酶体负调控的(图)。7C.).
讨论
我们之前已经证明了DAG1转录因子是种子萌发的抑制因子[12那14]作用于PIL5下游,负调控GA生物合成[15那16].我们之前也说过DAG1减少种子休眠[12],我们研究了DAG1在种子发育到幼苗萌发过程中的作用。
DAG1控制ABA和GA之间的动态平衡
本研究结果表明,DAG1通过控制激素GAs和ABA水平的动态平衡,在植物休眠的建立和维持中发挥关键作用。
事实上,种子成熟期间积极DAG1通过直接抑制分解代谢基因调节ABA水平CYP707A2.研究表明,CYP707A2是调控种子休眠过程中ABA水平的关键酶;特别是,表达CYP707A2从后期熟化阶段(16 DAP)增大到休眠种子[20.],始终如一,cyp707a2无效突变体的种子积累更多的ABA比在这些阶段野生型种子,示出了表型hyperdormant [23].这些结果与DAG1通过负调控促进种子成熟过程中休眠的建立相一致CYP707A2,因此允许种子干燥之前增加ABA水平的。事实上,我们之前已经报道,在发芽的种子CYP707A2在功能丧失中上调吗dag1突变体[15];一致地,DAG1和CYP707A2两者都表达在胚胎的普罗生组织中[20.那21].
结果表明,在干燥的种子储存期间,必须保持低水平,以确保种子休眠[19那24];我们的数据点DAG1通过抑制的表达在维持GA生物合成低了至关重要的作用GA3ox1[15(这项工作)。反过来,DAG1的表达和蛋白的稳定性都受GA的控制DAG1转录水平增加,蛋白质通过生物活性气体稳定。这表明DAG1可能在种子萌发中的微调GA水平中发挥枢轴作用。已经表明,GA生物合成基因的转录水平GA3ox1由GAs反馈控制[25-27]:可能,这通过增加DAG1水平,这直接压制发生GA3ox1.
此外,天然气促进Della蛋白质的降解,然后促进转录德拉基因[28].有趣的是,DELLA蛋白GAI与DAG1协同负调控GA3ox1,它直接与DAG1交互[16].事实上,GAI降解气体的存在,但它反过来积极德诺维为了确保GA3ox1通过与DAG1的相互作用抑制。此外,DAG1和GAI相互影响它们的表达[16].在这个调控回路中,GAs促进GA生物合成抑制因子(DAG1)的转录诱导和稳定,以及GA信号抑制因子(GAI)的诱导,有助于防止早期萌发和/或胎生,以及在不利条件下的萌发。
类似的结果在转录因子ABI4,其中通过调节ABA和赤霉素生物合成控制种子休眠的情况进行了最近描述29].ABI4钝化对不同的ABA和GA代谢基因有显著影响NCED2和NCED3和GA3ox1和GA2ox8分别 - 它已被证明直接调节ABA分解代谢的基因CYP707A1和CYP707A2[29].然而,ABI4对这些基因表达的影响似乎仅限于种子吸胀的前6小时,而失活的种子DAG1导致上调CYP707A2和GA3ox1在种子成熟,贮藏和种子吸收12和24小时[15这表明这两种转录因子并没有共同起作用。此外,abi4由于野生型和突变型种子的发芽率相似,种子的休眠没有减少abi4种子比野生类型更快地发芽,不同地萌发dag1种子,他们没有表现出增加sensivity冷处理[29],提示DAG1和ABI4在同一信号通路中不起作用。
我们的研究结果表明,DAG1是控制种子休眠和萌发之间发育转换的关键调节剂,其作用于ABA和GAs之间的平衡。
DAG1在种子发育和幼苗早期生长过程中是否受表观遗传水平的控制
我们的研究结果表明,组蛋白H3赖氨酸27 (H3K27me3)的三甲基化是一种重要的表观遗传标记DAG1轨迹。这种染色质抑制状态是由Polycomb压抑复合物2 (PRC2)催化的,该复合物已被证明控制拟南芥从种子到幼苗的转变[11].
事实上,一些种子发育调控基因喜欢DOG1,脱钙酸不敏感3(ABI3) 和索莫纳斯(耶鲁大学管理学院)已经被证明是PRC2的靶标,并由H3K27me3标记。此外,Bouyer等人[11]进行的染色质状态的全基因组分析外商投资企业(受精独立胚乳缺乏PRC2)突变株,发现DAG1表达上调,表明也DAG1可能是PRC2的靶标。
一致的是,我们的芯片实验表明,转录区DAG1在幼苗的H3K27me3压制性标记显著富集,指向DAG1作为种子发育基因。
类似于DAG1,表达耶鲁大学管理学院在,编码CCCH型锌指蛋白,上调外商投资企业突变体[11].有趣的是,SOM下调GA和ABA上调水平[30.]以抑制种子在高温下萌发[30.那31.].我们的研究结果,DAG1,进一步证实了之前Bouyer等人提出的观点,即PRC2在种子发育过程中发挥作用,维持ABA和GA的相反作用[11].
通过…Pdag1 :: GUS.直线,我们之前已经证明了DAG1启动子在胚胎发生(从球形阶段到成熟胚)中是活跃的[21].我们在本文中呈现的表达分析,由RT-QPCR进行,清楚地透露了这一点DAG1在种子成熟和休眠过程中被精细地调节。的DAG1转录水平在13dap时较高,在成熟和休眠过程中逐渐降低,在非休眠种子吸胀后再次升高。此外,DAG1表达是在吸收的种子中的外源气体引起的,因为PAC的治疗导致DAG1表达水平与水浸对照相当。始终如一,DAG1在H3K4ME3激活标记中富集的基因座,如用H3K4ME3抗体进行的芯片测定透露,表明这种表观遗传标记是确保活跃的转录状态所必需的DAG1轨迹。
最近显示出其他种子发育调控基因,如ABI3和DOG1显示类似的表达谱作为DAG1在从种子转变为幼苗期间,它们从活性到抑制染色质状态从活性转换为抑制染色质状态[32.].这将是有趣的,以评估这些调控基因是否在同一或在控制种子到幼苗过渡不同,但有可能的串扰调控网络的工作。
结论
而在种子萌发中ABA和气体之间的平衡的重要性已经确立,从种子发芽到幼苗的过渡的分子机制的证据是稀少。这项工作识别分子网络控制种子到幼苗过渡的一个关键组成部分。事实上,我们的工作提供了令人信服的证据表明,DAG1起通过分别控制激素GA和ABA水平的平衡,作用于他们的生物合成和分解代谢,建立和休眠的维护至关重要的作用。
方法
植物材料和生长条件
dag1是在帕皮等人描述的等位基因。[12]在WS-4生态型,DAG1DAG1-HA.是Gabriele等人所描述的转基因系[15].所有拟南芥在这项工作中使用的行中的生长室中21分之24℃下具有16/8小时白天/黑夜周期和300微摩尔/米光强度中生长-2S.-1如前所述[12].
种子萌发试验
所有用于发芽试验的种子均采自同一时间、相同条件下生长的成熟植株,并在室温、干燥、黑暗条件下保存4-5周。种子萌发检测:将每个基因型的60-100个未灭菌种子各3套,播种于595滤纸(Schleicher & Schüll, Dassel, Germany) 5层,用5 ml水浸泡,在昏暗的绿色安全灯光下。对不同批次的种子进行了发芽试验。
表达分析
RNA从收获物(DAH)干种子吸胀或种子后显影授粉后(DAP)从长角果在13,16,19和21天解剖种子,干种子在0,14和28天进行萃取。将种子吸胀6,12或24小时的滤纸上,用5ml水浸泡的五层并暴露于光。For hormone treatments, seeds were imbibed for 24 h in the presence of 100 μm GA 4 + 7 (Duchefa) or 100 μm PAC (Duchefa) or 3 μm ABA (Duchefa) and exposed to light. RNA extraction and RT-qPCR were performed according to Gabriele et al. [15].相对表达水平与适当的内参基因标准化。所使用的引物列在(附加文件3.:表S1)。相对表达水平的值是具有SD值的三种生物复制的平均值。分析了意义差异T.-测试 (*P. ≤ 0,05; **P. ≤ 0,01).
染色质免疫沉淀(ChIP)分析
根据Gabriele等人进行芯片测定。[15].研究DAG1与CYP707A2,用过表达DAG1-HA嵌合蛋白的转基因线进行芯片测定dag1突变体背景和与dag1突变体作为阴性对照。使用HA-探针抗体(Y-11,SC-805 Santa Cruz公司)进行免疫沉淀。为了分析的表观遗传概况DAG1基因座,染色质使用针对H3K27ME3(Millipore#07-449),H3K4ME3(ABCAM AB8580),或不作为阴性对照的抗体的抗体免疫沉淀过夜。反向交联后,通过使用特定底漆集(附加文件)通过QPCR量化富集的DNA水平(附加文件3.:表S1)。对内部控制的富集富集特定区域(pp2a.基因)和归一化的输入部分,以减少样品中的背景的差异。的值是2的平均(用于CYP707A2推动者)或三个(对于DAG1轨迹)生物学重复带有SD值。显著倍富集,通过分析T.-测试 (*P. ≤ 0,05).
ABA和GA剂量
根据[33.]有一些修改。将种子样品(20-30mg干重)在2ml聚丙烯管中均化,其中1ml 80%(v / v)乙腈含有5%(v / v)甲酸和19个内部GA标准([2H2] Ga1,[2H2)遗传算法3.,(2H2)遗传算法4.,(2H2)遗传算法5.,(2H2)遗传算法6.,(2H2)遗传算法7.,(2H2)遗传算法8.,(2H2)遗传算法9.,(2H2)遗传算法12,(2H2)遗传算法12ALD,[2H2)遗传算法15,(2H2)遗传算法19,(2H2)遗传算法20.,(2H2)遗传算法24,(2H2)遗传算法29,(2H2)遗传算法34.,(2H2)遗传算法44.,(2H2)遗传算法51.和[2H2)遗传算法53.)(Olchemim,Olchemim,捷克共和国)在向每个管中加入2.8和1.4mm氧化锆珠后,使用组织均化器精纤维24(Bertin Technologies)以2x6500rpm Hz的频率为2x20s,以提高提取效率。然后将管置于4℃的冰箱中,并在恒定的搅拌下以15rpm的频率施加过夜。将匀浆在4℃下离心10分钟。使用混合模式阴离子交换墨盒进一步纯化上清液(水,http://www.waters.com)和超高性能色谱(ACQUITY UPLC™系统进行分析;装备有电喷雾电离(ESI)的Waters接口); Waters)上耦合到三重级四极质谱仪(Xevo®TQ MS。使用多反应监测模式基于所述前体离子的过渡进行检测的气体[M-H]-生成相应的产物离子。数据采用Masslynx 4.1软件(Waters)进行数据采集和处理,GA水平采用标准同位素稀释法计算[34.].对于ABA剂量,将种子冷冻在液氮中并冷冻干燥。将干燥的种子(10mg)研磨在1.6ml萃取溶剂(丙酮/水/醋酸,80 / 19/1,v / v)中,其中2ng [2H4.ABA(( - ) - 5,8',8',8'-D4 aba从Irina Zaharia购买,植物生物技术研究所,加拿大国家研究委员会,http://www.nrc-cnrc.gc.ca.)作为内部标准添加。将样品离心回收上清液,再用超声将颗粒重新悬浮在0.1 ml色谱流动相中,再离心与上清液结合。提取溶剂蒸发,残渣在0.5 ml色谱流动相(乙腈/水/乙酸,50/50/0.05,v/v/v)中超声悬浮,通过1.6 μm GFA过滤器(Whatman,http://www.whatman.com/).ABA的定量采用LC- esi - ms - ms (Quattro LC, Waters,http://www.waters.com,通过多反应监测(MRM)在正离子模式。结果是两个(ABA剂量)或三个(GA剂量)生物重复的平均值,并以SD值表示。显著差异用分析T.-测试 (*P. ≤ 0,05).
免疫印迹分析
根据Oh等提取的蛋白共25 μg [35.], 12% sds -聚丙烯酰胺凝胶(Bio-Rad)分离,PVDF固定化p转移膜(Millipore)印迹。以抗ha抗体(Santa Cruz, Santa Cruz, CA, USA)为一抗,结合ap的抗小鼠抗体(Sigma, St. Louis, USA)为二抗进行嵌合蛋白检测。采用无染色技术(Bio-Rad)检测的总蛋白或使用抗微管蛋白抗体(Sigma, St. Louis, U.S.A.)检测的微管蛋白水平作为负载对照。对MG132处理,分别用MG132 (50 μm)或DMSO在黑暗或R光下处理5日龄暗生幼苗4 h。对于赤霉素、多效唑(PAC)和ABA处理,在赤霉素100 μm的存在下,分别在24和48 h内吸收50 μl种子4 + 7.(DUCHEFA)或100微米PAC(DUCHEFA)或3微米ABA(DUCHEFA)。对于治疗CHX,50μl的种子吸胀中GA的存在下24小时,或与水48小时,然后进行4或8小时上CHX(50微米)传送。蛋白质水平是三次生物学重复的平均值,带有SD值。显著差异用分析T.-测试 (*P. ≤ 0,05).
缩写
- ABA:
-
脱盐酸
- GA:
-
赤霉素
- H3K27ME3:
-
组蛋白H3在赖氨酸27三甲基化
- H3K4ME3:
-
组蛋白H3赖氨酸4的三甲基
- DAG1:
-
景深影响GERMINATION1
- GA3ox1:
-
赤霉素3 -β加双氧酶1
- 狗:
-
DELAY GERMINATION1的
- QTL:
-
数量性状位点
- PRC2:
-
Polycomb压抑情结2
- PHYB:
-
光敏色素B
- PIL5:
-
光敏色素相互作用因子3
- 盖:
-
GA不敏感
- DAP:
-
授粉后的几天
- 长音:
-
天收获后
- 芯片:
-
染色质免疫沉淀
- RT-qPCR:
-
定量逆转录酶-聚合酶链反应
- qPCR:
-
定量PCR
- PAC:
-
多效唑
- CHX:
-
环己酰亚胺
- DMSO:
-
二甲基亚砜
- 外商投资企业:
-
施肥独立胚乳
- ABI3:
-
脱落酸INSENSITIVE 3
- 耶鲁大学管理学院:
-
索莫纳斯
参考
- 1.
《针叶树种子休眠终止的改良处理》。方法Mol Biol (Clifton, NJ)。2011; 773:53 - 64。
- 2.
Raz V,Bergervoet JH,Koornneef M.拟南芥种子发育逮捕的顺序步骤。发展。2001; 128(2):243-52。
- 3.
Karssen Cm,Brinkhorst-Van der Swan DL,Breekland AE,Koornneef M.通过内源性脱落酸种子发育期间休眠期间的诱导:拟南芥脱落酸缺乏基因型的研究拟南芥(L.)Heynh。Planta。1983; 157(2):158-65。
- 4。
布雷JD。种子萌发与休眠。植物细胞。1997;9(7):1055 - 66。
- 5。
Debeaujon I,Koornneef M.拟南芥种子萌发的胃肠杆菌蛋白要求由Testa特征和胚胎脱落酸确定。植物理性。2000; 122(2):415-24。
- 6。
Dekkers的BJ,他H,汉森Ĵ,威廉姆斯LA,贾马DC,Cueff G,Rajjou L,Hilhorst HW,发芽1基因Bentsink L.拟南芥DELAY影响脱落酸INSENSITIVE 5(ABI5)的表达和基因拟南芥期间与ABI3相互作用种子发育。植物杂志2016; 85(4):451-65。
- 7。
Bentsink L,乔伊特Ĵ,HANHART CJ,DOG1的Koornneef M.克隆,数量性状基因座控制种子在拟南芥中休眠。国家科学院院刊美A. 2006; 103(45):17042-7。
- 8。
Bentsink L, Hanson J, Hanhart CJ, Blankestijn-de Vries H, Coltrane C, Keizer P, El-Lithy M, Alonso-Blanco C, de Andres MT, remond M, et al.;拟南芥种子休眠的自然变异是通过加性遗传和分子途径调控的。中国科学院院刊2010;107(9):4264-9。
- 9。
Alonso-Blanco C,Bentsink L,Hanhart CJ,BableStijn-de Vries H,Koornneef M.拟南芥种子休眠地点的自然等位基因变异分析。遗传学。2003; 164(2):711-29。
- 10.
穆勒K,BOUYER d,Schnittger A,克默德AR。在种子生命周期的过渡进化上保守的组蛋白甲基化动力学。Plos一个。2012; 7(12):e51532。
- 11.
BOUYER d,Roudier楼Heese男,安德森ED,Gey中d,Nowack MK,古德里奇Ĵ,Renou JP,Grini PE,Colot V,等人。梳压制性复杂2个控制胚胎到幼苗相变。公共科学图书馆·遗传学。2011; 7(3):e1002014。
- 12.
PAPI男,萨巴蒂尼S,Bouchez d,金瑞利C,科斯坦蒂诺P,Vittorioso P.鉴定和拟南芥锌指基因控制种子发芽的破坏。基因发展。2000; 14(1):28-33。
- 13.
Papi M,Sabatini S,Altamura MM,Hennig L,Schafer E,Costantino P,Vittorioso P.灭活的韧皮肽特异性DOF锌指基因DAG1影响拟南芥TESTA的光和完整性的反应。植物理性。2002; 128(2):411-7。
- 14。
Gualberti G, Papi M, Bellucci L, Ricci I, Bouchez D, Camilleri C, Costantino P, Vittorioso P. Dof锌指基因DAG2和DAG1的突变对拟南芥种子萌发有相反的影响。植物细胞。2002;14(6):1253 - 63。
- 15。
加布里埃莱S,Rizza A,MartoneĴ,Circelli P,科斯坦蒂诺P,通过GA生物合成基因AtGA3ox1负调节对种子发芽Vittorioso P上的Dof蛋白介导DAG1 PIL5活性。植物杂志2010; 61(2):312-23。
- 16。
Boccaccini A, Santopolo S, Capauto D, Lorrai R, Minutello E, Serino G, Costantino P, Vittorioso P. DOF蛋白DAG1和DELLA蛋白GAI协同负调控AtGA3ox1基因。摩尔。2014;7(9):1486 - 9。
- 17。
韩琛,杨平。种子萌发的分子机制研究。蛋白质组学,2015;15(10):1671 - 9。
- 18。
张X,Clarenz O,Cokus S,Bernatavichute YV,Pellegrini M,Goodrich J,Jacobsen SE。组蛋白H3赖氨酸的全基因组分析27拟南芥中三甲基化。Plos Biol。2007; 5(5):E129。
- 19。
王志强,王志强,王志强,等。水稻种子休眠的分子机制研究。植物生物学学报2008;59:387-415。
- 20.
CYP707A1和CYP707A2编码脱落酸8 ' -羟化酶,是控制拟南芥种子休眠和萌发所必需的基因。植物杂志。2006;141(1):97 - 107。
- 21.
Boccaccini A,Santopolo S,Capauto d,Lorrai R,Minutello E,Belcram K,Palauqui JC,科斯坦蒂诺P,Vittorioso P.独立和DOF影响发芽1(DAG1)的互动效果和DELLA蛋白的GA不敏感(GAI)和阻遏在胚胎发育和种子萌发ga1-3(RGA)。BMC植物生物学。2014; 14:200。
- 22.
哦,yamaguchi s,hu j,yusuke j,jung b,paik i,李hs,sun tp,kamiya y,choi g. pil5,一种植物色素相互作用的bhlh蛋白,通过直接与盖和rga结合来调节吉布林素反应性拟南芥种子的启动子。植物细胞。2007; 19(4):1192-208。
- 23.
Kushiro T,Okamoto M,Nakabayashi K,Yamagishi K,Kitamura S,Asami T,Hirai N,Koshiba T,Kamiya Y,Nambara E.拟南芥细胞色素P450 CYP707A编码ABA 8'-羟基酶:ABA分解代谢的关键酶。禁止J. 2004; 23(7):1647-56。
- 24.
芬奇 - 萨维奇WE,卡德曼CS,Toorop PE,林恩JR,Hilhorst HW。在拟南芥CVI种子休眠释放通过干后熟,基因表达的低温,硝酸盐和光显示常见定量图案定向由环境特定感测。植物杂志2007; 51(1):60-78。
- 25.
Zentella R, Zhang ZL, Park M, Thomas SG, Endo A, Murase K, Fleet CM, Jikumaru Y, Nambara E, Kamiya Y,等。拟南芥早期赤霉素信号转导直接靶标的全局分析。植物细胞。2007;19(10):3037 - 57。
- 26。
孙TP,在植物中赤霉素信号转居布莱F.分子机制。Annu启植物生物学。2004; 55:197-223。
- 27。
赤霉素代谢:基因揭示的新见解。植物科学进展,2000;5(12):523-30。
- 28。
Schwechheimer C.了解甘草酸信号 - 我们还在吗?CurrOp植物BIOL。2008; 11(1):9-15。
- 29。
舒锴,张华,王胜,陈明,吴勇,唐胜,刘超,冯勇,曹鑫,谢秋芹。ABI4通过调节脱落酸和赤霉素的生物发生调控拟南芥初级种子休眠。公共科学图书馆麝猫。2013;9 (6):e1003577。
- 30.
金DH,山口S,林S,噢E,公园Ĵ,花田A,神谷Y,彩G.就寝,在拟南芥一个CCCH型锌指蛋白,负调节PIL5的下游光依赖性种子萌发。植物细胞。2008; 20(5):1260年至1277年。
- 31.
Park J,Lee N,Kim W,LiM S,Choi G. Abi3和Pil5通过直接与吸收的拟南芥种子直接结合其启动子来协作激活Somnus的表达。植物细胞。2011; 23(4):1404-15。
- 32.
Molitor AM, Bu Z, Yu Y, Shen WH。拟南芥AL PHD-PRC1复合物通过抑制种子发育基因中的H3K4me3-to-H3K27me3染色质状态开关促进种子萌发。公共科学图书馆麝猫。2014;10 (1):e1004091。
- 33.
陈志强,陈志强,陈志强,等。超高效液相色谱-串联质谱法测定赤霉素中游离酸的含量。Talanta。2013;112:85 - 94。
- 34.
Rittenberg D,Foster GL。通过同位素稀释的定量分析的新方法,用于测定氨基酸和脂肪酸的测定。J Biol Chem。1940; 133(3):737-44。
- 35.
哦,yamaguchi s,kamiya y,bae g,chung wi,choi g.光激活了Pil5蛋白的降解,促进通过拟南芥中胃蛋白酶的种子萌发。工厂J. 2006; 47(1):124-39。
致谢
不适用
资金
该研究得到了Ministero Dell'istruzione,UniversitàeRicerca,Progetti di Ricerca di Intersess Nazionale的支持,以及从SapienzaUniversitàdi Roma到P.C.,以及来自Istituto Pasteur-Fondazione Cenci Bolognetti的P.V。
D.T.和M.S.感谢捷克共和国教育、青年和体育部的财政支持。LK21306,批准号LO 1204)、Palacký大学内部资助机构(IGA_PrF_2016_018)和捷克共和国资助机构(14-34792S)。A.B.获得了EMBO短期奖学金,在IJPB, INRA-Versailles进行研究。
数据和材料的可用性
支持本文结果的数据集包含在文章及其附加文件中。
作者的贡献
PV AB构思了这个策略。实验由PV, AB, AMP, MS设计。AB、RL、VR、AF、SMB、DT进行实验。AB、AMP、PC、PV为数据分析和解释做出了贡献。PV和PC写了手稿。AB, AMP, MS, DT对原稿进行了修改。所有作者阅读并批准了最终手稿。
利益争夺
提交人声明他们没有竞争利益。
同意出版物
不适用
伦理批准和同意参与
不适用
作者信息
从属关系
相应的作者
附加文件
附加文件1:图S1。
ChIP测定的阴性对照。以10/13 DAP、0 DAH、24 h吸收种子和14天龄幼苗的WT胚的染色质进行免疫沉淀,不含抗体作为阴性对照。采用qPCR检测DNA含量。fold enrichment的值被归一化到内部控制(相对于输入和pp2a.),为以SD值表示的三个独立实验的平均值。(PDF 265 kb)
附加文件2:图S2。
相对表达水平35S :: DAG1-HA,在吸收的种子。在35S CaMV启动子控制下,DAG1-HA的相对表达量在DAG1DAG1-HA.相对表达量为3个生物重复的平均值,以SD值表示。表达水平与UBQ10(AT4G05320)基因。(PDF 275 KB)
附加文件3:表S1。
本研究使用的引物。(PDF 554 kb)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Boccaccini,A.,Lorrai,R.,鲁塔,V.et al。在拟南芥中,DAG1转录因子负调控ABA和GA水平的种子到幼苗的转化。BMC植物BIOL.16,198(2016)。https://doi.org/10.1186/s12870-016-0890-5.
收到了:
公认:
发表:
关键字
- DAG1
- 种子发展
- 染色质重塑
- 遗传算法
- 阿巴
- 拟南芥
- 景深的蛋白质