摘要
背景
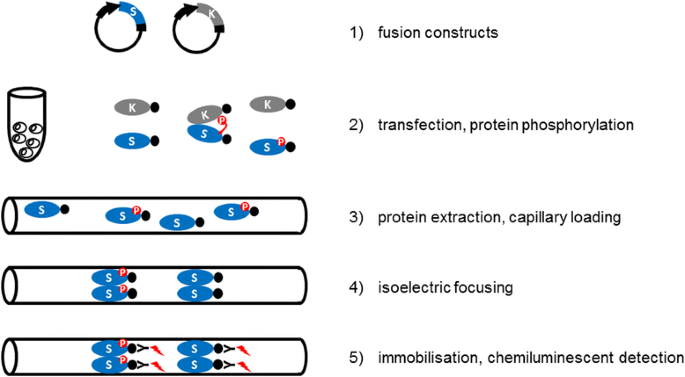
蛋白激酶是信号通路的重要组成部分,在植物中激酶已显著扩增。然而,我们对植物中激酶底物的了解很少,部分原因是动态分析蛋白质磷酸化的工具有限。在这里,我们描述了激酶相关磷异构体测定,一个灵活的实验方法,用于定向实验,研究体内特定的激酶-底物相互作用。
这个概念是基于候选底物的不同磷异构体分布,这些底物有或没有激活激酶的共同表达。表位标记蛋白的磷酸化状态随后通过高分辨率毛细管等电聚焦结合纳米流体免疫分析法检测,它能够探测到异构体分布的细微变化。
结果
通过显示MPK6对已知的丝裂原活化蛋白激酶(MAPK)底物ACS6的磷酸化,验证了这一概念。接下来,我们证明了两个转录因子,WUS和AP2,这两个转录因子都被广泛的遗传学研究证明是植物发育的主要调控因子,在植物细胞中存在多种亚型,并被活化的MAPKs磷酸化。
结论
由于植物的发育对环境条件有灵活的反应,环境激活的激酶对发育调节因子的磷酸化可能参与了外部信号与发育调节的联系。作为鉴定潜在蛋白激酶底物的无偏筛选方法(如磷酸蛋白质组学和计算预测)的对应方法,我们的研究结果扩展了基于候选激酶研究的实验工具包,并为现有的体外方法提供了另一种体内方法。
背景
在进化过程中,磷酸化因其通用性和可逆性而成为翻译后修饰的重要类型[1]。由于无根的生活方式,在植物王国中,kinomes显著扩大拟南芥水稻中有4%的基因编码激酶2,3.],而在人类基因组中,这个数字是2% [4]。尽管激酶在植物中被广泛使用,并且在关键过程中具有明显的重要性,但对实际植物蛋白激酶底物的了解严重落后于对动物激酶的了解。丝裂原活化蛋白激酶(mapk)就是一个很好的例子:植物mapk与人类erk型mapk最相似,而已知的ERK1/2底物有150多种[5],模型植物中只描述了大约20种单独表征的基质拟南芥[6,7]。由于MAPK信号网络在不同领域的独立进化,基于同源性的底物搜索不是一个合适的选择,已知的植物MAPK底物已经使用特定的和有针对性的技术,如酵母双杂交筛选。因此,为了有效地解剖植物激酶网络,分析细胞蛋白磷酸化的新工具的产生至关重要[8]。
激酶研究的技术进步主要集中在磷酸化蛋白质组学相关技术上[9],因此产生了各种筛选方法。然而,在低水平或罕见细胞类型中表达的基因很容易被这种方法遗漏。生物信息学和系统生物学的进步可以通过有效预测代表性不足的底物来解决这个问题。因此,使用蛋白质微阵列报道了体外MAPK底物[10,11]和磷蛋白质组学[12],并通过筛选随机定位肽库确定了MPK3和MPK6的一致磷酸化序列,从而用于预测新的候选MAPK底物[13在拟南芥.
然而,无论是通过体内还是计算机筛选鉴定,至少有一部分底物蛋白必须通过靶向实验进行验证。然而,无偏发现工具的发展并没有伴随着基于候选的方法的相应改进。蛋白质磷酸化通常是通过体外激酶测定来证明的,这是一种几十年前发展起来的方法,自那以后没有实质性的改进。这是一种繁琐的方法,涉及蛋白质亲和纯化,并且需要使用有害的放射性同位素。此外,在体外使用高浓度纯化激酶和缺乏细胞调节机制往往会导致错误的结果[9,14]。因此,开发能够以有针对性的方式解决体内磷酸化相互作用的替代方法是及时的。
毛细管等电聚焦(cIEF)耦合纳米流体免疫分析法已被开发用于检测细胞蛋白质样品中差异存在的蛋白质同种异构体[15]。在该系统中,不同等电点的蛋白质同工型通过毛细管中的等电聚焦分离,用紫外光固定,并用抗体进行免疫探针。抗体偶联酶产生的化学发光信号被灵敏的CCD相机捕捉。然而,特异性抗体的缺乏意味着基于免疫检测的检测方法在植物中的应用面临严重瓶颈。
将cief免疫分析与原生质体中融合蛋白构建物的瞬时表达相结合提供了两个重要的优势:1)它避免了特异性抗体可用性有限的问题;2)转染使所研究的蛋白与活性或非活性蛋白激酶共同表达,以研究感兴趣的特定激酶-底物关系。原生质体通常用于证明蛋白质之间的相互作用,也被用于研究mapk -底物之间的相互作用,例如[16- - - - - -19]。在这里,我们通过显示已知和两个新的MAPK底物的磷酸化,证明通过cief免疫分析法检测转染融合蛋白的磷酸化异构体分布的变化是研究植物体内激酶-底物磷酸化相互作用的合适方法。
结果
已知MAPK底物ACS6的磷酸化是通过这种新方法检测的
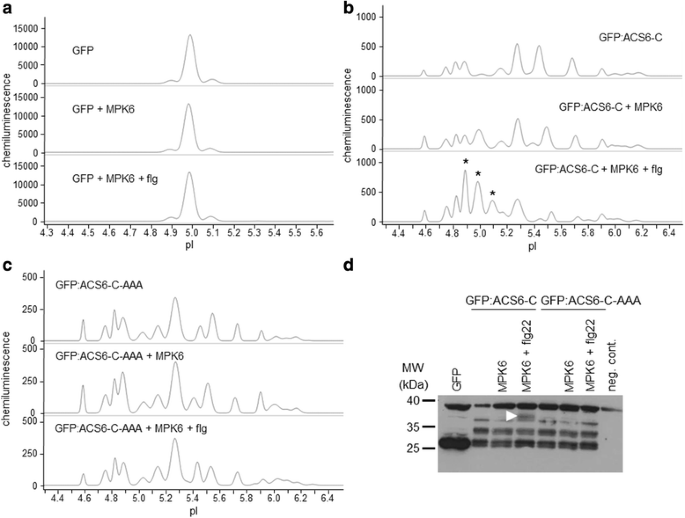
为了提供细胞替代通常不可靠的体外激酶测定来研究特定激酶-底物相互作用,我们优化了一种cief偶联的纳米流体免疫测定,以检测转染原生质体中活性蛋白激酶共表达或不共表达的差异存在的蛋白质异构体,并指定了激酶相关磷酸异构体测定的概念(图2)。1).为了对该概念进行初步测试,我们首先分析了1-氨基环丙烷-1-羧酸(ACC)合成酶6,ACS6 (ACS-C)的c端结构域的磷酸化,这是MAP激酶MPK6的已知底物[20.]。用绿色荧光蛋白(GFP)或与绿色荧光蛋白c端融合的ACS-C构建体(GFP:ACS-C)转化原生质体。绿色荧光蛋白主要以单一异构体存在(图2)。2),而GFP:ACS-C被检测为不同等电点(pI)值的几个峰,这意味着不同磷酸化亚型的平行存在(图2)。2 b、表1).虽然,硅分析预测磷酸化的可靠性有限,但真核线性基序(ELM)资源鉴定了ACS6 c端各种假定的磷酸化位点[21],(附加文件1(表S1),表明了强烈的和动态的磷酸化,与我们的观察结果很好地一致。通过对蛋白质提取物进行磷酸酶处理,可以减少复合物异构体的分布(附加文件)2:图S1)。细菌鞭毛蛋白衍生激发子肽flg22处理原生质体中MPK6的共表达[j]22], MPK6的激活剂,导致酸性异构体的显著积累,最显著的是pI 4.9, 5.0和5.1的异构体(图2)。2 b、表1),表明从头蛋白磷酸化。与非活化MPK6共表达也带来了较小程度的酸化,主要表现为pI 5.0亚型的积累。作为阴性对照,缺失MAPK磷酸化位点的GFP:ACS-C突变体(S46A, S49A, S54A)也与MPK6共表达,但其异构体分布不受MPK6的影响(图6)。2摄氏度、表1).同样,未融合的GFP也不会被MPK6磷酸化(图2)。2).相比之下,转染后的蛋白也通过常规的SDS-PAGE免疫印迹检测,在与活化的MPK6共转化的GFP:ACS-C样品中出现了较慢的迁移带(图6)。二维).因此,使用已知的MAPK底物,我们已经证明,通过转染偶联的cief免疫分析,通过共表达的活性激酶检测蛋白质(超)磷酸化是可能的,即使蛋白质在细胞环境中存在于多个磷酸化亚型中。
用cief免疫分析法检测瞬时表达GFP变异体的磷异构体分布。一个-c各种gfp融合蛋白的电泳图及其在cief免疫分析中的异构体分布。每种样品的表达蛋白和处理方法均有说明。一个未修饰的GFP存在于一个主要的亚型中,不会被MPK6磷酸化。上:对照(单个GFP构建转化),中:与MPK6共表达的GFP,下:与flg22激活的MPK6共表达的GFP。bGFP的异构体分布:ACS-C (ACS6的C端结构域与GFP的C端融合)。上:对照(单个GFP:ACS-C构建体转化),中:GFP:ACS-C与MPK6共表达,下:GFP:ACS-C与flg22激活的MPK6共表达。星号表示酸性同工异构体在活化的MPK6存在下特异性积累。c不被MAPKs磷酸化的GFP:ACS-C变体(GFP:ACS-C- aaa)的异构体分布。上:对照(单个GFP:ACS-C-AAA构建转化),中:GFP:ACS-C-AAA与MPK6共表达,下:GFP:ACS-C-AAA与flg22激活的MPK6共表达。d瞬时表达的GFP变体的常规SDS-PAGE免疫印迹。箭头表示一个条带,在激活MPK6存在时特异性地积累。阴性对照(Negative)(图1)表示原生质体样品未转染GFP
WUS在体内是MPK3的底物
植物MAPK研究的初步进展主要揭示了它们在逆境响应中的功能,然而,MAPK信号在植物发育中的重要作用越来越明显[8]。由于大多数已鉴定的底物也与防御相关,我们旨在鉴定具有发育功能的新型底物。我们利用了MAPK对接点的保守性[23],并筛选了关键的发育调节转录因子,以寻找d位点基序的存在,作为可能的MAPK相互作用的指标[24]。
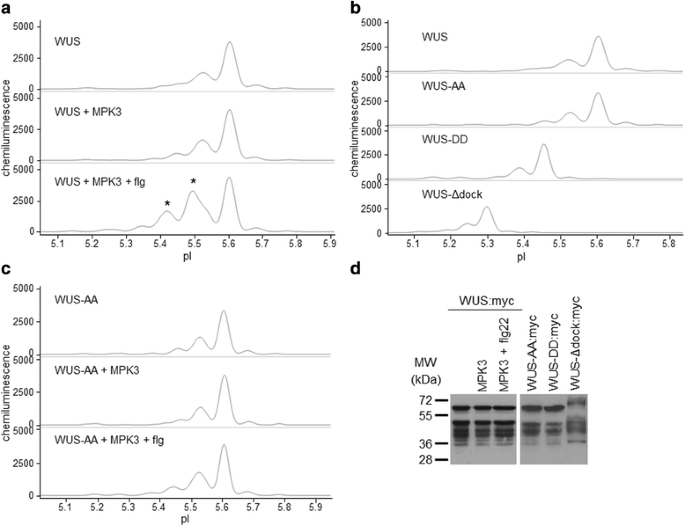
WUS是控制茎部和花分生组织干细胞池的关键转录因子[j]。25,26]。这一因素通过遗传方法进行了详细的表征,但对WUS的翻译后修饰一无所知。WUS包含一个RRTLPL基序,可能作为MAPK对接d位点,以及四个潜在的MAPK磷酸化位点3.表2)。在这里,我们发现使用GFP和myc表位标记的WUS结构存在于两种主要的同工异构体中。3、表2和附加文件4:图S2a)。接下来,我们测试了与活性MAPKs的共表达是否会导致WUS磷酸化。为此,WUS与4个mapk共表达,代表了植物mapk的3个系统发育群(图2)。3、表2和附加文件4:图S2a-c)。更多酸性WUS亚型的显著积累表明,WUS被MPK3特异性磷酸化,而不是被A组相关的MPK6、MPK11 (B组)和MPK1 (C组)特异性磷酸化。flg22处理不能不共表达MPK3,也不能与未激活的MPK3共表达,从而导致MPK3触发的磷酸化事件。作为额外的阴性对照,在flg22处理的样品中使用了一种失活的MPK3变体,而不影响任何同种异构体的再分布(附加文件)4:图S2c)。这些结果强烈暗示WUS在体内是MPK3的底物。
WUS在体内是MPK3的底物。一个-c各种WUS:myc融合蛋白的电泳图及其在cief免疫分析中的异构体分布。每种样品的表达蛋白和处理方法均有说明。一个活化MPK3对cief免疫分析中c端myc标记WUS亚型分布的影响。上:对照(单个WUS:myc构建转化),中:WUS:myc与MPK3共表达,下:WUS:myc与flg22激活的MPK3共表达。星号表示酸性同工异构体在活化的MPK3存在下特异性积累。b点突变体WUS变异体的不同电荷组成可以通过蛋白质pI值的变化来检测。WUSAA:不可磷酸化突变体,WUS- dd:拟磷突变体,WUS-Δdock: MAPK对接d位点失能突变体。c在MAPK磷酸化位点T108和S112上的丙氨酸取代会破坏MPK3对WUS的磷酸化。d瞬时表达WUS变异体的常规SDS-PAGE免疫印迹
为了进一步验证MPK3对WUS的磷酸化作用,我们引入了三种影响MAPK磷酸化的不同突变。位于同位结构域外的两个S/TP位点(T108, S112)上的磷受体残基被丙氨酸(WUS-AA,非磷酸化突变体)或谷氨酸(WUS-DD,拟磷突变体)取代。在第三个突变体中,假定的d位点失能(R252E, R253E, L257E: WUS-Δdock)。其中两个突变也改变了ExPASy Server计算的pI值[27]。虽然WUS- aa突变体与野生型蛋白具有相同的理论pI,但引入或交换的电荷降低了WUS- dd和WUS-Δdock的pI值。所有突变体形式的主峰都在预期的pI值处检测到,这表明可以可靠地检测到蛋白质电荷组成的细微差异(图2)。3 b和其他文件4和5:图S2b、S3)。在非磷酸化突变体和拟磷突变体中,mpk3介导的WUS酸化被完全消除。3 c、表2和其他文件4和5图S2d和S3b, c)。此外,磷酸化明显受损,没有功能d位点(表2)2和其他文件4和5(图S2e和S3g),暗示通过这个母题直接互动。转染后的蛋白也通过常规的SDS-PAGE免疫印迹检测,证实了表达,但未能解决磷异构体分布的变化(图2)。3 d和附加文件6:图S4a, b)。
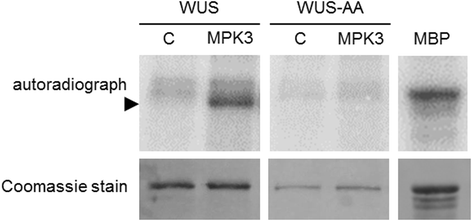
为了比较,MPK3对WUS的磷酸化作用也通过传统的体外激酶试验进行了检测。与上述发现一致,野生型WUS而非WUS- aa被MPK3磷酸化,如放射性标记的磷酸盐掺入所示(图2)。4).WUS同源物中确定的串联磷酸化位点的保存情况见附加文件7图S5。
WUS同工异构体被各种抗体一致检测到
为了确保我们的结果不是蛋白质标记或抗体介导检测的产物,WUS变异体由各种抗体检测。虽然GFP包含一个S/TP位点,但它位于球状结构内,很可能无法进入。相反,myc标签序列中没有S/TP位点。在两种融合变体中检测到相似的WUS异构体分布,尽管对于较小的myc标签,可以解析额外的小峰,因此对该版本进行了更详细的研究(图2)。3.和附加文件4:图S2)。蛋白质提取物的磷酸酶处理导致了单一WUS亚型的积累(附加文件)2:图S1),证实了蛋白磷酸化。为了进一步验证基于myc表位的检测,WUS:myc被三种具有一致异构体分布的不同抗体检测。常规使用直接与辣根过氧化物酶(罗氏)融合的单克隆抗myc抗体,不需要使用二抗。作为一致性对照,还检测了来自独立来源(Sigma)的抗myc抗体,结果相同(附加文件)6图S4e)。此外,Agrisera提供了一种特异性抗WUS抗体,这有助于选择WUS作为候选底物来测试基于融合蛋白的实验概念。事实上,在cief -免疫分析和SDS-PAGE免疫印迹中,特异性抗wus抗体检测到的同工型与抗myc抗体相同6:图S4b和e)。这些结果证实,标记和免疫检测不干扰细胞内WUS磷酸化和检测。
有趣的是,WUS融合变体在SDS-PAGE中异常迁移。WUS:myc和WUS:GFP的表观分子量分别为48.3 kDa和60.3 kDa,但WUS:myc的表观分子量约为68 kDa,而WUS:GFP的迁移分子量约为54 kDa。然而,不同磷酸化异构体的SDS-PAGE迁移是相同的。类似地,WUS- aa和WUS- dd突变体与它们的野生型对应体一样迁移,而WUS-Δdock迁移速度稍慢。因此,传统的SDS-PAGE不能解决WUS电荷组成的细微变化。此外,还可以观察到一些更快的迁移带,这些迁移带可以通过蛋白酶体抑制剂MG-115处理原生质体而显着消除,这意味着低分子量带是降解产物(附加文件)6:图S4c)。
本研究中使用的抗体在附加文件中有详细介绍8:表S3。
AP2在体内是MPK6的底物
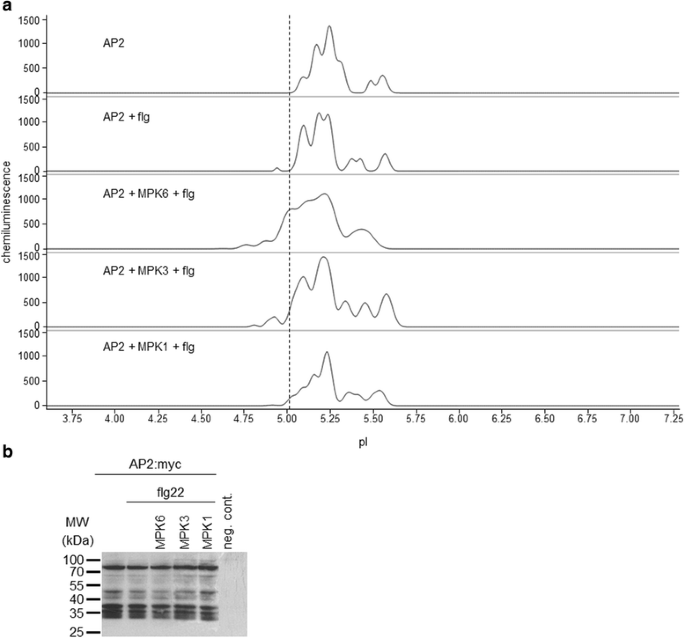
同源基因AP2是花发育的关键调控因子,根据花发育的ABC模型,AP2是a型转录因子[28,29]。尽管与WUS类似,AP2的功能通过遗传手段得到了广泛的表征,但AP2的翻译后修饰尚未见报道。尽管如此,AP2含有大量推测的激酶相互作用基序和磷酸化位点(附加文件)9:表S4)。因此,在未处理的细胞中检测到几个AP2亚型平行存在(图2)。5、表3.).蛋白提取物经磷酸酶处理后,复合物异构体分布显著减少(另附文件)2:图S1)。
我们通过与活化的MAPKs共表达来检测AP2的磷酸化(图2)。5、表3.).AP2:myc融合的理论pI为5.24,与所有样品中一致检测到的主峰相对应。在flg处理的样品中可以观察到一些酸化(特别是pI ~5.1的异构体),表明内源性激酶磷酸化。当MPK6共表达时,观察到AP2明显酸化。在这种情况下,出现了pI 5.0的一个新的主要同工异构体。相比之下,在AP2与相关MPK3或MPK1共表达的样品中不存在pI 5.0亚型。这些数据表明AP2在体内是MPK6的底物。同样,传统的免疫印迹不足以解决磷异构体分布的改变(图2)。5 b).
讨论
目前,特定激酶对特定蛋白质的磷酸化作用通常通过体外激酶试验来研究,尽管由于使用细胞外纯化的蛋白质,这种方法容易产生假阳性和阴性结果[9,14]。此外,放射性同位素的使用也意味着严重的安全和环境危害。在这里,我们提出了激酶相关磷异构体测定法,这是一种研究体内特定磷酸化相互作用的替代方法,并使用这种新方法首次证明了两个关键植物发育调节因子的磷酸化。这两种方法都需要将底物编码cdna克隆到融合载体中。在体外激酶试验的情况下,最常见的gst融合蛋白以合适的方式表达大肠杆菌菌株。然而,一个重要的区别是植物蛋白在原核系统中的有效表达可能是有问题的(例如包涵体的形成)。此外,在实际的激酶测定反应之前,表达蛋白的纯化需要进一步的努力,然后进行SDS-PAGE分离,随后通过放射自显影检测合并的放射性同位素。相比之下,使用这种新方法,感兴趣的蛋白质在植物细胞中表达,然后快速获得的粗提取物可以直接用于cief免疫分析,在几小时内进行分离和检测。
毛细管电泳在生物分子分析方面取得了突破性进展,当与免疫分析相结合时,它可以克服繁琐的传统SDS-PAGE免疫印迹方法的许多局限性。据我们所知,这是cief免疫测定在植物研究中的首次应用,激酶实验工具包的扩展有助于缩小哺乳动物和植物系统之间细胞信号传导的知识差距。基于转染的实验通常用于信号研究,原生质体瞬时表达已广泛用于植物MAPK的研究[30.].此外,常用表位的商业抗体可以从多种来源获得,它们特异性强、可靠且价格合理,而不是依赖于每种感兴趣的蛋白质的特异性抗体。毛细管电泳非常敏感,据报道,它能够检测25个细胞样本中的蛋白质[15],因此转染细胞和质粒DNA的数量可能会显著减少,以优化资源利用。
原生质体可以从各种类型的组织或特定的突变植物材料中分离出来,因此可以针对特定目的专门设计实验,例如,避免在相同细胞类型中不存在的蛋白质配对。与过表达相关的问题通常通过使用诱导或细胞类型特异性启动子来缓解。然而,原生质体在这方面提供了一个突出的优势:转化在给定的时间点同步发生,翻译后的蛋白质可以在转化后的几个小时内检测到,通常随后是大约20小时的线性增加。因此,可以通过调整孵育时间来微调原生质体中的表达水平[31]。此外,当检测给定激酶的候选底物时,原生质体可能来源于激酶零突变背景,并且转染的激酶也可以由其自身的启动子驱动。
重要的是,原生质体转染方法已经发展到广泛的植物物种,其中一些是困难的或漫长的转化[32]。因此,该方法也可用于直接研究重要经济作物的信号传导。
通过使用在线motif搜索工具,我们已经确定了假定的底物,这些底物仅在特定细胞类型中表达,因此可能被大多数筛选实验遗漏。然而,我们有理由期待未来将开发出更复杂的基序搜索方法,并应用于有效的底物预测。例如,开发了一种基于机器学习的方法来识别人类蛋白质中的d位基序[33]。在拟南芥通过一致的磷酸化序列预测了MPK3和MPK6的新的候选底物[13]。这种计算方法肯定会受益于一种强大的方法来快速可靠地验证磷酸化相互作用,从而促进识别和预测激酶底物的迭代模型。
在解决生物学问题时,必须考虑到每种方法都有一定的优点和缺点。这必须在先验知识、假设和独立证据线的背景下考虑实验设计。正如所有常用的蛋白质相互作用工具箱的细胞方法(例如,共免疫沉淀或片段互补),由于其细胞性质,所提出的分析也不能完全排除间接磷酸化相互作用的可能性。然而,由于该方法提供了表达差异标记蛋白的原生质体样品,因此也可以使用等分液进行平行相互作用测定,这通常在激酶底物研究中在原生质体中进行。除了其他证据外,如果已知特定的相互作用序列,则可以通过突变它们来推断直接的相互作用。
利用高通量原生质体转化扩大激酶相关磷异构体试验似乎是可行的[34]和公开的基于网关的cDNA收集[35]。除了验证筛选结果或计算预测外,该方法的中等通量应用原则上也可用于筛选表达库。
目前,分生组织和器官的形成,由于几十年的密集的遗传研究是非常详细的了解。突变系的使用导致了各种主调控转录因子的鉴定和表征。如图所示,两种特性良好的调节因子的体内磷酸化表明它们的细胞功能是动态调节的,并且必须考虑翻译后修饰以获得准确的功能理解,例如在转基因研究中使用磷酸化突变基因版本。
结论
提出的方法扩展了植物激酶实验工具包,并补充了无偏筛选和硅预测方法的技术进步。它提供了一种尖端的分析方法来测定体内特定的激酶-底物相互作用。此外,该方法是无放射性的,并且与体外测定法相比也显着无麻烦。使用已知的底物和各种控制设置,我们已经证明,所提出的原理来测定不同的磷异构体分布是可行的,以确定体内蛋白磷酸化事件。所提出的实验方法可以进一步调整和改进用于特定目的,例如通过使用各种启动子,原生质体来源或其他特性的毛细血管(例如pH分辨率)。因此,这种策略可以促进未来在各种调控途径中揭示激酶靶点的进展,这些调控途径包括无根植物的复杂适应机制。
方法
表达式构造的生成
从新合成的cDNA或从TAIR获得的cDNA克隆扩增开放阅读框。总RNA从拟南芥使用RNeasy Plant Mini kit (Qiagen)进行cDNA合成,然后使用RevertAid First Strand cDNA synthesis kit (Thermo Scientific)进行cDNA合成。PCR产物克隆到pGEM-T Easy载体(Promega)上。序列验证后,将orf亚克隆到pRT100中[36]衍生物利用pcr引入的5 ' NcoI和3 ' NotI限制性位点生成帧内c端三myc表位或GFP融合构建物。ACS6 c端结构域对应于435 ~ 495个氨基酸位置[20.在双35S启动子的驱动下,c端与pGreenII-0029载体上的GFP融合为5 ' NcoI - 3 ' NotI片段。
使用QuikChange Lightning定点诱变试剂盒(Agilent Technologies)进行定点诱变反应。激酶失活的MPK3是通过使atp结合位点失活产生的,方法如下[37]。
为了体外转录/翻译WUS CDS通过连接不依赖克隆将其亚克隆到pEU3-NII-GLICNot载体上[38]。
本工作中使用的Oligos在附加文件中给出10表S5。
原生质体制备与转染
本研究中使用的悬浮细胞培养最初是由拟南芥C. Koncz(德国科隆马克斯普朗克植物育种研究所)实验室Col-0(生态型哥伦比亚-0)根[39]。原生质体的制备和瞬时转化如下所述[40]。细胞培养是从拟南芥在4.414 g/l MS + B5维生素(Duchefa)、30 g/l蔗糖和1 mg/l 2,4- d、pH 5.7条件下维持。细胞培养物每周稀释1:5。290 rcf离心5分钟,收集3天的细胞。在添加0.25%纤维素酶(养乐多)和0.05%巨噬酶(养乐多)的B5- gm培养基(3.164 g/l B5粉(Duchefa), 0.34 M葡萄糖和0.34 M甘露醇,pH 5.5)中,28°C搅拌去除细胞壁,直至细胞变成球形(约4小时)。原生质体用B5- gm洗涤一次,用5 ml B5- sm培养基(3.164 g/l B5粉(Duchefa)和0.28 M蔗糖,pH 5.5)重悬。原生质体在130 rcf下离心7 min后进行漂浮分离。细胞计数后,将原生质体浓度调整为107/毫升。
每个质粒5 μg, 5 × 105每次转化反应均使用原生质体(50 μl)。用150 μl PEG溶液(25% peg6000)、0.45 M甘露醇和0.1 M Ca(NO)处理原生质体- dna混合物3.)2用1 ml 0.275 M Ca(NO . 1)洗涤PEG3.)2,原生质体在0.5 ml B5-GM中重悬。为了减少独立转化事件之间的差异,对每个样品进行3个转化反应,合并并分离为5 × 10个5和106细胞分别用于cief免疫测定和免疫印迹。用1 μM的flg22肽(由BioBasic定制合成)处理静止的原生质体30分钟,触发MAPK活化。MG-115处理通过在培养基中添加终浓度为100 μM的MG-115 (Calbiochem)处理10分钟,然后快速冷冻细胞。
cIEF-immunoassay
在NanoPro100仪器(ProteinSimple)上进行cief免疫测定。试剂和耗材由ProteinSimple提供。所有移液步骤均在4°C的冰箱箱内进行。
在100 μl终体积(94 μl Bicine/CHAPS缓冲液,4 μl水溶液抑制剂混合物,2 μl DMSO抑制剂混合物)中,在4°C下旋涡裂解10 s。裂解物在14000 rcf下在4°C下离心40分钟。用NanoDrop分光光度计(Thermo Scientific)在280 nm处测定上清液的蛋白质浓度,并设置为0.1 mg/ml终浓度。
146.7 μl预混料G2 pH 3-10或5-8分离梯度与3.3 μl pI标准梯料通过彻底的涡流混合。每个样品加入4 μl细胞裂解液(0.1 mg/ml)至12 μl分离梯度- pI标准混合物中,混合后将每个样品的4 μl装入NanoPro板的“A”行。将抗体稀释液1:50稀释后的一抗10 μl装入B行。将10 μl辣根过氧化物酶(HRP)偶联二抗用抗体稀存液1:100稀释后装入“C”行。如果一抗是直接酶标的,在C行上装10 μl抗体稀释液。然后在4°C下,2,500 rcf离心5分钟。排D上载500 μl 1:1的鲁米诺-过氧化物溶液。行' E '上载1800 μl Wash Buffer。在将样品板插入样品板支架并装入毛细管筒之前,在分离槽中装入900 μl电解质溶液。
根据以下方案分离和检测样品。所有步骤都在NanoPro系统中编程并自动执行。在15000 μW下聚焦30分钟。在工厂设置下,用紫外线照射100秒,将聚焦后的蛋白质固定在毛细血管内。一抗和二抗孵育时间分别为2 h和1 h。在每个孵育步骤之前,毛细管洗涤两次,持续150秒。分别在60、120、240、480和600 s进行化学发光检测。数据采用Compass软件(ProteinSimple)进行分析。所有实验至少进行了三次,结果一致。
Lambda蛋白磷酸酶(New England Biolabs)通过在比辛/CHAPS缓冲液中添加蛋白提取物(0.8 μg)进行处理,包括用于植物细胞和组织提取物的蛋白酶抑制剂鸡尾酒(Sigma)和用于PMP的NEBuffer, 1 mM MnCl2和200单位磷酸酶(New England Biolabs)至10 μl终体积,30℃孵育1 h, 65℃热灭活酶停止反应。电泳图归一化到原始的Bicine/CHAPS缓冲系统。
在这项工作中使用的抗体在附加文件中介绍8:表S3。
免疫印迹
原生质蛋白提取物在Lacus缓冲液中制备[41]。等量的蛋白质通过SDS-PAGE分离,转移到聚偏二氟乙烯膜(Millipore)上,用抗体检测(表S3)。
体外激酶测定
按照说明书,使用TranscriptAid T7高产转录试剂盒(Thermo Scientific)进行体外mRNA合成。使用WEPRO7240H表达试剂盒(Cell Free Sciences, Japan)进行无细胞翻译。为了激活his标记的MPK3,当包含在磷酸化试验混合物中时,编码构成活性myc:MKK4的mRNA也被添加到翻译混合物中,如下所述[42]。
体外翻译他的6-AtMPK3蛋白用TALON磁珠(Clontech)亲和层析纯化,体外翻译GST-WUS和GST-WUS- aa用谷胱甘肽磁珠(Thermo Scientific)亲和层析纯化[42]。
对于激酶检测,分别使用300和100 ng的体外翻译,亲和纯化的底物和激酶。10 μg髓鞘碱性蛋白(MBP)作为MAPK的通用底物作为活性对照。检测条件为:20 mM HEPES, pH 7.5, 100 μM ATP, 1 mM DTT, 15 mM MgCl2, 5 mM EGTA和5 μCi [γ-]32P]ATP在室温下以头结合GST-WUS或GST-WUS- aa为底物30min,然后加入Laemmli SDS缓冲液停止。采用SDS-PAGE对样品进行分离。凝胶固定,考马斯蓝染色,干燥,放射自显影分析。
缩写
- ACS6:
-
1-氨基环丙烷-1-羧酸合成酶6 (at4g11280)
- AP2:
-
无瓣2 (at4g36920)
- cIEF:
-
毛细管等电聚焦
- 榆树:
-
真核线性基序资源
- 绿色荧光蛋白:
-
绿色荧光蛋白
- MAPK:
-
丝裂原活化蛋白激酶
- MPK1:
-
mapkinase 1 (at1g10210)
- MPK11:
-
mapkinase 11 (at1g01560)
- MPK3:
-
mapkinase 3 (at3g45640)
- MPK6:
-
mapkinase 6 (at2g43790)
- sds - page:
-
十二烷基硫酸钠聚丙烯酰胺凝胶电泳
- 本人:
-
Wuschel 1 (at2g17950)
参考文献
为什么大自然选择磷酸盐来修饰蛋白质。[j] .中国生物医学工程学报,2012;37(2):444 - 444。
Dardick C, Chen J, Richter T, Ouyang S, Ronald P.水稻激酶数据库。水稻基因组系统基因组数据库。植物学报。2007;43(3):579 - 586。
刘建军,刘建军,刘建军,刘建军。拟南芥Kinome:系统发育和进化对功能多样化的见解。BMC Genomics. 2014;15:548。
杨建军,李建军,李建军,等。人类基因组中蛋白激酶补体的研究。科学。2002;298:1912-34。
李建军,李建军。细胞外信号调节激酶的研究进展。生长因子。2006;24:21-44。
王晓明,王晓明。拟南芥MAPK基因的表达及其调控机制。植物科学进展,2010;15:106-13。
MAPK底物识别与控制模式。植物科学进展,2015;20:49-55。
徐军,张松。丝裂原活化蛋白激酶级联在植物生长发育中的作用。植物科学进展,2015;20:56-64。
蛋白质磷酸化分析:研究激酶和底物的方法和策略。植物学报,2006;45(5):522 - 522。
Feilner T, Hultschig C, Lee J, Meyer S, Immink RG, Koenig A, Possling A, Seitz H, Beveridge A, Scheel D, Cahill DJ, Lehrach H, Kreutzberger J, Kersten B.拟南芥丝裂原活化蛋白激酶的高通量鉴定。生物工程学报。2005;4(4):558 - 568。
张志刚,张志刚,张志刚,张志刚。拟南芥MAPK基因的功能蛋白芯片研究。基因工程学报,2009;23:80-92。
李建军,李建军,李建军,等。丝裂原活化蛋白激酶对拟南芥防御代谢和磷酸化蛋白谱的影响。植物科学,2014;5:554。
Sorensson C, Lenman M, vede - vilg J, Schopper S, Ljungdahl T, Grotli M, Tamas MJ, Peck SC, Andreasson E.拟南芥MAPKs MPK3和MPK6的一序列特异性测定及其新底物的鉴定。中国生物医学工程学报。2012;46(1):1 - 8。
曼宁BD,坎特利LC。击中目标:寻找激酶底物的新兴技术。科学抽烟可以。2002; 2002: pe49。
O 'Neill RA, Bhamidipati A, Bi X, debb - basu D, Cahill L, Ferrante J, Gentalen E, Glazer M, Gossett J, Hacker K, Kirby C, Knittle J, Loder R, Mastroieni C, Maclaren M, Mills T, Nguyen U, Parker N, Rice A, Roach D, Suich D, Voehringer D, Voss K, Yang J, Yang T, Vander Horn PB。等电聚焦技术量化25个细胞中的蛋白质信号。科学通报,2006;22(3):391 - 391。
王晓明,王晓明,王晓明,等。拟南芥mapk6基因的克隆及其对乙烯响应因子的影响。科学通报,2009;26(6):867 - 872。
李建军,李建军,李建军,等。农杆菌转化过程中的特洛伊木马策略:利用MAPK防御信号。科学。2007;318:453-6。
杨树锌指蛋白的表达及其酶解机制的研究,杨树锌指蛋白的酶解机制及其酶解机制。植物生理学报,2011;37(2):379 - 393。
Pecher P, Eschen-Lippold L, Herklotz S, Kuhle K, Naumann K, Bethke G, Uhrig J, Weyhe M, Scheel D, Lee J.拟南芥丝裂原活化蛋白激酶MPK3和MPK6靶向含有VQ-motif的蛋白亚类调控免疫应答。植物学报,2014;23(3):592 - 606。
jus, Liu Y, Lueth A, Zhang S. MAPK磷酸化诱导ACS6蛋白稳定的非催化c端结构域介导,该结构域还包含26S蛋白酶体途径快速降解的顺式决定因子。植物学报,2008;44(4):559 - 564。
Dinkel H, Van Roey K, Michael S, Davey NE, Weatheritt RJ, Born D, Speck T, Kruger D, Grebnev G, Kuban M, Strumillo M, Uyar B, Budd A, Altenberg B, Seiler M, Chemes LB, Glavina J, Sanchez IE, Diella F, Gibson TJ。真核线性基序资源ELM: 10年和计数。中国生物医学工程学报,2014;42(2):559 - 566。
戈麦斯-戈麦斯L, Felix G, Boller T.一个基因座决定拟南芥对细菌鞭毛蛋白的敏感性。植物科学学报。1999;18(1):77 - 84。
李建军,李建军,李建军,等。植物MAPK网络的进化路径研究。植物学报,2012;17(5):518 - 25。
张建军,张建军,张建军,等。MAPK激酶对接位点的研究进展。生物化学学报,2009;28(4):344 - 344。
Laux T, Mayer KF, Berger J, Jurgens G.拟南芥茎部和花分生组织完整性需要WUSCHEL基因。发展。1996;122:87 - 96。
周颖,刘霞,Engstrom EM, Nimchuk ZL, Pruneda-Paz JL, Tarr PT, Yan A, Kay SA, Meyerowitz EM.保守相互作用转录调控因子对植物干细胞功能的控制。大自然。2015;517:377 - 80。
Wilkins MR, Gasteiger E, Bairoch A, Sanchez JC, Williams KL, Appel RD, Hochstrasser DF。ExPASy服务器中的蛋白质鉴定和分析工具。方法:中华医学杂志。1999;12:531 - 552。
Bowman JL, Smyth DR, Meyerowitz EM.拟南芥花发育调控基因。植物学报。1989;1:37-52。
Bowman JL, Smyth DR, Meyerowitz EM.花卉发育的ABC模型:过去和现在。发展。2012;139:4095-8。
王晓明,王晓明,王晓明,等。拟南芥MAPKs:一个复杂的信号网络,涉及多个生物过程。中国生物医学工程学报,2008;33(1):444 - 444。
Denecke J, Aniento F, Frigerio L, Hawes C, Hwang I, Mathur J, Neuhaus JM, Robinson DG。分泌途径研究:实验系统越多越好。植物学报。2012;24(2):1316 - 26。
王晓明,王晓明,王晓明,等。植物原生质体的研究现状及应用前景。生物工程学报,2005;23:131-71。
Whisenant TC, Ho DT, Benz RW, Rogers JS, Kaake RM, Gordon EA, Huang L, Baldi P, Bardwell L.新的MAP激酶对接位点和Gli转录因子的计算预测和实验验证。科学通报,2010;6:8。
Wehner N, Hartmann L, Ehlert A, Bottner S, Onate-Sanchez L, droger - laser W.高通量原生质体转录激活(PTA)系统分析拟南芥转录因子功能。植物学报,2011;38(6):559 - 559。
龚伟,沈玉萍,马丽丽,潘艳,杜玉玲,王德华,杨建勇,胡立德,刘晓峰,董彩霞,马丽,陈玉华,杨晓燕,高勇,朱丹,谭霞,穆建勇,张德宝,刘玉玲,Dinesh-Kumar SP,李勇,王晓萍,顾海燕,曲丽娟,白思安,陆玉婷,李建勇,赵建东,左杰,黄辉,邓晓文,朱永勇。拟南芥转录因子基因的全基因组克隆与分析。植物生理学报。2004;35(5):773 - 782。
李建军,李建军,李建军,李建军。一组转录和翻译融合的植物表达载体。核酸学报。1987;15:5890。
黄晓明,李晓明,李晓明,等。拟南芥MKK2信号通路在低温胁迫和盐胁迫下的表达。分子细胞学报。2004;15:141-52。
Bardoczy V, Geczi V, Sawasaki T, Endo Y, Meszaros T.一组不依赖于连接的真核蛋白体外翻译载体。生物工程学报,2008;8:32。
李建军,张建军,张建军,等。细胞悬浮培养的建立与维持。方法中华医学杂志,1998;82:27-30。
李建军,李建军,李建军,等。植物丝裂原活化蛋白激酶活性及其报告基因的研究。方法:中华医学杂志。2011;779:79-92。
Bogre L, Calderini O, Binarova P, Mattauch M, Till S, Kiegerl S, Jonak C, Pollaschek C, Barker P, Huskisson NS, Hirt H, Heberle-Bors E.一种MAP激酶在植物有丝分裂后期激活并定位于细胞分裂平面。植物学报。1999;11:101-13。
陈建平,李建平。蛋白激酶底物的体外翻译鉴定。方法:中华医学杂志。2014;18(1):231 - 43。
致谢
我们感谢Erika Gondos在细胞培养维护方面的技术援助。
资金
这项工作得到了欧共体居里夫人重返社会基金ERG 256554和匈牙利研究基金(OTKA K101250, NN114511, NN111085)的支持。RD是匈牙利科学院博雅研究员。
数据和材料的可用性
所有支持数据都作为附加文件包含。
作者的贡献
RD在ZD、BB和MD的帮助下设计了实验。MD、HA和RD进行了克隆、细胞培养和转染实验。ZD进行了cief免疫分析实验。SN和TM设计并进行了体外翻译和蛋白磷酸化实验。RD, ZD, BB和TM分析数据,RD撰写手稿。所有作者都已阅读并同意本文。
相互竞争的利益
作者宣称他们没有竞争利益。
发表同意书
不适用。
伦理批准并同意参与
不适用。
作者信息
从属关系
相应的作者
附加文件
附加文件1:表S1。
ACS6 (1-AMINOCYCLOPROPANE-1-CARBOXYLIC ACID (ACC) SYNTHASE 6) c端结构域(pos. 435-495)的激酶和磷酸酶相互作用(对接)和磷酸化基序。使用真核线性基序(ELM)资源进行线性基序搜索。假定的磷酸化残基用红色字体表示。此外,该序列包含一个假定的d位点MAPK对接基序。该基序在基本簇和庞大的疏水氨基酸之间包含5个间隔基残基,因此不符合ELM定义的2-4个间隔基。尽管如此,人们普遍认为d位点一致由1-6个间隔氨基酸组成。(PDF 88kb)
附加文件2:图S1。
磷酸酶处理对蛋白质异构体分布格局的影响。免疫分析中lambda磷酸酶处理后的各种蛋白的电泳图。每个样品的表达蛋白都显示出来。(PDF 94kb)
附加文件3:表S2。
WUSCHEL蛋白序列(292个氨基酸)中假定的激酶相互作用(对接)和磷酸化基序。采用ELM进行线性基序搜索。落在SMART/Pfam结构域内或ELM结构过滤器评分较差的基序用星号表示。假定的磷酸化残基用红色字体表示。此外,该序列包含一个假定的d位点MAPK对接基序。该基序在基本簇和庞大的疏水氨基酸之间仅包含一个间隔基残基,因此不符合ELM定义的2-4个间隔基。尽管如此,人们普遍认为d位点一致由1-6个间隔氨基酸组成。(PDF 87kb)
附加文件4:图S2。
WUS在体内是MPK3的底物。一个-b不同WUS:GFP融合蛋白在cief免疫分析中的电泳图及其异构体分布。每种样品的表达蛋白和处理方法均有说明。一个MAPK共表达和flg处理对cief免疫分析中c端gfp融合WUS异构体分布的影响星号表示在活化的MPK3存在下特异性地积累酸性同工异构体。b在MAPK磷酸化位点T108和S112上,氨基酸被替换为不可磷酸化的丙氨酸(WUS- aa:GFP)或拟磷天冬氨酸(WUS- dd:GFP)会破坏MPK3对WUS的磷酸化。星号表示在活化的MPK3存在下特异性地积累酸性同工异构体。一部各种WUS:myc融合蛋白的电泳图及其在cief免疫分析中的异构体分布。每种样品的表达蛋白和处理方法均有说明。cMAPK共表达和flg处理对cief免疫分析中c端myc标记WUS异构体分布的影响d在MAPK磷酸化位点T108和S112上的天冬氨酸取代破坏了MPK3对WUS:myc的磷酸化。eMAPK对接位点的失能会损害WUS:myc被MPK3磷酸化。(PDF 165kb)
附加文件5:图S3。
峰面积量化的例子。一个-d各种WUS:myc融合蛋白的电泳图及其在cief免疫分析中的异构体分布。每种样品的表达蛋白和处理方法均有说明。计算生成的面积以绿色显示。数据如表所示2.(PDF 149kb)
附加文件6:图S4。
用各种抗体对转染蛋白进行免疫检测。一个瞬时表达WUS的SDS-PAGE免疫印迹:与各种mpk共表达的GFP变体。b短暂表达的WUS:myc与多种mpk共表达的SDS-PAGE免疫印迹。阴性对照(Negative))是未转染myc表位的原生质体样本。右图显示一种特异性抗WUS抗体检测瞬时表达的WUS:myc。阴性对照(Negative))是未转染WUS:myc构建体的原生质体样本。c瞬时表达WUS:myc变异体的SDS-PAGE免疫印迹。使用蛋白酶体抑制剂MG-115来确定蛋白质降解在检测到的较轻条带形成中的作用。d本研究中使用的各种瞬时表达的mpk的SDS-PAGE免疫印迹。iMPK3是一个失活的MPK3突变体。阴性对照(Negative))是未转染HA表位的原生质体样本。eWUS的一致性:用cief免疫分析法检测myc。瞬时表达的WUS:myc通过以下抗体检测:特异性抗WUS (Agrisera,上图),酶联性抗myc (Roche)和抗myc (Sigma)。本研究中使用的抗体在附加文件中有详细介绍8表S3。(PDF 260kb)
附加文件7:图S5。
来自不同物种的WUSCHEL同源物中串联MAPK磷酸化位点的保护,代表了与拟南芥的不同进化距离。在可用的情况下,下载带注释的WUSCHEL蛋白序列并使用MUSCLE 3.8进行比对。与高度保守的homeobox域相反,homeobox域的下游区域保守性较差,该区域无法定义一致序列。本研究确定的磷酸化位点位于AtWUS的T108、S112位点。所示的比对结果对应于AtWUS氨基酸位置97-185,包括同源结构域的最后四个残基。突出显示了脯氨酸导向的丝氨酸/苏氨酸(MAPK)磷酸化位点。串联磷酸位点的位置在芸苔科植物中保守得很好,在其他双子科植物中与同源结构域距离较远,在单子科植物中位于更下游的位置。在某些物种中,可以观察到第三位点的出现。蛋白标识如下:阿拉伯菜:KFK40169.1,亚麻荠:XP_010467591.1,甘蓝型油菜:AFD50636.1,葡萄:XP_002266323.1,卵形杜鹃:AHJ14780.1,马铃薯:XP_006340731.1,水稻:CAM32354.1,玉米:CAM32346.1。(PDF 82kb)
附加文件8:表S3。
本研究中使用的抗体。(PDF 79kb)
附加文件9:表S4。
aptala2 (At4g36920.1)蛋白序列(432个氨基酸)中激酶和磷酸酶相互作用(对接)和磷酸化基序。采用ELM进行线性基序搜索。落在SMART/Pfam结构域内或ELM结构过滤器评分较差的基序用星号表示。假定的磷酸化残基用红色字体表示。(PDF 88kb)
附加文件10:表S5。
本研究中使用的寡核苷酸。(PDF 80kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有说明。
关于本文
引用本文
多莉,M.,多尔斯查尔,Z.,纳吉,S.K.et al。激酶相关磷酸异构体测定:一种新的基于候选物的方法来检测体内特定的激酶-底物磷酸化相互作用。BMC Plant Biol16日,204(2016)。https://doi.org/10.1186/s12870-016-0894-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-016-0894-1
关键字
- 蛋白激酶
- 磷酸化检测
- 信号转导
- 原生质体转染
- 毛细管等电聚焦
- 奈米流体免疫测定
- APETALA 2
- WUSCHEL
- 拟南芥