摘要
背景
抗性和生长是植物的两个相反的特性。npr1的SA不敏感性-5(SSI2.)编码硬脂酰- acp去饱和酶(S-ACP DES),此前有报道称该酶能同时增强抗性和抑制生长。
结果
在这里,我们描述SSI2-2了一种新的突变体等位基因的SSI2.它有两个氨基酸取代。与野生型和其他两种突变体进行了比较SSI2.,SSI2-2在生长大小、点状坏死、对病原菌的抗性等方面表现为中等表型太平洋标准时间DC3000,水杨酸(SA)含量,致病相关(PR.)基因水平和18:1含量。这些结果表明SSI2-2是一个弱突变体SSI2..此外,通过使用SSI2-2作为中间对照,在转录组分析中发现了一些差异表达基因。这些结果表明,防御相关基因的组成性表达和IAA信号相关基因的抑制均存在SSI2.突变体。
结论
总的来说,我们的结果表明,弱者SSI2-2突变维持植物免疫和营养生长比其他突变体之间取得更好的平衡,从而提供了一个基础,以基因工程在作物抗病能力。
背景
脂肪酸(FAs)对所有生物都至关重要,因为它们不仅是能量的来源,而且是细胞膜的主要成分。近年来,越来越多的研究表明FAs及其衍生物作为调节正常和疾病相关过程的信号分子具有重要作用[1].在植物中,FAs影响生物和非生物胁迫反应的各种过程[1,2].例如,叶绿体膜中多不饱和Fas的水平影响膜脂肪流动性,这可能影响植物容差的温度应激[3.,4].此外,亚麻酸参与热胁迫植物的蛋白质修饰[5].壬二酸是由c18fa衍生而来的,在碳9处含有一个双键。研究表明壬二酸具有主要的系统获得性抗性(SAR) [6].
硬脂酰-ACP去饱和酶(SACPD)是催化硬脂酸(18:0)转化为油酸(18:1)的关键酶德诺维植物细胞中脂肪酸的生物合成和产生单不饱和脂肪酸[7,8].的拟南芥基因组有七种SACPD亚型[8].SSI2.是一个SACPD同种型,可导致严重的生长缺陷,包括自发性坏死和变形的叶子,突变时。植物病原体的抗性的分析表明,不存在SSI2的激活的防御反应,并且导致水杨酸升高(SA)的水平和组成型表达与发病机理相关(PR.)基因导致对几种病原体的抗性增强,例如霜霉属parasitica,两pv。番茄(太平洋标准时间)和黄瓜花叶病毒[9- - - - - -17.].与SSI2相比,其他S-ACP-DES同工酶的特异性活性大大降低,S-ACP-DES 1和4的敲除突变不会改变防御表型。观察表明,SSI2是主要的SACPD亚型,调节防御信号[9].
使用遗传方法,一个SSI2-1抑制子分离,即ACT1.,编码甘油-3-磷酸(G3P)酰基转移酶(ACT1)。Act1是催化G3P的酰化的关键酶,以形成溶血金酸(LySO-PA)。一个突变ACT1.降低了18:1向lyso-PA的转化,恢复了18:1 in的含量SSI2-1突变体,导致生长恢复和逆转已改变的病原体反应SSI2-1表明18:1的减少可能是抗性增强和生长迟缓的直接原因[13.].另外,通过G3P脱氢酶的第二位点突变可以恢复18:1水平(GLY1)[14.]和酰基载体蛋白4 [15.].
由于叶绿体18:1分布在叶绿体中,18:1的还原对核编码的抗性基因的影响尚不明确[9,15.,16.].一种可能的解释是18:1的减少可能导致NOA1蛋白的积累,进而加速NO的产生,转录上调NO应答核基因,从而激活抗病能力[18.].
这种18:1衍生的抗性似乎在不同的植物物种中是保守的。在水稻中,SACPD亚型减少的植物对致病菌和卵菌的抗性增强[19.]和大豆〔20.], 分别。类似地,在水稻OSSSi2敲除突变体中观察到对水稻爆炸的增强抗性[19.].这不是在拟南芥作为SSI2-1突变增强了粉末状霉菌的抗性[21.],但显示出对受损电阻b .灰质[10.].除病原体抵抗力外,表征拟南芥fab2突变体,它是一种SSI2.不同于SSI2-1显示,SSI2.在植物发育和非生物适应中发挥作用,特别是对高温的适应。植物窝藏FAB2与野生型植物相比,突变非常小[22.,23.].显微分析表明FAB2突变导致叶肉层和表皮层的细胞扩张缺陷。令人惊讶的是,高温可以改善严重的生长缺陷FAB2突变体,与脂肪酸组成无相关性。一种可能的解释是,这种恢复是由于在较高温度下膜流动性增加[23.].
国防部可能是昂贵的植物,和防御基因的表达可对植物的发展,这在一定程度上抵消了其积极影响[负面影响24.].病变模拟突变体(LMM)总是具有改变的植物形式,例如SNC1.-1,LSD2.,LSD4.,DLL1.,HRL1,显示植物尺寸减少。此外,PCD诱导的叶坏死可以与抗性响应的激活相关[25.].在这里,分子分析,组织学染色和转录谱揭示的弱突变SSI2.使点状坏死斑和增强的抗细菌病原体太平洋标准时间DC3000,具有一定程度的阻力的小于的SSI2-1和T-DNA突变体,但生长破坏程度也降低。该突变体为潜在的基因工程提高抗病能力提供了重要信息。
结果
SSI2-2显示出降低的生长和增强抗病能力
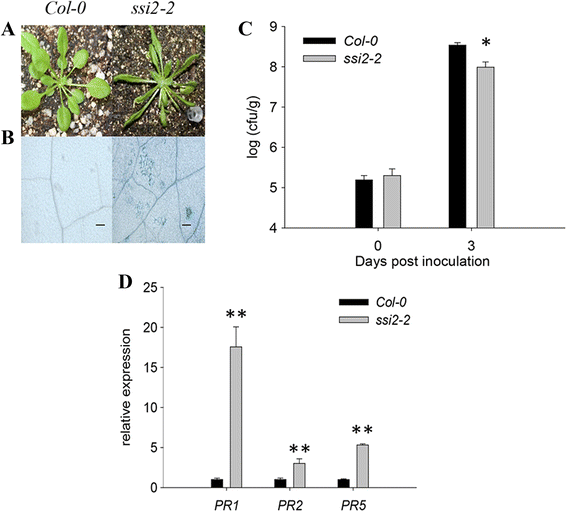
为了深入研究植物免疫机制,我们利用甲基磺酸乙酯(EMS)诱变筛选LMM表型显著的突变体拟南芥生态型哥伦比亚(Col-0)。通过近距离观察,发现一个突变体成熟叶片上有许多小白点,并进行了分离和标记SSI2-2基于基于地图的克隆结果(见下文)。成熟SSI2-2植株表现出生长缺陷,与野生型植株相比,其叶片又小又窄。1A).为了验证这些白色斑点是否是由于程序性细胞死亡(PCD),我们进行了台班蓝染色,这是一种广泛用于选择性检测死亡组织或细胞的方法。正如预期的那样,在成熟的叶中发现了许多蓝色斑点SSI2-2,表示白色斑点由PCD产生(图。1B.).
野生型之间的表型差异和SSI2-2突变体植物。一个Col-0和The的表型SSI2-2在22℃下在培养室中生长的突变植物4周。bCol-0野生型和SSI2-2台盼蓝染色突变体。比例尺= 100 μm。c的增长太平洋标准时间DC3000在野生型和SSI2-2培养4周的突变植物。从感染的叶片收获三片叶子,然后称重,在10mM MgCl中一起均化2,稀释10.5-or 106-折叠,并镀在国王的B介质。通过计数菌落形成单位(cfu),测定每个时间点3个重复的细菌数量。“0天”点表示接种细菌后2小时。每个点代表平均值±标准偏差。实验重复了三次。重要性由学生的决定t测试。*P< 0.05。d的表达PR1,PR2,PR5在SSI2-2突变体。本试验采用RT-PCR定量分析。基因的转录本丰度归一化至内参基因ACTIN2 (AT3G18780)。数据显示为平均值±SD从三个生物重复。实验重复了三次。Arunachal Pradesh,P < 0.01
测试是否SSI2-2突变体改变了病原体的抵抗力,太平洋标准时间DC3000接种到WT和SSI2-2突变体植物。细菌的总数SSI2-2接种后第3天(dpi)叶片显著低于野生型叶片,说明接种后第3天(dpi)叶片显著低于野生型叶片SSI2-2表现出活化的电阻反应(图。1C.).几个致病相关基因的转录水平,包括PR1(AT2G14610),PR2(AT3G57260)和PR5(AT1G75040)的显著通过上调17.6倍,3.1倍和5.3倍,分别在SSI2-2与野生型植物相比(图。1D).这些结果表明SSI2-2与植物抗病有关。
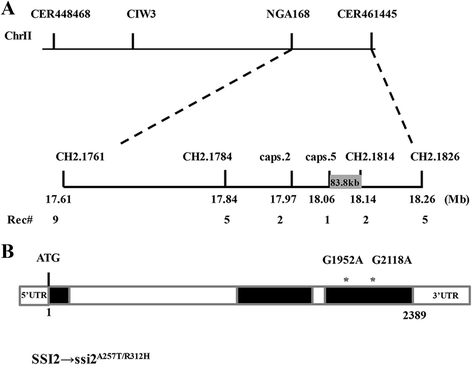
克隆SSI2-2显示了两个核苷酸替换SSI2.编码序列
为了克隆这个基因,一个分离的F2产生大约6,000人的人口。在这个过程中,我们发现所有f1植物显示WT形态,所有F2幼苗在近3:1(134:43)的正常分离中显示出:窄(WT:SSI2-2),表明SSI2-2是由单基因隐性突变引起的。通过粗糙的映射,突变的基因位于NGA168和Cer461445之间的3.4mb区域中的染色体II上。为了促进细微映射,在该地区开发了新的SSLP和帽标记,并产生了20种新的多态性标记物。通过使用这些新开发的标记,将突变的基因精细映射到83.8kb区(图。2A).然后我们设计了62对测序引物对整个候选区域进行重新测序。与Col-0的参考序列数据相比,在编码区域发现了两个单独的点替换SSI2.(AT2G43710),导致A257T和R312H的氨基酸改变(图。2B.).
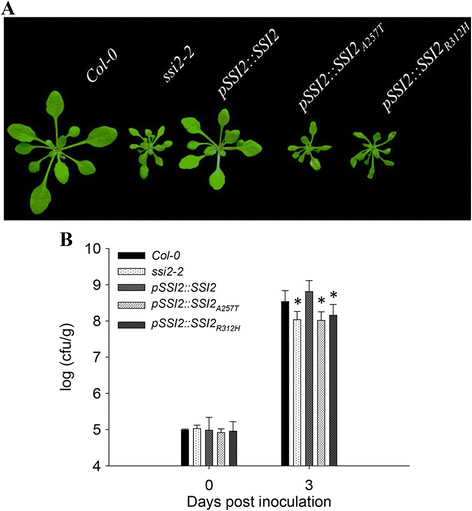
建立与这些突变的直接因果关系,完整SSI2.基因组DNA片段驱动的本地人SSI2.推出推动者SSI2-2植物。观察到正常生长大小pSSI2::SSI2.转基因后代(图。3A),确认生长缺陷SSI2-2是由SSI2.突变。因为SSI2-2在SSI2位点有两个突变,两个不同的突变SSI2.碎片,pSSI2::SSI2.A257T.和pSSI2::SSI2.R312H(附加文件1:图S1c),也被转化为SSI2-2突变体。令人惊讶的是,两个构建体都未补充发育和抗性表型(图。3 a, b),证明这两种氨基酸在SSI2-2是功能SSI2表型的关键。
SSI2.编码硬脂酰-ACP去饱和酶(S-ACP-DES),其催化来自SteAROYL-ACP(18:0-ACP)的油酰-ACP(18:1-ACP)的生产[10.].隐性突变体先前描述的隐性突变体SSI2-1缺乏近90%的这种酶活性,表现出多效表型[10.].的SSI2-1突变体最初被鉴定为一种基因抑制因子NPR1.-5并在没有病原体感染的情况下表现出构成性激活的植物防御反应[26.].基于这些先前的结果和我们目前的分析,我们新分离的等位基因被重新命名SSI2-2.
SSI2-2显示在发育和抗病抵抗中的中间表型
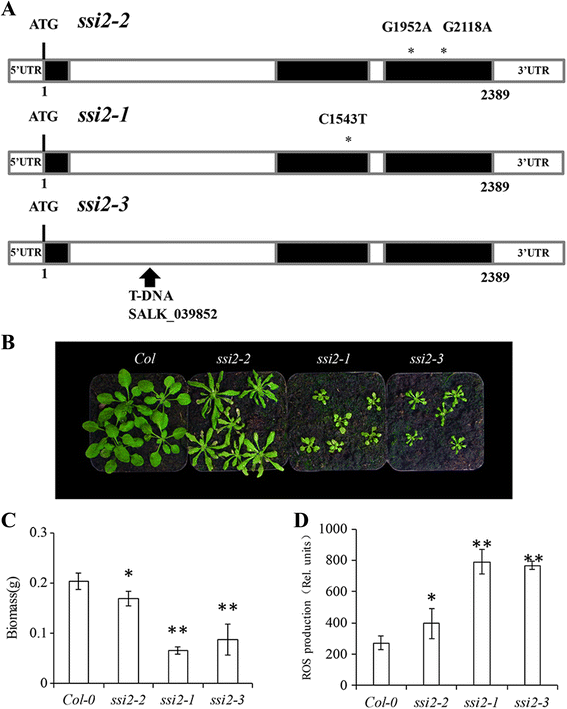
为进一步研究SSI2.我们分析了SSI2-1突变体[10.和T-DNA插入线(命名为SSI2-3.)(额外的文件1:图S1a,b)。基于TAIR数据库中的序列信息,T-DNA插入SSI2-3.位于第一个内含子SSI2.(图。4A).在生长室中培养这些突变体后观察到表型的明显差异。生物量SSI2-1和SSI2-3.与此相比,植物为38.13和51.57%SSI2-2分别(无花果。4 b, c).台盼蓝染色表明所有三个SSI2突变体表现为明显的细胞坏死;三种突变体的坏死区域差异不明显(附加文件)1:图S2)。
等位基因结构和表型差异SSI2-1,SSI2-2和SSI2-3..一个c-to-t突变SSI2-1在核苷酸位置1543处,将氨基酸位置146的亮氨酸(L)改变为苯丙氨酸(F)[10.].TAIR数据库显示T-DNA插入的第一个内含子SSI2.在SSI2-3.(SALK_039852)。b表型与Col-0野生型不同SSI2在22°C的培养室内培养4周。c所示线的生物量分析。野生型和突变体在22℃下培养4周。采用单因素方差分析对数据进行分析,采用多重比较Tukey’s检验(P< 0.05)。每棵植物有9株作为生物复制。dwt (Col-0)叶片中ROS的定量分析SSI2-1,SSI2-2和SSI2-3.植物。叶子直接用10毫米H处理2DCF-DA在37℃PBS中溶解30 min,分离表皮并监测荧光强度。使用ImagePro Plus分析包对ROS进行定量分析
ROS的爆发是植物抗病性的重要标志。活性氧的定量分析表明SSI2-2突变体积累的ROS水平低于SSI2-1和SSI2-3.突变体(无花果。4D).Nitroblue四唑(NBT)和3,3'-二氨基苯二胺(DAB)染色分别检测超氧化物和过氧化物的积累。染色模式确认了ROS定量的模型(附加文件1:图S2)。我们用苯胺蓝染色监测叶组织中胼胝质沉积。突变体的亮蓝色染色表明,所有三个突变系的叶片中都有自发的胼胝质沉积1:图S2)。这些结果与已知的SSI2与病原体抗性之间的联系一致。
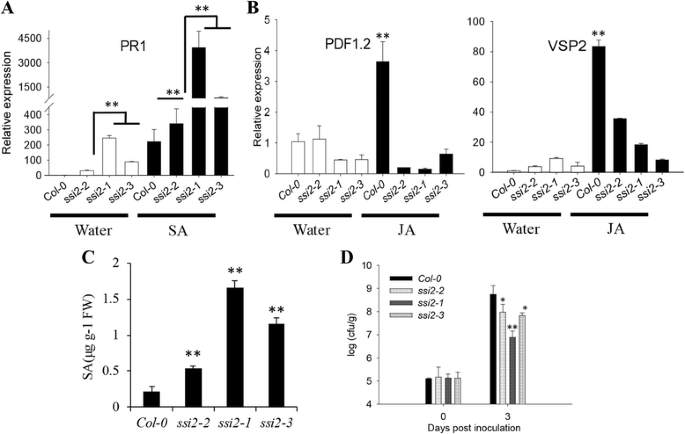
在野生型拟南芥植物,PR.基因可以通过各种类型的生物应力的被激活。PR1是植物中SA信号通路的标记基因[27.].的SSI2-1,SSI2-2和SSI2-3.突变体能够自我激活PR1表达,其分别显示出与野生型植物相比,在没有外源SA的情况下,分别增加了245.5分,29.5%和88.9倍。SSI2.缺陷导致SA信号的结构性激活。外源SA处理后,野生型植株的表达量增加了221.8倍SSI2-1,SSI2-2和SSI2-3.植物的表达量分别增加了3926.8-、340.6-和837.6倍。5),表示PR1表达可以是SA处理后进一步上调。
标记基因表达、SA含量和细菌生长情况在Col-0中存在差异SSI2突变线。col-0和不同SSI2分别用水和50 μM水杨酸(SA)或50 μM茉莉酸(JA)处理突变株,处理24 h后取样品。的表达水平PR1(一个)和PDF1.2,vsp2.(b)所示。本试验采用RT-PCR定量分析。基因的转录本丰度归一化至内参基因ACTIN2 (AT3G18780)。数据显示为平均值±SD从三个生物重复。实验重复了三次。Arunachal Pradesh,P< 0.01。cwt (Col-0)叶片中的SA水平SSI2-1,SSI2-2和SSI2-3.植物。d的增长太平洋标准时间DC3000在野生型和不同的叶子中SSI2培养4周的突变线。细菌接种后,0d时间点代表2小时。数据显示为平均值±SD从三个生物重复。实验重复了三次。重要性由学生的决定t测试。*表示显着差异P< 0.05, **表示在P < 0.01
PDF1.2和vsp2.可以用作JA信号传导的标记基因[28.].的表达PDF1.2在SSI2-2与野生型相似,但在SSI2-1和SSI2-3.突变体,表达PDF1.2显著降低至野生型的0.45倍和0.46倍。外源JA处理后,野生型植株的表达上调约4倍,而野生型植株的表达上调约4倍SSI2-1,SSI2-2和SSI2-3.与野生型相比,突变体增加约0.3倍。也观察到类似的结果vsp2.基因表达分析(图5 b).这些结果与北方印迹结果一致,表明损害了几个JA-Imbible防御反应SSI2-1植物(10.],表明JA信号通路也受损SSI2-2和SSI2-3..
同时测定了突变体叶片中SA含量。如图所示。5度,SSI2-1,SSI2-2和SSI2-3.突变体分别比野生型植物分别具有大约8-,2-和5倍,较高水平。与这些结果一致,所有SSI2突变体表现出抗性表型。野生型叶片的细菌总量比其更高的180.8-,14.7%,14.7%,SSI2-1,SSI2-2和SSI2-3.叶子(图。5 d).在阻力,方面SSI2-1突变体表现出最强的抗性SSI2-2突变体抗性最弱。
SSI2.位于叶绿体中。我们还测定了其亚细胞位置SSI2.在突变体中SSI2-2和SSI2.A257T.,SSI2.R312H突变体。与WT相似,一种含有两个突变氨基酸的蛋白质(SSI2-2)或单一氨基酸突变(SSI2.A257T.,SSI2.R312H)位于叶绿体中(附加文件1:图S3),表示SSI2-2没有影响蛋白质的亚细胞定位。
在18:1含量下降SSI2-2
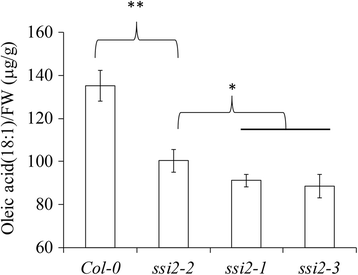
因为SSI2.是S-ACP-DES的一种亚型,可将18:0转换为18:1 [10.], 这SSI2-2突变可能会改变其活性,进而影响18:1的产量。为了检验这一点,我们直接测量了WT和SSI2突变体。在野生型植物中,油酸含量为135.35±7.13μg/ g。相比之下,所有人都观察到显着的减少SSI2突变体(91.2±3 μg/gSSI2-1,100.37±5.41μg/ gSSI2-2和88.71±5.43μg/ g forSSI2-3.).相比之下,SSI2-1和SSI2-3.突变体,SSI2-2突变体具有更高水平的油酸(图。6),表明这一点SSI2-2是弱等位基因。
SSI2调控SA和IAA通路相关基因的表达
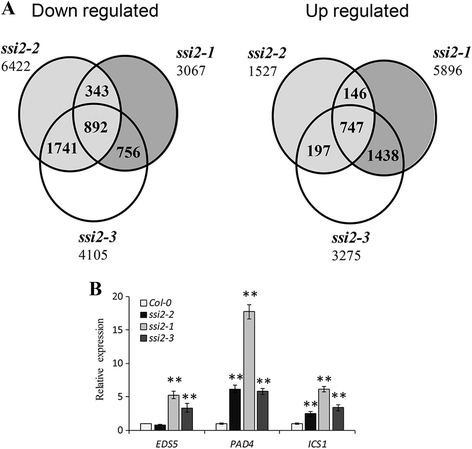
阐明观察到的表型背后的机制SSI2突变体中,RNA测序进行实验(附加文件2:表S1)。与野生型相比,所有突变体中数千个基因的转录水平都出现了显著变化。具体来说,SSI2-2突变体有1527个上调基因和6422个下调基因。共鉴定出上调基因5896个,下调基因3275个,下调基因3067个,下调基因4105个SSI2-1和SSI2-3.分别为突变体(图。7一个).
因为所有三个突变体表现出增加的抗性太平洋标准时间通过对RNA-seq数据的综合分析,在这3个突变体中共发现了747个上调基因和892个下调基因。使用SSI2-2突变体作为中间对照,747个上调基因中有484个表达降低SSI2-2与...相比突变体SSI2-1和SSI2-3.突变体,符合“弱突变体”表型。GO注释被分配到突变系中的差异表达基因,而PANTHER [29.]分析显示在这些基因中的免疫系统过程和SA信号传导途径中的显着富集(附加文件2表S2),这与之前SA途径与低水平油酸相关的结论一致。为了验证RNA-seq实验的数据,以PAD4.(AT3G52430),EDS5(AT4G39030),ICS1(AT1G74710)通过定量RT-PCR测试并表现出相同的表达模式(图。7 b).此外,在分析中显着富集,分类为对几丁质(GO:0010200)和对氮化合物的响应(GO:1901698)的基因,暗示SSI2.也介导了额外的抗性反应。
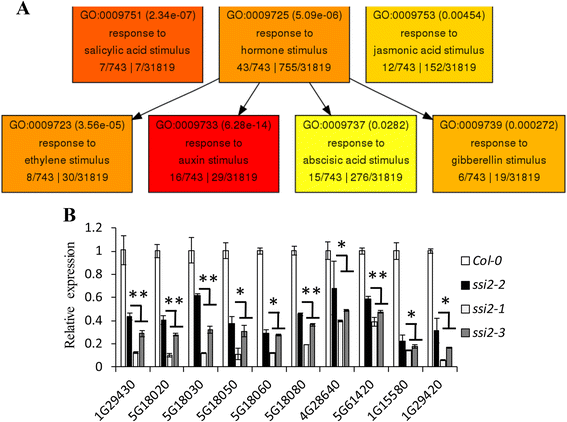
我们试图分析控制发育表型的分子机制SSI2突变体。异常生长表型通常与植物激素密切相关。作者:Agrigo [30.对于与激素相关的GO注释进行分析,892个下调基因的最高富集程度是对生长素刺激的反应(GO:0009733)(图。8),表明还原油酸可能抑制疾病介导的途径,影响发育过程。进一步的分析确定了892个基因中的24个基因是营养素相关的(附加文件2:表S3)。通过使用定量RT-PCR,其中24个中毒素相关基因中的10个抑制较少SSI2-2突变的SSI2-1和SSI2-3.突变体。值得注意的是,Saur20.(AT5G18020),Saur21.(AT5G18030),Saur22.(AT5G18050),Saur23.(AT5G18060),Saur24.(AT5G18080)属于据报道与植物休假尺寸有关的小型植物素UP rna(Saur)基因的亚组[31.].另外两个saur蛋白,SAUR61(AT1G29420)和SAUR62(AT1G29430),在器官发展中发挥作用[32.].IAA5 (AT1G15580)和IAA11(AT4G28640)作为两种早期的养肝诱导的转录因子,在SSI2突变体中也被大大压制。这些结果意味着植物蛋白介导的途径与SSI2介导的途径结合以产生窄叶矮化表型。
讨论
的SSI2-1突变体以前被鉴定为对病原体有抵抗力,并且SSI2-1 NPR1.双突变体是易受太平洋标准时间DC3000。这表明,对太平洋标准时间DC3000是由SSI2-1,依靠NPR1..然而,损耗NPR1.不能抑制SA含量的增加、自发坏死斑的发生和PR.基因在SSI2-1,证明SSI2.也介导npr1独立的途径[26.].的SSI2-2突变体也表现出结构性表达PR.基因(图。1D额外的文件2表S2)、自发性坏死和病原体抗性,表明SSI2-2一个新的等位基因是SSI2..外源性SASSI2突变体增加了表达PR.基因。这些结果,结合事实SSI2.突变体仅对生物营养病原体耐药,对坏死营养病原体高度敏感,表明ssi2介导的耐药主要依赖于SA途径。突变SSI2.可能调控SA信号通路,但不一定参与该通路SSI2.函数的上游EDS1基因[12.].
相比SSI2-1和SSI2-3.突变体,整体增长SSI2-2植株显著升高(Fig.;4 b, c).SSI2-2携带两个不在酶的中心激活区域的氨基酸取代。生长的改善可能是由于较高的酶活性SSI2-2相比于植物SSI2-1和SSI2-3.通过较小的油酸减少支持的植物SSI2-2植物(图。6).一些抗病指标,如叶片活性氧水平,PR.感染后的基因表达水平和菌落数量也处于中间水平SSI2-2突变体,野生型植物之间的突变体SSI2-1和SSI2-3.突变体(图。4和5).这些特征支持这样的结论SSI2-2是一种新的弱突变等位基因SSI2..通过序列比对,得到拟南芥翼257是阿拉220.在蓖麻中,它靠近铁结合螺旋对[33.].铁结合起着中断脂肪酸链的C-H键的关键作用[34.].A257T突变了吗拟南芥干扰铁的结合从而降低酶的活性?目前尚不清楚。通过对蓖麻亚基结构的分析,提出了一种新的蓖麻亚基结构274,对应Arg312在拟南芥,被预测为用Asp相互作用358第8 α-螺旋之后,第2 β-发夹之前[33.].因此,R312H突变SSI2-2被假设以干扰SSI2的结构,导致酶活性降低。
酶活性下降本身似乎不足以解释ssi2介导的抗性。18:1的内容是相似的SSI2-1和SSI2-3.植物,但SA含量SSI2-1树叶比在SSI2-3.叶子,以及抵抗力SSI2-1突变体也明显比的强SSI2-3.突变体。一种解释是,SSI2与其他蛋白质或大分子相互作用,这是SSI2介导的信号转导所必需的。
油酸水平降低与抗病能力之间的关系是什么?在表达谱分析中,考虑到18:1调控叶绿体NO生成的事实,我们重点研究了两个特异性富集的氧化石墨烯项目(对几丁质氧化石墨烯:0010200的响应和对氮化合物氧化石墨烯:1901698的响应)[18.],几丁质被认为是典型的病原体相关分子模式(PAMP) [35.].18:1的低水平可能不仅调控下游的SA信号通路,而且是植物抗性反应的早期信号。
我们还观察到,许多无辛相关基因显示突变体中的转录水平变化(附加档案2:表S3)。具体来说,一些Saur.和国际宇航科学院基因被抑制和通过QPCR确认(图。8 b),表明这些IAA反应基因可能参与SSI2突变体中叶片发育的调节。通常,通过抑制养蛋白信号传导途径来抑制升高的水杨酸抑制病原体生长[36.].由于SSI2突变体激活SA和其他抗病信号传导途径,因此这些途径可能通过未知机制拮抗IAA信号传导途径和调节Saur介导的Saur介导的发育信号传导。
结论
以前的研究表明,在诱导的抗性期间,涉及光合作用的基因和生长下调[37.].然而,很少有研究关注与诱导耐药性相关的成本和权衡。抗病性对产量的限制作用还有待进一步研究。的SSI2-1和SSI2-3.突变体显示Dwarf表型,SACPD基因沉默显着降低大豆植物高度和种子产量[20.].这些结果表明,高疾病性抗性通常以植物为巨大的成本。因此,弱者SSI2-2突变体呈现性和增长之间取得更好的平衡可能是在作物育种一个很大的优势,尤其是在低级脂肪酸的要求,如蔬菜和树木,其中病原体抗性可能对生长影响不大来获得植物。对于在脂肪酸组成方面严格的要求,如菜籽油和玉米作物,我们也可以制定战略,培育具有叶子是油酸低线,但具有包含一个不变的脂肪酸组成,实现种子植物的生长和病原体抗性之间的平衡。因此,我们的研究提供了有效的选择抗病育种策略提供了理论依据。
方法
植物栽培
SSI2-1纯粹的kachroo和salk_039852友好提供突变种子(SSI2-3.)种子取自拟南芥信息资源(http://www.arabidopsis.org).种子的拟南芥首先用5% (v/v)次氯酸钠和75% (v/v)乙醇对col0和Ler-0生态型等突变体进行表面消毒,然后用无菌水彻底清洗6次。4°C光照2 d后,拟南芥种子在土壤或含1% (w/v)蔗糖的1/2 Murashige and Skoog (MS)培养基上生长,并在生长室中培养。生长室控制在120 μmol量子m的辐照度下−2秒−1在22°C, 85%相对湿度下,12小时光照和12小时黑暗循环。营养液每3天灌一次水以维持植物生长。
突变体筛选和基于图谱的克隆
大约30000米2植物在22°C筛选病变模拟表型。孤立的SSI2-2,首先用LER-0交叉纯合突变植物以产生f1后代,然后自花授粉产生F2后代。对20株具有简单序列长度多态性(simple sequence length polymorphisms, SSLPs)的单株进行了体积分离分析,并将1200株窄叶单株进行了SSLPs的PCR扩增,进行了遗传定位。利用SSLPs和衍生的Col-0和Ler-0生态型之间的CAPS标记进行精细定位。引物采用(http://helix.wustl.edu/dcaps/dcaps.html).在基于地图的克隆所使用的引物在其他文件中列出的2:表S4。
转基因植物的产生
为pSSI2::SSI2.转基因株系,一个4.2 kb基因组片段包含SSI2.通过PCR从野生型(COL-0)中扩增启动子区域和编码序列,并插入PCXGFP-P [38.通过TA克隆]载体。我们使用快速诱变系统(FM111-01,Transgen生物技术,北京,CN)产生与基于PCR的突变的单一突变AtSSI2转基因构建。为载体构建的引物在其他文件中列出2:表S5。二元向量转化为SSI2-2用浸花法种植的植物[39.].在含有潮霉素的培养皿上选择转基因植株。通过基因型分析,验证了补体试验的正确性2植物。
定量rt - pcr分析
根据制造商的说明(T9424,Sigma-Aldrich,USA),从100mg植物组织中分离出总RNA与TRI试剂分离。RNA(0.5μg)用于用primescript用于第一链cDNA合成TM带有gDNA橡皮擦的RT试剂盒(中国大连塔卡拉)。采用SYBR®Premix Ex Taq™(Tli RNaseH Plus)在IQ5 Real-Time PCR系统(Bio-Rad, USA)上进行定量PCR。PCR方法如前所述[40].atactin2.的拟南芥被用作内部控制以规范结果。对于每个基因,用三份运行重复QRT-PCR测定至少两次。使用2确定相对表达水平-⊿⊿Ct分析方法。所有被检测基因的引物序列列于附加文件中2:表S5。
植物疾病抗性测定
在抗病性试验中,用强毒喷施28龄植株叶片两pv。番茄DC3000在600nm的光密度为0.2。在含有利福平和/或卡那霉素的含有利福平B培养基的kik的B培养基中生长细菌培养物。接种10 mm mgcl2被用作嘲弄治疗。接种植物用透明的塑料圆顶覆盖,在实验过程中保持湿度。在0和3 DPI下,收获处理过的叶片。将叶子在10mM MgCl中均化2,稀释10.3.- 或104-折叠,并镀在国王的B medium。P. inringae.对分析的每个基因型重复三次重复实验。
DAB,NBT,Trypan Blue和苯胺蓝染色
如前所述进行DAB染色和NBT染色[41.].简单地,将幼苗浸泡在DAB溶液(1mg mL)中−1)和NBT溶液(1mg mL−1将染色后的幼苗转入70% (v/v)乙醇中去除叶绿素后,可以看到褐色和蓝色的斑点,代表h2O2和o.2-,分别。如前所述,用乳酚台班蓝溶液对28 d龄植物的叶子进行染色[42.].使用乙醇(70%v / v)除去叶绿素,然后拍摄叶片。使用苯胺蓝(0.01%)可视化调用沉积(0.01%)2宝4, pH值9.5),如前所述[26.].染色后的叶子在黑暗中储存在50%甘油溶液中,随后使用尼康90I显微镜检查荧光,使用标准滤块紫外荧光UV-2A(激发波长330-380 nm)。
ROS定量
使用2,7-二氯二氢盐 - 荧光素二酸(H.)测定ROS水平(H.2DCF-DA)(海门海门生物技术学院Beyotime研究所)。将叶子直接用10毫米H处理2DCF-DA在37°C PBS中溶解30分钟,分离表皮,在激发波长488 nm和发射波长525 nm监测荧光强度。与之前的研究一样,使用ImagePro Plus软件对ROS进行量化[43.].
叶片脂肪酸(FA)分析和SA定量分析
如前所述进行,进行FA分析[16.].简言之,FA萃取通过在甲醇中放置的叶组织在2mL的3%的硫酸中进行。一个30分钟的温育在80℃后,加入1毫升用0.001%丁基化羟基甲苯的己烷。然后,将己烷相转移到小瓶中用于气相色谱(GC)。所述SA的浓度通过GC-MS分析根据Brader量化等.[44.].
荧光显微镜分析
以GFP为报告基因,研究不同基因等位基因片段的亚细胞定位在Planta..将全长SSI2基因和3个突变片段克隆到载体pEarley103 (Invitrogen公司,美国)中。这些结构被引入A. Tumefaciens.菌株GV3101在烟草表皮中瞬时表达。活体植物成像采用蔡司LSM510 META共聚焦显微镜(Carl Zeiss),使用40× c -色差水浸没物镜。
转录分析
用TRI试剂从4周龄植株中分离总RNA。利用RNA创建cDNA文库,用于Illumina HiSeq™2000测序。RNA测序由上海中国国家人类基因组中心(CHGC,www.hanyubio.com).带有火星的Degseq包(基于MA绘图的方法,随机抽样模型)[45.用于分析数据。包括序列数据集拟南芥col0 unigenes来自TAIR数据库(http://www.arabidopsis.org)被用作用于读取映射的参考基因。Go术语注释和Wego被用于对其推定功能进行分类。每个样品对中的每簇都计算基因表达的差异。FDR值小于0.001和信号强度日志2比率≥1或≤−1,即分别增加或减少2倍,作为显著差异的临界值。
数据处理
通过单向ANOVA进行分析生物量数据,然后进行TUKEY测试。学生分析了定量数据t测试(双尾t等方差检验;以确定野生型和突变型植株之间的显著差异。P < 0.05 is indicated by an asterisk, andP < 0.01 is indicated by two asterisks.
缩写
- 帽子:
-
酶切扩增多态性序列
- 费尔南多-阿隆索:
-
脂肪酸
- FAB2:
-
脂肪酸生物合成2
- NPR1:
-
发病相关基因不表达1
- PAMP:
-
病原体相关的分子模式
- PDF1.2:
-
植物DEFENSIN 1.2
- PR1:
-
PATHOGENESIS-RELATED 1
- QRT-PCR:
-
定量逆转录-PCR
- SA:
-
水杨酸
- 特别行政区:
-
系统获得性耐药
- SSI2:
-
sa不敏感抑制因子2
- SSLP:
-
简单的序列长度多态性
参考
- 1。
Kachroo A,Kachroo P.植物防御中的脂肪酸衍生信号。Annu Rev phytopathol。2009; 47:153-76。
- 2。
Savchenko T,Walley JW,Chehab Ew,Xiao Y,Kaspi R等人。花生酸:一种进化保守的信号分子调节植物应力信号通信网络。植物细胞。2010; 22:3193-205。
- 3。
Rouraboul JM,Fischer SF。需要三烯酸脂肪酸来维持在低温下的叶绿体功能。植物理性。2000; 124:1697-705。
- 4。
伊巴K. Acclimative响应于高等植物温度应力:基因工程的方法对温度耐受性。Annu Rev植物Biol。2002; 53:225-45。
- 5。
作者简介:田中平,男,河北人,博士,主要研究方向为生物医学工程。过氧化亚麻酸产生的丙二醛导致热胁迫植物的蛋白质修饰。植物生理与生物化学。2008;46:786-93。
- 6。
余凯,苏亚瑞斯。G3P与脂质转移蛋白DIR1和AZI1之间的反馈调节回路介导壬二酸诱导的全身免疫。细胞众议员3:1266 2013;78年。
- 7.
Shanklin J,CAHOON EB。脂肪酸的去饱和和相关修饰1. Annu Rev植物理遗。1998年; 49:611-41。
- 8.
王志强,王志强,王志强,等。的拟南芥硬脂酰酰基载体蛋白-去饱和酶家族和叶异构体对油酸合成的贡献。植物学报。2007;63:257-71。
- 9.
研究人员发现,质体脂肪酸水平调节抗性基因依赖的防御信号通路拟南芥.Proc Natl Acad Sci U S A. 2007; 104:7277-82。
- 10.
王志强,王志强,王志强。脂肪酸去饱和酶调节植物防御信号通路的激活。美国国家科学研究院2001;98:9448-53。
- 11.
Kachroo P, Kachroo A, Lapchyk L, Hildebrand D, Klessig DF。修复中有缺陷的串音SSI2突变体:水杨酸、茉莉酸和脂肪酸在ssi2介导信号转导中的作用。微生物与植物的互动。2003;16:1022-9。
- 12.
Kachroo P, Venugopal SC, Navarre DA, Lapchyk L, Kachroo A.水杨酸和脂肪酸去饱和通路在ssi2介导的信号转导中的作用。植物杂志。2005;139:1717-35。
- 13。
Kachroo A,Lapchyk L,Fukushige H,Hildebrand D,Klessig D等人。质量脂肪酸信号传导调节水杨酸 - 和茉莉酸介导的防御途径拟南芥ssi2突变体。植物细胞。2003;15:2952 - 65。
- 14。
Kachroo A, Venugopal SC, Lapchyk L, Falcone D, Hildebrand D,等。油酸水平调节的甘油脂代谢调节防御基因表达拟南芥.中国科学院院刊2004;101:5152-7。
- 15.
夏勇,高启明,于凯,拉普奇克,纳瓦拉,等。植物远端组织中完整的角质层是诱导系统获得性抗性的关键。细胞宿主微生物2009;5:151-65。
- 16。
等。增强的疾病易感性1和水杨酸冗余地调节抗性基因介导的信号。公共科学图书馆麝猫。2009;5:e1000545。
- 17.
石原慎太郎,王志强,王志强,等。拟南芥(Arabidopsis thaliana) ssi2突变体对黄瓜花叶病毒的抗性增强是通过sa独立机制介导的。植物微生物互动学报2004;17:623-32。
- 18.
郑东升,于克华,朱胜,等。油酸依赖的一氧化氮ASSOCIATED1蛋白水平调节一氧化氮介导的防御信号通路拟南芥.植物细胞。2012;24:1654 - 74。
- 19.
江志杰,Shimono M, Maeda S, Inoue H, Mori M,等。对水稻脂肪酸去饱和酶基因OsSSI2的抑制增强了水稻对稻瘟病和叶枯病的抗性。植物微生物互动学报2009;22:820-9。
- 20。
王志强,王志强,王志强,等。油酸介导的途径诱导大豆的结构性防御信号,增强大豆对多种病原菌的抗性。植物与微生物互动学报2008;21:564-75。
- 21。
歌,胡z,li y,li c,peng f等人。小麦硬脂酰-ACP去饱和酶(SACPD)基因的过度表达Tassi2.在拟南芥SSI2突变体对白粉病的抗性减弱。基因。2013;524:220-7。
- 22。
莱特纳Ĵ,詹姆斯DW,Dooner HK,浏览J.改变的身体形态通过增加硬脂酸水平的突变引起拟南芥.植物j . 1994; 6:401-12。
- 23。
吴建军,吴建军拟南芥随着硬脂酸水平增加。植物理性。1994年; 106:1443-51。
- 24.
与诱导抗性相关的成本和权衡。植物病理学杂志。2007;71:3-17。
- 25.
病变模拟突变体:破译植物细胞死亡和防御途径的关键?植物科学进展。2003;8:263-71。
- 26.
Shah J, Kachroo P, Nandi A, Klessig DF。拟南芥的SSI2基因发生隐性突变,PR基因不依赖SA-和npr1表达,对细菌和卵菌类病原体具有抗性。植物j . 2001; 25:563 - 74。
- 27.
关键词:NPR1,核定位,PR基因表达植物细胞。2000;12:2339-50。
- 28.
等。NPR1通过细胞质中的一种新功能调节水杨酸盐和茉莉酸盐依赖的防御途径之间的交叉对话。植物细胞。2003;15:760 - 70。
- 29.
Mi H,Muruganujan A,Thomas Pd。Panther在2013年:在系统发育树上的背景下建模基因功能的演变和其他基因属性。Nucl酸res。2013; 10:377-86。
- 30.
杜Z,周X,凌Y,张Zh,Su Z.Agrigo:农业社区的GO分析工具包。Nucl。酸res。2010; 38:64-70。
- 31.
等。SAUR19亚家族的小生长素UP RNA基因促进细胞扩张。植物j . 2012; 70:978 - 90。
- 32.
Chae K,Isaacs CG,Reeves ph,Maloney GS,Muday GK等人。Arabidopsis小型胃蛋白RNA63促进缺杆子和雄蕊长丝伸长。工厂J. 2012; 71:684-97。
- 33.
Lindqvist Y,Huang W,Schneider G,Shanklin J.Strta9硬脂酰载体蛋白的晶体结构来自蓖麻籽及其与其他二氧化铁蛋白的关系。Embo J. 1996; 15:4081-92。
- 34.
基于叠氮和乙酸配合物的二铁酶Δ9硬脂酰酰基载体蛋白去饱和酶的研究进展中国生物化学杂志。2003;278:25072-80。
- 35.
Lenardon医学博士,Munro CA, Gow NA。几丁质合成与真菌发病机制。微生物学杂志2010;13:416-23。
- 36。
王丹,董欣。水杨酸通过抑制生长素信号通路抑制病原菌在植物体内的生长。咕咕叫医学杂志。2007;17:1784 - 90。
- 37。
Scheideler男,Schlaich NL,Fellenberg K,BEISSBARTH T,豪瑟NC,等人。从监测到看家防御病原体代谢拟南芥开关使用拟南芥cDNA阵列。J Biol Chem。2002; 277:10555-61。
- 38。
陈胜,宋库马平,刘军,王光良。基因克隆和功能基因组学的零背景t载体。植物杂志。2009;150:1111-21。
- 39。
花浸:农杆菌介导的植物转化的一种简化方法拟南芥.植物j . 1998; 16:735-43。
- 40.
Li N,Kong Lg,周WH,Zhang X,Wei St,等。过度表达OS2H16增强植物病变和水稻干旱胁迫的耐受性。植物细胞组织兽人崇拜。2013; 115:429-41。
- 41。
Shi H,Ye T,Chen F,Cheng Z,Wang Y等。氨基酶表达的操纵调节拟南芥中的非生物胁迫耐受性:对精氨酸代谢和ROS积累的影响。J Exp Bot。2013; 64:1367-79。
- 42。
高QM,Venugopal S,Navarre D,Kachroo A.低油酸酸型抑制茉莉酸诱导的防御反应需要WRKY50和WRKY51蛋白。植物理性。2011; 155:464-76。
- 43。
Golani Y, Kaye Y, Gilhar O, Ercetin M, Gillaspy G, et al.;肌醇聚磷酸磷脂酰肌醇5-磷酸酶9 (At5PTase9)通过调节细胞内吞作用来控制植物的耐盐性。摩尔。2013;6:1781 - 94。
- 44。
MAP激酶MKK2激酶对拟南芥抗病能力的影响。植物与微生物的相互作用。2007;20:589-96。
- 45。
基于RNA-Seq的哺乳动物转录组的定位和定量研究。Nat方法。2008;5:621-8。
致谢
我们非常感谢美国肯塔基大学prdeep Kachroo教授的提供SSI2-1突变体种子。
资金
本研究由山东省现代农业技术产业体系项目(SDAIT-17-06)和山东省自然科学基金项目(ZR2015CM004)资助。Z.C.获山东省泰山学者计划资助。公司获得台山市产业专家计划(20150621)资助。
提供支持数据的可用性
支持这篇文章的结果数据集包括在项目和其他文件中。的核酸序列SSI2-2提供NCBI的数据库,其中包含登录号ku950361(http://www.ncbi.nlm.nih.gov/nicerotide.).支持本文结果的RNA-seq数据可在NCBI的SRA中获得,登录号为SRP072265 (http://www.ncbi.nlm.nih.gov/sra/).
作者的贡献
ZC和XD设计了实验。WY、RD、LL、ZH和JL进行了试验。WY、RD、YW和XD分析数据。文寅、LL、ZH、ZC共同撰写稿件。所有作者阅读并批准了最终的手稿。
利益争夺
两位作者宣称他们没有相互竞争的利益。
同意出版物
不适用。
伦理批准和同意参与
不适用。
作者信息
隶属关系
相应的作者
附加文件
附加文件1:图S1。
突变体试验和转基因植物确认。图S2。col0和不同的ssi2突变株细胞学染色。图S3。14个生长素相关基因的定量RT-PCR分析。图S4。SSI2和突变片段的亚细胞定位。(PPTX 1923 kb)
附加文件2:表S1。
带有RNA-seq数据的EXCEL文件。表S2。去分析484个上调基因。表S3。几种SA和IAA途径基因的转录分析数据。表S4。用于图谱克隆的引物。表S5。用于载体构建和突变体分析的引物。(XLSX 7942 kb)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
杨伟,董锐,刘磊。et al。一种新的突变等位基因SSI2.赋予抗病性,植物生长抑制之间的更好的平衡拟南芥.BMC植物BIOL.16,208(2016)。https://doi.org/10.1186/s12870-016-0898-x
收到了:
接受:
发表:
关键字
- 生长素
- 叶形状
- 植物免疫
- Stearoyl-acp去饱和酶
- 水杨酸