- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发表:gydF4y2Ba
在可逆性的黑暗诱导的碳水化合物消耗中,氮的再调动有利于不定根的形成gydF4y2Ba矮牵牛织布达gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba16.gydF4y2Ba, 文章编号:gydF4y2Ba219gydF4y2Ba(gydF4y2Ba2016年gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
腋下枝条切割中的不定根(AR)形成是用于观赏繁殖的关键生理过程,用于幼苗的全球生产链中使用。在该方法中,切割的氮和碳水化合物代谢由其总氮含量调节(ngydF4y2BatgydF4y2Ba),在不同的生产部位和阶段,通过特定的可塑性来重新调整代谢物库的运输和辐照水平的暗曝光。在这里,我们检查了NgydF4y2BatgydF4y2Ba具有组合暗暴露的扦插的内容物影响其内部N池,包括游离氨基酸,并考虑了AR形成的早期解剖事件以及进一步的根本发育gydF4y2Ba矮牵牛织布达gydF4y2Ba岩屑。gydF4y2Ba
结果gydF4y2Ba
增强NgydF4y2BatgydF4y2Ba无根扦插可提高叶片和基部的游离氨基酸含量,特别是谷氨酸和谷氨酰胺含量。移动n池的n分配增加,而不溶性蛋白- n分配减少。扦插的黑暗暴露保存了原始NgydF4y2BatgydF4y2Ba降低了不溶性蛋白质氮,提高了可溶性蛋白质、氨基和酰胺氮。叶片中氨基酸的增加主要包括天冬酰胺(asn)、天冬氨酸(asp)和精氨酸(arg),对高氮供应有明显的组织特异性反应。黑暗暴露诱导早期短暂的asp上升,随后短暂的glu增加。高氮强正氮效应gydF4y2BatgydF4y2Ba观察384 h后AR形成过程中岩屑的含量。根分生组织细胞在72 h发育,两种氮处理的差异可以忽略不计gydF4y2BatgydF4y2Ba的水平。168小时后,一个增强的ngydF4y2BatgydF4y2Ba加速AR形成并产生第一个明显的完全开发的根源,同时仅形成了单位的单位gydF4y2BatgydF4y2Ba.然而,168h的暗曝光促进了AR的形成,特别是在低氮的岩屑中gydF4y2BatgydF4y2Ba在一定程度上使NgydF4y2BatgydF4y2Ba几乎是补偿。暗曝光和低氮的组合gydF4y2BatgydF4y2Ba扦插在形成过程中强烈降低芽增长。gydF4y2Ba
结论gydF4y2Ba
结果表明增强型ngydF4y2BatgydF4y2Ba扦插的含量和暗暴露增强了茎基的N信号和移动N资源,促进了叶片衰老相关的蛋白质水解。基于我们的结果,我们假设了氮的移动伴随碳水化合物消耗的模型及其对AR形成的意义。gydF4y2Ba
背景gydF4y2Ba
不定根的形成是一个复杂的生理过程,在园艺、农林业中具有重要的经济意义。观赏植物的繁殖依赖于通过扦插生根的全球化链,确保有效利用有利的外部和内部因素。整个过程包括三个阶段:供体植株上的腋芽和芽的生长(成熟茎尖的反复切除即扦插),随后的扦插运输(即运输、储存)以及扦插到生根培养基中。在这个过程中,强烈的转录组和代谢变化发生,氮的有效性、暗照射和不同的辐照水平非常重要。因此,相互作用的调节迫使氮素和碳水化合物的代谢适应腋芽和茎生阶段,暗诱导的扦插衰老,胁迫恢复日光下的扦插和AR的形成。已经表明,供体植物的氮同化水平改变了氮通量,并重新平衡了碳水化合物和氨基酸的库[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].此外,蛋白质的降解和重新合成能够存活无源切割,并且需要缺失根器官的再生所需的。由于AR形成依赖于选择性蛋白质和重新合成蛋白质,因此切屑中的总氮库存构成了关键限制因子[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4GydF4y2Ba].有趣的是,AR形成与侧根之间既有相似之处,也有不同之处[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6克ydF4y2Ba特别是对植物体内缺氮和乙烯信号转导和合成的影响。缺氮会刺激已具有完整根系的无梗植物的侧根。然后侧根形成开始于细胞对外部氮信号的高度特异性反应,这些信号指向营养丰富的土壤斑块,以确保养分获取[gydF4y2Ba7gydF4y2Ba].相比之下,切除的腋窝射击尖端(即切割),例如矮牵牛切割体经验伤害和隔离,因此仅依赖于具有特异性转录组和代谢物的射击信号[gydF4y2Ba8gydF4y2Ba- - - - - -gydF4y2Ba10.gydF4y2Ba].当血管连续体崩溃时,生长素积累并诱导茎基组织中AR的形成[gydF4y2Ba11.gydF4y2Ba].AR形成的初级植物素控制取决于一氧化氮,多胺和乙烯等次级信号[gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba13.gydF4y2Ba].最近,据报道了氨基转移酶蛋白质以协调激素乙烯和养蛋白的生物合成[gydF4y2Ba14.gydF4y2Ba].此外,植物蛋白触发雷帕内蛋白复合物的植物靶标的植物靶,其在初级商品中表达,并通过调节蛋白质翻译整容养蛋白和营养信号传导[gydF4y2Ba15.gydF4y2Ba].因此,氮资源对扦插茎基的蛋白质合成至关重要,其中主要的氨基酸包括谷氨酰胺(gln),谷氨酸(glu),天冬酰胺(asn)和天冬氨酸(asp) [gydF4y2Ba8gydF4y2Ba,gydF4y2Ba16.gydF4y2Ba].碳水化合物储备和一氧化氮(NO)增强植物组织的复原力和暗衰老的存活[gydF4y2Ba17.gydF4y2Ba- - - - - -gydF4y2Ba19.gydF4y2Ba].作为AR形成取决于蛋白质重新合成[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4GydF4y2Ba从可移动或回收的氮储备,如asn [gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21.gydF4y2Ba]这些可能是在N缺乏的情况下限制,导致加速叶片衰老[gydF4y2Ba22.gydF4y2Ba,gydF4y2Ba23.gydF4y2Ba]不同于侧根形成,在这方面[gydF4y2Ba24.gydF4y2Ba,gydF4y2Ba25.gydF4y2Ba].迄今为止,天竺葵、菊花、一品红和月季都显示了AR形成的氮和碳水化合物限制[gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba- - - - - -gydF4y2Ba28.gydF4y2Ba].高氮含量的增强型Ar形成可能与碳水化合物的增加的副胎儿转运[gydF4y2Ba26.gydF4y2Ba]和含氮化合物[gydF4y2Ba20.gydF4y2Ba在对转录组、激素和代谢适应等因果机制了解有限的情况下。使用gydF4y2Ba矮牵牛织布达gydF4y2Ba作为模型植物,建立了AR形成的三个代谢阶段[gydF4y2Ba9gydF4y2Ba在此期间,氮供应维持在适当的水平。有报道称,在扦插的黑暗暴露过程中,碳水化合物的动态消耗和补充,然后在光下生根,对根系形成有刺激作用[gydF4y2Ba29.gydF4y2Ba].此外,在充足的氮水平下,吲哚-3-乙酸(IAA)的早期增加表明极性生长素运输(PAT)对AR的形成有很强的贡献。gydF4y2Ba在佩妮gydF4y2Ba[gydF4y2Ba16.gydF4y2Ba].此外,在水槽建立阶段期间,胃苷输送系统中的多发性转录组变化,蟾蜍蛋白缀合和养肝信号感知作为AR形成的关键调节器[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba16.gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31.gydF4y2Ba].在库侧氨基酸和氮库提供了重要的氮资源,以满足蛋白质再合成的新需求。此外,氮素资源的变化也可能对生长素水平产生影响。据推测,在断枝切除之前,包括细胞分裂素(CK)在内的各种信号激素将氮的有效性从供体植物的根传递给腋芽[gydF4y2Ba32.gydF4y2Ba]他们的活性可以部分地与谷氨酰胺新陈代谢有关[gydF4y2Ba33.gydF4y2Ba].CK被认为是生长素拮抗剂和AR形成的重要负调控因子[gydF4y2Ba34.gydF4y2Ba]这将通过针对PIN活动的下调来抵消助长分布[gydF4y2Ba35.gydF4y2Ba].相比之下,CK的早期诱导期间,CK的视为用于去诊断过程的重要信号[gydF4y2Ba4GydF4y2Ba],是不定根尖静止中心形成过程中生长素运输和生物合成的微调所必需的[gydF4y2Ba36.gydF4y2Ba].在这方面,CK和赤霉素的茎尖水平都随着根系氮素供应中断而下降[gydF4y2Ba37.gydF4y2Ba].氮素代谢与植物激素信号转导相互作用的复杂性,可能解释了对供体植株氮素营养和扦插暗照射对氮素代谢和AR形成影响的信息缺乏。因此,本研究验证了NgydF4y2BatgydF4y2Ba扦插的含量和暗暴露影响其内部的n -库,包括游离氨基酸,并影响AR形成的早期事件和进一步的根系发育gydF4y2Ba矮牵牛织布达。gydF4y2Ba
结果gydF4y2Ba
不同氮含量下AR形成早期事件的解剖gydF4y2Ba
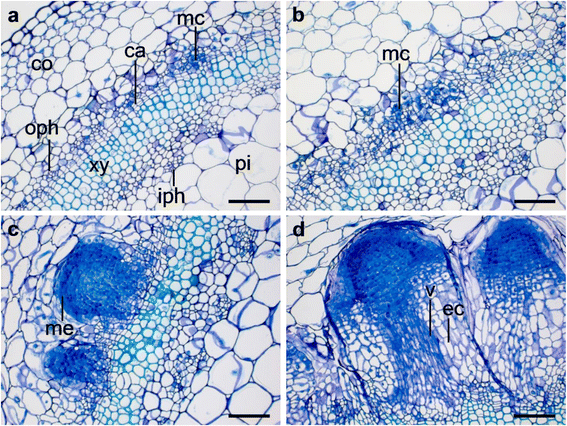
组织学检查显示,在具有两个不同总氮的切屑的茎基部分的72个HPIN中,在具有致密细胞质和致密细胞质的小细胞和大核的小细胞的第一营养细胞在具有两种不同的总氮的茎基截面中可见gydF4y2BatgydF4y2Ba(N)内容gydF4y2BatgydF4y2Ba-low: 2570 μmol NgydF4y2BatgydF4y2BaggydF4y2Ba−1gydF4y2BaDM,N.gydF4y2BatgydF4y2Ba-high: 3625 μmol NgydF4y2BatgydF4y2BaggydF4y2Ba−1gydF4y2BaDM)(无花果。gydF4y2Ba1AgydF4y2Ba,gydF4y2BabgydF4y2Ba).此时两种氮含量差异不大,但在168 hpin时两种氮含量差异显著gydF4y2BatgydF4y2Ba的水平。虽然在带有低n的扦插中gydF4y2BatgydF4y2Ba只有Metistems的级别形成为最先进的结构(图。gydF4y2Ba1CgydF4y2Ba),高氮处理gydF4y2BatgydF4y2Ba水平导致根部形成,具有伸长区的第一电池特性(图。gydF4y2Ba1DgydF4y2Ba).gydF4y2Ba
总氮总氮对AR形成早期细胞学事件的影响gydF4y2Ba矮牵牛织布达gydF4y2Ba.具有两个氮水平的切割(面板gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba) N-低在2570 μmol NgydF4y2BatgydF4y2Ba(面板gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba) N高在3625 μmol NgydF4y2BatgydF4y2Ba被从供体植物中切除,立即插入珍珠岩中,用同化光形成AR。所有显微照片都是茎基部从切除部位上方1-4毫米处的横切面,最先进的结构在(面板)处gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba) 72小时后切除(hpe)和插入(hpin)和(面板gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)168 HPE和HPIN。72个HPIN的部分(面板gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)显示典型的茎解剖结构,包括皮层(co)、外韧皮部(oph)、形成层(ca)、木质部(xy)、内层韧皮部(iph)、髓薄壁组织(pi)和发育中的根分生组织的第一分生组织细胞(mc),即具有致密细胞质和大核的小细胞。氮含量之间只有细微的差别。168 hpin的部分显示低氮吸收(面板gydF4y2BacgydF4y2Ba)首先出现Fout Root Meristems(Me),而高N吸收(面板gydF4y2BadgydF4y2Ba)第一个根的维管束(v)在中心被拉长细胞(ec)的延伸区是可见的。条形代表100 μm(面板)gydF4y2Ba一个gydF4y2Ba到gydF4y2BadgydF4y2Ba).备注:Ahkami等人。[gydF4y2Ba8gydF4y2Ba]表明,在切除(0 HPE)时,没有产生开发根商品的共同统计学分列。进一步的详细信息以方法和附加文件呈现gydF4y2Ba1gydF4y2Ba)钻头预处理的实验和附加文件gydF4y2Ba2gydF4y2Ba的实验设计说明gydF4y2BaExp。7:ar-n + cytgydF4y2Ba, 分别gydF4y2Ba
氮气池响应Cuttings的总N吸收gydF4y2Ba
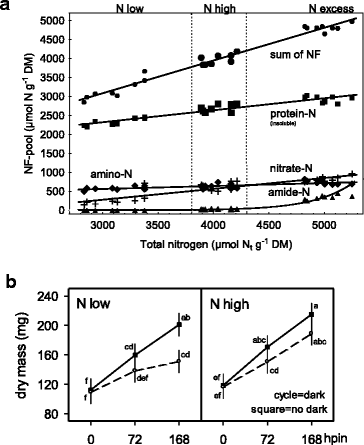
表征N的范围gydF4y2BatgydF4y2Ba不同施氮量(NgydF4y2BadgydF4y2Ba监测给供体植物的制度(ngydF4y2BadgydF4y2Ba低NgydF4y2BadgydF4y2Ba- NgydF4y2BadgydF4y2Ba-过量:55/90/179毫克氮植物gydF4y2Ba−1gydF4y2Ba周gydF4y2Ba−1gydF4y2Ba)(图。gydF4y2Ba2AgydF4y2Ba).NgydF4y2BatgydF4y2Ba整个插枝的含量以干质量(DM)为基础进行测定(2组样品,4个生物重复,gydF4y2BangydF4y2Ba = 24). The NdgydF4y2Ba低NgydF4y2BadgydF4y2Ba-和NgydF4y2BadgydF4y2Ba-过量处理产生NgydF4y2BatgydF4y2BaN为3112±187、4034±107、5004±119 μmol NgydF4y2BatgydF4y2BaggydF4y2Ba−1gydF4y2Ba分别DM。考虑所有24个样本,NgydF4y2BatgydF4y2Ba在2800到5300 μmol g之间变化gydF4y2Ba−1gydF4y2BaDM(无花果。gydF4y2Ba2AgydF4y2Ba).分配ngydF4y2BatgydF4y2Ba酰胺-N、氨基-N、硝酸盐-N和不溶蛋白-N与N呈显著正相关gydF4y2BatgydF4y2Ba,如NgydF4y2BatgydF4y2Ba和除酰胺-N之外的每个NF池。amide-n对于n仍然很低gydF4y2BadgydF4y2Ba-low (<1 μmol ggydF4y2Ba−1gydF4y2Badm)和ngydF4y2BadgydF4y2Ba-high(27±11μmolggydF4y2Ba−1gydF4y2BaDM)施肥水平,但陡峭地升高约12倍,电源过多(340±61μmolggydF4y2Ba−1gydF4y2BaDM)。硝酸盐-N范围从140到960μmolggydF4y2Ba−1gydF4y2BaDM是最不断增加的NF池(〜7倍的增加),然后是蛋白-N作为最丰富的NF池,而氨基-N在最低范围内最稳定(Δn= 500-800 =300μmolggydF4y2Ba−1gydF4y2BaDM)。gydF4y2Ba
(面板gydF4y2Ba一个gydF4y2Ba)土壤全氮积累的关系gydF4y2BatgydF4y2Ba)和N分配给NF池。腋下射击尖端gydF4y2Ba矮牵牛织布达gydF4y2Ba在切除时间,ngydF4y2BatgydF4y2Ba在3种氮水平下,代谢nf库的分配分为酰胺-N、氨基-N、不溶蛋白-N和总和gydF4y2BadgydF4y2Ba对供体植物的施肥(n低,n高,镍余量)。硝酸盐-N的线性相关系数(gydF4y2Bar =gydF4y2Ba 0.91), amide-N (r =gydF4y2Ba0.88), amino-N (gydF4y2Bar =gydF4y2Ba0.74)、不溶性蛋白- n (gydF4y2Bar =gydF4y2Ba 0.96) and sum of NF-pools (r =gydF4y2Ba 0.99) allngydF4y2Ba = 24,pgydF4y2Ba< 0.05。(面板gydF4y2BabgydF4y2Ba) AR形成过程中茎干质量(hpin)的增加对两种氮水平的响应gydF4y2BadgydF4y2Ba对供体植物的施肥(N低,N高)和扦插预生根暗暴露(暗暴露 - 开放式圆圈符号,没有深度平方符号)。垂直条表示平均值和不同小写字母的95%置信区间表示显着差异。实验的进一步细节,回归方程和统计数据以方法和附加文件呈现gydF4y2Ba1gydF4y2Ba)凹陷预处理的实验,附加档案gydF4y2Ba2gydF4y2Ba用于统计分析的实验设计说明及附加文件gydF4y2Ba3.gydF4y2BaPanel图2的补充数据gydF4y2Ba一个gydF4y2Ba:gydF4y2BaExp。1:nf-ngydF4y2Ba和面板gydF4y2BabgydF4y2Ba:gydF4y2BaExp。9:NF-NDCRgydF4y2Ba, 分别gydF4y2Ba
AR形成时的生长gydF4y2Ba
在珍珠岩插入的3个时间点(插入后0,72,168 hpin =小时),分析了在白天光照下AR形成过程中离体插枝的茎干质量积累(图2)。gydF4y2Ba2B.gydF4y2Ba).提前进行低氮和高氮扦插gydF4y2BatgydF4y2Ba内容(NgydF4y2BatgydF4y2Ba低NgydF4y2BatgydF4y2Ba-high: 2900/3500 μmol NgydF4y2BatgydF4y2BaggydF4y2Ba−1gydF4y2Ba从两种施肥速率(NgydF4y2BadgydF4y2Ba- 球和ngydF4y2BadgydF4y2Ba-高:46/78毫克氮植物gydF4y2Ba−1gydF4y2Ba周gydF4y2Ba−1gydF4y2Ba).此外,将切割暴露于暗(168hpe =小时后发出的小时)。两者,没有和黑暗暴露的切屑在0个HPIN的初始干肿块中没有不同的不同,而高NgydF4y2BatgydF4y2Ba含量增强干质量+ 10%作为显着的主要N效应。干肿块主要加速,随着+ 79%的+ 79%的插入时间增加了168个Hpin。在暗暴露后,这种增加降低至+ 50%,而低N切屑的延迟在168个HPIn最明显。gydF4y2Ba
AR形成,氮吸收减少,岩屑显露黑暗gydF4y2Ba
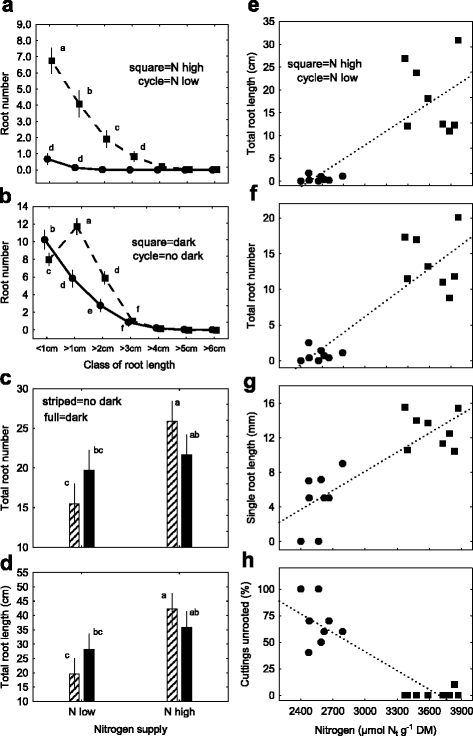
不同N剂量对供体植物的影响(ngydF4y2BadgydF4y2Ba低NgydF4y2BadgydF4y2Ba-high:51/106 mg n植物gydF4y2Ba−1gydF4y2Ba周gydF4y2Ba−1gydF4y2Ba对N)gydF4y2BatgydF4y2Ba(NgydF4y2BatgydF4y2Ba低NgydF4y2BatgydF4y2Ba-high: 2575/3629 μmol NgydF4y2BatgydF4y2BaggydF4y2Ba−1gydF4y2BaDM)和AR的形成进行分析。每次刈割第16天(384 hpe =刈割后小时)的总根数(TRN)差异显著,低氮和高氮分别达到0.83和13.84gydF4y2BatgydF4y2Ba内容,分别(无花果。gydF4y2Ba3AgydF4y2Ba).为了进行详细的分析,我们将一次切割的所有根(即TRN)分配给7个根长度类,以确定每个长度类的根数(RNC)。高氮促进根系发育gydF4y2BatgydF4y2Ba内容在低于3cm的长度等级中变得明显(trn =σrnc= 13.8 = 6.8 + 4.1 + 1.9 + 0.8 + 0.2 + 0 + 0),并且用低n观察到显着的减少gydF4y2BatgydF4y2Ba内容(TRN =∑RNC = 0.83 = 0.68 + 0.14 + 0.01 + 0 + 0 + 0 + 0)。随后,研究了扦插生根前暗暴露对高氮条件下AR形成的影响gydF4y2BadgydF4y2Ba提供给供体植株以防止扦插时氮的限制(图。gydF4y2Ba3B.gydF4y2Ba).取下的岩屑置于黑暗中7天(168 hpe),然后插入珍珠岩。切割后16天(384 hpe),每次切割的TRN为26.8根。同时(384 hpe),当不施暗剂时,根的发育明显减少(TRN = 19.9),切除后立即进行珍珠岩插入。RNC分析表明,预生根暗处理是增加第2和第3类根数的先决条件。然而,没有黑暗暴露的插枝在第一类<1 cm的植株上平均多发育2根(图1)。gydF4y2Ba3B.gydF4y2Ba).结果表明,在低施氮和高施氮条件下,384 hpe增强AR形成,TRN增加73%(15比26),TRL增加110%(20比42 cm根长)gydF4y2BadgydF4y2Ba低NgydF4y2BadgydF4y2Ba-high:55/90 mg n植物gydF4y2Ba−1gydF4y2Ba周gydF4y2Ba−1gydF4y2Ba分别)分别(图。gydF4y2Ba3CgydF4y2Ba,gydF4y2BadgydF4y2Ba).在同一试验中,供体植株施氮量和暗照射组合处理,低氮扦插的TRN增加了+ 30%,TRL增加了+ 40%gydF4y2BatgydF4y2Ba而高氮的扦插gydF4y2BatgydF4y2Ba根稍少(- 14%),根较短(- 15%)(图。gydF4y2Ba3 c, dgydF4y2Ba).NgydF4y2BatgydF4y2Ba含量范围为2400 ~ 3900 μmol NgydF4y2BatgydF4y2BaggydF4y2Ba−1gydF4y2BaDM NgydF4y2BadgydF4y2Ba- 球和ngydF4y2BadgydF4y2Ba-高剂量(51/106毫克氮植物gydF4y2Ba−1gydF4y2Ba周gydF4y2Ba−1gydF4y2Ba)分别没有暗暴露(图。gydF4y2Ba3EgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba).回归分析结果为NgydF4y2BatgydF4y2Ba使用TRL,TRN和单根长度(SRL)(图。gydF4y2Ba3EgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba),在384 hpe处无根插枝百分率为负值(图。gydF4y2Ba3h.gydF4y2Ba).gydF4y2Ba
不定根形成384 hpe与插枝gydF4y2Ba矮牵牛织布达gydF4y2Ba: (控制板gydF4y2Ba一个gydF4y2Ba)每个长度类(RNC)的根数(RNC),具有两种水平的总氮含量(ngydF4y2BatgydF4y2Ba)(循环= n低,方块= n高)。(面板gydF4y2BabgydF4y2Ba) RNC对暗曝光的响应(方形=暗,周期=不暗)。(面板gydF4y2BacgydF4y2Ba和gydF4y2BadgydF4y2Ba)总根数字(TRN)和总根长度(TRL)的响应在两个n的组合上gydF4y2BatgydF4y2Ba水平和深色曝光(条纹条=不深色,全条纹=深色)。(面板gydF4y2BaegydF4y2Ba到gydF4y2BahgydF4y2Ba) N之间的回归关系gydF4y2BatgydF4y2Ba不同氮水平下无根扦插苗的含量及其最终根的发育gydF4y2BadgydF4y2Ba施肥水平给供体植物(循环= N低,方块= N高)(E:总根长度 - TRL,F:总根数 - TRN,G:每单根平均长度 - SRL,H:Ofrooted Cuttings -URC。(面板gydF4y2Ba一个gydF4y2Ba到gydF4y2BacgydF4y2Ba)垂直条表示平均值的95%置信区间,不同的小写字母表示显着差异。(面板gydF4y2BaegydF4y2Ba到gydF4y2BahgydF4y2Ba线性相关系数:面板gydF4y2BaegydF4y2Ba(gydF4y2Bar =gydF4y2Ba 0.82), PanelfgydF4y2Ba(gydF4y2Bar =gydF4y2Ba 0.88), PanelggydF4y2Ba(gydF4y2Bar =gydF4y2Ba 0.84) and PanelhgydF4y2Ba(gydF4y2Bar =gydF4y2Ba0.89)gydF4y2BangydF4y2Ba= 16,gydF4y2BapgydF4y2Ba< 0.05。进一步的实验细节,生根评级(范围每类根长= 1厘米),统计和回归方程是在方法和附加文件gydF4y2Ba1gydF4y2Ba)凹陷预处理的实验,附加档案gydF4y2Ba2gydF4y2Ba用于统计分析的实验设计说明及附加文件gydF4y2Ba3.gydF4y2Ba)面板图3的补充数据gydF4y2Ba一个gydF4y2Ba:gydF4y2BaExp。7:ar-n + cytgydF4y2Ba;面板gydF4y2BabgydF4y2BaExp。4:AR-DgydF4y2Ba;面板gydF4y2BacgydF4y2Ba和gydF4y2BadgydF4y2Ba:gydF4y2BaExp。2:AR-NDgydF4y2Ba和面板gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba:gydF4y2BaExp 7: AR-N + CYT,gydF4y2Ba分别gydF4y2Ba
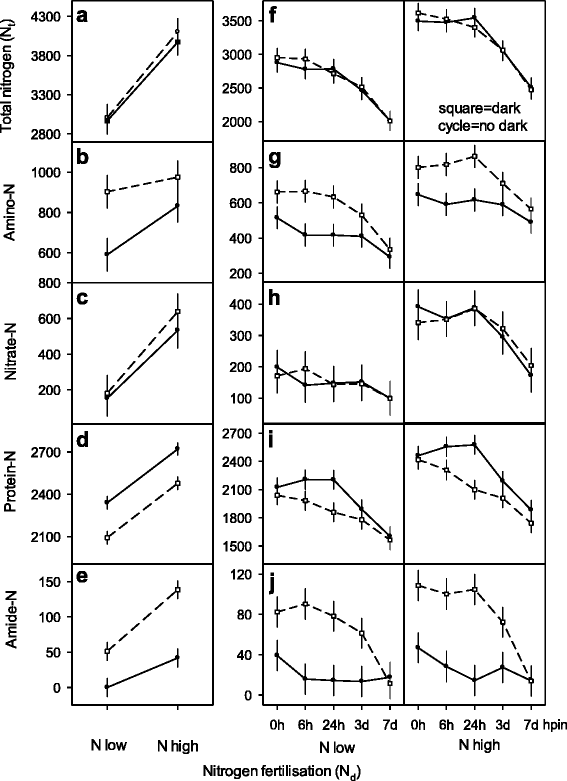
氮含量和N型分配在未加速切割和ar形成期间gydF4y2Ba
低氮和高氮施肥制度(NgydF4y2BadgydF4y2Ba)供体植物导致两种不同的ngydF4y2BatgydF4y2Ba切屑的吸收水平同时切割的暗暴露(如图1中的虚线所示)。gydF4y2Ba4GydF4y2Ba)仍然对n没有任何影响gydF4y2BatgydF4y2Ba内容(图。gydF4y2Ba4AgydF4y2Ba,gydF4y2BafgydF4y2Ba).相比之下,在将切屑被种植(插入)到珍珠岩上并暴露于昼夜光,插入后的较长时间导致N的连续减少gydF4y2BatgydF4y2Ba即刻种植和深色预暴露扦插苗的含量(图。gydF4y2Ba4F.gydF4y2Ba).分配(N)gydF4y2BatgydF4y2Ba对单个nf -pool的影响差异很大gydF4y2BadgydF4y2Ba水平,黑暗暴露)。氨基- nf积累了12 - 25%的NgydF4y2BatgydF4y2Ba,两者都提高了NgydF4y2BadgydF4y2Ba水平和暗暴露在切除的切屑(0HPE)和暗暴露的切割中增加氨基-N(168 HPE)(图。gydF4y2Ba4B.gydF4y2Ba,gydF4y2BaggydF4y2Ba).随着插入时间的延长,氨基氮不断减少(图2)。gydF4y2Ba4GgydF4y2Ba).5 - 18%的氮gydF4y2BatgydF4y2Ba被分配到2ngydF4y2BadgydF4y2Ba水平,切屑的暗暴露未改变硝酸盐-N含量(图。gydF4y2Ba4C.gydF4y2Ba,gydF4y2BahgydF4y2Ba).相比之下,NgydF4y2BadgydF4y2Ba水平和增加后插入后的时间导致硝酸盐-N的不同减少(图。gydF4y2Ba4h.gydF4y2Ba).不溶性蛋白- nf含量最高,占氮的50 - 70%gydF4y2BatgydF4y2Ba(无花果。gydF4y2Ba4D.gydF4y2Ba,gydF4y2Ba我gydF4y2Ba).增加的N供应增强蛋白-NF,然后在两个暗中暗暴露时减少gydF4y2BadgydF4y2Ba供应水平(图。gydF4y2Ba4D.gydF4y2Ba).黑暗处理随着插入后时间的延长和白天光照的暴露,加速了随后的蛋白- nf的减少。与NgydF4y2BadgydF4y2Ba水平上,有暗处理和没有暗处理的岩屑间差异最大。最后,不管暗处理与否,蛋白质- nf同样将168 hpin降低到最低水平(图。gydF4y2Ba4I.gydF4y2Ba).酰胺-N是最小的nf -池,只积累0 - 3.5%的NgydF4y2BatgydF4y2Ba(无花果。gydF4y2Ba4EgydF4y2Ba,gydF4y2BajgydF4y2Ba).NgydF4y2BadgydF4y2Ba水平和暗暴露在黄色暴露的切屑(168 HPE)中,在切除的切割(0 HPE)中高达42μmol高达42μm,高达140μmol升高。黑暗曝光在高n内发布了更多的amide-ngydF4y2BatgydF4y2Ba扦插相比低氮gydF4y2BatgydF4y2Ba岩屑(无花果。gydF4y2Ba4EgydF4y2Ba).无论在高氮和低氮条件下,随插入时间的增加(168 hpin后<18 μmol),酰胺-N在离体扦插和暗照射下均显著下降gydF4y2BadgydF4y2Ba供应。因此,不同的减少率证明了暗曝光和插入后的时间是变化的来源(图。gydF4y2Ba4J.gydF4y2Ba).gydF4y2Ba
变化总氮(ngydF4y2BatgydF4y2Ba)和nf池的岩屑gydF4y2Ba矮牵牛织布达gydF4y2Ba具有毕业氮肥(ngydF4y2BadgydF4y2Ba)对供体植物,暗照射和AR形成。(面板gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba):完全周期和打开平方符号,与完整和间歇线,分别以分离(0 HPE)和168小时黑暗暴露(168 HPE)直接显示切割。(面板gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba):在0 hpe和168 h暗曝光(168 hpe)后插入AR形成的特定时间(0,6,24,72,168 hpin, x轴为3d, 7d)的全周期和开放的正方形符号与完整的和间断的线连接。所有数据均以μmol N g表示gydF4y2Ba−1gydF4y2BaDM。Multifactorial Anova揭示了n的重要主要和互动效果gydF4y2BadgydF4y2Ba- 威尔士gydF4y2BapgydF4y2Ba < 0.01 (Panels一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba),黑暗曝光gydF4y2BapgydF4y2Ba< 0.00001(面板gydF4y2BadgydF4y2Ba),用于时间后插入gydF4y2BapgydF4y2Ba< 0.0001(面板gydF4y2BafgydF4y2Ba), NgydF4y2BadgydF4y2Ba-电平×暗曝光gydF4y2BapgydF4y2Ba< 0.05(面板gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba), NgydF4y2BadgydF4y2Ba-level ×插入后的时间gydF4y2BapgydF4y2Ba= 0.01(面板gydF4y2BahgydF4y2Ba),用于黑暗曝光×插入后的时间gydF4y2BapgydF4y2Ba < 0.001 (PanelggydF4y2Ba,gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba).竖条代表平均值的95%置信区间。实验和统计的进一步细节在方法和附加文件中提出gydF4y2Ba1gydF4y2Ba)凹陷预处理的实验,附加档案gydF4y2Ba2gydF4y2Ba用于统计分析的实验设计说明及附加文件gydF4y2Ba3.gydF4y2Ba)图4的补充数据gydF4y2BaExp。6:NF-NDgydF4y2Ba(与面板gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba)和for.gydF4y2BaExp。9:NF-NDCRgydF4y2Ba(与面板gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba),分别gydF4y2Ba
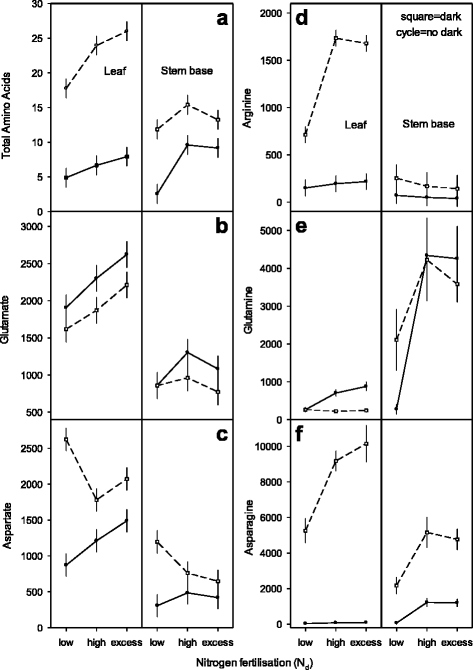
在提高氮营养和黑暗暴露时改变游离氨基酸gydF4y2Ba
研究了3种氮处理对源库组织(叶和基茎)中游离氨基酸的影响gydF4y2BadgydF4y2Ba水平的供体植株和扦插暗暴露(图。gydF4y2Ba5gydF4y2Ba).氨基酸代表氨基-NF的枢轴部分,包括植物组织中总氮的共同量,范围为0.075至0.1075%gydF4y2BatgydF4y2Ba.总和单氨基酸的水平和单个氨基酸Glu,Gln,Asp,Asn和Arg的响应于毕业ngydF4y2BadgydF4y2Ba供体植物的受精和扦插的暗曝光(图。gydF4y2Ba5gydF4y2Ba:带有虚线的平方符号显示黑暗响应)。此外,在0 HPE的0 HPE的切除切屑的叶子和茎碱中观察到氨基酸的特异性图案,分别在168hPe的暗暴露之后(图。gydF4y2Ba5A到F.gydF4y2Ba).游离氨基酸(AA)在3 ~ 26 μmol g之间变化较大gydF4y2Ba−1gydF4y2Ba在330 ~ 4260 nmol N g之间积累gydF4y2Ba−1gydF4y2Bafm = aa-ngydF4y2BatgydF4y2Ba.AA在离体扦插(0 hpe)中增加,N增加gydF4y2BadgydF4y2Ba浓度从5到8 μmol ggydF4y2Ba−1gydF4y2BaFM在叶片中(相当于590-1002 nmol N = AA-NgydF4y2BatgydF4y2Ba)和3 ~ 10 μmol ggydF4y2Ba−1gydF4y2BaFM在茎基(相当于330-1550 nmol N = AA-NgydF4y2BatgydF4y2Ba).扦插植株168h暗暴露后,叶片和茎基AA的释放量增加了4倍,最高可达26 μmol ggydF4y2Ba−1gydF4y2Ba在氮含量最高时,叶片FM含量最高gydF4y2BadgydF4y2Ba级别(无花果。gydF4y2Ba5AgydF4y2Ba).作为N同化中的原代代谢物,与茎组织相比,谷氨酸浓度在叶片中较高,并随着N的增加而增加gydF4y2BadgydF4y2Ba供应高达2622 nmol glu ggydF4y2Ba−1gydF4y2Ba调频。此外,升高了ngydF4y2BadgydF4y2Ba切块(0 hpe)和深色外露扦插(168 hpe)叶片谷氨酸水平均升高。施氮量由高施氮量增加gydF4y2BadgydF4y2Ba过量的ngydF4y2BadgydF4y2Ba,茎基谷氨酸的减少表现为氮的互作效应gydF4y2BadgydF4y2Ba- 细胞和组织类型。除此之外,暗暴露在叶片中的暗暴露下降部分地处于截然不同的ngydF4y2BadgydF4y2Ba水平(〜380 nmol glu ggydF4y2Ba−1gydF4y2BaFM)(无花果。gydF4y2Ba5B.gydF4y2Ba).谷氨酸积累量在73 ~ 250 nmol N之间gydF4y2BatgydF4y2Ba响应不同的氮水平和暗暴露。在切除的切割中(0 HPE)天冬氨酸也随着n增加而增加gydF4y2BadgydF4y2Ba供应。与Glu相反,在叶和茎组织中,对于响应暗暴露,ASP的含量是增加的。通过低N切屑监测天黑诱导的最高ASP增加(图。gydF4y2Ba5CgydF4y2Ba).在3个变异源的驱动下,asp在32 ~ 276 nmol N之间积累gydF4y2BatgydF4y2Ba.茎叶组织中精氨酸(arg)的积累水平极低(<220 nmol arg g)gydF4y2Ba−1gydF4y2BaFM),虽然提高了NgydF4y2BadgydF4y2Ba水平略微增加叶片,并在茎中略微下降。然而,切屑(168 HPE)的暗暴露导致巨大,几乎9倍的增加,高达1734米氏蛋白,特别是在高N的叶组织中gydF4y2BadgydF4y2Ba供应(图。gydF4y2Ba5DgydF4y2Ba)在分配给arg池的n次,而在10到461 nmol n之间发生变化gydF4y2BatgydF4y2Ba.谷氨酰胺(gln)在切割(0 hpe)中反映了ngydF4y2BadgydF4y2Ba以组织特异性方式对供体植物的水平。在升高的N.gydF4y2BadgydF4y2Ba在茎中含量增加约17倍,达到4341 nmol GLN ggydF4y2Ba−1gydF4y2Ba调频。暗曝光(168 hpe)降低了叶片组织中gln的含量,尤其是在高氮条件下gydF4y2BadgydF4y2Ba而低氮和高氮对茎基组织的反应则相反gydF4y2BadgydF4y2Ba水平(无花果。gydF4y2Ba5egydF4y2Ba).NgydF4y2BadgydF4y2Ba水平仍然是茎基Gln变异的临界来源,而黑暗暴露是叶子中的重要因素。ngydF4y2BatgydF4y2Ba谷氨酰胺的分配范围为42 ~ 168和53 ~ 832 nmol NgydF4y2BatgydF4y2Ba在叶和茎组织中,相应的。天冬酰胺的生物合成包括天门冬氨酸和谷氨酰胺分别作为铵的受体和供体。天冬酰胺(asn)在离体扦插(0 hpe)中随N增加而增加gydF4y2BadgydF4y2Ba在组织特异性反应中的水平它在叶片中仍然非常低(≤93 nmol asn ggydF4y2Ba−1gydF4y2BaFM)并仅在高N的茎碱中积累gydF4y2BadgydF4y2Ba水平(≤1226nmol asn ggydF4y2Ba−1gydF4y2BaFM)。相反,黑暗暴露(168 hpe = hde)在提高氮水平时引起叶和茎组织特异增加gydF4y2BadgydF4y2Ba浓度可达10147 nmol asn ggydF4y2Ba−1gydF4y2Ba调频(无花果。gydF4y2Ba5f.gydF4y2Ba).低氮区相对asn增加最高gydF4y2BadgydF4y2Ba特别是在叶和茎中,在较低程度上(叶与茎:NgydF4y2Ba低的gydF4y2Ba= 164- vs. 33, NgydF4y2Ba高的gydF4y2Ba = 121- vs. 4-fold; N过量的gydF4y2Ba= 105- vs. 4)。分配ngydF4y2BatgydF4y2Ba天门冬酰胺的含量在7 ~ 2151 nmol N之间gydF4y2BatgydF4y2Ba.此外,暗暴露对氨基酸积聚的影响与氮磷助焊剂与天冬酰胺,天冬氨酸和精氨酸池相一致,其高达77%的AA-NgydF4y2BatgydF4y2Ba而茎组织中AA-N的含量高达74%gydF4y2BatgydF4y2Ba如谷氨酰胺和天冬酰胺。gydF4y2Ba
叶片和茎基蛋白质原性氨基酸随扦插的变化gydF4y2Ba矮牵牛织布达gydF4y2Ba对分级施氮(NgydF4y2BadgydF4y2Ba)给捐赠植物和黑暗的曝光。水平:低,高且多余的ngydF4y2BadgydF4y2Ba和168h暗曝光岩屑(168 hpe, 10°C)。面板gydF4y2Ba一个gydF4y2Ba到gydF4y2BafgydF4y2Ba:完全周期和与完整和间歇线的开放方形符号分别代表直接以遣散(0 HPE)和深色曝光后的切屑。总氨基酸为μmolggydF4y2Ba−1gydF4y2BaFM和单一氨基酸如nmol ggydF4y2Ba−1gydF4y2Ba分别调频。Multifactorial Anova揭示了n的重要主要和互动效果gydF4y2BadgydF4y2Ba- ××暗暴露×组织类型gydF4y2BapgydF4y2Ba< 0.00001gydF4y2BapgydF4y2Ba< 0.05(面板年代gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba), NgydF4y2BadgydF4y2Ba-级别×组织类型gydF4y2BapgydF4y2Ba< 0.00001(面板gydF4y2BabgydF4y2Ba),黑暗曝光gydF4y2BapgydF4y2Ba< 0.000001(面板gydF4y2BabgydF4y2Ba).竖条代表平均值的95%置信区间。进一步的详细信息以方法和附加文件呈现gydF4y2Ba1gydF4y2Ba)凹陷预处理的实验,附加档案gydF4y2Ba2gydF4y2Ba用于统计分析的实验设计说明及附加文件gydF4y2Ba3.gydF4y2Ba)图5的补充数据gydF4y2BaExp。3:AA-ND,gydF4y2Ba分别gydF4y2Ba
三种不同条件下游离氨基酸的变化gydF4y2Ba
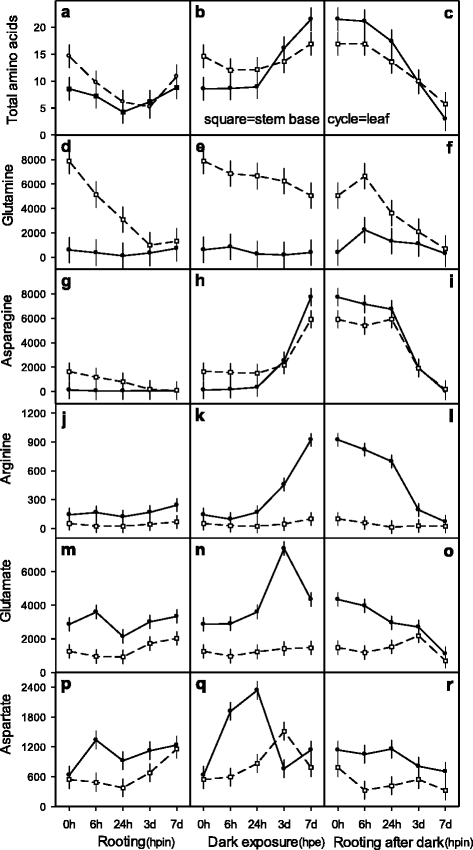
为了研究暗暴露条件下插枝叶片和基茎中氨基酸的变化规律,采用因子设计对插枝的3个环境处理(生根、暗暴露、暗暴露后生根)和每个环境中的5个时间点进行了更详细的研究(图)。gydF4y2Ba6克ydF4y2Ba).有足够的NgydF4y2BadgydF4y2Ba0 hpe切出的岩屑初始含15和9 μmol AA ggydF4y2Ba−1gydF4y2BaFM在茎和叶组织中的含量(图。gydF4y2Ba6AgydF4y2Ba).在昼夜光下的立即珍珠菌插入导致24hPE,其显着的AA减少,在72hpe下,在叶和茎中显着回收(图。gydF4y2Ba6AgydF4y2Ba).在暗暴露下,AA水平最初在茎中略微下降,叶片保持不变,直至24 HPE。延长的暗暴露在茎和叶(+ 5和+12μmol)中强烈升高至168hPe的AA强度(图。gydF4y2Ba6B.gydF4y2Ba).当种植暗预暴露的插枝(即插入到珍珠岩上),并暴露在白天的光照下,茎和叶组织的AA分别减少了3倍和7倍(图2)。gydF4y2Ba6CgydF4y2Ba).综上所述,叶片中AA的增减速率大于茎组织(图2)。gydF4y2Ba6 b, cgydF4y2Ba).gydF4y2Ba
叶片和茎底的总和单氨基酸过程gydF4y2Ba矮牵牛织布达gydF4y2Ba岩屑暴露于三种环境条件下gydF4y2Ba- - - - - -gydF4y2Ba立即种植生根,在暗暴露下,在暗曝光后种植,并在五次曝光时间(0,6,24,72,168个HPI或HPE,在X轴上显示相应的日期:3D,7D),分别。面板gydF4y2Ba一个gydF4y2Ba到gydF4y2BargydF4y2Ba:完整的循环和用完整的和间断的线连接的开放的正方形符号分别代表叶子和蒸汽基组织。总(游离)氨基酸以μmol g表示gydF4y2Ba−1gydF4y2BaFM和单一氨基酸如nmol ggydF4y2Ba−1gydF4y2Ba分别调频。多因素方差分析显示,环境条件×暴露时间×组织类型存在显著的交互作用gydF4y2BapgydF4y2Ba< 0.00001gydF4y2BapgydF4y2Ba< 0.05(面板年代gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba-gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba-gydF4y2BaegydF4y2Ba-gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba-gydF4y2BahgydF4y2Ba-gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba-gydF4y2BakgydF4y2Ba-gydF4y2BalgydF4y2Ba,gydF4y2Ba米gydF4y2Ba-gydF4y2BangydF4y2Ba-gydF4y2BaogydF4y2Ba,gydF4y2BapgydF4y2Ba-gydF4y2Ba问gydF4y2Ba-gydF4y2BargydF4y2Ba).竖条代表平均值的95%置信区间。实验和统计的进一步细节在方法和附加文件中提出gydF4y2Ba1gydF4y2Ba)凹陷预处理的实验,附加档案gydF4y2Ba2gydF4y2Ba用于统计分析的实验设计说明及附加文件gydF4y2Ba3.gydF4y2Ba)图6的补充数据gydF4y2BaExp。5:AA-DCRgydF4y2Ba, 分别gydF4y2Ba
在切除时,游离氨基酸中,gydF4y2Ba谷氨酸gydF4y2Ba茎基(茎/叶:7881/601 nmol GLN ggydF4y2Ba−1gydF4y2BaFM)。直接插入生根导致叶片(24 hpe)和茎基(72 hpe)的gln下降到最低水平。直到168 hpe,谷氨氮在叶片中恢复到初始水平,但在茎中仅略有恢复。gydF4y2Ba6D.gydF4y2Ba).扦插的暗暴露(0 hde)使茎基中的gln浓度降低了36%,直到168 hde,并使叶片中的gln浓度降低到较低的初始水平(图1)。gydF4y2Ba6e.gydF4y2Ba).暗生根导致茎和叶的gln短暂增加,随后这两个组织在168 hpe时降低到最低水平(图)。gydF4y2Ba6f.gydF4y2Ba).gydF4y2Ba
芦笋gydF4y2Ba茎碱和叶片组织(0 HPE茎/叶:1634/122 Nmol Asn GgydF4y2Ba−1gydF4y2BaFM)。直接插入生根导致茎中asn基因减少,而叶中则维持在较低水平(图2)。gydF4y2Ba6克gydF4y2Ba).在暗暴露的第一天ASN在茎碱中略微下降,叶子中度增加。相比之下,进一步的暗暴露(168HDE)导致叶片的ASN高达23倍的增加,从72 HDE开始,在72hDE后开始在茎中4倍(图。gydF4y2Ba6小时gydF4y2Ba).插入暴露的深色扦插导致茎基部24hpin无asn变化,叶片略有减少(图2)。gydF4y2Ba6我gydF4y2Ba)在茎(34倍)和叶片(169倍)中强烈地减少,在168hpin下达到最低水平(图。gydF4y2Ba6我gydF4y2Ba).gydF4y2Ba精氨酸gydF4y2Ba低(茎/叶:52/143 nmol arg ggydF4y2Ba−1gydF4y2Ba在茎基部和叶组织中保持不变,直到168 hpe(图。gydF4y2Ba6 jgydF4y2Ba).暗照射对茎秆的arg没有显著的影响,但在7d前,arg显著增加了9倍(923 nmol arg)(图2)。gydF4y2Ba6 kgydF4y2Ba).在暗期后的生根第一天,茎和叶的arg均明显减少。在进一步的过程中,茎中精氨酸含量保持在低水平,而叶组织中精氨酸含量减少了10倍(图)。gydF4y2Ba6 lgydF4y2Ba).gydF4y2Ba
谷氨酸gydF4y2Ba茎中积累量低于叶(0 hpe茎/叶:1254/2861 nmol glu ggydF4y2Ba−1gydF4y2BaFM)(无花果。gydF4y2Ba6米gydF4y2Ba).直接插入生根只导致叶片中谷氨酸的轻微增加,在第一天,这两个组织中的谷氨酸减少到短暂的最低水平,并最终恢复到初始水平。黑暗暴露导致叶片在72 hpe水平(7378 nmol glu)瞬时增加,而茎则保持不变(图。gydF4y2Ba6 ngydF4y2Ba).在黑暗处理后生根,叶片谷氨酸持续减少,而茎谷氨酸仅在72 - 168 hpe之间下降(图。gydF4y2Ba6 ogydF4y2Ba).gydF4y2Ba
天冬氨酸gydF4y2Ba从低水平开始(0 HPE茎/叶:542/629 NMOL ASP GgydF4y2Ba−1gydF4y2BaFM)。对于仅在叶片(6 HPE:1338 Nmol ASP)中仅升高的直接生根ASP,止动茎和叶片减少24小时,并且超过初始水平的168 HPE增加(图。gydF4y2Ba6 pgydF4y2Ba).在暗暴露时,ASP在茎中的6 HDE不变,72 HDE上升到临时峰值,最后降低到初始水平。在叶片中,ASP立即增加至24 HDE至最大(2336nmol ASP),在72 HDE下降至最小(761nmol ASP),并在2倍的增加(1138 Nmol ASP)中以168 HDE结束(图1138 Nmol ASP)(图。gydF4y2Ba6问gydF4y2Ba).在暗生根过程中,叶片中的asp在24 hpe时保持不变,随后持续下降。在茎基中,asp的下降在72 hpe时达到峰值,然后在所有三种环境条件下都下降到最低水平(图)。gydF4y2Ba6 rgydF4y2Ba).gydF4y2Ba
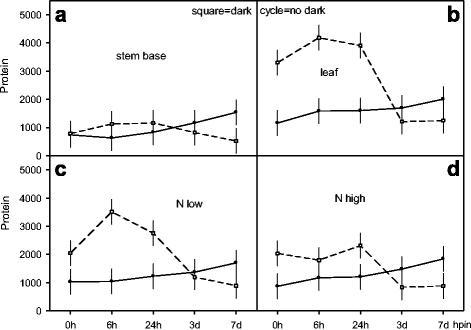
ar形成期间可溶性蛋白质的过程gydF4y2Ba
研究了在日光下AR形成过程中枝条中可溶性蛋白的变化。采用因子设计分析环境影响,包括NgydF4y2BadgydF4y2Ba供体植株的供给水平,扦插的暗曝光,种植在珍珠岩上形成AR(即插入)后的5个时间点和两个组织(图。gydF4y2Ba7gydF4y2Ba).直接插入开始于0 hpe,叶片蛋白质含量比茎高1.6倍(1158/738 μg)gydF4y2Ba−1gydF4y2BaFM)(无花果。gydF4y2Ba7一个gydF4y2Ba,gydF4y2BabgydF4y2Ba).在茎中,6 hpin的瞬时减少与叶片的增加相一致,在168 hpin时,两种组织中均达到最高水平。相比之下,在插入处(0 hpin),深色暴露的插枝(168 hde)仅在叶片中显示了较高的蛋白含量(3301 μg),随后在24 hpin处(168 hde + 24 hpin = 192 hpe)蛋白含量下降,并下降到新鲜扦插的水平(图)。gydF4y2Ba7一个gydF4y2Ba,gydF4y2BabgydF4y2Ba).直接插入以类似的蛋白质水平开始0 HPEgydF4y2BadgydF4y2Ba水平,并持续增加168 hpin(图。gydF4y2Ba7 cgydF4y2Ba,gydF4y2BadgydF4y2Ba).在暗暴露的切割(168 HDE)中,插入(168 HDE + 0 HPIN)时蛋白质增加,但n没有不同gydF4y2BadgydF4y2Ba的水平。然而,在6 hpin低NgydF4y2BadgydF4y2Ba供应导致瞬时蛋白质升高(3511μg),而在高n保持不变gydF4y2BadgydF4y2Ba供应24个HPIN。此后,蛋白质有ngydF4y2BadgydF4y2Ba水平降至168个HPIN到新切屑中的水平(图。gydF4y2Ba7 cgydF4y2Ba,gydF4y2BadgydF4y2Ba).gydF4y2Ba
叶片和茎基部可溶性蛋白的变化过程gydF4y2Ba矮牵牛织布达gydF4y2Ba,生长在两个NgydF4y2BadgydF4y2Ba施肥水平(低氮、高氮)对供体植株的影响,并暴露于不同的环境条件下gydF4y2Ba- - - - - -gydF4y2Ba即刻栽植生根和暗栽植生根,分别按5次展示时间采样(0、6、24、72、168 hpin, x轴分别为3d、7d)。(面板gydF4y2Ba一个gydF4y2Ba到gydF4y2BadgydF4y2Ba):与完整和间歇线连接的全周期和开放方形符号表示切除(0 HPE)后直接显示168个HPIN的AR形成,分别在暗暴露(168 HPE,10°C)之后。Multifactorial Anova对n表示显着的互动效应gydF4y2BadgydF4y2Ba- level×黑暗曝光×博览时间gydF4y2BapgydF4y2Ba< 0.05(面板年代gydF4y2BacgydF4y2Ba-gydF4y2BadgydF4y2Ba),用于暗暴露×expous时间x组织类型(面板gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba).竖条代表平均值的95%置信区间。实验和统计的进一步细节在方法和附加文件中提出gydF4y2Ba1gydF4y2Ba)凹陷预处理的实验,附加档案gydF4y2Ba2gydF4y2Ba用于统计分析的实验设计说明及附加文件gydF4y2Ba3.gydF4y2Ba)图7的补充数据gydF4y2BaExp。8:PR-NDCRgydF4y2Ba, 分别gydF4y2Ba
讨论gydF4y2Ba
N降低后,早期AR形成事件延迟gydF4y2BatgydF4y2Ba内容gydF4y2Ba
根据解剖特征,矮牵牛AR形成分为根形成期、根原基形成期和根伸长及/或出苗期[gydF4y2Ba8gydF4y2Ba].在本研究中,已经选择了两次AR形成的组织学检查,从根系原始形成相(72hpin)的转变和根部原始形成到根伸长相(168hpin)。结果表明,72个HPIN的AR形成过程类似于Ahkami等人报告的方法。[gydF4y2Ba8gydF4y2Ba[不管氮处理如何(图。gydF4y2Ba1AgydF4y2Ba,gydF4y2BabgydF4y2Ba).在后期(168 hpin),只有在高氮水平处理下才观察到第一个根(图。gydF4y2Ba1DgydF4y2Ba).有趣的是,低氮不能证实这一观察(图。gydF4y2Ba1CgydF4y2Ba),证明氮的临界水平是保证根的正常起始和随后分化成完整根体所必需的。低氮供应下根系形成延迟很可能是由于营养物质和激素对根系发育和代谢适应的调节[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].据报道,IAA的早期瞬态升高,AR和LR形成没有触发的解剖改变[gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba38.gydF4y2Ba],以及矮牵牛AR形成早期细胞学事件前的基部生长素转运[gydF4y2Ba16.gydF4y2Ba].gydF4y2Ba
移动氮资源升高gydF4y2BatgydF4y2Ba内容gydF4y2Ba
腋窝射击尖端扦插整体氮气积累的范围gydF4y2Ba矮牵牛织布达gydF4y2Ba可与已发表的菊花、天竺葵和矮牵牛花的研究结果相媲美[gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba39.gydF4y2Ba].增加NgydF4y2BatgydF4y2Ba吸收导致可溶性NF池的较高分配,同时分配不溶性蛋白-N降低。但是,随着n增加gydF4y2BatgydF4y2Ba矮牵牛扦插物中硝酸盐和酰胺氮的积累量大于氨基氮(图2)。gydF4y2Ba2AgydF4y2Ba).种植切割和随后暴露在昼夜光线诱导巨大的ngydF4y2BatgydF4y2Ba在初始无根阶段减少,表明所有NF池有助于AR形成(图。gydF4y2Ba4 f jgydF4y2Ba).gydF4y2Ba
在AR形成期间拍摄增长应对ngydF4y2BatgydF4y2Ba和黑暗的曝光gydF4y2Ba
较高的氮含量可使茎干质量积累增加10%,这与以前的报告相当[gydF4y2Ba39.gydF4y2Ba].直接生根(即种植rsp。在0 hpe处的珍珠岩插入)导致了最显著的干质量增加,直到168 hpin。相比之下,在短暂的黑暗经历(168 hpe)后,随后在白天光照下的枝条生长(168 hpin)主要因扦插初始氮吸收较低而减少。gydF4y2Ba2B.gydF4y2Ba).考虑到具有低N吸收的AR形成的同时暗刺激(图。gydF4y2Ba3 c, dgydF4y2Ba),这与研究结果一致,即黑暗暴露增强了生根区的库竞争力,导致根系发育中分配干质量的比例更高[gydF4y2Ba40gydF4y2Ba].gydF4y2Ba
增加N吸收和暗处理改善了AR形成gydF4y2Ba
AR形成(TRN和RNC)的参数在下部n明显降低gydF4y2BadgydF4y2Ba供给量和减少的NgydF4y2BatgydF4y2Ba吸收(图。gydF4y2Ba3AgydF4y2Ba).这一致恰逢菊花,天竺葵,一品红和诱饵中AR形成的氮局限的报道[gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba27.gydF4y2Ba,gydF4y2Ba39.gydF4y2Ba].在本研究中,喇叭花的AR形成甚至在低n下减少gydF4y2BadgydF4y2Ba供应(图。gydF4y2Ba3AgydF4y2Ba)当NgydF4y2BatgydF4y2Ba略低于推荐的n略低于gydF4y2BatgydF4y2Ba-范围在2750-5429 μmol N之间gydF4y2BatgydF4y2Ba[gydF4y2Ba39.gydF4y2Ba(图。gydF4y2Ba3EgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba).扦插未发现明显高于1471 μmol N缺乏症临界水平的表型gydF4y2BatgydF4y2Ba[gydF4y2Ba41.gydF4y2Ba].ar形成的暗刺激(图。gydF4y2Ba3B.gydF4y2Ba)支持较早的数据,即在黑暗照射下根系生长增加、加快和同步[gydF4y2Ba29.gydF4y2Ba].但是,低和高初始ngydF4y2BatgydF4y2Ba水平证实了高氮对AR形成的影响,只有在没有黑暗暴露的情况下(图)。gydF4y2Ba3 c, dgydF4y2Ba).gydF4y2Ba
氮气分配镜NgydF4y2BatgydF4y2Ba内容物、暗曝光和AR形成期间的时间gydF4y2Ba
营养物质的浓度,特别是硝酸盐,氨基酸和NgydF4y2BatgydF4y2Ba在AR形成的早期阶段迅速下降,表明高氮需求[gydF4y2Ba21.gydF4y2Ba,gydF4y2Ba42.gydF4y2Ba,gydF4y2Ba43.gydF4y2Ba].作为AR形成的暗刺激涉及强烈的黑暗诱导的碳水化合物饥饿[gydF4y2Ba29.gydF4y2Ba]它进一步暗示的并发N助焊剂显然有助于改善生根区域的N个可用性,在早期无根阶段满足高N的需求[gydF4y2Ba8gydF4y2Ba].虽然黑暗没有改变NgydF4y2BatgydF4y2Ba它在两个N上都降低了不溶性蛋白NgydF4y2BadgydF4y2Ba供应水平(图。gydF4y2Ba4AgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2Ba我gydF4y2Ba)和释放N的保证助熔剂进入可溶性氨基-N和酰胺-N池(图。gydF4y2Ba4B.gydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BajgydF4y2Ba).这与研究报告一致,长期的黑暗会影响细胞间的蛋白质水解系统,并激活蛋白质分解以应对碳水化合物饥饿[gydF4y2Ba44.gydF4y2Ba].因此,总N和硝酸NF池保持不受影影响(图。gydF4y2Ba4AgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BahgydF4y2Ba),因为黑暗会阻止光合作用,并同时使硝酸盐还原酶和氮同化失活[gydF4y2Ba45.gydF4y2Ba].gydF4y2Ba
氨基酸表现出特定的模式,提高氮营养和黑暗暴露gydF4y2Ba
Petunia的氨基酸水平随增强的n增加gydF4y2BadgydF4y2Ba然而,对于叶子和茎,供应和暗暴露不同的不同(图。gydF4y2Ba5AgydF4y2Ba).在其他变异源中,暗处理是一个例外(NgydF4y2BadgydF4y2Ba-水平×暗曝光×组织类型)。有趣的是,叶暗处理导致最高的氨基酸浓度与过量的NgydF4y2BadgydF4y2Ba低氮条件下,茎中氨基酸含量显著增加gydF4y2BadgydF4y2Ba供应。最近的报告表明,NgydF4y2BadgydF4y2Ba供应是一个关键的外部因素,启动合成,提高氨基酸和内部氮水平,并改变基因转录[gydF4y2Ba46.gydF4y2Ba- - - - - -gydF4y2Ba48.gydF4y2Ba].氨基酸水平在不同组织内也会发生变化,并对其他外部因素如光照水平、温度变化和碳水化合物供应作出反应[gydF4y2Ba49.gydF4y2Ba,gydF4y2Ba50.gydF4y2Ba].以谷氨酸、asp和gln为主要氨基酸,以精氨酸为次要氨基酸的施氮量决定了叶片中AA的增加。gydF4y2Ba5B.gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba).相反,在茎中NgydF4y2BadgydF4y2Ba供应导致高水平的GLN(约17倍)和低水平的glu和asn。这些结果与先前报道的数据一致,即在矮牵牛花和其他植物的茎中谷氨酰胺是主要氨基酸,其次是谷氨酸、asn和asp [gydF4y2Ba8gydF4y2Ba,gydF4y2Ba51.gydF4y2Ba].外源氮供应从高到过量的转变gydF4y2BadgydF4y2Ba导致茎秆氨基酸的停滞(AA, gln, asn)或轻微下降(glu, asp)(图。gydF4y2Ba5AgydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba).这可能是由渗透干扰以及过量辐射后的土壤盐积累引起的(盐gydF4y2Ba氯化钾gydF4y2Ba等效和扦插的增长查看附加文件gydF4y2Ba1gydF4y2Ba).在这方面,据报道,盐在茎组织中特别抑制了长距离氨基酸转运[gydF4y2Ba52.gydF4y2Ba].gydF4y2Ba
虽然黑暗暴露提高了叶和茎中的氨基酸含量,但每个组织中的单个氨基酸反应不同。N代谢的一般转变与严重的碳水化合物饥饿同时发生[gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba44.gydF4y2Ba].暗诱导的AA增加主要包括asn、asp和arg水平的升高,并在不同N点的组织特异性反应gydF4y2BadgydF4y2Ba供应水平(图。gydF4y2Ba5CgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba).这也强烈地通过报告来留下阳光明酰胺和其他氨基酸的增加[gydF4y2Ba53.gydF4y2Ba].此外,通过表显示在不同的植物中,在不同的植物中,通过光抑制天冬酰胺合成酶基因并被暗淡。此外,由于基因与植物中的碳水化合物水平与碳水化合物水平相反,而外源蔗糖作为根基因表达抑制[gydF4y2Ba54.gydF4y2Ba- - - - - -gydF4y2Ba56.gydF4y2Ba].因此,假设自由天冬酰胺和精氨酸 - 具有高氮至碳比的氮脂肪,以用作氮气释放的N储存化合物。铵释放由深色诱导的蛋白水解和氨基酸脱氨基产生,并通过加速呼吸道碳水化合物驱动的呼吸碳水化合物在黑暗期间组织存活的要求[gydF4y2Ba47.gydF4y2Ba,gydF4y2Ba57.gydF4y2Ba].有趣的是,黑暗诱导的ASP的增加在低ngydF4y2BadgydF4y2Ba叶片和茎组织的供给水平(图。gydF4y2Ba5CgydF4y2Ba).这对应于响应于玉米叶中许多代谢适应的低氮胁迫的ASP增加[gydF4y2Ba58.gydF4y2Ba].然而,虽然ASN,ASP和Arg随着黑暗曝光而增加,但两种组织中的Glu水平均比下降(图。gydF4y2Ba5B.gydF4y2Ba).gln在高且多余的n下暗暴露而消失gydF4y2BadgydF4y2Ba叶的供给量,茎的供给量保持不变(图。gydF4y2Ba5egydF4y2Ba).相反,低N切屑的干燥组织响应于黑暗暴露而显示出升高的GLN。在n缺乏的条件下一起服用(低ngydF4y2BadgydF4y2Ba在暗胁迫下,观察到谷氨酰胺和asp的增加,特别是随着AA在茎中的增加(图。gydF4y2Ba5AgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba).这可能反映了黑暗诱导的N再活化活性升高,这是asn合成的代谢物前体如asp和gln的临时积累[gydF4y2Ba57.gydF4y2Ba].在这方面,有报道称,蛋白质降解导致谷氨酰胺合成酶/谷氨酰胺合成酶(GS/GOGAT)循环增加,谷氨酸和谷氨酰胺的数量增加,尽管总体氨基酸随着缺氮而减少[gydF4y2Ba59.gydF4y2Ba].gydF4y2Ba
氨基酸过程反应不同的环境情况gydF4y2Ba
考虑到高而充足的氮gydF4y2BadgydF4y2Ba在两个独立的试验中,AA和单个氨基酸的水平显示出相当的范围。gydF4y2Ba5gydF4y2Ba和gydF4y2Ba6克ydF4y2Ba).与AA,GLN和ASN一起显示茎碱最多72hpin的初始减少(图。gydF4y2Ba6AgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaggydF4y2Ba),而茎基中的glu和asp则在72 hpin前开始掉头恢复(图。gydF4y2Ba6米gydF4y2Ba茎基氨基酸的变化与Ahkami等人提出的建立、恢复和维持库的代谢阶段是一致的[gydF4y2Ba8gydF4y2Ba].高NgydF4y2BadgydF4y2Ba供应量,在检查的所有组织和病症中,氨基酸的水平不同。特别是,在黑暗暴露的结束时(168 HDE / 168HPE)AA,GLN,ASN和ARG的组织特异性改变显而易见(图。gydF4y2Ba5AgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba和gydF4y2Ba6B.gydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BahgydF4y2Ba,gydF4y2BakgydF4y2Ba).此外,在早期的时间点的AA和单氨基酸的各种疗程意味着由低能量状态引起的氨基酸代谢(24HDE和72 HDE之间)转录调节的转换[gydF4y2Ba60.gydF4y2Ba,gydF4y2Ba61.gydF4y2Ba],并在叶组织中暗诱导碳水化合物消耗[gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba44.gydF4y2Ba,gydF4y2Ba57.gydF4y2Ba].此外,随后的氨基酸(72HDE之后)的后续底碱基分配可以在根部再生的茎基区域中具有优选的早期水槽建立诱导[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba62.gydF4y2Ba].库细胞的发育强烈依赖于氮,氮主要以谷氨酰胺或asn的形式运输,通过韧皮部以谷氨酸或asp的形式运输[gydF4y2Ba21.gydF4y2Ba,gydF4y2Ba63.gydF4y2Ba].然而,在叶片中累积的黑暗N-富含富含氨基酸(ASN,ARG)(图。gydF4y2Ba6小时gydF4y2Ba,gydF4y2BakgydF4y2Ba)防止氨中毒,并利用精氨酸作为AR形成早期假定的NO信号级联的前体[gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba64.gydF4y2Ba].在6 HDE之前叶片的ASP水平直接和强劲上升至24 HDE(图。gydF4y2Ba6问gydF4y2Ba)随后从24HDE直到72HDE的后续增加Glu水平(图。gydF4y2Ba6 ngydF4y2Ba)表明在黑暗中重新编程氨基酸代谢。在gydF4y2Ba拟南芥gydF4y2Ba,天冬酰胺生物合成途径的编码酶基因,如谷氨酸脱氢酶2、天冬酰胺转氨酶、谷氨酸合成酶和天冬酰胺合成酶在黑暗暴露8d时被发现[gydF4y2Ba60.gydF4y2Ba].此外,有报道称,NAD(H)依赖的谷氨酸脱氢酶是植物在黑暗诱导的碳饥饿中生存所必需的[gydF4y2Ba65.gydF4y2Ba].最后,发现天门冬酰胺合成酶基因通过光和代谢产物(如谷氨酰胺)相互调节[gydF4y2Ba66.gydF4y2Ba].这与白天光照和黑暗照射后AR形成过程中氨基酸水平的下降是一致的(图)。gydF4y2Ba6CgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2Ba我gydF4y2Ba,gydF4y2BalgydF4y2Ba和gydF4y2BaogydF4y2Ba)当碳水化合物生物合成重新成立时[gydF4y2Ba29.gydF4y2Ba].gydF4y2Ba
可溶性蛋白质在衰老中进行蛋白水解gydF4y2Ba
扦插繁殖过程中的生长发育和非生物胁迫信号包括损伤、暗暴露和根系诱导等。因此,衰老(发育和/或暗诱导)和AR形成后的恢复和存活依赖于转录组和代谢调节对低能量状态的调节,包括蛋白质水解和新的蛋白质合成[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba67.gydF4y2Ba,gydF4y2Ba68.gydF4y2Ba].在我们的研究中,在茎和叶片和高低N的7D(168 HPE = HPIN)期间升高的可溶性蛋白质gydF4y2BadgydF4y2Ba供应(图。gydF4y2Ba7gydF4y2Ba).铃木和河野[gydF4y2Ba21.gydF4y2Ba表明茎基生长部分(库)所需的氮来自源组织(如叶片)的蛋白质分解。然而,不溶性蛋白的强烈下降表明,在白天的光照下,AR形成过程中氮的调动(图。gydF4y2Ba4I.gydF4y2Ba).在两种氮水平下,蛋白质水解开始24 hpin,同时可溶性蛋白升高约2倍(图。gydF4y2Ba7一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba).gydF4y2Ba
相比之下,扦插生根前的暗暴露可能涉及人为的、可逆的衰老和转录组变化[gydF4y2Ba67.gydF4y2Ba]诱导强蛋白质降解[gydF4y2Ba44.gydF4y2Ba]在低能量应力下改变了氨基酸代谢[gydF4y2Ba60.gydF4y2Ba,gydF4y2Ba68.gydF4y2Ba].这可以解释尤其是在叶片和低水平的可溶性蛋白的高〜4倍的瞬态升高(图。gydF4y2Ba7 bgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba).源组织中蛋白酶的暗诱导和根区中相应的库的建立,随后在随后的光照下同化物的通量增强[gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba62.gydF4y2Ba]可包括叶绿体蛋白的降解,如Rubisco [gydF4y2Ba69.gydF4y2Ba],并涉及衰老相关液泡[gydF4y2Ba70gydF4y2Ba,释放肽和氨基酸供韧皮部上载和运输到基部茎的新汇[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba62.gydF4y2Ba].这解释了蛋白质,氨基酸和n之间的正相关性gydF4y2BatgydF4y2Ba在矮牵牛中形成(图。gydF4y2Ba3EgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba), minirose [gydF4y2Ba28.gydF4y2Ba]和菊花[gydF4y2Ba26.gydF4y2Ba].虽然蛋白质降解有助于泛素 - 蛋白酶体途径的养蛋白信号传导[gydF4y2Ba71.gydF4y2Ba蛋白水解选择性地涉及泛素连接酶(E3s),它通过靶向周期蛋白依赖的激酶抑制剂来控制细胞周期[gydF4y2Ba72.gydF4y2Ba],从而影响侧根和AR的发育[gydF4y2Ba73.gydF4y2Ba,gydF4y2Ba74.gydF4y2Ba].因此暗胁迫可能调节生长素介导的细胞周期进程,加速矮牵牛花AR的形成[gydF4y2Ba29.gydF4y2Ba].gydF4y2Ba
黑暗诱导自由氨基酸的积累gydF4y2Ba
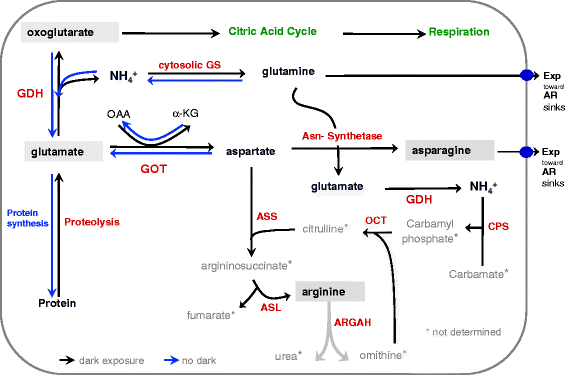
基于我们的发现,提出了一个黑暗诱导的游离氨基酸积累模型(图。gydF4y2Ba8gydF4y2Ba).延长的黑暗导致快速糖酵解消耗碳水化合物和低能量状态触发蛋白质水解和氨基酸分解代谢与谷氨酸为主要氨基酸。通过天门冬氨酸氨基转移酶(AspAT) =谷草转氨酶(GOT)的作用,谷氨酸的氨基(−NH2)转移到草酰乙酸(OAA),产生天门冬氨酸和α-酮戊二酸(α-KG)。这是由天冬氨酸(6 - 24hde)和谷氨酸(24 - 72hde)的积累支持的(图。gydF4y2Ba6 ngydF4y2Ba,gydF4y2Ba问gydF4y2Ba).此外,依赖NAD(H)的谷氨酸脱氢酶(GDH)将谷氨酸脱氨为氧戊二酸和游离NH4+,后者又被胞浆谷氨酰胺合成酶(GS)捕获,产生谷氨酰胺和谷氨酸并出口到库组织。天冬酰胺合成酶利用谷氨酰胺和天冬酰胺生成谷氨酸和天冬酰胺(24-168hde),而天冬酰胺作为AR形成的氮源输出到sink组织。这个过程也有助于谷氨酸(24-72hde)的瞬时积累(图。gydF4y2Ba6 ngydF4y2Ba)通过GDH再次释放到Oxoglutarate和Free NH4 +。为了防止NH4 +积累至毒性水平,NH 4 +和氨基甲酸酯是通过CARBA-MOYLPHOPHAT-合成酶(CPS)对氨基甲酰基磷酸氨基磷酸酯的作用而结的。最后,精氨酸积累(24-168HDE)(图。gydF4y2Ba5DgydF4y2Ba和gydF4y2Ba6 kgydF4y2Ba)在尿素循环中,可能有助于内源性没有合成,这对于AR形成中的IAA信号转导至关重要。gydF4y2Ba
碳水化合物耗尽辐射蛋白水解期间N重复滤成的代谢过程的示意图。扩展的黑暗导致碳水化合物耗竭和低能量状态,触发蛋白水解和氨基酸分解代谢与谷氨酸作为伯氨基酸。GDH将谷氨酸胺脱氨基酸盐,并通过细胞溶胶谷氨酰胺 - 合成酶(GS)捕获的游离NH 4 +以产生谷氨酰胺和谷氨酸。芦笋合成酶使用谷氨酰胺和天冬氨酸产生谷氨酸和天冬酰胺。两者,天冬酰胺和谷氨酰胺都出口以沉入组织作为氮资源。精氨酸积累在尿素循环中以防止NH4 +积累到毒性水平。gydF4y2Ba酶gydF4y2Ba: GDH - Glutamate-dehydrogenase, GS -谷氨酰氨合成酶,Asn - Asparagine-synthetase了——Glutamic-oxaloacetic转氨酶= AspAT -天冬氨酸转氨酶,屁股——Argininosuccinate-synthetase手语——Argininosuccinate-lyase ARGAH Arginine-amidohydrolase, 10月——Ornithin-carbamoyl-transferase CPS - Carbamoylphosphat-synthetase;gydF4y2Ba代谢物gydF4y2Ba: α-KG - α-酮戊二酸、OAA -草酰乙酸、CP -氨基甲酰磷酸盐、CT -氨基甲酸酯;gydF4y2Ba●gydF4y2Ba-细胞膜运输蛋白,gydF4y2Ba黑色箭头gydF4y2Ba- - - - - -gydF4y2Ba黑暗暴露gydF4y2Ba,gydF4y2Ba蓝色箭头gydF4y2Ba- - - - - -gydF4y2Ba没有黑暗gydF4y2Ba
结论gydF4y2Ba
在本研究中,我们首先证明了增强的氮浓度的切屑浓度没有改变新的根系专用细胞的建立,直至72小时。但是,随后,一个增强的ngydF4y2BatgydF4y2Ba岩屑加速进一步分化的早期解剖事件在AR形成干细胞基础直到168 h,紧随其后的是一个强劲增长的数量出现了ARs及其总长度在384 h。同时,黑暗暴露刺激AR形成岩屑,这与低N最为明显gydF4y2BatgydF4y2Ba.结果进一步清楚地表明,NgydF4y2BadgydF4y2Ba供体植株和扦插暗照射改变了氮的积累gydF4y2BatgydF4y2BaN分配到茎和叶组织的可溶性蛋白、氨基N和初级N代谢的主要氨基酸如谷氨酸、谷氨酰胺、asp、asn和精氨酸等代谢产物库。在这方面,研究表明,氮素代谢的发育和可逆衰老适应与氮素化合物的再活化促进了扦插中AR的形成。进一步分析代谢反应和包括植物激素相关途径在内的转录组,应结合候选因子的功能分析,以解开氮再流动如何刺激扦插中AR的形成。最后得出结论,优化的繁殖速率策略应包括供体植株施氮和随后扦插暗贮藏。为了提高生存和生根能力,需要改进质量评估系统[gydF4y2Ba75.gydF4y2Ba].他们可以认为氨基酸谱和/或复合氮气池作为切割质量的代谢指示剂以及碳水化合物在全球生产链中为幼苗。gydF4y2Ba
方法gydF4y2Ba
供体植物栽培gydF4y2Ba
年轻的植物gydF4y2Ba矮牵牛织布达gydF4y2Ba简历。Mitchell(基因型W115)是从种子体外培养的,然后转移到温室[gydF4y2Ba29.gydF4y2Ba].随后,它们被移植到1.1L罐中,填充泥炭基底的特殊混合物,没有缓慢释放肥料(Einheitserde典型的ED-73与Optifer,Patzer,Sinntal-Jossa,德国)。所有成熟射击尖端的每周切除诱导腋窝侧枝的持续增长。每次切除的射击尖端都有4-5个类似的大小的叶子,而两个腋窝节点仍然是其供体拍摄提供的网站,用于再生新芽和芽。储物厂的温室气候受到过度自然辐照度的阴影(光子通量密度(PPFD)>720μmolmgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba(400 - 700 nm)),昼长限制(10小时日光由不透明窗帘调节)和加热/通风温度设定点(白天20/22°C,夜间16/18°C)。在温室内记录了21天的平均日光积分(DLI)、相对湿度和空气温度,同时在切除前供体植株上有新的侧枝生长。这21天的平均值从2.4到14.2 mol m不等gydF4y2Ba−2gydF4y2BadgydF4y2Ba−1gydF4y2BaDLI(400-700 nm),相对湿度55至77%,4个培养期内的17至23°C空气温度(有关详细信息,请参阅其他文件中的补充数据gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba和gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
调节供体植物和插枝的生理机能gydF4y2Ba
所有供体植物最初以均匀的营养可用性,pH和渗透物质在泥炭底物中的渗透性(Einheitserde典型ED-73中的渗透性植物开始培养gydF4y2Ba−1gydF4y2Ba: 167没有gydF4y2Ba3.gydF4y2Ba-N,75 p,133 k,4.1 pH,盐等效1.83 g lgydF4y2Ba−1gydF4y2BaKCL)。Fifteen donor plants were assembled in each of two or three treatment plots for graduated nitrogen fertigation regimes while the different treatment plots comprised each of four replication plots (3 N-treatments × 4 replications × 15 plants = 180 plants assembled in 12 plots or 2 N-treatments × 4 replications × 15 plants = 120 plants assembled in 8 plots). The excised leafy cuttings were either transplanted immediately into a perlite substrate for adventitious root (AR) formation or exposed to a dark cool environment (see details below) prior to transplanting for AR formation.
在毕业氮肥剂量下培养供体植物gydF4y2Ba
为了区分可切除的叶状扦插植株的氮水平,供体植株接受三种不同的施肥方式,这三种施肥方式仅在氮量上不同,并在相似pH水平下提供所有剩余营养物质的正常供应。根据Zerche和Druege的研究,为了根据生物生长的环境变化调整养分用量,泥炭基质通过定期的化学分析进行控制[gydF4y2Ba27.gydF4y2Ba].gydF4y2Ba
在移植后约14天分化氮剂量,并在三个毕业的N-Dosage制度下通过营养溶液(每株150mL营养液和周)递送:ngydF4y2BadgydF4y2Ba低41 - 64 NgydF4y2BadgydF4y2Ba-高78-109和NgydF4y2BadgydF4y2Ba-每株和每周分别过量150-179 mg N。通过这种方法,在每个茎尖切除日期之前,供体植株栽培的不同时期积累了特定的总氮量(详情见附加文件)gydF4y2Ba1gydF4y2Ba).栽培至切除期最长的供体植株共吸收了973、1978和3611 mg NgydF4y2BadgydF4y2Ba低NgydF4y2BadgydF4y2Ba-和NgydF4y2BadgydF4y2Ba- 分别为剂量制度。gydF4y2Ba
通过适当和平衡的nhh组合,配制不同氮素状态下的营养液gydF4y2Ba4GydF4y2Ba没有gydF4y2Ba3.gydF4y2Ba(9%不gydF4y2Ba3.gydF4y2Ba-n + ngydF4y2Ba4GydF4y2Ba- n)和Ca(没有gydF4y2Ba3.gydF4y2Ba)gydF4y2Ba2gydF4y2Ba(19%CA + 14.5%NOgydF4y2Ba3.gydF4y2Ba-n + 1% nhgydF4y2Ba4GydF4y2Ba-n)根据Zerche和Druege [gydF4y2Ba27.gydF4y2Ba].所有其他宏观和微量营养素以相等的量加入到这些营养溶液中,使用复合肥培养基础1(14%P.gydF4y2Ba2gydF4y2BaOgydF4y2Ba5gydF4y2Ba, 38% kgydF4y2Ba2gydF4y2BaO,5%MgO和微量营养素;plantadüngemittelgmbh,德国雷根斯夫)。gydF4y2Ba
切割切除,暗暴露和照明珍珠岩插入AR形成gydF4y2Ba
成熟的切割切除(带4-5叶的射击尖端)仅在供体植物收到至少4小时灯后开始[gydF4y2Ba29.gydF4y2Ba].按氮水平和复制图采集插穗。在黑暗处理中,他们被放置在纸板盒中的无孔塑料袋中,并立即转移到一个10°C冷却的黑暗机柜中,持续7天。为了在日间光照下形成AR,将岩屑插入填充珍珠岩的托盘中(颗粒尺寸0-6 mm;可耐福珍珠岩有限公司,多特蒙德,德国),并置于昼夜循环的气候室中[gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].将插枝切除后直接插入/种植在珍珠岩中16天形成AR,或在黑暗中保存7天,然后插入9天(切除后16天)形成AR。在每个切除日期,每个复制地块和与平行取样有关的处理组合收集限定的插枝数量,以检查(i)组织学阶段(2个插枝),(ii)生根能力(10个插枝)和(iii)生物量生长(10个插枝)或(iv) nf池(10 - 15个插枝)的生化分析,(v)游离氨基酸(2个或5个切块)和(vi)可溶性蛋白质(2个切块)。因此,多因素试验选择性地考虑了氮素水平、黑暗暴露时间、插入(种植)后时间和日光暴露等单一处理或组合环境因子对AR形成的影响。根据Klopotek等人的说法,统一的时间尺度适用于所有样本[gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba40gydF4y2Ba]分别利用切除后小时(hpe)、暗照射后小时(hde)和AR形成后插入后小时(hpin)。gydF4y2Ba
评估AR形成的能力gydF4y2Ba
对于不定根形成,每个复制地块插入10根扦插到珍珠岩盘中,每天浇水一次,并盖上透明罩以保持湿度。AR形成的培养在植管中持续16或9天(按单独实验定义为384 hpin或216 hpin)。在光照10 h /暗14 h、温度22℃/夜20℃、湿度85% /夜60%的昼夜循环条件下,均维持生长条件。荧光管(Master TLD 58 W 830,暖白,飞利浦,荷兰)提供100 μmol m的光gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2BaPPFD (400-700 nm) [gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].gydF4y2Ba
根据标准程序,AR形成能力被均匀地定为384 hpe(切除后小时)[gydF4y2Ba27.gydF4y2Ba,gydF4y2Ba29.gydF4y2Ba].这个常数时间384 hpe正好与384 hpin后插入珍珠岩(小时)的直接种植下的基于“增大化现实”技术的形成昼夜光或包含一个初始时间168年hde黑暗暴露(小时)是完成种植下的基于“增大化现实”技术的形成昼夜光216年hpin(即384 hpe = 168 hde + 216 hpin)def我ned我ntheexperiment. Accordingly the number of adventitious roots was counted at each inserted cutting while all the roots were assigned to their classes of root length in 10 mm ranges. The total number of roots per inserted cutting (TRN), the root number per length class per cutting (RNC), the mean single root length (SRL), the total root length per inserted cutting (TRL) and the percentage of unrooted cuttings (URC) were calculated as follows:
每插入切割总数(TRN):gydF4y2Ba
每次切割每长度类根数(RNC):gydF4y2Ba
单根长度(SRL, mm):gydF4y2Ba
每切割总长度(TRL,CM):gydF4y2Ba
无根据切割的百分比(URC,%):gydF4y2Ba
在哪里gydF4y2BangydF4y2Ba代表每个插入切割的根数,gydF4y2Ba我gydF4y2Ba每个复制地块插入10个插片,gydF4y2BalgydF4y2BaxgydF4y2Ba是长度间隔的平均长度(例如1.5cm的长度范围为1.0-2.0 cm),gydF4y2BangydF4y2BaLxgydF4y2Ba是特定长度区间内的根数,和gydF4y2BangydF4y2BazgydF4y2Ba是每次复制10个插枝中无根插枝的数量。gydF4y2Ba
生根区的组织学检查gydF4y2Ba
采用72 hpin (=72 hpe)和168 hpin (=168 hpe)两种氮处理(2570 μmol N低氮素吸收水平),在AR形成过程中采集了5 mm枝条的基部茎组织gydF4y2BatgydF4y2Ba在3625 μmol N时N高gydF4y2BatgydF4y2Ba).如Haensch详细描述的,样品制备和组织学分析基本完成[gydF4y2Ba76.gydF4y2Ba].简而言之,将基础部分嵌入羟乙基甲基丙烯酸酯(Histo-Technet-Set Technocit 7100; Kulzer,Wehrheim,Germany)中,切成6μm的部分,并用0.05%甲苯胺蓝澳(Serva,Heidelberg,德国)染色。使用AxioImager A1显微镜与Axiocam MRC5相机(Carl Zeiss,Jena,Germany)和软件AxioVision Rel,进行微观分析。4.7.1。原始图像补充有嵌入的注释和比例条。gydF4y2Ba
生化测量与分析gydF4y2Ba
总氮和分馏氮池(整个茎尖)gydF4y2Ba
分析总氮(NgydF4y2BatgydF4y2Ba),每复制图采样,四个分馏的氮气(NF池:氨基池:氨基,氨基-N,氨基-N和不溶性蛋白-N),并在60℃下轻轻地干燥10-15个切割。48小时。一种适应的kjeldahl方法[gydF4y2Ba77.gydF4y2Ba]用于消化300 mg干燥和粉碎的亚样品(1 g维宁格试剂(w/w 96,5%钠)gydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4GydF4y2Ba;1、5% CuSOgydF4y2Ba4GydF4y2Ba;% K % K % KgydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4GydF4y2Ba + 10 ml 98 % H2gydF4y2Ba所以gydF4y2Ba4GydF4y2Ba)并确定总氮(ngydF4y2BatgydF4y2Ba)经水蒸汽蒸馏法(Büchi凯氏定氮管线:K-435, B-324, Titrino 719S;Büchi & Metrohm,瑞士)。另一个500mg的亚样品在50ml 1% w/v KAl(SO)中提取gydF4y2Ba4GydF4y2Ba)gydF4y2Ba2gydF4y2Ba(Shaker KL 2, Edmund Bühler GmbH, Germany),并通过一个折叠过滤器(Schleicher&Schüll 595½)。为了测定每个nf池中的氮,每10毫升的提取液用于三种蒸馏:(i)纯酰胺-N, (ii)用Devarda合金还原硝酸盐(w/w 45% Al, 50% Cu, 5% Zn),以及(iii)与N一起消化氨基-NgydF4y2BatgydF4y2Ba.最后,(iv)在滤饼和滤纸中分析不溶性蛋白n(消化:2g维宁格试剂+ 4g K)gydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4GydF4y2Ba + 20 ml 98 % H2gydF4y2Ba所以gydF4y2Ba4GydF4y2Ba).各氮池的氮含量、氮池总数和总氮(NgydF4y2BatgydF4y2Ba)计算为μmol N ggydF4y2Ba−1gydF4y2Ba干燥质量(DM)。氮的回收率可以采用nf池的总和,而N是独立确定的值gydF4y2BatgydF4y2Ba在100±5%的范围内吻合。gydF4y2Ba
可溶性蛋白(叶、茎基部)gydF4y2Ba
对于在AR形成期间的可溶性蛋白质分析,在定义的时间点的每复制图中收集两个切屑。从完全开发的两种切割的第二个最旧的叶子中,每两种椎间盘都被切除并用一叶样品(2×2圆盘,ø4mm,45±12mg fm)组合,而左右薄层组织立即采样中静脉和叶边界。两种切屑的基底干序作为一个茎样样品(2×5mm,114±31mg Fm)组合。将所有样品在液氮中冻结,并在-80℃下储存,在低温球磨机(RetSch MM 301,Haan,Haan,Haan,Haan,Haan,German)中均化,并在1ml含有50mM Tris-HCl的缓冲液中提取,pH 6.8,5mM MgClgydF4y2Ba2gydF4y2Ba,5mM巯基乙醇,15%甘油,1mM EDTA,1mM EGTA,0.1mm PEFabloc。将0.1ml的萃取等分试样与1ml Bradford试剂(Sigma-Aldrich Chemie GmbH,慕尼黑,德国)和可溶性蛋白质混合[gydF4y2Ba78.gydF4y2Ba通过分光光度计(Spekol 11,Carl Zeiss,Jena,德国)定量为595nm。用真正的标准(BSA - 白蛋白来自牛血清,Sigma-Aldrich,Germany)计算蛋白质的浓度,并以μgg表示gydF4y2Ba−1gydF4y2Ba调频。gydF4y2Ba
自由蛋白质含氨基酸(叶和茎碱)gydF4y2Ba
叶片和茎基组织的游离氨基酸分析,每5 (gydF4y2BaExp。3 AA-ND,设计详情请见之前或其他文件gydF4y2Ba)或两个(gydF4y2BaExp。5 AA-DCRgydF4y2Ba)在每个复制地块和规定的时间点采集插穗。切取2个叶盘(1 × 2叶盘,在中脉左右两侧,Ø 4 mm, 25±5 mg FM),每次切取发育完全的第2老叶;gydF4y2BaExp。3 AA-NDgydF4y2Ba)或两个(gydF4y2BaExp。3 AA-DCRgydF4y2Ba)获得了复制的叶样品。每个切割(1×5mm,50±15mg FM)的基底茎段分别贡献了五个或两种复制的茎样品。将样品立即冷冻在液氮中并储存在-80℃。每个样品在低温球磨机(RetSch mm 301,Haan,Haan,德国)中的均匀化在恒温器振动器(80℃,45分钟)中的500μl80%乙醇中(Thermixer Comfort,Eppendorf,Germany)。冷却15分钟后,将样品以14,000rpm和4℃离心5分钟。将上清液转移到新管中并在真空浓缩器(救助SpeedVac,SPD111V,Thermo Fisher Scientific,Germany)以50℃蒸发至干燥(60-90分钟)。干燥残余物在150μl中溶解(gydF4y2BaExp。3 AA-NDgydF4y2Ba250μl(gydF4y2BaExp。5 AA-DCRgydF4y2Ba),或在−20°C冷冻直到分析,或直接在14000 rpm离心1分钟。根据Ahkami等人2009年的研究,6-氨基喹啉- n -羟基琥珀酰亚胺氨基甲酸酯(AQC)衍生出了一个分馏物[gydF4y2Ba8gydF4y2Ba].计算18种氨基酸的个体含量及其保留的氮量为nmol ggydF4y2Ba−1gydF4y2BaFM和nmol NgydF4y2BatgydF4y2BaggydF4y2Ba−1gydF4y2Ba调频。总游离氨基酸(AA)及其相关的总氮含量(AA-N.gydF4y2BatgydF4y2Ba)以μmolg表示gydF4y2Ba−1gydF4y2Bafm和nmol aa-ngydF4y2BatgydF4y2BaggydF4y2Ba−1gydF4y2Ba分别调频。gydF4y2Ba
统计分析gydF4y2Ba
氮(N吸收gydF4y2BatgydF4y2Ba研究了供体植物施氮(N .)、氮库(N -库)、不定根(AR)形成、早期细胞学事件(CYT)、游离氨基酸(AA)和可溶性蛋白(PR)对供体植物施氮(N .)等不同或组合环境因子的响应gydF4y2BadgydF4y2Ba),并且在10个实验中完全在十个实验中接触暗(d)和在昼夜光(Cr)的切屑培养期间,切割切割的时间后切除切割。在这些实验中,应用了在附加文件中指定的阶乘设计gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba和gydF4y2Ba3.gydF4y2Ba并将结果分配到Figs中。gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4GydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6克ydF4y2Ba和gydF4y2Ba7gydF4y2Ba(gydF4y2Ba实验:1 NF-N, 2 AR-ND, 3 AA-ND, 4 AR-D, 5 AA-DCR, 6 NF-ND, 7 AR-N±CYT, 8 PR-NDCR, 9 NF-NDCRgydF4y2Ba).数据分析软件系统STATISTICA采用ANOVA/MANOVA [gydF4y2Ba79.gydF4y2Ba].全氮(NgydF4y2BatgydF4y2Ba)和NgydF4y2BatgydF4y2Ba分配给nf池以及NgydF4y2BatgydF4y2Ba并且在基本统计模块中进行了切屑的根本。使用Tukey的诚实的显着差异(HSD)测试(α= 0.05)评估平均值之间的差异,并且在P≤0.05的相关系数中被认为是显着的。在单个图中,垂直条表示最小二乘(LSM)值的95%置信区间,作为电流相互作用效果的均匀标准度量。从而将LSM值的95%置信区间的计算被接受为默认软件模式。在适当的情况下,在进行的加权平均值的95%置信区间的计算,以显示在当前相互作用效果中的单个平均值的分散中的可变偏差。数据点上的不同小写字母表示显着的差异gydF4y2BaPgydF4y2Ba ≤ 0.05.
缩写gydF4y2Ba
- AA:gydF4y2Ba
-
自由氨基酸gydF4y2Ba
- ar:gydF4y2Ba
-
不定根gydF4y2Ba
- 参数:gydF4y2Ba
-
精氨酸gydF4y2Ba
- 作为:gydF4y2Ba
-
天冬酰胺合成酶基因gydF4y2Ba
- ASN:gydF4y2Ba
-
芦笋gydF4y2Ba
- asp:gydF4y2Ba
-
天冬氨酸gydF4y2Ba
- CK:gydF4y2Ba
-
细胞分裂素gydF4y2Ba
- cyt:gydF4y2Ba
-
细胞学事件gydF4y2Ba
- 遗传算法:gydF4y2Ba
-
吉布林斯gydF4y2Ba
- gln:gydF4y2Ba
-
谷氨酰胺gydF4y2Ba
- glu:gydF4y2Ba
-
谷氨酸gydF4y2Ba
- hde:gydF4y2Ba
-
几个小时的黑暗博览会gydF4y2Ba
- hpe:gydF4y2Ba
-
切除岗位gydF4y2Ba
- hpin:gydF4y2Ba
-
插入后的小时(即在昼夜光线下在珍珠岩基板中种植后的灭菌衬底)gydF4y2Ba
- 国际宇航科学院:gydF4y2Ba
-
吲哚-3-醋酸gydF4y2Ba
- NgydF4y2BadgydF4y2Ba水平:gydF4y2Ba
-
供氮水平gydF4y2Ba
- NF-POOLS:gydF4y2Ba
-
氮的分馏池gydF4y2Ba
- 不:gydF4y2Ba
-
一氧化氮gydF4y2Ba
- NgydF4y2BatgydF4y2Ba:gydF4y2Ba
-
总氮gydF4y2Ba
- 拍:gydF4y2Ba
-
极地生长素运输gydF4y2Ba
- 销:gydF4y2Ba
-
植物素转运蛋白销形成gydF4y2Ba
- PR:gydF4y2Ba
-
可溶性蛋白质gydF4y2Ba
- RNC:gydF4y2Ba
-
每次切割每长度类的根数gydF4y2Ba
- 生存研究实验室:gydF4y2Ba
-
单根长度gydF4y2Ba
- TRL:gydF4y2Ba
-
每插入切割总长度gydF4y2Ba
- TRN:gydF4y2Ba
-
每次扦插总根数gydF4y2Ba
参考文献gydF4y2Ba
- 1。gydF4y2Ba
高等植物氮素同化相关的标记和信号。acta botanica sinica(云南植物研究)2003;54(2):585-93。gydF4y2Ba
- 2。gydF4y2Ba
Sulpice R, Nikoloski Z, Tschoep H, Antonio C, Kleessen S, Larhlimi A, Selbig J, Ishihara H, Gibon Y, Fernie AR,等。碳氮供应对拟南芥材料代谢和生物量关系和连通性的影响(1w OA)。植物杂志。2013;162(1):347 - 63。gydF4y2Ba
- 3。gydF4y2Ba
刘锐,陈胜,姜军,朱丽,郑超,韩胜,顾军,孙军,李慧,王慧,等。菊花插枝不定根形成过程中基部蛋白质组的变化。BMC基因组学。2013;14:919。gydF4y2Ba
- 4.gydF4y2Ba
Da Costa CT,De Almeida Mr,Ruedell Cm,Schwambach J,Maraschin FS,Fett-Neto AG。当压力和发展齐头并进时:扦插偶然生根的主要激素控制。前植物SCI。2013; 4:133。gydF4y2Ba
- 5。gydF4y2Ba
2 .黄志强,李志强,李志强,等。不定根与侧根的异同。植物学报。2014;65(1):639-66。gydF4y2Ba
- 6。gydF4y2Ba
negi s,sukumar p,liu x,cohen jd,muday gk。乙烯在番茄中调节杂氮依赖性侧和不定根形成的遗传解剖。工厂J.2010; 61(1):3-15。gydF4y2Ba
- 7。gydF4y2Ba
acta botanica yunnanica(云南植物研究中心);acta botanica yunnanica(云南植物研究中心);acta botanica yunnanica(云南植物研究中心)植物科学进展。2013;18(8):455-63。gydF4y2Ba
- 8.gydF4y2Ba
Ahkami啊,Lischewski S,Haensch K-T,Porfirova S,Hofmann J,Rolletschek H,Melzer M,Franken P,Hause B,Druege U等。不定根形成内杂交的分子生理学:伤口反应和初级代谢的参与。新植物。2009; 181(3):613-25。gydF4y2Ba
- 9.gydF4y2Ba
Ahkami A,Scholz U,Steuernagel B,Steuernagel B,Stekert M,Haensch Kt,Druege U,Reinhardt D,Nouri E,Von Wiren N,Franken P等人。综合转录组分析释放出在Petunia Hybrida偶然根部形成期间调节初级代谢的关键基因的存在。Plos一个。2014; 9(6):E100997。gydF4y2Ba
- 10。gydF4y2Ba
植物扦插不定根形成过程中激素的稳态、信号转导和功能。植物科学学报2016;7:381。gydF4y2Ba
- 11.gydF4y2Ba
Blabesley D,Weston Gd,JF大厅。内源性生长素在根起始部分的作用I:来自研究疾病应用的证据,以及内源水平的分析。植物生长调节。1991; 10:341-53。gydF4y2Ba
- 12.gydF4y2Ba
Pagnussat GC。一氧化氮和环GMP是吲哚乙酸诱导不定根过程中的信使分子。植物杂志。2003;132(3):1241 - 8。gydF4y2Ba
- 13。gydF4y2Ba
Flores T,Todd CD,Tovar-Mendez A,Dhanoa PK,Correa-Aragunde N,Hoyos Me,Brownfield DM,Mullen Rt,Lamattina L,Polacco JC。拟南芥的氨基酶 - 阴性突变体表现出根部发育中的增加的一氧化氮信号传导。植物理性。2008; 147(4):1936-46。gydF4y2Ba
- 14。gydF4y2Ba
郑Z,郭Y,诺瓦克O,戴X, Y, Ljung K, Noel JP Chory j .协调生长素和乙烯生物合成的转氨酶VAS1。中国生物化学学报。2013;9(4):244-6。gydF4y2Ba
- 15.gydF4y2Ba
博格雷L,亨利克斯R,马扎尔Z. TOR的生长素之旅。EMBO j . 2013; 32(8): 1069 - 71。gydF4y2Ba
- 16。gydF4y2Ba
关键词:矮牵牛,茎尖扦插,吲哚-3-乙酸,生长素运输,碳水化合物代谢,不定根形成足底。2013;238:499 - 517。gydF4y2Ba
- 17。gydF4y2Ba
Druege U,Zerche S,Kadner R.氮气和储存受影响的碳水化合物,在低光下的生存和不定根形成方面的高型颅骨切割中的碳水化合物分区。Ann Bot。2004; 94(6):831-42。gydF4y2Ba
- 18。gydF4y2Ba
Rapaka VK,Bessler B,Schreiner M,Druege U.在初始碳水化合物可用性,当前光合作用和颅骨扦插中的不定根形成之间的相互作用。植物SCI。2005; 168(6):1547-60。gydF4y2Ba
- 19.gydF4y2Ba
刘芳,郭凤琴。一氧化氮缺乏加速暗诱导的拟南芥叶片衰老过程中叶绿素的分解和类囊体膜稳定性的损失。PLoS ONE。2013; 8 (2): e56345。gydF4y2Ba
- 20.gydF4y2Ba
基于13C和15N标记的落叶松叶茎插枝碳和氮的迁移及其与生根的关系树生理。2000;20:807-14。gydF4y2Ba
- 21.gydF4y2Ba
陈志强,陈志强。桑树扦插生根过程中氮素水平和游离氨基酸的变化。杂志。1983;(3):59 455 - 60。gydF4y2Ba
- 22.gydF4y2Ba
玉米源叶片对氮素缺乏的适应不仅影响氮素和碳的代谢,而且还影响磷素稳态的控制。植物杂志。2012;160(3):1384 - 406。gydF4y2Ba
- 23.gydF4y2Ba
陈志强,陈志强,陈志强,等。低氮营养对向日葵叶片衰老的诱导作用。杂志。2010;138(3):256 - 67。gydF4y2Ba
- 24.gydF4y2Ba
是时候做出改变了:通过营养信号调节根系结构。[J] .机器人。2014;65(3):769-78 .]gydF4y2Ba
- 25.gydF4y2Ba
豆科植物根系结构的氮素调控信号通路涉及植物激素和小调控分子。植物科学学报2013;4:385。gydF4y2Ba
- 26.gydF4y2Ba
黄志强,王志强,王志强,等。采前供氮和冷藏条件对菊花扦插生根的影响。安机器人。2000;85(5):687 - 701。gydF4y2Ba
- 27.gydF4y2Ba
Zerche S,Druege U.氮含量决定了在足够的光线下独立于预生根的碳水化合物耗尽切屑的偶然光下偶然生根。SCI Hortic。2009; 121(3):340-7。gydF4y2Ba
- 28.gydF4y2Ba
接种丛枝菌根真菌改变了微型月季不定根早期扦插成分的变化。acta Hortic sinica, 2004; 29(5): 624-34。gydF4y2Ba
- 29.gydF4y2Ba
KLOPOTEK Y,Haensch K-T,Hause B,Hajirezaei M-R,Druege U. Druege U. Drunia Cuttings的黑暗曝光强烈提高了不定根形成,并在灯光中加强了碳水化合物可用性。J植物理性。2010; 167(7):547-54。gydF4y2Ba
- 30.gydF4y2Ba
植物激素在库源关系调控中的作用。出自:佩特拉·M,编辑。高等植物的马氏矿物质营养。伦敦:学术;2012.120 - 31页。gydF4y2Ba
- 31。gydF4y2Ba
德鲁奇U,弗兰肯P,丽思欣斯基S,Ahkami啊,Zerche S,Hause B,Hajirezaei M-R。转录组分析显示乙烯作为刺激剂和植物素作为矮牵牛扦插在不定根形成的调节因子。前植物SCI。2014; 5:494。DOI:gydF4y2Ba10.3389 / FPLS.2014.00494gydF4y2Ba.gydF4y2Ba
- 32。gydF4y2Ba
氮与细胞分裂素的相互作用及其在代谢和发育中的作用。植物科学进展。2006;11(9):440-8。gydF4y2Ba
- 33。gydF4y2Ba
Kamada-Nobusada T,Makita N,Kojima M,Sakakibara H. De Novo Cytokinin生物合成中的氮依赖调节水稻:谷氨酰胺代谢作为额外信号的作用。植物细胞生理。2013; 54(11):1881-93。gydF4y2Ba
- 34。gydF4y2Ba
香石竹不定根生根的早期步骤:形态、激素谱和碳水化合物代谢。杂志。2014;150(3):446 - 62。gydF4y2Ba
- 35。gydF4y2Ba
Perilli S,Moubayidin L,Sabatini S.细胞素蛋白功能的分子基础。CurrOp植物BIOL。2010; 13(1):21-6。gydF4y2Ba
- 36。gydF4y2Ba
生长素和细胞分裂素对拟南芥不定根顶端静止中心形成的控制。安机器人。2013;112(7):1395 - 407。gydF4y2Ba
- 37。gydF4y2Ba
张志强。营养对植物激素内源浓度的影响。出自:佩特拉·M,编辑。《高等植物的矿物质营养》第3版。伦敦:学术版;2012.127 - 9页。gydF4y2Ba
- 38。gydF4y2Ba
Bhalerao Rp,EkloèJ,Ljung K,Marchant A,Bennett M,Sandberggèr。射击植物素对于拟南芥幼苗早期的根出来至关重要。工厂J. 2002; 29(3):325-32。gydF4y2Ba
- 39。gydF4y2Ba
Santos Km,Fisher Pr,Yeager Th,Simonne eh,Carter Hs,Argo Wr。矮牵牛植物营养状况对繁殖过程中肥料反应的影响。J植物Nutr。2011; 34:1424-36。gydF4y2Ba
- 40.gydF4y2Ba
矮牵牛(Petunia hybrida)扦插的不定根形成过程中,生根区和转化酶具有较高的库竞争力。植物科学。2016;243:10-22。gydF4y2Ba
- 41.gydF4y2Ba
Santos KM, Fisher PR, Argo WR。营养扦插的组织营养水平调查。土壤通报,2011;42(6):669-93。gydF4y2Ba
- 42.gydF4y2Ba
Zerche S, Drüge U, Kadner R. Nitrat zeigt innere Qualität -菊花stecklingen的地位和Bewurzelung。Gartnerborse。2001年,101(2):拿下。gydF4y2Ba
- 43.gydF4y2Ba
陈志强,陈志强。一品红扦插生根和生长过程中组织元素浓度的变化。HortScience。1995; 30(3): 617 - 9。gydF4y2Ba
- 44.gydF4y2Ba
在光/暗循环和延长黑暗条件下,整个玉米植株中碳饥饿相关的蛋白质水解的诱导。植物杂志。1998;117:1281 - 91。gydF4y2Ba
- 45.gydF4y2Ba
李志刚,李志刚,李志刚,等。硝酸还原酶的翻译后调控机制及其意义[j]。[J] .中国生物医学工程学报。2004;55(01):1275-82 .]gydF4y2Ba
- 46.gydF4y2Ba
Cheible WR,Morcuende R,Czechowski T,Fritz C,Osuna D,Palacios-Rojas N,Schindelasch D,Zhimm O,udvardi Mk,Stift M. Genome-宽的初级和次生代谢,蛋白质合成,细胞生长过程的基因组重新编程,和拟南芥的监管基础设施响应氮。植物理性。2004; 136(1):2483-99。gydF4y2Ba
- 47.gydF4y2Ba
Forde BG,Lea PJ。植物中的谷氨酸:代谢,调节和信号。J Exp Bot。2007; 58(9):2339-58。gydF4y2Ba
- 48.gydF4y2Ba
王L,江j,宋A,王H,李P,关Z,陈F,陈S.菊花颈动脉对氮缺乏症的比较转录分析。SCI Hortic。2015; 195:101-7。gydF4y2Ba
- 49.gydF4y2Ba
叶柄光合作用对天竺葵根形成的影响。43杂志。1978;(2):136 - 41。gydF4y2Ba
- 50。gydF4y2Ba
(4)蛋氨酸氧化物和氮转运氨基酸与驯化玉米幼苗的分析。氨基酸。2007;33:607 - 6013。gydF4y2Ba
- 51。gydF4y2Ba
Kant S,Bi Ym,Rothstein SJ。了解植物对氮气限制改善作物氮利用效率的影响。J Exp Bot。2011; 62(4):1499-509。gydF4y2Ba
- 52。gydF4y2Ba
Delrot S,Atanassova R,Maurouset L.调节糖,氨基酸和肽植物膜转运蛋白。Biochim Biophys Acta。2000; 1465:281-306。gydF4y2Ba
- 53。gydF4y2Ba
Weckenmann D,Martin P.内肽酶活性和在光明和黑暗中的尼古利亚纳鲁察叶片中的氮气动员。physiol植物。1984; 60(3):333-40。gydF4y2Ba
- 54。gydF4y2Ba
Lea PJ, Sodek L, Parry MAJ, Shewry PR, Halford NG。天冬酰胺的植物。中国科学(d辑:地球科学)2007;gydF4y2Ba
- 55。gydF4y2Ba
文耶Z.后基因组时代植物中的氮代谢。年度工厂审查。2010; 42(Wiley-Blackwell(John Wiley&Sons Ltd的印记)):366。gydF4y2Ba
- 56。gydF4y2Ba
Beato VM,Rexach J,Navarro-Gochicoa MT,Camacho-Cristobal JJ,Herrera-Rodriguez MB,Maldonado JM,Gonzalez-Fontes A.含烟和氮地位应对碳和氮地位,其根系表达受到硼胁迫的影响。植物SCI。2010; 178(3):289-98。gydF4y2Ba
- 57。gydF4y2Ba
Masclaux-Daubresse C,Daniel-Vedele F,Dechorgnat J,Chardon F,Gaufichon L,Suzuki A.植物中的氮气吸收,同化和重新化:可持续和生产性农业的挑战。Ann Bot。2010; 105(7):1141-57。gydF4y2Ba
- 58。gydF4y2Ba
玉米源叶片代谢对碳、氮、磷平衡胁迫的适应。BMC基因组学。2013;14:442。gydF4y2Ba
- 59。gydF4y2Ba
Rubio-Wilhelmi MM, Sanchez-Rodriguez E, Rosales MA, Blasco B, Rios JJ, Romero L, Blumwald E, Ruiz JM。PSARK中铵的形成和同化gydF4y2Ba∷gydF4y2Baacta botanica sinica(云南植物学报),2012;gydF4y2Ba
- 60.gydF4y2Ba
在低能量胁迫下,拟南芥转录因子bZIP1和bZIP53的异源二聚体重组氨基酸代谢。植物学报。2011;23(1):381-95。gydF4y2Ba
- 61.gydF4y2Ba
USADEL B,Blasing Oe,Gibon Y,Retzlaff K,Hohne M,Gunther M,Stitt M.全球转录水平响应拟南芥玫瑰花属植物中的碳水化合物逐渐耗尽过程中碳状况的小变化。植物理性。2008; 146(4):1834-61。gydF4y2Ba
- 62.gydF4y2Ba
Bieker S,Zentgraf U:植物衰老和氮气动员和信号传导。衰老和衰老相关的疾病。在:王志伟(ed)。2013. p。53-83。ISBN:Intech:978-953-51-0997-6。DOI:105772/54392(可从:gydF4y2Bahttp://dx.doi.org/10.5772/54392)gydF4y2Ba.gydF4y2Ba
- 63.gydF4y2Ba
Potel F, Valadier MH Ferrario-Mery年代,Grandjean O,莫林H, Gaufichon L, Boutet-Mercey年代,Lothier J, Rothstein SJ, Hirose N, et al。拟南芥中过量铵的同化为氨基酸和氮的转运-叶片中谷氨酸合成酶和氨甲酰磷酸合成酶的作用。2月j . 2009; 276(15): 4061 - 76。gydF4y2Ba
- 64.gydF4y2Ba
植物精氨酸生物合成的基因、酶和调控。植物生理与生物化学。2005;43(8):729-45。gydF4y2Ba
- 65.gydF4y2Ba
Miyashita y,好ag。NAD(H) - 依赖谷氨酸脱氢酶对于拟南芥在黑暗诱导的碳饥饿期间的拟南芥存活至关重要。J Exp Bot。2008; 59(3):667-80。gydF4y2Ba
- 66.gydF4y2Ba
林HM,Hsieh MH,Coruzzi G.拟南芥中光和代谢物的不同附加冬酰胺合成酶基因的互核调节。工厂J.998; 16(3):345-53。gydF4y2Ba
- 67.gydF4y2Ba
Buchanan-Wollaston V, Page T, Harrison E, Breeze E, Lim PO, Nam HG, Lin J- f, Wu S-H, Swidzinski J, Ishizaki K,等。比较转录组分析揭示了拟南芥发育衰老和黑暗/饥饿诱导衰老之间的基因表达和信号通路的显著差异。植物j . 2005; 42(4): 567 - 85。gydF4y2Ba
- 68.gydF4y2Ba
Tome F,Nagele T,Adamo M,Garg A,Marco-Llorca C,Nukarinen E,Pevrotti L,Peviani A,Simeunovic A,Tatkiewicz A等。低能量信令网络。前植物SCI。2014; 5(第353条):1-12。gydF4y2Ba
- 69.gydF4y2Ba
Feller U, Anders I, Mae T. Rubiscolytics: Rubisco在细胞中的酶功能终止后的命运。中国生物医学工程学报。2008;59(7):1615-24。gydF4y2Ba
- 70。gydF4y2Ba
Martinez DE, Costa ML, Gomez FM, Otegui MS, Guiamet JJ。“衰老相关液泡”参与了烟草叶片叶绿体蛋白的降解。植物j . 2008; 56(2): 196 - 206。gydF4y2Ba
- 71。gydF4y2Ba
Woodward AW,Bartel B.植物:调节,行动和互动。Ann Bot。2005; 95(5):707-35。gydF4y2Ba
- 72.gydF4y2Ba
Marrocco K, Bergdoll M, Achard P, Criqui MC, Genschik P.选择性蛋白水解决定了细胞周期的节奏。植物学报。2010;13(6):631-9。gydF4y2Ba
- 73.gydF4y2Ba
Nodzon La,Xu Wh,王Ys,Pi Ly,Chakrabarty PK,Song Wy。泛素连接酶XBAT32调节拟南芥中的侧向根部发育。工厂J. 2004; 40(6):996-1006。gydF4y2Ba
- 74。gydF4y2Ba
王海东,马金坤,闫艳,曹勇,孙述平,徐光华。OsSIZ1调控水稻营养生长和生殖发育。植物学报2011;29(2):411-7。gydF4y2Ba
- 75。gydF4y2Ba
LOHR D,Tillmann P,Zerche S,Druege U,Rath T,Meinken E.近红外反射光谱(NIRS)近红外反射光谱(NIRS)进行叶状装饰切割的氮气状态的非破坏性测量。生物系统工程。2016; 148:157-67。gydF4y2Ba
- 76。gydF4y2Ba
豪舍kt。腹腔腹部腹腔培养中体细胞胚胎结构的形态学组织学研究。植物细胞代表2004; 22:376-81。gydF4y2Ba
- 77。gydF4y2Ba
Jakob F,Vielemeyer HP,Podlesak W.氮素级分的适用性研究诊断冬小麦(Triticum-Aestivum L)的氮气状态。Archiv Fuer Acker und Pflanzenbau und Bodenkunde - Arch Agron土壤SCI。1986; 30(10):599-605。gydF4y2Ba
- 78。gydF4y2Ba
布拉德福德mm。利用蛋白质染料结合原理的微克数量蛋白质量化的快速敏感方法。肛门生物化学。1976; 72:248-54。gydF4y2Ba
- 79。gydF4y2Ba
StatSoft: STATISTICA for Windows(数据分析软件系统),Version 6, (gydF4y2Bawww.statsoft.com.gydF4y2Ba).互联网2004。gydF4y2Ba
确认gydF4y2Ba
我们感谢Sabine Czekalla, Barbara Weinlich和Katrin Schultz(都是IGZ),他们在种植供体植物和扦插、取样以及熟练的化学和组织学分析方面提供了出色的技术援助。gydF4y2Ba
资金gydF4y2Ba
这项工作由德国研究基金会(DFG, DR411/2-1)资助,并得到萨克森-安哈尔特州、勃兰登堡州、图林根自由州和德意志联邦共和国的支持。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
所有支持我们结论的数据都包含在手稿和附加文件中。gydF4y2Ba
作者的贡献gydF4y2Ba
SZ,Kth和UD设计并进行了研究。SZ和Kth分析了数据。SZ用Kth的组织学贡献写了一篇文章,以及MRH对模型的发展的贡献。UD和MRH编辑了稿件。所有作者阅读并认可的终稿。gydF4y2Ba
利益争夺gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
通讯作者gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:gydF4y2Ba
岩屑氮预处理实验1-9。(PDF 22 kb)gydF4y2Ba
附加文件2:gydF4y2Ba
统计分析的实验设计说明。(PDF 13 kb)gydF4y2Ba
附加文件3:gydF4y2Ba
图2至7的补充数据。(PDF 31 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
Zerche, S, Haensch, KT。Druege U。gydF4y2Baet al。gydF4y2Ba在可逆性的黑暗诱导的碳水化合物消耗中,氮的再调动有利于不定根的形成gydF4y2Ba矮牵牛织布达gydF4y2Ba.gydF4y2BaBMC植物BIOL.gydF4y2Ba16,gydF4y2Ba219(2016)。https://doi.org/10.1186/s12870-016-0901-6gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-016-0901-6gydF4y2Ba
关键字gydF4y2Ba
- 根原基gydF4y2Ba
- 分生组织gydF4y2Ba
- 根伸长gydF4y2Ba
- 缺氮gydF4y2Ba
- 暗反应gydF4y2Ba
- 碳水化合物消耗gydF4y2Ba
- 氨基酸gydF4y2Ba
- 不定根的形成gydF4y2Ba