摘要
背景
一小群F箱蛋白,由与域与聚糖结合蛋白质同源的域连接的保守的F盒结构域组成,在基因组内拟南芥.以前,所谓的F-box-Nictaba蛋白,由基因编码AT2G02360,被证明是一种具有结合功能的凝集素n乙酰丙基酰胺结构。在这里,我们提出了一种详细的QRT-PCR表达分析F-box-Nictaba在拟南芥植物造成不同应力和激素治疗。
结果
的表达F-box-Nictaba用水杨酸和植物感染植物治疗后,基因增强了毒性两pv。番茄应变DC3000 (太平洋标准时间DC3000)。转基因拟南芥植物的β-葡糖醛酸酶组织化学染色显示的优先活性AT2G02360在幼小莲座叶的滴毛瘤的促进剂。QRT-PCR分析证实了高表达F-box-Nictaba在叶毛状体。答:芥过表达该基因的植物显示出较少的疾病症状太平洋标准时间与受感染的野生型和F-Box-Nictaba敲除植物相比,DC3000感染减少了细菌殖民。
结论
我们的数据显示拟南芥F-box-Nictaba基因是响应于SA,细菌感染和热应激的应激诱导基因,并且参与水杨酸相关植物防御反应。这种知识丰富了我们对F-Box-Nictaba的生理重要性的理解,并且可用于在改变环境条件方面创造具有更好性能的植物。
背景
F-box蛋白代表了植物中最大和最多样化的蛋白家族之一,因为大多数物种有几百个代表[1].它们以其高度保守的n端蛋白质-蛋白质相互作用基元(约50个氨基酸残基)命名,称为F-box结构域。大多数F-box蛋白作为Skp1-Cullin1-F-box (SCF)型泛素E3连接酶的一部分[2其中F-box蛋白包含底物结合模块。F-box蛋白通过F-box基序与SCF核心s相激酶相关蛋白1 (Skp1)的直接结合,组装成活性SCF复合物。F-box蛋白通过其可变的c端底物结合结构域特异性地结合并将合适的底物传递到SCF复合物上,通过泛素-蛋白酶体系统进行泛素介导的蛋白水解[3.].
植物中的令人印象深刻的F箱蛋白和其C末端靶结合结构域的广泛多样性有助于SCF复合物靶向各种基材的能力。因此,F箱蛋白涉及植物发育和应力信号传递中的许多细胞过程并不令人惊讶4].遗传学方法已经揭示了F-box蛋白在植物激素感知和信号转导中的重要作用[5].还报告了F箱蛋白涉及昼夜钟控制,光膀胱和开花[6,7],叶衰老[8], self-incompatibility [9和对各种生物压力的反应[10.- - - - - -12.].
多次新发现的F箱蛋白(所谓的FBXO蛋白)结合了各种识别机制,该机制能够通过F箱蛋白和每个互补的SCF复合物进行底物选择的紧密调节[3.].在这些新的FBXO蛋白中,首先在哺乳动物中发现糖粉结合F盒(或FBG)蛋白[13.],包括FBG1,FBG2和FBG5其结合高甘露糖N- 糖基化蛋白[14.].FBG1和FBG2的C末端底物结合结构域特异性与内部N,N'-二乙酰苯酮(GLCNAC)相互作用2)高甘露糖的核心n含有不完全折叠或变性糖蛋白的聚糖。由于FBG1和FBG2不靶向自由甘露糖结构或非糖基化蛋白,因此得出结论,FBG蛋白均用作糖基结合F箱蛋白,参与内质网相关的降解途径[15.].在该途径中,将在内质网的内腔内腔内正确折叠或组装成低聚复合物的蛋白质被复转移到细胞溶胶中,在那里通过SCF捕获它们FBG1 / 2.被泛素-蛋白酶体系统降解前的复合物[16.].
最近,植物中也有fbg样蛋白的报道。的答:芥基因组含有多种编码F箱蛋白质的多种基因,其具有推定的聚糖结合或凝集素状结构域[17.,18.].这些蛋白被称为F-box-Nictaba家族,因为它们的c端结构域高度类似于Nictaba, anN烟草-糖结合茉莉酸诱导凝集素[19.].这个F-box蛋白家族答:芥组约30个成员,F-box结构域和Nictaba结构域的序列相似性分别超过90和40 - 64% [4].由于存在与凝集素的C末端底物衬底结合结构域的F型盒结构域,推测这些F-BOX-NITTABA蛋白作为基质适配器在植物中的内质网相关降解途径中的底物适配器类似于哺乳动物FBG蛋白质。此外,Nictaba和FBG1都显示出朝向内芯结构的相当的聚糖结合特性N聚糖(14.,20.].然而,对糖的特异性进行了详细的分析答:芥F-box-Nictaba蛋白(由基因编码AT2G02360)显示其Nictaba域的结合n和O-聚糖含有(聚)n乙酰乳胺(Galβ1-3GlcNAc和Galβ1-4GlcNAc)结构,Lewis a, Lewis x和Lewis y motif [j]18.].目前尚不清楚(核细胞质)F-box-Nictaba蛋白是否以及如何与这些结构结合在足底。n用Lewis进行甘草改性,在Golgi设备中发生基序,并且仅在一些细胞外糖蛋白和植物细胞表面存在的膜结合的糖蛋白上显示植物特异性Lewis表位[21.- - - - - -23.].此外,与大多数植物科不同的是,路易斯的出现在答:芥据报道,通常是低矮的和组织特异于花梗,茎和节点中的最高水平,并且在单体和枝条中具有中等水平。刘易斯在叶子中没有可检测到的结构答:芥植物 [24.].
在这项研究中,我们发现答:芥F-Box-nictaba蛋白编码AT2G02360用水杨酸(SA),热应激和感染后植物处理后上调两pv。番茄菌株DC3000,其启动子序列在叶毛中具有优先活性。转基因胁迫试验答:芥结构改变F-框Nictaba表达的植物建议为角色F-box-Nictaba在植物防御相关的信号通路中。
结果
F-box-Nictaba后SA应用和热休克治疗基因的表达是上调
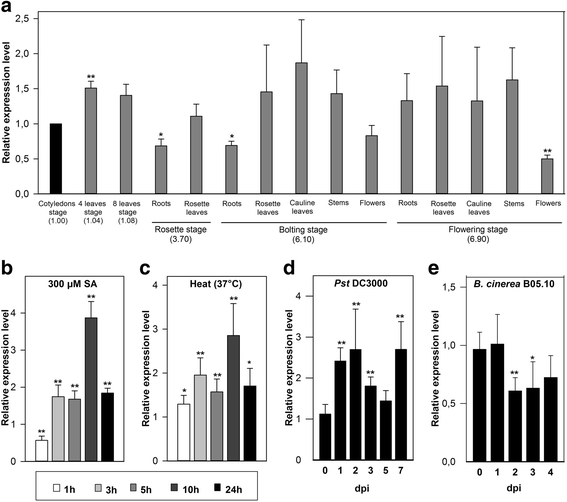
的表达模式F-box-Nictaba在野生型首次分析(WT)答:芥在实验室生长条件下种植的植物。QRT-PCR分析证明了AT2G02360在所有发育阶段和被检测的组织中表达(图。1).表达略低AT2G02360在幼嫩植物的根和花中观察到与幼嫩阶段(即子叶阶段)相比的差异。在网上表达分析表明AT2G02360是应激反应基因(附加文件1:图S1-S2,表S1和文本S1)。实际上,统一的表达谱AT2G02360当时大大改变答:芥植物经受各种植物激素和几种非生物应激因子的治疗方法(图。1B-C.)(额外的文件1:图S4)。1小时后的SA治疗后,AT2G02360与模拟治疗相比,表达略微下调,但是AT2G02360SA应用的10 H(图后mRNA水平具有几乎最大增加3小时后分别为显著高4倍。1 b).经处理的植物中的转录物水平在24小时后略微滴落,但仍然比未处理的植物高两倍。SA型诱导转录因子WRKY70的转录物水平较快调节,与...相比达到更高的水平F-box-Nictaba表达式级别(附加文件1:图S3a)。
相对转录水平AT2G02360在wt.答:芥通过qRT-PCR分析col0植株的两个独立生物学实验,每个实验都有多个技术重复,如方法部分;误差柱±SE。与对照样品相比,星号表示统计学上显着的差异表达(*p< 0.05;Arunachal Pradesh,p< 0.01)。一个,AT2G02360测量的表达水平答:芥在标准条件下种植的植物。b-c,AT2G02360表达水平在16日龄答:芥SA治疗后的幼苗(b)或热休克后(c).d-e,相对表达AT2G02360感染后5周大答:芥植物有太平洋标准时间DC3000 (d)或b .灰质应变B05.10 (e).比较表达水平(一个)AT2G02360在子叶期的表达水平或(b-e)到基因表达水平
还热应力增强F-box-Nictaba与对照相比,热胁迫10 h后基因表达量最高增加了近3倍(图2)。1 c).但是,与...相比AT2G02360基因表达了Hsp70b基因,编码热休克响应伴侣蛋白,增强得多,达到更高的mRNA水平(附加文件1:图S3B)。其他激素和非生物胁迫治疗略微下调或不影响F-box-Nictaba基因表达(附加文件1:图S4)。
F-box-Nictaba表达在wt中升级答:芥植物后假单胞菌感染但是通过真菌感染略微下调
五周龄wt答:芥用强毒半生物营养细菌侵染col0植株P. inringae.pv。番茄应变DC3000 (太平洋标准时间DC3000)或病养殖真菌葡萄孢菌菌株B05.10。太平洋标准时间DC3000感染显著增强了这两个对照基因的表达WRKY70和PR1在玫瑰叶子(附加文件1:图S3c)。F-box-Nictaba与模拟喷涂的植物相比,MRNA水平在1,2和7dpi下显着上调约2.5倍。F-box-Nictaba表达下降3和5 dpi,但仍然高于模拟处理植物中的植物(图。1 d).相比之下,b .灰质感染轻微影响F-box-Nictaba与模拟处理植物的mRNA水平比较(图。1 e).在2和3 dpi处,AT2G02360表达水平几乎降低了两倍。控制基因的表达PR1没有显著改变(附加文件1:图S3d)。相反,控制基因的表达PDF1.2高度上调达到3 dpi的感染组织增加50倍(附加文件1:图S3d)。
F-box-Nictaba促进剂特别活跃于叶子毛状体中
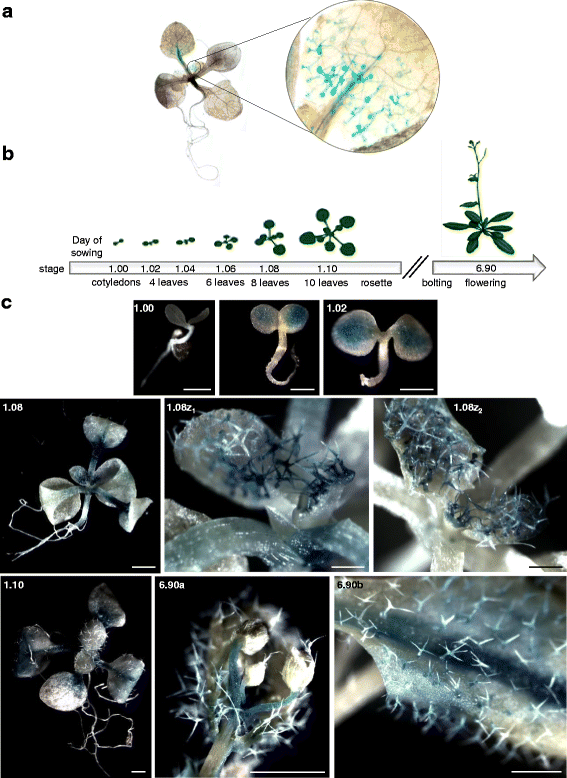
测试5'-上游区域的活动AT2G02360基因,启动子AT2G02360:GUS记者构建被引入答:芥COL-0植物并用于组织化学测定。第一个数据揭示了14天的叶子毛圈中明显和局部的GUS染色Pat2G02360:Gus A. Thaliana幼苗(图。2).随后,在不同的发育阶段分析了标准条件下生长的植物(图。2 b).总体而言,不同转基因系的植物显示出可比的GUS染色模式,但GUS染色的强度在植物中不同。在非常年轻的幼苗(阶段0.7)中,没有检测到GUS染色(图。2摄氏度).在子叶期和2叶期(1.00和1.02期),植株的叶肉细胞上GUS活性较弱。在植株发育过程中(从1.08期开始),整个叶柄、茎分生组织和初生叶上的大部分毛状体中都观察到非常强烈的GUS活性。新发育叶片上毛状体的GUS染色在植物的进一步发育过程中仍然存在。在1.10期及更老期(莲座期)的植株中,新叶的毛状体、叶柄、主叶脉和老叶的部分叶肉细胞中GUS染色明显。在老叶上的毛状体也显示出GUS染色,特别是在叶柄附近的毛状体,但与在幼叶上的毛状体相比,GUS染色较弱。在开花植物(6.90期)中,GUS染色主要出现在花中,在莲座和茎生叶中,部分角质层和主脉以及靠近主脉的毛状体上。CaMV35S:GUS对照植株在整个发育过程中,所有器官和组织的GUS染色均呈深蓝色,均匀(结果未显示)。
组织化学分析Pat2G02360:Gus A. Thaliana行。一个, 14日龄植株GUS染色数据。b,不同的发育植物阶段分析[46].c,GUS染色针对选定的发育阶段的数据,仔细看看新叶子(面板1.08Z)和花蕾上存在的毛状物(面板6.90A);面板6.90b代表莲座叶的特写镜头。秤条代表1毫米
F-box-Nictaba主要在毛状体中表达答:芥植物
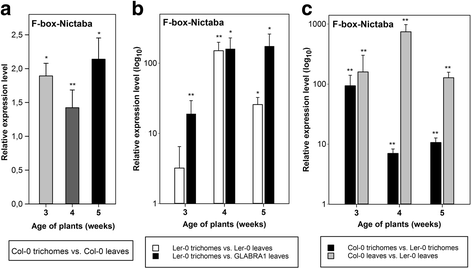
鉴于表观活动Pat2G02360:GUS.报告基因在叶状毛体中的构造和发生推定CIS-报告的监管要素负责培养的特异性基因规则F-box-Nictaba启动子序列包括8个myb样识别位点和5个T/G-box元件(附加文件1:图S5)的表达式F-box-Nictaba通过从WT纯化的粒子中通过QRT-PCR定量基因答:芥Col-0玫瑰叶子。AT2G02360与在未加工的玫瑰花叶(含有胎儿)中测量的那些相比,在胎儿中测量的mRNA水平略高,在4周龄植物中增加毛状体中的胎儿表达增加至约1.5倍,3-周末 -旧植物(图。3).
转录水平AT2G02360在从wt的玫瑰花叶隔离的毛状物中答:芥COL-0或LER-0生成的植物与完全莲座叶中的相应基因表达水平相比来自WT答:芥Col-0或LER-0生态型的植物Glabra1 A. Thaliana.植物。通过两个独立的生物学实验(每个实验有两个技术重复),qRT-PCR分析了3周龄、4周龄和5周龄植株的相对转录水平;误差柱±SE。与对照样品(完全玫瑰花叶材料)相比,星号表示统计学上显着的差异表达。一个,WT的毛状体中的基因表达水平答:芥Col-0中的植物相比,从WT完整莲座叶答:芥Col-0植物。b,WT的毛状体中的基因表达水平答:芥Ler-0植株与完整莲座叶片的比较答:芥Ler-0植株或比较完整莲座叶Glabra1 A. Thaliana.在WT的完全莲座叶中答:芥LER-0植物相比,完整的莲座叶GLABRA1植物。c,基因表达水平的比较F-box-Nictaba在胎儿和完全玫瑰花叶的wt答:芥COL-0相比wt答:芥Ler-0植物
F-box-Nictaba并对突变体莲座叶的基因表达进行了分析答:芥植物完全缺乏毛粒。这些GLABRA1植物在GL1.基因(AT3G27920)编码培养体发育所需的MyB样转录因子[25.].自从此以来GLABRA1突变体是在Landsberg erecta-0 (Ler-0)背景下产生的,F-box-Nictaba表达也在wt中检查答:芥Ler-0植物。从玫瑰花叶的滴毛颗粒纯化答:芥Ler-0植物产生的毛状体数量与答:芥Col-0植物。然而,相对的表达F-box-Nictaba基因在毛状体中更加明显答:芥与3、4、5周龄相比,Ler-0植株叶片组织总量上调3.2倍(但无统计学意义),上调150倍和25倍答:芥分别为ler-0植物(图。3 b,白色的酒吧)。相比Glabra1 A. Thaliana.植物,AT2G02360毛状体的转录水平分别高出20倍、160倍和175倍答:芥与3-,4-周和5周龄Glabra1的总叶组织相比,LER-0植物答:芥植物,分别(无花果。3 b黑条)。
转录水平F-box-Nictaba基因在WT中较高答:芥无论是否评估两种生态型的纯化毛状体或完整莲座叶,研究了所有发育阶段的col0背景植物的叶片与Ler-0背景的野生型植物的叶片的比较(图2)。3 c).比较未加工的莲座叶片时差异表达最显著(灰色条):AT2G02360mRNA水平约为。在Col-0生态型的3-,4-周和5周龄植物的叶片中,与来自LER-0背景的植物的叶子相比,3-,4-和5周龄植物的叶子中叶片的叶子160,740和130倍。在从3-,4-周和5周龄的滴虫中分离出来答:芥Col-0植物F-box-Nictaba基因表达是90-,7-和10-倍中的3-毛状体更高,4-和来自WT 5周龄的植物答:芥分别为ler-0(图。3 c黑条)。
GALT1和FUT13基因在WT的毛状体中上调答:芥Ler-0植物
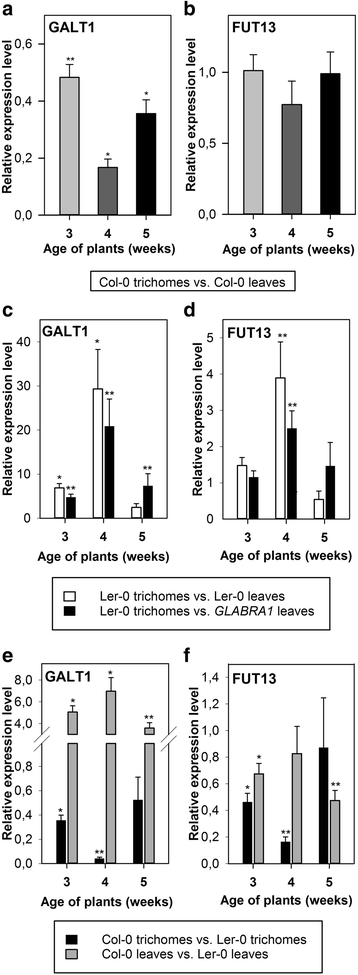
F-Box-Nictaba被鉴定为可以结合的功能凝集素N- 和O含乳糖胺结构的-聚糖,Lewis a, Lewis x和Lewis y基序[18.].据报道拟南芥植物仅含有一种改进的lewisn聚糖。据我们所知,还没有人在毛状体中研究过路易斯a的存在答:芥植物。自从F-box-Nictaba在毛状体中表达明显,我们讨论了Lewis a基模是否可以在毛状体中特异性合成。因此,我们采用qRT-PCR分析方法,分析在大肠杆菌中合成Lewis a表位所必需的酶的基因表达情况答:芥:也就是,At1g26810β1,3-半乳糖基转移酶(GALT1)编码AT1G71990.α1,4-聚焦转移酶(FUT13)的编码(图。4)[21.,24.,26.].根据图。4, 两个都GALT1和FUT13在莲座叶,以及在的叶毛中表达答:芥Col-0植物。转录水平GALT1WT的毛状体显着降低答:芥col0植株与同一植株在所有研究发育阶段未加工莲座叶中测量的叶片相比,最低值为5倍GALT1在4周龄植物毛状体中的表达(图。4).在3年和5周龄的植物GALT1毛状体的mRNA水平分别比莲座叶低2倍和3倍左右(图。4).与此相反GALT1,FUT13在胎儿和未加工的玫瑰花叶之间没有显示出显着的差异表达(图。4 b).
转录水平GALT1(At1g26810),FUT13(AT1G71990.)的毛状体分离的莲座叶答:芥Col-0中或LER-0生态型的植物相比,在WT的完整莲座叶对应的基因表达水平答:芥Col-0或LER-0生态型的植物Glabra1 A. Thaliana.植物。通过两个独立的生物实验的QRT-PCR分析在3-,4-季和5周龄植物中测定转录水平,每个实验都有两种技术复制;误差柱±SE。与对照样品(完全玫瑰花叶材料)相比,星号表示统计学上显着的差异表达。一个-b,相对基因表达水平GALT1(一个),FUT13(b)在WT的毛状体答:芥Col-0中的植物相比,从WT完整莲座叶答:芥Col-0植物。c-d,相对基因表达水平GALT1(c),FUT13(d)在WT的毛状体答:芥Ler-0植株与完整莲座叶片的比较答:芥Ler-0植株或比较完整莲座叶Glabra1 A. Thaliana.在WT的完全莲座叶中答:芥LER-0植物相比,完整的莲座叶GLABRA1植物。e-f,基因表达水平比较GALT1(e),FUT13(f)在毛状体和完全莲座叶中答:芥COL-0植物与WT相比答:芥Ler-0植物
相反,在3周和4周大的毛中答:芥Ler-0植物的表达GALT1与来自这些植物的未加工莲座叶片相比,基因的表达水平分别显著上调了7倍和29倍。4摄氏度,白色的酒吧)。比较的GALT1WT毛状体中的表达水平答:芥Ler-0的植物,那些在trichomelessGLABRA1叶子透露,GALT1在被测的三个植物时期,毛状体的mRNA水平分别高出5倍、20倍和7倍。4摄氏度黑条)。差异FUT13毛状体和未加工的莲座叶之间的表达水平答:芥Ler-0的植株比GALT1基因表达。FUT134周龄植物的毛状体中的表达只有4倍,而在3-周和5周龄植物中则没有明显的差异FUT13Ler-0叶材料毛状体RNA和总RNA的表达(图。4 d,白色的酒吧)。然而,FUT13毛状体中表达上调2.5倍答:芥LER-0植物相比GLABRA14周龄植物的叶子(图。4 d,黑条).类似于F-box-Nictaba表达式模式,GALT1和FUT13与3周和5周的植物相比,4周的植物毛状体中基因的上调更为显著。
的GALT1在叶子中表达的基因是3.5-7倍答:芥col0植物与相应的叶片相比答:芥Ler-0植物(图。4 e,灰色的条形图,在4周龄植物中具有最高的差异表达。相比之下,GALT13周龄和4周龄毛状体的基因表达分别增加了3倍和30倍答:芥LER-0植物相比答:芥Col-0植物(图。4 e黑条)。一般来说,WT答:芥LER-0植物的转录水平略高FUT13比wt.答:芥在未加工的玫瑰花叶中的Col-0植物(图。4 f灰色酒吧)。更重要的差异是在3周和4周的植物的毛FUT13转录水平在较高的程度上是2-和5倍答:芥以Ler-0为背景的植物(图。4 f黑条)。
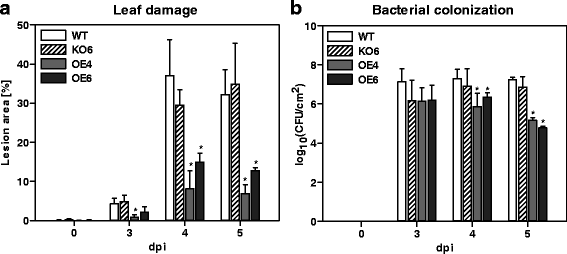
过度表达F-box-Nictaba废弃叶片损坏并抑制太平洋标准时间DC3000定植在图4和5 dpi的
自从F-box-NictabaSA处理后基因表达显着上调(图。1 b)和感染太平洋标准时间DC3000(无花果。1 d)有人建议,F-Box-Nictaba在植物防御反应中发挥作用。探讨F-Box-nictaba对植物抗性的相关性,转基因的相关性答:芥Col-0中的植物受损F-box-Nictaba基因表达量(KO6系)以及植株均有增加F-box-Nictaba基因表达(OE行)(附加文件1:文本S2)与毒力进行感染太平洋标准时间DC3000菌株和评估疾病症状和细菌生长。感染后24小时的定子水平反映了初始生长太平洋标准时间在Apoplast中的DC3000,而感染后下天的病原体的生长伴随着宿主编程的细胞死亡和坏死。事先,转基因F-Box-Nictaba植物被证明在整个生长和发展中的WT植物(附加档案)是与WT植物的形态无法区分1:文本S2)。
如图所示。5在附加文件中1:图S6,KO6植物显得与WT植物的类似疾病症状,其特征在于,分别构成高达30和35%的叶面积为4和5 dpi的叶片病变。OE线的植物显然表现出比4和5 dpi的WT植物更少疾病症状,病变覆盖总叶面积的8%至12%。同样在3 dpi,与WT植物相比,OE4植物表现出降低的疾病症状。与减少的叶片损伤水平一致,WT和KO6植物的定植无显着差异,而OE线与4dpi和5dpi的WT样品相比,细菌计数显着降低(图。5 b).
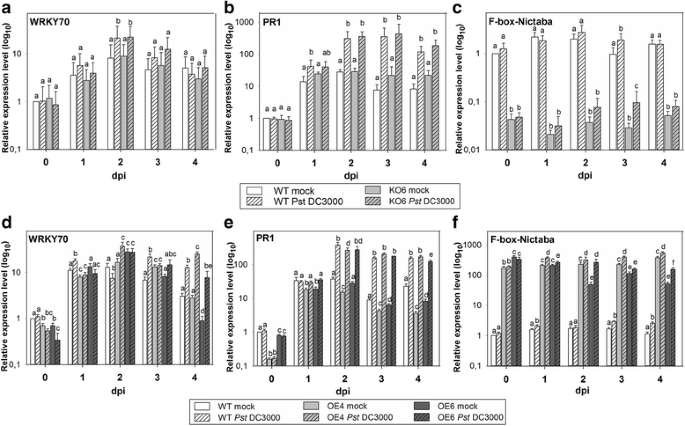
qRT-PCR结果显示,两种阳性对照均无差异表达WRKY70和PR1、在受感染和模拟处理的KO6植物中也没有。6A-B.OE4和OE6植株(图2)。6D-E.).F-box-Nictaba在感染实验的时间过程中,在所有转基因植物中表达仍然是稳定的,在KO6线中具有非常低的转录水平,与WT植物相比,两个OE线中的显着100-200倍过表达(图。6C和F.).
转录水平AT2G02360通过QRT-PCR在5周龄转基因中测定的阳性对照基因答:芥植物后太平洋标准时间DC3000感染。一个和d,的表达At3g56400(WRKY70)在KO6线路(一个)和oe4和OE6线(d).b和e,的表达AT2G14610(PR1)在KO6线(b),以及在OE4和OE6行(e).c和f,的表达AT2G02360在KO6线(c),以及在OE4和OE6行(f).基因表达水平相对于0dPI在0dPI下的模拟处理的WT植物中的表达计算。对于每个时间点,不同的字母表示不同线之间的统计学显着的差异表达,与模拟处理的植物相比(p < 0.05). Values were obtained from three independent biological experiments, each with three technical replicates; error bars ± SE
讨论
QRT-PCR数据和Meta分析数据库搜索显示,虽然是基础表达AT2G02360存在于整个植物发育过程中吗F-box-Nictaba是SA-和病原体诱导基因。的表达式配置文件支持WRKY70基因及启动子分析AT2G02360,很可能是SA诱导的表达AT2G02360为(a)的SA-依赖性WRKY转录调节(一个或多个)的控制下。从在用于最大表达的延迟判断F-box-Nictaba与关键sa依赖的WRKY转录因子进行比较,提示F-box-Nictaba是一种晚期sa反应基因。如假单胞菌感染测定,AT2G02360表达在病原体防御中并不起重要作用。此前有报道称答:芥基因组包含20多个同源基因编码AT2G02360- 似的基因可获得表达证据[17.,19.].所有这些基因都显示出相当大的氨基酸序列相似性,F-box结构域和Nictaba结构域的序列相似性分别达到> 90和> 40 %。这些基因中可能有一些显示出功能冗余,并可能完成相同或至少类似的作用,这在男性配子发生过程中也得到了证实[27.].因此,我们认为At2g02360更可能在一个复杂的防御相关蛋白网络中扮演伙伴的角色。因为F-box-Nictaba在WT被上调答:芥SA治疗后的植物太平洋标准时间DC3000的表达不受MeJA/乙烯利处理和感染的影响B. Cinerea,它是合理的结论是F-框Nictaba起着SA介导的植物的防御反应病原体感染的作用。
F-box-Nictaba的表达不仅对生物胁迫有响应,在热胁迫后它的表达也上调了3倍。生物和非生物应激信号通路之间的交叉信号是很常见的[28.,29.].F-box-Nictaba热应激的上调可能由热休克激活的转录因子驱动,这可以与热冲击响应响应CIS-元素AT2G02360启动子序列,也可通过热胁迫诱导WRKY转录因子的激活F-box-Nictaba通过其启动子序列中的多个W-box基序表达。表达分析F-box-Nictaba基因WRKY -特异性突变系可以明确其转录调控方式F-box-Nictaba.
符合植物防御相关表达AT2G02360,组织化学测定显示出优先的活性AT2G02360转基因非腺叶毛状体植物发育过程中的启动子答:芥植物,特别是在幼叶上存在的毛状体。类似地,QRT-PCR测定显示出优势存在AT2G02360拟南芥叶毛状体的mRNA表达。非腺毛是大多数植物气生器官表面的表皮毛,其特征是单细胞的树枝状结构,有茎和三到四个分枝。它们涉及蒸腾控制、耐热性和对昆虫、疾病和紫外线照射的保护[30.].虽然非腺毛状体可能是不分泌的,但它们确实表达参与次级化合物生物合成的基因,这表明它们在植物防御病原体中的假定作用[31].根据推测的wrky依赖调节F-box-nictaba,腕骨转录因子在毛状体组织中高度表达[32].另外,F-box-Nictaba胎儿中的基因表达可能在MYB转录因子的控制下进行[33,可以绑定到多个myb类CIS-法规要素F-box-Nictaba据报道,促进剂对特异性特异性基因调节有害[34,35].有趣的是,另外两种F-Box-nictaba同源物也主要在毛状体中表达[4].这些同源物之一,由AT1G80110,在毛状体和感染后都上调太平洋标准时间DC3000。
更高的转录水平GALT1和FUT13在wt的毛状体中答:芥与Ler-0背景强烈相似的毛状细胞特异性表达F-box-Nictaba基因研究。一般来说,这三个基因在4周大的毛体中上调幅度更大答:芥LER-0植物相比,这些3-和5-周龄植物的。它并不完全清楚为什么最高的毛状体特异性表达在这个特定的时间点达到,但最有可能的解释是,4周龄答:芥植物正经历从营养阶段到生殖阶段的过渡,其特征是茎的形成和发展到抽薹[36].这是可能发生主要生理变化的时间,在这一过程中,毛状体的产生受到了显著影响[37- - - - - -39].不论观察到的时间依赖性差异的原因,这些数据表明,Lewis一种结构所需的两种酶GALT1和FUT13,以及碳水化合物结合蛋白F-BOX-NICTABA的生物合成所必需的胎儿答:芥Ler-0植物。在毛状体中可以合成含有Lewis a的多糖,这一事实并不表明它们可以被细胞核浆室中的F-box-Nictaba所利用。未来的研究将包括相互作用研究,以阐明(1)叶片毛状体中Lewis修饰蛋白的可用性和(2)sa诱导的F-box-Nictaba蛋白与这些聚糖结构的结合。
结论
详细分析碳水化合物结合F-Box-nictaba蛋白的转录水平答:芥在植物治疗后展示上调生物和非生物起源的应激刺激,包括热应激,防御相关植物激素水杨酸和植物感染毒性两pv。番茄菌株DC3000。此外,组织化学测定结果表明,F-Box-Nictaba基因大量表达在叶子毛状体中,植物防御反应所涉及的阑尾。试验实验答:芥过表达F-box-Nictaba蛋白的植物在发病后症状减轻太平洋标准时间DC3000感染与野生型植物或植物相比,其中F箱-Nictaba表达减少。完全暗示数据表明F-Box-Nictaba是植物反应中涉及的防御蛋白质假单胞菌感染。此外,我们表明F-Box-Nictaba以及合成由F-Box-nictaba特异性识别的甘油基序所需的糖基转移酶在胎儿中共表达。虽然F-Box-Nictaba的推定目标仍然待阐明,但我们的研究揭示了一种新的光线,以通过基于聚糖的应力信号传导的植物反应对病原体攻击的非腺体胎儿的推定功能。
方法
植物材料和培养条件
WT的种子答:芥生态型Col-0购自Lehle Seeds(圆形岩石,德克萨斯州,美国)。WT的种子答:芥生态型的Ler-0(NW20),GLABRA1(N64)和SALK_085735C(这里重命名行KO6) [40]从欧洲拟南芥股票中心(英国诺丁汉大学Nasc)获得。为了建立体外培养,表面灭菌的种子在无菌过滤纸上播种,置于固体Murashige和Skoog(MS)中(Duchefa,Haarlem,荷兰)的顶部。为了建立体内培养物,表面灭菌的种子直接播种为人工土壤(JIFFY-7,44mmØ)(作为JIFFY产品,Drobak,Norway),进入膨胀的粘土颗粒(>4mmØ)或锅土壤中。为了破坏休眠,将种子在黑暗中在4℃下分层三天。然后,将种子转移至在21℃下设定的受控的生长间,用16/8 H光周期进行种子萌发和植物发育。仅针对感染实验和毛状体分离,种子被置于生长室(Compurirm German GmbH,柏林,德国),设定为21°C,具有12/12 H Photopheriod。所有幼苗和植物都经常浇水。从不同的发育阶段收集植物样品,如[41].从体外种植植物收集早期植物材料(子叶,4叶和8叶阶段)并包括完整的幼苗,而其他样品取自人造土壤中生长的植物。从颗粒中生长的植物收集根料。从植物土中生长的植物中收集的莲甜叶材料中分离出毛状物。
化学试剂
软面包卷,3.和Meja是从Sigma-Aldrich(Billgium)的Sigma-Aldrich)购买的。ABA和Ethephon是从Acros Organics(Geel,Belgium)获得的。从Duchefa获得Sa,吲哚醋酸(IAA)和盐,而甘露醇是从VWR(Leuven,Belgium)购买的。MG132是从Enzo生命科学(安卫尔普,比利时)获得的。在使用之前,适量的Meja,SA,ABA,IAA和GA3.溶解在100%(W / V)乙醇,而BAP和MG132溶解在100%(重量/体积)二甲基亚砜(DMSO)(VWR)。乙烯利,NaCl和甘露醇溶解于水中。
激素治疗,非生物应激应用和WT的感染测定答:芥植物
激素和非生物应激治疗是根据[42- - - - - -46]有修改。即,在体外种植16天龄幼苗从MS琼脂平板转移到填充有含有激素溶液的液体MS培养基的培养皿(100μm浓度,在ABA,BAP,Ethephon,GA3.,IAA或茉莉酸甲酯和SA的情况下,300μM浓度),50μMMG132,150mM NaCl的或100mM甘露醇和在21℃下温育合适的时间。对照保持包含相应溶剂(乙醇,DMSO或水)的等体积的液体MS培养基上。冷和热应力是由孵育MS琼脂在黑暗幼苗板或者在4℃或37℃下分别施加。与此同时,控制在黑暗中在21℃温育。在几个时间点的每个应力施加20-30幼苗收集用于RNA提取,立即在液氮中冷冻并储存在-80℃直至使用。感染试验用两pv。番茄菌株DC3000和葡萄孢菌菌株B05.10按其他描述进行[47- - - - - -49].对于每种感染,用感染或模拟溶液接种一个单独种植的5周龄拟南芥植物。感染P. inringae.对莲座叶片喷施菌液,从生长中后期(OD600= 0.6-1.0),接种液由细菌重悬在10 mM MgSO中4补充有0.05%的SILWET-77(GE特种材料(SUISSE)S.A.R.L.,瑞士)以获得OD的细菌溶液600 = 0.05 corresponding to 2.5 × 107CFU /毫升。前一天细菌感染治疗后,截止到两天,植物保持在100%的相对湿度,以增加感染效率。感染b .灰质通过液滴技术完成,通过将10μl的孢子溶液放入来自每种植物的三个随机选择的莲座叶的上侧的10μl液体液体,从10天血液中收获。接种解决方案包含5×105分生孢子/ ml在½强度马铃薯右旋糖肉汤培养基。在真菌测定法中,将植物在整个实验过程中保持在100%相对湿度。在指定时间点后每感染,8-10随机选择的植物的莲座叶在液氮中冷冻并储存在-80使用℃下之前。所有的实验为每个激素治疗,非生物胁迫的应用和感染测定用P. inringae.用两个独立的生物实验进行,每次分析进行三种技术复制。感染实验b .灰质通过两个独立的生物学实验和两个技术重复进行。
RNA提取和cDNA合成
用研钵和杵将植物样本磨成细粉,然后根据制造商的说明使用TRI试剂(Sigma-Aldrich)提取RNA。为了去除任何残留的基因组DNA,样品用2个单位的RNase-free dnase (Fermentas, St. Leon-Rot, Germany)在37°C下处理30分钟。加入2 μl EDTA (25 mM)后,在65°C孵育10分钟使DNase酶失活。用Nanodrop 2000分光光度计(Thermo Scientific, USA)测定RNA浓度和纯度。用1 μg无dna总RNA和1 μL 50 μM寡核苷酸(dT)合成第一链cDNA20.使用M-MLV转录酶试剂盒(Invitrogen),然后用RNase-free水稀释2.5倍。利用特异性引物进行RT-PCR检测cDNA质量UBC9基因(附加文件1:表S2)。
定量RT-PCR测定
使用SensiMix SYBR试剂盒(Bioline reagent Ltd, London, UK)进行qRT-PCR分析。反应混合物含1x SensiMix™SYBR, 2ng μL−1第一链cDNA和500nm的基因特异性前向和反向引物(附加文件1:表S2),总容积为20 μL。对于激素和应激治疗,根据[50- - - - - -54].qRT-PCR在一个Rotor- gene 3000 (Corbett Life Science)中进行,3个技术重复,使用Rotor Discs (Qiagen, Hilden, Germany),如所述[55].
GUS报告系统和F-box-Nictaba过表达载体的构建
的Pat2G02360:GUS.报告构造以及CaMV 35S:AT2G02360使用网关产生构造TM值克隆技术(表达载体)。一个1806元AT2G02360从WT提取的总基因组DNA中,采用两步PCR扩增启动子片段(包括5’UTR)答:芥Col-0植物。的AT2G02360从cDNA克隆BX820545 (INRA, Centre de Toulouse, Unité de Recherche 1258-CNRGV, Castanet-Tolosan Cedex, France)开始,采用两步法PCR扩增编码序列。在第一步中,引物被用来生成一个AT2G02360启动子序列(引物EVD555和EVD556)和一个AT2G02360基因序列(引物EVD1046和EVD1047),包括分别在其5'和3'序列的ATTB1和ATTB2网关适配器站点的部分(附加文件1:表S3)。启动子扩增引物序列基于AT2G02360TAIR10基因信息。第二步,使用引物evd2和evd4完成attB位点(附加文件)1:表S3)。然后通过pDONR221供体载体(Invitrogen)将AttB-PCR产物克隆到pKGWFS7.0或pK7WG2.0目的载体中,分别获得启动子和基因序列[56,排序并引入A. Tumefaciens.使用电穿孔应变GV3101。使用花卉浸法转化Wt Arabidopsis Col-0植物[57].在添加75 mg L的MS琼脂平板上选择转基因后代−1卡那霉素。利用gus特异性引物GUS-F和GUS-RV或卡那霉素特异性引物evd463和evd261对基因组DNA进行PCR,检测T-DNA与植物基因组的整合情况(附文件)1:表S3)。用于启动子的植物纯合:T3代的GUS构建体用于组织化学测定。植物纯合的CAMV 35s:AT2G02360T4代的构建体(OE线)用于感染实验。
组织化学GUS测定
GUS检测根据[58].显微镜分析使用尼康eclipse TE2000-e显微镜(比利时布鲁塞尔尼康Belux)和徕卡DFC400显微镜(德国Heerbrugg徕卡),分别使用NIS-Elements和徕卡Application Suite软件包。
叶毛的分离和随后的RNA分析
叶毛状物与3-,4-周和5周龄植物的玫瑰花叶中分离出来的叶子 -59].纯化后的毛体用液氮冷冻,−80°C保存,待进一步加工。使用徕卡DFC400显微镜(徕卡)和徕卡应用套件软件包,通过透射显微镜评估分离毛状体的产量、纯度和完整性。提取总RNA时,加入1 mL TRI Reagent (Sigma-Aldrich)和50 mg玻璃珠(300 μm Ø, Sigma-Aldrich)。60000 - 80000毛(从25克莲座叶中分离出来)。以最大速度混合溶液(5个循环,20秒混合,20秒冰封)。对未加工的莲座叶进行RNA提取,加入1 mL TRI试剂。用研钵和杵将100mg样品研磨成细粉。然后根据制造商的建议加工毛状体和全叶组织。DNase处理、cDNA合成、RT-PCR和qRT-PCR均按上述方法进行。 The complete experiment was repeated twice.
转基因胁迫处理答:芥植物
大约六十个单独种植5周龄WT植物以及转基因f-box-nictaba-接种特定的KO和OE植株太平洋标准时间如上所述的DC3000感染或模拟解决方案。在0,3,4和5dpi下,为每条线收集大约一叶,并用平板扫描仪(Canoscan Lide 25)扫描。用imagej软件处理单个叶子的扫描。使用APS评估2.0计划的疾病评估软件,确定对叶片相对于总叶面积相对于总叶面积的损伤。通过序列稀释测定法测定模拟处理和感染植物叶中的细菌生长,如[49].细菌定植量以菌落形成单位(CFU) cm确定−2取样的叶片组织。RNA提取、DNase处理、cDNA合成、qRT-PCR分析0、1、2、3、4、5 dpi的表达。整个叶片损伤评估和细菌定殖试验采用2个独立的生物学试验,每个分析采用3个技术重复。
缩写
- DPI:
-
感染后期
- 等:
-
乙烯
- FBG:
-
聚糖结合F箱蛋白
- FUT13:
-
α1,4-岩氧基转移酶
- GAL:
-
半乳糖
- GALT1:
-
β1,3-galactosyltransferase
- glc:
-
葡萄糖
- GlcNAc:
-
N- 乙酰葡糖胺
- JA:
-
茉莉酸
- 柯:
-
淘汰赛
- 答:
-
刘易斯一个结构
- Nictaba:
-
尼科尼亚塔哈瓦姆凝集素
- OE:
-
过度表达
- 太平洋标准时间DC3000:
-
两pv。番茄应变DC3000
- QRT-PCR:
-
定量逆转录酶聚合酶链反应
- 山:
-
水杨酸
参考
- 1。
华Z,邹C,肇S-H,Vierstra RD。超家族内植物界F-盒(FBX)基因的系统发育比较揭示发散进化历史指示基因组漂移。Plos一个。2011; 6:e0016219。
- 2。
佩特罗斯基MD,德赛RJ。功能和滞-RING泛素连接酶的调节。NAT Rev Mol Cell Biol。2005; 6:9-20。
- 3.
F-box蛋白补充底物的机制和作用。细胞生物学杂志。2013;14:369-81。
- 4.
史蒂芬诺维茨K,兰奴N,云顿EJM。植物F-box蛋白-判断生死。植物科学进展。2015;34:523-52。
- 5.
泛素介导的植物激素信号调控。植物杂志。2012;160:47-55。
- 6.
ZEITLUPE的F-box蛋白具有剂量依赖性,可控制生物时钟、光形态建成和开花时间。植物细胞。2004;16:769 - 82。
- 7.
ITO S,Song Yh,Imaizumi T.含有Lov域的F箱蛋白质:拟南芥中的光依赖性蛋白质降解模块。莫尔植物。2012; 5:573-82。
- 8.
在拟南芥中调控叶片衰老的F-box蛋白ORE9。植物细胞。2001;13:1779 - 90。
- 9.
Kubo K,Entani T,Takara A,Wang N,Fields Am,Hua Z,Toyoda M,Kawashima S,Ando T,Isogai A,Kao Th,基于S-RNase的自我识别系统的合作非自我识别系统不相容。科学。2010; 330:769-99。
- 10。
Maldonado-CalderónMt,Sepúlveda-garcíae,Rocha-SOSA M.用生物和非生物胁迫诱导的植物新型F箱蛋白的特征。植物SCI。2012; 185:208-17。
- 11.
植物免疫信号转导中的泛素化。植物杂志。2012;160:15-27。
- 12.
郭丽琴,邓新文,魏宁。植物非生物胁迫途径中Cullin-RING泛素连接酶家族的研究。acta botanica yunnanica(云南植物研究). 2013;55:21-30。
- 13。
Yoshida Y, Chiba T, Tokunaga F, Kawasakik H, Iwai K, Suzuki T, Ito Y, Matsuoka K, Yoshida Y, Tanaka K. ER和cytosol中Lectin-like ERAD players。生物物理学报。2010:172-80。
- 14.
Glenn Ka,Nelson RF,Wen HM,Mallinger AJ,Paulson HL。组织表达,底物结合和SCF复杂形成的多样性遍在蛋白的胞外蛋白的连接酶。J Biol Chem。2008; 283:12717-29。
- 15.
糖蛋白特异性泛素连接酶识别未折叠底物中的n-聚糖。EMBO众议员2005;6:239-44。
- 16.
Hoseki J,Ushioda R,Nagata K.内质网相关降解的机制和组分。j生物学习。2010; 147:19-25。
- 17.
Lannoo N, peumers WJ,云顿EJM。具有烟草凝集素c端同源结构域的f -box蛋白是否在植物蛋白降解中发挥作用?生物化学学报2008;36:843-7。
- 18.
Stefanowicz K, Lannoo N, prost P,云顿EJM。含有nictaba相关凝集素结构域的拟南芥F-box蛋白与n乙酰丙基酰胺结构。FEBS开放生物。2012; 2:151-8。
- 19.
Delporte A, Van Holle S, Lannoo N, Van Damme EJM。烟草凝集素,烟草相关蛋白家族的原型。植物营养学报。2015;16:5-16。
- 20。
Lannoo N,Peumans WJ,Van Pamel E,Alvarez R,Xiong Tc,Hause G,Mazars C,Van Damme EJM。本地化和体外结合研究表明,细胞质/核烟草凝集素可以用高甘露糖和复杂地原位互动n聚糖。2月。2006;580:6329-37。
- 21。
莱昂纳尔R,沿海G,Darrambide E,Lhernould S,弗勒拉-莱萨德P,Carlué男,Gomord V,菲L,Maftah A.刘易斯在表位的存在拟南芥糖醌缀合物取决于活性α4-岩氧基转移酶基因。糖生物学。2002; 12:299-306。
- 22。
Melo NS,Nimtz M,Conradt HS,Fevereiro PS,Costa J.从植物细胞悬浮培养中鉴定人类Lewis在分泌过氧化物酶中的碳水化合物基序(Vaccinium myrtillus L。).2月。1997;415:186 - 91。
- 23。
马文·L,马文·L,马文·L,马文·B,萨at- jeunemaitre B, Gomord V, Crooks K, Lerouge P, Faye L, Hawes C. Lewis a-containing的生物合成和免疫定位n聚糖在植物细胞中。植物理性。1999; 121:333-43。
- 24。
Strasser R, Singh Bondili J, Vavra U, Schoberer J, Svoboda B, Glössl J, Léonard R, Stadlmann J, Altmann F, Steinkellner H, Mach L.一种独特的β1,3-半乳糖基转移酶是生物合成不可缺少的n包含Lewis的聚糖A结构拟南芥.植物细胞。2007; 19:2278-92。
- 25。
Oppenheimer DG, Herman PL, Sivakumaran S, Esch J, Marks MD拟南芥用尺寸表达。细胞。1991; 67:483-893。
- 26。
威尔逊IB。鉴定编码植物Lewis型α1,4-岩氧基转移酶的cDNA。Glycoconj J. 2001; 18:439-47。
- 27。
IKRAM S,Durandet M,VESA S,Pereira S,Guerche P,Bonhomme S.在拟南芥男性配子体中表达的F箱蛋白基因中的功能冗余和/或正在进行的伪析化。植物团体。2014; 27:95-107。
- 28。
AIM1转录因子介导了番茄生物和非生物胁迫反应的交叉对话。植物j . 2009; 58:347-60。
- 29。
Wang S., Cheng H ., Li X ., Xiao J, Xu C ., Wang S. Rice WRKY13通过选择性结合不同顺式元件调控非生物和生物胁迫信号通路间的串扰。植物杂志。2013;163:1868 - 82。
- 30.
Traw MB,Bergelson J.茉莉酸,水杨酸和吉布林蛋白在拟南芥中诱导胎儿的互动作用。植物理性。2003; 133:1367-75。
- 31.
不同的监管网络导致趋同结构。植物科学进展。2006;11:274-80。
- 32。
戴旭,王刚,杨东升,唐勇,Broun P, Marks MD, Sumner LW, Dixon RA,赵px。植物毛状体的比较组学数据库。植物杂志。2010;152:44-54。
- 33。
杜博斯,李志刚,李志刚,李志刚。拟南芥MYB转录因子的研究进展。植物生态学报。2010;15:573-81。
- 34。
NI SM,孟LJ,Zhao J,Wang XC,Chen J.特异性特定ATTSG1启动子的分离与表征拟南芥.植物生物学代表2008;26:263-76。
- 35。
上官晓霞,徐波,于志新,王丽娟,陈晓艳。棉纤维MYB基因启动子在毛状体中的功能拟南芥烟草的腺毛状体。J Exp Bot。2008; 59:3533-42。
- 36。
Pouteau S,螺栓和花转变,如拟南芥生殖生长阶段变化指标阿尔贝蒂尼C.意义。J Exp Bot。2009; 60:3367-77。
- 37。
Chien JC,苏塞克斯IM。赤霉素和光周期对叶正面和背面毛状体形成的差异调控拟南芥(l)Heynh。植物杂志。1996;111:1321-8。
- 38.
陈志强,陈志强,陈志强,等。植物体表毛状体的相位变化及其分布规律拟南芥.发展。1997年; 124:645-54。
- 39.
俞ñ,蔡wj,王某,山厘米,王lj,陈xy。MicroRNA156针对性滴毛组分布的时间控制SPL.基因在拟南芥.植物细胞。2010;22:2322-35。
- 40。
Alonso JM,Ocker JR。逆转前进:遗传技术,以使拟南芥的基因组的表达筛选。NAT Rev Genet。2006; 7:524-36。
- 41。
基于生长阶段的拟南芥表型分析:植物高通量功能基因组学模型。植物细胞。2001;13:1499 - 510。
- 42。
D 'Agostino IB, Deruère J, Kieber JJ。拟南芥应答调节基因家族对细胞分裂素的响应特性。植物杂志。2000;124:1706-17。
- 43。
Stavang JA,Gallego保持-BARTOLOMEĴ,戈麦斯MD,吉田S,麻美T,奥尔森JE,加西亚 - 马丁内斯JL,Alabadíd,MA的Blazquez。在拟南芥中温度诱导的生长的激素调节。植物杂志2009; 60:589-601。
- 44。
Sato H,Mizoi J,Tanaka H,Maruyama K,Qin F,Osakabe Y,Morimoto K,Ohori T,Kusakabe K,Nagata M,Shinozaki K,Yamaguchi-Shinozaki K.AciaMopsis DPB3-1,Dreb2a互动手,专门增强热量通过形成具有NF-Y亚基的热应激特异性转录复合物来应激诱导的基因表达。植物细胞。2014; 26:4954-73。
- 45。
Kim SJ,Kim Wt。抑制拟南芥环E3 ubiquitin连接酶Atatl78对冷应激的耐受性增加,并降低了对干旱胁迫的耐受性。费用。2013; 587:2584-890。
- 46。
Blanco F,Salinas P,Cecchini Nm,Jordana X,Van Hummelen P,Alvarez Me,Holuigue L.拟南芥中对水杨酸的早期基因组反应。植物mol biol。2009; 70:79-102。
- 47。
Pieterse CM, van威斯SC, Hoffland E, van Pelt JA, van Loon LC。生防菌诱导的拟南芥系统抗性与水杨酸积累和致病相关基因表达无关。植物细胞。1996;8:1225-37。
- 48。
奥达特·克,德梅尔GB,Höftemm。脱落酸决定了番茄的基础易感性葡萄孢菌并抑制水杨酸依赖的信号机制。植物杂志。2002;128:491 - 501。
- 49。
katagiri f,in thilmony r,他sy。的拟南芥-两相互作用。拟南芥书。2002; 1:e0039。
- 50。
Goda H,佐佐木E,秋山K, Maruyama-Nakashita, Nakabayashi K,李W,小川M,山内Y,普雷斯顿J, K,青木牙T, Takatsuto年代,Fujioka年代,Asami T, Nakano T,加藤H,美津浓T,神H,山口,Nambara E, Kamiya Y,高桥H,平井一夫,樱井T, Shinozaki K,齐藤K,吉田年代,岛田Y. AtGenExpress激素和化学治疗数据集:实验设计、数据评估、模型数据分析和数据访问。植物j . 2008; 55:526-42。
- 51.
Kim Sh,Gao F,Bhattacharjee S,Adiasor Ja,Nam JC,Gassmann W.拟南芥抵抗含量基因SNC1是由突变激活的SRFR1.并有助于对细菌效应因子AvrRps4的耐药性。公共科学图书馆Pathog。2010;6:e1001172。
- 52.
Nishizawa-yokoi A,Tainaka H,Yoshida E,Tamoi M,Yabuta Y,Shigeoka S。响应于氧化应激的HSFA2表达调节的26S蛋白酶体功能和HSP90活性。植物细胞生理。2010; 51:486-96。
- 53.
李建平,李建军,李建军,等。WRKY54和WRKY70对水稻叶片衰老的负调控作用拟南芥.J Exp Bot。2012; 63:2667-79。
- 54.
Espunya MC, De Michele R, Gómez-Cadenas A, Martínez MC。S-亚硝基谷胱甘肽的是在创伤 - 和水杨酸诱导的全身反应的成分拟南芥.J Exp Bot. 2012; 63:3219-27。
- 55.
Van Hove J,Stefanowicz K,De Schutter K,Eggermont L,Lannoo N,Al Atalah B,Van Damme EJM。凝集素Aratheuls3的转录分析拟南芥对非生物压力。acta botanica yunnanica(云南植物研究),2014;
- 56。
Karimi M, Inzé D, Depicker A. GATEWAYTM值向量为农杆菌属介导的植物转化。趋势植物SCI。2002; 7:193-5。
- 57。
阵伤SJ,弯曲AF。花卉DIP:简化方法农杆菌属介断的转换拟南芥.工厂J. 1998; 16:735-43。
- 58。
杰斐逊RA。植物嵌合基因的分析:GUS基因融合系统。Plant Mol Biol rep 1987; 5:387-405。
- 59。
Marks DM,Betancur L,Gilding E,Chen F,Bauer S,Wenger JP,Dixon Ra,Haigler Ch。一种用于分离转录组,细胞壁和其他类型分析的大量拟南芥粒瘤的新方法。工厂J. 2008; 56:483-92。
致谢
我们感谢比利时根特大学分子生物技术系G. Gheysen教授提供的pCa35S:GUS拟南芥种子,以及比利时根特大学作物保护系D. De Vleesschauwer博士和M. Höfte教授提供的病原体和感染检测技术援助。我们感谢D. Marks教授对毛状体提取方案的技术建议。
资金
本研究由根特大学研究理事会(项目BOF2010/GOA/003)和弗兰德斯科学研究基金(FWO Grant G006114N)资助。nl承认收到了弗兰德斯科学研究基金的博士后奖学金。
可用性数据和材料
支持这篇文章的结论数据集(S)是(被)包括在项目和其他文件中。
作者的贡献
KS, NL和EJMVD构思和设计了实验。KS, NL, YZ, LE, JVH和BA进行了实验。KS, NL和EJMVD分析数据并撰写手稿。所有作者阅读并批准了最终的手稿。
利益争夺
两位作者宣称他们没有相互竞争的利益。
同意出版物
不适用。
伦理批准和同意参与
不适用。
作者信息
隶属关系
通讯作者
额外的文件
附加文件1:图S1。
AT2G02360启动子序列,主要推定独联体- 突出显示的监管元素。图S2。水平AT2G02360WT生命周期中的表达答:芥col0植物使用generesearcher搜索工具。图S3。在应力 - 处理的WT选择阳性对照基因的相对转录水平答:芥Col-0植物。图S4。相对转录水平AT2G02360在16天大的wt答:芥不同胁迫处理下的幼苗。图S5。AT2G02360启动子序列,有突出推定独联体- 治疗可能参与胎儿中的启动子活性的调节元件。图S6。WT和转基因KO6、OE4和OE6叶片病徵的发展答:芥植物感染太平洋标准时间DC3000。表S1。假定的独联体-识别为高频的作用调节元件AT2G02360启动子序列依据在网上对存储在PLACE、PlantCARE和AGRIS数据库中的相同主题进行分析。表S2。qRT-PCR中所有引物概述。表S3。分子克隆中所有引物的概述。文本S1。在网上表达式分析表明AT2G02360是一种应激响应基因。文本S2。对转基因答:芥植物与改变F-框Nictaba表达。(DOCX 1858 KB)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
赵永强。et al。聚糖结合F箱蛋白拟南芥保护植物两感染。BMC植物杂志16日,213(2016)。https://doi.org/10.1186/s12870-016-0905.2.
已收到:
接受:
发表:
关键字
- F-box-Nictaba
- 多糖
- 植物血凝素
- 假单胞菌
- 水杨酸
- 压力