摘要
背景
吲哚-3-乙酸(IAA)是生长素中含量最多的一种促生长激素,参与多种发育过程。生长素的内稳态对其功能至关重要,这是通过调控IAA的生物合成、偶联、降解和转运来实现的。IAA在葡萄果实发育初期起着重要作用,它通过降低脱落区乙烯敏感性来延缓果实脱落。因此,需要连续的IAA极性运输到花梗。这种转运是由IAA控制的,它通过修改在细胞内不对称定位的PIN- formed (PIN)生长素外排促进因子的表达和定位来调节自身的运动。另一方面,激素赤霉素(GA)也通过增加PIN稳定性来激活生长素的极性运输。在葡萄,小果脱落发生在开花后的前两到三周。在此期间,存在IAA和GA,但这些激素在控制生长素极性转运中的作用尚不清楚。
结果
在这项工作中,使用放射性标记的IAA表明,生长素基本上是在葡萄果实脱落过程中运输的。这一观察结果进一步得到了VvPIN蛋白的免疫定位的支持,这些蛋白在果皮细胞中显示出基瓣分布。四种生长素的极性转运和转录本推测VvPIN随着脱落的增加,基因减少,极性生长素运输的抑制导致果实掉落。遗传算法3.IAA处理降低了生长素的极性转运,而GA处理仅降低了生长素的极性转运3.治疗减少VvPIN转录丰度。当GA生物合成被阻断时,IAA能够促进生长素的极性转运,表明其作用取决于GA含量。最后,我们观察到几种与iaa相关的化合物的含量在脱落期间发生了显著变化。
结论
这些结果表明,生长素的稳态在葡萄果实的初始发育过程中起着关键作用,而GA和IAA通过减少生长素的极性运输来控制生长素的稳态。
背景
生长素是一组参与多种发育过程的植物激素[1]通过信号级联和转录激活[2].在生长素中,吲哚-3-乙酸(IAA)是最丰富的,考虑到几个过程对其水平进行微调,这使得通过其信号传导对植物生长和发育进行优化控制[3.].
通过生物合成、转运、降解和转化途径维持IAA水平被称为生长素稳态[4].新创IAA生物合成维持这种激素的稳定供应,并发生在特定部位,特别是年轻组织[5].IAA的合成主要有两种途径:色氨酸依赖途径和色氨酸不依赖途径[3.].植物中IAA的主要合成途径可能是色氨酸依赖的生物合成途径,其中色氨酸先转化为吲哚-3-丙酮酸(IPyA)再转化为IAA的两步法是目前了解最多的途径[6- - - - - -8].吲哚-3-乙酰胺(IAM)也是IAA的直接前体[9],但IAM在工厂生产的步骤仍有待阐明。IAA的水平也可通过偶联(主要与氨基酸和糖)和降解来调节[10,11].值得注意的是,IAA-Asp, IAA-Trp和IAA-Glu的缀合是不可逆的,这表明这些化合物是通过氧化降解的[12].IAA- trp缀合物是一种IAA拮抗剂,可抵消IAA反应[13],增加了IAA监管网络的复杂性。生长素失活是通过氧化IAA和IAA缀合物,产生oxaa、oxia - asp和oxia - glu等[14,15].除了IAA水平的代谢控制外,其转运对调节生长素稳态也至关重要[16].IAA从生物合成点移动到远处的位点产生IAA梯度,这对其功能至关重要[17,18].IAA的定向运动是通过生长素外排促进剂在质膜中的不对称排列实现的,称为PIN- formed (PIN)蛋白[19- - - - - -21].所有这些机制共同维持不同发育过程所需的最佳IAA水平。
IAA在果实发育初期起着重要作用。拟南芥在开花时在子房中施用IAA会在没有授粉或受精的情况下导致坐果,从而形成孤雌无核果实(拟南芥)和番茄(茄属植物lycopersicum) [22,23].向发育中的苹果注入IAA (家棠)水果也会增加果实的大小和细胞的膨胀[24].一些证据表明生长素稳态在果实生长发育中的重要性。用极性生长素转运抑制剂处理未授粉的番茄子房会导致孤雌。相应的,处理授粉子房会抑制果实的形成,与较高的IAA含量相关[25].结果表明,果实结实需要一个最佳的IAA浓度。同样,番茄的沉默SlPIN4基因导致单性果实的形成[26].尽管减少了SlPIN4沉默系的IAA水平与野生型植物开花时的IAA水平相似,与开花前IAA- asp含量增加有关,这表明一些稳态机制能够缓解IAA中断。研究表明,应用IAA可增加苹果的果实大小并减少脱落,而过量的IAA则会减少苹果的生长和落果[24].总之,这些例子说明了控制生长素稳态对实现正常果实发育的重要性。
脱落是发生在果实最初发育过程中的一个重要过程,它决定了果实的负荷,从而使来自多个sink的同化物得到适当的分布。这一过程主要由激素乙烯[27,28].IAA还参与控制小果脱落,因为它通过降低乙烯敏感性来防止花梗内脱落区(AZ)的形成[29].AZ的持续IAA供应来自于发育中的水果[25,30.]而应用极性生长素转运抑制剂导致脱落[31].
尽管生长素的极性转运在离体过程中起着重要作用,但目前对其调控机制的认识还很有限。生长素的极性运输和表达的变化针果实生长过程中的基因已被报道[26,30.,32但这些变化背后的信号仍然未知。IAA通过抑制PIN蛋白循环的内吞步骤来刺激自身的转运[33]并通过塑形肌动蛋白丝[34].IAA还上调编码PIN基因的转录,增加PIN蛋白的丰度[35- - - - - -37].赤霉素(GAs)也可能调节生长素的运输,通过积极调节生长素的极性运输和诱导PttPIN1杂交白杨维管束形成层的表达(银耳杨树) [38].此外,GAs还增加了拟南芥中PIN蛋白的丰度[39].由于番茄和葡萄在果实发育初期气体含量较高[23,40,41],可能对离体期生长素的极性转运有一定的控制作用。
小道消息(葡萄)浆果是一种非更年期的肉质果实,由数十颗葡萄串成一串[42].在葡萄果实发育过程中,根据果皮生长模式可分为三个阶段。第一阶段的特点是浆果生长活跃;阶段II对应于滞后阶段,此时浆果大小没有明显变化;第三阶段,是恢复生长和成熟过程的时期[43].从开花开始,第一阶段持续4至6周不等,这取决于不同的品种[44].在此期间,浆果大小的增加主要是由于细胞分裂和细胞增大[45],出现脱落过程[46]与乙烯含量高相吻合[47,48].关于IAA水平,在葡萄果实发育过程中存在一定的差异。然而,据报道,从开花到成熟,IAA含量有所下降[49],而IAA水平在浆果发育过程中一直保持在较低的水平[50].然而,没有研究报道IAA在I期含量的变化,也没有报道极地生长素运输的作用,以及这些变化如何与控制葡萄果实脱落有关。
葡萄果实生长素稳态的重要性在果实成熟过程中得到了突出的体现,IAA含量的降低与IAA- asp浓度的升高相关;因此,偶联法通过降低IAA含量来促进成熟[49],因为这种激素被认为可以延缓这一过程。然而,还没有其他生长素稳态机制控制葡萄浆果发育过程的例子。在这项工作中,葡萄果实的脱落与极性生长素运输和同源拟南芥基因转录丰度的变化有关针进行了研究。由于模式生物中生长素的极性转运受GA和IAA的调控[36,38,39]而这两种激素在葡萄浆果发育的第一阶段都被检测到[40,49,51,52],这些激素在调节生长素极性运输中的作用也进行了评估。最后,定量分析了果实发育早期IAA前体、IAA偶联物和氧化产物的变化。据我们所知,这是第一份评估激素对极地生长素运输的调节以及在初始浆果发育过程中生长素相关化合物的变化的报告。
结果
葡萄果实生长素极性转运的测定
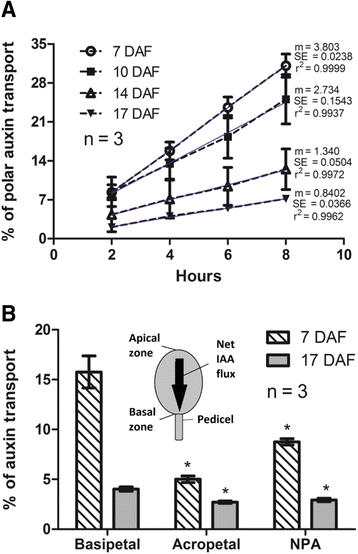
为了确定在葡萄果实中是否发生生长素的极性运输,使用放射性标记的IAA在切除的果实中设计了一种量化IAA在浆果中的移动的方法。在开花后7 - 17天(DAF)取样的浆果中,生长素运输速率在实验持续时间(8小时)中是恒定的(图。1).但在7 ~ 17 DAF之间,线性回归的斜率逐渐减小,表明生长素的极性转运速率随发育阶段的不同而不同。接下来,设计了一个实验,以比较基瓣(从浆果的根尖区到花梗)和顶瓣的生长素运输(从花梗到浆果的根尖区)以及生长素运输抑制剂NPA对极性生长素运输的影响(图。1 b).试验4 h后,在7和17 DAF时,浆果的生长素有效转运量分别为15.8%和4.0%。1 b).同时,在7 DAF和17 DAF时,肢端转运(IAA扩散的测量)分别为5.0%和2.7%。IAA净通量,实验4小时后,由基瓣输运减去顶瓣输运得到[53]在7 DAF和17 DAF时分别为10.8%和1.3%。IAA的通量方向从果实的顶区向基区。用生长素转运抑制剂n -1-萘酞酸(NPA)处理后的IAA运动在7和17 DAF进行评估。如图所示。1 b在7 DAF和17 DAF时,NPA处理浆果IAA的基部转运量分别从15.8%下降到8.8%和4.0%下降到2.9%。这些结果表明,生长素转运速率随发育阶段的不同而不同,在7 DAF时,NPA降低了生长素转运速率,这可能是一种极性转运。
极性生长素转运抑制剂NPA对葡萄果实脱落的影响
为了确定抑制生长素极性转运是否对果实脱落有影响,用NPA处理了10个和20个DAF果实,并在处理后4天(DPT)评价其效果。如图所示。2结果表明,NPA处理后10个DAF果实发生脱落,14个DAF处理的果量较对照显著降低。但与对照相比,NPA对20个DAF果实24个DAF浆果数的影响不明显。然后对10个经DAF - npa处理的果实和对照果实的脱落率进行量化(图。2 b).结果发现,NPA导致约90%的脱落,而对照簇在14 DAF时的脱落率不到30%。这些结果表明,NPA处理对10 DAF时的果实脱落有主要影响,此时生长素的极性转运似乎更高。
生长素转运抑制对葡萄果实脱落的影响。一个40 μM npa处理团簇和对照团簇的代表图像。治疗时间分别为10和20 DAF,治疗后4天进行视力检查(DPT)。b14个DAF集群的小果脱落估计显示在(一个).小果脱落率等于1减去14 DAF时每丛浆果数与10 DAF时同一丛浆果数之比(见附加文件)3.:表S1)。误差柱表示四个重复(簇)的SE。星号表示npa处理浆果的果实脱落率与对照果实的相应值差异显著(p <0.05)
葡萄果实脱落过程中的脱落动态及生长素的极性转运时间过程
葡萄小果的最初发育特点是由于脱落而导致的果实损失,根据不同的品种,它可能在10 DAF内迅速发生,或逐渐发生,有的下降至30 DAF [46].在本研究中,秋王氏品种在开花后几天就发现了脱落。将7、10、14和17个DAF条件下的每丛浆果数分别与3、6、10和13个DAF条件下的同一丛浆果数进行比较,确定果实脱落率。如图所示。3,果实脱落率在10和14 DAF时最高,在17 DAF时下降。从7 DAF到10 DAF浆果脱落的突然增加先于14 DAF之后浆果体积的增加(图。3).有趣的是,从7 DAF到14 DAF的脱落增加与被切除的果实中生长素极性运输百分比的下降相关(图2)。3 b)和输运斜率(图;3 c),这是衡量生长素运输强度的指标,如Shinkle等所述。[54].
葡萄小果脱落过程中推测的葡萄PIN基因转录丰度的变化
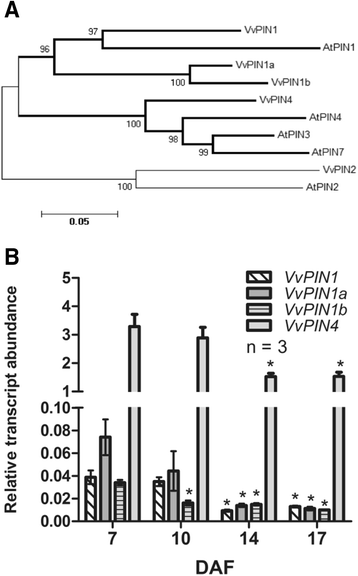
在拟南芥中,生长素外排促进蛋白PIN家族由8个成员组成,AtPIN1-AtPIN8 [16].由于只有AtPIN1-AtPIN4和AtPIN7以极性方式定位于质膜,与生长素反应报告子的活动模式相关,因此有人认为它们负责生长素的极性转运[20.].因此,核苷酸序列AtPIN1-AtPIN4而且AtPIN7用于黑皮诺葡萄基因组的同源性搜索。这一分析允许鉴定推定葡萄藤的五个基因模型销基因(VvPINs),被称为VvPIN1,VvPIN1a,VvPIN1b,VvPIN2而且VvPIN4。为了检查它们的水果特异性表达,存在VvPINsRT-PCR检测果实和根中的转录本。VvPIN1,VvPIN1a,VvPIN1b而且VvPIN4在发育中的浆果和VvPIN2发现仅在根中表达(数据未显示)。因此,只有VvPIN1,VvPIN1a,VvPIN1b而且VvPIN4用于进一步分析。的预测开放阅读框架VvPIN1,VvPIN1a,VvPIN1b而且VvPIN4分别编码604、555、554和656个氨基酸残基。AtPIN1蛋白与VvPIN1、VvPIN1a和VvPIN1b蛋白的同源性分别为73%、61%和60%,而VvPIN4蛋白与AtPIN3、AtPIN4和AtPIN7蛋白的同源性分别为76%、73%和74%。由拟南芥和葡萄PIN氨基酸序列生成的系统发育树的拓扑结构如图所示。4.其次,相对转录丰度VvPINs用qRT-PCR方法对果实进行评价。有趣的是,成绩单都积累了VvPINs在7 DAF时显示出最高值,然后从14 DAF起观察到显著下降(图。4 b).这种模式与之前描述的生长素极性转运的减少有关(图2)。3.).自VvPIN4显示出最高的转录丰度VvPINs评估后,选择它进行免疫定位测定。
拟南芥(At)和假定葡萄藤(Vv)的系统发育树预测了PIN蛋白和时间进程VvPINs葡萄果实中的表达。(一个)基于全长蛋白质比对的邻居连接树。给出了1000次迭代的自举。标尺表示每个位点的氨基酸取代数。在葡萄柚果实中检测到的含有VvPINs转录本的分支以粗体突出显示。b相对转录丰度VvPIN1,VvPIN1a,VvPIN1b而且VvPIN4在7、10、14和17个DAF果实中进行了评价。转录丰度与构成基因的平均表达有关VvUBI1而且VvGPDH(见方法部分)。误差柱表示三个重复的SE。星号表示转录丰度在7 DAF时与相应值有显著差异(p <0.05)
推测的VvPIN4蛋白的免疫定位
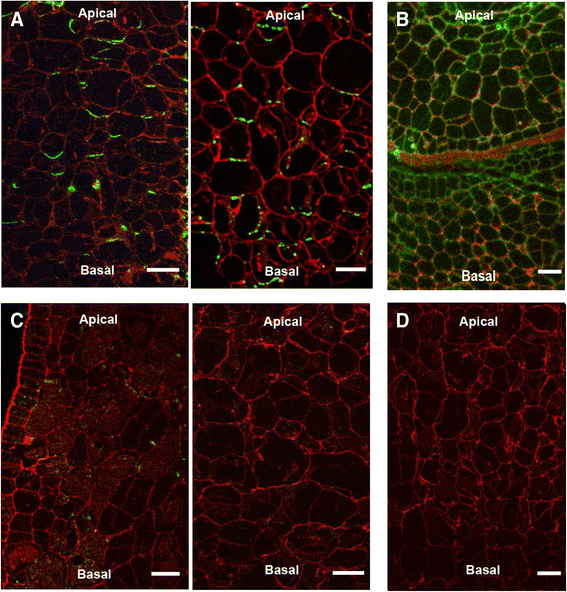
以确定生长素是否转运和极性高VvPINs在10 DAF记录的转录丰度与假定的细胞水平PIN定位一致,使用针对拟南芥PIN4的抗体在葡萄果实上进行免疫定位。一个在网上分析表明,假定的VvPIN4蛋白被预测为膜转运蛋白(http://pfam.xfam.org/)和氨基酸序列比对显示YPAPNP基序附近的丝氨酸和苏氨酸残基,其磷酸化对PIN极性至关重要[55],在VvPIN4中存在(数据未显示)。如图所示。5当使用抗atpin4抗体时,在10个DAF果皮细胞基底侧观察到清晰的极化信号。用fm4 -64膜亲脂染料对膜进行染色,识别的蛋白为膜蛋白。使用抗肌动蛋白的对照组显示弥散荧光,表明极化信号表明对VvPIN4的识别(图2)。5 b).
IAA、GA的作用3.和IAA / GA3.生长素极性转运的处理
我们发现从7到14 DAF的果实脱落率显著增加,这与生长素的极性运输有关VvPINs转录丰度降低(图;3.和无花果。4 b).由于IAA和GA在其他模式生物中调控生长素的极性运输[34,38,39],我们怀疑葡萄果实中生长素的极性转运是否也受到IAA和GA的调控。
我们进行了顺式作用元素的搜索VvPINs启动子,以及多种生长素和ga反应元件VvPIN1,VvPIN1a,VvPIN1b而且VvPIN4发现启动子序列(附加文件1:图S1)。在拟南芥启动子区也发现了这些元素销基因(56- - - - - -59].
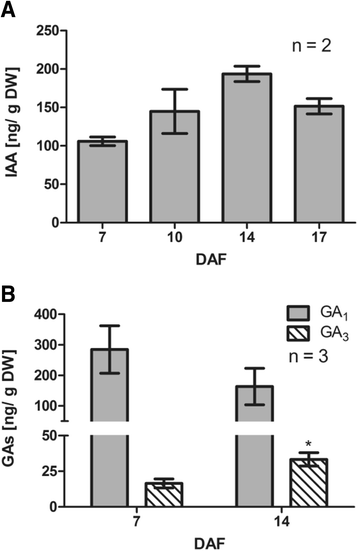
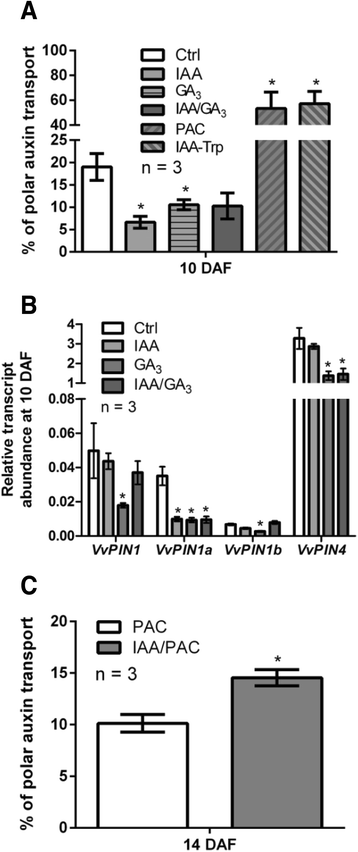
当对这些激素的内源性量进行量化时,发现游离IAA水平在每克组织100-200 ng之间,在7 - 17 DAF之间没有显著差异(图2)。6).在生物活性气体的情况下,GA1水平在分析时间点没有表现出显著变化,而GA3.7 ~ 14 DAF含量显著增加(图;6 b).研究这些激素是否调控生长素的极性转运、IAA、GA3.和IAA / GA3.7 DAF处理对生长素极性转运的影响VvPINs用3dpt测定转录本丰度。如图所示。7一个, iaa, ga3.和IAA / GA3.处理显著降低了生长素的极性转运。有趣的是,GA生物合成抑制剂Paclobutrazol (PAC)和对IAA具有拮抗作用的IAA- trp [13],导致与对照和激素处理样品相比,生长素的极性转运增加(图2)。7一个).在基因表达水平上,GA3.治疗导致所有人转录丰度的降低VvPINs,而IAA处理仅降低VvPIN1a转录丰度。IAA/GA组合3.治疗后出现下降VvPIN1a而且VvPIN4转录丰度(图;7 b).由于IAA通过一种缓解生长素水平升高的正反馈机制,正向调节生长素的极性运输[33,34,37],我们假设IAA在我们的实验中观察到的对生长素极性转运的负面影响(图。7一个)可能是由于GA生物合成的激活,因为IAA诱导GA氧化酶基因[23,60- - - - - -63].为了验证这一点,将PAC和PAC/IAA联合处理应用于12个DAF浆果。与PAC处理2 DPT相比,PAC/IAA联合处理显著增加了生长素的极性转运。7 c).可以假设,在PAC/IAA处理中,没有GA生物合成的诱导,只有IAA可以解释生长素极性运输的任何变化。综上所述,GA和IAA对生长素的极性转运和转运具有负调控作用VvPINs葡萄果实离体期的表达。然而,当GA生物合成受到抑制时,IAA可能是生长素极性转运的正向调节因子。
IAA和GA对生长素极性转运的影响VvPINs表达式。转运6小时后生长素极性转运的百分比(一个)和相对转录丰度VvPIN1,VvPIN1a,VvPIN1b而且VvPIN4(b)对1 μM IAA, 30 μM GA的响应3., 1 μm iaa /30 μm ga3.10 DAF时,20 μM PAC和1 μM IAA-Trp处理。治疗在7 DAF进行,评价在3 DPT进行。转运4小时后生长素极性转运的百分比(c)对20 μM PAC和1 μM IAA/20 μM PAC处理在14 DAF下的响应。治疗时间为12 DAF,评估时间为2 DPT。(一个)及(b),星号表示处理果实的生长素转运量或相对转录本丰度与对照(Ctrl)浆果的相应值显著不同(p <0.05)。(c),星号表示IAA/ pac处理浆果的生长素极性转运量与pac处理浆果的相应值显著不同(p <0.05)。误差柱表示三个重复的SE
葡萄果实离体过程中iaa相关化合物的测定
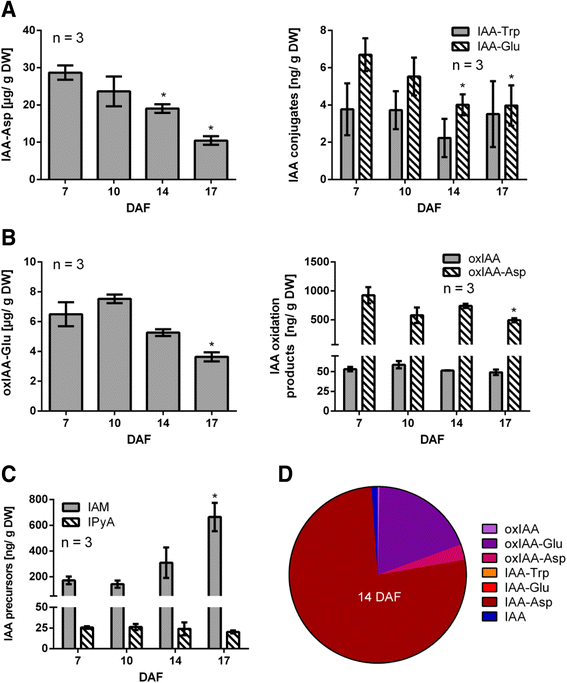
由于生长素的极性转运在离体过程中稳步下降(图;3 b,c),假设IAA的生物合成是恒定的,那么在实验结束时,IAA的含量也会随之增加。然而,IAA水平没有表现出重要的变化,至少从10到17 DAF(图。6).因此,我们推测其他机制可能参与了IAA水平的控制。为了评估IAA生物合成、偶联和降解过程中的变化,IAA前体吲哚乙酰胺(IAM)和吲哚-3-丙酮酸(IPyA)的水平;IAA氨基酸缀合物,IAA-丙氨酸(IAA- ala), IAA-天冬氨酸(IAA- asp), IAA-色氨酸(IAA- trp)和IAA-谷氨酸(IAA- glu);采用LC-MS/MS对7 ~ 17 DAF葡萄果实中的IAA氧化产物oxindol3 -乙酸(oxIAA)、oxindol3 -乙酸-谷氨酸(oxia - glu)和oxindol3 -乙酸-天冬氨酸(oxia - asp)进行了分析(图。8).
与IAA- trp和IAA- glu缀合物相比,IAA- asp被发现是最丰富的偶联IAA形式(图。8).另一方面,未检测到IAA-Ala。还观察到,IAA-Asp和IAA-Glu水平从7 DAF显著降低到14 DAF,而IAA-Trp在评估时间点没有变化。对iaa -氧化产物进行分析,发现其中含量最高的化合物为oxia - glu,而oxia - asp和oxia - glu含量较低(图。8 b).与7 DAF相比,17 DAF时oxia - glu和oxia - asp显著下降。关于IAA的生物合成,IPyA前体的水平是恒定的,而IAM的水平从7 DAF显著增加到17 DAF(图。8 c).从IAA中获得的最丰富的化合物是不可逆的IAA- asp共轭物和IAA-氧化产物oxIAAGlu和oxia - asp(图2)。8 d).这些结果,以及观察到的生长素极性转运的变化,表明在葡萄果实发生脱落过程的短发育窗口期,生长素稳态发生了深刻的变化。
讨论
生长素主要在葡萄果实中运输
生长素的定向通量是几个发育过程的基础[17,18].在果实发育方面,番茄果实和甜樱桃花梗的基瓣运输已被报道过[25,30.].
在本研究中,测量了秋季皇家品种葡萄果实的生长素的极性运输。放射性标记的IAA应用于浆果的顶端区域被发现基本运输,运输速率在测量期间呈线性增加(图2)。1).相比之下,甜樱桃花梗的基瓣运输在1.5 h后趋于平稳[30.].据Vieten等人所述,报道的稳定可能是由于PIN蛋白离域导致的运输饱和,以响应高水平的IAA。[37].
在7daf时,约16%的放射性标记IAA被浆果在4小时后运输到基区(图。1 b).有趣的是,在NPA处理后,基瓣运输减少了大约50%,这表明测量到的IAA运输是极性的。这些值与黄化拟南芥和番茄幼苗下胚轴切除切片经过3小时转运期后得到的值相似[53].在17 DAF时,基底输运较低,NPA效应不明显。肢端转运反映了非极性IAA运动,包括被动扩散和非极性PGP/MDR/ABCB外排载体介导的IAA运动[64- - - - - -66]和AUX/LAX家族的生长素流入载体[67- - - - - -69].在7 DAF时,顶瓣转运约为基瓣转运的三分之一,高于报道[30.,53].这可以解释为非极性生长素转运体的增加。在17 DAF时,肢端转运比7 DAF时低,表明非极性IAA运动也随着浆果年龄的变化而变化。
基瓣VvPIN分布支持基瓣生长素运输,使用放射性标记IAA确定。在使用抗atpin4抗体时,VvPIN4推测蛋白在10daf时定位于果皮细胞基底侧(图。5).尽管我们没有足够的证据表明AtPIN4只识别VvPIN4而不识别其他VvPINs,但在细胞基底侧观察到的极化信号强烈表明,该抗体可以识别葡萄PIN生长素外排促进因子。
抑制生长素运输导致葡萄果实脱落
果实脱落是一个受多种因素影响的形态发生过程。在内源性因素中,激素起着至关重要的作用。乙烯是导致果实脱落的主要激素。27,28],分离过程的微调是乙烯敏感性调制的结果,已知这取决于生长素的极性转运[29].
NPA抑制了生长素的极性运输,增加了10 DAF下的果实脱落(图2)。2),表明生长素的极性运输维持有助于果实的保留。值得注意的是,同样的治疗在20 DAF时没有效果。此前有报道称,在苹果花梗开花后阶段施用NPA会增加果实脱落[70].然而,对我们的知识差异影响取决于发展阶段的NPA还没有研究。NPA处理在20 DAF时可能对果实负荷没有影响,因为此时浆果脱落过程已经结束。与前几天相比,乙烯含量在17 DAF时较低(附加文件)1:图S2,附加文件2).因此,通过生长素的极性运输来调节乙烯的敏感性在这个时候可能不再需要了。
脱落的增加与生长素的极性转运和推测的葡萄PIN基因转录丰度的降低有关
从7 DAF到14 DAF,脱落显著增加,然后从14 DAF开始,浆果大小急剧增加(图2)。3).可以建议植物在促进果实生长之前确保果实保留,以避免资源徒劳地流向可能脓肿的组织。脱落增加可能是IAA转运量减少和/或转运强度降低的结果(图。3 b而且c).在甜樱桃中也得到了类似的结果,在果实脱落之前运输强度下降[31].从7到10 DAF,生长素的极性转运减少不如脱落增加那么明显,但我们认为生长素稳态的轻微变化足以控制脱落等发育过程。在实验条件下,不可能在7 DAF之前测量生长素的极性运输,但人们可以预期它甚至更高,因为生长素运输强度的最高值早在甜樱桃花到花蒂的三天内,即细胞分裂阶段[30.].
生长素极性转运的减少与生长素转运的减少有关VvPINs7 - 17 DAF的转录丰度(图;4 b).莫奈等人。[26]也报告了番茄的减少销在果实发育过程中表达量最高,开花后4天表达量最高SlPINs.的变化VvPIN转录本可能有助于所观察到的生长素极性转运的减少,尽管蛋白质丰度和定位的变化也可能涉及。
生长素的极性转运受IAA和GA的调控
生长素可以通过上调PIN转录来修饰自身的转运,如拟南芥[36,37].此外,在杂交白杨和拟南芥中,GA激活了生长素的极性运输[38,39].因此,IAA和GA可能参与调控葡萄果实生长素的极性转运,因为这两种激素都在葡萄果实中被检测到。
如图所示。3.在拟南芥和杂交白杨中,如果IAA和GA正调控了生长素的极性转运,则其水平应相应降低。然而,IAA和活性GA年代并没有呈现出预期的模式(图;6),可能这些激素并不像之前报道的那样在葡萄藤中起作用。事实上,IAA和GA抑制了生长素的极性转运3.并没有预料到(图;7一个),尽管它与PAC和IAA-Trp处理后的激活一致。在分子水平上,VvPINs都被GA调低了3.而只有VvPIN1aIAA影响转录丰度(图;7 b).我们假设IAA对生长素极性转运的影响是通过激活GA生物合成来实现的。正如预期的那样,当GA的生物合成被PAC阻断时,IAA能够激活生长素的运输(图2)。7 c).
如果IAA诱导GA的生物合成,则IAA和IAA/GA的组合3.治疗应导致VvPIN下调监管,但这只适用于VvPIN1a.也许在IAA的假定诱导作用之间存在一种平衡VvPINs以GA作为负调控因子,因此净结果对其无影响VvPINs表达式。另一方面,也许吧VvPIN4被IAA/GA联合下调3.因为GA的负面作用3.优于假定的IAA诱导作用。综上所述,需要做更多的工作来了解IAA和GA之间的影响的平衡VvPIN表达式。
GA对VvPINs表达与内部存在的几种ga响应元件不一致VvPINspromoters(附加文件3.:图S1)。然而,这些元件的作用不是很清楚,因为它们存在于GA诱导基因中,但也存在于GA无响应基因中,所以这些元件的出现并不一定表明GA响应性[57].它们也存在于AtPIN1而且AtPIN4被GA抑制的基因[39].
结果表明,GA和IAA对生长素的极性转运具有负向调控作用,而当GA生物合成受到抑制时,IAA则激活生长素的极性转运。我们认为,在葡萄果实脱落过程中,IAA保持在一个高浓度范围内,能够激活GA的生物合成,从而导致VvPINs从而使生长素的极性运输从7 DAF减少到17 DAF。
如前所述,由于GA会刺激拟南芥花序茎段生长素的转运,因此对生长素极性转运的负面影响是意料之中的[39]和杂交白杨的维管形成层[38].然而,支持我们的结果的是,最近有报道称GA抑制了杂交白杨茎中IAA的流出,影响了不定根[71].因此,GA对生长素极性转运的影响可能是可变的,可能取决于组织和发育阶段。
葡萄果实脱落过程中iaa相关化合物的含量发生变化
关于水果生长素内稳态控制的证据很少。有报道称,在浆果成熟过程中,IAA- asp含量上升,同时IAA含量下降,因此偶联被认为参与了成熟启动[49].我们在葡萄果实中发现了极高浓度的这种共轭物,其浓度为微克/克组织,而Böttcher等人。[49报告的浓度为纳克级。从7 DAF到17 DAF,这种结合物至少减少了50%,这表明生长素的稳态在离体期间发生了显著的变化(图2)。8).在IAA氧化过程中,最丰富的化合物是oxia - glu(图。8 b).该化合物的含量为微克级,而IAA- glu的含量为纳克级,由此可见,所有与谷氨酸结合的IAA都立即被氧化。另一方面,与IAA-Asp相比,oxia - asp的含量较低,这表明该共轭物不是良好的氧化底物。我们的结果表明,IAA氧化在7到14 DAF之间没有发生强烈的变化。只有在17 DAF时,氧化形式的IAA的含量显著降低(图。8 b),可能是由于IAA氧化减少,或者是由于这些氧化化合物的进一步化学修饰。就IAA的生物合成而言,IAA产生的调控似乎是通过IAM途径进行的。该化合物在17 DAF时显著增加(图。8 c),表明IAA生物合成的抑制在此时发生。与7 DAF相比,14 DAF时可能较少的偶联和较低的IAA输出导致14 DAF时较高的IAA含量(图。6),而这种增加反过来抑制IAA的生物合成,导致IAM含量在17 DAF时增加。从图中可以看出,在14 DAF时,iaa衍生化合物的含量存在显著差异。8 d,说明IAA代谢的某些途径的偏好,以天冬氨酸缀合最为突出。
结论
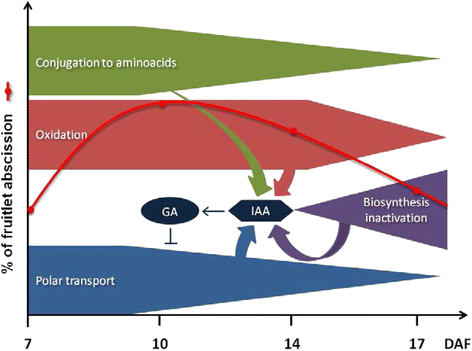
作为果实脱落过程中生长素动态平衡的模型,提出在7 DAF时,大量的共轭和氧化IAA形成控制IAA水平。此外,生长素的极性运输避免了IAA在果实内的积累。有人提出,体内平衡机制协调一致地将IAA水平维持在生物学上显著的范围内,因此GA生物合成保持激活状态,从而抑制生长素的极性运输。最后,极性生长素运输的减少,以及乙烯敏感性的预期增加,将解释从10 DAF开始的脱落。在17 DAF时,由于乙烯含量低,脱落率会下降(附加文件1:图S2)。该模型如图所示。9.
在这项工作中,GA对果实脱落的影响没有进行评估,但在开花结束时使用GA作为稀释剂有很好的描述[72].有趣的是,坐果后GA不会使浆果变薄,只会使浆果变大[73].可能,GA在果实发育早期影响果实的保留,当乙烯含量低且脱落过程结束时,只观察到GA对浆果大小的众所周知的影响。IAA也被用作稀释化合物[74].其在脱落中的作用将通过控制GA水平来实现,如图所示。9).有趣的是,100 ppm的IAA处理对葡萄果实脱落没有显著影响,而1000 ppm几乎杀死了集群[74].因此,体内平衡机制似乎可以缓冲IAA干扰的范围,超出这个范围,IAA效应对正常发育是有害的。值得一提的是,在一些果实品种中,IAA通过降低对乙烯的敏感性来延迟小果脱落,但重要的是要记住,这依赖于从小果到花梗的持续生长素供应。在这里,我们提出了另一种机制,IAA可能通过激活GA生物合成来抑制生长素的极性转运。据我们所知,这是第一次提出这样的机制。
综上所述,本研究结果表明,生长素稳态在果实初期发育过程中至关重要,因为其极性生长素转运抑制导致脱落。我们提出了一个IAA和GA调控生长素极性转运的模型,说明了生长素稳态是如何被控制的。最后,脱落期IAA相关化合物含量的急剧变化表明,在这一时期生长素的稳态发生了深刻的变化,以维持最佳的IAA水平。了解这种葡萄的脱落过程,可能有助于在未来改善某些品种的农业实践,并减少因脱落而造成的果实损失。
方法
植物材料及处理
三株葡萄藤(VitisviniferaL. cv Autumn Royal)于2011/2012和2012/2013生长季从智利Curacaví山谷(33°36′S, 70°39′W)的试验田中挑选。在开花后7天、10天、14天和17天(0 DAF = 30%开花)采集浆果样品,以评价脱落期脱落、生长素极性转运和基因表达的变化。
以10 mL 40 μ mn -1-萘酞酸(NPA;Sigma-Aldrich)在羊毛oline:凡士林(1:3)的混合物(NPA(+)处理)或单独的混合物(NPA(-)处理)分别应用于10和20 DAF。治疗后4天(DPT)进行脱落评估。用10 mL 1 μM IAA (Sigma-Aldrich)、10 mL 30 μM GA评价激素对生长素极性转运的调节作用3.(Sigma-Aldrich), 15ml 1 μM IAA/30 μM GA3.20 μM多效唑(PAC;Sigma-Aldrich)和10 mL 1 μM IAA-Trp (OlChemIm Ltd.)在羊毛oline:凡士林(1:3)混合或单独混合(对照)中施用于7 DAF,并在3 DPT时评估其对生长素极性运输和基因表达的影响。为了确定IAA在缺乏ga条件下调控生长素极性转运的作用,在12 DAF下,在羊毛oline:凡士林(1:3)的混合溶液中分别施用10 mL 20 μM PAC和10 mL 1 μM IAA/20 μM PAC,并在2 DPT时评估IAA对生长素极性转运的影响。在每一种处理中,包括花梗在内的整个浆果都被一层薄薄的羊毛碱:凡士林(1:3)单独混合或含有生长调节剂。
对于所有测量,独立的植物都被视为生物复制,如图所示,每个植物的样本都是在上午10点至下午2点之间采集的。
生长素的极性运输测量
Else等人描述的基瓣IAA转运实验[30.]进行了修改,以测量生长素通过其纵向轴在被切除的果实之间的运输。简单地说,用锋利的剃须刀片在去离子水下将果蕊从果蕊中取出,在果蕊顶端挖一个小孔,滴入0.2 μL [5-]3.H]IAA(比活度50.55 TBq/mmol, 1 mCi/mL, 250 μCi, American radiolabel Chemicals Inc.), 1:10稀释于纯乙醇(终浓度4 μM)。接下来,将小果放置在24孔组织培养板(Sigma-Aldrich)中,其基面与接收琼脂盘(1.5% (w/v)琼脂(Merck), 0.2% (w/v) MES (Sigma-Aldrich), pH 5.5, 300 μ l终体积)接触。放置[5-]后3.H]IAA滴在小果上,在指定的运输期间,将盘子盖上并保持在22°C。1,3.而且7).孵育后,果实和琼脂盘分别在2 mL 80%甲醇中均质,在4°C下搅拌过夜。接下来,他们被转移到一个含有3ml液体闪烁鸡尾酒(OptiPhaseHiSafe 3, perkins - elmer)的小瓶中。在液体闪烁分析仪(Beckman Ls6500)中,用放射性闪烁计数每分钟分解次数(DPM)测定果果和琼脂圆盘中累积的放射性。如前所述,结果以极性生长素的百分比(%)表示[53],数值由果实体积和接触面修正,根据Eq。1:
在哪里DPM琼脂琼脂圆盘中累积的放射性,DPM小果实是残留在水果里的放射性,R接触面的半径是否在横向切割和卷为根据式估计的平均体积。2:
在哪里道明而且LD横向和纵向直径是用卡尺测量的。
在顶瓣控制中,通过放置小果,使其顶端表面与琼脂盘和[5-3.H]IAA滴入果梗连接处。在NPA对照中,加入40 μM NPA (Sigma-Aldrich),以羊毛oline:凡士林(1:3)混合在足底生长素转运实验前24 h。
小果脱落估计
对于脱落估计,每簇的果实数量通过计数花梗在开花时拴在花梗上的细线来记录。脱落率(%)根据式。3.:
在哪里小果实最初的在开花时登记的果实数量是初始日期和小果实最后是四天后在同一集群中注册的小果的数量。进行了三到四次生物复制。复制的值显示在附加文件中4:表S1和附加文件5:表S2。
DNA序列
的CDS核苷酸序列拟南芥编码PIN生长素转运蛋白的基因,AtPIN1[基因库:AEE35479.1],AtPIN2[基因库:AED96845.1],AtPIN3[基因库:AEE35140.1],AtPIN4[GenBank: AEC05448.1]和AtPIN7[GenBank: AEE30332.1]来自NCBI的GenBank数据库(http://www.ncbi.nlm.nih.gov).这些序列被用作BLAT(类爆炸对齐工具)搜索中的查询VitisviniferaGENOSCOPE基因组数据库12版基因预测(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/)鉴定葡萄PIN生长素转运蛋白的编码基因。发现了5个葡萄基因模型,命名为VvPINs基于每个推导出的氨基酸序列的蛋白质结构域,用Pfam (http://pfam.xfam.org/).三个VvPINs被确定为AtPIN1序列被用作查询,因此它们被命名为VvPIN1(GSVIVT00017824001),VvPIN1a(GSVIVT00023254001)和VvPIN1b(GSVIVT00023255001)。一个VvPIN被发现是在AtPIN3,AtPIN4而且AtPIN7序列被用作查询,因此被命名为VvPIN4(GSVIVT00030482001)和一个VvPIN是在什么时候发现的AtPIN2序列作为查询,因此被命名VvPIN2(GSVIVT00031315001)。
系统发育分析
利用ClustalW对拟南芥PIN蛋白(AtPIN)和葡萄PIN蛋白(VvPIN)的氨基酸序列进行比对[75].利用该比对在MEGA 5.05软件中构建系统发育树[76],采用带自举分析的Neighbor-Joining方法(1000重复)。
RNA提取和cDNA合成
RNA从一个由7到10个浆果组成的池中提取,这些浆果来自同一簇(0.5 g冷冻组织),使用由oupinet al.(2007)改进的ctab -亚精胺方法[77].接下来,按照制造商的说明,用TURBO DNA-free™DNase (Ambion®)处理RNA。RNA浓度和质量使用NanoDrop®ND-1000分光光度计(Thermo Scientific™)进行评估。所有样本A260/A280比值值在1.8 ~ 2.0之间,A260/A230比值值为> 2.0。对于cDNA合成,根据制造商的说明,使用SuperScript™II逆转录酶(Invitrogen)逆转录RNA。简单地说,1.5 μg无dna RNA与50 ng随机六聚物引物和1 μl 10 mMdNTP混合物混合,最终体积为12 μl。样品在65°C下孵育5分钟,然后立即转移到冰中。接着加入5X First-strand buffer (Invitrogen) 4 μl和0.1 M DTT (Invitrogen) 2 μl, 25℃孵育2 min。最后加入SuperScript™II 1 μl, 25℃孵育10 min, 42℃孵育50 min, 70℃孵育15 min。
聚合酶链反应
最终体积为20 μl,使用Taq DNA聚合酶(Invitrogen)进行PCR反应。缓冲液和底漆浓度(每个底漆10 μM)由供应商推荐。按照制造商的说明,在以下条件下进行PCR: 94℃孵育3 min, 94℃孵育30 s, 57℃孵育30 s, 72℃孵育30 s, 35个循环。在最后的延伸步骤中,样品在72°C下孵育10分钟。
中存在
根据制造商的说明,定量实时PCR在MX3000P检测系统(Stratagene)中进行,使用SensiMix™Plus SYBR商业试剂盒(quantiace)。
引物适用于100-180 bp的扩增VvPIN1,VvPIN1a,VvPIN1b,VvPIN2而且VvPIN4基因设计使用引物blast工具,可在NCBI网页(http://www.ncbi.nlm.nih.gov/tools/primer-blast/).引物在附加文件中列出6:表S3。为确定扩增子大小和引物特异性,进行常规PCR反应,PCR产物在1.5% (w/v)琼脂糖凝胶中运行。PCR产物从凝胶中分离,用Qiaex II (Qiagen)进行纯化并测序。引物效率由标准曲线确定。所有引物效率均在95% ~ 100%之间。
为了估计相对转录丰度值,用感兴趣基因的表达(GOI)和管家基因表达的几何平均值,VvGPDH(VvGLYCERALDEHYDE-3-PHOSPHATE脱氢酶, GenBank加入:XM_002263109)[78),而VvUBI1(VvUbiquitin1,TC53702,TIGR数据库VvGi5)[79],根据式生成。4:
其中E为引物放大效率值。VvGPDH而且VvUBI1具有相似的Ct值,并且在整个发育过程中和治疗之间的转录水平稳定。qRT-PCR方法按先前报道进行[77],在以下条件下:94℃变性2 min, 94℃变性30 s, 58℃变性30 s, 72℃变性30 s,循环40次。
Immunolocalization
羊抗atpin4多克隆抗体是从羊血清中提取的(http://arabidopsis.info/CollectionInfo?id=114).一抗稀释1:60。AtPIN4目标序列与葡萄同源序列的同源性为44%。以绵羊抗人肌动蛋白c末端抗体(ABCAM)为对照。采用驴抗羊IgG H&L DyLight®488 (ABCAM)作为二抗。二抗稀释1:300。使用FM™4-64FX (Invitrogen)作为膜染色剂。
为了进行免疫定位试验,将果实固定在5%冰醋酸,3.7%甲醛和50%乙醇中,并在4°C的黑暗中保存。固定样品通过增加乙醇系列进行完全组织脱水。在HM 325旋转切片机(Thermo Scientific™)中连续切割6-8 μm厚度的纵向切片,并粘附在玻片上。切片在1% (w/v)牛血清白蛋白(BSA)的磷酸盐缓冲盐水(PBS)中封闭1小时,然后与一抗或前免疫血清在1% PBS中在4°C孵育过夜。切片在PBS中清洗三次,每次清洗5分钟。二抗在黑暗的1% PBS中接种1小时。然后,切片在PBS中清洗三次,每次清洗5分钟。在图像拍摄前立即使用FM™4-64FX (5 μg/ mL)。
共焦图像使用尼康Eclipse Ti C2Si显微镜(尼康仪器公司)获得。使用DPSS 488 nm激光激发DyLight®488荧光,并在波长525和549 nm之间检测到发射。使用DPSS 561 nm激光激发FM™4-64FX,并在波长605到1000 nm之间检测发射。图像处理采用尼康徕卡NIS-Elements软件。
质/ MS分析
液相色谱-串联质谱(LC-MS/MS)分析,50毫克冻干组织在3ml提取溶剂(甲醇:甲酸:水,15:1:4)中提取。接着,加入各含20ng的内标液100 μL。提取方法在Gouthu等中有描述。80].在每个发育阶段,从三株植物中收集三份样品。
吲哚-3-乙酸(IAA), IAA-天冬氨酸(IAA- asp), IAA-丙氨酸(IAA- ala), IAA-谷氨酸(IAA- glu), IAA-色氨酸(IAA- trp),赤霉素A1 (GA1),赤霉素A3 (GA3.)和内部标准(2H5iaa (d-iaa), (2H5) IAA - (15N)天冬氨酸(DN-IAA-Asp), (2H5) IAA - (15N)谷氨酸(DN-IAA-Glu), (2H5) IAA - (15N)色氨酸(DN-IAA-Trp), (2H2)遗传算法1(D-GA1)及(2H2)遗传算法3.(D-GA3.)从OlChemIm Ltd购买。吲哚-3-丙酮酸(IPyA)和吲哚-3-乙酰胺(IAM)标准品采购自Sigma-Aldrich。oxindol3 -乙酸(oxaa)、oxia - asp和oxia - glu标准及内部标准(2H2) oxaa (d - oxaa)和(2H2) oxia - glu (d - oxia - glu)由HisashiMiyagawa博士(日本京都大学农业研究生院应用生命科学部)提供。IAA、IPyA和IAM采用D-IAA作为内部标准。以DN-IAA-Asp为内标,分别测定IAA-Asp和IAA-Ala。以D-oxIAA作为oxaa和oxia - asp的内标。
激素定量是在俄勒冈州立大学的OSU EHSC质谱设备中完成的,科瓦利斯,或97331,美国。分析是在配备Turbo V源(Applied Biosystems)的混合三重四极杆/线性离子阱4000 QTRAP LC-MS/MS仪器上进行的,分析方法是在多反应监测模式(MRM)下的液相色谱(LC)-串联质谱法,并与标准曲线进行比较。转换在附加文件中报告7:表S4。
统计分析
进行了Tukey的媒体比较分析。对于所有的分析,统计显著性评估使用p值< 0.05。
缩写
- 阿兹:
-
离层区
- BSA:
-
牛血清白蛋白
- DAA:
-
开花后几天
- DAF):
-
开花后几天
- DPM:
-
每分钟分解数
- DPT:
-
治疗后天数
- DW:
-
干重
- 遗传算法:
-
赤霉素
- 遗传算法1:
-
赤霉素A1
- 遗传算法3.:
-
赤霉素A3
- 国际宇航科学院:
-
Indole-3-acetic酸
- IAA-Ala:
-
IAA-Alanine
- IAA-Asp:
-
IAA-Aspartate
- IAA-Glu:
-
IAA-Glutamate
- IAA-Trp:
-
IAA-Tryptophan
- 我:
-
Indole-3-acetamide
- IPyA:
-
Indole-3-pyruvic酸
- 质/女士:
-
液相色谱-串联质谱法
- MRM:
-
多反应监控模式
- NPA:
-
N-1-naphthylphtalamic酸
- OxIAA:
-
Oxindole-3-acetic酸
- OxIAA-Asp:
-
Oxindole-3-acetic acid-Aspartate
- OxIAA-Glu:
-
Oxindole-3-acetic acid-Glutamate
- PAC:
-
摘要
- PBS:
-
磷酸盐
- 销:
-
PIN-FORMED
- RT-qPCR:
-
实时定量PCR
- SE:
-
标准错误
- VvGPDH:
-
VvGLYCERALDEHYDE-3-PHOSPHATE脱氢酶
- VvUBI1:
-
VvUbiquitin1
参考文献
Stewart JL, Nemhauser JL。树长在钱上吗?生长素是细胞经济的货币。中国生物医学工程学报。2010;2:a001420。
同行佤邦。从感知到衰减:生长素信号和反应。植物学报,2013;16:561-8。
探讨生长素生物合成和代谢的细胞和分子分辨率。中国生物医学工程学报。2010;2:a001594。
Normanly J, Slovin JP, Cohen JD。生长素的合成与代谢。进:Davies PJ,编辑。植物激素:生物合成,信号转导,作用。多德雷赫特:Kluwer学术出版社;2004.36 - 62页。
李志强,李志强,李志强,等。拟南芥营养生长过程中生长素合成的稳态调控。植物学报2001;28:465-74。
Phillips KA, Skirpan AL, Liu X, Christensen A, Slewinski TL, Hudson C, Barazesh S, Cohen JD, Malcomber S, McSteen P。tassel2消失编码玉米营养和生殖发育所需的草特异性色氨酸转氨酶。植物细胞,2011;23:50 50 - 66。
Stepanova AN, Yun J, Robles LM, Novak O, He W,郭宏,Ljung K, Alonso JM。拟南芥YUCCA1黄酮单加氧酶在生长素生物合成的吲哚-3-丙酮酸分支中起作用。植物学报。2011;23:3961-73。
袁超,沈霞,马什口K,郑珍,戴霞,程燕,Kasahara H, Kamiya Y, Chory J,赵艳。拟南芥和丝兰色氨酸转氨酶转化吲哚-3-乙酸的研究。自然科学进展(英文版);2011;
Sugawara S, Hishiyama S, Jikumaru Y, Hanada A, Nishimura T, Koshiba T, Zhao Y, Kamiya Y, Kasahara H.拟南芥吲哚-3-乙醛氧辛依赖生长素生物合成的生化分析。自然科学进展(英文版);2009;
Staswick PE, Serban B, Rowe M, Tiryaki I, Maldonado MT, Maldonado MC, Suza W.将氨基酸偶联到吲哚-3-乙酸的拟南芥酶家族的特征。植物学报。2005;17:616-27。
杨晓明,李志强,李志强,等。拟南芥植物生长素缀合物的研究进展。吲哚-3-乙酰天冬氨酸、吲哚-3-乙酰谷氨酸和吲哚-3-乙酰葡萄糖的低稳态水平。植物学报。2000;123:589-95。
杨晓明,王晓明,王晓明,等。拟南芥吲哚-3-乙酸代谢产物的定量分析。植物物理学报,2001;127:1845-53。
Staswick体育。茉莉酸和吲哚-3-乙酸的色氨酸缀合物是内源性生长素抑制剂。植物科学学报。2009;30(2):344 - 344。
田凯,堀田J,若浅K,宫川H.吲哚-3-乙酸的三种氧化代谢产物拟南芥.植物化学,2007;68:1651 - 63。
王晓明,王晓明,王晓明,等。拟南芥吲哚-3-乙酸代谢的研究进展。植物科学学报,1998;18(2):366 - 366。
Zažímalová E, Murphy AS, Yang H, Hoyerová K, hoekp .生长素转运体-为什么这么多?中国生物医学工程学报。2010;2:a001552。
frml J, wisniewskka J, Benkova E, Mendgen K, Palme K.拟南芥生长素外排调节因子PIN3的横向定位介导向性。大自然。2002;415:806-9。
Friml J, Vieten A, Sauer M, Weijers D, Schwarz H, Hamann T, Offringa R, Jurgens G.拟南芥生长素梯度的建立大自然。2003;426:147-53。
张文杰,李文杰,张文杰,等。PIN蛋白在细胞生长素外排中起限速作用。科学。2006;312:914 - 91。
wisniewskka J, Xu J, Seifertova D, Brewer PB, Ruzicka K, Blilou I, Rouquie D, Benkova E, Scheres B, Friml J.极性PIN定位指导植物生长素流动。科学。2006;312:883。
杨华,李文杰。拟南芥ABCB、AUX 1和PIN生长素转运体的功能表达及鉴定Schizosaccharomycespombe.植物J. 2009; 59:179-91。
维维安-史密斯A,科尔图诺AM。拟南芥生长调节剂诱导孤雌果的遗传分析。植物科学进展。1999;21(2):337 - 344。
Serrani JC, Ruiz‐Rivero, Fos M, García‐Martínez JL。番茄生长素诱导的结果部分是由赤霉素介导的。植物J. 2008; 56:922-34。
杜琛,李志强,等。用基因组学方法研究苹果生长素的作用(家棠)水果大小控制。BMC植物生物学。2012;12:7。
Serrani JC, Carrera E, Ruiz-Rivero O, Gallego-Giraldo L, Peres LEP, García-Martínez JL。抑制从子房或从根尖芽的生长素运输可诱导赤霉素介导的番茄孤雌坐果。植物学报。2010;153:851-62。
莫奈F, Moing A, Kowalczyk M,等。单一生长素外排转运蛋白的下调可诱导番茄早熟。中国科学(d辑),2012;
Iannetta PPM, Wyman M, Neelam A, Jones C, Taylor MA, Davies HV, Sexton R.乙烯和内do-β-1,4-葡聚糖酶在红覆盆子脱落中的作用(Rubusidaeus)核果。植物生理学,2000;110:535-43。
王晓明,王晓明,王晓明。桃树果实脱落过程中乙烯的生物合成。植物细胞环境,1998;21:731-7。
幼果的脱落和变薄及其受植物激素和生物调节剂的调节。植物生长规律,2000;31:43-59。
Else MA, Stankiewicz-Davies AP, Crisp CM, Atkinson CJ。极性生长素通过花梗运输的作用PrunusaviumL.与果实发育和保存有关。中国机械工程学报,2004;26(2):344 - 344。
白兰莎,马丽霞,李丽娟,李丽娟。生长素极性转运对甜樱桃果实脱落的调控。植物生长学报。2005;45:19 9 - 98。
Nishio S, Moriguchi R, Ikeda H, Takahashi H, Takahashi H, Fujii N, Guilfoyle TJ, Kanahama K, Kanayama Y.生长素外排载体家族在番茄果实发育中的表达分析。足底。2010;232:755 - 64。
Paciorek T, Zažímalová E, Ruthardt N, Petrášek J, Stierhof YD, Kleine-Vehn J, Morris DA, Emans N, Jürgens G, Geldner N,等。生长素抑制细胞内吞作用,并促进细胞自身的外排。大自然。2005;435:1251-6。
黄建平,韩俊梅,安国强。生长素通过塑形肌动蛋白丝促进自身转运。植物科学进展。2009;
Heisler MG, Ohno C, Das P, Sieber P, Reddy GV, Long JA, Meyerowitz EM.拟南芥花序分生组织发育过程中生长素转运和基因表达模式的研究。《生物学报》2005;15:1899-911。
Peer WA, Bandyopadhyay A, Blakeslee JJ, Makam SN,陈rj, Masson PH, Murphy AS。生长素转运改变的类黄酮突变体中生长素外排促进蛋白PIN家族的表达变化和蛋白定位拟南芥.《植物科学》2004;16:1898-911。
Vieten A, Vanneste S, wisniewskka J, Benková E, Benjamins R, Beeckman T, Luschnig C, Friml J. PIN蛋白功能冗余与生长素依赖的PIN表达交叉调控。发展。2005;132:4521-31。
Björklund S, Antti H, Uddestrand I, Moritz T, Sundberg B.赤霉素与生长素在发育中的交叉对话杨树木材:赤霉素刺激生长素的极性运输,与生长素具有共同的转录组。植物J. 2007; 52:499-511。
Willige BC, Isono E, Richter R, Zourelidou M, Schwechheimer C.赤霉素调节PIN-FORMED丰度,并在植物生长素运输依赖的生长发育中必需拟南芥.植物学报。2011;23:2184-95。
Giacomelli L, Rota-Stabelli O, Masuero D, Acheampong AK, Moretto M, Caputi L, Moser C.赤霉素代谢Vitisvinifera葡萄赤霉素氧化酶在开花和结实期的功能特征和进化。中国科学(d辑),2013;
Mariotti L, Picciarelli P, Lombardi L, Ceccarelli N.番茄坐果和早期果实生长与吲哚乙酸、细胞分裂素和生物活性赤霉素含量增加有关。中国植物学报。2011;30:405-15。
栽培葡萄生殖解剖学研究进展。艾诺·维提克,1971;22:92-109。
Coombe BG, Hale C.成熟葡萄浆果激素含量及生长物质处理的影响。植物物理学报。1973;51:629-34。
狭谷BG。肉质果实的发育植物物理年鉴1976;27:507-28。
Ojeda H, Deloire A, Carbonneau A, Ageorges A, Romieu C.葡萄果实发育:果实生长与其DNA含量之间的关系表明细胞增殖和增大。葡萄。1999;38:145-50。
尔尔尔liolo DS, Lakso AN。果实脱落与果实生长有关。Vitislabruscana“协和和”Vitisvinifera“雷司令。葡萄。2009;48:53-4。
柄C,贝西R.葡萄果实的脱落与乙烯生物合成。葡萄。2003;42:1-4。
稻叶A,石田M, Sobajima Y.与特拉华葡萄成熟相关的浆果发育过程中内源激素浓度的变化。日本园艺学报,1976;45:245-52。
Böttcher C, Keyzers RA, Boss P, Davies C.吲哚-3-乙酸-酰胺合成酶GH3-1对葡萄果实生长素的分离(VitisviniferaL.)和生长素偶联在成熟过程中的作用。中国科学(d辑),2010;
Symons GM, Davies C, Shavrukov Y, Dry IB, Reid JB, Thomas先生。油菜素内酯参与葡萄果实的成熟。植物学报。2006;140:150-8。
Pérez FJ, Viani C, Retamales J.有籽和无籽葡萄中的生物活性赤霉素:浆果发育过程中的鉴定和含量变化。艾诺·维提克。2000;51:315-8。
张晓荣,罗广根,王荣荣,王杰,Himelrick DG。有籽和无籽葡萄浆果对芽束的生长发育响应。中国农业科学,2003;28(3):326 - 326。
刘旭,柯恒,郭志强。低通量红光促进植物生长素的转运和生物合成。植物科学进展。2011;
辛克尔,卡达奇亚,琼斯。暗红光诱导黄瓜幼苗极性生长素转运的增加:I.能力、速度和对抑制剂的响应改变的发展。植物科学,1998;
张j, nodzyzynski T, Pěnčík A, Rolčík J, Friml J. PIN磷酸化能够调节PIN极性和直接生长素转运。自然科学进展(英文版),2010;
王丽娟,王丽娟,王丽娟,等。吲哚乙酸诱导基因中生长素响应元件的鉴定,PS-IAA4/5,指豌豆(Pisumsativum).中华分子生物学杂志,1993;33(3):366 - 366。
小川M,花田A,山内Y,库原A,神谷Y,山口S.拟南芥种子萌发过程中赤霉素的生物合成及其响应。《植物科学》2003;
杨晓明,王晓明,王晓明,等。水稻种子中赤霉素上调蛋白酶表达的两种顺式作用元件。植物J. 2003; 34:636-45。
刘志斌,刘志强,刘志强。生长素反应元件的复合结构。植物学报,1995;7:1611-23。
M friigerio, Alabadí D, Pérez-Gómez J, Garcia-Cárcel L, philillils AJ, heden P. BlázquezMAx。拟南芥生长素信号通路对赤霉素代谢基因的转录调控。植物物理学报。1995;42:553 - 63。
奥尼尔DP,罗斯JJ。生长素对豌豆赤霉素途径的调控。植物科学学报,2002;30(4):344 - 344。
黄志刚,张志刚,张志刚。赤霉素3β-羟化酶基因在豌豆果实和种子中表达的调控。植物科学学报,2003;
Wolbang CM, Ross JJ。生长素促进断头烟草植株赤霉素的生物合成。足底。2001;214:153-7。
王志强,李志强,等。PIN和PGP生长素转运机制的相互作用。生物化学学报,2007;35:137-41。
植物进化:AGC激酶讲述生长素的故事。植物科学进展,2007;12:541-7。
王晓明,王晓明,王晓明,等。拟南芥MDR/PGP转运体AtPGP1催化生长素的细胞外排植物学报,2005;
Bennett MJ, Marchant A, Green HG, May ST, Ward SP, Millner PA, Walker AR, Schulz B, Feldmann KA。拟南芥AUX1基因:根向地性的量程调节因子。科学。1996;273:948-50。
李志强,李志强,等。拟南芥生长素渗透酶AUX1的结构功能分析。《植物科学》2004;16:3069-83。
Swarup K, Benková E, Swarup R,等。生长素流入载体LAX3促进侧根萌发。细胞生物学杂志,2008;10:946-54。
德拉泽塔L,朗A,卡佩里尼C,霍尔AJ,沃尔兹RK,詹姆森PE。苹果花梗血管分化及生长素转运抑制作用。植物生理学,2004;120:162-70。
Mauriat M, Petterle A, Bellini C, Moritz T.赤霉素通过影响生长素转运抑制杂交白杨和拟南芥的不定根。植物学报(英文版);
Dokoozlian NK, Peacock WL。赤霉素酸在开花时施用可减少坐果,提高“深红色无籽”鲜食葡萄的大小。科学通报2001;36:706-9。
Reynolds AG, de Savigny C.剥皮和赤霉酸对“君主加冕”鲜食葡萄产量组成、果实组成和残留种子形成的影响。科学通报2004;39:541-4。
Weaver RJ, Pool RM。葡萄串的化学减薄(VitisviniferaL).葡萄。1971;10:201-9。
马晓燕,李志强,李志强,等。ClustalW和ClustalX 2.0版。生物信息学。2007;23:2947-8。
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:利用最大似然,进化距离和最大简约方法进行分子进化遗传学分析。中国生物医学杂志,2011;28:2731-9。
Poupin MJ, Federici F, Medina C, Matus JT, Timmermann T, Arce-Johnson P. b级mds -box三个葡萄子系的分离TM6,PISTILLATA而且APETALA3花和果实发育过程中差异表达的基因。基因。2007;404:10-24。
Vega A, Gutiérrez RA, Peña-Neira A, Cramer GR, Arce-Johnson P.兼容glv -3病毒感染影响浆果成熟减少糖积累和花青素生物合成Vitisvinifera.植物分子生物学杂志,2011;
王晓明,王晓明,王晓明,等。设拉子和霞多丽葡萄果实黄酮醇合成及黄酮醇合成酶基因的表达(Vitisviniferal .)。澳大利亚J葡萄酒res 2003; 9:110-21。
郭修,莫雷J,麦尔CS,德鲁克LG。采用液相色谱法和多反应监测质谱法定量分析葡萄莓中3个植物激素家族。入:Gang DR,编辑。植物化学物质,植物生长与环境。2013。19-36页。
确认
这项工作得到了Millennium nucleus of Pant Systems and Synthetic Biology的NC130030和FONDECYT 1150220的支持。Nathalie Kühn由CONICYT博士奖学金和Alejandra Serrano由FONDECYT博士后研究3150608 (AS)支持。
资金
本研究由植物系统与合成生物学千年核NC130030、FONDECYT 1150220和FONDECYT博士后研究3150608 (AS)资助。
数据和材料的可用性
所有支持研究结果的数据都包含在手稿中。
作者'contributions
数据采集、分析和解释由NK、AS、CA和AA进行。NK由PAJ, LD和SG监督。AS由PAJ监督。论文写作和关键编辑由NK, AS, CE, SG, LD和PAJ负责。所有作者都已阅读并批准了最终版本的手稿。
相互竞争的利益
作者宣称他们之间没有利益冲突。
发表同意书
不适用。
伦理批准并同意参与
所有作者均已批准并同意本稿件。所有程序均按照智利CONICYT公司的生物安全手册进行。
作者信息
从属关系
相应的作者
附加文件
附加文件1:图S2。
葡萄果实中乙烯的演化。(pptx173kb)
附加文件2:
补充方法。(docx89 kb)
附加文件3:图S1。
假定生长素和GA顺式调节剂存在于VvPINs启动子。(pptx147 kb)
附加文件4:表S1。
本研究使用的RT-qPCR引物。(docx60kb)
附加文件5:表S2。
在14 DAF下NPA(+)和NPA(-)处理下估计果实脱落的每丛浆果数。(docx55kb)
附加文件6:表S3。
在7、10、14和17 DAF时估计小果脱落的每簇浆果数。(docx71 kb)
附加文件7:表S4。
LC-MS/MS分析的MRM转换。(docx66 kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
Kühn, N,塞拉诺,A,阿贝洛,C。et al。葡萄果实生长素极性转运的调控(葡萄L.)和生长素稳态在果实脱落过程中的作用。BMC植物生物学16日,234(2016)。https://doi.org/10.1186/s12870-016-0914-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-016-0914-1
关键字
- 生长素内稳态
- 小果实离层
- 小道消息
- 国际宇航科学院
- PIN输出促进器
- 生长素极性转运