- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
黄酮类化合物和黑暗可以降低衰老过程中的PCDgydF4y2Ba葡萄gydF4y2Ba悬浮细胞培养gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba16gydF4y2Ba、物品编号:gydF4y2Ba233gydF4y2Ba(gydF4y2Ba2016gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
衰老是植物生命周期中发生的一个关键发育过程,也可由环境条件(如饥饿和/或黑暗)诱导。在衰老过程中,严格控制基因调节有序降解和拆除事件,其中最显著的是遗传程序性细胞死亡(PCD),在大多数情况下,在光照下上调类黄酮生物合成。gydF4y2Ba
黄酮类化合物是次生代谢物,在植物的发育、繁殖和防御中起着多种重要作用,部分原因是其众所周知的抗氧化特性,也可能影响相同的细胞死亡机制。为了进一步了解内源性黄酮类化合物的作用及其与不同环境(光或暗)条件的相互作用,利用衰老葡萄愈伤组织的两部分(红色和绿色)进行悬浮细胞培养。红色悬浮细胞培养(RSC)和绿色悬浮细胞培养(GSC)最终在黑暗或光照条件下生长6天。gydF4y2Ba
结果gydF4y2Ba
与光照条件下生长的细胞相比,黑暗促进了悬浮细胞的死亡(主要是坏死)。此外,黄酮类化合物含量高的RSC比GSC表现出更高的活力,并且对PCD的保护更强,这与黄酮类化合物含量高有关,黄酮类化合物可能会抑制ROS,从而限制相对的信号级联反应。相反,PCD主要发生在GSC中,并在光照下进一步增加,正如细胞色素所显示的那样gydF4y2BacgydF4y2Ba释放和TUNEL试验。gydF4y2Ba
结论gydF4y2Ba
内源性黄酮类化合物被证明是开发有效的抗氧化应激和PCD诱导的良好候选者。光似乎是诱导PCD的一个重要环境因素,特别是在缺乏黄酮类化合物的GSC中,它不能防止氧化损伤和导致衰老的信号。gydF4y2Ba
背景gydF4y2Ba
植物衰老是一个涉及多种信号通路的多因子过程,需要核基因的积极调控。冗余过程的存在赋予弹性,当主要过程未能完成时,通过激活替代途径来确保弹性。此外,平行通路的同时存在允许调节和加强衰老诱导。三种主要的衰老诱导因子已被确认,如碳饥饿、黑暗和发育过程[gydF4y2Ba1gydF4y2Ba]。饥饿和黑暗基本上是由细胞糖消耗组成的,而发育是一个由基因激活更精细地调节的过程。如果在离体叶片上施用暗处理,将不被认为是模拟自然过程的最合适的实验模型。因此,其他胁迫现象,如单个叶片上的水分胁迫,与导致细胞死亡的级联事件重叠[gydF4y2Ba2gydF4y2Ba]。在葡萄细胞培养的情况下,有可能研究黑暗的影响,避免上述其他应激现象的重叠。gydF4y2Ba
植物叶片衰老过程中有数百个基因表达gydF4y2Ba拟南芥gydF4y2Ba,其中一些与类黄酮生物合成有关[gydF4y2Ba3.gydF4y2Ba]。另一方面,与类黄酮合成有关的那些可能受到不同的调节,这取决于衰老的类型,因为在细胞培养中,发育和饥饿诱导的衰老与黑暗诱导的衰老不同[gydF4y2Ba1gydF4y2Ba]。gydF4y2Ba
根据该方案,植物衰老的激素激发是特异性的。发育性衰老暗示乙烯、茉莉酸甲酯和水杨酸甲酯的参与,而后者与黑暗和饥饿诱导的衰老无关[gydF4y2Ba1gydF4y2Ba]。特别是,通过调节基因,激素起着至关重要的作用,类似于在程序性细胞死亡(PCD)中发现的情况[gydF4y2Ba4gydF4y2Ba]。在这种情况下,已经描述了许多信号分子的参与和一个大的相互作用网络。gydF4y2Ba
在gydF4y2Ba拟南芥gydF4y2Ba悬浮细胞培养、热诱导细胞死亡和衰老有许多PCD的相似特征[gydF4y2Ba5gydF4y2Ba],其参与的过程已经被描述为超敏反应(HR)、缺氧条件下的通气组织分化和木质部分化[gydF4y2Ba6gydF4y2Ba]。PCD表现出特殊的特征(即DNA阶梯和液泡破碎),这些特征也出现在衰老的晚期[gydF4y2Ba1gydF4y2Ba]。gydF4y2Ba
黄酮类化合物是植物中广泛存在的次生代谢产物。最丰富的种类是黄烷-3-醇、花青素和黄酮醇,而最常见的酚类非类黄酮抗氧化剂包括羟基肉桂酸[gydF4y2Ba7gydF4y2Ba]。它们的成分和质量取决于植物的生长条件、地理位置和品种。gydF4y2Ba
花青素和无色黄酮类化合物主要分布在不同的亚细胞区室中,如液泡和细胞壁,与动物相比,它们的浓度更高。因此,验证它们的作用是否可能促进细胞凋亡是很有趣的,因为它通常发生在动物细胞中[gydF4y2Ba8gydF4y2Ba],或抗细胞凋亡。色素细胞中的花青素积累可以防止发育或氧化应激介导的pcd样死亡,如在蕾丝植物(gydF4y2BaAponogeton madagascariensisgydF4y2Ba),gydF4y2Ba拟南芥gydF4y2Ba细胞系分别[gydF4y2Ba9gydF4y2Ba- - - - - -gydF4y2Ba11gydF4y2Ba]。与非色素细胞相比,有色素的细胞更容易受到类黄酮的保护,以抵抗氧化应激[gydF4y2Ba12gydF4y2Ba]。这表明这些代谢物具有抗凋亡作用,与活性氧(ROS)的产生和繁殖减少有关。因此,植物中黄酮类化合物的抗凋亡机制一般可以解释为抗氧化活性。这种效应也可以解释在花青素丰富的番茄品种中报道的成熟和衰老的延迟[gydF4y2Ba13gydF4y2Ba]。gydF4y2Ba
花青素和无色类黄酮在人体健康中也发挥着关键作用,它们可以作为抗氧化剂,预防一些与活性氧有关的疾病,如癌症[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba],或在癌细胞系中作为抑制肿瘤的天然分子[gydF4y2Ba16gydF4y2Ba- - - - - -gydF4y2Ba19gydF4y2Ba]。gydF4y2Ba
小道消息(gydF4y2Ba葡萄gydF4y2BaL.)是一种广泛种植的富含多酚(主要是类黄酮和二苯乙烯)的植物,它们存在于大多数组织中。它们是在植物周期中合成和积累的,在应对生物和非生物胁迫中起着多种作用。葡萄藤类黄酮,包括花青素,是强大的抗氧化剂,保护叶子和浆果免受紫外线光氧化损伤,但也可以作为种子分散剂或传粉者的招募者。gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba]。在葡萄细胞培养中,纤维素酶处理引起hr样反应,引起局部细胞死亡、褐变和诱导酚代谢[gydF4y2Ba22gydF4y2Ba]。据此,Repka及其合作者表明,由葡萄中的茉莉酸甲酯引发的HR诱导了与防御、PCD和苯丙类生物合成相关的基因的激活[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba]。然而,在所有这些关于植物诱导子或凋亡激活子诱导PCD的研究中,很难区分细胞内黄酮类化合物的积累是HR的后果之一,还是通过诱导促凋亡作用导致细胞死亡的主要原因。gydF4y2Ba
在本工作中,通过将其生长延长到其增殖速率平台之外,获得了在光照下生长的饥饿葡萄固体细胞培养物。这种生长条件在细胞聚集体的外层诱导了色素类黄酮的产生,而内层,接近培养基的营养物质,免受过量光照,保持绿色,不着色。从这种不同的材料中获得红色和绿色细胞,并在不同的光照条件下(光与暗)分别在液体培养基中传代培养。这些悬浮细胞培养为研究内源性黄酮类化合物在衰老和PCD中的作用提供了一个简单的模型系统,避免了黄酮类化合物生物合成诱导和衰老调节之间的多因素相互作用(即渗透胁迫、激素浓度、营养利用率、ROS或氧化应激源)。因此,本文重点研究了暗、光条件对葡萄衰老悬浮细胞培养的主要影响。此外,还考虑了内源性黄酮类化合物在衰老和/或PCD中的作用。gydF4y2Ba
方法gydF4y2Ba
固体培养基上的植物材料和细胞培养物gydF4y2Ba
葡萄长期愈伤组织培养(gydF4y2Ba葡萄gydF4y2BaL,简历。Limberger),由斯洛伐克布拉迪斯拉发葡萄栽培和酿酒研究所V. Repka提供。然后,根据Repka等人的说法,将愈伤组织置于固体培养基上,在光照下维持。[qh]gydF4y2Ba25gydF4y2Ba],稍加修改。它们的维持是通过每14天进行几个周期的继代培养来获得的。在悬浮细胞培养实验中,这一周期延长至23天,比通常的生长周期延长了1周。在这个阶段,细胞已经达到了一个固定的生长阶段,经历了营养匮乏,因此触发了导致衰老的途径。选择23日龄的色素红细胞,定位于外细胞层,作为获得红色悬浮细胞培养(RSC)的起始接种物。同样,选择下层的浅绿色细胞获得绿色悬浮细胞培养(GSC)。RSC和GSC分别于继代后3天和6天在黑暗或光照条件下进行实验。gydF4y2Ba
在第0天,还分析了GSC和RSC的可溶性己糖(分别为葡萄糖和果糖)含量和总蛋白质浓度,作为衰老计划的一般标志[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba]。3个独立愈伤组织取等量的100±20 mg FW,在液氮条件下磨成冷冻粉末。用于蛋白质分析,将粉末重悬于0.5 ml 50 mM Tris-HCl (pH 7.5)中,用Bradford法测定蛋白质[gydF4y2Ba28gydF4y2Ba]并以mg g表示gydF4y2Ba−1gydF4y2Ba弗兰克-威廉姆斯。gydF4y2Ba
糖分析时,将粉末悬浮于1 ml 50 mM Tris-HCl, 0.05% Triton X-100中,100℃煮沸5分钟,用Mikro 120 hetich离心机离心。上清液用于葡萄糖和果糖的标准酶法测定,用珀金-埃尔默荧光仪分别在329和460 nm波长下进行激发和发射[gydF4y2Ba29gydF4y2Ba]。己糖含量以μmol g表示gydF4y2Ba−1gydF4y2Ba弗兰克-威廉姆斯。gydF4y2Ba
悬浮细胞培养gydF4y2Ba
在所有实验中,将4 g(鲜重,FW)的GSC或RSC分别转移到含有250 cm的120 ml新鲜液体培养基中gydF4y2Ba3.gydF4y2Ba锥形烧瓶。烧瓶在INNOVA 2300平台激振器中保持,转速为110 rpm,温度为27±1°C。最后,GSC和RSC分别在光照(12 h光照期)和黑暗条件下生长6 d。gydF4y2Ba
生长速率的测定gydF4y2Ba
为了估计在固体培养基上培养的细胞的生长速度,将3g FW的愈伤组织片初步转移到新鲜的固体培养基上。在愈伤组织增殖3、6、9、12、15、18、21和23 d后取伤组织重称。gydF4y2Ba
黄酮的提取gydF4y2Ba
葡萄藤GSC和RSC在光照条件下生长,在第0天和第6天收获,在液氮中冷冻并磨成细粉末。然后,0.5 g (FW)冷冻粉末与1 ml 15% (gydF4y2Bav / vgydF4y2Ba) HCl在甲醇中提取黄酮。然后将酒精提取物(悬浮液)在12,000下离心10分钟gydF4y2BaggydF4y2Ba在Mikro - 120赫提希离心机中回收上清液,在N下干燥gydF4y2Ba2gydF4y2Ba在200 μl流动相(85%甲醇和15%蒸馏水)中流动并最终溶解。gydF4y2Ba
黄酮类化合物的反相高效液相色谱分析gydF4y2Ba
以0.5% (gydF4y2Bav / vgydF4y2Ba)醋酸,pH为2.5(洗脱液A)和甲醇(洗脱液B),流速为0.5 ml mingydF4y2Ba−1gydF4y2Ba。RP-HPLC采用Zorbax Eclipse超密键合- c18色谱柱(5 μm, 4.6 × 150 mm, Agilent 1200系列仪器),配备二元泵送系统,连接DAD。二元梯度条件为:27 - 44.5% B (32 min),然后是44.5 - 67.5% B (13 min), 67.5 - 100% B (2 min),等径100% B (3 min)。花青素在520 nm处监测,并通过与商业标准malvidin 3-O-glucoside (Extrasynthese, Lyon France)的色谱谱比较进行鉴定。gydF4y2Ba
酒精提取物的质谱分析gydF4y2Ba
为了鉴定HPLC分析中显示的主要多酚类化合物,将GSC和RSC在光照下生长6天,得到上述酒精提取物,然后用质谱法进行表征。多级质谱分析(MSgydF4y2BangydF4y2Ba)实验和液相色谱-电喷雾电离-质谱(LC-ESI-MS)分析通过在负离子模式下工作的Finnigan LXQ线性离子阱,与Dionex UltiMate RS 3000 RS泵结合,并配备Dionex UltiMate RS 3000自动进样器(Thermo Scientific, San Jose, CA, USA)完成。甲醇标准溶液(200 μg ml)gydF4y2Ba−1gydF4y2Ba以10 μl min的流速将没食子酸、槲皮素葡萄糖苷、槲皮素、马来苷葡萄糖苷和山奈酚注入离子源gydF4y2Ba−1gydF4y2Ba,借助注射泵,以获得相应的质谱gydF4y2BangydF4y2Ba光谱(见gydF4y2Ba补充材料gydF4y2Ba)。只有在花青素-葡萄糖苷的情况下,鉴定是使用数据检索从一个gydF4y2Ba在网上gydF4y2Ba库(gydF4y2Bahttp://www.massbank.jp/jsp/Dispatcher.jsp?type=disp&id=PR020036&site=1gydF4y2Ba)。gydF4y2Ba
典型源条件为:输电线毛细管温度275℃,离子喷雾电压4.70 kV,护套、辅助和扫气(NgydF4y2Ba2gydF4y2Ba)的流量分别为20、5和0任意单位。离子阱中的碰撞阻尼气体为氦,压力为1mtorr。质gydF4y2BangydF4y2Ba在隔离宽度为1.2的离子阱中分离合适的前体离子后,通过碰撞诱导解离(CID)实验获得了光谱gydF4y2Bam / zgydF4y2Ba单元),并将其置于以下典型条件下:归一化碰撞能量在20% - 30%之间,选择保留5%数量级前体离子的信号;激活gydF4y2Ba问gydF4y2Ba0.25,激活时间30ms。采用意大利Phenomenex公司的Synergi 4 μm Hydro-RP 80A柱(250 mm × 2.0 mm)进行高效液相色谱分离。流动相为0.2% (gydF4y2Bav / vgydF4y2Ba)甲酸水溶液(洗脱液A)和0.2% (gydF4y2Bav / vgydF4y2Ba线性梯度洗脱条件为:27 - 44.5% B (32 min)、44.5 - 67.5% B (13 min)、67.5 - 100% B (2 min)、100% B等分(19 min)、100- 27% B (3 min)、27% B等分(6 min),流速为0.1 ml mingydF4y2Ba−1gydF4y2Ba在30℃下。gydF4y2Ba
死细胞测定gydF4y2Ba
GSC和RSC与含有双醋酸荧光素(FDA)的溶液孵育以测定细胞活力。FDA的工作溶液是按照McCabe和Leaver的描述制备的[gydF4y2Ba30.gydF4y2Ba]。在LEICA Fluovert荧光显微镜下观察细胞化学染色的细胞,使用Nageotte腔,计数至少100个无聚集体的细胞。通过考虑未染色细胞数与细胞总数之比计算死亡细胞的百分比。gydF4y2Ba
活性氧(ROS)测定gydF4y2Ba
参照Ledoux et al.和Santos et al.的方法监测ROS的生成。[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba],使用2 ',7 ' -二氯二氢荧光素(HgydF4y2Ba2gydF4y2BaDCFDA)作为探针。将悬浮细胞培养样品(2 ml)于第0天在24孔细胞培养团中以5 μM H孵育gydF4y2Ba2gydF4y2BaDCFDA。使用Multilabel Counter (WALLAC,型号1420,Perkin-Elmer)以5 min间隔读数进行105 min检测,激发波长为485±10 nm,发射波长为535±10 nm。GSC和RSC也以1 mM 2,2-偶氮双(2-甲基丙酰胺)盐酸盐(ABAP)作为自由基引发剂孵育。在实验开始和结束时评估细胞死亡的程度。gydF4y2Ba
细胞ATP的测定gydF4y2Ba
GSC和RSC(大约)10 g FW),在不同的采样天数(0,3和6),先用尼龙纱(100 μm目)过滤,然后用液氮冷冻,最后磨成细粉。样品(100±20 mg FW)重新悬浮在1 ml 50 mM Tris-HCl (pH 7.5)和0.05% (gydF4y2Baw / vgydF4y2Ba) Triton X-100,立即煮沸2分钟。离心后(在12,000gydF4y2BaggydF4y2Ba在Mikro 120赫提希离心机中),按照Petrussa等人的描述,等分的上清液用于光度测定。[gydF4y2Ba29gydF4y2Ba]。每个实验绘制ATP校准曲线,然后插值计算样品浓度。第0天的凋亡或坏死样本作为对照,用10% (gydF4y2Bav / vgydF4y2Ba)放置24小时或在80℃下放置10分钟。gydF4y2Ba
细胞色素检测gydF4y2BacgydF4y2Ba释放gydF4y2Ba
在光照或黑暗条件下生长6天的GSC或RSC约4 g FW用于提取细胞质。用4 ml匀浆缓冲液(20 mM HEPES-Tris, pH 7.6;0.3 M蔗糖;1毫米EDTA;5mm DTE;2 mM PMSF;1毫米苄脒和0.6% (gydF4y2Baw / vgydF4y2Ba) PVPP),通过尼龙网(100 μm目)过滤,然后在1000下离心gydF4y2BaggydF4y2Ba在4°C下,用Mikro 120赫提希离心机分离10分钟,以消除碎片。在15000℃下再次离心上清gydF4y2BaggydF4y2Ba20分钟。获得的上清液进一步在100,000下进行超离心gydF4y2BaggydF4y2Ba用贝克曼L7-55型离心机(ty70ti转子)离心40min,得到最终可溶部分。可溶性蛋白用5000 MWCO浓缩器VIVASPIN 4 (Sartorius, Göettingen, Germany)在10000下浓缩gydF4y2BaggydF4y2Ba静置30分钟(Mikro 120赫提希离心机)。可溶性蛋白(约30-40 μg)分离15% (gydF4y2Baw / vgydF4y2Ba) SDS-PAGE,并电印迹到硝化纤维素膜上。用200 μl多克隆抗细胞色素在4℃下孵育过夜gydF4y2BacgydF4y2BaAb (Agrisera),稀释1/1000。经碱性磷酸酶偶联抗兔IgG抗体(1/2500稀释)孵育后,用硝基蓝四唑和5-溴-4-氯-3-吲哚磷酸显色法检测交叉反应;Sigma,圣路易斯,密苏里州,美国)。使用Quantity One软件(Bio-Rad, Hercules, USA)对免疫印迹的计算机辅助密度分析进行定量。gydF4y2Ba
原位gydF4y2BaDNA片段检测(TUNEL法)gydF4y2Ba
于第0天和第6天收集GSC和RSC样品(1ml悬浮液),在磷酸盐缓冲盐水(PBS)中洗涤3次,用2% (gydF4y2Bav / vgydF4y2Ba)在PBS中浸泡60分钟。然后,样品用渗透溶液(0.1% (gydF4y2Baw / vgydF4y2BaTriton X-100 (0.1%)gydF4y2Baw / vgydF4y2Ba(柠檬酸钠)并用PBS洗涤三次。样品用TUNEL反应混合物(TMR-red)标记gydF4y2Ba原位gydF4y2Ba细胞死亡检测试剂盒,罗氏诊断公司)在黑暗中37°C下60分钟。阴性(不含末端转移酶)和阳性(第0天用乙醇处理),如Hogg等人所述。[gydF4y2Ba33gydF4y2Ba])样本被正确纳入。核染色用PBS洗涤2次,用1 μg ml染色gydF4y2Ba−1gydF4y2Ba4’,6-二氨基-2-苯基吲哚(DAPI)作用15 min。最后,在Leitz Fluovert荧光显微镜下检测所有样品,使用两组滤光片:360 nm激发和420 nm发射用于DAPI检测;分别为540nm激发和620nm发射。通过计数至少200个细胞核来确定凋亡的tunel阳性细胞核的百分比。gydF4y2Ba
统计数据分析gydF4y2Ba
根据Fisher统计检验,用LSD (Least Significant Difference,最小显著差异)比较各治疗组的均值,用不同的字母表示均值,表示统计学差异gydF4y2BaPgydF4y2Ba≤0.05。由于细胞死亡和TUNEL阳性细胞以占细胞总数的百分比进行评估,因此将其转化后的数据按公式arcsen (x)进行统计处理gydF4y2Ba1/2gydF4y2Ba)。一个gydF4y2BatgydF4y2Ba采用-试验比较第0天GSC和RSC愈伤组织的蛋白质和糖含量。gydF4y2Ba
结果gydF4y2Ba
悬浮细胞培养物的生产gydF4y2Ba诉酿酒用葡萄gydF4y2Ba(简历。Limberger)及其类黄酮谱的表征gydF4y2Ba
葡萄藤细胞培养物在固体培养基上光照下生长。14天后,这些细胞达到了在固体培养基上继代培养的最佳生长期。生长呈s型趋势,在21 ~ 23天达到稳定状态(附加文件)gydF4y2Ba1gydF4y2Ba:图S1)。在这个阶段,检测到愈伤组织表面的红色色素积累(结果未显示)。因此,选择同一块愈伤组织中的红色(有色素)和绿色(无色素)集群作为接种物,在液体培养基中进行继代培养,研究内源黄酮类化合物在衰老开始时的作用。如gydF4y2Ba方法gydF4y2Ba切片,从同一块愈伤组织中获得不同类型的细胞,它们的相对位置不同(内部/绿色或外部/红色)。此外,绿色和红色细胞的葡萄糖和果糖浓度没有显著差异gydF4y2Ba2gydF4y2Ba(表S1),这表明两种细胞类型都受到了相似程度的己糖信号诱导衰老。作为细胞降解标志的总蛋白质含量的差异在不同的细胞类型(gydF4y2BapgydF4y2Ba= 0.01)。然而,在随后的液体培养过程中,红色细胞中蛋白质的减少是明显的,红色细胞比绿色细胞更能保护PCD。gydF4y2Ba
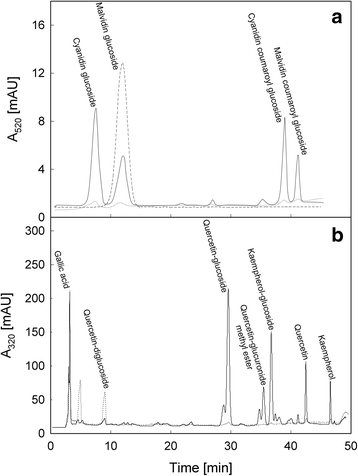
两种悬浮细胞(GSC和RSC)在液体培养基中光照或黑暗下维持6天。由于处理只持续了6天,我们认为在这段时间后,暗处理和光处理的细胞培养物的类黄酮含量没有实质性差异。因此,仅在光生长的RSC和GSC中,用RP-HPLC分析了花青素的含量和组成(图2)。gydF4y2Ba1gydF4y2Ba色谱图显示Limberger细胞主要积累了花青素和malvidin糖苷,以及它们的香豆素衍生物。特别是,GSC中的花青素含量较低,分别在第0天(数据未显示)和第6天(图a,虚线)具有相似的模式,表明光照处理在6天后没有改变其类黄酮浓度或组成。相反,与GSC相比,RSC在6天后显示出相当数量的花青素(图a,实线)。为了进一步表征两种悬浮细胞培养第6天积累的不同种类的黄酮类化合物,还对酒精提取物进行了质谱(MS)分析(附加文件)gydF4y2Ba3.gydF4y2Ba:图S2)。HPLC图谱显示,除花青素外,RSC主要积累没食子酸、槲皮素-葡萄糖苷、槲皮素、山奈酚-葡萄糖苷和山奈酚(图2)。gydF4y2Ba1gydF4y2Ba图b,实线)。GSC主要合成没食子酸和槲皮素-二葡萄糖苷(图2)。gydF4y2Ba1gydF4y2Ba图b,虚线)。山奈酚己糖([M-H])离子的存在gydF4y2Bam / zgydF4y2Ba447),山奈酚二己糖([M-H]]离子atgydF4y2Bam / zgydF4y2Ba609),槲皮素-二己糖([M-H]]离子atgydF4y2Bam / zgydF4y2Ba625)和槲皮素-葡萄糖醛酸甲酯([M-H])gydF4y2Bam / zgydF4y2Ba491)由细胞浸提液的质谱所示。这些化合物的鉴定是基于它们的质谱gydF4y2BangydF4y2Ba碎片行为(附加文件gydF4y2Ba4gydF4y2Ba:图S3,附加文件gydF4y2Ba5gydF4y2Ba:图S4,附加文件gydF4y2Ba6gydF4y2Ba:图S5和附加文件gydF4y2Ba7gydF4y2Ba:图S6)。特别是,这些化合物显示出己糖(162 Da)或葡萄糖醛酸甲酯(190 Da)部分的损失,产生相应的糖苷离子gydF4y2Bam / zgydF4y2Ba285和301,进一步破碎后,分别显示山奈酚和槲皮素的典型片段。gydF4y2Ba
RP-HPLC分析花青素(gydF4y2Ba一个gydF4y2Ba)和多酚类(gydF4y2BabgydF4y2Ba)由…获得的酒精提取物gydF4y2Ba诉酿酒用葡萄gydF4y2Ba(简历。林伯格)悬浮细胞培养。GSC (gydF4y2Ba虚线gydF4y2Ba)及RSC (gydF4y2Ba实线gydF4y2Ba)在光照条件下生长6天。第6天测定其代谢物含量。介绍了花青素糖苷、花青素和malvidin及其各自的取代衍生物的色谱谱。马齿苋糖苷(gydF4y2Ba虚线gydF4y2Ba)作为标准(图2)gydF4y2Ba一个gydF4y2Ba)。对520 nm处的色谱峰进行质谱分析,得到了鉴别结果。在320 nm处进行了类似的分析gydF4y2BabgydF4y2Ba),提取的黄酮类化合物鉴定如下:1)没食子酸;2) quercetin-diglucoside;3) quercetin-glucoside;4)槲皮素-葡糖苷甲酯;5) kaempferol-glucoside;6)槲皮素;7)山柰酚。数据代表了三个不同的实验gydF4y2Ba
黑暗和内源黄酮类化合物对悬浮细胞培养活力的影响gydF4y2Ba
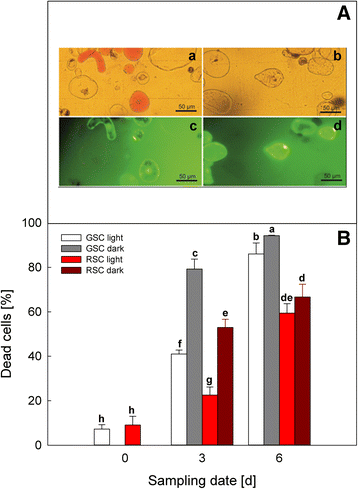
以光照处理为对照,测定黑暗和黄酮类化合物对细胞活力的可能影响。用FDA染色法评价不同细胞培养物的生存能力。数字gydF4y2Ba2gydF4y2Ba(图a)为RSC第6天的形态学特征(gydF4y2Ba一个gydF4y2Ba)及总务委员会(gydF4y2BabgydF4y2Ba),而经fda染色的样本(gydF4y2BacgydF4y2Ba和gydF4y2BadgydF4y2Ba),只计算活的荧光细胞。细胞死亡在整个实验期间都在增加,所有样本在第6天达到最大值(图b)。gydF4y2Ba
细胞死亡gydF4y2Ba诉酿酒用葡萄gydF4y2Ba(简历。Limberger)悬浮细胞培养用FDA染色评估。面板gydF4y2Ba一个gydF4y2BaGSC (gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba)及RSC (gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba)在光照条件下生长6天。经FDA染色后,在荧光(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)或可见(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)光。面板gydF4y2BabgydF4y2BaGSC和RSC在光照或黑暗条件下生长,分别在第0、3和6天取样,观察细胞总死亡的时间过程。死亡细胞百分比由fda染色与总细胞数之比计算。gydF4y2Ba酒吧gydF4y2Ba平均值是±sd至少三个不同的实验。不同的字母表示显著的差异(gydF4y2BaPgydF4y2Ba≤0.05),方差分析(ANOVA)检验gydF4y2Ba
这种趋势在GSC中更高,并且受到黑暗的刺激,尽管这种影响在第6天不那么明显。即使在这种情况下,在第6天,光照和黑暗处理的细胞之间的差异也较小。gydF4y2Ba
悬浮细胞培养中PCD标记物的表征gydF4y2Ba
分析PCD的不同生化和分子标记,以确定:i)在光照或黑暗条件下生长的两种悬浮细胞培养中观察到的细胞死亡是否显示PCD特征;ii)黄酮类化合物如何调节PCD的表现。gydF4y2Ba
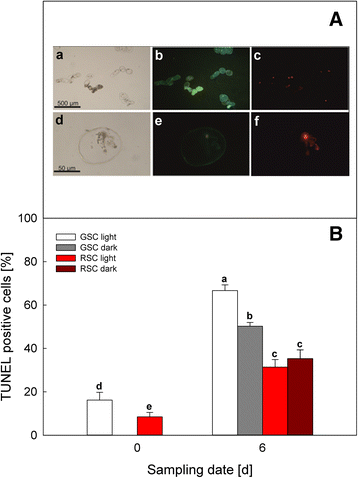
在第0天和第6天对所有样品进行TUNEL和DAPI检测(图2)。gydF4y2Ba3.gydF4y2Ba)。图a为DAPI和TUNEL反应阳性的细胞特征。蓝色荧光染色的细胞核(gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba)作为总细胞数的估计,而TMR红色荧光核(gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba)表示发生pcd的细胞中分裂的细胞核。这些参数使我们能够估计在第0天和第6天不同处理下进行PCD的细胞数量(图b),因为正是这些样本显示了GSC和RSC之间ATP水平的最大差异(见下文)。PCD在GSC中较高,而黑暗则抑制GSC。在RSC中,黄酮类化合物显著减少了TUNEL阳性细胞的数量,并消除了黑暗的影响,表明光仅在GSC中刺激PCD。gydF4y2Ba
PCD在gydF4y2Ba诉酿酒用葡萄gydF4y2Ba(简历。Limberger)悬浮细胞培养,通过TUNEL试验评估。在可见光下观察第0天的细胞(gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba);细胞核用DAPI (gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba)或TMR-red进行TUNEL分析(gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba),并在紫外线下观察,低(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba)及高(gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba)放大(面板gydF4y2Ba一个gydF4y2Ba)。在第0天和第6天,在光照或黑暗条件下生长的GSC和RSC进行TUNEL试验,以评估发生PCD的细胞百分比gydF4y2BabgydF4y2Ba),将细胞核呈红色荧光染色的细胞计数为凋亡样死细胞。gydF4y2Ba酒吧gydF4y2Ba平均值是±sd至少三个不同的实验。不同字母表示差异显著(gydF4y2BaPgydF4y2Ba≤0.05),方差分析(ANOVA)检验gydF4y2Ba
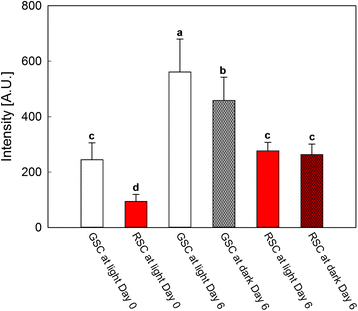
PCD的另一个标志是细胞色素gydF4y2BacgydF4y2Ba线粒体释放(图2)gydF4y2Ba4gydF4y2Ba)。在第6天对不同处理的细胞质组分进行分析,与第0天进行比较,作为对照。抗体交叉反应的密度分析显示细胞色素gydF4y2BacgydF4y2BaGSC的释放量高于RSC,特别是在光照下,这与TUNEL试验的结果一致。根据TUNEL分析的结果,黑暗部分抑制了这种释放,但对RSC没有影响。gydF4y2Ba
细胞色素gydF4y2BacgydF4y2Ba从中分离的细胞质组分释放gydF4y2Ba诉酿酒用葡萄gydF4y2Ba(简历。林伯格)悬浮细胞培养。GSC和RSC分别在光照和黑暗条件下生长6 d。分别在第0天和第6天取样品进行细胞色素分析gydF4y2BacgydF4y2Ba释放。交叉反应信号的密度分析是在细胞培养物中分离的细胞质蛋白,用抗细胞色素孵育后进行Western blot检测gydF4y2BacgydF4y2Ba主要的抗体。gydF4y2Ba酒吧gydF4y2Ba平均值是±sd至少三个独立实验的结果。不同字母表示差异显著(gydF4y2BaPgydF4y2Ba≤0.05),方差分析(ANOVA)检验gydF4y2Ba
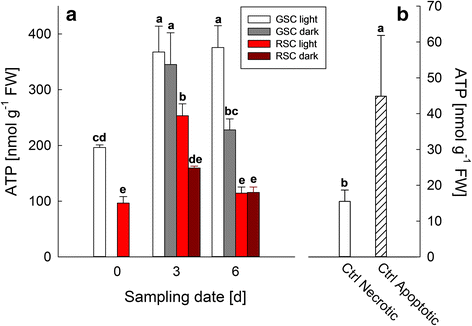
由于已知ATP水平对PCD的进展至关重要,因此在不同的采样日期(0,3和6天)评估其细胞水平。gydF4y2Ba5gydF4y2Ba在第0天,观察到GSC和RSC之间的显著差异;特别是,在光照下,GSC中检测到的最高ATP浓度可能归因于较高的光合活性。此外,光处理的GSC的ATP含量从第0天到第3天增加,并且在第6天相当,而在黑暗条件下GSC的ATP浓度下降的水平与初始水平相似。在光照条件下,RSC的ATP水平在第3天达到最大值,随后在第6天下降,而在黑暗条件下,ATP水平在第3天和第6天保持不变。为了评估与PCD表现相关的ATP水平,通过在第0天用10%乙醇(83±0.11%的PCD,数据未显示)处理GSC,与在80°C下处理10分钟(100%坏死细胞,数据未显示)进行阳性对照(图b)。gydF4y2Ba
ATP含量gydF4y2Ba诉酿酒用葡萄gydF4y2Ba(简历。林伯格)悬浮细胞培养。GSC和RSC分别在光照或黑暗条件下生长6天,分别在第0天、第3天和第6天取样gydF4y2Ba一个gydF4y2Ba)。坏死样和凋亡样样品作为阳性对照,于第0天在GSC上获得,在80°C孵育10分钟或在10% (gydF4y2Bav / vgydF4y2Ba)乙醇分别作用24 h(图2)gydF4y2BabgydF4y2Ba)。gydF4y2Ba酒吧gydF4y2Ba平均值是±sd至少三个独立实验的结果。不同字母表示差异显著(gydF4y2BaPgydF4y2Ba≤0.05),方差分析(ANOVA)检验gydF4y2Ba
悬浮细胞培养中活性氧(ROS)的产生gydF4y2Ba
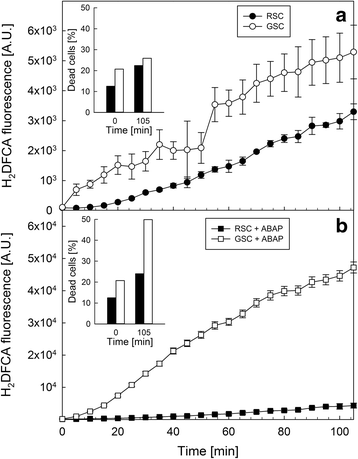
由于在第0天GSC和RSC表现出相当水平的细胞死亡,因此评估两个系统中ROS产生水平是否不同是很有趣的。两种细胞培养物均用荧光探针HgydF4y2Ba2gydF4y2BaDCFDA,监测ROS生成的时间过程(图2)。gydF4y2Ba6gydF4y2Ba)。图a显示,与RSC相比,GSC产生了大量的ROS,但这种ROS的过量产生并没有引起105分钟后细胞死亡的明显差异(插图图a)。相反,当细胞用自由基产生剂ABAP处理时,GSC表现出ROS产生的急剧增加(插图图b),与此同时,细胞死亡的强烈增加(插图图b),这在RSC中没有观察到。gydF4y2Ba
讨论gydF4y2Ba
黄酮类化合物具有多种相关的生理作用。首先,它们起到抗氧化剂的作用,通过延缓/抑制与PCD相关的基因的激活来防止细胞死亡。然而,为了发挥抗氧化剂的作用,类黄酮需要不断减少。这只能通过有效的还原系统来实现,例如抗坏血酸和还原性谷胱甘肽,它们由光合作用提供。其次,黄酮类化合物可能引起线粒体氧化磷酸化轻度解偶联,导致呼吸链电子通量升高,跨膜电位降低,从而阻止线粒体产生ROS [gydF4y2Ba34gydF4y2Ba]。gydF4y2Ba
在目前的工作中,我们利用从同一愈伤组织中获得的两个葡萄细胞培养物,一个具有高(RSC)含量,另一个具有低(GSC)含量,来评估黑暗和黄酮类化合物对衰老的影响。gydF4y2Ba1gydF4y2Ba)。在固体培养基上生长的起始材料由于营养缺乏而容易衰老,而在愈伤组织表面观察到的色素沉着主要是由于这些细胞受到过量的光照射而引起的。然而,当在液体培养基中继代培养时,它们在第0天的次生代谢物差异与相似水平的细胞死亡有关。由于GSC和RSC具有相同的基因型,由于它们起源于相同的愈伤组织,因此它们之间除了受刺激的类黄酮生物合成途径和清除ROS过剩的能力不同外,彼此之间没有遗传差异(图2)。gydF4y2Ba6gydF4y2Bab)。gydF4y2Ba
在传代培养开始时(第0天),GSC和RSC的细胞死亡水平很低,基本相当,但在液体培养基中3天后,黑暗条件强烈刺激了两种细胞培养的细胞死亡(图2)。gydF4y2Ba2gydF4y2Ba)。这种行为与先前的结果一致[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba],证明黑暗是细胞死亡的诱导因素。这种效果在第3天比第6天更明显。gydF4y2Ba2gydF4y2Ba)。黄酮类化合物的存在在黑暗和光处理的细胞中都降低了这种作用。gydF4y2Ba
Buchanan-Wollaston等。[gydF4y2Ba1gydF4y2Ba研究表明,与发育程序相比,由黑暗或饥饿引起的衰老表现出独特的转录组模式。此外,黑暗会增加ROS的产生[gydF4y2Ba37gydF4y2Ba]。因此,在第0天(在固体培养基上饥饿23天后),GSC比RSC表现出更高的ROS进化(图2)。gydF4y2Ba6gydF4y2Ba),因为类黄酮作为抗氧化剂,减少了活性氧的产生。gydF4y2Ba
6天后,细胞凋亡样PCD明显出现,TUNEL实验显示(图2)。gydF4y2Ba3.gydF4y2Ba)和细胞色素gydF4y2BacgydF4y2Ba释放(图。gydF4y2Ba4gydF4y2Ba)。细胞凋亡样PCD在光照下生长的GSC中比在黑暗中生长的更明显。黄酮类化合物减少了这种类型的死亡,证实除了黑暗诱导的细胞死亡外,这些代谢物还特别保护细胞免受PCD的侵害。事实上,高ATP水平有利于细胞凋亡的执行[gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba],在GSC中6天后仍然明显,并且与细胞凋亡样PCD的发生相一致(图2)。gydF4y2Ba5gydF4y2Ba与RSC相比,GSC中较高的ATP含量可以用前者细胞中更有效的光合活性来解释,这在第0天就已经很明显了。光处理也扩大了GSC和RSC之间ATP含量的差异,因为只有在光下生长的悬浮细胞培养物才有功能叶绿体[gydF4y2Ba40gydF4y2Ba]。黑暗降低了GSC和RSC中的ATP,尽管这种影响在6天后在RSC中更为明显。gydF4y2Ba
黄酮类化合物对细胞死亡的保护作用,特别是在6天后,可能是由于它们的抗氧化活性[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba]。因此,ROS可以维持在一个临界水平以下,以避免它们成为细胞毒性,从而作为坏死诱导剂[gydF4y2Ba43gydF4y2Ba]。这种保护甚至可以阻止ROS作为触发细胞凋亡样PCD的信号[gydF4y2Ba44gydF4y2Ba]在RSC线粒体中,如果与叶绿体相比,那里的ROS合成已知较低[gydF4y2Ba45gydF4y2Ba]。gydF4y2Ba
需要强调的是,已发现质体ROS的作用发生在线粒体释放促凋亡因子的下游,但在caspase激活之前[gydF4y2Ba46gydF4y2Ba- - - - - -gydF4y2Ba48gydF4y2Ba]。在光照下生长的GSC中,通过线粒体和叶绿体途径的重叠,可以诱导额外的PCD。凋亡样PCD主要发生在光生长的GSC中(图2)。gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba),也可能取决于叶绿体的参与[gydF4y2Ba44gydF4y2Ba,gydF4y2Ba49gydF4y2Ba]。同意这一点,在gydF4y2Ba拟南芥gydF4y2Ba紫外光单独诱导caspase样活性介导的PCD [gydF4y2Ba50gydF4y2Ba]。这可以解释即使线粒体途径占主导地位,在光处理的GSC中观察到的PCD增加。相反,在光照和黑暗处理的RSC中,黄酮类化合物对PCD有保护作用。gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Ba),这种现象在第6天尤为明显。gydF4y2Ba
结论gydF4y2Ba
总之,黑暗主要是触发坏死细胞死亡的原因,这是由高ROS产生引起的,再加上低效率的抗氧化系统。值得注意的是,细胞从固体介质转移到液体介质必须面对强氧化环境。相反,PCD在光生长的GSC中更受刺激,因为ROS触发不被黄酮类化合物抵消。多酚类化合物的参与也可能在线粒体水平上被假设,正如在哺乳动物中已经提出的那样,这些化合物通过与复合物I相互作用减少过氧化氢的形成[gydF4y2Ba34gydF4y2Ba]。同样地,这些次生代谢物可以减少质体ROS引起的氧化损伤。gydF4y2Ba
补充材料gydF4y2Ba
额外的文件gydF4y2Ba1gydF4y2Ba:添加图S1作为补充材料,显示增殖率gydF4y2Ba诉酿酒用葡萄gydF4y2Ba(简历。在固体培养基上培养的细胞。额外的文件gydF4y2Ba3.gydF4y2Ba:图S2,附加文件gydF4y2Ba4gydF4y2Ba:图S3,附加文件gydF4y2Ba5gydF4y2Ba:图S4,附加文件gydF4y2Ba6gydF4y2Ba:图S5和附加文件gydF4y2Ba7gydF4y2Ba图S6为葡萄细胞培养酒精提取物和参比标准物的质谱图。gydF4y2Ba
额外的文件gydF4y2Ba2gydF4y2Ba表S1作为补充材料,显示了第0天细胞培养物的蛋白质和己糖含量。gydF4y2Ba
缩写gydF4y2Ba
- ABAP:gydF4y2Ba
-
2, 2-azobis (2-methylpropionamide)盐酸gydF4y2Ba
- CID:gydF4y2Ba
-
碰撞诱发离解gydF4y2Ba
- DAPI:gydF4y2Ba
-
4, 6-diamidino-2-phenylindolegydF4y2Ba
- 食品药品监督管理局:gydF4y2Ba
-
荧光素二乙酸gydF4y2Ba
- GSC:gydF4y2Ba
-
绿色悬浮细胞培养gydF4y2Ba
- HgydF4y2Ba2gydF4y2BaDCFDA:gydF4y2Ba
-
2 ', 7 ' -dichlorodihydrofluorescein二醋酸盐gydF4y2Ba
- 人力资源:gydF4y2Ba
-
过敏的反应gydF4y2Ba
- LC-ESI-MS:gydF4y2Ba
-
液相色谱-电喷雾电离-质谱法gydF4y2Ba
- 迷幻药:gydF4y2Ba
-
最小显著差异gydF4y2Ba
- 女士gydF4y2BangydF4y2Ba:gydF4y2Ba
-
多级质谱分析gydF4y2Ba
- PBS:gydF4y2Ba
-
磷酸盐缓冲盐水gydF4y2Ba
- 纤毛运动:gydF4y2Ba
-
细胞程序性死亡gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- RSC:gydF4y2Ba
-
红色悬浮细胞培养gydF4y2Ba
- TUNEL分析:gydF4y2Ba
-
原位gydF4y2BaDNA断裂检测gydF4y2Ba
参考文献gydF4y2Ba
Buchanan-Wollaston V, Page T, Harrison E, Breeze E, Lim PO, Nam HG, Lin JF, Wu SH, Swidzinski J, Ishizaki K,等。比较转录组分析揭示了拟南芥发育和黑暗/饥饿诱导的衰老之间基因表达和信号通路的显著差异。植物学报,2005;42(4):567 - 585。gydF4y2Ba
帕斯托里总经理,德里奥洛杉矶。豌豆叶片的自然衰老-活化过氧化物酶体的氧介导功能。植物生理学报。1997;13(2):411 - 418。gydF4y2Ba
郭艳,蔡志,甘森。拟南芥叶片衰老的转录组研究。植物学报,2004;27(5):521-49。gydF4y2Ba
霍伯里希茨FA,沃尔林EJ。植物程序性细胞死亡的多种介质:保守细胞死亡机制和植物特异性调节因子的相互作用。Bioessays。2003;25(1):47-57。gydF4y2Ba
Swidzinski JA, Sweetlove LJ, Leaver CJ。拟南芥程序性细胞死亡过程中基因表达的定制微阵列分析。植物学报,2002;30(4):431 - 446。gydF4y2Ba
彭奈尔,兰姆C.植物的程序性细胞死亡。植物学报。1997;9(7):1157 - 668。gydF4y2Ba
张伟,张文杰,张文杰,等。茉莉酸对葡萄悬浮培养花青素组成的影响。生物技术学报。2003;25(14):1131-5。gydF4y2Ba
Batra P, Sharma AK。黄酮类化合物的抗癌潜力:最新趋势和未来展望。生物技术学报,2013;3(6):439-59。gydF4y2Ba
Ceoldo S, Levi M, Marconi AM, Baldan G, Giarola M, Guzzo F.图像分析和体内成像工具在胡萝卜花青素产生细胞培养中的生产力动态研究。中国生物医学工程学报,2009;32(1):349 - 349。gydF4y2Ba
Lord CEN, Wertman JN, Lane S, Gunawardena AHLAN:线粒体在植物程序性细胞死亡过程中重塑叶片中发挥作用吗?植物生态学报,2011,11(2):591 - 591。BMC Plant biology . 2013;2013:2058gydF4y2Ba
Lord CEN, Dauphinee AN, Watts RL, Gunawardena AHLAN。揭示植物程序性细胞死亡(PCD)中线粒体、caspase样蛋白酶和肌动蛋白细胞骨架之间的相互作用。科学通报,2013;8(3):e57110。gydF4y2Ba
杨建军,杨建军。花青素是否具有抗氧化作用?机械损伤后红、绿叶中H(2)O(2)的成像。植物学报。2002;25(10):1261-9。gydF4y2Ba
张勇,Butelli E, De Stefano R, Schoonbeek HJ, Magusin A, Pagliarani C, Wellner N, Hill L, Orzaez D, Granell A,等。花青素通过延缓过熟和降低对灰霉病的易感性使番茄的保质期延长一倍。当代生物学,2013;23(12):1094-100。gydF4y2Ba
戴杰,马珀RJ。植物酚类物质的提取、分析及其抗氧化和抗癌特性。分子。2010;15(10):7313 - 52。gydF4y2Ba
王立生,石匠GD。花青素及其在癌症预防中的作用中华癌症杂志,2008;26(2):281 - 291。gydF4y2Ba
Kampa M, Hatzoglou A, Notas G, Damianaki A, Bakogeorgou E, Gemetzi C, Kouroumalis E, Martin PM, Castanas E.葡萄酒抗氧化多酚对人前列腺癌细胞增殖的抑制作用。中华癌症杂志,2000;37(2):223-33。gydF4y2Ba
Seeram NP, Adams LS,张玉军,Lee R, Sand D, Scheuller HS, Heber D.黑莓、黑覆盆子、蓝莓、蔓越莓、红覆盆子和草莓提取物对人癌细胞生长和凋亡的体外抑制作用。食品化学学报,2006;34(5):929 - 939。gydF4y2Ba
Damianaki A, Bakogeorgou E, Kampa M, Notas G, Hatzoglou A, Panagiotou S, Gemetzi C, Kouroumalis E, Martin PM, Castanas E.红酒多酚对人乳腺癌细胞的抑制作用。中国生物医学工程学报,2009;32(3):444 - 444。gydF4y2Ba
王丽娟,王晓明,王晓明,等。红薯提取物的化学预防作用。简历。Koganesengan)。农业食品化学学报,2004;52(23):7152-7。gydF4y2Ba
Tavares S, Vesentini D, Fernandes JC, Ferreira RB, Laureano O, Ricardo-Da-Silva JM, Amancio S.硫酸盐耗尽对葡萄次生代谢的影响植物生理学报,2013;33(6):1186 - 1186。gydF4y2Ba
黄酮类化合物的生物合成及其对胁迫的影响。植物学报,2002;5(3):218-23。gydF4y2Ba
陈建军,陈建军,陈建军,陈建军。葡萄植株抗病性与4-羟基苯乙烯氧化异过氧化物酶水平的关系。植物细胞组织器官杂志。1992;29(2):63-70。gydF4y2Ba
通过十八烷途径产生的过氧化氢对于茉莉酸甲酯诱导的木本植物超敏细胞死亡既不是必要的也不是充分的。生物化学学报,2002;45(1):105-15。gydF4y2Ba
茉莉酸甲酯是葡萄叶片和细胞悬浮培养中多种防御反应的有效激发子。生物质化学工程学报,2004;32(2):393 - 398。gydF4y2Ba
李建军,李建军,李建军,等。葡萄叶感染后pr -1样蛋白的免疫检测。葡萄。2000;(3):123 - 7。gydF4y2Ba
李建军,李建军,李建军,等。植物糖信号转导的研究进展。植物学报,2002;14:585 - 591。gydF4y2Ba
王晓明,王晓明,王晓明,等。植物叶片衰老过程中环境信号的表达及其调控作用。中国生物医学工程学报,2006;37(2):391 - 391。gydF4y2Ba
利用蛋白质-染料结合原理的一种快速灵敏的微量蛋白质定量方法。生物化学学报。1976;72:248-54。gydF4y2Ba
刘建军,刘建军,刘建军,等。白冷杉体细胞胚胎发生过程中细胞程序性死亡的研究进展。足底。2009;231(1):93 - 107。gydF4y2Ba
麦凯布PF,莱弗CJ。细胞培养中的程序性细胞死亡。植物化学学报,2000;44(3):359 - 368。gydF4y2Ba
Ledoux Q, Veys P, Van Cutsem P, Mauro S, Lucaccioni F, Marko I.硼酸盐传感器ContPY1在植物过氧化氢荧光检测中的应用。植物信号学报,2013;8(11):826 - 827。gydF4y2Ba
Santos A, Miguel A, Tomaz L, Malhó R, Maycock C, Vaz Patto M, Fevereiro P, Oliva A. CdSe/ZnS量子点对紫花苜蓿悬浮培养细胞的影响。纳米生物学报,2010;8(24):1-14。gydF4y2Ba
王晓明,王晓明,王晓明,等。植物根毛细胞凋亡样细胞程序性死亡的研究进展。植物学报。2011;7:45-54。gydF4y2Ba
Lagoa R, Graziani I, Lopez-Sanchez C, Garcia-Martinez V, Gutierrez-Merino C.复合物I和细胞色素C是黄酮类化合物抑制线粒体产生过氧化氢的分子靶点。生物化学学报,2011;07(12):1562-72。gydF4y2Ba
李建军,李建军,李建军,等。衰老相关受体样蛋白激酶基因的克隆与表达。植物生理学报,2000;24(3):1305 - 1404。gydF4y2Ba
林建峰,吴世生。拟南芥叶片衰老的分子事件。植物学报,2004;39(4):612 - 628。gydF4y2Ba
李建军,李建军,李建军,等。紫花天竺葵扦插衰老过程中活性氧(ROS)和衰老相关基因转录物(SAG)水平的升高及赤霉素酸的影响。植物科学,2006;17(4):873-9。gydF4y2Ba
王晓东,王晓东,王晓东,等。线粒体凋亡与细胞坏死的关系。生理学报。1998;60:619-42。gydF4y2Ba
Desagher S, Martinou JC。线粒体是细胞凋亡的中心控制点。细胞生物学进展。2000;10(9):369-77。gydF4y2Ba
王晓明,王晓明,王晓明。拟南芥悬浮培养中叶绿体和活性氧参与细胞凋亡样程序性死亡的研究。实验学报,2010;61(2):473-82。gydF4y2Ba
Hernandez I, Alegre L, Van Breusegem F, Munne-Bosch S.黄酮类化合物作为植物抗氧化剂的相关性如何?植物科学进展,2009;14(3):125-32。gydF4y2Ba
Spatafora C, Barbagallo E, Amico V, Tringali C.葡萄源于西西里葡萄品种,富含多酚,具有增强的抗氧化活性。食品科学技术,2013;54(2):542-8。gydF4y2Ba
死与生:叶片衰老对干旱胁迫下植物存活的影响。植物学报,2004;31(3):203-16。gydF4y2Ba
李建军,李建军,李建军,等。植物细胞程序性死亡:氧化还原调控和过氧化氢作用的新进展。中国生物医学工程学报,2008;31(2):444 - 444。gydF4y2Ba
王志强,王志强。线粒体、过氧化物酶体和叶绿体氧化还原信号的研究进展。植物物理学报,2003;19(3):355-64。gydF4y2Ba
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。植物生理学报,2011;36(1):185-201。gydF4y2Ba
王海军,朱晓宁,李慧,崔健,刘超,陈旭,张伟。水稻叶绿体释放细胞色素f诱导caspase -3样活性及其与泛素-蛋白酶体系统的相互作用。科学通报,2014;4(4):589 - 599。gydF4y2Ba
李建军,张世荣,李金平,李建军,李建军,李建军,李建军,李建军。拟南芥叶绿体对植物程序性细胞死亡信号通路的影响。植物学报,2012,24(7):3026-39。gydF4y2Ba
王晓明,王晓明,王晓明,等。逆境胁迫诱导植物细胞程序性死亡的研究进展。植物科学,2015;6:69-96。gydF4y2Ba
Danon A, Rotari VI, Gordon A, Mailhac N, Gallois P.紫外- c过度暴露诱导拟南芥程序性细胞死亡,这是由caspase样活性介导的,可以被caspase抑制剂、p35和Defender against apoptosis death抑制。生物化学学报,2004;27(1):779-87。gydF4y2Ba
致谢gydF4y2Ba
我们感谢乌迪内大学G. Verardo教授和A. Gorassini博士通过LC-ESI-MS分析鉴定多酚代谢物。我们也非常感谢Dr. V. Repka提供葡萄愈伤组织培养物(gydF4y2Ba葡萄gydF4y2BaL,简历。Limberger)。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了意大利教育、大学和研究部(国家研究计划PRIN2010CSJX4F)的支持。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持我们发现的所有数据都包含在手稿中。gydF4y2Ba
作者的贡献gydF4y2Ba
AB进行细胞死亡标志物实验(FDA染色、TUNEL染色、细胞色素染色)gydF4y2BacgydF4y2Ba释放和免疫测定),ATP含量和ROS生成。他还参与了手稿的撰写和关键性的修改。EP构思设计实验,获取细胞死亡标志物(FDA染色、TUNEL、细胞色素)数据gydF4y2BacgydF4y2Ba释放和免疫测定)。她参与起草了手稿,并对其进行了关键性的修改。SP进行了多酚的色谱分析,并对稿件进行了严格的修改。MZ, CP和VC对稿件的重要修改做出了贡献。AV构思和设计了这项研究,并共同撰写了手稿。EB构思设计实验,进行统计数据分析,并参与撰写论文。所有作者都已阅读并同意本文。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有竞争利益。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
的增殖率gydF4y2Ba诉酿酒用葡萄gydF4y2Ba(简历。在固体培养基上培养的细胞。细胞在光照下培养23天。柱状图表示平均值±标准差至少三个独立实验的结果。(TIF 176kb)gydF4y2Ba
附加文件2:表S1。gydF4y2Ba
GSC和RSC的衰老特征。液体培养前第0天GSC和RSC中总蛋白含量和己糖浓度的测定。(DOCX 13kb)gydF4y2Ba
附加文件3:图S2。gydF4y2Ba
质谱采用多级质谱法(MS)获得gydF4y2BangydF4y2Ba)用于分析由gydF4y2Ba诉酿酒用葡萄gydF4y2Ba(简历。林伯格)悬浮细胞培养。上光谱为光照下生长6天的RSC粗提取物的光谱。中谱和下谱分别表示用H洗脱的两种不同组分的光谱gydF4y2Ba2gydF4y2Ba分别从C18固相萃取柱中分离O和甲醇。(TIF 47kb)gydF4y2Ba
附加文件4:图S3。gydF4y2Ba
质谱联用技术表征马丽花苷标准品的结构gydF4y2BangydF4y2Ba。上光谱为全光谱malvidin-glucoside。下谱为[M-H]离子碰撞诱导解离谱gydF4y2Bam / zgydF4y2Bamalvidin-glucoside的491.1离子。(TIF 41kb)gydF4y2Ba
附加文件5:图S4。gydF4y2Ba
质谱法表征没食子酸标准品的结构gydF4y2BangydF4y2Ba。上光谱显示没食子酸的全光谱。下谱为[M-H] +的CID谱gydF4y2Bam / zgydF4y2Ba168.8的没食子酸。(TIF 35kb)gydF4y2Ba
附加文件6:图S5。gydF4y2Ba
槲皮素-葡萄糖苷标准品的质谱结构表征gydF4y2BangydF4y2Ba。上光谱显示槲皮素-葡萄糖苷全谱。下谱为[M-H] +的CID谱gydF4y2Bam / zgydF4y2Ba槲皮素-葡萄糖苷的463.1(TIF 30kb)gydF4y2Ba
附加文件7:图S6。gydF4y2Ba
山奈酚标准品的质谱结构表征gydF4y2BangydF4y2Ba。上光谱显示山奈酚的全光谱。下谱为[M-H] +的CID谱gydF4y2Bam / zgydF4y2Ba山奈酚285离子。(TIF 32kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Bertolini, A., Petrussa, E., Patui, S.。gydF4y2Baet al。gydF4y2Ba黄酮类化合物和黑暗可以降低衰老过程中的PCDgydF4y2Ba葡萄gydF4y2Ba悬浮细胞培养。gydF4y2BaBMC Plant BiolgydF4y2Ba16日,gydF4y2Ba233(2016)。https://doi.org/10.1186/s12870-016-0917-ygydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-016-0917-ygydF4y2Ba
关键字gydF4y2Ba
- 细胞培养gydF4y2Ba
- 类黄酮gydF4y2Ba
- 纤毛运动gydF4y2Ba
- 衰老gydF4y2Ba
- 葡萄gydF4y2Ba