摘要
背景
不同的表型和基因型是在局部适应群体中确定自然选择目标的关键信号。在这里,我们使用了多种生长、植物结构和种子性状的常见花园表型的组合,以及单核苷酸多态性(SNP)基因分型来描述15个野生向日葵群体的多样性范围模式(向日葵L.)在北美中部沿纬度梯度取样。我们分析了表型多样性的地理模式,量化了种群内SNP多样性的水平,并确定了该物种范围内的种群结构的程度。然后,我们使用这些数据来识别显著过度分化的位点,作为可能有助于局部适应的基因组区域的指标。
结果
花期、株高、籽油成分(即饱和脂肪酸百分比)等性状与纬度显著相关,从而区分了南北居群。成对平均F圣结构分析确定了两个显著的聚类,在很大程度上分离了北方和南方的个体。重要的F圣异常值包括苏格兰民族党HaFT2开花时间基因,之前已被证明与开花时间QTL共定位,并在基因表达中表现出已知的cline。
结论
在北美中部的野生向日葵种群中观察到表型性状和SNP等位基因频率的纬向分化。这种分化可能在整个物种范围内发挥重要的适应作用,并可能促进对气候变化的适应。
背景
局部适应,即种群在其“家”环境中比在非本地环境中具有更高的适应性,是进化生物学领域中一个非常有趣的话题(例如,[1])。然而,这种适应性差异的遗传基础还没有在绝大多数非模式生物中得到阐明。对于植物来说,导致局部适应的选择压力可以包括各种非生物和生物因素,例如:土壤类型[2- - - - - -4]、水供应量[5],光周期[6],温度[7]、食草动物[8]、菌根的关系[9],以及靠近农田[10].因为这些选择压力预计会在赋予适应性差异的基因及其附近产生遗传变异的特征模式,因此群体遗传学方法有可能提供对基因或至少基因组区域的深入了解,这些基因负责在整个物种范围内产生局部适应性特征。
在预期在产生适应当地的种群中起重要作用的分化选择的情况下,重点通常是种群遗传分化的措施。更具体地说,不同的选择压力预计会在目标基因附近相对于全基因组平均水平产生更高的种群结构(例如,[11- - - - - -14])。相比之下,平衡选择预期会导致更低水平的群体遗传分化[15,16].当与高通量基因分型方法相结合时,这种群体遗传方法已被用于识别被认为与多种物种的适应性有关的基因,包括北方黑云杉[17]、大西洋鳕鱼[18]、草原鸡[19]和沼泽青蛙[20.].
除了种群分化的总体水平外,遗传变异的临床模式也可以指示局部适应(例如,[21,22])。在不同的物种范围内,各种各样的环境变量通常是不同的,因此,在一个物种范围的极端,可能会有对不同表型值的选择。虽然由于遗传漂变和基因流的共同作用,许多位点上的等位基因频率可能在给定的环境对比中表现出弱相关性,但在局部适应中起重要作用的位点上的等位基因应该明显与相关的环境变量相关[21].例如,等位基因频率的自适应临床已在拟南芥开花时间基因FRIGIDA(23),PHYTOCROME C(24),在杨树tremula开花时间基因光敏色素B2(25),在黑腹果蝇胰岛素信号基因胰岛素样受体(26],在选择polionotus对于毛色基因刺(27].虽然上述研究为了解局部适应的遗传基础提供了巨大的见解,但对非模式生物的研究将有助于拓宽我们对这一基本进化过程的理解。在本文中,我们报道了普通向日葵表型和遗传多样性的大范围模式。向日葵。
向日葵是菊科的一员(又名,菊科),这是最大和最多样化的开花植物家族之一。普通向日葵的本土范围横跨北美大部分地区,野生种群出现在以大范围环境变量变化为特征的栖息地,包括:光周期、生长季节、最低/最高温度和降水。普通向日葵也是栽培向日葵的野生祖先h . annuus),原产于北美中东部[28- - - - - -30.]也是世界上最重要的油籽作物之一[31].栽培向日葵与普通向日葵相比,在分枝、开花时间、株高和各种种子性状等方面存在显著差异[32].
在这里,我们描述了北美中部沿纬度梯度的15个野生向日葵种群内部和之间的表型和遗传多样性模式。我们在温室环境中对这些群体中的个体进行培养和表型分析,并使用单核苷酸多态性(SNP)阵列对分布在向日葵基因组中的384个位点进行基因分型。我们利用这些数据研究了表型分化的地理模式,描述了群体遗传变异的总体模式,并确定了具有群体局部适应遗传特征的位点。我们还将群体遗传结果放在向日葵数量性状位点(QTL)定位研究的背景下,以确定高分化位点是否与已知QTL区域共定位。
方法
植物材料及表型分析
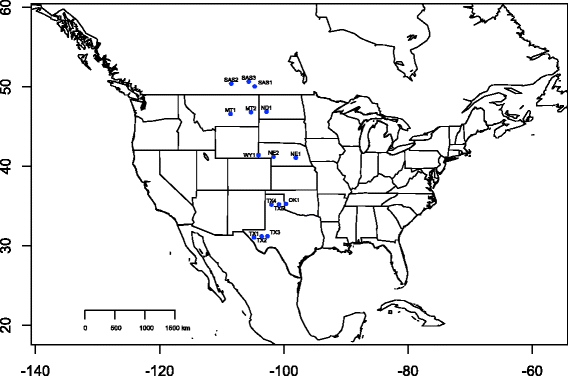
来自15个野生采集种群的种子h . annuus均来自美国农业部北中部地区植物引进站(艾姆斯,IA)。这些种群的样本来自北美中部的一个纬度范围(图2)。1;表格1),被选来代表真正的野生种群,这些种群似乎不受过去与栽培向日葵的渗透影响(L. Marek和G. Seiler,个人交流)。注意避免采样的不同亚种h . annuus(例如,h . annuusssp。Texanus),因为这可能会扩大遗传结构和/或表型分化。发芽前,所有种子都用3%的过氧化氢清洗,用去离子水冲洗,并放在培养皿中潮湿的滤纸上。为了打破休眠,将培养皿放置在4摄氏度的黑暗寒冷的房间里14天。冷处理后,将它们移至生长室,在23℃下保持16 h。发芽后,将幼苗种植在土壤托盘中。一旦建立,这些幼苗被移植到土壤花盆(900经典,苗圃供应公司,基西米,佛罗里达州),并转移到温室,在那里补充照明提供了一个一致的昼夜16小时的周期。
本研究中使用的15个种群在美国中部和加拿大的位置地图。Map是在R中使用' maps '库构建的[65]
植物被安排在温室中的四个块,每个块包含15个种群中的5个个体(每个块共75个个体)。所有植物都有多种表型性状,包括:真叶天数至四对,开花天数,植株衰老时的高度,分枝结构,种子大小和种子油含量/成分。由于野生向日葵是自交不亲和的,人工杂交产生种子。这涉及种群内的交叉个体(即,从种群内个体收集的散装花粉用于为该种群内的个体授粉),花序被袋装以防止交叉污染。然后在生理成熟时收集种子并进行表型分析。根据既定方案评估油品特性[32].简单地说,含油量百分比是通过脉冲核磁共振(NMR)分析确定的,使用Bruker MQ20 Minispec核磁共振分析仪(Billerica, MA),该分析仪已按已知标准校准。脂肪酸组成由气相色谱法测定(Hewlett-Packard, Palo Alto, CA),已知脂肪酸标准(Nu-Check Prep, Elysian, MN)。
通过确定所有286个成年个体的性状值的频率直方图是否偏离正态,对所有性状进行了测试(最初种植的个体中有14个在发育早期死亡,但每个群体至少分析了12个个体)1))与JMP 11 (SAS Institute, Cary, NC)中Shapiro-Wilk检验的正态分布显著不同,性状值使用Box-Cox转换[33)。限制性最大似然采用区域作为固定效应(随机效应包括块和块-区域相互作用)来检验性状值的区域差异。对于脂肪酸性状,脂肪酸提取日期被用作阻挡因子,而不是温室阻挡因子,因为对原始数据的检查表明,提取效率在天内有明显变化。使用Tukey检验比较区域间的最小二乘均值。
DNA提取和SNP基因分型
从286株完全生长的植株中收获叶片组织(表1)上述个体,DNA提取使用Qiagen DNeasy Plant Mini Kit (Valencia, CA)。所有DNA样本均使用NanoDrop (Thermo Scientific, Wilmington, DE)定量,并在基因分型前稀释至50 ng/μl。然后使用GoldenGate法(Illumina, San Diego, CA)对每个样本进行基因分型,目标是从Bachlava等描述的大量向日葵snp中选择的384个snp, [34].这些位点被选择来提供17个向日葵连锁群(lgg)的均匀覆盖,平均每3.5 cM有一个SNP。基因型呼叫使用Illumina 's GenomeStudio进行。2011.1),然后人工检查。在进行群体遗传分析之前,将表现出异常杂交信号(可能是由于存在/不存在变异或重复基因的出现)、整体多态性缺失(即小等位基因频率< 0.05)和/或大量缺失数据(即缺失数据> 0.05的部分)的位点去除。共有246个位点(平均为14.5个/ LG;范围=每LG 11-20)留作进一步分析(http://dx.doi.org/10.5061/dryad.6p1c4).
群体遗传分析
遗传多样性的测量,包括多态性位点的百分比,观察到的杂合度(Ho)和Nei的无偏期望杂合度(UHe;(35])在种群水平上使用GenAlEx (version 6.501;(36])。我们还使用GenAlEx通过对999个排列进行分子方差(AMOVA)分析来研究群体之间的遗传分化,以确定我们数据集中的群体结构水平。最后,程序STRUCTURE(版本2.3.4)[37]用于研究整个物种范围内的群体遗传结构。具体来说,STRUCTURE使用的是来自K= 1 ~ 17个群体遗传簇,每个群体遗传簇的MCMC迭代分别为100,000和1,000,000次(每个重复20次)K值)。结果被导入到STRUCTURE Harvester [38的最可能值K是用Delta确定的吗K方法(39].STRUCTURE,还被用于测试数据的单个子集,以研究更精细的遗传结构水平。
采用多种方法研究了局部选择压力在单个位点多样性形成中的潜在作用。首先,我们使用Arlequin计算了20,000次模拟,以获得F的零分布圣,然后用于开发99%的置信区间用于高异常值和低异常值识别(版本3.5.1.2;(13])。一般而言,过度分化的基因座被认为是适应局部环境的候选基因座,而低分化的基因座通常被认为是平衡选择的候选基因座[15,16],或者可能是对多个种群的横扫[40].BayeScan还通过比较每个位点的两种模型(选择vs.无选择)的后验概率来检验选择[14].继foland Gaggiotti(2.1版;(14]),包括选择在内的模型的后验概率大于0.91的位点被认为是“强”F圣离群值的候选人。然后,我们挖掘了向日葵QTL文献,以确定任何其置信区间与本研究中确定的假定的局部适应SNP共定位的QTL,因为这样的重叠位点可能是未来研究特别有吸引力的候选区域。共定位信息是通过先前发表的向日葵杂交研究获得的[32,41- - - - - -44].
结果
表型多样性
我们在五个样本区域中发现了许多表现出差异的性状,其中纬度是开花时间、株高、分枝和许多籽油性状等性状表型多样性分配的重要因素(表2)2;额外的文件1).来自南部地区的个人(德克萨斯州和俄克拉荷马州,地区1和2;表格2;额外的文件1)与来自萨斯喀彻温省、北达科他州和蒙大拿州(第4和第5区;表格2;额外的文件1).脂肪酸组成数据也显示了一些有趣的趋势,饱和类型(即棕榈酸和硬脂酸)显示出如上所述的相同类型的区域分化。而不饱和脂肪酸(即油酸和亚油酸)在区域间没有显著差异。不同地区籽粒含油量差异不显著(表2)2;额外的文件1).除了上述种子油中饱和脂肪酸百分比的差异外,不同地区的种子长度也随纬度有显著差异。虽然种子重量和种子宽度都表现出一些区域差异,但这两个性状的差异不是由纬度引起的,因为最南部的地区与最北部的地区在这两个性状上没有显著差异(表2)2;额外的文件1).值得注意的是,饱和脂肪酸含量和开花时间的纬度变化趋势与以往研究结果一致[45,46].总分支在地区间表现出显著差异,但在纬度上没有明显的变化趋势。然而,来自德克萨斯州和俄克拉荷马州的植物(地区1和2;表格2;额外的文件1)的顶部分支明显多于北部三个地区。其他植物结构特征,如分支长度和二级、三级或更高阶分支的程度,在区域之间有显著差异,但这些差异同样没有显示出纬向格局(表2)2;额外的文件1).有趣的是,在所有五个区域之间,没有性状表现出显著的差异(表2;额外的文件1).
群体遗传结构
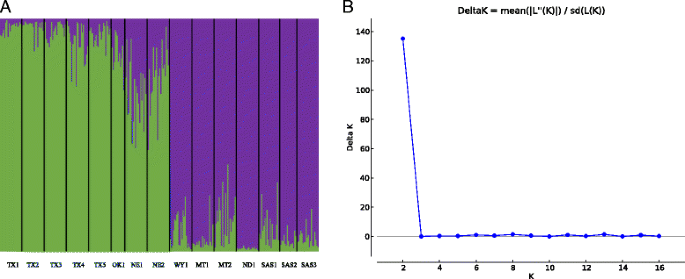
对15个居群的遗传统计数据的计算显示,野生向日葵的遗传多样性在整个范围内都是巨大的,尽管是可变的3.).在遗传多样性水平降低的范围内,没有向任何纬度极端方向发展的趋势(表3.).然而,两个群体(WY1和ND1)的多态位点比例明显低于其他13个群体。分子方差分析显示,大约20%的观察到的遗传变异可归因于群体水平分化(数据未显示)。在其余的遗传变异中,76%出现在个体内水平,而仅4%出现在个体间水平。结构[37]的数据分析加上三角洲K群体遗传簇最可能数目的确定方法[39)确定K= 2簇(图;2).的结构条形图K= 2显示出南北分界,区域3的中东部部分对应一个过渡区(图2)。2).另外一个只包含最南端6个种群的结构运行也表明了这一点K= 2。在这个层次上K在德克萨斯州和俄克拉荷马州发现的其余五个种群中,TX1被分离出来K= 6显示次要峰值(附加文件2,3.,4).当STRUCTURE对最北端的六个种群进行分析时,K= 2也是最受支持的遗传群数量。与该范围南部的结果相似,在该范围北部,只有一个种群(ND1)与其他5个种群分离K= 2(附加文件5和6).此外,由于最初的完整数据集结构分析表明,三个中纬度种群中的两个更南,而另一个种群更北,我们进行了更多的结构分析,以探索中间范围内的分化。为了研究中纬度人群,我们将NE1和NE2添加到南部数据集,并将WY1添加到北部数据集以进行进一步测试。当我们对这些较大的分组进行结构分析时,我们发现K北部星团= 3。这三个聚类分别对应于ND1、WY1和其余居群。此外,我们发现K南部聚类= 2,其中一个聚类对应NE2个体,另一个聚类包含其余7个种群。
异常识别
多个离群点识别程序强调了一组重叠的位点的存在,这些位点表现出了局部适应的特征(表4).Arlequin鉴定了8个高度分化的F圣计算(所有可能成对的F圣组合;99%置信区间)。这些位点包括:LG4上1个无注释的SNP;两个snp位于lg6远端附近,一个在HaFT2(46,47]另一个位于与丝裂原激活蛋白激酶同源的基因中;在一个基因的LG7上有一个SNP,与犰狳重复蛋白家族中的一个基因高度相似答:芥;在GRAS/DELLA转录因子的LG10上有一个SNP时至今日;LG 12上的两个snp,一个对应一个ef -hand样结构域的基因,另一个对应一个功能未知的蛋白质;1个SNP位于lg14上,与lg14基因高度相似角质层脊有缺陷(DCR)答:芥。BayeScan通过识别3个高度分化的位点(snp)提供了互补的异常值结果DCR同源物,即GRAS/DELLA转录因子,以及含有ef -hand样结构域的基因)已经被Arlequin强调。4个位点与Arlequin和BayeScan均有显著低分化的证据。lg13上有两个低分化位点,其中一个SNP位于具有α - β辫核苷酸结合作用的基因上,另一个SNP位于与5 ' - amp活化蛋白激酶同源的基因上。糖苷水解酶和鸟苷酸结合基因中的SNPs也有异常低的F圣,并分别在lg8和lg17上发现(数据未显示)。
SNP异常值与已知QTL的共定位
我们将8个过度分化位点的位置与之前绘制的向日葵QTL的位置进行了比较,以确定可能涉及局部适应的性状。在lg4上,一个未标注的基因与叶片数量的QTL共定位[44].如上所述,lg6的远端包含两个F圣离群值:HaFT2还有一个可能具有激酶功能的基因。在两个向日葵定位群体(ANN1238 × CMS 89)中,这两个QTL都与开花时间相关。32]和ANN1238 × Hopi [42].这个基因组区域实际上包含多个安顿下来假字,包括HaFT1,这已被证明对栽培向日葵的光周期反应很重要[46,47].该地区除了与开花时间QTL共定位外,还有形态性状(如瘦果宽度、株高、射线花数)的QTL,甚至还有叶片真菌损伤的QTL。lg7的SNP异常值,来自一个与ARM重复蛋白同源的EST,与开花时间、株高、叶数和头部食草性的QTL共同定位[32,44].有趣的是,Arlequin和BayeScan都强烈支持的两个位点(GRAS/DELLA转录因子和转录因子DCR同源体(分别映射到lgs10和lgs14)未与任何已知QTL共定位。LG12的两个异常值之一,一个未注释的基因,与叶片形状和头数共定位[32].最后,在lg12上发现含有ef -hand结构域的基因与总头(描述分枝程度的一种方式)以及叶和分枝性状的QTL共定位(表2)4).
多种不同性状的低分化位点与QTL共定位。特别有趣的是两个低F圣在lg13上分布在彼此附近的异常值,这些异常值与一组共享的QTL共定位,包括:分枝数、头数、头和叶的食草性、茎粗、瘦果长度、叶面积和茎高[32,42- - - - - -44].
讨论
在野生向日葵的范围内,种群具有异常数量的表型多样性。这些特征在多大程度上有助于当地适应是一个重要的问题,可以通过多种方式解决,包括相互移植、公共花园测量和种群基因组扫描。在我们的分析中,许多性状(如开花时间、株高、植物结构和种子油成分)与纬度有关。向日葵是一种油料作物,人们对其籽油变异的遗传机制进行了大量的研究。在育种系中,强大的人工选择创造了不同的种质群,它们的油脂分布差异极大。在野外,自然选择可能会成为一种强大的力量,影响在特定环境中生活的人群最有益的饱和脂肪酸和不饱和脂肪酸的相对数量。
常见的花园表型变异
种子油成分在不同纬度上有显著的差异。以往对多种物种种子油组成的研究表明,在相对粗糙的地理尺度上,饱和脂肪酸含量与纬度和饱和度呈负相关[45].通过量化向日葵中饱和脂肪酸的百分比,我们能够确定一个类似的趋势(表2;额外的文件1),尽管是在更精细的地理范围内。鉴于这些植物生长在一个普通的花园中,我们可以推断观察到的差异具有遗传基础,并且油生物合成途径的功能多态性存在于野生向日葵的范围内。在不同的环境条件下,种子油中饱和脂肪酸的百分比对于种子的萌发具有重要的进化意义。众所周知,与不饱和脂肪酸相比,饱和脂肪酸每碳储存的可用能量更多[45],但饱和脂肪酸的熔点也高于不饱和脂肪酸;因此,在较低的温度下,相关的能量不太容易获得。由此得出的推论是,在高纬度地区生产不饱和脂肪酸是有利的,因为它确保了在较低的温度下能量的可用性[45].相反,饱和脂肪酸在低纬度地区更好,因为它们的能量更丰富,同时由于相对温暖的温度,它们仍然可以用于发芽的种子。
观察到的开花时间的差异可以用类似的框架来解释。在高纬度地区,生长季节往往较短;因此,提早开花是有好处的,可以让种子在生长季节结束前结子。另外,在低纬度地区,通常有较长的生长季节,这可能会选择开花较晚的植物,这些植物可能会长得更大,并产生更多和/或更高质量的种子。然而,必须指出的是,株高和开花时间是发育相关的;因此,它们形成了一系列相互关联的特征[48,49].在这项研究中看到的分化证实了Blackman等人记录的一些多样性模式,[46],生长16 h时,北方种群开花时间明显早于南方种群。虽然常见的花园方法确实分离了基因型对性状变异的影响,但应该注意的是,这样的方法确实排除了基因型-环境(G × E)相互作用的研究。因此,在整个范围内的相互移植将有助于进一步描述上述特征在局部适应中的相关性。虽然不是本研究的重点,但应该指出的是,正如Kooyers等人所表明的那样,海拔高度也是一系列特征差异的一个可能原因。[50].
群体遗传结构
对整个数据集的结构分析揭示了野生向日葵自然范围的总体南北划分,内布拉斯加州和怀俄明州附近出现了一个过渡区。以前的样本h . annuus基因多样性暗示了类似的南北分化[51],我们的分析建立在这一发现的基础上,通过增加每个种群内的标记密度和采样密度。从历史上看,这一纬度样带有类似的遗传分化模式。例如,使用移植花园,麦克米兰[52]表明,多个草地物种在开花时间上表现出遗传差异,其中北方种群开花时间明显更早。当对北方和南方个体子集进行进一步的结构分析时,发现我们的数据集中存在分层结构。换句话说,在整个数据集中发现的巨大的南北分裂可能掩盖了区分个体种群的更微妙的模式。
候选适应位点
在群体遗传分化方面,我们发现了一些有趣的可能的候选者,以赋予开花时间的局部适应。我们在第6号染色体上发现了两个具有SNPs的离群位点,它们与一个假定具有激酶活性的基因共定位HaFT2。这两个位点都与之前确定的开花时间QTL共同定位,[32,42]以及其他特征(表4).FT2是一种拟南芥同源物已被证明在促进开花中发挥重要作用[53].此外,该基因所在的向日葵lg6区域先前已被证明会影响驯化向日葵与野生向日葵的开花时间[32,42,47].值得注意的是,这些组合的亲本由野生×作物和野生×地方组成。这一区域的连锁不平衡(LD)的程度目前尚不清楚,尽管以前的工作表明,平均而言,LD在野生向日葵中衰减很快[54].对栽培种质资源的研究表明,向日葵基因组中的LD存在差异[55].除了映射信息,HaFT2由于之前在野生范围内的基因表达工作,这是一个特殊的本地适应候选者吗h . annuus(46].在短时间内,基因表达出现了突变HaFT2其中北方个体表现出高于南方个体的表达,这与该基因在适应性分化中发挥作用一致[46].我们的研究结果进一步证明HaFT2通过对该基因提供选择的群体遗传证据,在基因表达上显示出与选择的影响相一致的纬向cline。
我们在其他染色体上发现了群体分化值显著升高的snp。lg14上的一个强分化SNP位于向日葵的同源物中角质层脊有缺陷(DCR).在答:芥,突变体DCR改变叶片生长过程中的毛状体发育[56,57].毛状体在植物中有多种功能,包括:反射阳光以防止伤害[58]、水的潴留[59],以及防御[60].由于上述许多因素可能与生长季节有关,在没有额外数据的情况下很难得出任何结论。例如,我们不能得出结论,本文所记录的变异在本质上是因果关系。相反,它们为我们提供了一个可供进一步研究的候选适应区域的初步库。此外,由于我们缺乏关于这些基因组区域的连锁不平衡强度的知识,这些snp可能只是与附近基因中发现的因果多态性有关。
这些F圣异常值构成了未来实验可能的候选基因列表。重要的是,需要在这些基因组区域中评估连锁不平衡的程度,以确定种群结构升高区域的大小。对某些snp缺乏共定位QTL的一个可能解释是,向日葵目前不存在野生×野生定位群体。另外,许多细微的(毛状体密度或形态)和生化表型尚未测量,因此不可能与种群分化共定位。标记密度已成为自然群体局部适应基因组扫描研究的主要限制[61].限制性内切位点相关DNA测序(RAD-seq)和测序基因分型(GBS)等高通量方法的出现,使研究人员能够获得大量标记物和均匀的基因组分布[62- - - - - -64].
结论
本研究利用246个位点对一种重要经济作物野生祖系的遗传多样性和结构进行了表征。这些标记清楚地表明,北纬40°左右的南北种群之间存在遗传分离,内布拉斯加州的种群似乎是混合的(图2)。2).本研究还根据其群体遗传分化的程度,生成了多个用于局部适应的候选基因组区域。这些基因组间隔与以前的性状映射实验相关的程度也被考虑在内。这些位点代表了更大的物理基因组间隔,这将是未来分子进化分析、跨范围基因表达比较和实地研究的重点,以进一步研究它们在局部适应中的假定作用。
缩写
- AMOVA:
-
分子方差分析
- g × e:
-
环境分基因型
- GBS:
-
测序分型
- HO:
-
观察到的杂合性
- LD:
-
连锁不平衡
- 格林:
-
连锁群
- 核磁共振:
-
核磁共振
- QTL:
-
数量性状位点
- RAD-seq:
-
限制位点相关DNA测序
- SNP:
-
单核苷酸多态性
- 呃e:
-
无偏期望杂合度
参考文献
- 1.
Kawecki TJ, Ebert D.地方适应的概念问题。生态学报2004;7(12):1225-41。
- 2.
桑巴提JB,赖斯KJ。加州蛇形向日葵的本地适应、选择模式和基因流(向日葵exilis).进化。2006;60(4):696 - 710。
- 3.
李志强,李志强,李志强。不同土壤类型的基因组分析揭示了土壤局部适应的候选基因拟南芥lyrata。公共科学图书馆,2008;3(9):e3183。
- 4.
Turner TL, Bourne EC, Von Wettberg EJ, Hu TT, Nuzhdin SV。种群重测序揭示了局部适应拟南芥lyrata到蛇形土壤。中国科学,2010;42(3):260-3。
- 5.
Knight CA, Vogel H, Kroymann J, Shumate A, Witsenboer H, Mitchell-Olds T.表达谱分析与局部适应Boechera holboellii种群在自然发生的水压力梯度上的水利用效率。分子生态学报,2006;15(5):1229-37。
- 6.
李志刚,李志刚,李志刚,等。环境和遗传对南、北居群开花差异的影响拟南芥lyrata(十字花科)。中国科学(d辑),2004;29(4):344 - 344。
- 7.
杨,杨晓明,杨晓明,等。两种植物叶片暗呼吸的温度适应和驯化潜力毛茛属植物来自温暖和寒冷的栖息地。北极高山决议,1997;29(1):122-5。
- 8.
索克VL, Stowe KA, Hochwender C.北方红橡树邻近亚居群的局部适应证据(Quercus rubraL)表现为对叶类食草动物的抵抗。中国地质大学学报(自然科学版),1993;29(6):344 - 344。
- 9.
Johnson NC, Wilson GWT, Bowker MA, Wilson JA, Miller RM。资源限制是菌根共生中局部适应的驱动因素。美国国家科学院。2010年,107(5):2093 - 8。
- 10.
美世KL, Wyse DL, Shaw RG。竞争对不同野生居群和作物系野生和作物-野生杂交向日葵适应度的影响。进化。2006;60(10):2044 - 55。
- 11.
李万廷,李文华,李文华,等。基因频率分布对多态性选择中性理论的检验。遗传学。1973;74(1):175 - 95。
- 12.
Beaumont MA, Nichols RA。评估用于群体结构遗传分析的基因座。中国生物医学工程学报(自然科学版)1996;39(1):1 - 7。
- 13.
L, Lischer HE。Arlequin套件3.5:在Linux和Windows下执行群体遗传学分析的新系列程序。分子生态学报,2010;10(3):564-7。
- 14.
Foll M, Gaggiotti O.一种基因组扫描方法来识别适合显性和共显性标记的选择位点:贝叶斯视角。遗传学。2008;180(2):977 - 93。
- 15.
Polley SD, Chokejindachai W, Conway DJ。基于等位基因频率的分析在疟疾疫苗候选抗原的平衡选择下稳健地绘制了序列位点。遗传学。2003;165(2):555 - 61。
- 16.
Cagliani R, Fumagalli M, Riva S, Pozzoli U, Comi GP, Menozzi G, Bresolin N, Sironi M.人类防御素β -1启动子长期平衡选择的签名。中国生物工程学报。2008;9:R143。
- 17.
Prunier J, Laroche J, Beaulieu J, Bousquet J.北方黑云杉气候适应相关基因snp的基因组扫描和分子水平的选择估计。分子生态学报,2011;20(8):1702-16。
- 18.
Nielsen EE, Hemmer-Hansen J, Poulsen NA, Loeschcke V, Moen T, Johansen T, Mittelholzer C, Taranger GL, Ogden R, Carvalho GR.高基因流海洋生物局部定向选择的基因组特征;大西洋鳕鱼(Gadus morhua).9.中国生物医学工程学报,2009;
- 19.
Bollmer JL, Ruder EA, Johnson JA, emes JA, Dunn PO。漂变和选择影响草原鸡免疫位点的地理变异。分子生物学,2011;20(22):4695-706。
- 20.
Richter-Boix A, Quintela M, Segelbacher G, Laurila ARana arvalis。分子生态学报,2011;20(8):1582-600。
- 21.
Coop G, Witonsky D, Di Rienzo A, Pritchard JK。利用环境相关性来确定潜在的局部适应位点。遗传学。2010;185(4):1411 - 23所示。
- 22.
Kooyers NJ, Olsen KM。引种北美白三叶草的适应性氰化渐变的快速进化(三叶草被l .)。分子生态学报,2012;21(10):2455-68。
- 23.
Stinchcombe JR, Weinig C, Ungerer M, Olsen KM, Mays C, Halldorsdottir SS, Purugganan MD, Schmitt j拟南芥由开花时间基因调节FRIGIDA。美国国家科学院。2004; 101(13): 4712 - 7。
- 24.
Balasubramanian S, Sureshkumar S, Agrawal M, Michael TP, Wessinger C, Maloof JN, Clark R, Warthmann N, Chory J, Weigel d光敏色素C光受体基因介导植物开花和生长反应的自然变异拟南芥。中国科学。2006;38(6):711-5。
- 25.
Ingvarsson PK, Garcia MV, Hall D, Luquez V, Jansson sphyB2,这是一种在欧洲白杨中跨越纬度梯度的日长诱导生长停止和芽集的候选基因(杨树tremula).遗传学。2006;172(3):1845 - 53年。
- 26.
王晓明,王晓明,王晓明,等。植物自适应多态性的研究进展果蝇在两个大陆上通过平行的独立临床研究生活史。分子生物学,2010;19(4):760-74。
- 27.
穆伦LM,胡克斯特拉HE。沿着环境梯度的自然选择:小鼠色素沉淀的经典渐变。进化。2008;62(7):1555 - 69。
- 28.
暴击GD。在公元前5千年驯化向日葵的时间背景-来自田纳西州中部的新证据。古物学报。1993;58(1):146-8。
- 29.
Harter AV, Gardner KA, Falush D, Lentz DL, Bye RA, Rieseberg LH北美洲东部现存的家养向日葵的起源。大自然。2004;430(6996):201 - 5。
- 30.
Blackman BK, Scascitelli M, Kane NC, Luton HH, Rasmussen DA, Bye RA, Lentz DL, Rieseberg LH北美东部向日葵驯化等位基因支持单一驯化中心。美国国家科学院。2011; 108(34): 14360 - 5。
- 31.
施奈德AA,美国农学学会。美国作物科学学会。,Soil Science Society of America. Sunflower technology and production. Madison: American Society of Agronomy : Crop Science Society of America : Soil Science Society of America; 1997.
- 32.
Burke JM, Tang S, Knapp SJ, Rieseberg LH。向日葵驯化的遗传分析。遗传学。2002;161(3):1257 - 67。
- 33.
柯克斯博士。转换分析。中国社会科学院学报(自然科学版),2004;26(2):366 - 366。
- 34.
巴赫拉瓦E,泰勒CA,唐S,鲍尔斯JE,曼德尔JR,伯克JM,纳普SJ。向日葵SNP的发现与高密度基因分型阵列的建立。公共科学学报,2012;7(1):e29814。
- 35.
细分居群的基因多样性分析。美国国家科学院。70(12): 3321 - 1973; 3。
- 36.
Peakall R, Smouse PE。GENALEX 6: Excel基因分析。群体遗传教学和科研软件。Mol Ecol Notes 2006;6(1): 288-95。
- 37.
王晓燕,王晓燕,王晓燕,等。基于多位点基因型数据的种群结构推断。遗传学。2000;155(2):945 - 59。
- 38.
Earl DA, Vonholdt BM。STRUCTURE HARVESTER:一个用于可视化结构输出和实现Evanno方法的网站和程序。自然资源学报。2012;4(2):359-61。
- 39.
李志强,李志强,李志强,等。利用软件STRUCTURE检测个体聚类的数量:模拟研究。分子生态学报,2005;14(8):2611-20。
- 40.
陈J,卡拉曼T,马XF,脾气G, Morgante M, Lascoux M .识别自然选择的基因签名使用池人口测序在挪威云杉。G3(贝塞斯达)。2016;10.1534 / g3.116.028753。
- 41.
Burke JM, Knapp SJ, Rieseberg LH。栽培向日葵进化过程中选择的遗传后果。遗传学。2005;171(4):1933 - 40。
- 42.
威尔斯DM,伯克JM。向日葵早期驯化的数量性状位点分析。遗传学。2007;176(4):2589 - 99。
- 43.
Baack EJ, Sapir Y, Chapman MA, Burke JM, Rieseberg LH。作物-野生向日葵杂交种驯化性状和数量性状位点的选择。分子生物学杂志,2008;17(2):666-77。
- 44.
Dechaine JM, Burger JC, Chapman MA, Seiler GJ, Brunick R, Knapp SJ, Burke JM。向日葵作物-野生杂交种植物-食草动物相互作用的适应性效应和遗传结构。植物学报。2009;184(4):828-41。
- 45.
植物种子油的适应性进化:解释种子油中饱和脂肪酸和不饱和脂肪酸的生物地理分布。自然科学进展。2000;26(4):442-58。
- 46.
Blackman BK, Michaels SD, Rieseberg LH。向日葵适应过程中将太阳与开花联系起来。分子生物学,2011;20(17):3503-12。
- 47.
Blackman BK, Strasburg JL, Raduski AR, Michaels SD, Rieseberg LH。最近衍生的角色英国《金融时报》向日葵驯化中的平行谱线。动物学报,2010;20(7):629-35。
- 48.
Koester RP, isco PH, Stuber CW。两个玉米近等基因系控制开花天数和株高的数量性状位点的鉴定。作物科学1993;33:1209-16。
- 49.
张晓东,张晓东,张晓东,张晓东,张晓东,等。春季油菜开花时间和株高QTL的标记回归定位(大麦芽l .)十字架。遗传。1996;77:64 - 73。
- 50.
郭志刚,李志刚,王志刚,王志刚。干旱胁迫对植物生长的影响Mimulus guttatus。新植物,2015;206:152-65。
- 51.
曼德尔,迪凯因JM,马立克LF,伯克JM。栽培向日葵的遗传多样性、群体结构及其与野生向日葵的比较向日葵[j] .理论与实践。2011;29 (5):366 - 366 .]
- 52.
McMillan C.生态变异在北美中部草地分布中的作用。生态学报,1959;29(4):285-308。
- 53.
Turck F, Fornara F, Coupland G.开花植物的调控与鉴定:开花位点T走向中心。植物学报。2008;59:573-94。
- 54.
刘A,伯克JM。野生和栽培向日葵核苷酸多样性的模式。遗传学。2006;173(1):321 - 30。
- 55.
Mandel JR, Nambeesan S, Bowers JE, Marek LF, Ebert D, Rieseberg LH, Knapp SJ, Burke JM。向日葵的关联作图及选择的基因组结果。公共科学学报,2013;9(3):e1003378。
- 56.
Marks MD, Wenger JP, Gilding E, Jilk R, Dixon RA。转录组分析拟南芥野生型和gl3-sst sim毛状体确定了毛状体发育所需的四个额外基因。植物学报。2009;2(4):803-22。
- 57.
王晓燕,王晓燕,王晓燕,等。拟南芥研究进展DCR编码可溶性BAHD酰基转移酶是角质聚酯形成和种子水化特性所必需的。植物科学进展。2009;29(4):344 - 344。
- 58.
Manetas Y.毛的重要性:脱毛对茎光合作用的不利影响Verbascum speciosum是由于太阳的UV-B辐射。新植物,2003;158:503-8。
- 59.
Brewer CA, Smith WK, Vogelmann TC。叶片毛状体、叶片润湿性与水滴光学特性之间的功能相互作用。植物细胞环境。1991;14(9):955-62。
- 60.
莱文哒。毛状体在植物防御中的作用。Q Rev biology, 1973;48(1): 3-15。
- 61.
Flint-Garcia SA, Thornsberry JM, Buckler ES。植物连锁不平衡结构。植物学报。2003;54:357-74。
- 62.
Hohenlohe PA, Bassham S, Etter PD, strenler N, Johnson EA, Cresko WA。基于序列RAD标记的三棘鱼平行适应群体基因组学研究。公共科学学报,2010;6(2):e1000862。
- 63.
Davey JW, Hohenlohe PA, Etter PD, Boone JQ, Catchen JM, Blaxter ML.利用下一代测序发现全基因组遗传标记并进行基因分型。植物学报。2011;12(7):499-510。
- 64.
Elshire RJ, Glaubitz JC, Sun Q, Poland JA, Kawamoto K, Buckler ES, Mitchell SE。一种用于高多样性物种的强大、简单的基因测序(GBS)方法。公共科学学报,2011;6(5):e19379。
- 65.
R核心团队。R.统计计算的语言和环境。R统计计算基金会,维也纳,奥地利,2015。http://www.R-project.org/。
确认
我们感谢佐治亚大学植物育种遗传学和基因组学研究所的斯科特·杰克逊实验室提供的温室空间和实验室设备,以及本·布莱克曼提供的设备安顿下来探针设计序列。我们感谢伯克实验室的成员对这个手稿的早期版本的评论。特别感谢Caitlin Ishibashi和Jeff Roeder在DNA提取方面的协助以及Shannon Ritter, Michael Cherry和Shreyas Vangala在表型方面的协助。
数据和材料的可用性
表型分析包括在与本文相关的电子补充材料中。基因分型资料已存入Dryad数码资料库(http://dx.doi.org/10.5061/dryad.6p1c4).
作者的贡献
EVM和JMB构想了这项研究。EVM进行了普通花园表型、SNP基因分型和群体遗传分析。JC设计SNP芯片探针并协助基因分型。EVM和JMB根据JC的意见起草了手稿。所有作者都阅读并批准了最终的手稿
相互竞争的利益
作者宣称他们之间没有利益冲突。
资金
本研究由美国国家科学基金会植物基因组研究计划(DBI-0820451和DBI-1444522)资助。
发表同意书
不适用。
伦理批准并同意参与
不适用。所有的种子都是从美国农业部收集的
作者信息
从属关系
相应的作者
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
McAssey, e.v., Corbi, J. & Burke, J.M.野生向日葵表型和遗传分化范围。BMC植物生物学16日,249(2016)。https://doi.org/10.1186/s12870-016-0937-7
收到了:
接受:
发表:
关键字
- 纬度的变化
- 当地的适应
- 表型分化
- 群体遗传学
- 向日葵