摘要
背景
据预测,气候变化将对农业构成严重威胁,因为作物需要能够承受不断增加的热胁迫。沙漠植物已经适应了高水平的热胁迫,因此它们是识别耐热基因的绝佳系统。Rhazya一成不变是一种常绿灌木,原产于西亚和南亚的极端炎热地区,使其成为研究植物对热应激反应的绝佳系统。叶尖和成熟叶的转录组r .一成不变在一天中不同时间点的不同温度下进行分析,以检测可能赋予植物耐热性和保护光合装置的热响应机制。
结果
白天交叉的生物途径包括几种与热应激相关的化合物的生物合成,包括可溶性糖、多元醇、次生代谢物、酚类物质和蛋氨酸。在一天中最热的时间(40-42.4℃),转录本高度下调的包括编码细胞周期蛋白、细胞色素p450/secologanin合成酶和含有U-box蛋白的基因,而转录本大量上调的包括编码热休克蛋白(HSPs)、伴侣蛋白、udp -糖基转移酶、水通道蛋白和蛋白透明testa 12的基因。编码HSPs、伴侣蛋白和udp -葡萄糖基转移酶的转录本上调,编码U-box蛋白的转录本下调,可能有助于植物的耐热性r .一成不变通过纠正蛋白质折叠和防止蛋白质降解。在热应激下调控编码热休克蛋白及其伴侣基因表达的转录因子包括HSFA2 - 4、AP2-EREBP和WRKY27。
结论
本研究为野生植物耐热性调控机制的研究提供了新的视角r .一成不变这是一种干旱地区,常见于阿拉伯半岛和印度次大陆的多年生常绿灌木。来自几种途径的酶在可溶性糖、多元醇、次生代谢产物、酚类物质和蛋氨酸的生物合成中相互作用,是该物种耐热性的主要贡献者。
背景
预测的气候变化可能对农业和食品安全构成严重威胁[1- - - - - -3.].到本世纪末,根据工业排放的不同,预计最高气温将上升2°C以上[4].热胁迫对作物的生长和生产力是最有害的影响之一[5].这些影响包括叶片的一些生理变化,如低光合速率和代谢产物积累的变化[6- - - - - -8].综合胁迫的总体影响是改变蛋白质稳态[9],包括蛋白质合成、细胞内分选、折叠和降解的控制[10].
植物对热胁迫的耐受性是一个多基因过程,在植物发育过程中有许多调控机制[11,12].热应激损伤和反应在植物叶片中更为明显[1]和花粉[13]在有性生殖过程中比其他组织更有效。植物对热胁迫的反应是合成热休克蛋白[14)(休克)。转录丰富的HSPs及其伴侣已被证明与热应激耐受性有关[15,16].热休克蛋白被认为是分子伴侣(如热休克蛋白)., HSP90, HSP70和HSP60)控制其他蛋白质的稳定性和折叠,以保护错误折叠的蛋白质不可逆聚集[17- - - - - -20.].
一般来说,植物细胞通过调节异化和同化之间的能量代谢来耐受热应激[21],通过清除抗氧化酶[22]以及减少活性氧(ROS)的解毒作用,活性氧会导致膜脂质和色素的过氧化,从而导致膜渗透性的丧失[23,24].后一种作用需要抗氧化基因的高水平表达,以帮助赋予植物耐热性。
组学已被广泛应用,为提高植物耐热性的育种计划提供有价值的信息。在最近的报道中,约5%的植物转录本由于热胁迫而高度上调[25- - - - - -27].上调转录本包括编码伴侣蛋白[7,25],而另一些则参与钙/植物激素/脂质信号、磷酸化、糖积累、次生代谢和许多其他生物过程[28].
转录因子(TFs)是生命中几乎所有生物合成途径调控所必需的关键蛋白质[29].它们对生物的发育和所有细胞功能以及对生物和非生物应激的反应都很重要[30.].在之前的研究中[31],在多年生常绿植物C3.沙漠灌木Rhazya一成不变Mapman分析。这种灌木在干旱的高温和蒸汽压不足的环境下生长良好。正午时分,编码基本螺旋-环-螺旋(bHLH)、同源盒结构域(HB)、MYB和AP2-ERF的基因家族表达显著降低[31].
在本研究中,我们扩展了Yates等人先前的努力。31通过研究叶尖和成熟叶的转录组Rhazya一成不变在不同的白天温度下,对植物光合装置的耐热性和保护有关的热响应机制有新的认识。这种机制可能是通过转基因提高重要经济作物耐热性的一个目标。
结果与讨论
在一天中不同时间的不同温度下基因表达的集群
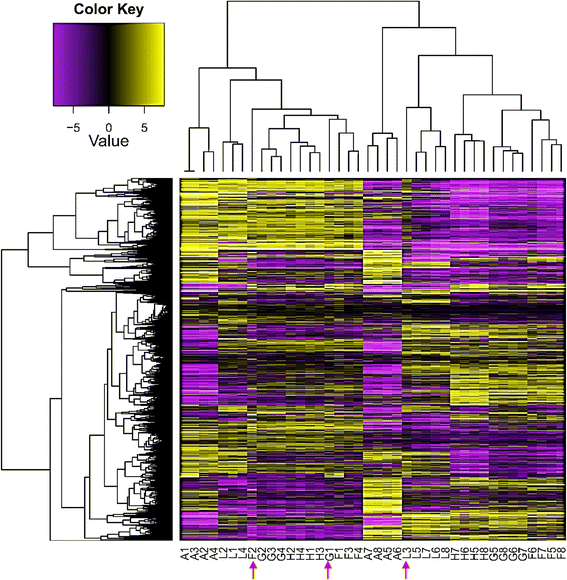
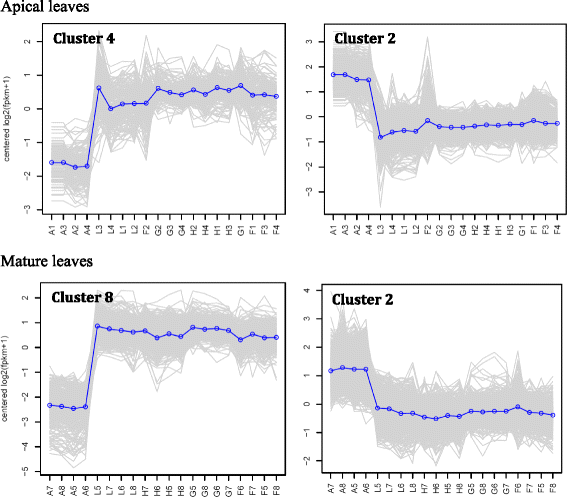
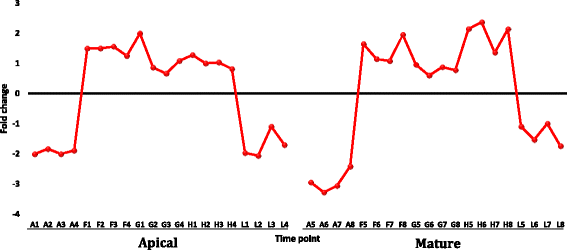
利用RNA-Seq分析分析了两种不同叶型的尖叶和成熟叶,以检测热响应基因在两种不同叶型中的表达是否相似。这两种类型的叶子在发育阶段和细胞分裂状态上存在差异,这可能会对热反应基因产生不同的影响。我们推测,这种植物器官将为热胁迫下的反应基因家族和生物学途径提供丰富的信息。三个中午时间点(13:25,14:05,14:30)的温度(40-42.4°C)比早上时间点(07:10)的温度(27.4°C)高12.6-15°C,证实了这一点Rhazya一成不变与早上相比,在中午的时间点经历了热应激。我们推测,在不同时间点比较同一植物的转录组,例如,黎明(非胁迫)和正午(胁迫),而不是在给定时间点比较胁迫和非胁迫植物的转录组,例如,中午,将获得更准确的结果。此外,很难控制植物在田间生长的环境条件。基于对数比RPKM数据的基因表达层次聚类分析r .一成不变当天不同时间点的根尖叶和成熟叶的SRA数据库表明,40个样本中37个重复的时间点内聚类证明了高质量的采样和RNA-Seq分析(图2)。1).当研究顶端叶和成熟叶中不同表达模式的基因时,也得到了类似的结论(附加文件)1:表S1和附加文件2:表S2和附加文件3.:图S1和附加文件4:图S2)。唯一不一致的样本(图。1(红色箭头)为顶叶样本F2、G1和L3;F2与黄昏时的顶叶样本聚在一起(L), G1与正午F时间点的顶叶样本聚在一起,L3与黄昏时的成熟叶样本聚在一起。一般来说,成熟叶的采样结果比顶端叶的数据更均匀。从不同时间点的根尖叶RNA-Seq分析中得到的DE转录本数量为32个簇中的2507个(附加文件)1:表S1)。在38个簇中,成熟叶片中不同时间点的DE转录本数量为4853个(附加文件2:表S2)。我们可以推断,与顶端分生叶相比,成熟叶在一天中富集的基因数量更多的一个关键原因是后者在细胞分裂和细胞分化中更活跃[32].图中显示了两种叶片类型经常使用的从中午开始上调或下调的簇。2.
使用随机选择的10个基因的半定量RT-PCR验证RNA-Seq数据,在三个时间点,即上午(A),中午(F-H)和黄昏(L),对两种类型的叶子进行三次重复(附加文件)5:图S3)。这10个基因的表达模式包括中午开始上调和逐渐下调(附加文件)6:表S3)。对所选基因进行半定量RT-PCR的结果证实了RNA-Seq数据在两种叶片和三个时间点上的折叠变化。
差异表达基因分析
KEGG分析
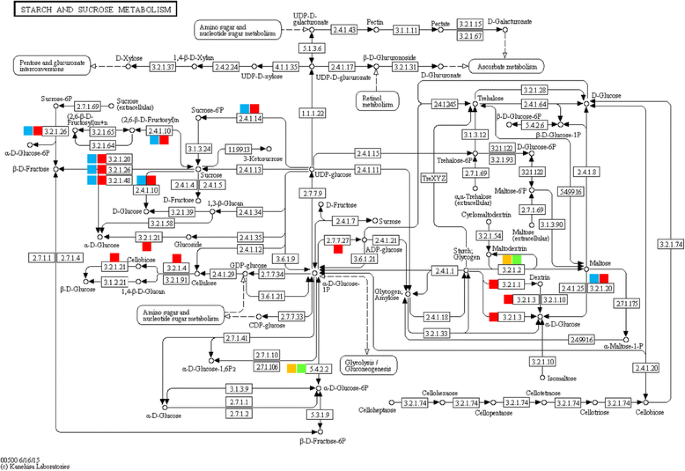
目的:确定在叶尖和成熟叶中活跃的生物学途径r .一成不变白天,我们将检测到的基因绘制成参考京都基因和基因组百科全书(KEGG) (http://www.genome.ad.jp/kegg/).耐热性是一个多基因过程,不同的代谢途径影响植物的生长[12].在顶叶和成熟叶中,研究了在热胁迫下白天调控途径中起作用的酶1和无花果。3.而且4和附加文件7:图S4,附加文件8:图S5,附加文件9:图S6,附加文件10:图S7和附加文件11:图S8)。
KEGG分析表明,可溶性糖、多元醇、次生代谢产物、酚类物质和蛋氨酸的生物合成参与了植物耐热性的形成r .一成不变.淀粉和蔗糖代谢途径的结果表明,12种酶参与了对热应激的反应(表2)1和无花果。3.).最明显的反应是几种可溶性糖的合成,如蔗糖、果糖和葡萄糖,以及淀粉和麦芽糖的消耗,主要是通过蔗糖-磷酸合成酶、左旋蔗糖酶、麦芽糖酶、蔗糖酶和转化酶的作用。早先关于桑葚和大豆中的蔗糖磷酸合酶和转化酶的报道记录了它们在热胁迫下的抑制作用[33,34].因此,在这两种植物中,可溶性糖的积累并不是对白天热应激的反应。淀粉的损耗r .一成不变白天对可溶性糖的产生可以被认为是一个有利的行动只有在晚上。因此,在白天高温胁迫下,ADP葡萄糖焦磷酸化酶(AGPase)的激活r .一成不变导致糖原的合成,在白天提供持续的淀粉供应。这种转变使细胞内的胞质碳汇强度最大化[35].克拉森斯基和约纳克[36]也表明AGPase和其他酶在光合作用时质体中淀粉的生成中起积极作用。糖原不太可能在白天在叶子中转化为麦芽糖r .一成不变作为这种作用的酶,β-淀粉酶[37,38,被压抑了。因此,我们可以得出结论,可溶性糖和淀粉都有利于积累r .一成不变在白天。
劳森等人[39]在研究植物的光合能力时发现了耐热性的证据r .一成不变在与我们研究相同的时间和场地条件下。证据涉及到极大期的发生在活的有机体内耐热Rubisco的羧化能力[40](高达50°C)。在Lawson和我们的实验中记录的温度是43°C。萨尔乌奇和克拉夫特-布兰德纳[41]表明,两种Rubisco活化酶(RCA)异构体在如此高温下的热不稳定性是光合能力的主要限制。该酶在光合作用中起着重要的调节作用,因为它催化Rubisco催化位点的糖磷酸盐的去除[42].糖磷酸盐因其与Rubisco结合并阻止氨甲酰化过程而在减缓光合作用中起作用而闻名[42].本研究的结果支持Lawson等人的结果。[39因为我们检测到一个编码rubisco亚单位结合蛋白α的基因在正午期间在两种叶片类型中上调(图2)。5).编码蛋白结合Rubisco小亚基和大亚基,并参与酶低聚物的组装。该基因在正午时的上调确保了光合作用期间热稳定性Rubisco的持续供应。此外,在红枫成熟叶片中检测到两种RCA形式(RCA1和RCA2),它们是热胁迫下适当光合能力的薄弱环节r .一成不变,而在顶叶中仅检出一种形态。在本研究中,这些酶亚型仅在黄昏时下调(图。6).白天两个RCA基因的连续表达保证了热应激下酶异构体的生物合成,从而促进光合作用。这些结果增加了对耐热性机理的理解r .一成不变.
热胁迫下苜蓿叶片半乳糖代谢途径酶活性的研究r .一成不变支持可溶性糖(如蔗糖、葡萄糖和半乳糖)的积累,以及几种多元醇(如肌醇、山梨醇、甘露糖、甘油)的合成,这是由于α-半乳糖苷酶(或蜜氨酸酶)的活性(表1和无花果。4).这种酶的类似物,即β-半乳糖苷酶(或乳糖酶),通过半乳糖聚糖和乳糖的转化参与半乳糖的合成。众所周知,淀粉和糖原对变化的环境非常敏感。43- - - - - -46].这两种化合物的代谢对细胞内碳和能量的储存都很重要[47].黄芪叶片日间淀粉、蔗糖代谢及半乳糖代谢相关酶活性的研究r .一成不变导致可溶性糖的积累,可作为渗透剂维持细胞膨胀,保护膜和蛋白质免受不同的非生物应力造成的损伤。多元醇是相容的溶质,具有稳定蛋白质和清除羟基自由基的能力,以防止膜和酶在非生物应激(包括热应激)下的氧化损伤[48].与我们的结果一致,许多报告表明,耐胁迫植物在不利条件下积累了大量的保护性代谢物,如可溶性糖和多元醇[40,44].罗莎等人。49]还发现蔗糖和己糖会上调与生长相关的基因,而下调与压力相关的基因。这种双重反应可能保证在不利条件下的适当增长r .一成不变.
许多次级代谢产物是由初级碳代谢的中间产物合成的[50].苯丙类代谢途径中的重要酶与许多下游次生代谢途径如类黄酮和花青素生物合成相互作用。众所周知,高温应激诱导产生具有耐热性的酚类化合物,如黄酮类化合物和苯丙类化合物[9].苯丙氨酸代谢途径中的关键酶——苯丙氨酸解氨酶(PAL)在白天被激活r .一成不变(表1和附加文件7:图S4)。PAL对热应激反应的活性早前已被报道为主要的适应反应[9在那里,酶会诱导该途径中其他酚类物质的生物合成。酚类物质,包括类黄酮和花青素,早前被报道为非生物应激耐受的关键次生代谢产物[50,51].相反,过氧化物酶在苯丙代谢途径中受到抑制,这表明叶尖和成熟叶中酚类物质的氧化受到抑制r .一成不变在白天。这一作用有助于减少ROS的解毒,以维持细胞膜的通透性[24].
查尔酮合成酶是黄酮类化合物生物合成途径中的第一个酶,在白天被激活r .一成不变(表1和附加文件8:图S5)。这种酶在其他几种途径的协调中也很重要,包括黄酮和黄酮醇生物合成和花青素生物合成。黄酮生物合成途径中与几种重要的中间类黄酮合成有关的另外3种酶,即黄酮3 ',5 ' -羟化酶、黄酮3 ' -单加氧酶和柚皮素3-双加氧酶,也在黄酮类生物合成途径中被激活r .一成不变在高温下。另外两种关键酶,即亮色素还原酶(LAR)和亮色素加氧酶(ucucocyanidin oxygenase)被激活r .一成不变用于生产重要的酚类物质。第一种酶作用于原花青素(PAs)的形成,黄烷-3-醇亚基的聚合物,而第二种酶的作用通过许多途径直接与花青素生物合成途径相连(表2)1和附加文件9:图S6)。早先关于葡萄的报道表明,温度升高会促进PAs的产生[52],可在白天保护植物免受食草动物及紫外线辐射的伤害[53].花青素生物合成途径中的KEGG分析表明,只有一种酶被激活,即udp -葡萄糖:花青素(表1和附加文件9:图S6)。这种关键酶催化了通向细胞中许多花青素最终合成的途径的第一步。
类胡萝卜素生物合成途径中的两种光响应酶也在叶片中受到调控r .一成不变(表1和附加文件10:图S7)。第一种酶玉米黄质环氧化酶在热胁迫下被抑制,而第二种酶紫黄质去环氧化酶被激活。这两种酶在两种类胡萝卜素、玉米黄质和紫黄质的可逆相互转化中起穿梭作用,其活性受光调节[9].结果表明,玉米黄质的生物合成得到了促进,紫黄质的生物合成受到了抑制。玉米黄质以其在细胞中的光保护作用而闻名,因为它还可以防止ROS在非生物应激下引发的膜脂过氧化损伤[24,54].
半胱氨酸和蛋氨酸的代谢途径在成熟叶细胞中受到调控r .一成不变在热应激下对蛋氨酸的过度合成(表1和附加文件11:图S8)由于蛋氨酸合酶、酪氨酸转氨酶和芳香氨基酸转氨酶三种酶的激活。另外两种酶,s -腺苷蛋氨酸合成酶和s -腺苷蛋氨酸脱羧酶,也在顶端和成熟叶中被激活,导致蛋氨酸的消耗。然而,在成熟的叶片中,这可以通过前面提到的三种酶的作用来补偿蛋氨酸的过度合成。由于热胁迫可能抑制了细胞内半胱氨酸合成酶A/B酶,因此半胱氨酸在顶叶和成熟叶中呈负调控。蛋氨酸是叶绿体小热休克蛋白(sHSPs)中的一种主要氨基酸,sHSPs通过保护光系统II电子传递过程来帮助植物适应严重的热胁迫[55].Gustavsson等人[56]还报道了HSP21中的蛋氨酸残基介导热应激下蛋白质的修复。
热胁迫下调控基因家族≥5倍变化
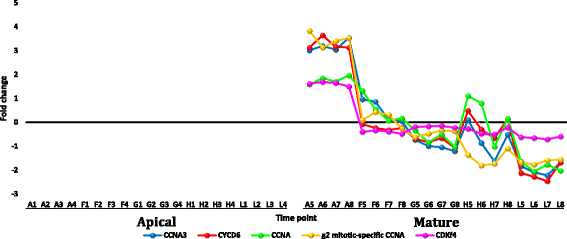
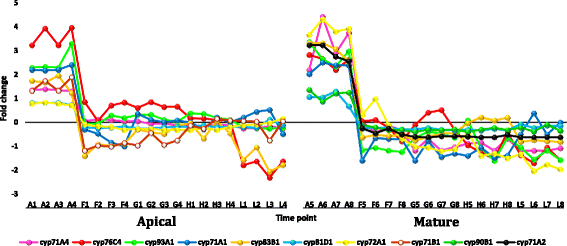
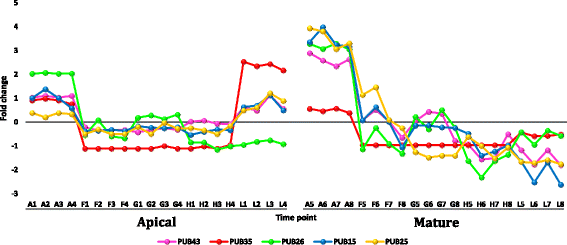
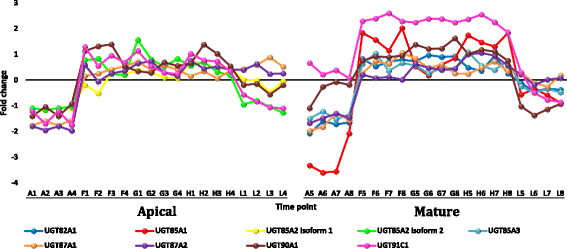
从叶尖和成熟叶的数据集中选择转录本r .一成不变fold change (FC)≥5时显示的下调或上调见附加文件12:表S4。选择性地分析了叶片中成员频繁上调或下调的基因家族r .一成不变或者那些事先知道他们对热应激反应的人。选择的转录本在正午最高温度下表达高度下调r .一成不变包括基因编码周期蛋白,细胞色素p450/secologanin合成酶和U-box包含蛋白质(附加文件12:表S4和图7,8而且9分别)。上调的、丰富的转录本包括编码HSPs/伴侣、udp -糖基转移酶、水通道蛋白和蛋白透明testa的基因12(附加文件)12:表S4和图10,11,12而且13分别)。部分上调转录本在黄昏表现出极端的下调,而在正午没有转录本出现下调,且正午三个时间点(如F、G、H)之间没有差异的调控。
顶叶(A1-L4)和成熟叶(A5-L8) HSPs编码基因在白天(A,上午;F-H,正午& L,黄昏)在r .一成不变.数字参照附加文件13表S5
编码细胞周期蛋白A (CCNA)、A3 (CCNA3)和D6 (CYCD6)的转录本仅在成熟叶片中下调r .一成不变(附加文件12:表S4)。这种植物细胞周期蛋白基因家族有10个类型(A、B、C、D、H、L、T、U、SDS和J18;张等。[57])。A型和D型分别参与S - M期和G1 - S期细胞分裂的调控[58].因此,它很可能是成熟的叶细胞r .一成不变在G1-S阶段因热应激而停滞。与这些发现一致的是,编码周期蛋白依赖激酶(CDK)类f4-like的转录本,通过与周期蛋白结合来调节细胞周期进程,也仅在成熟叶中高度下调,而在根尖叶中上调r .一成不变(附加文件12:表S4)。这只会导致成熟叶片的细胞分裂迅速受到抑制,这可能是通过避免或逃避热胁迫而产生的耐受机制。基于这些结果,应力规避机制不太可能适用于叶尖r .一成不变其主要过程是细胞分裂。最近的研究表明,CDKs通过一种复杂的胁迫规避机制在植物对热胁迫的耐受性中起间接作用[59].
在热胁迫下,编码细胞色素P450 (cyt P450)的转录本被高度下调r .一成不变(附加文件12:表S4)。这涉及7个基因家族的10个基因,cyp71A1, cyp71A2, cyp71A4, cyp71B1, cyp72A1(编码secologanin合成酶), cyp76C4, cyp81D1, cyp83B1, cyp90b1和cyp93A1.然而,Larkindale和Vierling [60]表示下调了18个不同的cyp基因在拟南芥在高温压力下。其他报告表明,其中一些基因参与了其他生物过程。例如,cyp71A1而且cyp72A1(编码secologanin合成酶)基因参与吲哚类生物碱secologanin的合成,而secologanin在合成两种抗癌双吲哚类生物碱长春碱和长春新碱的甲丙酸途径中起重要作用[61].cyp83B1参与葡萄糖苷的生物合成,葡萄糖苷具有抗癌和调味功能[62].cyp71A4参与对病原体攻击的防御反应[63].综上所述,高位下调的幅度很大cyp植物叶片对热胁迫的响应基因r .一成不变尚未完全理解。
在植物叶片中检测到大量编码高敏感蛋白和伴侣蛋白(或伴侣蛋白)的基因转录本上调r .一成不变(附加文件12:表S4和附加文件13:表S5)。这些基因经常被报道参与植物的耐热性(例如,Hu et al. [58])。热休克蛋白是一种保护性蛋白质,作为分子伴侣,可防止蛋白质在热应激时发生错误折叠和聚集或变性[64].最近的报道表明,不依赖于atp的伴侣与sHSPs作为“holdases”,在热应激下抑制蛋白质的聚集并延迟其折叠[65].不依赖于atp的伴侣蛋白还可在热应激下协助蛋白质的重折叠,以恢复蛋白质的原始结构[66].高sps主要有两类,即60至100 KDa的高分子质量或hm -HSPs和15至30 KDa的小高分子sps [64].根据细胞内定位将这两类基因分为5个基因家族。I类和II类为细胞质,而III类、IV类和V类则定位于叶绿体、线粒体或内质网[64,67].在本研究中,植物叶片中编码HMM-HSPs的转录本大量上调r .一成不变白天为I类细胞质,而编码sHSPs的为II类细胞质或III类或IV类叶绿体(补充文件)12:表S4)。不同植物种类的转基因hsp基因,特别是叶绿体(CP)基因对热应激的耐受性增强[68- - - - - -72]主要透过光系统II (PSIIHSP)的保护[55].单位蛋白中CP-sHSPs的数量与耐受水平呈正相关藜而且Lycopersicum esculentum[73].在叶片中,编码udp -糖基转移酶的转录本也大量上调r .一成不变(附加文件12:表S4)。它们涉及5个基因家族的8个基因,ugt82A1,ugt85A1,ugt85A2,ugt85A3,ugt87A1,ugt87A2,ugt90A1而且ugt91C1.该酶在内质网(ER)中新合成糖蛋白的质量控制机制中起着关键作用。该细胞器负责合成/折叠细胞外分泌或传递到内膜系统的蛋白质[74].质量控制包括calnexin (CNX)/calreticulin (CRT)循环,其中包括凝集素伴侣在ER中保留n-糖化蛋白,而它们经历折叠过程。udp -糖基转移酶在折叠过程中作用于未糖基化的蛋白质,并催化调节糖基化,使蛋白质与CNX/CRT结合并保留在内质网中,以继续折叠过程[75].相比之下,在叶片中出现了几个编码含有U-box蛋白的高度下调转录本r .一成不变,如E3泛素蛋白连接酶atl42。这些基因包括pub15,25,26,35而且43(附加文件12:表S4)。U-box蛋白家族代表了一类E3酶(如CHIP),作为HSP70和HSP90的降解联合伴侣[76].这是热应激下蛋白质质量控制的另一种机制,其中热休克蛋白与具有折叠或降解活性的共同伴侣的相互作用决定了热休克蛋白的命运。在转基因拟南芥与过表达pub22而且23基因,两个同源U-box E3泛素连接酶对干旱胁迫过敏[77,78].相反,这两个基因的功能缺失导致耐旱植物的恢复。在我们的分析中,高水平的下调pub23以及在叶片中编码U-box蛋白的其他基因r .一成不变表明这些酶在热应激下对目标蛋白的降解活性不太可能(附加文件)12:表S4)。综上所述,编码HSPs、伴侣蛋白和udp -葡萄糖基转移酶的转录本大量上调,编码U-box蛋白的转录本下调,可能有助于植物叶片细胞的耐热性r .一成不变通过保持适当的蛋白质折叠和防止蛋白质降解。
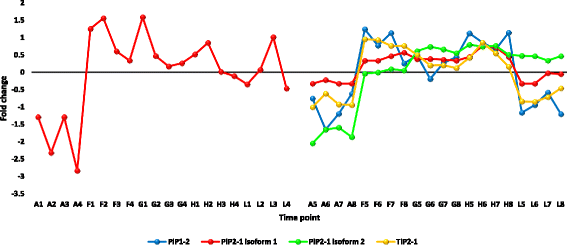
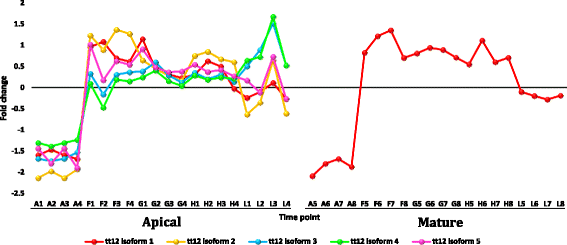
在叶片中,编码水通道蛋白(AQPs)或主要内在蛋白(MIPs)的转录本也大量上调r .一成不变(附加文件12:表S4)。MIPs的主要类型包括质膜内禀蛋白(PIPs)和液膜内禀蛋白(TIPs)。在r .一成不变,三个MIP基因,pip2-1,pip1-2而且tip2-1,可能与叶片的耐热性有关。AQPs是一类膜蛋白,在对不良环境刺激的反应/耐受过程中促进水在细胞膜上的扩散[79,80]包括热应激[81].它们还参与细胞门的打开和关闭,以及在非生物胁迫下的水平衡生理学和水利用效率[82].我们认为,这三个编码AQPs的基因的上调可能有助于植物的耐热性r .一成不变叶子。最后,在叶片中,编码蛋白透明种膜12 (tt12)的转录本大量上调r .一成不变(附加文件12:表S4)。Debeaujon等人。[83]表明黄酮类化合物在黄酮类化合物的作用下被隔离在种皮内皮中tt12但我们的研究结果表明,该基因在叶片中的上调是对热胁迫的反应。这一结论与热应激下黄酮类化合物生物合成的KEGG分析结果相补充,因为这一过程可能伴随着积累的黄酮类化合物在叶细胞液泡中的隔离。如前所述,类黄酮是耐受非生物胁迫的关键次生代谢产物[50].
与共同表达的转录因子Hsp或者伴侣基因
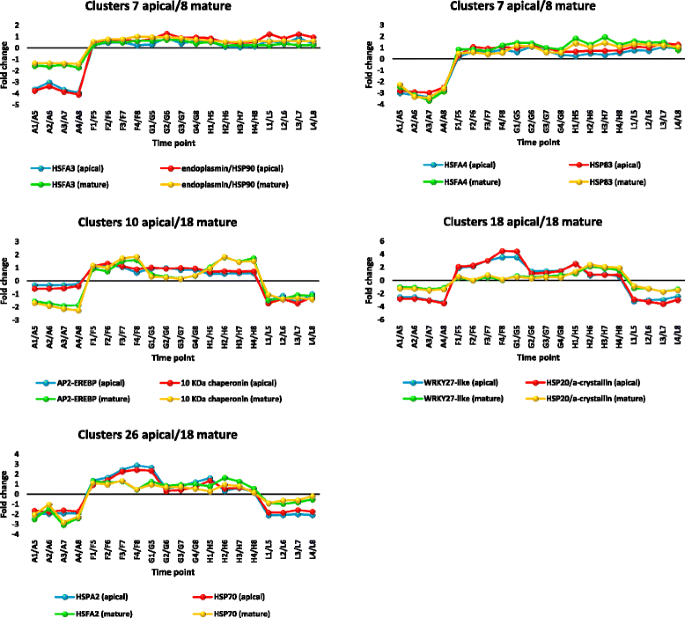
采用共表达分析的方法,研究了在叶尖和成熟叶中调控HSPs或伴侣蛋白编码基因的转录因子r .一成不变特别强调在中午温度最高的采样时间上调的那些(附加文件13:表S5)。在任何一种叶片类型中选择用于共表达分析的DE转录本簇都是目标基因数量最多的那些(附加文件)14:表S6)。他们是簇4,7,10,18和26的顶端叶(附加文件1:表S1),成熟叶片为8和18(附加文件2:表S2)。所选的tf与编码HSPs和伴侣蛋白的基因共表达见附加文件14:表S6。这些tf因其对非生物应激的反应而闻名,包括HSFAs, AP2/ERF(或AP2- erebp), WRKY, bHLH,锌指和MYB(补充文件)14:表S6)。中的hsp基因编码HSP10、HSP20、HSP60、HSP70、HSP83和HSP90。结果表明,在白天,tf和编码HSPs或伴侣蛋白的基因有几种高度一致的共表达。在根尖叶和成熟叶中选择了5对这些共表达基因进行进一步分析(图2)。14).各基因对在两种叶片中的表达模式相同。五对基因在一天中高度相似的共表达不太可能是巧合。这5对基因表达模式包括正午开始上调(7簇顶叶和8簇成熟叶)和正午上调(10、18和26簇顶叶和18簇成熟叶)。第一种模式表明编码HSFA3和内质蛋白/HSP90的基因共表达,编码HSFA4和HSP83的基因共表达(附加文件)14:表S6和图14).第二种表达模式为AP2/ERF(或AP2- erebp)基因和10个KDa伴侣蛋白的共表达(根尖叶10簇,成熟叶18簇,附加文件)14:表S6和图14),编码WRKY27-like和HSP20/α-结晶蛋白的基因共表达(根尖叶和成熟叶的簇18,附加文件14:表S6和图14)和编码HSFA2和HSP70的基因共表达(根尖叶26簇和成熟叶18簇,附加文件14:表S6和图14).
在植物根尖叶(A1-L4)和成熟叶(A5-L8)中选择与HSP或伴侣基因共表达模式非常相似的转录因子r .一成不变在一天的不同时间点(A,早上;F-H,正午和L,黄昏)。表达模式包括正午开始上调(簇7(顶端)/8(成熟))和正午上调(簇10、18或26(顶端)/18(成熟))。转录本折叠变化参考附加文件中的描述14表S6
的表达式hsp基因对各种刺激的反应是由HSFs调节的[84].我们的研究结果表明,编码HSP70、HSP90和HSP83的大量上调转录本与编码HSFA2、HSFA3和HSFA4的大量上调转录本分别共表达(附加文件)14:表S6和图14).有三种hsf拟南芥, A, B和C [85].只有HSF A类含有转录激活所必需的AHA基序hsp基因(86,87].我们观察到5个上调的,丰富的HSF转录本在叶片r .牛皮叶属编码HSFA1, HSFA2, HSFA3, HSFA4和HSFB1(附加文件12:表S4)。早期关于编码HSFA1基因的报道表明,它是番茄早期热应激反应的主要调节因子[88]并在几种诱导中起重要作用hsp基因在拟南芥[89].编码HSFA2的基因是一种热诱导的transactivatorhsp基因和促进获得性耐热持续时间延长拟南芥[90].编码HSFA2的基因的破坏导致的表达减少shsp基因Hsp18.1,Hsp25.3-P而且Hsa32在胁迫下,过表达导致耐热性增强[91].然而,我们的结果表明编码HSFA2的转录本与aHMM-hsp转录本编码HSP70r .一成不变.至于编码HSFA3的基因,Yoshida等[92他们发现,在过度表达的转基因植物中,在热胁迫下它会高度上调dreb2A基因。这表明dreb2A作用于编码HSFA3的基因上游.反过来,hsfA3据报道,调节转录级联下游许多热诱导基因的表达,因为该基因作为一种有效的激活剂hsp基因启动子[93].hsfA3-敲除突变系拟南芥显示出降低的水平hsp101而且shsps在高温下。我们没有证据证明hsp101用树叶r .一成不变.相反,我们的结果表明编码HSFA3和HMM-的基因共表达hsp编码热休克蛋白90的基因。植物叶片中编码HSFA4的基因r .一成不变与hsp83基因(图。14).最近有报道称,该TF可增强细胞的瞬时转活化hsp17.6A热应激下的转录[94].据报道,它还赋予耐受性盐和氧化应激。我们的结果与Pérez-Salamó等人的结果相矛盾。[94],因为该TF与编码HMM-HSP的基因共表达,而不是与编码sHSP17.6A蛋白的基因共表达。总的来说,我们可以得出结论,HSF机械在r .一成不变基本上作用于HMM-hsp基因。本研究中检测到的参与共表达的HSFAs均未驱动shsp在其他植物物种中报道的基因,如拟南芥.
我们的结果表明,一个上调的、丰富的AP2-EREBP转录本编码与一个上调的、丰富的10 KDa转录本编码伴侣蛋白共表达(附加文件14:表S6和图14)用r .一成不变.大量编码AP2/ERFs或AP2- erebp的转录本在白天也上调r .一成不变叶子(附加文件14:表S6)。它们包括编码AP2-ERF17、AP2-ERF34、AP2-ERF98、AP2-ERF109和AP2-EREBP的基因(AT2G41710)拟南芥).另外两个编码AP2-ERF的基因在r .一成不变包括上调的基因编码AP2-ERF23和下调的基因编码AP2-ERF10(附加文件2:表S2 &附加文件6:表S3).耶茨等人。[31]表明AP2-EREBP基因家族在中午表达量下降。这些结果适用于本研究中编码AP2-ERF04、AP2-ERF5、AP2-ERF12、AP2-ERF13、AP2-ERF1b、ap2 - erfab1和AP2-ERFwin1的基因2:表S2 &附加文件6:表S3).一般来说,ERFs被认为在热应激反应中起上游作用,特别是在夜间[95],但没有报道表明ERF驱动伴侣蛋白编码基因的表达。AP2/ERFs包含至少一个DNA结合域,即AP2结构域[96].它们是由干旱、热、盐、渗透、伤害等生物和非生物胁迫诱导的。97].在非生物应激反应中研究最广泛的ERFs是DREB蛋白。其中,DREB2A在拟南芥以不依赖aba -乙烯的方式被热诱导,过度表达它的植物表现出更好的耐热性[98].
WRKY27和HSP20/α-结晶蛋白基因在叶尖和成熟叶中同时表达r .一成不变(无花果。14).该TF在拟南芥影响青枯病症状的因素Ralstonia solanacearum[99],但没有报告支持它与热应激有关。另外3个编码WRKY28、WRKY35和WRKY56的基因也在叶片中表达上调r .一成不变但利率较低。已有报道指出,柳枝稷在热胁迫下可诱导1个WRKY转录因子和4个HSFs [One hundred.].耶茨等人。[31]表明编码WRKY的基因家族在中午表达量下降。我们确认了编码WRKY6、WRKY7、WRKY12、WRKY33、WRKY40、WRKY44、WRKY46、WRKY48、WRKY49、WRKY50、WRKY53和WRKY55的基因的这些结果2:表S2 &附加文件6:表S3)。有报道表明,编码WRKY25、WRKY26或WRKY33的基因的本构表达增强了对热应激的耐受性[101].此前没有报道表明WRKY直接参与驾驶hsp基因,包括shsp20.热胁迫诱导柳枝稷钙调素依赖性蛋白激酶[One hundred.].在叶片中检测到大量编码钙调素依赖性蛋白激酶的转录本r .一成不变在一天中以不同的速度(附加文件2:表S2 &附加文件6:表S3)。钙调素在细胞中的作用研究拟南芥表明它是热应激信号传递所必需的,并且可以作为WRKY39和许多hsf的激活剂[102].在叶子中似乎不是这样r .一成不变.
结论
总的来说,我们得出结论,几种途径的酶在可溶性糖、多元醇、次生代谢产物、酚类物质和蛋氨酸的生物合成中相互作用。编码这些酶的基因可能是野生植物耐热性的主要贡献者r .一成不变.大量的热响应基因在热胁迫下被调节,可以增加这种植物的耐热性。我们的分析还揭示了在热应激过程中个体基因和转录因子的关系。总的来说,我们的研究结果有助于在分子水平上了解热应激反应的调节机制r .一成不变.这是非常重要的,因为这个物种的原生栖息地非常热,使它成为一个很好的系统来研究植物对热胁迫的反应。在未来,控制影响蛋白质折叠和降解的基因的表达,如编码热敏感蛋白(HSPs)、伴侣蛋白(chaperones)、udp -葡萄糖转移酶(UDP-glucosyltransferase)和U-box的基因,在提高重要经济作物的耐热性方面具有巨大潜力。
方法
植物采样和RNA-Seq数据
的顶端和成熟的叶r .一成不变采集自沙特阿拉伯吉达的巴赫地区。该标本保存在阿卜杜勒阿齐兹国王大学生物科学标本室(编号1150/M/75,由N. Baeshen、M. Baeshen和J. Sabir收集)。在当天的7个时间点分4次重复采集两种叶片类型的样品,并从当天的5个时间点中选择以下五个时间点;上午(A, 07:10),中午(F, 13:25;G, 14:05 & H, 14:30)和黄昏(L, 18:27)。5个时间点的温度分别为27.4 (A)、42.4 (F)、42.2 (G)、40.0 (H)和33.5℃(L),两种叶片类型的样品总数为40个(2个叶片类型X 5个时间点X 4个重复)。早晨和黄昏的样本分别在日出后和日落前采集。第一个时间点被认为是热应激的控制条件,时间点F-H被统称为正午。RNA样本被分离出来[31]并由基因组分析中心(Norwich, UK)的Genome Enterprise Limited (GEL)测序,RNA-Seq数据的原始读取结果保存在NCBI的短读档案(SRA)中(SRP028238研究)。
生物信息学分析
相对丰度由RSEM v1.1.6计算r .一成不变核基因组[103用作参考。默认情况下,RSEM使用领结对齐器[104] (Bowtie v0.12.1)将读取与转录本进行映射。EdgeR(版本3.0.0,R版本2.1.5)将预期读计数作为DE分析的输入。这些值的中位数被用作DE分析的常见分散因子。使用Blast2GO软件对DE转录本进行注释和KEGG通路分析[105](版本2.3.5,https://www.blast2go.com).此外,在NCBI非冗余蛋白数据库中,对所选簇的DE转录本进行Blastx, E值截断值为1e−5.利用HMMER v3.1b2鉴定TF中常见的蛋白结构域,以检测TF基因在所选簇中可能参与调控编码HSPs和伴侣蛋白的DE转录本的表达。在中午热胁迫下,两种叶片转录水平的折叠变化与对照条件下的早晨相比,引入了差异表达数据。
RNA-Seq数据集验证
通过实验验证了所选基因的RNA-Seq数据,这些基因在根尖叶中的表达模式与成熟叶中的表达模式相似,且在每个时间点的4个重复中表达率基本一致。适用于两种叶片验证实验的表达模式包括正午开始的上调和全天逐渐下调,其中随机选择10个转录本肌动蛋白被用作不受监管的管家基因(附加文件6:表S3)。原始RNA- seq研究的4个重复RNA样本中的3个[31],以验证所选基因在一天中不同时间点的表达模式(A,上午;F-H,中午;L,黄昏)通过半定量RT-PCR。引物使用Netprimer软件设计(http://www.premierbiosoft.com/netprimer/index.html),标准为:长度~20个碱基,GC含量~50%,二级结构最小,对等的退火温度(55℃),PCR产物为~ 350-450 bp(附加文件)6:表S3)。
缩写
- AQP:
-
水通道蛋白
- bHLH:
-
基本helix-loop-helix
- CDK:
-
细胞周期蛋白依赖性激酶
- CNX:
-
Calnexin
- CRT:
-
Calreticulin
- Cyt 450:
-
Cytochromome P450
- 德:
-
微分表达式
- 呃:
-
内质网
- 舰队指挥官:
-
褶皱变化
- HB:
-
同源框域
- HSP:
-
热休克蛋白
- KDa:
-
Kilodalton
- KEGG:
-
京都基因和基因组百科全书
- 政治:
-
Leucocyanidin还原酶
- MIP:
-
主要内在蛋白
- PA:
-
Proanthocyanidin
- 朋友:
-
苯丙氨酸ammonia-lyase
- 皮普:
-
质膜内禀蛋白
- PSII:
-
光系统II
- ROS:
-
活性氧
- sHSP:
-
小热休克蛋白
- SRA:
-
短读存档
- TF:
-
转录因子
- 提示:
-
膜内源性蛋白
参考文献
- 1.
张勇,MR棉,Chekhovskiy K, So S, Kupfer D,等。差异基因表达羊茅属在热应激条件下。中国机械工程学报,2005;26(6):897 - 907。
- 2.
许超,黄波。两种植物根系对热胁迫的蛋白质组学响应Agrostis耐热性不同的草种。中国科学(d辑),2008;
- 3.
黄军,崔凯,聂林,沙涛,等。高温胁迫对水稻植株及其耐受性性状的影响。中国农业科学,2011;49(4):349 - 349。
- 4.
联合国政府间气候变化专门委员会。管理极端事件和灾害风险,推进气候变化适应。In: Field CB, Barros V, Stocker TF, Qin D, Dokken DJ,等,编辑。政府间气候变化专门委员会第一和第二工作组的特别报告。剑桥:剑桥大学出版社;2012.p。582。
- 5.
蒋耀文,黄斌斌。干旱和热胁迫对两种冷季草坪草抗氧化代谢和脂质过氧化的影响。作物科学2001;41:436-42。
- 6.
李志刚,梁洪亮,李志刚,等。干旱胁迫和热休克对烟草基因表达的影响。植物科学学报,2002;30(2):344 - 344。
- 7.
李日基,梁海军,舒曼,舒拉耶夫,达维托娃,等。当防御途径发生碰撞时。回应拟南芥干旱和高温的结合。植物物理学报。2004;134:1683-96。
- 8.
Szabados L, Savouré a .脯氨酸:一种多功能氨基酸。植物科学进展,2010;15:89-97。
- 9.
Wahid A, Close TJ。高温胁迫下甘蔗叶片脱氢酶的表达及其与水分关系的关系。生物植物。2007;51:104-9。
- 10.
傅志强,张志强,张志强,等。分子伴侣蛋白在蛋白质折叠和蛋白质稳态中的作用。大自然。2011;475:324-32。
- 11.
铃木,李志强,李志强,李志强,等。表达转录辅激活物多蛋白桥接因子1c的转基因植物对环境胁迫的耐受性增强。植物物理学报,2005;139:1313-22。
- 12.
李文杰,李文杰,李文杰,等。Koskull-Döring P。植物热应激反应的复杂性。植物生态学报,2007;10(3):361 - 366。
- 13.
Zinn KE, Tunc-Ozdemir M, Harper JF。温度胁迫与植物有性繁殖:揭示最薄弱环节。中国科学(d辑),2010;
- 14.
植物对热休克发生率增加的分子反应。植物细胞环境。1991;1:831-41。
- 15.
田娟,黄波。热适应植物热胁迫响应基因的鉴定Agrostis作用研究通过抑制减法杂交。中国植物学报。2009;26(2):366 - 366。
- 16.
Giorno F, Wolters-Arts M, Grillo S, Scharf KD, Vriezen WH,等。番茄花药中HsfA2和小热休克蛋白的发育和热应激调控表达。中国科学(d辑),2010;
- 17.
Nakamoto H, Vigh L.小热休克蛋白及其客户。细胞生物学与生命科学,2007;
- 18.
傅晓峰,王晓峰,王晓峰,等。蛋白质折叠的聚合概念在体外而且在活的有机体内.分子生物学学报。2009;16:574-81。
- 19.
Pratt WB, Morishima Y, Peng HM, Osawa Y.当蛋白质遭受氧化和毒性损伤时,基于Hsp90/ hsp70的伴侣机制在做出分类决策中的作用的提议。中华生物医学杂志,2010;23(3):388 - 388。
- 20.
Taipale M, Jarosz DF, Lindquist S. HSP90在蛋白质稳态中心:新兴机制的见解。中国生物医学杂志,2010;11:515-28。
- 21.
Huner N, Öquist G, Sarhan F.能量平衡与对光和冷的适应。植物科学进展,1998;3(4):344 - 344。
- 22.
胡涛,李辉,张霞,罗华,付娟。NaCl对多年生黑麦草离子代谢、抗氧化酶及基因表达的毒性作用。环境安全。2011;74:2050-6。
- 23.
李志刚,李志刚。植物耐盐胁迫的生理和分子生物学研究。动物科学,2004;86:407-21。
- 24.
徐宏伟,吕世勇,宋方波。东北黑土地区玉米壳叶脂质过氧化、抗氧化酶活性及渗透调节的变化Afr J agricultural Res. 2011; 6:3098-102。
- 25.
秦东,吴华,彭华,姚勇,倪震,等。耐热和耐热小麦热胁迫响应转录组分析(小麦L.)采用小麦基因组阵列。BMC基因组学,2008;9:432。
- 26.
芬卡A, Mattoo RU, Goloubinoff P.热与化学上调伴侣基因在植物和人类细胞的meta分析。Cell Stress章节2011;16:15-31。
- 27.
植物热胁迫反应和耐热性机制的解读。植物科学进展,2013;
- 28.
Mittler R, Finka A, Goloubinoff P.植物是如何感知热量的?生物化学学报,2012;37:118-25。
- 29.
Latchman DS。转录因子概述中国生物化学杂志,1997;29:1305-12。
- 30.
林德默斯,李志强,李志强,等。非生物胁迫响应中转录因子的结构、功能和网络研究。中国生物化学杂志,2013;
- 31.
叶志刚,张志刚,张志刚,等。多年生C3.沙漠植物Rhazya一成不变在自然环境中。BMC植物学报。2014;14:2。
- 32.
杨晓明,杨晓明。茎尖分生组织的形成与维持。植物科学,2000;5:110-5。
- 33.
柴坦雅KV,桑达D, Reddy AR.高温胁迫下桑叶代谢。生物植物,2001;44:379-84。
- 34.
吴继伟,葛西,彭南能,李海杰,等。大豆光合作用、rubisco和碳水化合物酶在CO升高的超最佳温度下发挥作用2.植物科学学报,2001;29(2):366 - 366。
- 35.
张晓燕,张晓燕,张晓燕,等。原质体糖原代谢向淀粉代谢的转变。植物科学进展,2014;19:18-28。
- 36.
克拉森斯基,乔克。干旱、盐和温度胁迫诱导的代谢重排和调节网络。中国科学(d辑),2012;
- 37.
泰特洛IJ,莫雷尔MK,埃姆斯MJ。高等植物淀粉代谢调控研究进展。中国科学(d辑),2004;
- 38.
Kotting O, Kossmann J, Zeeman SC, Lloyd JR.淀粉代谢的调节:启蒙的年龄?植物学报,2010;13:321-9。
- 39.
劳森,戴维PA,叶茨SA,贝克托德U,贝森M,等。C3.沙漠植物的光合作用Rhazya一成不变在高温和光照强度下完全正常。新植物,2014;201:862-73。
- 40.
Crafts-Brandner SJ, Salvucci ME。Rubisco活化酶在高温和CO2条件下抑制叶片的光合潜能。自然科学学报,2000;29(2):342 - 344。
- 41.
Salvucci ME, Crafts-Brandner SJ。热胁迫对光合作用的抑制:Rubisco作为光合作用限制因素的激活状态。植物科学,2004;
- 42.
Portis AR. Rubisco活化酶- Rubisco的催化伴侣。光合作用,2003;75:11-27。
- 43.
Todaka D, Matsushima H, Morohashi Y.水分胁迫增强黄瓜子叶β -淀粉酶活性。中国科学(d辑),2000;
- 44.
卡普兰F,盖伊CL。麦芽糖在温度休克中的β -淀粉酶诱导及保护作用。植物物理学报。2004;135:1674-84。
- 45.
王志刚,李志刚,李志刚。干旱条件下鹰嘴豆渗透调节对水分吸收和光合作用的影响。中国生物医学杂志,2007;
- 46.
张志刚,张志刚,张志刚,张志刚,等。脱落酸在胁迫调节碳水化合物代谢中的作用。科学通报。2008;3:e3935。
- 47.
Gründel M, Scheunemann R, Lockau W,齐里格斯Y.糖原合成受损引起代谢溢出反应,影响蓝藻的应激反应集胞藻属sp. PCC 6803。Microbiol。2012;158:3032-43。
- 48.
沈斌,杨永强,李永强。通过将甘露醇生物合成靶向于叶绿体,转基因植物增加了对氧化应激的抗性。植物物理学报。1997;113:527-32。
- 49.
罗莎M,普拉多C,波达扎G, Interdonato R, González JA,等。可溶性糖-代谢,感应和非生物应激。植物生命中一个复杂的网络。植物学报。2009;4:388-93。
- 50.
王志强,王志强,王志强,等。甘蔗耐盐性与次生代谢产物的关系。中国植物学报。2006;23(3):344 - 344。
- 51.
黄酮类化合物的生物合成及应激的影响。植物学报,2002;5:218-23。
- 52.
Cohen SD, Tarara JM, Gambetta GA, Matthews MA, Kennedy JA。日温度变化对葡萄浆果发育、原花青素积累及类黄酮途径基因表达的影响中国科学(d辑),2012;
- 53.
李志强,李志强,李志强,等。在绿色和成熟的葡萄中,昼夜热胁迫触发不同的转录组反应(葡萄)水果。BMC植物生物学。2014;14:108。
- 54.
霍顿P.作物改良通过改变光合膜,ISB新闻报道。布莱克斯堡:弗吉尼亚理工大学;2002.
- 55.
Heckathorn SA, Downs CA, Sharkey TD, Coleman JS。小的,富含蛋氨酸的叶绿体热休克蛋白在热应激时保护光系统II电子传递。植物学报。1998;116:439-44。
- 56.
古斯塔夫松,郭克英,韩达尔,西洛,贝克托尔,等。在光合组织中高度表达的一种肽蛋氨酸亚砜还原酶拟南芥能保护一种叶绿体定位的小热休克蛋白的伴侣样活性。植物学报2002;29:545-53。
- 57.
张涛,王旭,陆勇,蔡霞,叶铮,等。全基因组分析细胞周期蛋白番茄基因家族。中国生物化学杂志,2014;
- 58.
胡涛,孙霞,张霞,聂娥,付娟。高温胁迫下高羊茅的RNA测序转录组分析揭示了植物耐热性的新认识。BMC Genomics. 2014;15:147。
- 59.
郭志刚,张志刚。植物细胞周期蛋白依赖性蛋白激酶与胁迫反应。植物学报。2011;6:204-9。
- 60.
杨晓明,张晓明,张晓明,等。植物对高温环境的适应性研究。植物物理学报。2008;146:748-61。
- 61.
Irmler S,施罗德G,圣皮埃尔B,克劳奇NP, Hotze M.吲哚生物碱的生物合成Catharanthus roseus也叫:新的酶活性及细胞色素P450CYP72A1作为secologanin合成酶的鉴定。植物学报2000;24:797-804。
- 62.
王志强,王志强,王志强,等。CYP83A1和CYP83B1是两种非冗余细胞色素P450酶,代谢硫代葡萄糖苷生物合成中的肟拟南芥.植物物理学报。2003;133:63-72。
- 63.
武本栋,林林松,王志强,王志强,王志强。烟草细胞色素P450基因的克隆。植物细胞物理学报,1999;40:1232-42。
- 64.
热休克蛋白在植物中的作用。植物化学学报,2001;26(2):366 - 366。
- 65.
Mashaghi A, Kramer G, Lamb DC, Mayer MP, Tans SJ。伴侣作用在单分子水平。化学,2014;114:660-76。
- 66.
王伟,王晓明,王晓明,王晓明。植物热休克蛋白和分子伴侣蛋白在非生物胁迫响应中的作用。植物科学进展(英文版);2004;
- 67.
李建军,李志强,李志强,等。植物小分子热休克蛋白的进化、结构与功能。中国科学(d辑),1996;
- 68.
张志强,张志强,张志强,等。叶绿体小热休克蛋白发生氧化依赖性构象变化,可能保护植物免受氧化胁迫。细胞应激章1999;4:29 - 38。
- 69.
Malik MK, Slovin JP, Hwang CH, Zimmerman JL。胡萝卜小热休克蛋白基因hsp17.7的修饰表达可提高或降低耐热性。植物学报1999;20:89-99。
- 70.
郭志刚,洪文伟,李志刚,林奎斯特。热休克蛋白101在植物耐热性中的重要作用拟南芥.《植物科学》2000;12:479-92。
- 71.
Chauhan H, Khurana N, Nijhavan A, Khurana JP, Khurana P.小麦叶绿体小热休克蛋白(sHSP26)参与种子成熟和萌发,具有耐热性。植物生态学报。2012;35:1212 - 1212。
- 72.
王安,于旭,毛勇,刘勇,刘刚,等。一个小的热休克蛋白基因的过表达增强了水稻对非生物胁迫的耐受性。植物育种。2015;134:384-93。
- 73.
唐斯加州,瑞安SL,赫克索恩SA。叶绿体小热休克蛋白:在保护光系统II对抗氧化应激和光抑制的一般作用的证据。植物科学学报,1999;29(2):349 - 349。
- 74.
blaco - herrera F, Moreno AA, Tapia R, Reyes F, Araya M,等。UDP-glucose:糖蛋白糖基转移酶(UGGT)是内质网质量控制的关键酶,在植物生长以及生物和非生物胁迫中起着重要作用拟南芥.BMC植物生物学。2015;15:127。
- 75.
Taylor SC, Thibault P, Tessier DC, Bergeron JJ, Thomas DY.分泌蛋白折叠传感器的糖肽特异性。EMBO代表2003;4:45 5 - 11。
- 76.
Cyr DM, Höhfeld J, Patterson C.蛋白质质量控制:含u -box的E3泛素连接酶加入折叠。生物化学学报,2002;27:368-75。
- 77.
赵sk,柳美美,宋c,郭建民,金卫东。拟南芥PUB22和PUB23是同源U-box E3泛素连接酶,在干旱胁迫响应中发挥组合作用。《植物细胞》2008;20:1899-914。
- 78.
徐德华,刘my, Jammes F, Hwang JH, Turek M,等。四个角色拟南芥U-box E3泛素连接酶在脱落酸介导的干旱胁迫响应中的负调控作用。植物科学进展。2012;
- 79.
Forrest KL, Bhave M.,小麦中的PIP和TIP水通道蛋白形成了一个庞大而多样的家族,具有独特的基因结构和重要的功能特征。功能性整合基因组学,2008;8:115-33。
- 80.
李娟,班林,文华,王铮,朱本科,等。水通道蛋白与耐旱性有关。生物化学学报。2015;49:20 8 - 13。
- 81.
Christou A, Filippou P, Manganaris GA, Fotopoulos V.硫化钠通过热休克蛋白和水通道蛋白的转录调节诱导草莓系统性耐热性。BMC植物生物学。2014;14:42。
- 82.
赵春霞,邵海波,褚丽丽。水通道蛋白结构-功能关系:水在植物活细胞中的流动。胶体冲浪B:生物界面。2008;62:163-72。
- 83.
德博约,彼得斯,Léon-Kloosterziel KM, Koornneef m透明TESTA12基因的拟南芥编码一种多药二级转运体样蛋白,用于类黄酮在种皮内皮液泡中的隔离。植物细胞,2001;13:853-71。
- 84.
热休克转录因子在植物热休克反应调控中的作用。王志强,2001;15:418 - 418。
- 85.
李志强,李志强,李志强,等。拟南芥在热应激转录因子领域我们需要多少热应激转录因子?细胞应激章2001;6:177-89。
- 86.
Kotak S, Port M, Ganguli A, Bicker F, von Koskull-Doring P. c端结构域的表征拟南芥热应激转录因子(Hsfs)和植物a类Hsfs与AHA和NES motif的新签名组合的鉴定,这对激活因子功能和细胞内定位至关重要。植物学报2004;39:98-112。
- 87.
刘海辉,廖海涛,充YY。A1类热休克因子(HSFA1s)在响应热和其他应力中的作用拟南芥.植物细胞环境学报。2011;34:738-51。
- 88.
Mishra SK, Tripp J, Winkelhaus S, Tschiersch B, Theres K,等。在复杂的热胁迫转录因子家族中,HsfA1作为番茄耐热性的主调节因子具有独特的作用。基因开发,2002;16:55 - 67。
- 89.
Lohmann C, Eggers-Schumacher G, Wunderlich M, Schoffl F.两种不同的热休克转录因子调节应激基因的即刻早期表达拟南芥.Mol Genet Genomics, 2004; 271:11-21。
- 90.
充悠悠,刘兴辉,刘永宁,迟文涛,王国忠,等。热诱导转录因子,HsfA2,是延长获得性耐热性所必需的拟南芥.植物物理学报,2007;43(3):344 - 344。
- 91.
李超,陈强,高旭,齐斌,陈楠,等。AtHsfA2调节应激反应基因的表达,增强植物对热和氧化应激的耐受性拟南芥.中国科学C辑,2005;
- 92.
吉田T,佐久间Y, Todaka D,丸山K,秦F,等。功能分析拟南芥DREB2A应激调节系统下游转录级联中的热休克转录因子HsfA3。生物化学与生物物理学报,2008;
- 93.
李志强,李志强,李志强,等。转录因子DREB2A和热应激转录因子HsfA3级联调控小鼠热应激反应拟南芥.植物J. 2008; 53:264-74。
- 94.
Pérez-Salamó I, Papdi C, Rigó G, Zsigmond L, Vilela B,等。热休克因子A4A具有耐盐性,并受氧化应激和丝裂原活化蛋白激酶MPK3和MPK6的调节。植物科学进展。2014;
- 95.
徐志生,陈敏,李立春,马永志。AP2/ERF转录因子家族在作物改良中的功能及应用中国生物工程学报,2011;
- 96.
中野T,铃木K,藤村T, Shinshi H. ERF基因家族的全基因组分析拟南芥和米饭。植物物理学报。2006;140:411-32。
- 97.
李建平,李建平,李建平,等。aptala2 /乙烯反应因子(AP2/ERF)转录因子的研究进展。新植物,2013;1999:639 - 49。
- 98.
佐久间Y,丸山K,秦F,大坂Y,筱崎K,等。的双重功能拟南芥转录因子DREB2A在水胁迫响应和热胁迫响应基因表达中的作用。中国科学院学报(自然科学版)2006;103:18822-27。
- 99.
穆赫塔尔MS, Deslandes L, Auriac MC, Marco Y, Somssich IE。的拟南芥转录因子WRKY27影响青枯病症状的发展Ralstonia solanacearum.植物J. 2008; 56:935-47。
- One hundred.
李艳芳,王艳,唐艳,Kakani VG, Mahalingam .柳枝稷热胁迫应答的转录组分析(黍virgatuml .)。BMC植物生物学,2013;13:153。
- 101.
李松,李峰,王娟,张伟,孟Q,等。甜菜碱在番茄种子萌发和幼苗生长过程中增强了番茄植株对高温的耐受性。植物细胞环境。2011;34:1931-43。
- 102.
李松,周旭,陈玲,黄伟,于东拟南芥WRKY39的热应激。中国生物医学工程学报,2010;
- 103.
萨比尔,Jansen RK, Arasappan D, Calderon V, Noutahi,等。核基因组Rhazya一成不变以及夹竹桃科一个医学相关分支生物碱多样性的进化。科学通报2016;6:33782。
- 104.
Langmead B, Trapnell C, Pop M, Salzberg SL.人类基因组短DNA序列的超快和内存高效对齐。中国生物工程学报。2009;10:R25。
- 105.
Conesa A, Götz S, García-Gómez JM, Terol J, Talón M,等。Blast2GO:用于功能基因组学研究的注释、可视化和分析的通用工具。生物信息学。2005;21:3674-6。
致谢
作者感谢阿卜杜勒阿齐兹国王大学(KAU)主任Abdulrahman O. Alyoubi教授和沙特阿拉伯吉达KAU科学研究院长的财政支持,由战略技术研究单位代表,通过项目号431/008-D为题为“盐和耐热基因的鉴定和分离”的项目Rhazya一成不变《通过化学信息学检测代谢物及其治疗作用》。
资金
阿卜杜勒阿齐兹国王大学(KAU)主任Abdulrahman O. Alyoubi教授和沙特阿拉伯吉达科研所院长,由战略技术研究单位代表,项目编号为431/008-D。
数据和材料的可用性
RNA-Seq数据的原始读取被保存在NCBI的短读存档(SRA)中(研究SRP028238)。收集许可Rhazya一成不变种植材料和在现场进行实地调查是由麦加省省长Khalid Al- Faisal王子批准的。
作者的贡献
AYO、JSMS、AA、SE、FMD、NH、RKJ、AB四组设计了实验。AA、XL、MZM、NOG、NHH、MAK进行了实验。AA、SE、FMD、AB对数据进行分析。AYO、JSMS、FMD、NH、RKJ、AB撰写稿件。所有作者都阅读并批准了最终的手稿。
相互竞争的利益
作者宣称他们之间没有利益冲突。
发表同意书
不适用。
伦理批准并同意参与
不适用。
作者信息
从属关系
相应的作者
附加文件
附加文件1:表S1。
的组装转录本的折叠变化值r .一成不变SRA数据库在一天不同时间点(A,上午;F-H,正午和L,黄昏)。(xlsx775 kb)
附加文件2:表S2。
的组装转录本的折叠变化值r .一成不变在一天的不同时间点(A,上午;F-H,正午和L,黄昏)。(xlsx1523 kb)
附加文件3:图S1。
的转录本r .一成不变顶叶(a1 ~ l4)在一天的不同时间点(A,上午;F-H,正午和L,黄昏)。灰色线表示给定集群中单个转录本的表达模式。蓝线表示给定聚类的不同转录本的总体表达模式。(PDF 223kb)
附加文件4:图S2。
的转录本r .一成不变成熟叶(A5-L8)在一天不同时间点(A、上午;F-H,正午和L,黄昏)。灰色线表示给定集群中单个转录本的表达模式。蓝线表示给定聚类的不同转录本的总体表达模式。(PDF 397 kb)
附加文件5:图S3。
采用半定量RT-PCR和RNA-Seq分析的折叠变化值谱,选取从正午(1-5)开始上调的基因和逐渐下调的基因(6-10),用于验证叶尖(A1-L4)和成熟叶(A5-L7)的RNA-Seq数据r .一成不变在一天的不同时间点收集。序号1-10指附加文件中描述的基因6:表S3。“肌动蛋白基因被用作不规范的管家基因。(docx9867 kb)
附加文件6:表S3。
在叶尖(A1-L4)和成熟叶(A5-L8),转录本在两种表达模式下的折叠变化值(即中午开始上调,逐渐下调)r .一成不变在一天的不同时间点(A,早上;F-H,正午& L,黄昏)和引物信息进行半定量RT-PCR验证实验。“肌动蛋白”被用作不受管制的管家基因。(xlsx35kb)
附加文件7:图S4。
在两个时间点(上午,A和中午,G),顶叶和成熟叶苯丙基代谢途径中的酶对环境变化的响应不同,蓝色为顶叶上调(激活),红色为成熟叶上调(抑制),橙色为顶叶下调(抑制),绿色为成熟叶下调(抑制)。(docx174kb)
附加文件8:图S5。
顶叶和成熟叶类黄酮代谢途径中的酶在两个时间点(上午A和中午G)对环境变化的响应不同,顶叶(蓝色)上调(激活),成熟叶(红色)上调。(docx193kb)
附加文件9:图S6。
顶叶和成熟叶花青素代谢途径中的酶在两个时间点(上午,A和中午,G)对环境变化的响应不同,顶叶(蓝色)上调(激活),成熟叶(红色)上调。(docx210 kb)
附加文件10:图S7。
顶叶和成熟叶类胡萝卜素代谢途径中的酶在两个时间点(上午,A和中午,G)对环境变化的响应不同。顶叶上调(激活)(蓝色),成熟叶上调(红色),顶叶下调(抑制)(橙色框),成熟叶下调(绿色框)。(docx242kb)
附加文件11:图S8。
顶叶和成熟叶中半胱氨酸和蛋氨酸代谢途径中的酶在两个时间点(上午,A和中午,G)对环境变化的响应不同。顶叶(蓝色)上调(激活),成熟叶(红色)上调(抑制),顶叶(橙色框)下调(抑制),成熟叶(绿色框)下调。(docx201 kb)
附加文件12:表S4。
基因的比较差异表达r .一成不变不同时间点(a,上午;F-H,正午和L,黄昏)。蓝框=上调,橙框=下调。括号内的数字表示no。某一特定基因的类似物绿框表示选择用于进一步分析的基因。(docx80 kb)
附加文件13:表S5。
顶叶(A1-L4)和成熟叶(A5-L8) HSPs编码基因在白天(A、早晨;F-H,正午& L,黄昏)在r .一成不变(xlsx25kb)
附加文件14:表S6。
在选定的根尖叶(a, A1-L4)和成熟叶(b, A5-L8)中选择差异表达基因,表明tf在白天(a,上午;F-H,正午& L,黄昏)在r .一成不变.(xlsx42 kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
欧拜德,a.y.,萨比尔,j.s.m.,阿特夫,A。et al。植物对热应激的转录反应分析Rhazya一成不变.BMC植物生物学16,252(2016)。https://doi.org/10.1186/s12870-016-0938-6
收到了:
接受:
发表:
关键字
- 耐热性
- HSP
- 陪伴
- HSF
- 细胞周期蛋白
- U-box
- Aquaporine
- 蛋白质透明种膜
- AP2-EREBP
- WRKY27