抽象的
背景
从进化的观点来看,针叶树胚胎发育调控基因的表达和功能的特性是有趣的。然而,我们对针叶树胚胎发育的调控知之甚少。在胚胎发育的早期松树物种proembyo经历一个卵裂过程,称为卵裂多胚,产生四个胚胎。其中一个胚胎发育为显性胚胎,进一步发育为成熟的子叶胚胎,而另一个胚胎,即次级胚胎,则被降解。本研究的主要目的是确定对调节卵裂过程和显性胚胎发育可能重要的过程。
结果
在种子发育的四个早期发育阶段的胚胎和巨配子体的RNA样本抗旱性进行高通量测序。总共生成了660万个原始reads,产生了121,938个转录本,其中有36.106个包含orf。18,638个转录本在胚胎和巨配子体中有差异表达。GO富集分析表明,在胚胎中上调的转录本富集于不同的细胞过程,而在巨生植物中上调的转录本富集于储存物质的积累和对胁迫的响应。在裂解过程的起始阶段检测到的det数量最多。在胚胎发育早期,与胚胎发生能力、细胞壁修饰、细胞分裂模式、轴的规范以及对激素和胁迫的反应相关的转录本高度丰富并有差异表达。通过qRT-PCR分析证实了具有代表性的DETs的丰度。
结论
基于在富集分析中鉴定的方法和所选转录物的表达,我们建议(i)与胚性能力和细胞壁松动相关的方法,参与激活切割过程;(ii)在主要胚胎中严格调节外壳基础极化,但不在下属胚胎中;(iii)从形态发生阶段到成熟阶段的转变在下属胚胎中未完成。这是胚胎发育期间最早阶段的第一种基因组转录物表达分析松树物种。我们的结果可以作为未来研究揭示鉴定基因的功能的框架。
背景
植物的胚胎后期发育依赖于胚胎发生期间茎和根分生组织中干细胞龛的建立。胚胎中模式的形成受到基因表达、细胞分裂和激素功能的时空协调调控。我们对胚胎发育中模式形成的调控的大部分知识都是基于被子植物模式植物拟南芥(拟南芥) [1].相比之下,我们对胚胎发育的裸子植物调控的知识是有限的。分子数据表明,现存种子植物(裸子植物和被子植物)大约300万年前共享的最后共同祖先[2].因此,调节在裸子植物中调节胚胎发育的基因的表达和功能的表征是有趣的一种进化的观点。研究裸子植物,特别是针叶树的另一个原因是它们具有很大的商业意义。
胚胎发展松树可以分为三个阶段[3.:(1)胚发生-胚柄伸长之前的所有阶段;(2)胚发生早期-胚柄伸长期间和之后以及根分生组织建立之前的所有阶段;(3)胚发生晚期-根和芽分生组织的建立和胚的进一步发育。原胚发生始于游离核阶段。受精卵经历几轮核复制,其后没有细胞分裂。细胞壁形成后,形成四层,其中最下层形成胚块,最下层伸长形成胚柄。在大多数松树物种在Proembryo中的四个顶端电池和悬浮网分离成四个丝状胚胎[4.那5.].该过程被称为裂解聚亚胺丙烯[6.].四个胚胎,从分离的各层所出现,由顶端细胞生长开始它们的发展[7.].胚块的基底细胞背斜分裂并拉长,形成胚柄,胚柄由数个末分化的不分裂细胞组成。早期胚胎发生始于胚柄的伸长。不断扩大的胚柄将胚胎从颈卵壳中推出,进入巨配子体丰富的营养储备中。在有多胚现象的胚珠中,基因相同的胚胎之间的竞争没有选择优势;相反,有人认为,处于最适宜环境中具有最佳生理结构的胚胎会成为优势胚胎,并通常发育成熟。8.].其余的胚胎,从属胚胎,被程序性细胞死亡(PCD)降解[9.].在晚期胚胎中,根和芽顶部分泌物被描绘并建立植物轴。成熟的胚胎的特征在于引发子叶。
已经采取了各种方法来阐明植物中胚胎发育的调节。在整套植物中进行了对转录器中的转录物分析的最全面的研究(松果体taeda),其中约68,700个est从合子和体细胞胚胎中再生[10].基于295个基因,对于拟南芥胚胎发生至关重要,85%对Loblolly Pine数据库中的EST具有非常强的序列相似性[11].在挪威云杉中,应力相关过程和生长素介导过程被鉴定为与早期体细胞胚胎发育相关[12].微阵列分析也用于研究海松(Pinus Pinaster.) [13].结果表明,与生长素转运和反应相关的表观遗传调控和转录对照在早期到松树胚胎发生的中期阶段至关重要,胚胎发生过程中的重要事件似乎是通过高血管植物的主要发育调节剂的推定直肠协调。高吞吐量测序技术的最新进展使得全局转录组分析能够进行现有序列知识[14].通过在玉米早期种子发育期间分析胚胎和胚乳之间的转录网络(Zea Mays.)研究表明,许多代谢活动对胚胎或胚乳是特异性的,转录因子和印迹基因在胚胎或胚乳中是特异性表达的[15].棉花体细胞胚和合子胚的转录组比较分析(陆地棉)发现,体细胞胚胎发生的过程的特征在于诱导几种相关基因[16].玉米胚胎发生组织启动过程中,整个转录组分析显示应激因子表达增加,体细胞胚胎发生相关基因的协调表达的重要性[17],以及复杂的养羊石信号通路的参与[18]. 在日本落叶松增殖胚性培养物中,通过转录组分析检测到几种代谢事件(Larix Leptolepis.) [19].
为了改善苏格兰松树早期胚胎发育中涉及的基因组因子的理解,我们在Zygotic胚胎发生过程中对早期阶段进行了基因组宽的高通量转录组测序。通过QRT-PCR分析证实了二十三种差异表达基因的表达。基于这些分析,并假设苏格兰杉木基因对其拟南芥对应物同源,我们已经确定了在早期胚胎发育期间发生的转录物和推定过程,包括启动切割聚胚胎产生和显性胚胎的发育。据我们所知,这代表了胚胎发育期间最早阶段的第一种基因组转录表达谱分析松树物种。
方法
植物材料
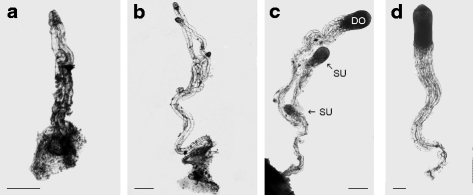
2012年夏天,研究人员从苏格兰松(抗旱性在哈德,瑞典中部(60.3°纬度,17.0°经度)。经营种子园的瑞典林业研究所允许我们收集球果。同样的克隆被用于测序苏格兰松基因组(欧洲共同体第七框架计划,ProCoGen项目中的WP1)。为了收集合子胚和巨配子体的所需发育阶段,在11th和20th七月。在立体显微镜下从MegAgametophytes切除Zygotic胚胎。根据发育阶段,将胚胎(E)和胚胎(E)和MegAgameTophy(M)分选和收集并收集在冰上的Eppendorf管中(图。1):第1阶段,胚珠包含在阶段单个胚胎裂解(E1,M1)之前;第2阶段,胚珠包含在裂解的阶段(E2,M2)的胚胎;阶段3,胚珠包含显性胚,DO,和从属胚胎,SU(显性和下级胚胎分别取样,E3DO,E3SU,M3);第4阶段,胚珠只是子叶分化(E4,M4)之前包含显性的胚胎。最多在冰上10分钟后,将Eppendorf管中收集与胚胎或配子体在液氮中冷冻。包括从27到50的胚胎每个样品,这取决于发育阶段。收集等效材料夏季2014年期间的qRT-PCR分析,以避免在特定的区域中的胚胎发生过程的特异性,从苏格兰的树中收集的新的样品在位于Ultuna,瑞典中央(59.8的SLU地产生长松°纬度,17.7°经度),从其中可收集锥体的数量不受限制。是在17之间周期性地执行锥体的收获th6月8日th七月。
RNA提取和cDNA合成
使用RNAwewous-Micro RNA分离试剂盒(AMAMION)提取来自Zygotic胚胎的总RNA,然后根据制造商的说明,进行DNase I治疗以除去任何残留的基因组DNA。使用Spectrum植物总RNA试剂盒(Sigma-Aldrich)分离来自MegAgameTophytes的RNA,包括用于去除基因组DNA的痕量的柱DNase I消化步骤。
使用Qubit荧光仪(Invitrogen公司)荧光测定用于RNA测序(一个生物重复)的样本中分离的RNA浓度,并由安捷伦生物分析仪(Agilent BioAnalyzer)使用RNA 6000纳米芯片(Agilent technologies公司)验证其完整性。RNA完整性值(RIN)大于7的RNA样本用Mint-2 cDNA合成试剂盒(Evrogen)进行cDNA合成和扩增。简单地说,用1 μg总RNA通过Mint RT进行第一链合成,使用修饰的poly-dT引物。第二链由Encyclo DNA聚合酶(Evrogen)合成,然后进行PCR扩增。估计每个样品的双链cDNA (dsDNA)扩增周期数(18或21)。扩增的cDNA用NucleoSpin凝胶和PCR cleanup kit (Macheray-Nagel)纯化。最后,利用特异性引物进行再扩增,进行454测序。共构建了9个不同的dsDNA富集文库,其中5个来自E1、E2、E3DO、E3SU和E4期合子胚胎,4个来自M1、M2、M3和M4期巨配子体。
RNA从收集的qRT-PCR(4个生物学重复)胚胎中分离使用NanoDrop-1000分光光度计(使用Nanodrop Technologies)中进行定量。使用的QuantiTect全转录盒(Qiagen)根据制造商的高收率反应协议随后8小时的扩增进行从100 cDNA合成ng总RNA的。
转录组测序
转录组测序在马拉加大学超测序设施进行,使用GS-FLX +平台和GS-FLX Titanium试剂盒,罗氏应用科学(印第安纳波利斯,IN, USA)遵循Canas等人描述的协议。[20.].
RNA-seq转录本重建
在组装之前,对660万原始454个读取进行了质量检查,并使用seqclean(附加文件1:表S1)。清洁读取后德诺维使用NewBler软件(v2.8.1)组装,导致包含117,551个IsoTigs的76,425 isogroups(附加文件1:表S2)。为了得到一个更全面的转录组数据集,我们还将公共可用的数据集与之前获得的组装。我们从PlantGDB (Resources for Comparative Plant Genomes)中整合了另外67,744个put [21和一组来自NCBI ESTdb的2161 est,它们被用作对映射读取的参考(附加文件1:表S3)。使用CD-HIT软件进行整合各种数据集[22以去除多余的转录本并聚类成同群。对于每个同位群,只有最长的同位群被保留以供进一步分析。这导致了最终的121,938份转录本(附加文件)1:表S3)。组装的转录物的长度在附加文件中示出1:表S4。
注:种子转录组中不存在的PUTs和Cl/118转录本未接受任何读取,因此其RPKM在所有阶段均为0,然后从差异表达分析中删除。
对于每个样本的表达定量,使用BWA将所有清洗后的reads映射回整合的转录本集[23].之后使用SAMTOOLS处理映射结果[24要获取读取计数,然后使用内部Perl脚本处理,以导致每个转录物的RPKM值。
通过将TransDecoder应用于默认参数,除了用于编码模型的默认参数之外,可以获得开放阅读框(ORF)预测。p的抗旱性,由手工策划的完整文本。TransDecoder在数据集中识别出36,106个orf。
功能注释和富集分析
为了对产生的orf进行功能特征分析,对拟南芥TAIR10数据库进行了blastP分析(e-value cut 1e-5)。所有orf也用interproscan (v5.13.52)分析蛋白结构域[25]根据InterPro域确定可能的GO项。为了确定我们数据集中的假定转录因子(TF),所有ORF均根据植物转录因子数据库PlantTFDB v3.0进行筛选[26使用blastP (e值切断1e-5)。
利用WeGO (Web Gene Ontology annotation Plot)工具对胚胎和巨配子体中差异表达转录本进行基因注释分析和功能富集[27]及AgriGO分析工具包[28分别)。在功能富集分析中,将注释的种子转录组作为背景/参考基因组。统计方法采用超几何检验,FDR值调整后(cut-off 0.05),基因本体论类型选择完全GO。
鉴定差异表达的转录物
(ⅰ)胚胎和雌配子体在相同的发育阶段(E1 VS M1,E2 VS M2,E3DO VS M3,E3SU VS M3和E4 VS M4),(:差异表达的转录物(DETS)的识别,分别之间进行成对比较ⅱ)在胚胎连续发育阶段(E1 E2 VS,E2 VS E3DO,E3DO VS E4,E3DO VS E3SU)和(iii)在连续的发育阶段雌配子体(M1 M2 VS,M2 M3 VS,M3 VS M4)。的相对倍数变化(FC)呈现为RPKM比率(样品A /样品B)的LOG2。用FC高于2转录物被认为是差异表达的转录物(dets的)。当一个样本的RPKM值为0(没有表达检测的)的倍数变化不能被估计。在这些情况下99点-99的值被分配为相对倍数变化。此外,当RPKM值在样品中的一个为0,并在其他低于10,所述转录物被排除的差异表达分析。
已经使用在线网络工具绘制了Venn图表http://bioinformatics.psb.ugent.be/webtools/Venn/.
K均值聚类分析(大于2 FC更高和RPKM超过10)的dets的子集执行任何在胚胎和在雌配子体的不同发育阶段之间的成对比较的检测。首先,对于每个DET的相对表达值是由来自不同发育阶段的所有RPKM值归一化到其最大RPKM值来计算。簇的最佳数目是为胚胎和大配子体数据分别估计,并使用k均值中的R软件功能进行聚类归一化值。
定量rt - pcr
在Bio-Rad CFX Connect™实时PCR检测系统循环仪(Bio-Rad Laboratories)中进行定量RT-PCR。所有样品均在从5个生物重复的5ng cDNA中开始重复,每个发育阶段。延长因子1(EF1.) 和PHOSPHOGLUCOMUTASE(无机磷)用作参考基因[12].在2后进行相对定量分析-ΔΔctLivak方法。仅包括在四种生物重复中至少三种生物重复中的至少三种表达表达谱的转录物。测试的转录物的引物序列被示出为附加文件2:表S5。不同发育阶段的转录本积累存在显著差异t -检验平均数比较分析(P. ≤ 0.05) using the JMP software (v11).
为了验证RNA-seq数据,使用qRT-PCR检测用于测序的相同RNA。从胚胎中合成新的cDNA,并使用quantitative Whole Transcriptome kit (Qiagen)进行扩增,如上所述。根据制造商说明,使用PrimeScript™RT reagent Kit (Takara)合成巨生植物的cDNA。通过RNA-seq和qRT-PCR计算胚胎中23个候选转录本和巨子生植物中7个选择的det(参与应激和刺激反应)的表达谱之间的Pearson相关系数(附加文件)2:表S6)。利用Microsoft Excel中的Pearson统计函数估计相关系数。
结果和讨论
种子中转录组的概述
为了鉴定转录物和涉及在欧洲赤松早期胚胎发生的合子的生物过程,RNA从胚胎和雌配子体代表四个发育阶段分离(图1).采用454罗氏测序技术对9个RNA-seq文库进行测序。总共生成了660万个原始读取,产生了121,938个文本,长度从150到18,101 bp不等,平均长度为1242 bp(附加文件1:表S1, S2, S3和S4)。
总共有36,106种含有ORF的转录物在种子转录组中鉴定,其中28,190转录物(78%)对此有显着对准拟南芥TAIR10数据库和7404转录物(20%)与植物转录因子数据库(表1).26743个转录本(74%)已将GO术语标注为至少三个主要类别中的一个:22,362个转录本(60%)显示与生物过程相关的一个或多个本体,24,259个(67%)显示与分子功能相关的本体,19,301个(53%)显示与细胞成分相关的本体。
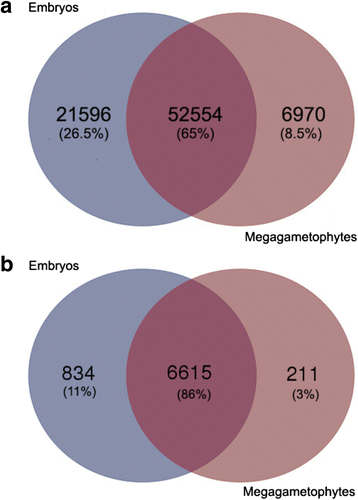
转录物表达值计算为RPKM,导致81120个组装转录与可检测的表达信号(RPKM> 0),在发育阶段的至少一种(表1).在胚胎和巨配子体中分别检测到74 150和59 526个转录本。大多数转录本(65%)均在两种组织中检测到,但胚胎中独特转录本的数量比巨子生植物中高3倍(图)。2).在胚胎中鉴定的转录因子(TFs)的数量也较高(图。2 b).
在种子发育过程中的每个发育阶段检测到的转录物的总数在胚胎中增加,但在大配子体下降(表2).大约15000个转录本在胚胎和巨配子体的所有发育阶段都有表达。在胚中,在特定发育阶段检测到的独特转录本数量相当稳定,但在种子发育过程中,巨配子体中从M1阶段的10,907个转录本减少到M4阶段的3201个转录本(补充文件)1:图S1a和b)。在早期胚胎发育期间鉴定的7404个TFS中,在所有发展阶段检测到3734个TFS(50%),只在一个发展阶段检测到约140个TFS(附加档案1:图S1C)。在大配子体,转录因子3775(56%)在所有发育阶段进行检测,然而,转录因子的数量检测在种子发育过程中只有一个发育阶段降低(附加文件1:图S1D)。
为了测试RNA-SEQ结果的可靠性,选择30种转录物(胚胎中的23个转录物和在兆甘油癣中的7种转录物)进行QRT-PCR检查。通过RNA-SEQ和QRT-PCR获得的表达谱系之间的Pearson相关系数分别从每个转录物计算(附加文件2:表S6)。除了个别转录本在某些时间点的相关系数外,大多数转录本的相关系数是相似的。
种子发展过程中成绩单积累的变化
在种子发育过程中胚胎和MegameTophytes的成对比较中的差异表达转录物
为了鉴定差异表达转录本(DETs),我们对胚胎和巨配子体在同一发育阶段进行了两两比较。共18638个转录本在胚胎和巨子生植物之间的至少一个成对比较中被上调,其变化倍数高于2 (FC > 2)(附加文件)3.:图S2A,附加文件4.).在胚胎中有12,906个转录本上调,在巨配子体中有5732个转录本上调。胚胎和巨配子体在发育第2阶段的转录本上调量差异最大(附加文件)3.:图开通)。
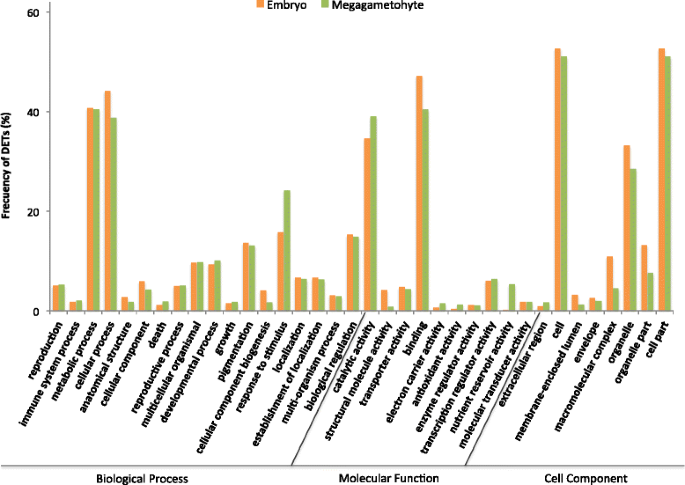
胚胎中有54%的DETs上调,巨子生植物中有58%的DETs上调可以被GO注释(附加文件)3.:图S2A)。细胞过程和代谢过程在胚胎和巨子生植物的生物过程中都是最主要的群体(图2)。3.).此外,被指定对刺激作出反应的转录本在巨生植物中有过多的代表性。在胚胎和巨子生植物中,分子功能类的氧化石墨烯富集具有催化和结合活性,细胞成分类的细胞和细胞部分的氧化石墨烯富集最多。
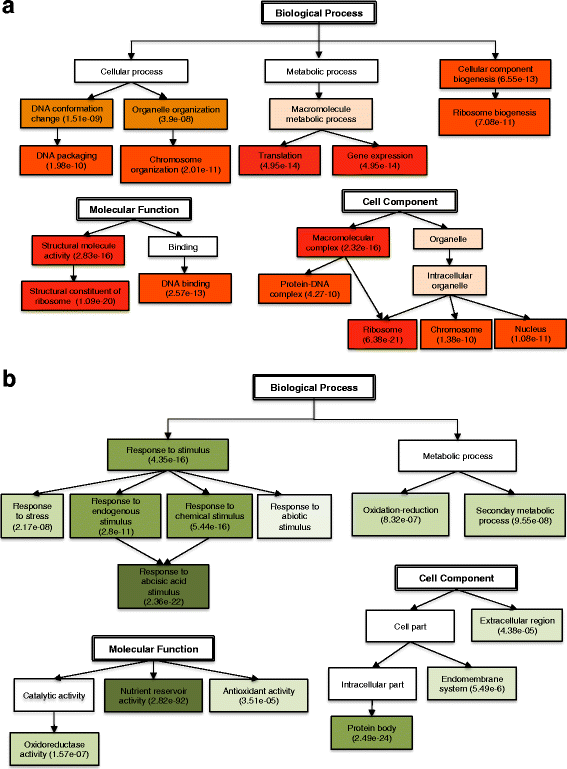
通过增加GO注解的水平,我们发现转录物上调胚胎富集不同生物过程,诸如细胞成分的生物合成以及与染色体组织细胞和代谢过程,DNA包装,翻译和基因表达(图4和附加文件3.:图S3)。在MegAgameTophytes中,高调节的转录物响应于刺激而高度富集,例如对应激和化学和内源刺激的响应,包括对脱钙酸(ABA)的反应(图。4 b和附加文件3.:图S4)。在分子函数类别中,胚胎中的作用主要与核糖体的DNA结合和结构组分有关。两种活动与基因表达和蛋白质合成具有高度相关。在MegAgameTophytes中,在营养储存器活性中发挥的转录物高度超过(FDR = 2.82E-92)。细胞组分类别中胚胎中鉴定的转录物显示核,核糖体和蛋白质-DNA复合物的富集(图。4)和巨生植物的转录本主要富集在蛋白质体成分(图。4 b).正如预期的那样,胚胎中转录本上调表明氧化石墨烯在dna包装、翻译和基因表达的不同细胞过程和功能中富集。这些过程在活跃的细胞增殖过程中非常重要[29].转录在雌配子体上调被富集用于储存材料和响应的累积对化学和内源性刺激。这可能表明,大配子体,以类似的方式与胚乳,可以感测环境信号,并诱导相应的信号传导途径,用于调节胚胎发育[30.].
早期的种子发育过程中差异表达的转录基因本体论(GO)富集分析总结。的一种nalysis included DETs with a fold change greater than 2 (FC > 2) identified in any of the pairwise comparisons between embryos and megagametophytes. The most abundant classes in each category, Biological Process, Molecular Function and Cell Component are shown for一种胚胎和B.megagametophytes。浓缩程度与颜色强度成正比。括号中显示了FDR值。详细信息见附加文件3.:图S2和S3
我们在每组转录物组之间进行成对比较,显示每个发育阶段的胚胎和MegagameTophytes之间丰富的最高差异(附加文件5.).与拟南芥细胞色素p450基因家族的成员有关的转录物(CYP78A7那CYP78A8和CYP71B22)表明,在所有发育阶段,胚中积累量高,而巨子生植物中积累量低或无积累(RPKM接近0)。巨配子体中上调的转录本主要与拟南芥12S种子贮藏蛋白家族相关(CRB那儿童权利公约那CRD),也称为十字花科素。这些蛋白质参与营养库的活动,是种子萌发早期氮和碳的主要来源[31].十字花科素相关转录本的RPKM值在各个发育阶段相似。大多数在巨生植物中上调的转录本在TAIR数据库中没有命中(附加文件5.).
在E1、E2和E3DO阶段,检测到细胞壁修饰基因(膨胀素、纤维素代谢、内切葡聚糖酶、果胶乙酰酯酶和果胶裂解酶)的相关转录本。特别是在E1阶段,一个假定的同系物体细胞胚胎发生受体样激酶1(SERK1)那以及与生长素和其他激素反应相关的基因转录本,比如INDOLE-3ACETATE O-METHYLTRANSFERASE 1(Iamt1.),SKP1-LIKE蛋白1(SKP1A),GAMMA-VACUOLAR-PROCESSING酶(GAMMA-VPE)赤霉素调节蛋白2(GASA2) 和谷胱甘肽S-转移酶U17(GSTU17)非常丰富(附加档案5.,同比E1)。与核小体装配(组蛋白)的转录物在所有发育阶段检测到,除了在阶段E1。即,非特定的其他转录物来自阶段2上调起编码有关的应激反应蛋白脂质转运蛋白3(LTP3),糖转运蛋白13(STP13) 或者脱落酸不敏感4(ABI4).在阶段E4上调节的转录物包括与细胞信号传导,细胞分裂和细胞壁的阴性调节有关的转录物,以及与发展有关的转录物,如蛋白质RALF样34(Ralfl34.),法玛,PLANTACYANIN(ARPN)或果胶乙酰酯酶(PAE9)(额外的文件5.,上E4)。
在种子发育早期共检测到7704个转录因子(见表)1).出于这些TFS,2890差异表达,折叠变化高于胚胎和MegameTophytes(附加文件)6.).差异表达的tf属于78个家族,其中bHLH、FAR1、TRAF和NAC家族最大(附加文件)7.:图S5及附加文件6.、家庭分布)。总的来说,每个科的转录因子在胚胎中都比在巨配子体中多。有趣的是,在种子发育过程中,一些TF家族在胚胎和巨配子体中富集程度不同,如bHLH、C3H、NAC、AP2-EREBP和TRAF(附加文件)7.:图S6)。此外,有16个TF家族仅在胚胎中检测到,4个TF家族仅在巨配子体中检测到。一般来说,在胚胎中特异表达的几个家族的TF参与了植物的生长发育,而只在巨配子体中检测到的TF家族则与对胁迫和其他刺激的反应有关[32-34].
胚胎发育期间差异表达的转录物
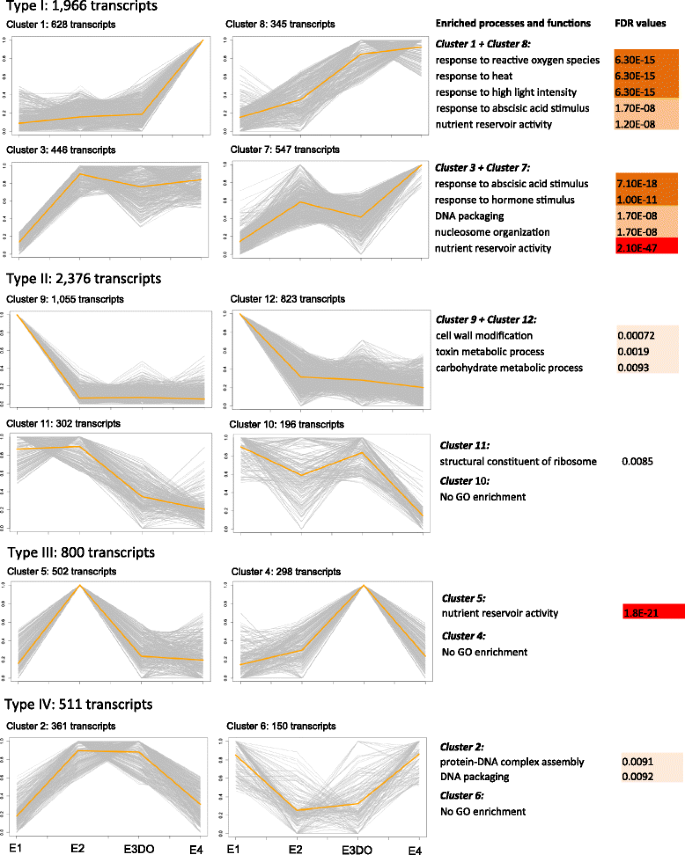
在不同发育阶段的胚胎之间的成对比较中,鉴定了18,234个折叠变化的DEC,在不同发育阶段之间的成对比较(附加文件8.:图S7)。当只包含带有RPKM > 10的转录本时,检测到6669个DETs。通过k-means聚类分析(不包括次级胚胎的DETs),对胚胎发育过程中DETs的表达模式进行了综述。检测到四种类型的表达谱,其中I型和II型各包含四个簇,III型和IV型包括两个簇(图2)。5.).在整个胚胎发育过程中,属于I型的转录物的积累增加。簇1和8中的转录物特异性地富集与对非生物胁迫的反应相关的方法,并且群体3和7的转录物用于营养储层活性(FDR = 2.10e-47),对ABA和其他激素的反应进行高度富集。胚胎发育期间II型转录物的表达降低。然而,累积模式在四个集群中不同。簇9和12中的转录物对细胞壁改性,毒素和碳水化合物代谢过程具有丰富,而群体11包括核糖瘤的结构成分的函数的较多的转录物。III型转录物仅在一个中间发育阶段(E2或E3DO)显示高累积。簇5内的转录物主要在e2阶段累积,以营养储存活性高度富集。然而,没有获得显着的富集群体4. IV型转录物的表达水平在E2和E3DO阶段的高或低。簇2包括DNA包装和蛋白质-DNA复合组件中涉及的转录物。 Together the GO enrichment analyses of the clusters showed that the abundance of transcripts related to stress response and nutrient activity increased during embryo development, while the abundance of transcripts related to cell wall modification decreased.
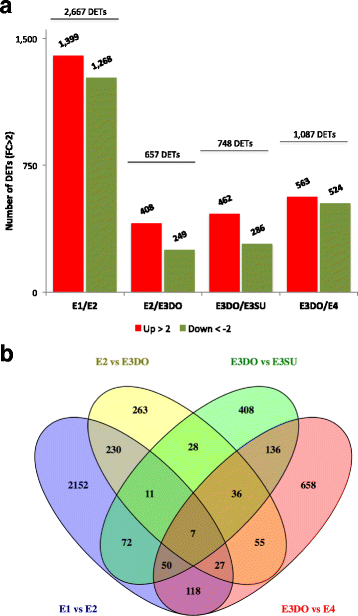
当比较连续发育阶段的胚胎时,检测到包括从属胚胎,4411个DET。在阶段E1和E2的胚胎之间的比较中检测到最多的DECs(2667),并且仅在该成对比较中检测到80%(2152)所述的这些DECs(图。6a和b).在阶段E1中积累的DECS高积累,富集了与细胞壁松动,组织和改性有关的生物过程,β-扩展蛋白(EXPB1) - 具有最高折叠变化的重新转录(附加文件9., E1xE2)。此外,检测到几种发育过程中涉及的28个TFS,其中包含与之相关的转录物LOB域,含蛋白质29(LBD29) 和SERK1,以及属于同源框亮氨酸拉链蛋白家族一些成员(HAT5和HB13.),显示高折页变化(附加文件8.:表S7和附加文件10, E1xE2)。E2中超标的转录本在ABA响应、激素刺激、核小体组织和营养库活性相关过程中富集(附加文件)9.E1xE2下来)。这些det包括21个用于开发过程的GO注释的tf(附加文件8.:表S7和附加文件10E1xE2下来)。
当比较E2期和E3DO期胚胎时,鉴定出接近660个DETs(图。6). 分配给ABA和激素刺激反应的转录物在E2期显示出较高的积累,而参与非生物胁迫反应的转录物在E3DO期富集(补充文件9.,e2xe3do)。当在阶段E3DO和阶段E4,检测到阶段E4,检测到1087例时(图。6).E3DO胚胎中上调的转录本主要与轴的规范过程有关,而E4期上调的转录本则参与激素刺激反应和脂质运输的相关过程(LTP3和LTP4)(额外的文件9.E3DOxE4下来)。转录因子在E3DO和E4期胚胎中差异表达,与发育过程相关,包括转录因子生长素反应因子2(ARF2.),leunig(耳舌),Wuschel相关的Homeobox(WOX.),CYP78A7和拟南芥NAC含有蛋白质9的域(ANAC009)(额外的文件8.:表S7和附加文件10).
通过比较E3期显性胚和从属胚,共检测到748例det(图2)。6).许多转录本在显性胚胎中上调与碳水化合物代谢过程和轴规范过程有关(附加文件)9.,E3DOxE3SU向上)。在次级胚胎中富集的DET参与了水分胁迫(包括水分剥夺)和脂质转运的反应。NAC和HB是显性胚胎中最大的TF家族,而在次级胚胎中,MYB相关因子最为丰富(补充文件)10,TF家庭)。
从胚胎发育的连续阶段的两两比较中获得的结果的概要图如图所示。7..我们的研究结果表明,细胞壁修饰、激素信号、轴规范和应激诱导反应的过程在早期胚胎发育中被激活。在胚胎模式形成过程中,细胞分裂、伸长和粘附的严格调控至关重要。生长素可能是植物中最普遍的信号分子,在许多发育过程中都有涉及,包括被子植物和针叶树的胚胎发生[35-37]. 几项研究表明,在早期胚胎发育过程中,与应激相关的基因过度表达[12那16那17那38].此外,许多属于最大家族的差异表达tf (bHLH、FAR1、NAC和AP2-EREBP)与细胞和发育过程、激素信号转导和应激反应有关[39-42].
巨生植物不同发育阶段转录本的差异表达
在连续发育阶段的巨生植物的两两比较中鉴定出的DETs也进行了k-means聚类,得到12个不同的聚类,分为5种类型的表达谱11:图S8)。没有重大的富集过程或功能(FDR <0.05)被分配给任何群集。I型转录物的累积从阶段M1增加到阶段M4。与刺激刺激和调节相关的转录物是最丰富的。II型转录物的表达从阶段M1降低至阶段M4。II型簇在与细胞墙组织相关的GO术语的转录物中丰富,以及生殖和发育过程。在阶段M2或阶段M3中累积III型转录物。转移到III型集群的GO术语主要与刺激措施相关。IV型和v包括每个小集群。簇6具有在阶段M2和M3中累积的转录物,呈现了响应刺激的高百分比,而来自簇11的转录物仅注释代谢和细胞过程。
在连续发育阶段的MegAgameTophytes之间的成对比较中检测了总共600个DEC(Fc <2,RPKM> 10)。在任何一对比较中没有发现显着的浓缩过程或功能。与胚胎类似,在从阶段M1到M2的转变期间检测到最大数量的DEC,并且在此成对比较中专门检测到85%的DED(附加文件11:图S9a和b)。用于发育过程的转录物的数量在阶段M1至2的阶段M1至2中降低。同时,与应力和刺激响应相关的GO术语的DEC的数量仍然更加常量(附加文件11:图S9C)。此外,小热休克蛋白(sHSP)家族蛋白的转录本编码在应激反应中发挥着重要作用,在所有发育阶段都显示出类似的积累(附加文件)12,m1xm2向下,m2xm3向上)。
在M1阶段特别检测到10个与发育相关的具有指定GO术语的DETs,其中推定的同源蛋白(EXPB1和敏锐的疯子盒(AGL11)都包括在内。AGL11在任何发育阶段没有在胚胎中检测到。如此AGL11在胚乳中表达但不是胚胎Broachypodium distachyon.(EMBL-EBI表达图谱数据)。一些与金属离子传输有关的转录本,例如。铜转运蛋白5(COPT5) 和锌转运体11(ZIP11)那在阶段M1检测到(附加文件12,m1xm2向上)。在胚胎种子中检测到参与胚胎和胚乳发育期间的离子易位的拉链转运仪[43].在M4阶段,一个与AtEP3,编码为endochitinase,非常丰富(附加文件12,m3xm4 down)。一种同源基因,Chia4-PA1已显示在挪威云杉种子的MegAgameTophyte中的腐蚀腔周围的单个细胞层分区中表达[44].
胚胎早期发育中所选转录本的表达
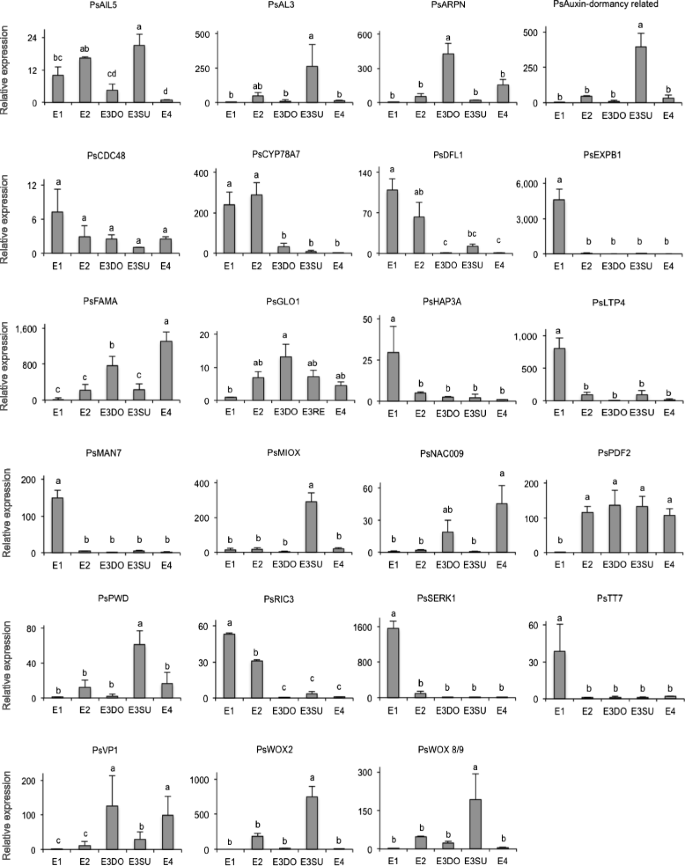
采用qRT-PCR检测4个生物重复中所选DETs的转录水平。该选择是基于从其他物种(主要是拟南芥)的转录组数据和功能注释中获得的与胚胎发育相关的同源基因的估计表达量(RPKM值)。针叶树的基因序列信息是有限的,为了方便起见,我们将每个针叶树的转录本都指向序列相似度最高的拟南芥基因。我们采用这种方法,是为了能够大致了解在早期胚胎发育过程中哪些过程可能是重要的。qRT-PCR分析结果如图所示。8..
与之相关的成绩单ENDO-BETA-MANNASE 7(MAN7),透明测试7(TT7),EXPB1那SERK1那LTP4,hap3a.在阶段E1中的高度丰富,在阶段E2阶段显着下降。
在拟南芥种子中,甘露杀酶编码基因,AtMAN7,表达于珠孔胚乳和胚根萌发前的胚根尖[45]. We assume that the high expression ofPSMan7.在E1胚胎中,可以促进他们渗透到营养丰富的MegAgametophyte中。
早期胚胎发生是通过主要由营养流入和流出载体介导的定向养蛋白转运建立顶端基底极性的关键发育阶段[46].此外,黄酮醇可以作为养蛋白运输的负调节剂[47].attt7.编码黄酮类化合物3'Hydroxylase,一种黄酮醇生物合成酶。下调PSTT7.从阶段E2可能反映出从切割阶段和进一步胚胎发育过程中增加的植物素转运。以前的研究与细胞壁松动,膨胀,兼容或分离中的扩展蛋白的作用相关[48那49]. 高度表达PsEXPB1在阶段E1可能表示松开细胞壁以允许分离四种早期胚胎的重要性。AtSERK1标记细胞有能力以形成胚胎,并且它也影响细胞的能力分化成胚胎[50].的高表达PsSERK1在阶段E1可能对刺激四个顶端细胞来分化成单独的胚胎是重要的,从而刺激切割过程开始。直接在第一次切割后,四个新的胚胎应该进一步发展。我们假设对下调PsSERK1对阻止第二轮卵裂很重要。
另一组成绩单,由推定的同源物代表CYP78A7那光矮星1(DFL1) 和rop -交互式婴儿床基序含蛋白3(RIC3.),在E1期也很丰富,但在发育后期逐渐减少。
细胞色素P450参与植物细胞中大多数激素和许多次生代谢产物的代谢。CYP78A家族成员在水稻中的过度表达(奥雅萨苜蓿)促进细胞增殖,但降低胚的大小[51].此外,基因产物AtDFL1,参与养肝信号转导,可以抑制细胞伸长率[52].在显性胚胎的发展之前,四种早期胚胎是相等的。尽管尚未知道哪种机制限制阶段2胚胎的胚胎质量的生长,但我们的结果表明PSCYP78A和PSDFL1可能涉及。AtRIC3对花粉管的尖端生长很重要[53].早期胚胎松属,卵裂过程后发育,通过顶端细胞生长开始发育[7.]. 高度表达Psic3.E1期和E2期可能反映了这些胚胎是通过顶端细胞生长发育的。
与之相关的成绩单水平NAC009.那生物那PROTODERMAL FACTOR2(PDF2)那和viviparous1.(VP1)在E1期较低,但在后期升高。假定的同源染色体,PLANTACYANIN(ARPN) 和乙二醛酶我(GLOI)在E3DO期表现出较高的积累。此外,在从属胚胎中观察到与相关的转录本丰度峰值WOX2.那WOX8 / 9.那Aintegumenta样5(PsAIL5),PHOSPHOGLUCAN水二激酶(PWD),肌肉肌醇加氧1(miox1.),阿尔芬般的3(与)以及编码生长素休眠相关蛋白的转录本。
ANAC009在根冠干细胞中表达,其中它促进平周细胞分裂[54].FAMA是一种基本的螺旋环 - 螺旋蛋白,调节在气孔发育过程中分裂与分化之间的关键开关[55]. 在挪威云杉中,早期胚胎发育过程中的顶端-基部极化通过建立胚胎团的分生组织细胞和末端分化、扩张的胚柄细胞进行[56].的高表达PsNAC009和PsFAMA在E3DO和E4阶段,而不是E3SU阶段,可能反映了正确的细胞分裂方式对优势胚胎发育的重要性。PaWOX8/9在挪威云杉胚胎发生的早期和晚期调控胚胎团基底部细胞分裂面的方向[57].如此PsWOX8 / 9然而,在所有分析的发育阶段表达,阶段E3SU的表达显着高。虽然我们不知道如何过表达PaWOX8/9影响早期胚胎发育,人们倾向于认为PsWOX8 / 9在下属胚胎中抑制胚胎的进一步发展,或者只是由其他因素引起的阻塞发育的结果。在拟南芥植物过表达AtARPN,内皮雌性退化,可能是由于植物素蛋白诱导的早期PCD [58].PCD消除了苏格兰松和挪威云杉早期胚的末向分化胚柄细胞[9.那59].的高表达Psarpn.在E3DO和E4胚胎中,胚柄细胞的退化与胚柄细胞的退化相一致,而在E3SU中则不一致。综上所述,这些结果表明,顶端-基底极化在优势胚中受到严格的调节,而在从属胚中则没有。
云杉同源框1(多环芳烃B1),的同源物AtPDF2,Pawox2.是挪威云杉体细胞胚原胚层的重要指标[60那61].此外,挪威云杉的表达LTP.基因(PA18)从ProMbryogenic肿块中的均匀表达切换到开发体细胞胚胎的特异性特异性定位[62].我们假设差异表达PsLTP4和PSPDF2反映了原胚层的特征,这表明在显性和从属胚胎中,径向模式以类似的方式被调节。的表达模式Psswox2.类似于PsWOX8 / 9,两种转录物在所有发育阶段表达,但在下属胚胎中具有显着较高的水平。这可能与下属胚胎的堵塞开发有关。
我们之前已经证明过了PsHAP3A在形态发生阶段表达和PSVP1在成熟阶段[63].PsHAP3A在E3DO和E3SU胚胎中均下调,而PSVP1在E3DO中上调,而在E3SU中不上调。过度的拟南芥胚胎制剂(AtEMK),它与Atail5.导致在幼苗上形成胚胎状结构[64].作者的结论是AtEMK是维持胚胎身份的关键因素。的PsAIL5转录物在E3DO中下调,但不在E3SU胚胎中。连胜,表达低PSVP1和高表达PsAIL5在从属胚胎中,表明从形态发生相到成熟阶段的转变在下属胚胎中未完成.
尽管在胚胎发育期间,编码与PWD,MIOx1,Al3和疾病 - 休闲相关蛋白质相关的蛋白质的基因的功能尚不清楚,但它们在E3DO和E3SU胚胎中差异表达的事实表明了主导和下属之间代谢过程的差异胚胎。
基于在GO富集分析和所选择的转录物的表达确定的进程我们建议关系到胚发生能力和细胞壁松弛该过程参与激活裂解过程。切割后直接,胚胎的生长受到限制。顶端 - 基底端极化中占主导地位的胚胎,这已经达到了成熟阶段严格监管。不过,在我们就会明白控制早期胚胎的连续发展的过程的功能性研究必须执行。
结论
在这项研究中,我们在早期种子发育过程中分析了成绩单积累的变化。在胚胎和配子体差异表达的转录的GO富集分析强调了在胚胎和存储材料的积累和成绩单应对不同的刺激雌配子体中涉及DNA复制和翻译不同的细胞过程和功能的重要性。与胚胎源性,细胞壁修饰,细胞分裂模式,轴规格和对激素的反应相关的转录物在胚胎发育期间高度丰富和差异表达。通过QRT-PCR分析验证了胚胎发育不同阶段的代表性Dets的丰富。
然而,必须考虑到,我们必须专注于所表征的基因。对差异表达基因的进一步函数研究,以及至少已经注释于没有已知功能或完全缺乏有原植物同源物的有贪眼的基因的那些的功能研究将增加我们对胚胎发育调控的理解松树.
缩写
- 依据:
-
差异表达成绩单
- 美东时间:
-
表达序列标签
- FC:
-
折叠变化
- FDR:
-
假发现率
- 走:
-
基因本体论
- 子:
-
开放阅读框架
- 纤毛运动:
-
程序性细胞死亡
- PlantTFDB:
-
植物转录因子数据库
- 把:
-
假定的序列
- QRT-PCR:
-
定量逆转录聚合酶链反应
- RPKM:
-
每百万映射读取每千碱基读
- 塔尔:
-
拟南芥信息资源
- TF:
-
转录因子
参考
- 1.
迪斯ILS,迈耶U,JLau S,迈耶U,尤尔根G.胚胎 - 植物生命的不起眼的开始。植物杂志2010; 61(6):959-70。
- 2.
史密斯SA,蟠龙JM,多诺霍MJ。一个不相关的放松时钟分析,提出了开花植物的早期起源。P国家科学院院刊USA。2010; 107(13):5897-902。
- 3.
裸子植物的胚胎学。Handbuch Pflanzenanatomie。在:Zimmermann W CZ, Ozenda P, Wulff HD,编辑。Gebrüder Borntrager,柏林,1978。p . 187 - 241。
- 4.
Chowdhury R.针叶树胚胎学 - 审查。植物形态。1962; 12:313-38。
- 5.
王志强,王志强。维管植物的形态与进化。植物学报。在:Co. WHF,编辑。旧金山:W.H. Freeman & Co.;1989.p。440。
- 6.
Buchholz J.悬挂器和Pinus早期胚胎。BOT GAZ。1918; 66:185-228。
- 7.
松柏属植物的胚胎发育与多胚发育关系。中国科学(d辑:地球科学)(英文版);
- 8.
多格拉人PD。针叶树种子的不育性和胚胎发生的干扰,特别是松科种子试验和树木育种。Studia forestal suec Skogshogsk. 1967(45):97页。
- 9.
Filonova LH, von Arnold S, Daniel G, Bozhkov PV。在多胚植物种子中,细胞程序性死亡消除了除一个胚胎外的所有胚胎。细胞死亡差异。2002;9(10):1057-62。
- 10.
刘建军,郑立军,刘建军,等。火炬松胚胎表达序列标签揭示了其与被子植物胚胎发生的相似性。植物学报。2006;62(4-5):485-501。
- 11.
凯尼J,普拉曼GS。针叶树胚胎发生的细胞和分子生物学。新植物。2007; 176(3):511-36。
- 12.
Vestman D,Larsson E,Uddenberg D,Cairney J,Clapham D,Sundberg E等。全球基因表达变化揭示的挪威云杉体细胞胚胎分化及早期发展的重要过程。树遗传学基因组织。2011; 7(2):347-62。
- 13.
Vega-Bartol JJD,Simoes M,Lorenz WW,Rodrigues As,Alba R,Dean JFD等。转录组分析突出了Pinus Pinaster Zygotic胚胎发育过程中的表观遗传和转录调控。BMC植物BIOL。2013; 13(123)。
- 14.
Wang Z,Gerstein M,Snyder M.RNA-SEQ:转录组织的革命性工具。NAT Rev Genet。2009; 10(1):57-63。
- 15.
卢晓东,陈德良,舒东风,张震,王文祥,Klukas C,等。玉米种子发育早期胚和胚乳转录网络的差异(1[C][W][OA])植物杂志。2013;162(1):440 - 55。
- 16.
金福,胡ls,元dj,xu j,gao wh,他lr等。棉花体细胞胚胎(SES)和Zygotic胚胎之间的比较转录组分析:SE发展中应力反应功能的证据。植物Biotechnol J. 2014; 12(2):161-73。
- 17.
Salvo SAGD、好施中国、贝尔CR、卡普勒SM、卡普勒HF。玉米体细胞胚胎发生早期的全转录组分析揭示了胁迫因子和胚胎发生相关基因表达的改变。公共科学图书馆一号。2014;9(10).
- 18.
杨XY,张XL,元DJ,金FY,张YC,XU J.转录性分析揭示了复杂的养羊石信号通路和棉花体细胞胚胎发生过程中的复杂化和转化症。BMC植物BIOL。2012; 12。
- 19.
张义,张某,韩Sy,李XM,齐LW。转录组分析和日本落叶松(Larix Leptolepis)的体细胞胚的分析。植物细胞批准。2012; 31(9):1637-57。
- 20.
Canas Ra,Canales J,Gomez-Maldonado J,Avila C,Canovas FM。使用激光捕获微小纤维和454焦磷酸纤维松树的转录组分析。树生理。2014; 34(11):1278-88。
- 21.
董庆福,王志强,王志强。植物基因组数据库及其分析工具。核酸学报2004;32:D354-9。
- 22.
付玲,牛波,朱志华,吴胜,李伟。CD-HIT:用于下一代测序数据聚类的加速算法。生物信息学,2012,28(23):3150 - 2。
- 23
李H,Durbin R.快速准确的短读对齐与挖洞轮转变换。生物信息学。2009; 25(14):1754-60。
- 24
关键词:SNP,突变发现,关联图谱,遗传参数估计生物信息学。2011;27(21):2987 - 93。
- 25
Jones P,Binns D,Chang Hy,Fraser M,Li Wz,Mcanulla C等人。Interprocan 5:基因组级蛋白质功能分类。生物信息学。2014; 30(9):1236-40。
- 26
金金平,张浩,孔林,高刚,罗建军。植物转录因子功能和进化研究的门户。42(D1): D1182-7。
- 27.
叶j,方l,郑香港,张烨,陈俊,张紫猫。Wego:用于绘制GO注释的Web工具。核酸RES。2006; 34:W293-7。
- 28.
杜Z,周X,凌Y,张ZH,苏Z. agriGO:为农业社区GO分析工具。核酸RES。2010; 38:W64-70。
- 29.
Wickramasuriya,Dunwell JM。全球规模转录体外亚洲胚胎发生分析。BMC基因组学。2015; 16。
- 30.
颜DW,Duermeyer L,Leoveanu C,胚乳种子萌发过程的Nambara E.中的作用。植物细胞生理学。2014; 55(9):1521至1533年。
- 31.
李Q,BC王,徐Y,朱YX。期间拟南芥种子成熟和早期幼苗发芽阶段12S种子贮藏蛋白的积累和降解模式系统的研究。生物化学与分子生物学杂志。2007; 40(3):373-81。
- 32.
Tsuda K, Tsuji T, Hirose S, Yamazaki K.三种具有不同表达谱的拟南芥MBF1同源物作为转录辅助激活因子发挥作用。植物生理学报。2004;45(2):225-31。
- 33.
Teotia S,Muthuswamy S,RS羔羊。自由基诱导的细胞death1和类似RCD one1和应激诱导的形态发生反应。植物信号Behav。2010; 5(2):143-5。
- 34.
刘玉克,江益,兰杰布,邹y,高吉普。桉树邓尼生冷驯化响应的比较转录组分分析。Plos一个。2014; 9(11)。
- 35.
李志强,李志强,李志强,等。依赖外排的生长素梯度建立拟南芥的顶-基轴。大自然。2003;426(6963):147 - 53年。
- 36.
拟南芥(Arabidopsis thaliana)的胚胎模式研究。《细胞发展生物学》2007;23:207-36。
- 37.
生长素极性运输的抑制导致挪威云杉胚发育异常。新植醇。2008;177(2):356 - 66。
- 38.
becerra c,puigdomenech p,vita。计算和实验分析识别在早期种子发育期间特异性表达的拟南芥基因。BMC基因组学。2006; 7。
- 39.
Carretero-Paulet L,Galstyan A,Roig-Villanova I,Martinez-Garcia JF,Bilbao-Castro JR,Robertson DL。拟南芥,杨树,水稻,苔藓和藻类的BHLH系列转录因子的基因组分类和进化分析。植物理性。2010; 153(3):1398-412。
- 40。
El Ouakfaoui S,Schnell J,Abdeen A,Colville A,Labbe H,Han S等人。AP2转录因子对体细胞胚胎发生和胚胎发育的控制。植物mol biol。2010; 74(4-5):313-26。
- 41。
唐W,吉q,黄y,姜z,bao m,wang h等。远红细长的胚乳3和远红色受损反应1转录因子在拟南芥中整合光和脱钙信号。植物理性。2013; 163(2):857-66。
- 42.
海洋松(Pinaster Pinaster)的NAC转录因子家族:参与胁迫反应的两个基因的分子调控。15.生物谷bioon . 2015;
- 43.
李淑珍,周晓军,黄玉强,朱丽丽,张淑娟,赵玉飞等。玉米锌调控转运体、铁调控转运体样蛋白(ZIP)基因家族的鉴定与特性分析。13.生物谷bioon . 2013;
- 44.
Wiweger M,Farbos I,Ingouff M,Lagercrantz U,Von Arnold S.在挪威云杉(Picea Abies)的体细胞和Zygotic胚胎发育过程中Chia4-Pa Chitinase基因的表达:裸子植物和幼儿植物级别几阶段三胰酶之间的相似之处和差异。J Exp Bot。2003; 54(393):2691-9。
- 45.
Iglesias的费尔南德斯R,巴雷罗-西西里C,Carrillo的-巴拉尔N,奥尼亚特桑切斯L,Carbonero P.拟南芥bZIP44:影响种子的发芽和甘露聚糖酶编码基因的AtMAN7表达的转录因子。植物杂志2013; 74(5):767-80。
- 46.
王志强,王志强,王志强,等。植物生长素运输途径的研究进展。发展。2009;136(16):2675 - 88。
- 47
Lewis Dr,Ramirez MV,Miller Nd,Vallabhaneni P,Ray WK,Helm RF等。养羊酸和乙烯通过不同的转录网络诱导黄酮醇累积。植物理性。2011; 156(1):144-64。
- 48
陈飞,王志强,王志强。在番茄种子发育和萌发过程中,两个扩展蛋白基因在胚中表达和定位存在差异。植物杂志。2001;127(3):928 - 36。
- 49
科斯格罗夫DJ,李LC,赵HT,霍夫曼 - 本宁S,摩尔RC,扩展蛋白的布莱克D.不断发展的世界。植物细胞生理学。2002; 43(12):1436至1444年。
- 50。
Hecht V, Vielle-Calzada JP, Hartog MV, Schmidt EDL, Boutilier K, Grossniklaus U, et al.;拟南芥体细胞胚发生受体激酶1基因在胚珠和胚发育中表达,在培养过程中增强胚发生能力。植物杂志。2001;127(3):803 - 16。
- 51。
杨WB,高MJ,YIN X,LIU JY,XU YH,ZENG LJ等。用新型细胞色素P450控制水稻胚胎发育,射击顶端营养性维持和谷粒产量。莫尔植物。2013; 6(6):1945-60。
- 52。
中泽M, Yabe N, Ichikawa T, Yamamoto YY, Yoshizumi T, Hasunuma K,等。生长素响应基因GH3的同源基因DFL1负调控茎细胞伸长和侧根形成,正调控下胚轴长度的光响应。植物j . 2001; 25(2): 213 - 21所示。
- 53.
吴国栋,顾勇,李树华,杨志强。拟南芥与Rop互作GTPase靶点的CRIB基序蛋白的全基因组分析。植物细胞。2001;13(12):2841 - 56。
- 54.
Willemsen V,Bauch M,Bennett T,Campilho A,Wolkenfeelt H,Xu J,等。NAC结构域转录因子FEZ和Somberro控制拟南芥根干细胞中细胞分裂平面的方向。开发单元。2008;15(6):913–22.
- 55.
Ohashi-Ito K,Bergmann DC。Arabidopsis Fama在气孔发育过程中控制最终的增殖/差异化开关。植物细胞。2006; 18(10):2493-505。
- 56.
Smertenko AP,Bozhkov PV,Filonova LH,Von Arnold S,Hussey PJ。在Picea的发育编程细胞死亡期间重新组织细胞骨架胚胎胚胎。工厂J. 2003; 33(5):813-24。
- 57.
homobox 8/9在裸子植物挪威云杉(norwegian spruce)胚胎模式形成中起重要作用。J Exp Bot. 2014;65(22): 6543-52。
- 58.
东杰,金斯特,耶和华勋爵。Plantacyanin在拟南芥中繁殖起作用。植物理性。2005; 138(2):778-89。
- 59.
Bozhkov PV,Filonova LH,Suarez MF,Helmersson A,Smertenko AP,Zhivotovsky B等。遮蔽酶是涉及植物编程细胞死亡的主要胱天蛋白酶样活性,对胚胎图案形成是必不可少的。细胞死亡有所不同。2004; 11(2):175-82。
- 60。
homobox 2在裸子植物挪威云杉原胚层和胚柄发育中起重要作用。BMC Plant Biol. 2016;16。
- 61。
Von Arnold S.Pahb1是在挪威云杉胚胎发育的Protoderm中表达的进化保守的HD-GL2 homeobox基因的进化保守的HD-GL2 homeobox基因。创世纪。2001; 30(4):220-30。
- 62。
Sabala I,Elfstrand男,Farbos I,克拉d,在挪威云杉胚胎发育过程PA18,推定的脂质转移蛋白基因,冯阿诺德S.组织特异性表达(云杉)。植物mol biol。2000; 42(3):461-78。
- 63。
Uddenberg D,Valladares S,Abrahamsson M,Sundstrom JF,Sundas-Larsson A,von Arnold S.胚胎源和针叶树中的胚胎发生相关基因的表达受组蛋白脱乙酰酶抑制剂的治疗影响。Planta。2011; 234(3):527-39。
- 64。
在拟南芥胚胎发育过程中,AP2结构域转录因子的编码在植物发育到胚胎阶段的过程中起着关键作用。acta botanica sinica(云南植物学报),2010;43(4):481 - 492。
确认
笔者想感谢贡纳尔Flygh(SLU)为样本采集,康塞普西翁阿维拉和佩皮·戈麦斯(UMA)的RNA测序和胡安·弗朗西斯科为他用脚本建设数据分析帮助。
资金
欧洲共同体的第七框架在第289841号协议(Procogen Project)中计划的第七框架提供支持这项工作。
数据和材料的可用性
本研究中产生的序列读取和表达数据已保存在欧洲生物信息学研究所(EBI)中,并可在ArrayExpress数据库中获得(www.ebi.ac.uk/arrayexpress)在加入号E-MTAB-5193下。RNA-SEQ数据也可以通过Gymno Plaza 1.0(http://bioinformatics.psb.ugent.be/plaza/versions/gymno-plaza/).
作者的贡献
这项研究的最初的设计是由广电和FC成立。MA促进了组织收集和定量RT-PCR。BC分离的RNA和建造的cDNA文库中454焦磷酸测序。LS的确从RNA-seq的谈话重建。IM进行生物信息学分析,RNA分离,定量RT-PCR,数据分析和手稿组织。IM和广电审查的手稿。所有作者都已经阅读并赞成最终的手稿。
利益争夺
两位作者宣称他们没有相互竞争的利益。
同意出版物
不适用。
伦理批准和同意参与
不适用。
作者信息
从属关系
相应的作者
附加文件
额外的文件1:
表S1。在种子转录组中有454个测序reads。表S2。转录组组装结果(由Seqclean修剪)。表S3。转录组整合的结果。表S4。属于种子转录成绩单的长度。图S1。VENN图,显示不同发育阶段的常见和唯一转录物和具有可检测表达式(RPKM> 0)的TFS的数量。Venn图显示(a)胚胎和(b)emagameTophytes的每个发育阶段的转录物的数量。VENN图显示(c)胚胎和(d)兆甘油癣的每个发育阶段的TFS的数量。(PDF 393 KB)
额外的文件2:
表S5。用于qRT-PCR分析的转录本列表。表S6。RNA-seq表达数据的验证。(PDF 88.2 kb)
额外的文件3:
图S2。在胚胎和MegameTophytes之间的每对比较中鉴定的倍数变化的差异表达转录物(DETS)的数量大于2(FC> 2)。(a)在早期种子发育期间在不同发育阶段的胚胎和MegameTophytes(b)胚胎和MegameTophytes(b)胚胎(橙色)和MegagameTophytes(绿色)的上调转录物的数量的总数。图S3。胚胎中上调转录本(FC > 2)的GO富集分析,在图中显示的四个发育阶段的胚胎和巨配子体的任何一对比较中鉴定。1.在生物过程中富集使用AgriGO Toolkit数据库(FDR < 0.05)。高显着水平由红平方根表示。图S4。GO enrichment analysis of up-regulated transcripts (FC > 2) in megagametophytes, identified in any of the pairwise comparisons between embryos and megagametophytes at the four developmental stages shown in Fig.1.使用Agrigo Toolkit数据库获得生物过程富集(FDR <0.05)获得。高显着水平由红平方根表示。(PDF 672 KB)
附加文件4:
差异表达的转录物,折叠变化高于2,在胚胎和Megamagametophytes之间的至少一种成对比较中。该文件分别包括分别由成对比较E1 VS M1,E2 VS M2,E3DO VS M3,E3SU与M3和E4 VS M4中的所有上调转录物中的所有上调转录物中的所有上调转录物的列表。显示抄本名称(抄本ID)和反对TAIR数据库的最佳匹配(在轨迹ID,名称和注释时)。(XLSX 626 KB)
附加文件5:
种子发育不同阶段的胚胎和大配子体中差异表达的转录本。在胚胎和大配子体的不同发育阶段,具有最高倍变化的DET也包括在内。成绩单名称(成绩单ID),折叠更改(日志2E/M)、表达值(RPKM embryo和RPKM Megagametophytes)以及与TAIR数据库的最佳匹配(At locus ID, At name, At annotation)。(XLSX 6.02 kb)
额外的文件6:
转录因子(TFS)差异表达,在胚胎和Megamagometophytes之间的任何一对比较中,倍频变化较高。分别由成对比较E1 VS M1,E2 VS M2,E3DO与M3,E3SU VS M3和E4 VS M4中的胚胎和MegAgameTophytes中的差异表达的TFS(DETFS)列表。指示TF名称(转录ID),TF系列以及与TAIR数据库的最佳匹配(在轨迹ID,名称和注释时)。还包括在胚胎和MegAgameTophytes的种子发育过程中针对每个家庭检测到的所有DETF的数量。(XLSX 200 KB)
附加文件7:
图S5。TF家族上调成员在胚胎和巨配子体中的分布。目前的数据是基于TF家族成员在种子发育过程中的差异积累(FC > 2),在任何一个胚胎和巨配子体的两两比较中。橙色条表示胚胎中属于每个科的tf数量,绿色条表示巨配子体中属于每个科的tf数量。使用公开的PlantTFDB v 3.0数据库将TF分类为TF家族。图S6。在图2所示的种子开发期间,在胚胎和MegAgametophytes之间差异表达的十个最大TF系列的丰富。5..在(A)胚胎和(B)大配子体发育过程中的检测到的在每个TF家庭成员的数目。下属的胚胎被排除在这一分析。(PDF 312 KB)
额外的文件8:
图S7。在胚胎发育阶段之间的每对成对比较中鉴定的倍数变化的差异表达转录物(DETS)的数量大于2(FC> 2)。上调和下调的转录物分别以红色和绿棒示出。每个成对比较中的总标准数据的数量如下所示。表S7。与发育过程相关的差异表达的TFS(FC> 2),在胚胎发育期间在连续阶段之间的成对比较中检测到。(PDF 341 KB)
额外的文件9:
差异表达的转录本(FC > 2;RPKM > 10)在胚胎发育的连续发育阶段之间。只包括与TAIR数据库阳性匹配的det。显示了转录组名称(转录组ID)、fold-change (FC)、每个胚胎发育阶段的表达值(RPKM)以及与TAIR数据库的最佳匹配(at locus ID、at name、at annotation)。氧化石墨烯富集分析的上调或下调的转录清单产生的每一对比较。对于每个氧化石墨烯富集结果显示氧化石墨烯术语,Onthology, (P = Biological Process, F = Molecular Function, C = Cell Component),在上调或下调的转录本列表中属于每个类别的氧化石墨烯注释转录本的数量(输入列表中的数量),在种子转录组中属于每个类别的GO注释转录本的总数量(在BG/Ref中的数量),p值和富集水平(FDR)。(XLSX 35.8 kb)
额外的文件10:
差异表达转录因子(FC > 2;RPKM > 10),在胚胎发育的连续发育阶段之间。该文件中列出了每对比较中上调和下调的TF,以及检测到的TF家族的列表和频率。标记了转录组名称(Transcript ID)、fold-change (FC)、每个胚胎发育阶段的表达值(RPKM)、TF家族以及与TAIR数据库的最佳匹配(at locus ID、at name、at annotation)。在每一个比较中,表达发育生物学过程的转录因子GO在上调的转录因子列表中以红色标注,在下调的转录因子列表中以绿色标注。(XLSX 131 kb)
额外的文件11:
图S8。在不同大配子体发育阶段之间的成对比较中确定的差异表达转录物的聚类。分析包括带有FC的DET > 2和RPKM > 10.对于每个转录本,RPKM值在发育期间被标准化为其最大RPKM值。标准化值采用k-均值聚类法,并根据其在四个发育阶段的表达水平分为不同的聚类。聚类图的Y轴表示相对表达式(从0到1)。每种类型的GO术语分配给不同生物过程(GO为2级)的转录本百分比如下所示。图S9。早期种子发育期间MegAgameTophytes的连续阶段之间的差异表达转录物。该分析包括DED,具有FC> 2和RPKM> 10,在三个对比较中的任何一个中鉴定。(a)直方图,显示不同发育阶段之间的上调和下调的标准的数量。(b)Venn图,示出了在连续成对分析中检测到的常见和特定数量的DED。(c)摘要表显示每个开发过渡中的不同进程中的DECTS(不包括与TAIR的分配匹配)的数量。(PDF 1.23 KB)
额外的文件12:
差异表达的转录本(FC > 2;RPKM > 10)连续巨配子体发育阶段。只包括与TAIR数据库阳性匹配的det。结果显示了各巨生植物发育阶段的转录名称(Transcript ID)、fold-change (FC)、表达值(RPKM)以及与TAIR数据库的最佳匹配(at locus ID、at name、at annotation)。标记发育生物学过程的转录本GO在上调或下调列表中分别显示为红色或绿色。所有注释了对刺激和压力的反应的转录本都用粗体突出显示。(PDF 12.2 kb)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
梅里诺,I.,亚伯拉罕松,M.,斯特克,L。等等。在苏格兰松树中胚胎发育期间早期阶段的转录物分析。BMC植物杂志16日,255(2016)。https://doi.org/10.1186/s12870-016-0939-5
收到了:
公认:
发表:
关键词
- 胚胎发育
- 抗旱性L.
- Polymbryony
- RNA-seq
- 转录组分析
- Zygotic胚胎发生