- 研究文章
- 开放访问
- 发表:
转录组学和蛋白质组学方法鉴定差异表达的基因和蛋白质拟南芥缺乏叶绿体1和胞质fbases的突变体揭示了几个水平的代谢调节
BMC植物生物学体积16.文章编号:258(2016)
摘要
背景
在光合作用中,果糖-1,6-二磷酸酶(FBPase)的两种亚型,叶绿体(cFBP1)和胞质(cyFBP),分别催化磷酸三糖(TP)转化为淀粉或蔗糖的第一个不可逆步骤。cyFBP和cFBP1亚型的缺失会导致淀粉/蔗糖比例的不平衡,当质体酶缺乏时,会对植物的发育产生巨大影响。
结果
我们研究了莲座和根的转录组和蛋白质组谱之间的相关性CFBP1.或者cyFBP基因被破坏拟南芥淘汰赛突变体。通过使用70聚寡核苷酸微阵列代表拟南芥基因组,我们鉴定出1067和1243个基因在拟南芥的莲座和根中表达发生了改变cfbp1突变体分别;而在玫瑰和根cyfbp突变体1068和1079基因分别上调和下调。根据我们的芯片分析,定量实时PCR验证了一组14个选择的基因的100%差异表达。基于二维凝胶电泳的蛋白质组学分析显示,在莲座和根中调控的36和26个蛋白质的数量差异cfbp1分别,而18种48人在瓣状体和的根调节cyfbp分别突变。基因的差异表达和蛋白质的丰富程度揭示了生物和非生物胁迫在蛋白质代谢、RNA调控、细胞信号和组织、碳代谢、氧化还原调控和运输等方面的变化。值得注意的是,一组显著的(25%)被鉴定的蛋白质也被发现在转录水平上受到调控。
结论
该转录组和蛋白质组学分析是缺乏FBPPase同种型的拟南芥突变体的光合作用和非光合器官的基因/蛋白质重新调整的第一个综合和比较研究。
背景
在叶片中,被吸收的碳要么以淀粉的形式暂时储存在叶绿体中,要么以在细胞质中合成的蔗糖的形式输出到碳库组织。为了维持一个最佳的光合速率,这种碳分配需要被高度调节[1].这种调节强烈依赖于植物的昼夜节律和碳代谢物水平,并通过输出叶绿体中产生的磷酸三糖中间体(在还原磷酸戊糖途径或卡尔文-本森循环中)来实现[2].在C语言中3.在植物中,几个关键酶是高度协调碳代谢所必需的。其中包括果糖-1,6-二磷酸酶(FBPase),已报道有三种亚型[3.].胞浆酶一种胞浆酶(cyFBP),存在于原核和真核细胞中,参与糖异生和蔗糖合成[4].一种叶绿体异构体(cFBP1),也存在于光合真核生物中[5,通过硫氧还蛋白(TRX)的二硫化物键的还原以及pH和Mg的变化来调节2+由光照引起的浓度[3.].最近,我们实验室发现了另一种质体cFBP亚型(cFBP2) [6].与cFBP1相比,这种新型亚型缺乏TRX激活所需的调节氧化还原域。一部分磷酸三糖通过cFBP1产生1,5-二磷酸核酮糖,用于卡尔文-本森循环再生,其余的可以输出到胞质中,通过cyFBP转化为蔗糖。cFBP2在蔗糖合成和碳水化合物分布控制中的作用仍有待阐明。
有报道称,拟南芥中cFBP1活性的降低(拟南芥)导致可溶性糖的增加[7].最近,Rojas-Gonzalez和同事[8已经在生理和代谢上描述了功能丧失突变体的特征cyfbp和cfbp1。的淘汰赛cfbp1该株系呈矮化表型,叶片褪绿,光合速率低,蔗糖/淀粉率高。另一方面,cyfbp显示野生型表型,光合能力下降,淀粉合成和动员率高[8].最后,同时过表达磷酸三糖/磷酸转运体和cyFBP导致可溶性糖和淀粉含量增加[9].其他研究强调了FBPases在控制蔗糖/淀粉平衡中的关键作用[3.].
在拟南芥和农业相关植物中,利用野生型植物研究了碳水化合物(蔗糖和淀粉)分配和利用之间的平衡[10.]和敲除初级代谢酶的转录或氧化还原调节因子的突变体[11.- - - - - -14.,无淀粉突变体[15.- - - - - -17.],并结合敲除突变体的产生和全基因组微阵列分析[18.- - - - - -22.].与野生型植物相比,拟南芥中缺乏磷葡萄糖合成酶(PGM)基因叶绿体亚型的无淀粉突变体在白天光照/黑暗周期的不同时间点的数千个基因显示了显著的转录变化[19.,22.,23.].然而,对植物碳水化合物代谢的蛋白质组分析知之甚少。考虑到FBPases在植物碳水化合物稳态中的重要性,在本研究中,我们对拟南芥的莲座和根器官进行了全基因组的mRNA和蛋白质图谱分析cfbp1和cyfbp用野生型植物剔除突变体。我们发现:(i)cfbp1和cyfbp突变体影响广泛的基因表达,代表近10%的拟南芥基因组的重编程;(2)CFBP1.或者cyFBP基因破坏诱导莲座和根的表达谱不同;(iii)差异表达基因/蛋白与碳代谢、蛋白质代谢、细胞信号、基因调控、转运和应激反应有关;(iv)转录组和蛋白质组数据是相关的。
结果
拟南芥差异表达基因敲除缺失突变体CFBP1.和cyFBP基因
来分析全基因组的影响CFBP1.或者cyFBP在莲座和根组织中,我们进行了基因芯片分析比较cfbp1和cyfbp用代表拟南芥基因组的70聚寡核苷酸微阵列敲除野生型植物的突变体。采用bootstrap微阵列显著性分析(SAM)鉴定差异表达基因。SAM计算表达差异的fold change和significant。每次比较的delta值从1.07到1.86不等。假显著数(FSN)在13.7 ~ 23.7之间,假发现率(FDR)在1.10 ~ 2.20之间。在分析的28,964个蛋白编码基因转录本中,发现有4457个基因存在差异表达,其中3,198个和1,259个分别对应于上调和下调基因(表)1).两种基因中分别有2310和2147个差异调节基因cfbp1和cyfbp突变体分别代表了总评估转录组的8.0和7.4%的重编程(表1).的cfbp1在莲座和根中分别有474和1057个基因表达上调,而在莲座和根中有726和941个基因表达上调cyfbp背景。在莲座和根中分别鉴定出593和186个表达下调的基因cfbp1而在莲座和根中有342个基因下调,138个基因下调cyfbp背景(表1).值得注意的是,根表明相比于在这两个突变体的FBPase报道的上调的基因(分别为85和87%),非常少的下调的基因(分别为15%和13%)。显著改变转录物(1.5倍改变截止值)的完整列表在其他文件呈现1S1:表。
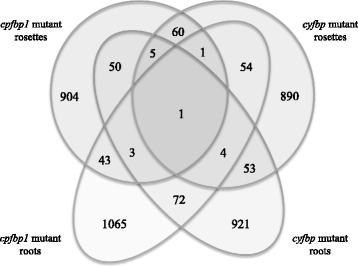
考虑到一个事实,即CFBP1.和cyFBP这两个基因都是碳水化合物代谢的关键基因吗?我们可以假设,在我们的微阵列实验中发现的差异表达基因中,有很大比例应该是共享的吗cfbp1和cyfbp.以确定是否CFBP1.或者cyFBP基因破坏诱导相似的基因表达型改变,我们比较了突变体和植物器官之间的差异表达基因(图。1).如维恩图所示,大多数基因在各自遗传背景下的莲座和根中都有特定的调控。4457年的出口押汇-调控基因中,904和1065个基因仅在莲座和根中受调控cfbp1,而890和921只调控于莲座和根cyfbp分别可能被视为在玫瑰花丝和根部差异差异的基因cfbp1和cyfbp突变体。然而,那些被特别调节的基因cfbp1和cyfbp正如下面讨论的,属于同一功能类别的最丰富的组对应于(i)没有指定的生物过程的基因;(ii)蛋白质的合成、转换和目的地;(iii) RNA调控、加工和结合。这意味着,尽管每个突变体都有不同的表达基因,但同样的功能生物过程也会受到影响。
微阵列数据的聚类分析
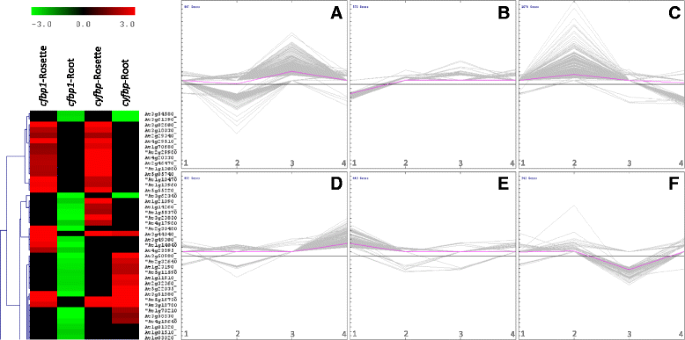
一个k-意味着进行聚类分析,以获得每个差异表达基因的性能概况,并与莲座和根中的其他基因进行比较cfbp1和cyfbp突变体。定义了六个集群(图。2,基因在附加文件中识别2:表S2)。
基于差异表达模式的转录本群集。聚类分析的一个代表性片段显示了每个基因相对于其他的行为在莲座和根cfbp1和cyfbp突变体(左).图中显示了莲座中上调的基因cfbp1和cyfbp,基因下调cfbp1根;以及基因的上调或下调cyfbp的根源。将差异表达的转录本聚类k——方法。创建了6个集群(集群一个-f,右边),与集群一个和d包括莲座和根中上调的基因cyfbp分别;和集群f和c包括下调基因。集群e和b包括上调和下调基因cfbp1玫瑰花饰。集群c和一个包括上调和下调基因cfbp1根,分别。x轴表示(1)cfbp1圆花饰(2)cfbp1根源(3.)cyfbp花结,(4)cyfbp的根源。y轴表示表达式级别
群集A包括847份与cyfbp莲座基因表达上调和下调cfbp1根(图。2A和额外的文件2:表S2A)。在这些转录本中,19.3%编码假想的或未知的蛋白质。这组基因包括卡尔文循环、糖酵解或淀粉代谢的已知基因,如甘油醛3-磷酸脱氢酶(At1g79530)的编码,CFBP1.基因(At3g54050)、β -淀粉酶5和6 (At2g32290和At4g15210)、adp -葡萄糖焦磷酸化酶大亚基4 (At2g21590)。一个惊人的发现是,编码糖转运所需蛋白的转录本(如糖转运蛋白2 - STP2、udp -半乳糖转运蛋白6和STP4)仅富集在A、B和C簇中,这些簇主要由在cyfbp花结和cfbp1的根源。簇B包含572个转录本,其中19.0%编码假想或未知的蛋白质(图2)。2B.和额外的文件2:表开通)。这些转录本主要在cfbp1玫瑰花饰。聚类- b转录本包括糖酵解、糖异生和淀粉代谢的基因,如焦磷酸依赖的6-磷酸果糖-1激酶(At1g12000)、丙酮酸激酶(At5g08570)和β -淀粉酶4 (BAM4;At5g55700)。聚类C包含1074个转录本,其中大部分在cfbp1根(图。2C和额外的文件2:表S2C)。这些转录本在cfbp1在向下调节的表达的根cyfbp的根源。大约群集-C的转录物的17.0%编码假想的或未知的蛋白质。转录物编码蛋白质,其在卡尔文循环是必要的是存在于该集群。例如,醛缩酶(At4g38970),甘油醛-3-磷酸脱氢酶B(At1g42970)和核酮糖二磷酸羧化酶小链(At1g67090)。簇d包括897个转录物在高表达cyfbp的根源。在这些转录本中,13.0%编码假想的或未知的蛋白质。值得一提的是,大量糖酵解和糖异生酶编码上调的基因也属于这一簇(附加文件)2:表S2)。这些包括磷酸甘油酸激酶(At3g12780)、磷酸葡萄糖酶(At1g23190)、葡萄糖-6-磷酸异构酶(At5g42740)、PFK7和pfk2 -磷酸果糖激酶(At5g56630和At5g47810)、甘油醛-3-磷酸脱氢酶(At3g04120)、2,3-二磷酸甘油酸突变酶1 (At1g09780)和丙酮酸激酶(At5g63680)。
聚类分析也揭示了在莲座中协调表达的基因群cfbp1和cyfbp.基因在cfbp1莲座和下调cyfbp分别用聚类E和F表示(图。2 e和f和额外的文件2:表S2)。在E群中,转录本编码假想蛋白或未知蛋白的比例为19.1%,在F群中为22.2%。有趣的是,在F群中没有蔗糖或淀粉代谢相关基因。
受FBP酶基因破坏生物过程
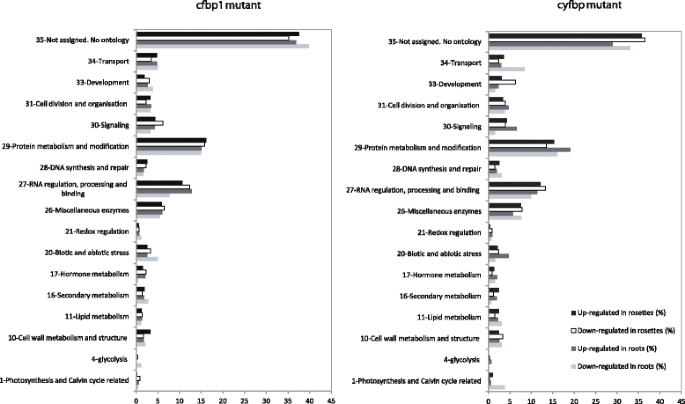
接下来,我们研究了哪些代谢和细胞过程受到影响CFBP1.或者cyFBP失活。为此,最终的调控基因列表及其差异表达值被导入MapMan 3.5.0 [18.,21.以及包含TAIR拟南芥全基因组注释的图谱文件。由于GO术语和MapMan容器之间的对应关系并非微不足道,我们最终放弃了这些方法。但我们使用PageMan的过度代表分析(Additional file)对功能类别(bins)进行了统计分析3.:图S1)。这是一个经典的类统计测试:给定选择的对象的数量、对象的总数量和类的大小,该测试提供了一个统计证据(基于列联表),以区分哪个对象(如基因)从类(如功能箱)不是随机分类的。因此,箱中包含的基因数量是ORA分析认为在差异表达集中代表过多的基因。因此,差异表达基因被分配到17个功能分类箱(图。3.).大多数差异表达基因(超过60%)cfbp1和cyfbp可分为三类:(1)没有指定生物学过程的基因;(ii)蛋白质的合成、转换和目的地;(iii) RNA调控、加工和结合。杂酶的比例较高(6-8%)。细胞信号、细胞组织、碳代谢和运输,以及生物和非生物胁迫,占差异调控基因的20%以上(图)。3.).
光合作用、光呼吸和碳代谢相关基因
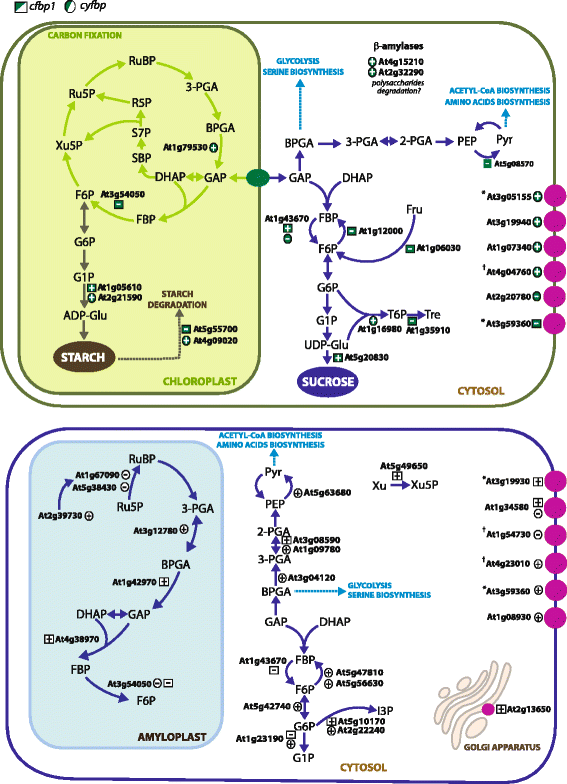
本研究发现的参与光合作用、光呼吸作用和卡尔文循环的差异表达基因在莲座和根中均有上调和下调cfbp1分别(无花果。4;额外的文件4:表S3)。在叶片中,adp -葡萄糖焦磷酸化酶小亚基2 (APS2;At1g05610和蔗糖合酶(At5g20830)上调,叶绿素A-B结合蛋白(At1g76570)、光系统II反应中心PsbP蛋白(PsbP, At4g15510)和光系统I亚基IV蛋白(At4g28750)下调(附文件)1:表S1)。对果糖 - 双磷酸醛磷酸酶(AT4G38970),甘油醛-3-磷酸脱氢酶B(AT1G42970)和2,3-双磷基甘露出酶(AT3G08590)(附加档案1:表S1)。奇怪的是,尽管在一个非光合器官中,根的上、下调控位点包括编码光系统I反应中心亚基psaK蛋白(At1g30380)、光敏色素移动素:铁还蛋白氧化还原酶(At3g09150)和光系统II反应中心W蛋白(At2g30570)的基因。在…的情况下cyfbp,大多数的差异表达基因上调玫瑰叶子,甘油醛3 -磷酸脱氢酶的编码(At1g79530)、光系统I反应中心蛋白亚基三世(At1g31330)和phytochromobilin:铁氧还蛋白氧化还原酶(At3g09150)和根如ferredoxin-NADP——或衰减+分别是还原酶(At4g32360)、二磷酸羧化酶(At2g39730)和磷酸甘油酸激酶1 (At3g12780)以及二磷酸核酮糖羧化酶小链(At1g67090)。值得注意的是,cyFBP(AT1G43670)被发现在上调cfbp1玫瑰花属(图。4).这一结果之前由Rojas-Gonzalez和他的同事报道过[8].
碳水化合物代谢调控基因的示意图。提出了一个淀粉和蔗糖代谢模型。该模型显示的基因(AGI数字)揭示了在cfbp1玫瑰花属和根;和cyfbp花结和根源。莲座调控基因(上面板)编号如下:甘油醛3-磷酸脱氢酶(At1g79530),CFBP1.-淀粉酶4 (At5g55700), -异淀粉酶3 (At4g09020),四糖转运蛋白家族蛋白B淀粉酶5和6 (At2g32290和At4g15210),丙酮酸激酶(At5g08570),焦磷酸-果糖-6-磷酸- 1-磷酸转移酶(At1g12000),pfkb样碳水化合物激酶(At1g06030),海藻糖-磷酸酶合酶2 (At1g16980),海藻糖-6-磷酸磷酸酶(At1g35910)。根调控基因(下图)为:二磷酸核酮糖羧化酶小链(At1g67090)、二磷酸核酮糖活化酶(At2g39730)、二磷酸核酮糖小亚基(At5g38430)、磷酸甘油酸激酶(At3g12780)、甘油醛-3-磷酸脱氢酶B (At1g42970)、果糖-二磷酸醛缩酶(At4g38970)、CFBP1.(At3g54050),碳水化合物跨膜转运蛋白(At1g08930),丙酮酸激酶(At5g63680), 2,3-二磷酸甘油酸突变酶(At3g08590),甘油醛-3-磷酸脱氢酶(At3g04120),木露糖激酶2 (At5g49650),cyFBP(At1g43670),磷酸果糖激酶PFK2 (At5g47810)和PFK7 (At5g56630);葡萄糖-6-磷酸异构酶(At5g42740)、肌醇-3-磷酸合酶(At5g10170)、肌醇-3-磷酸合酶(At2g22240)。(+)表示上调,(-)表示下调。根据Cell eFP Browser对亚细胞定位的预测(http://bar.utoronto.ca/cell_efp/cgi-bin/cell_efp.cgi).(*)预测为质膜和/或高尔基体转运体;(†)三个假定的定位:质膜,高尔基体和质体
同样值得注意的是,大量编码糖酵解和糖异生相关酶的关键基因的表达谱发生了改变cfbp1和cyfbp遗传背景(无花果。4;额外的文件1:表S1)。在它出现的酶催化的FBPase,焦磷酸果糖-6-磷酸1-磷酸(At1g12000)的相对反应即转录物的积累,被下调cfbp1莲座叶片与丙酮酸激酶(At5g08570)。然而,具体的根转录再调节包括2,3-二磷酸甘油酸突变酶(At3g08590)和磷酸葡萄糖转移酶(At1g23190)的上调和下调。的cyfbp磷酸葡萄糖酶(At1g23190)、葡萄糖-6-磷酸异构酶(At5g42740)、PFK7和pfk2 -磷酸果糖激酶(At5g56630和At5g47810)、胞质甘油醛-3-磷酸脱氢酶(At3g04120)、2,3-二磷酸甘油酸突变酶1 (At1g09780)、和丙酮酸激酶(At5g63680),而叶绿体甘油醛-3-磷酸脱氢酶(At1g79530)升高cyfbp玫瑰花属(图。4).令人惊讶的是,无论失活的FBPase亚型是什么,上述基因都为参与胞质生化途径的酶编码。
一些与蔗糖生物合成有关的基因,如蔗糖合酶(At5g20830),以及cyFBP(At1g43670),在莲座中被上调cfbp1突变体,而淀粉降解相关基因,如β -淀粉酶4 (BAM4;At5g55700)在莲座中表达下调,在根中表达上调。与此相反,淀粉代谢相关的酶编码基因在莲座和根中均上调cyfbp.突变体研究表明α -异淀粉酶3 (At4g09020)基因与淀粉分解密切相关,而adp -葡萄糖焦磷酸化酶大亚基4 (At2g21590)与淀粉合成相关[24.(图。4).Balmer鉴定的289种蛋白质中,发现了几个由根差异表达基因编码的蛋白质et al。[25.]在小麦胚乳淀粉体中。它们大多参与碳水化合物和氮代谢、细胞分裂、应激、信号传导和运输。
氧化还原调节和应激反应
在这两种fbpase缺失突变体中,涉及氧化还原状态的30多个基因受到了调控。其中大多数为glutaredoxin, thioredoxin或与抗坏血酸和谷胱甘肽代谢相关的蛋白质编码。总体而言,glutaredoxin相关基因(At5g58530、At3g02000、At4g28730)在莲座或根中受负向影响cfbp1,而硫氧还蛋白(At1g53300, At1g21750, At3g16110)和抗坏血酸-谷胱甘肽相关基因上调(附加文件1:表S1)。在大部分的氧化还原相关的基因表达上调cyfbp玫瑰和根(附加文件1:表S1)。这些基因包括硫氧还蛋白还原酶B (At4g35460)、硫氧还蛋白ATY1 (At1g76760)细胞色素还原酶(At5g20080)、硫氧还蛋白样1-3 (At2g33270)和过氧化氢酶3 (At1g20620)。此外,还发现了135个与生物和非生物胁迫相关的基因cfbp1和cyfbp背景。基因表达上调或下调的比例相对相似cfbp1和cyfbp花结和cfbp1根,cyfbp根中只有2个基因表达下调(At1g42560和At5g66910), 44个基因表达上调(附加文件)1:表S1和附加文件5:表S4)。
基于MapMan和基因本体的分类方法,并与PageMan进行了验证CFBP1.或者cyFBP失活在广泛的分子功能和生化途径中影响全基因组的表达水平。然而,发现生物和非生物应力的功能类别得到了很好的代表是有帮助的(附加文件6:图S2)。在对胁迫响应响应的位点中,有31个和35个基因在莲座和根中受到调控cfbp1而23个基因和46个基因在莲座和根中受调控cyfbp背景(额外的文件1S1:表;额外的文件5:表S4)。为了更清楚地理解这一结果的意义,我们进行了基因聚类分析,比较了所有发现的差异表达基因cfbp1和cyfbp利用拟南芥寡核苷酸微阵列进行了五个与压力相关的实验。这些数据集可在GEO数据库中获得,对应于拟南芥受到砷酸盐非生物胁迫的转录分析[26.)、铜2+(accession number GSE13114),干旱,以及干旱和热应激联合[27.,并受到生物的压力烟草腐蚀potyvirus(TEV)感染(28.].对这些数据集的比较揭示了这一点cfbp1 -和cyfbp-调控基因在应对生物和非生物胁迫时也有差异表达(图S2和S3)。我们还使用默认选项的MeV软件,对所有实验中的调控基因进行k-means聚类分析,根据其表达模式的相似性对其进行分组。通过对莲座和根的比较,确定了4个和6个簇出口押汇-调控基因与其他数据集,分别(附加文件7:图S3)。
RNA调控、加工和结合
在莲座和根部,CFBP1.和cyFBP基因破坏诱导高度动态的转录调节。发现一百转录因子的差异表达cfbp1花环,119cfbp1112根,cyfbp花环和96cyfbp根(附加文件5:表S4)。这意味着9.4和9.6%的差异表达基因在cfbp1和cyfbp,分别为转录因子编码。这些转录因子主要属于AP2/EREBP、bZip、bHLH、MYB、GATA、WRKY、C2C2(Zn) DOF、C2H2锌指家族蛋白,可能调控上游的转录响应组分CFBP1.或者cyFBP基因失活。
细胞信号传导
220多种受体激酶、可溶性蛋白激酶、丝氨酸/苏氨酸蛋白磷酸酶、MAP激酶通路组分、钙结合蛋白和g蛋白的转录水平均发生变化cfbp1和cyfbp背景。其中,55个基因受到了影响cfbp1花结,50cfbp1根,43岁cyfbp玫瑰花树,63岁cyfbp根(附加文件5:表S4)。已知这些蛋白质在代谢、细胞生长、细胞分化和细胞分裂的调节和协调方面发挥关键作用[29.].丝氨酸/苏氨酸蛋白磷酸酶在控制光合作用氧化还原反应中的作用最近已被证实[30.].在cfbp1在莲座中,上调或下调基因的比例相似;然而,大多数细胞信号相关基因在cfbp1根和cyfbp玫瑰花饰。
超过75个基因分配给激素代谢和信令表明改性的表达谱在cfbp1和cyfbp(附加文件5:表S4)。大多数是生长素或赤霉素调控基因,其次是脱落酸或乙烯反应基因。只有19个基因下调,其中13个在cfbp1而其余部分则上调。
蛋白质的合成、转化和终点
蛋白质合成、降解和修饰组是继具有未知生物学功能的基因之后第二大最具代表性的类别。在这类基因中,大多数调控基因都参与蛋白质降解,特别是泛素途径的调控基因,其次是蛋白质合成和翻译后修饰的调控基因。63个属于泛素途径的基因在cfbp1玫瑰花园,57 incfbp163根,cyfbp玫瑰花结,68英寸cyfbp根(附加文件5:表S4)。我们的结果表明,蛋白质降解机制在cfbp1和cyfbp突变体;它可以是正常的蛋白质转换过程的一部分,但也可以在泛素复合体中发挥作用,通过蛋白质降解参与信号传递。
运输
几个基因的转录水平参与氨基酸,肽,钙,磷酸盐,膜,特别是糖转运是在改变cfbp1和cyfbp背景(图。4).udp -半乳糖转运体6 (At3g59360)基因在大肠杆菌中表达下调cfbp1而糖转运体4 (At3g19930)、gpd -甘露糖跨膜转运体1 (At2g13650)和一个推测的单糖转运体(At1g34580)均上调cfbp1根(附加文件1:表S1和附加文件5:表S4)。糖转运蛋白2 (At1g07340)和3个糖转运蛋白家族蛋白(At3g05155、At4g04760、At3g19940)表达上调cyfbp玫瑰花结,而且只有一个甘露醇转运体(At2g20780)中下调。在最后,碳水化合物跨膜转运(At1g08930)和两个UDP-半乳糖转运体(At4g23010和At3g59360)表达上调cyfbp而两种单糖转运蛋白(At1g34580和At1g54730)在该器官中下调(附加文件1:表S1和附加文件5:表S4)。
差异表达基因的验证,使用QRT-PCR
验证cfbp1和cyfbp我们对一组14个在莲座和根中表达上调或下调的基因进行了实时荧光定量PCR (QRT-PCR),这些基因代表不同的功能类别2).QRT-PCR选择的基因属于最具代表性的功能类别,如蛋白质合成、降解和翻译后修饰(At2g20140)、RNA调控、加工和结合(At3g61850)、糖酵解和糖异生(At4g15210、At5g20830和At1g50460)、光合作用和加尔文循环相关基因(At1g79530和At2g39730)、运输(At1g07340和At3g19930)、发育(At5g24780)、氧化还原调节(At1g76760和At1g28480)、杂酶(At5g20340)和未分配的生物过程(At1g67850)。QRT-PCR结果支持微阵列数据,也表明所有基因的表达模式是相同的。如表所示2,与芯片提供的数据相比,QRT-PCR的表达值更高,说明实时PCR是一种更敏感的方法。
从莲座和根中差异调节的蛋白质cfbp1和cyfbp突变体
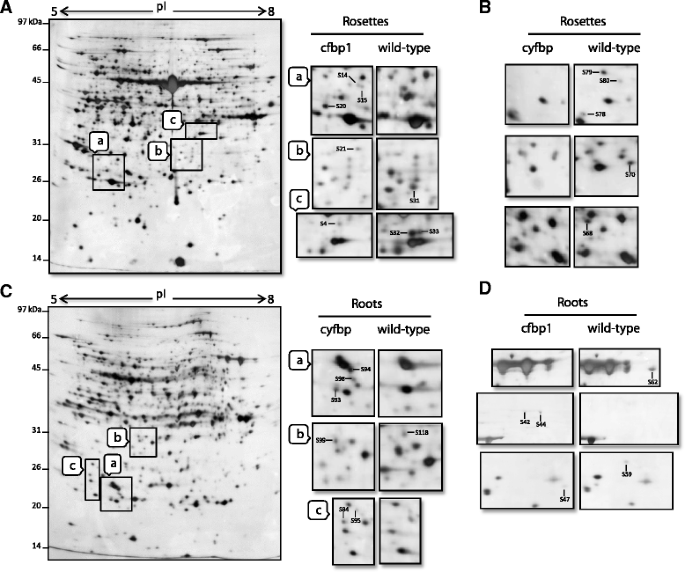
微阵列几乎提供了转录组的全面评估,但不一定反映在蛋白质或功能水平,因此,我们随后寻求蛋白质组学方法来研究蛋白质谱出口押汇突变体。对2-DE模式的分析显示,在每张图像中解析的约1000种蛋白质点强度中,总共有128种不同的蛋白质点强度(附加文件)8:表S5)。从这些点中,36和26对应于在莲座和根中调控的蛋白质cfbp1分别,而18种48人在瓣状体和的根调节cyfbp(详细统计、Mr/pI和蛋白功能详见附加文件8:表S5).数字5展示了具有代表性的实验(至少两个生物学重复),用于测定莲座和根中上调和下调的蛋白质出口押汇通过MS提取和鉴定的蛋白质点分析突变体(附加文件8:表S5)。这些点对应于在一般代谢、光合作用、蛋白质合成、蛋白质目的地、信号转导、RNA调节、激素代谢、氧化还原调节、细胞组织、发育、生物和非生物胁迫以及各种功能未知的酶和蛋白质的推定功能(附加文件)9:图S4)。
莲座和根组织的2-DE图像cfbp1和cyfbp突变体。植物莲座和根组织总蛋白的2-DE凝胶cfbp1和cyfbp突变体。凝胶的指示部分,一个通过c,复制在大窗户,一个通过c对每个突变体和组织使用2-DE凝胶。(一个)植物莲座组织总蛋白2-DE凝胶cfbp1突变和扩大的面板,cfbp1(左)及野生植物(正确的).(b2-DE凝胶的部分选定区域显示莲座组织cyfbp对WT植物的突变体。(c)根组织总蛋白2-DE凝胶cyfbp突变和扩大的面板,cyfbp(左)及WT工厂(正确的).(d) 2-DE凝胶的选定区域显示根组织cfbp1对WT植物的突变体。通过MALDI-TOF/TOF分析鉴定(S4 - s118)的蛋白点(表S4)。图中显示了三次具有代表性的实验
正如我们所料,我们的蛋白质组学分析表明CFBP1.和cyFBP也会引发蛋白质水平的变化。在……的情况下cfbp1突变体,其中所述上调或下调的蛋白质在瓣状体和根中发现,一些参与光合作用和碳水化合物代谢:甘油醛-3-磷酸脱氢酶C2(At1g13440)和活化酶(At2g39730)表达上调在玫瑰花结,而在根中的颗粒结合型淀粉合成酶(At1g32900)中下调。此外,一些上调的或下调的蛋白质(附加文件8:表S5)也参与生物和非生物胁迫,如:谷胱甘肽s-转移酶(At4g19880),一个众所周知的应激标志物,参与活性氧(ROS)解毒过程[31.];AtNDX18 (At1g14860),一种nudix水解酶家族蛋白质的成员,有助于保护植物细胞中DNA和RNA的氧化损伤[32.];TUDOR-SN蛋白2 (At5g61780),它对耐受性和稳定应激反应mrna水平至关重要;单脱氢抗坏血酸还原酶(At1g63940),通过清除ROS与耐盐性有关[33.];过敏诱导的响应蛋白3(AT3G01290);冷休克蛋白2(AT4G38680);Athva22H蛋白(AT1G19950),通过干旱,冷却和高盐度在应力下诱导[34.];玉米黄质环氧化酶(At5g67030),该酶参与叶绿素对氧化损伤的保护[35.].与蛋白质点的关系cyfbp其中,可溶性淀粉合成酶(At5g24300)、磷酸烯醇丙酮酸羧激酶(At4g37870)、gdp - l -聚焦合成酶(At1g17890)均下调cyfbp玫瑰花饰。甘油醛-3-磷酸脱氢酶B (At1g42970)、磷酸烯醇丙酮酸羧化酶(At3g14940)、丙氨酸转氨酶(At1g72330)、6-磷酸葡萄糖酸脱氢酶(At5g41670)和β -葡萄糖苷酶(At3g09260)均上调cyfbp果糖激酶(At2g31390)和酮二磷酸醛缩酶(At1g18270)下调。所鉴定的蛋白点中约有35%是质体定位的,这表明CFBP1.或者cyFBP基因破坏主要影响与塑体相关的蛋白质。值得注意的是,与微阵列数据集(<3%)相比,功能类别“氧化还原调节”在蛋白质组学数据(10%)中更好地表示。据报道,mRNA和蛋白质丰度之间的相关性因基因官能团而变化[36.,提示氧化还原相关蛋白的翻译水平调控可能是关键cfbp1和cyfbp突变体。相比之下,与泛素-蛋白酶体途径相关的蛋白质在微阵列和蛋白质组数据集中都有很好的代表性,这表明泛素-蛋白酶体系统对蛋白质降解的调控可能在转录组和蛋白质组水平上都很重要。
cfbp1和cyfbp芯片数据与蛋白质组分析的一致性
我们比较了cfbp1- 和cyfbp2-DE在莲座和根中鉴定的-调控蛋白,并通过微阵列分析检测差异调控的转录本。128个差异表达点中32个对应的蛋白点有差异的RNA积累(见附加文件)8:表S5)。从这些蛋白质点中,有7个受到了调控cfbp1花结,5cfbp1根,3cyfbp玫瑰花结,17英寸cyfbp的根源。通过转录组分析和蛋白质组学技术同时识别的差异表达基因和蛋白质水平的变化属于重要的功能类别,包括细胞氧化还原稳态(At5g61510、At1g28480、At3g52880、At2g44160、At3g25530、At1g75280、At2g44160)、蛋白质过程(At1g54270、At3g13920、At2g20140、At2g45240、At5g50920)、代谢过程(At2g39730、At1g42970、At5g43780、At1g17890、At1g72330、At1g54220)细胞信号传导(At1g10630、At2g28940、At5g63400、At1g17170、At1g16920、At5g61780)和RNA调控(At5g24780)。
讨论
碳水化合物代谢及其调控是一种复杂的现象,可能是由众多基因协同表达所驱动的。转录谱分析和蛋白质组学数据无法用于cfbp1和cyfbp因此,本研究提供了深入编译的转录组和蛋白质组效应CFBP1.或者cyFBP并有助于阐明这些酶调控的不同步骤在控制拟南芥碳水化合物代谢和间接控制其他过程中的重要性。我们的结果表明,大约10%的评估转录组受到CFBP1.或者cyFBP基因破坏。此前已有报道称,碳水化合物平衡的紊乱会影响大量涉及一般代谢反应、信号传递、基因调控和蛋白质代谢的基因。Osuna等人[19.报道了在拟南芥中添加15 mM蔗糖3 h后> 1700基因转录水平的变化。一项全面的分析表明,野生型拟南芥和无淀粉植物在昼夜周期和延长的夜晚中,代谢、蛋白质组学和总体转录水平发生了根本的变化的pgm突变体(19.,22.,23.].Bläsing等[20.研究表明,超过17%的基因在无淀粉基因中表现出两倍以上的日变化的pgm与Col-0。在我们的分析中发现了很大比例的受影响基因,以及主要的表型和生理变化[8,反映了在代谢场景中忽略cFBP1作为cyFBP的活性以及缺乏这两种酶所产生的生理适应的严重影响。类似地,Usadel等人[18.在野生型和无淀粉型的生物周期中进行整体转录组分析的pgm突变植物,观察到参与生物合成和细胞生长的基因转录减少,但参与替代碳源的重新动员的基因增加。PageMan对我们研究的统计分析显示了不同表达的功能类别。按功能分类显示,与蛋白质代谢和修饰、RNA调控、信号转导、光合作用、碳代谢、生物和非生物胁迫、氧化还原调控相关的基因表达变化更容易受到影响CFBP1.或者cyFBP基因灭活而不是其他基因。
比较转录组分析表明,除代谢相关基因外,其他机制可能有助于解释其表型差异和发育改变CFBP1.相比cyFBP[8].的cfbp1突变体莲座较小,叶绿素含量低,CO含量低2-同化率与野生型植物有关,该植物在较小的莲座丛发育、较低的可溶性糖含量、较少的淀粉积累和较高的超氧化物歧化酶(SOD)活性[8].该突变体在发育过程中也发生了一些变化,包括气孔开放缺陷和根维管层数量增加。例如,大量的cfbp1不同调控基因编码的蛋白质与细胞壁生物合成/修饰、发育和氧化还原调节有关(图。3.).重要的是要注意到CFBP1.和cyFBP对与蛋白质代谢、RNA调控相关的基因产生重要影响;生物和非生物胁迫如图所示。3..这一结果与观察到的表型一致cfbp1[8].此外,cFBP1和cyFBP在拟南芥莲座和根的糖代谢中起关键作用。先前的研究报道,降低cFBP1活性导致总糖含量降低,但与对照植物相比,蔗糖:淀粉比例更高[7].如果cFBP1催化的这一步骤被破坏,则存在淀粉合成的缺陷,植物将通过诱导与淀粉合成相关的基因或减少淀粉降解相关的基因来平衡这一缺陷。与这一假设一致的是,该突变体中有一些基因差异表达(图。4和额外的文件4表S3)与淀粉代谢、糖酵解和卡尔文-本森循环有关。这些数据表明CFBP1.失活可触发淀粉合成相关下游通路的改变,如APS2 (At1g05610)、海藻糖-磷酸酶合成酶2 (At1g16980)和pfkb型糖激酶(At1g06730)的诱导。然而,在cfbp1突变体,磷酸三糖供应受阻,导致叶绿体中淀粉含量低,蔗糖/淀粉比增加[8].值得注意的是,cyFBP基因被诱发cfbp1突变体(8以及蔗糖合酶(At5g20830)。淀粉的生物合成和降解途径在莲座和根中都受到正调控cyfbp.我们报道cyfbp拟南芥突变体过度积累淀粉,胞质中可溶性糖没有减少cyFBP失活(8,转录组分析揭示了这一点APL4基因(At2g21590),参与淀粉合成cyfbp背景。cyFBP的缺乏导致碳水化合物的重新分配,这种情况包括CFBP1.感应(8].有趣的是,重要的糖酵解酶如磷酸果糖激酶PFK2 (At5g47810)和PFK7 (At5g56630)、甘油醛-3-磷酸脱氢酶(At1g79530和At3g04120)、磷酸甘油酸激酶(At3g12780)和丙酮酸激酶(At5g63680)均上调cyfbp的根源。基于这些结果,我们推测cyFBP引起淀粉过度积累的破坏诱导淀粉降解和糖酵解相关基因的表达。拟南芥突变缺乏PFK2比野生型植物积累更少的淀粉和更多的可溶性糖[14.,显示出与之相反的生物学功能PFK2和cyFBP在调控蔗糖合成过程中,当PFK2活性被刺激时,cyFBP活性被抑制。最近的研究也表明,蔗糖磷酸合酶双敲除拟南芥突变体(spsa1/spsc)具有缓解淀粉- s6p转化过程堵塞的机制,如淀粉周转加速,以及淀粉分解产物向糖酵解、氧化戊糖磷酸和三羧酸循环途径的通道[13.].
在莲座和根中基因表达的不同,表明这两个器官之间有协调的相互作用,以维持植物的适当发育。在cfbp1和cyfbp突变体在根中诱导率分别为85%和88%,在莲座中诱导率分别为44%和68%。和叶片一样,根转录组对异养cyFBP或光合作用cFBP1缺乏引起的缺陷作出反应。对功能基因分类的分析表明CFBP1.或者cyFBP灭活还诱导参与RNA调节,蛋白质代谢和修饰的基因的表达变化,以及生物和非生物应激反应。的k- 集群分析表明cfbp1和cyfbp在生物和非生物胁迫下的拟南芥中也能诱导-调控基因(附加文件)7:图S3)。Ma和Bohner [37.,通过分析拟南芥的胁迫依赖表达谱,定义了一个共同的胁迫转录组,该转录组显然代表了普遍的细胞水平的胁迫响应。植物对不同类型的刺激作出反应,通过重新编程类似代谢途径的表达。引起的生理和代谢的变化CFBP1.或者cyFBP基因破坏可能导致植物处于永久胁迫状态;在蛋白质组学分析中发现的抗氧化蛋白的数量和氧化代谢酶的测定证实了这一点[8].这种紧张的情况在cfbp1,考虑到该突变体的生长似乎受到严重抑制,如Rojas等[8),而cyfbp植株表现出野生型表型。
在本研究中,我们发现63个与蛋白酶体相关的基因受到调控。蛋白质水解影响许多代谢活动,如植物叶绿体的生物发生和维持[38.].众所周知,超过1300个基因通过泛素-蛋白酶体系统(UPS)促进蛋白质降解[39.].这一过程负责去除或修改大多数异常多肽和寿命较短的细胞调节剂。因此,UPS影响植物的细胞周期、信号转导、转录和胁迫应答等诸多过程[40].
拟南芥基因组编码了超过2000个转录因子[41.].在这两个突变体中,我们发现了大量的转录因子被调控,其中大多数属于AP2/EREBP、bZip、bHLH、MYB、GATA、WRKY、C2C2(Zn) DOF和C2H2锌指转录因子家族。据报道,bZip、bHLH、MYB和DOF家族的成员是光信号的主要转录调控因子[42.,并参与糖信号传递和碳分配[43.- - - - - -47.].AP2/EREBP家族的特征已经很清楚[48.],该家族的不同成员在光合作用环境中具有调节氧化还原的功能,但也在激素依赖信号和糖感知之间的功能连接中发挥作用[48.].
基因表达是一个复杂的过程,mRNA和蛋白质的丰度受到许多细胞和物理过程的影响,包括转录、转录后调控、RNA降解和剪接、翻译、翻译后修饰和蛋白质降解。mRNA水平的变化并不总是导致蛋白质水平或酶活性的类似变化。迄今为止对mRNA和蛋白质丰度进行的比较研究表明,大数据集之间的相关性通常是适中的[36.,49.].在我们的研究中,在蛋白质水平上鉴定出的128个差异点中,有32个(25%)被芯片分析同时调控。这些蛋白,如rubisco活化酶(At2g39730), glutaredoxin-C9 (At1g28480), 26S蛋白酶体4亚基(At2g20140), atp依赖的Clp蛋白酶(At5g50920),参与叶绿素生物合成,和营养储存蛋白(AT5G24780),与重要的功能类别相关(附加文件8:表S5)。我们的转录组和蛋白质组分析的一致性约为20%。蛋白质组和微阵列数据之间的相关性明显较低,这与一般的观察一致,即mRNA水平并不总是与蛋白质水平相关,因为转录后、翻译后和翻译后的调控和蛋白质翻转[49.,50.].在这个意义上,虽然CFBP1.被诱导cyfbp突变,在蛋白质水平上没有观察到差异[8,这表明可能正在发生翻译调控。比较拟南芥转录本和蛋白质图谱差异表达模式重叠的研究报道,其一致性低于5% [51.],而且还31.1%同余[52.].这些结果强调了整合mRNA和蛋白质数据的重要性,以便更准确地了解植物细胞在应对关键遗传信息丢失时所触发的复杂调控机制。此外,如果不使用特异性富集技术,低丰度蛋白(如转录因子或信号蛋白)可能会逃避一般的蛋白质组学分析。此外,我们必须考虑两种技术之间存在的灵敏度差异。在这个意义上,尽管cyFBP在转录和蛋白水平上都被诱导cfbp1[8在本工作中未发现蛋白质诱导。
结论
对转录组和蛋白质组的大规模表征为全面了解植物碳代谢变化的分子基础和调控机制提供了丰富的数据cfbp1和cyfbp突变体。我们的实验数据足以证明这一点CFBP1.和cyFBP是调节植物细胞中淀粉-蔗糖含量平衡的关键基因;这cfbp1或者cyfbp突变影响其他重要途径,特别是与碳代谢、蛋白质代谢、RNA调控、信号传递和应激反应相关的基因的重要调控。此外,我们还首次提供了这些代谢变化的蛋白质组学特征cfbp1和cyfbp这在光合作用和非光合作用组织中都发生,我们试图设计一个对碳水化合物依赖途径的影响的综合场景。进一步研究这些蛋白质的具体修饰特征,将为控制蔗糖和淀粉合成的代谢途径提供独特的见解,这是农产品的关键化合物。
方法
植物的生长
拟南芥植物(生态型Col-0),cfbp1(Gabi-kat第472行g06) [53.),cyfbp(索尔克SALK_064456行)54.以Col-0为背景,在Murashige和Skoog (MS)培养基中培养,在22℃长日照条件下(16-h光/8-h暗),光合有效辐射为120 μmol光子m2年代-1.突变体的表型是由FBPPAS基因破坏引起的,因为它通过先前研究中进行的互补实验证明[8].突变cyfbp也被称为FINS1.秋和柳的作品[55.].将12日龄植株的莲座和根系分离,立即转入液氮中,-80℃保存。
RNA提取和微阵列
拟南芥DNA微阵列由Galbraith实验室(亚利桑那大学图森分校,AZ, USA)提供,由一组70聚寡核苷酸制成。该微阵列包含29,110个探针,来自拟南芥基因组Oligo Set Version 3.0 (Operon)。该寡聚体包含26.173个蛋白编码基因、28.964个蛋白编码基因转录本和87个mirna,基于TIGR拟南芥基因组注释数据库(http://www.tigr.org/tdb/e2k1/ath1/).使用Bio-rad和Clontech试剂盒进行突变体和CDNA合成的玫瑰花和根的总RNA提取。如前所述进行DNA微阵列杂交[56.].
在每个样品,cDNA,从莲座和根cfbp1和cyfbp将突变体与野生型植株进行比较。为了最大限度地提高数据的统计可靠性,我们进行了三个独立的生物学实验来比较两种植物的莲座和根的转录组cfbp1和cyfbp突变体(处理)与各自的野生型植物(对照),用Cy5或Cy3荧光染料标记的两个cDNA样品被逆转,以防止染料相关的标记效率的潜在差异。
使用GenePix 4100A芯片阅读器/扫描仪(Axon Molecular Devices)对幻灯片进行扫描。使用GenPix Pro 5.1软件(Axon)对扫描切片的光斑强度进行量化。利用该程序进行局部背景校正。使用GenPix Pro 5.1输出数据文件进行最低强度归一化、标准偏差归一化、重复分析和染料交换过滤,使用MIDAS计算机程序[57.].不同载玻片间的归一化通过居中实现[58.].使用SAM的Bootstrap分析使我们能够识别差异表达基因,使用截断值1.5,并调整delta值、FDR和FSN,以最小化假阳性基因的数量[59.].我们进行了k-采用TM4 Microarray software Suite的MeV软件(http://www.tm4.org/)及默认选项[57.].
使用MapMan软件3.5.0版本显示通路水平的表达谱(http://mapman.gabipd.org/web/guest/mapman).因此,处理后的平均信号相对于同一实验的野生型植物的信号进行了表达,并将比值的平均值转化为对数2规模。概览图是使用映射文件版本Ath_AGI_TAIR9_Jan2010准备的。利用AgriGO和GOrilla进行生物富集分析,两者都基于GO条件。功能类别(箱)的统计分析采用基于双尾Fisher精确检验的PageMan的过度表征分析[60.].
QRT-PCR验证芯片数据
我们选择了14个在莲座和/或根中有差异表达的基因cfbp1和cyfbp突变体通过QRT-PCR确认(表2),如Soto-Suárez等人所述[56.].比较基因芯片和QRT-PCR的表达水平。同样,每个分析基因的微阵列比率与18S核糖体基因的微阵列比率进行归一化。这样就可以直接比较每个转录本的18S核糖体基因归一化QRT-PCR比值和18S核糖体基因芯片比值。
蛋白质提取、增溶和IEF
从根和莲座组织蛋白提取物通过使用TCA - 丙酮苯酚协议执行的处理61.].最后的颗粒悬浮在蛋白质溶解缓冲液(9 M尿素,4% CHAPS, 0.5% TritonX100和100 mM DTT)中。对每个样品进行三次定量蛋白质的生物重复[62.].对预制的17 cm IPG pH值5-8线性梯度(Bio-Rad)条进行了等电聚焦(IEF)。蛋白在pH范围4-7使用三步程序分离:在500 V下分离15分钟,然后在10,000 V下分离2小时,最后一步在10,000 Vh完成60,000 Vh。对焦后,试纸立即运行。
二维电泳、凝胶染色、图像采集与分析
聚焦的IPG条(pH 5-8)通过将20分钟浸入375mM Tris-HCl,pH 8.8,含有6M尿素,2%SDS,20%甘油和2%DTT,然后在其中含有2.5%碘乙酰胺代替DTT的相同溶液。然后将条带转移到垂直板12%SDS-聚丙烯酰胺凝胶(Bio-rad Protean Plus Dodeca细胞)上,电泳在55mA /凝胶中运行,直至染料前达到凝胶的底部。电泳后,凝胶是银染色,如Yan等人所述。[63.或与考马斯亮蓝色G-250(西格玛)。凝胶图像被捕获并数字化(Molecular Imager Pharos FX™Plus multiImager System, Bio-Rad),并使用PDQuest™2d分析软件(Bio-Rad实验室,Hercules, CA)进行分析,使用10倍于背景作为存在/缺失的最小标准。利用该程序进行斑点强度标定、斑点检测、背景提取、匹配和母凝胶的建立。使用总光斑体积归一化方法乘以所有光斑的总面积,对图像进行归一化后计算光斑体积,对单个斑点的蛋白质染色进行量化。在MALDI-TOF/TOF分析前,人工切除显著斑点,并在4°C的milliq水中保存。
蛋白质斑点消化和MALDI-TOF分析是在UCO-SCAI蛋白质组实验室进行的,UCO-SCAI是Carlos III网络蛋白质组学平台protered - isciii的成员。消化方案如前所述执行[64.].对于MALDI-TOF分析,使用GPS Explorer™软件v 3.5(应用生物系统)在非冗余NCBInr数据库上使用吉祥物搜索引擎(Matrix Science, London;http://www.matrixscience.com)下列参数[64.].
缩写
- cFBP1:
-
叶绿素的特性,6-bisphosphatase
- cyFBP:
-
胞质特性,6-bisphosphatase
- FBPase:
-
果糖-1,6-二磷酸酶
- TRX:
-
硫氧还蛋白
- UPS:
-
ubiquitin-proteasome系统
参考文献
- 1。
陈志强。光合作用的代谢调控。见:贝克NR,《光合作用与环境》。多德雷赫特:Kluwer学术;1996.635 - 40页。
- 2。
Lunn Je,Delorge I,Figueroa Cm,Van dijck P,Step M.海藻糖代谢在植物中。工厂J. 2014; 79(4):544-67。
- 3.
王志强,王志强,王志强,等。fbpase调控植物糖分配的研究进展。中国农业科学。2009;60(10):2923-31。
- 4.
张志强,张志强,张志强,等。植物叶片光合产物形成与利用的调控。植物营养与肥料学报。Acta botanica yunnanica(云南植物研究);
- 5。
光在叶绿体酶调控中的作用。植物生理学报1980;31:341-74。
- 6。
关键词:cpFBPaseII,果糖-1,6-二磷酸酶,氧化还原依赖性植物学报。2009;32(7):811-27。
- 7。
张志刚,张志刚,张志刚,等。拟南芥叶绿体果糖-1,6-二磷酸酶基因的克隆及表达研究进展。植物营养与肥料学报,2017,29(4):459 - 463。acta botanica sinica(云南植物研究)2004;
- 8。
在拟南芥中,叶绿体和胞质fbase基因的破坏导致了一个矮化表型和重要的淀粉和代谢产物的变化。J Exp Bot. 2015;66(9): 2673-89。
- 9。
关键词:拟南芥,磷酸三糖/磷酸转运子,果糖-1,6-二磷酸酶,外源基因Photosynth杂志2012;111(3):261 - 8。
- 10。
关键词:拟南芥,碳消耗,蔗糖吸收,转录响应,时间动力学植物学报。2015;39(4):768-86。
- 11.
玉米来源叶片的转录和代谢特征表明淀粉过渡到蔗糖平衡和自主花转变之间的联系。中国生物医学工程学报。2012;63(14):5079-92。
- 12.
Thormählen I, Ruber J, VON roepenacklahaye E, Ehrlich S, Massot V, Hümmer C, Tezycka J, Issakidis-Bourguet E, Geigenberger P., et al . Thormählen, Ruber J, VON roepenacklahaye E, Ehrlich S, Massot V, Hümmer C, Tezycka J, Issakidis-Bourguet E, Geigenberger植物学报。2012;36(1):16-29。
- 13。
Bahaji A, barja - fernandez E, Ricarte-Bermejo A, Sanchez-Lopez AM, Munoz FJ, Romero JM, Ruiz MT, Baslam M, Almagro G, Sesma MT等。多个SPS敲除突变体的特性揭示了四种拟南芥蔗糖磷酸合酶亚型在植物生存能力中的冗余功能,并强烈表明增强呼吸和加速淀粉周转可以缓解蔗糖生物合成的阻碍。植物科学。2015;238:135-47。
- 14。
McCormick AJ, Kruger NJ。缺乏果糖2,6-二磷酸会影响拟南芥在波动环境中的光合作用和生长。工厂j . 2015, 81(5): 670 - 83。
- 15.
Bahaji A, Li J, Ovecka M, Ezquer I, Muñoz FJ, Baroja-Fernández E, Romero JM, Almagro G, Montero M, Hidalgo M,等。缺乏adp -葡萄糖焦磷酸化酶的拟南芥突变体积累淀粉和野生型adp -葡萄糖含量:进一步证明adp -葡萄糖与叶片淀粉生物合成相关的重要来源,而不是adp -葡萄糖焦磷酸化酶。植物生理学杂志。2011;52(7):1162-76。
- 16。
Vriet C, Welham T, Brachmann A, Pike M, Pike J, Perry J, Parniske M, Sato S, Tabata S, Smith AM, et al.;一组荷花淀粉突变体揭示了淀粉代谢的保守性和新颖性。植物杂志。2010;15(2):643 - 55。
- 17。
斯莫尔碳分区及淀粉缺乏对拟南芥对冷温的初始反应的影响。植物SCI。2011; 181(2):167-76。
- 18。
关键词:碳水化合物,碳消耗,全球转录水平,碳状态拟南芥玫瑰花饰。植物杂志。2008;146(4):1834 - 61。
- 19。
Bläsing OE, Gibon Y, Gunther M, Hohne M, Morcuende R, Osuna D, Thimm O, Usadel B, Scheible W-R, Stitt M.糖和昼夜调控对拟南芥昼夜基因表达的全球调控有重要贡献。植物细胞。2005;17(12):3257 - 81。
- 20.
Osuna D, Usade B, Morcuende R, Gibon Y, Bläsing OE, Höhne M, Günter M, Kamlage B, Trethewey R, Scheible W-R,等。蔗糖对碳剥夺后转录本、酶活性和代谢物的时间反应拟南芥幼苗。植物j . 2007; 49(3): 463 - 91。
- 21.
Thimm O, Bläsing O, Gibon Y, Nagel A, Meyer S, Krüger P, Selbig J, Müller LA, Rhee SY, Stitt M. mapman:一个用户驱动的工具,用于在代谢途径和其他生物过程的图表上显示基因组数据集。植物j . 2004; 37(6): 914 - 39。
- 22.
Gibon Y,BläsingO,帕拉西奥斯-Rojas的N,Pankovic d,Hendriks的Ĵ,FisahnĴ,霍内男,京特男,昼夜淀粉周转短的天斯蒂特M.调整:夜导致的暂时抑制期间的糖耗尽碳水化合物利用,糖和在下面的光周期ADP葡萄糖焦磷酸化酶的翻译后活化的积累。植物杂志2004; 39(6):847-62。
- 23.
关键词:拟南芥,代谢产物,转录本,酶活性分析基因组医学杂志。2006;7 (8):R76。
- 24.
文特里lia T, Kuhn ML, Ruiz MT, Ribeiro-Pedro M, Valverde F, Ballicora MA, Preiss J, Romero JM。两个拟南芥adp -葡萄糖焦磷酸化酶大亚基(APL1和APL2)具有催化作用。植物杂志。2008;148(1):65 - 76。
- 25.
Balmer Y, Vensel WH, Cai N, Manieri W, Schurmann P, Hurkman WJ, Buchanan BB。一个完整的铁氧还蛋白/硫氧还蛋白系统调节淀粉体的基本过程。中国科学(d辑:地球科学)2006;103(8):2988-93。
- 26.
Abercrombie JM, Halfhill MD, Ranjan P, Rao MR, Saxton AM, Yuan JS, Stewart CN-J。拟南芥对As (V)胁迫的转录反应植物学报。2008;6(8):87。
- 27.
Weston Dj,Gunter Le,Rogers A,Wullschleger SD。将基因,共抑制模块和分子签名与植物环境应激表型连接。BMC SYST BIOL。2008; 4(2):16。
- 28.
agudello - romero P, Carbonell P, de la Iglesia F, Carrera J, Rodrigo G, Jaramillo A, Pérez-Amador MA, Elena SF。烟草蚀刻病毒感染拟南芥后基因表达谱的变化性研究j . 2008; 7(5): 92。
- 29.
栾树华。植物蛋白磷酸酶。植物学报2003;54:63-92。
- 30.
Puthiyaveetil S, Ibrahim IM, Allen JF。叶绿体中状态转换和光系统化学计量调节调控途径中的氧化还原信号成分。植物学报。2012;35(2):347-59。
- 31.
Alvarez ME, penell RI, Meijer PJ, Ishikawa A, Dixon RA, Lamb C.活性氧中间体在植物免疫建立中介导了一个系统信号网络。细胞。1998;92(6):773 - 84。
- 32.
AtNUDX1是一种8-oxo-7,8-二氢-2'-脱氧鸟苷5'-三磷酸焦磷酸水解酶,负责消除拟南芥中的氧化核苷酸。植物生理学报。2007;48(10):1438-49。
- 33。
苏丹娜S,Khew CY,穆尔希德MM,Namasivayam P,Napis S,何CL。从水稻红树植物(AeMDHAR)赋予耐盐单脱氢抗坏血酸还原酶的表达。J植物理性。2012; 169(3):311-8。
- 34。
6 .陈振华,蒋永昌,何涛。拟南芥AtHVA22d和AtHVA22e遗传多样性的合并过程和选择性约束的缓解。中国生物医学工程学报。2004;32(2):616-26。
- 35。
Niyogi Kk,Grossman Ar,BjörkmanO.拟南芥突变体定义了在光合能量转化的调节中的棘皮螺纹循环的核心作用。植物细胞。1998; 10(7):1121-34。
- 36。
Washburn议员,Koller A, Oshiro G, Ulaszek RR, Plouffe D, decu C, Winzeler E, Yates JI。酿酒酵母蛋白途径及相关mRNA和蛋白表达的复杂聚类分析。中国科学院院刊2003;100(6):3107-12。
- 37。
马志强,王志强。拟南芥胁迫相关转录谱、启动子结构和细胞特异性表达的整合。基因组医学杂志。2007;8 (4):R49。
- 38。
王志强,王志强,王志强,等。水稻叶片茉莉酸调控蛋白的蛋白质组学分析。中国生物医学工程学报。2007;14(4):311-9。
- 39。
vierstra rd。泛素/ 26s蛋白酶体途径,在许多植物蛋白的寿命中的复杂最后一章。趋势植物SCI。2003; 8(3):135-42。
- 40.
E3泛素连接酶与植物固有免疫的关系。中国生物医学工程学报。2009;60(4):1123-32。
- 41.
Davuluri RV, Sun H, Palaniswamy SK, Matthews N, Molina C, Kurtz M, Grotewold E. AGRIS:拟南芥基因调控信息服务器,拟南芥顺式调控元件和转录因子的信息资源。BMC生物信息学。2003;25。
- 42.
卡萨尔·JJ,亚诺夫斯基·MJ。光对基因表达的调控。中华医学杂志。2005;49(5-6):501-11。
- 43.
姜SG, Price J, Lin PC, Hong JC, Jang JC。拟南芥bZIP1转录因子参与糖信号、蛋白质网络和DNA结合。摩尔。2010;3(2):361 - 73。
- 44.
李Z,高Q,刘,何C,张X,转录因子ZmPTF1张J.表达提高通过调节碳代谢和根系生长的玉米低磷耐受性。Planta。2011; 233(6):1129至1143年。
- 45.
张红霞,梁伟,杨晓霞,罗晓霞,姜宁,马洪,张东东。水稻花粉发育所需糖分配调控的MYB结构域蛋白。植物细胞,2010,22(3):672 - 89。
- 46.
肖林,McIntyre CL, Gresshoff PM,薛广平。小麦Dof转录因子家族成员与光介导的基因调控有关。基因组学杂志。2009;9(4):485-98。
- 47.
Yanagisawa S. Dof1和Dof2转录因子与玉米碳代谢相关的多个基因表达相关。植物j . 2000; 21(3): 281 - 8。
- 48.
AP2/EREBP转录因子是基因调控网络的一部分,在应激适应和逆行信号中整合代谢、激素和环境信号。原生质。2010;245(1 - 4):3 - 14。
- 49.
酵母中mRNA丰度与蛋白质丰度的相关性。中国生物医学工程学报。1999;19(3):1720-30。
- 50.
研究基因和基因组的蛋白质组学。大自然。2000;405(6788):837 - 46所示。
- 51.
Bohmer M,Schroeder Ji。拟南芥悬浮细胞中脱落酸诱导和活性氧物质依赖性表达变化的定量转录组分及蛋白质组学分析。工厂J1111; 67(1):105-18。
- 52.
Hajduch M, Hearne LB, Miernyk JA, Casteel JE, Joshi T, Agrawal GK, Song Z, Zhou M, Xu D, Thelen JJ。拟南芥种子灌浆的系统分析:使用一般线性模型评估转录本和蛋白表达的一致性。植物杂志。2010;152(4):2078 - 87。
- 53.
Kleinboelting N,Huep G,Kloetgen A,Viehoever P,Weisshaar B.Gabi-Kat SimpleSearch:拟南芥T-DNA突变体数据库的新功能。核酸RES。2012; 40:D1211-1215。
- 54.
拟南芥全基因组插入突变研究(英文)科学。2003;301(5633):653 - 7。
- 55.
赵Y-H,刘世德。FBP介导的果糖在拟南芥中的信号转导作用公共科学图书馆麝猫。2011;7 (1):e1001263。
- 56.
水稻白叶枯病菌(xanthomasonasoryzae)非洲株MAI1基因表达分析。BMC Microbiol。2010;10(1):170。
- 57。
李建军,梁伟,李建军,李建军,等。TM4:一个用于微阵列数据管理和分析的免费、开源系统。生物学技术。2003;34(2):374 - 8。
- 58。
微阵列生物信息学。剑桥:剑桥大学出版社;2003.
- 59。
陈志强,陈志强,陈志强,等。微阵列在电离辐射响应中的意义分析。中国科学院院刊2001;98(9):516 - 21。
- 60.
Usadel B, Nagel A, Steinhauser D, Gibon Y, Blasing OE, Redestig H, Sreenivasulu N, Krall L, Hannah MA, Poree F,等。PageMan:一个交互式的本体工具,用于生成、显示和注释概要图,用于分析实验。BMC生物信息学。2006;7:535。
- 61.
利用质谱法鉴定根质膜组分中丛枝菌根相关蛋白的研究。蛋白质组学。2006;6:S145-55。
- 62.
Ramagli LS, Rodríguez LV。二维聚丙烯酰胺凝胶样品缓冲电泳微量蛋白的定量分析。电泳。1985;6:559 - 63。
- 63.
Yan JX, Wait R, Berkelman T, Harry RA, Westbrook JA, Wheeler CH, Dunn MJ。基于基质辅助激光解吸/电离和电喷雾电离-质谱技术的蛋白质可视化的改良银染色方案。电泳。2000;21(17):3666 - 72。
- 64.
Castillejo M, Fernández-Aparicio M, Rubiales D. Pisum sativum对crenata的早期反应的二维差异凝胶电泳(2D DIGE)蛋白质组学分析。中国生物医学工程学报。2012;63(1):107-19。
确认
作者感谢Trinidad Moreno和Ángel García-Díaz提供的技术支持。蛋白质斑点消化和MALDI-TOF分析在科尔多瓦大学UCO-SCAI蛋白质组学设施进行,该设施是Carlos III网络蛋白质组学平台ProteoRed-ISCIII的成员。作者还感谢Málaga大学的platform Andaluza de Bioinformática提供的计算机资源和技术支持。
资金
这项工作是由研究项目资助BIO2009-07297,从科学和创新的西班牙外交部和欧洲基金区域发展,项目P07-CVI-2795和BIO 154从安达卢西亚地区政府,西班牙和项目BIO2012-33292从经济和竞争力的西班牙外交部。中号索托 - 苏亚雷斯已经从安达卢西亚地区政府和CSIC博士后合同支持。贾。罗哈斯,冈萨雷斯已经从安达卢西亚地区政府合同的支持。
数据和材料的可用性
该微阵列研究的数据集保存在基因表达综合(GEO)中,序列号为GSE32522。所有的支持数据都可以在手稿及其附加文件中找到。
作者的贡献
构思设计实验:MS, MS- s, AJS。进行了MS-S、JAR-G实验。数据分析:MS, MS- s, AJS, RB。写论文:MS, MS- s, AJS。所有作者阅读并批准了最终的手稿。
相互竞争的利益
提交人声明他们没有竞争利益。
同意出版
不适用。
伦理批准
不适用。
作者信息
从属关系
相应的作者
附加文件
附加文件1:表S1。
清单cfbp1和cyfbp通过微阵列分析鉴定在莲座和根中有差异表达的基因。(XLSX 549 kb)
附加文件2:表S2.A-F。
基因聚类分析。通过k-means聚类分析鉴定出6种转录模式cfbp1和cyfbp突变体.(邮政编码136 kb)
附加文件3:图S1。
PageMan显示调控基因类别的协调变化cfbp1和cyfbp失活。(PDF 4098 kb)
附加文件4:表S3。
清单cfbp1和cyfbp通过微阵列分析确定在莲座和根中有差异表达的基因,这些基因涉及卡尔文循环、糖酵解和淀粉代谢。(CSV 9 kb)
附加文件5:表S4。
受影响的生物过程cfbp1和cyfbp基因破坏以下的基因本体论(GO)功能分类方案。(XLSX 252 KB)
附加文件6:图S2。
MapMan表示的表达式变化cfbp1和cyfbp与生物和非生物应激反应相关的基因。(PDF 2874 kb)
附加文件7:图S3。
集群cfbp1和cyfbp调控基因与用于研究应激反应的微阵列实验数据进行了比较。上图显示的是与来自莲座的调控基因的比较,下图显示的是与来自根的调控基因的比较。(PDF 1677 kb)
附加文件8:表S5。
在莲座和根中鉴定的蛋白质点列表cfbp1和cyfbp突变体。(多克斯59 kb)
附加文件9:图S4。
MapMan bin成员为斑点代表蛋白质水平的变化cfbp1和cyfbp.(PDF 635 kb)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Soto-Suárez, M., Serrato, a.j., Rojas-González, J.A.et al。转录组学和蛋白质组学方法鉴定差异表达的基因和蛋白质拟南芥缺乏叶绿体1和胞质fbases的突变体揭示了几个水平的代谢调节。BMC植物BIOL.16,258(2016)。https://doi.org/10.1186/s12870-016-0945-7
收到了:
接受:
发表:
关键字
- 果糖-1,6-二磷酸
- 碳水化合物
- 转录组
- 蛋白质组学
- 玫瑰
- 根