- 研究文章
- 开放访问
- 发表:
结合转录组和代谢组分析来了解水稻植株对螟虫攻击的动态响应卡勒suppressalis(鳞翅目:Crambidae)
BMC植物生物学体积16., 文章编号:259(2016)
摘要
背景
大米(奥雅萨苜蓿是世界上一半以上人口的主食,经常受到草食昆虫的攻击,包括稻螟虫,卡勒suppressalis。c . suppressalis亚洲温带地区的水稻产量大幅下降,但水稻如何在分子和生化水平上防御这种草食动物,我们知之甚少。
结果
在目前的研究中,我们将下一代RNA测序和代谢组学技术相结合,来研究水稻植株在连续喂食后基因表达和代谢过程的变化c . suppressalis不同持续时间的幼虫(0,24,48,72和96小时)。此外,使用定量实时PCR验证数据。当水稻植物损坏时,有4,729个基因和151种代谢物不同调节c . suppressalis幼虫。进一步的分析表明,防御相关的植物激素、转录因子、莽草酸介导的和萜类相关的次级代谢被激活,而生长相关的次级代谢被抑制c . suppressalis喂食。将活化的防御被推动通过能量贮藏化合物的分解代谢,如单糖,其同时导致参与水稻植物防御反应的是代谢物的水平升高。可比分析表明转录模式和代谢特征的对应关系。
结论
这些发现极大地加深了我们对水稻诱导防御反应机制的理解c . suppressalis在为患分子和生化水平,并会提供的抗虫水稻品种的发展线索。
背景
为了抵御食草昆虫的攻击,植物进化出了构成和诱导防御机制[1].诱导防御包括直接和间接的反应,这些反应由食草动物的进食、爬行、草蛉或产卵激活[2].诱导的直接反应包括产生次级代谢物和杀虫蛋白,这可以减少草食动物的发育和生存[1那3.].虽然间接引起的反应主要涉及的挥发性化学物质的释放,可以吸引食草动物的天敌[1那3.那4.].
对取食植物响应与在基因表达和代谢[大规模变化相关5.-9.].转录组学、蛋白质组学和代谢组学等现代组学技术的整合,为在分子和细胞水平上更深入地了解植物对草食动物取食的防御反应机制提供了巨大的机会[7.那9.-11.].先前的研究结果表明,植物对草食动物取食的反应是一个动态过程,转录模式、蛋白质和代谢物谱是受时间和空间调节的[1那10.那12.].这表明对与昆虫饲养相关的转录,蛋白质组学和代谢变化的动态至关重要[6.那7.那9.那11.].转录组和蛋白质组学研究仅能够预测基因表达和蛋白质水平的变化,而代谢组研究研究了这些基因或蛋白质施加的改变的功能。因此,转录组,蛋白质组学和代谢方法的整合可以更好地了解植物对食草动物喂养的反应[10.].
大米(奥雅萨苜蓿是世界上一半以上人口的主食。13.]但是,食草昆虫经常减少水稻产量[14.].Lepidopteran Steph Borers在所有水稻生态系统中是慢性害虫,以及稻瘟病螟卡勒suppressalis是亚洲温带地区最严重的水稻害虫之一[15.].c . suppressalis由于杂交品种的广泛采用,在中国的危害尤其严重。更好地了解水稻植物抗虫害的遗传和分子机制对开发抗病水稻品种和其他防治害虫的策略非常重要[14.].对刺吸水稻稻飞虱防御的遗传基础得到了很好的阐明,一些基因的功能已经确定[16.-19.].例如,Liu等人[16.]鉴定出了几个凝集素受体激酶基因,这些基因为褐飞虱提供了持久的抗性摘要研究选择性和白背飞虱Sogatella furcifera.然而,水稻植物对咀嚼昆虫(如鳞翅目幼虫)的防御反应很少被研究,尽管使用微阵列技术进行了一些研究,其中鉴定出了相对少量的差异表达基因[8.那20.那21.].此外,之前的实验只在之后的一个时间点采集大米样品c . suppressalis因此,这些数据并没有揭示水稻植株对虫害的动态响应c . suppressalis在转录和代谢水平上进食。
在目前的研究中,我们结合转录组和代谢组分析来研究水稻植株对攻击的动态响应c . suppressalis,以期为水稻的防御机制提供更好的理解c . suppressalis水稻虫害及防治策略的发展线索。
方法
植物和生长条件
水稻品种明辉63,是一种优良品种籼稻在中国细胞质雄性不育恢复系,在这个研究中使用。种子在水中温育2天,在温室中育苗床播种(27±3℃,65±10%RH,16 L:8 d)。15天龄幼苗被单独移植到塑料盆(630厘米3.)含有泥炭和蛭石的混合物(3:1)。每天每天浇水并每周供应10毫升氮肥。移植后四周使用植物进行实验。
昆虫的殖民地
标本的c . suppressalis从实验室殖民地检索,该殖民地被维持在人工饮食中超过60代随着现场收集的个体介绍。将菌落保持在27±1°C,75±5%RH和16 L:8 D PhotoPeriod [22.].
昆虫生物测定
将盆栽水稻移入气候控制箱(27±1℃,75±5% RH, 16 L: 8 D光周期)24 h,接种3株3rd.龄c . suppressalis每个工厂。幼虫在与水稻植株关在一起之前先被饥饿2小时。在被幼虫破坏的区域上方4厘米处的主要水稻茎秆,是在幼虫接触后收割的c . suppressalis分别饲喂0(健康对照水稻植株)、24、48、72和96 h。植物样品立即在液氮中冷冻,并在−80°C下保存,以便以后进行分析。在0、24、48和72 h的每个时间点采集4个样本(重复),用于转录组分析。在每个时间点采集10个样本,用于代谢组分析:0、48、72和96 h。转录组和代谢组分析的采样时间不同,因为水稻植株在转录组水平上对昆虫取食的反应比在代谢组水平上更快[1那10.].
转录组分析
RNA提取
根据制造商的说明,使用TRIzol试剂(Invitrogen, Carlsbad, CA, USA)从水稻茎样品中分离总RNA。使用2200生物分析仪(安捷伦技术公司,圣克拉拉,加州,美国)检测RNA质量。经鉴定,所有样品的RNA完整性数(RIN)均为> 9.7。
图书馆准备和RNA测序
根据制造商的协议,使用Ion Total RNA-sequencing (RNA- seq) Kit v2 (Life Technologies, Carlsbad, CA, USA)制备每个RNA样本的测序库。简而言之,用寡核苷酸(dT)磁珠从每个样品的5 μg总RNA中纯化mRNA,并使用RNase III (Invitrogen公司,Carlsbad, CA, USA)将其片段化。将片段mRNA杂交并与离子适配器连接。首先用随机引物逆转录合成第一链cDNA,然后用DNA聚合酶I和RNase H (Invitrogen公司,Carlsbad, CA, USA)合成第二链cDNA。得到的cDNA片段经过末端修复过程,然后磷酸化,然后连接适配器。这些产物随后被纯化并通过PCR扩增,以建立cDNA文库。cDNA文库在OneTouch 2仪器上处理和富集,使用Ion PI™Template OT2 200 Kit (Life Technologies, Carlsbad, CA, USA)制备模板- positive Ion PI™Ion Sphere™Particles。富集后,混合模板-阳性离子PI™离子球™粒子最终加载在Ion PI™芯片上,使用Ion PI™Sequencing 200 Kit (Life Technologies, Carlsbad, CA, USA)进行测序。如前所述,上海Novelbio有限公司对RNA-seq文库进行生物信息学数据分析[23.].
定量实时聚合酶链反应
用于定量实时PCR(qPCR的)的植物组织样品来自相同的批次中取样用于RNA-SEQ实验稻植物中的不同植物收集。简言之,总RNA 500ng的然后稀释50X逆转录使用第一链cDNA合成试剂盒(Promega,麦迪逊,WI,USA),用DNA酶I(赛默飞世尔科技,沃尔瑟姆,MA,USA)消化,和。qPCR的反应使用SYBR预混实施例的Taq预拌与POX参考染料(宝生物技术,京都,日本)和ABI 7500实时PCR检测系统仪器(Applied Biosystems公司福斯特城,CA,USA)进行。将热循环仪的设置如下:30秒95℃,接着第5号第40个循环的95℃下和34号在60℃下。为了证实单峰的形成和排除引物二聚体和非特异性产物形成的可能性,熔融曲线(15秒95℃,60秒60℃,和15秒,在95℃)为由每个PCR反应的结束时产生。引物对用信标设计软件(总理BIOSOFT,版本7.0)设计和其他文件中列出1:表S1。使用比较2计算基因表达的相对折叠变化-ΔΔct方法 [24.]并被标准化为管家基因泛素5[25.].所有qPCR反应均在3个生物学重复和4个技术重复中重复。
差异表达基因(DEGs)分析
使用FAST-QC检测RNA-seq读取质量值(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/).读取映射到密歇根州立大学(MSU)水稻基因组注释项目数据库(RGAP,V7.0)的参考水稻基因组(http://rice.plantbiology.msu.edu/)[26.]使用MapSplice软件[27.].DEGSeq算法[28.]用于过滤deg。每千碱基外显子模型的Reads per million mapping Reads (RPKM)被用来探索DEGs的表达水平[29.],和上四分位数算法应用于用于数据校正。用于数据的校正假发现率(FDR)发生在多个显著测试[30.].表达差异至少两倍的基因2(倍数变化)> 1或<-1,FDR <0.05)被认为是DEGS与R统计编程环境来确定(http://www.r-project.org).与使用Mapman软件从未喂食的人进行过24,48或72小时,分别由毛毛虫喂养的水稻植物中的果酒。31.].利用这些差异基因生成维恩图,以确定共同和独特的基因受影响c . suppressalis在不同的时间点之间[32.].基于Short Time-series Expression Miner (STEM)方法的时间序列聚类分析(http://www.cs.cmu.edu/~jernst/stem/)[33,用于识别总差异值表达的全球趋势和相似的时间模型模式。
植物激素签名分析
荷尔蒙计画分析[34)(http://hormonometer.weizmann.ac.il/)被用来评估水稻基因的诱导表达的相似性c . suppressalis用外源施用植物激素所得到的索引数据集拟南芥如前所述[7.].将水稻基因爆炸到拟南芥蒂利亚纳基因组。的拟南芥基因鉴定(AGI)转化为拟南芥使用g:Convert Gene ID Converter工具识别探针集[35)(http://biit.cs.ut.ee/gprofiler/gconvert.cgi).只有RNA-SEQ中包含的基因含有拟南芥探针集标识用于分析。在某些情况下,一个AGI有两个探测集,而在少数情况下,一个探测集有两个AGI。这表明行被复制,集合因此被丢弃。
基因本体(GO)和通路富集分析
检索不同类别的DEGs进行氧化石墨烯和通路分析。GO分析采用BioConductor (http://www.biocumon.org/),基于生物过程分类(Fisher精确测试,FDR < 0.001)。根据京都基因和基因组百科全书(KEGG) (http://www.genome.jp/kegg)数据库。采用Fisher精确检验,然后采用Benjamini-Hochberg多重检验校正来识别显著途径(P.< 0.05)。
代谢组分析
使用自动化Microlab STAR制备样品®系统(汉密尔顿公司,博纳杜茨,瑞士),并使用超高性能液相色谱 - 串联质谱法(UHPLC-MS)和气相色谱 - 质谱(GC-MS)平台由Metabolon公司(北卡罗来纳州达勒姆,USA)进行分析.这些平台此前已描述36那37].简而言之,在提取过程的第一步之前加入回收标准以进行质量控制目的。通过用甲醇的连续提取除去样品的蛋白质级分。随后将样品集中在ZymarkTurbovap®系统(Kckinley Scientific,Sparta,NJ,USA)上以除去有机溶剂,然后真空干燥。将得到的样品分为五个级分,它们通过以下方式用于分析:I)UHPLC-MS,具有正离子模式电喷雾电离,II)具有负离子模式电喷雾电离,III)UHPLC-MS极性平台(负离子化),IV)GC-MS和V)分别保留用于备用。在UHPLC-MS分析之前,将子样物在氮气下储存过夜。对于GC-MS分析,将每个样品在真空下干燥过夜。所有样品的UHPLC-MS和GC-MS分析是与Metabolon Inc.的协作进行的,如下所述[36那37].
为了进行统计分析,假设缺失值低于检测限,以最小复合值输入[37].分析前对各代谢物的相对丰度进行对数转换,使之符合正态。邓尼特试验被用来比较不同时间点之间每种代谢物的丰度。使用SPSS 22.0软件包(IBM SPSS, Somers, NY, USA)进行统计分析。
结果
水稻转录组的全球变化卡勒suppressalis侵扰
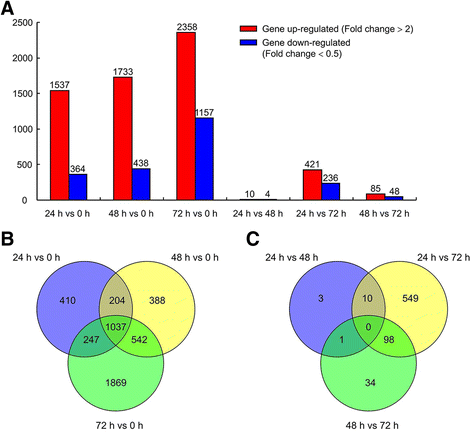
总共进行了16个文库(4次采样的4次生物重复),大约产生了2900 - 4100万次干净读取;GC内容占这些读取的48-53%(附加文件2:表S2)。映射到大米参考基因组的平均读数数> 87%,独特的映射率范围为73至87%(附加文件2:表S2)。唯一的匹配reads被用于进一步的分析。基因结构分析显示,大部分测序片段(61-73%)分布在外显子中(附加文件)3.:表S3)。RNA-seq数据归一化到RPKM值以量化转录本表达。在所有样本中检测到42,100个基因(附加文件)4.:表S4)。只有显著改变了基因P.< 0.05 (FDR)和fold-change > 2或< 0.05被认为是差异表达基因(deg),导致至少在两个时间点共4729个deg(图)。1额外的文件5.:表S5和附加文件6.:表S6)。比较不同时间点的DEGs与对照(24 h vs. 0 h, 48 h vs. 0 h, 72 h vs. 0 h),发现有超过1000个基因的表达水平显著改变,表达上调的基因多于表达下调的基因(图)。1A).MapMan分析表明,在不同的时间点(24,48,或72小时)和对照(0 H)之间的水稻植物的上调DEGS主要参与细胞壁,脂质和次生代谢。虽然主要涉及光反应的下调DEGS(附加文件7.:图S1)。该数据集的维恩图显示,在24、48和72 h相对于0 h的3个时间点上,有1037个基因表达不同(图2)。1B.).然而,在24 h与48 h、24 h与72 h、48 h与72 h之间检测到的deg数量要低得多,并且在这三个时间点中的两个之间的deg没有共性(图)。1A那C).
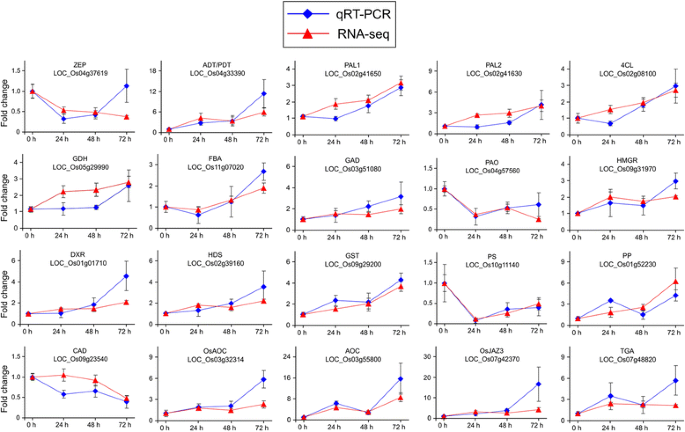
选择的基因的表达模式通过qPCR使用稻茎样品来自相同的批次稻株被用于RNA-SEQ该确认。共20个基因中选择与植物激素的信令,初级代谢和次级代谢。虽然只有一个持家基因在qPCR分析(图用于通过qPCR测试的大多数基因的表达谱与通过RNA-SEQ分析是一致的。2),表明我们的转录组实验结果得到了验证.
mRNA表达水平的比较通过RNA-SEQ(实心三角)和qPCR(实心正方形)20个选择的基因检测。所有的qPCR数据归一对看家基因泛素5.值为平均值±SE;N= 4的RNA-seq和N= 3进行qRT-PCR。齐柏林飞艇,玉米黄质环氧酶;ADT / PDT, arogenate / prephenate脱水酶;朋友,苯丙氨酸ammonia-lyase;4 cl, 4-coumarate-CoA连接酶;国民幸福指数,谷氨酸脱氢酶;FBA, I类果糖二磷酸醛缩酶;迦得,谷氨酸脱羧酶;PAO聚胺氧化酶;HMGR hydroxymethylglutaryl-CoA还原酶; DXR, 1-deoxy-D-xylulose 5-phosphate reductoisomerase; HDS, 4-hydroxy-3-methylbut-2-enyl diphosphate synthase; GST, glutathione S-transferase; PS, phytoene synthase; PP, phosphatase; CAD, cinnamyl-alcohol dehydrogenase; AOC, allene oxide cyclase; JAZ, jasmonate ZIM domain-containing protein; and TGA, TGACGTCA独联体元件结合蛋白
系列集群和浓缩分析
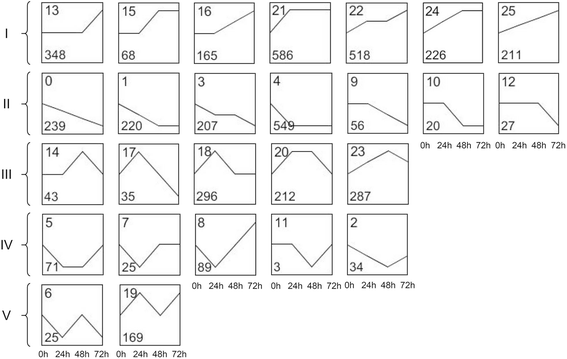
为了优化至少在两个时间点表达不同的基因集,我们使用了STEM方法,该方法通常用于转录组学研究中的基因表达群集[33].在4729度的视角聚为26个可能的模型概要文件(图3.;额外的文件6.:表S6)。基于这些参数的表达式动态,将它们的表达式模式分配为五个类(附加文件6.:表S6)。第I类中有2122个基因在幼虫取食72 h时有上调表达的趋势。第II类有1318个基因表达呈下调趋势。III类中有873个基因在早期上调,后期下调。第IV类中有222个基因在早期下调而在晚期上调。V类包含其余194个表达谱不规则的基因。GO分析显示,5个分类中生物工艺类的显著GO项分别为85、47、48、2、5个(补充文件)8.:表S7)。这表明大多数的deg参与了对c . suppressalis损坏包括在前三个类别。这些deg的GO分析的更多细节在附加文件中提供8.: S7表。途径富集分析表明,第I类基因主要与植物次生代谢产物的生物合成、植物激素信号转导、氮代谢、半乳糖、萜类等途径相关(见表)1).II类基因主要参与核苷酸代谢和光合作用等初级代谢,这可能表明光合作用活性受到抑制,核酸分解代谢增加。III类基因主要参与硫代葡萄糖苷、苯丙素等次生代谢产物的生物合成途径和半乳糖、果糖、甘露糖等碳水化合物的代谢。IV类基因主要与淀粉和蔗糖的代谢以及光合作用天线蛋白、黄酮和黄酮醇的生物合成有关。V类基因主要参与次级代谢。
Phytohormone-related度
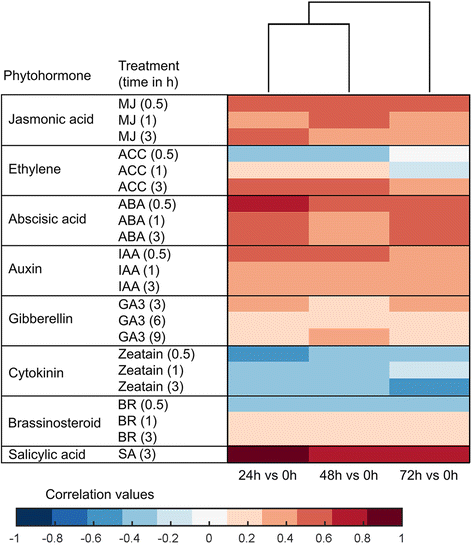
共计9 221人拟南芥水稻基因的同源性包括在激素分析中(附加文件)9.:表S8)。基因表达的变化c . suppressalis在水稻与那些由SA(水杨酸),JA(茉莉酸),ABA(脱落酸)诱导呈正相关,而在治疗生长素拟南芥(无花果。4.).基因表达的变化与细胞分裂素(CTK)信号相关基因呈负相关。这些模式通常由5个类(附加文件)的GO分析支持8.:表S7)。
转录因子(TF)相关度的视角
鉴于转录因子的重要调控功能,我们通过对植物转录因子数据库(PlnTFDB,V3.0) (http://plntfdb.bio.uni-potsdam.de/v3.0/)[38].我们确定了385个TFS在4,729次DEG中分发了39个家庭(附加档案10.:表S9)。这些资助项目主要包括:AP2-EREBP (apetala2-ethylene-responsive元素结合蛋白)基因(50),WRKY基因(37),bHLH(基本helix-loop-helix)基因(27),MYB基因(22)(成髓细胞瘤),南京(南、ATAF1-2 CUC2)基因(20),孤儿基因(17),HB(驼背)(15个基因),MYB-related基因(13)和bZIP(基本区域/亮氨酸拉链主题)(13)的基因。AP2-EREBP、WRKY、MYB、bHLH、MYB相关和NAC家族的大部分基因属于i类。附加文件中提供了已识别tf的表达式概要文件的更多细节10.:表S9。
代谢组分析的组合物
在水稻幼虫摄食96 h内,共检测和定量了151种已知代谢物(附文件)11.:表S10)。通过基于KEGG和植物代谢网络(PMN)绘制一般生化途径,我们将代谢产物分为7类,其中氨基酸最常见(占代谢产物的33%),其次是碳水化合物(占29%)(补充文件)12.:图S2)。次级代谢物占7%(附加文件11.:表S10;额外的文件12.:图S2)。
转录组和代谢数据集的综合分析
芳香族氨基酸,水杨酸和苯丙素的生物合成
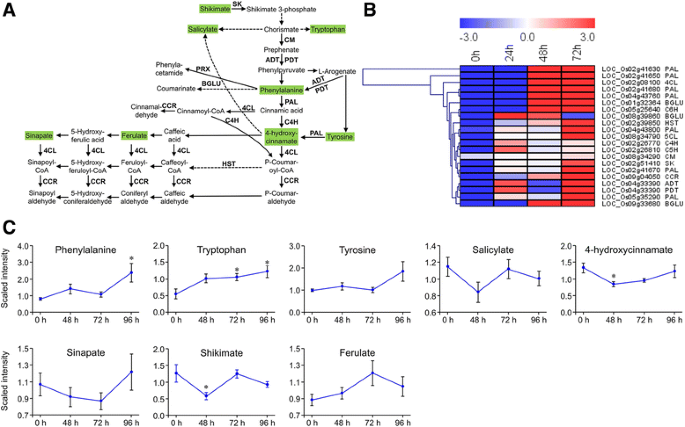
莽草酸途径是植物中的主要途径,负责芳香族氨基酸Phe、Tyr、Trp以及生长素、SA、木质素、苯丙素的生物合成[39].转录组和代谢数据的整合显示,基因的转录上调伴随着通路中主要代谢物的升高(图。5.;额外的文件13.:表S11)。例如,在幼虫取食的72小时内积累的shikimate途径中编码关键酶的所有基因都属于I类,其中含有上调的DEGs(图)。5.).
的表达模式卡勒suppressalis诱导的基因和代谢物参与的芳香族氨基酸,水杨酸,和苯丙生物合成。一种通路示意图。大写字母表示编码酶的基因。用绿色阴影测量代谢物。固体箭头表示已确定的生物合成步骤,而断裂箭头表示涉及多个酶反应。SK shikimate激酶;厘米,chorismate变位酶;ADT, arogenate脱水酶;PDT, prephenate脱水酶;BGLU beta-glucosidase;插件可以,过氧化物酶; CCR, cinnamoyl-CoA reductase; PAL, phenylalanine ammonia-lyase; C4H, cinnamic acid 4-hydroxylase; 4CL, 4-coumarate-CoA ligase; HST, shikimate O-hydroxycinnamoyltransferase.B.相关基因表达水平的热图。热图由RPKM数据使用MeV (V4.9.0)生成。C代谢物丰富后c . suppressalis侵扰;值为平均值±SE (N= 10)。*,P.<0.05通过Dunnett相对于未捕获的控制测试
卡勒suppressalis在碳水化合物代谢诱导的变化
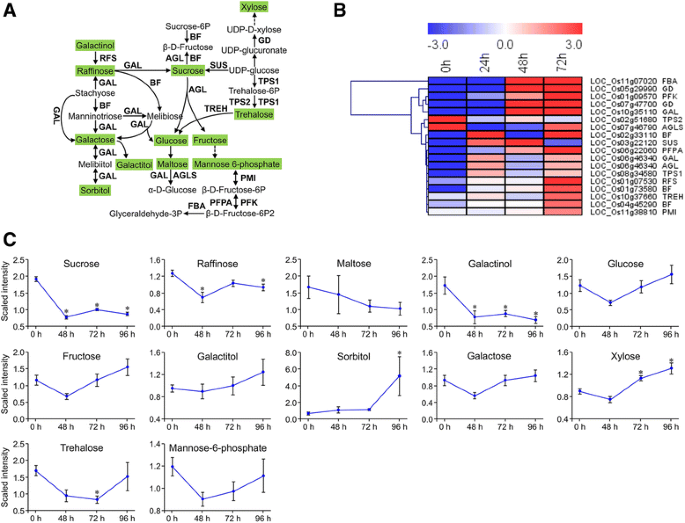
碳水化合物是植物光合作用的产物,是植物储存能量的主要来源。大多数参与碳水化合物代谢的基因表达上调(图。6 b),除了编码海藻糖6-磷酸合酶(TPS)和4-α-葡聚糖转移酶(AGL)的基因。始终如一地,代谢分析表明,除了寡糖和半乳糖醇,所有单糖(胰酸盐,半乳糖醇,葡萄糖,果糖和木糖)随时间的增加而增加(图。6摄氏度;额外的文件11.:表S10)。
的表达模式卡勒suppressalis-诱导基因和代谢产物,涉及典型的碳水化合物代谢。一种典型的碳水化合物代谢途径示意图。大写字母是编码酶的基因。用绿色阴影测量代谢物。固体箭头表示已确定的生物合成步骤,而断裂箭头表示涉及多个酶反应。RFS棉子糖合成酶;加,alpha-galactosidase;男朋友,beta-fructofuranosidase;榴弹炮,alpha-glucosidase;SUS,蔗糖合酶;alpha-trehalase TREHα; PMI, mannose-6-phosphate isomerase; TPS, trehalose 6-phosphate synthase; PFK, 6-phosphofructokinase 1; PFPA, pyrophosphate-fructose-6-phosphate 1-phosphotransferase; FBA, fructose-bisphosphate aldolase, class I; AGLS, 4-alpha-glucanotransferase.B.相关基因表达水平的热图。热图由RPKM数据使用MeV (V4.9.0)生成。C代谢物丰富后c . suppressalis侵扰;值为平均值±SE (N= 10)。*,P.<0.05通过Dunnett相对于未捕获的控制测试
的影响二化螟以氨基酸、有机酸和氮代谢为食
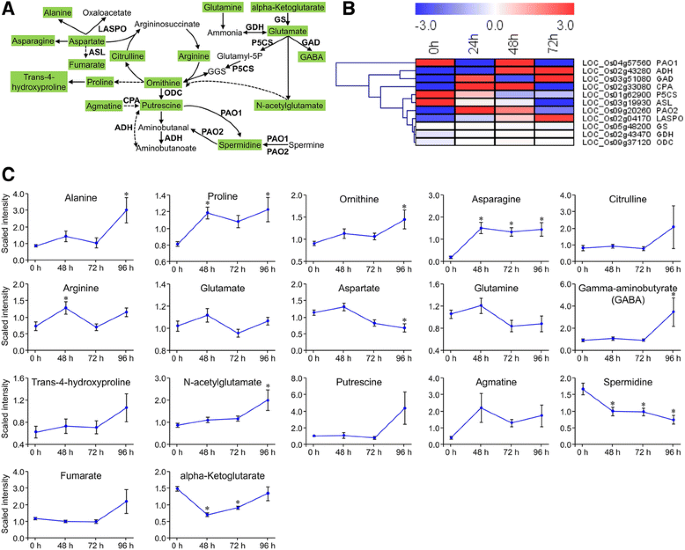
我们的分析表明,谷氨酸脱羧酶(GAD)、n -氨甲酰腐胺酰胺酶(CPA)、鸟氨酸脱羧酶(ODC)和l -天冬氨酸氧化酶(LASPO)的基因编码酶上调;而编码腺苷琥珀酸裂解酶(ASL)和delta-1-吡咯-5-羧酸合成酶(P5CS)的基因则随着时间的推移而下调。结果表明,水稻植株中鸟氨酸、-氨基丁酸和腐胺等代谢物含量增加,而天冬氨酸和亚精胺含量降低c . suppressalis由于上述酶的作用而摄食(图。7一个那B.).此外,我们还检测到其他氨基酸如Pro、Ala和Asn的水平升高(图。7 c).
的表达模式卡勒suppressalis诱导的基因和参与的胺和多胺以及从谷氨酸和天冬氨酸家族氨基酸的代谢的代谢物。一种氨基酸代谢的途径示意图。大写字母是编码酶的基因。用绿色阴影测量代谢物。固体箭头表示已确定的生物合成步骤,而断裂箭头表示涉及多个酶反应。国民幸福指数,谷氨酸脱氢酶;迦得,谷氨酸脱羧酶;GS,谷氨酸合成酶;ODC,鸟氨酸脱羧酶;PAO聚胺氧化酶;CPA,N-Carbamoylputrescine酰胺酶; ASL, adenylosuccinate lyase; ADH, aldehyde dehydrogenase; LASPO, L-aspartate oxidase; and P5CS, delta-1-pyrroline-5-carboxylate synthetase. GABA, gamma-Aminobutyric acid; GGS, L-glutamate gamma-semialdehyde.B.相关基因表达水平的热图。热图由RPKM数据使用MeV (V4.9.0)生成。C代谢物丰富后c . suppressalis侵扰;值为平均值±SE (N= 10)。*,P.<0.05通过Dunnett相对于未捕获的控制测试
卡勒suppressalis-诱导的萜类代谢变化
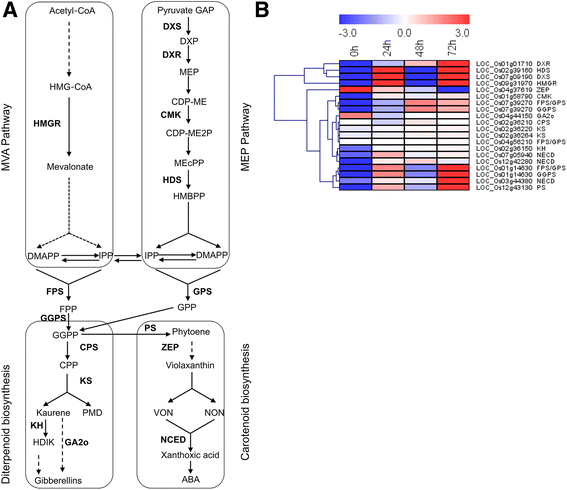
分析集中于参与萜类化合物的代谢(图基因。8.;额外的文件13.:表S11)。甲基赤藓糖醇磷酸(MEP)途径中编码以下关键酶的四个基因被上调c . suppressalis喂养:1-脱氧d木酮糖-5-磷酸合酶(DXS),1-脱氧d木酮糖-5-磷酸还原异构酶(DXR),4-二磷酸胞苷-2-C-甲基d赤藓糖醇激酶(MCT),和4-羟基-3-甲基丁-2-烯基二磷酸合成酶(HDS)。此外,编码羟甲基-CoA还原酶(HMGR)和编码牻牛儿基二磷酸合酶(GPS),法呢基二磷酸合酶(FPS)的基因,和香叶基香叶基二磷酸合酶(GGPS)基因也上调诱导c . suppressalis喂食。二萜合成和类胡萝卜素合成途径中编码酶的基因表达也发生了改变c . suppressalis喂食。在这些基因中,基本上调节9-CIS-环氧丙酮蛋白二氧化酶(NCED)。相反,在整个幼虫进料期间,编码Ga 2-氧化酶(Ga2O)和Zeaxanthin环氧酶(Zep)的基因进行了下调。
的表达模式卡勒suppressalis-诱导基因涉及萜类生物合成途径。一种萜类代谢途径示意图。大写字母是编码酶的基因。固体箭头表示已确定的生物合成步骤,而断裂箭头表示涉及多个酶反应。MVA,甲羟戊酸;欧洲议会议员,2-C-methyl-D-erythritol 4-phosphate;β- Hydroxymethylglutaryl-CoA;HMGR,β-还原酶;焦磷酸dimethylallyl DMAPP;IPP,焦磷酸isopentenyl;伊迪,IPP异构酶; GAP, glyceraldehyde-3-phosphate; DXP, 1-deoxy-D-xylulose 5-phosphate; DXS, DXP synthase; DXR, 1-deoxy-D-xylulose 5-phosphate reductoisomerase; CDP-ME, 4-diphosphocytidyl-2-C-methyl-D-erythritol; MCT, 4-diphosphocytidyl-2-C-methyl-Derythritol synthase; CMK, 4-diphosphocytidyl-2-C-methyl-D-erythritol kinase; CDP-ME-2P, 4-diphosphocytidyl-2-C-methyl-D-erythritol 2-phosphate; MEcPP, 2-C-methyl-D-erythritol 2,4-cyclodiphosphate; HDS, 4-hydroxy-3-methylbut-2-enyl diphosphate synthase; HMBPP, 4-hydroxy-3-methylbut-2-enyl diphosphate; GPP, geranyl diphosphate; GPS, GPP synthase; FPP, farnesyl diphosphate; FPS, FPP synthase; GGPP, geranylgeranyl diphosphate; GGPS, GGPP synthase; CPP, copalyl diphosphate; CPS, CPP synthase; KS, kaurene synthase; PMD, Pimara-8(14),15-diene; KH, Ent-isokaurene C2-hydroxylase; HDIK, ent-2-alpha-Hydroxyisokaurene; GA2o, GA 2-oxidase; PSY, phytoene synthase; PS, phytoene synthase; ZEP, zeaxanthin epoxidase; VON, 9-cis-Violaxanthin; NON, 9′-cis-Neoxanthin; NCED, 9-cis-epoxycarotenoid dioxygenase; ABA, abscisic acid.B.相关基因表达水平的热图。热图由RPKM数据使用MeV (V4.9.0)生成。
讨论
目前的研究首次尝试将转录组学和代谢技术相结合,对水稻植物对由黄萎病引起的损害的反应所涉及的基因和代谢物进行比较分析c . suppressalis幼虫。这些结果增加了我们对水稻植物对毛虫摄食动态响应机制的理解。
基因表达分析显示,在对摄食的反应中,上调的deg多于下调的c . suppressalis幼虫。这与先前的发现有关蚜虫感染玉米的结果一致[7.和玉米被机械损伤,然后用口腔分泌物治疗Mythimna separata[9.].同样,当温度升高时,上调的deg比下调的多拟南芥植物被单独感染Myzus persicae那Brevicoryne brassicae那Spodoptera exigua, 要么地区rapae[40],或当棉花是由咀嚼昆虫损害Helicoverpa Armigera要么Anthonomus茅[41].然而,也有研究报道,当水稻植株受到破坏时,下调的deg多于上调的,或者上调和下调的deg数量相等c . suppressalis[8.]或棕色植物卧室N. LuGens.[42那43或者棉花植株受到白蝇的侵扰烟或蚜蚜虫棉[6.那44].这种变异可能是由食草动物物种、植物物种、被侵染的植物组织、侵染的持续时间和用于检测基因表达的技术的差异来解释的[40].
作为转录的关键调节因子,转录因子在植物对草食[重要5.那8.那45-47].在我们的转录组分析中,我们鉴定了385个TF基因c . suppressalis这表明,诱导的防御反应是复杂的,涉及到水稻代谢的实质性变化。TF家族的表达变化最大c . suppressalis摄食AP2-EREBP和WRKY。越来越多的证据表明,wrky在植物发育以及对生物和非生物胁迫的响应中发挥重要作用[5.那8.那45-47],和对生物和/或非生物应力的AP2-EREBP家族中介防御的成员[45].例如,最近发现OsWRKY70通过积极调节JA和SA之间的跨谈米饭攻击时,介导防御的优先级c . suppressalis[47),而OsWRKY53是植物生长的负调控因子和诱导防御的早期抑制因子[46,这两家公司都属于WRKY家族。转录因子在水稻抗虫中的作用有待进一步研究。
植物激素在复杂的调节网络中发挥重要作用,这是草食动物诱导的反应所必需的,如前所述[1那4.那48我们的激素分析也表明了这一点。我们的结果表明c . suppressalis诱导JA和SA相关基因的表达,这与之前的研究一致[8.].反过来,在水稻植株上施用甲基茉莉酸或茉莉酸会降低两种根性食草动物黄瓜甲虫的生长性能Diabrotica balteata还有稻水象甲lissorhoptrus oryzophilus[49],并诱导释放可吸引寄生蜂的挥发物[50].SA是莽草酸途径的中枢激素,在防御生物营养病原体和刺/吸昆虫中起重要作用[1].我们的数据显示,由一批大米SA相关基因表达上调c . suppressalis幼虫取食(无花果。5 b).虽然有研究报道JA和SA之间的串扰在拟南芥[51],并且依赖JA依赖的防御可能会被SA妨碍反之亦然[5.那19.],我们的发现与SA和JA在水稻中有重叠甚至协同作用的证据是一致的[8.那51].
我们发现所诱导的基因表达的变化c . suppressalis与ABA处理引起的变化呈显著正相关拟南芥,这与几种植物 - 昆虫系统中的先前结果同意[5.那7.那9.那40那44].ABA在调节水稻对病原体的防御中所起的作用已被充分证明[51,但它在抵抗昆虫方面的作用却知之甚少。我们的研究结果表明,ABA标记也可能在水稻对昆虫食草动物的防御中发挥重要作用,尽管研究人员最近报道,对水稻根系施用ABA并不影响昆虫的表现D. Balteata.和L. oryzophilus[49].我们推测ABA可能在水稻植物对草食动物的防御中发挥其他作用,但这一假设还需要进一步的研究。相反,我们发现ctk诱导的与c . suppressalis-诱导的基因表达(图4.).这种负相关也在其他植物物种中观察到[7.那34那52,可能反映了水稻植株生长速度的下降c . suppressalis侵扰。
昆虫侵袭导致初级和次级代谢许多变化,和代谢的重新配置是一种常见的防御策略[11.那48那53].我们的MapMan分析和GO和途径富集分析表明,水稻植株在响应玉米的生长过程中,会对初级和次级代谢进行重组c . suppressalis喂养(表1;额外的文件7.:图S1和附加文件8.:表S7)。光合作用减少,通过光合作用相关基因的下调显示,是昆虫进食的常见反应[5.那8.那11.那40那53]目前的研究中还确认了什么。伴随着国防相关基因上调的光合基因的下调可能允许稻草将资源重定向到防御。
昆虫攻击植物中的光合作用减少,而植物需要能量和碳以产生与防御相关的代谢物[11.那53].通过促进能量贮藏化合物的分解代谢的损害许多植物物种反应,如可通过转化酶的活性增加和编码催化复杂碳水化合物的降解酶的基因的表达的增加反映[11.];这种变化在目前的研究中也很明显。例如,我们发现编码转化酶的基因,如葡萄糖苷酶(榴弹炮),β-呋喃果糖苷酶(BF.)和-半乳糖苷酶(加)被上调c . suppressalis喂食。其结果是,寡糖,棉子糖,和galattinol的内容下降,而单糖的增加(图6摄氏度).氨基酸是植物中氮的主要形式,是食草动物生长的主要限制营养物质,也是产生防御相关代谢产物的前体。氨基酸因此在植物和食草动物之间的相互作用中非常重要[11.].我们的代谢分析表明,大多数氨基酸的含量增加了c . suppressalis喂食(图。5.和7.和额外的文件11.:表S10)。在这些氨基酸中,色氨酸(Trp),例如,显著增加c . suppressalis喂食(图。5度).色氨酸可以作为防御代谢物的前体。以前的研究也报告了类似的结果[40那49].苯丙氨酸是莽草酸介导的苯丙素生物合成的前体[39].结果显示,苯丙氨酸解氨酶(朋友)基因表达随着时间的推移伴随着升高的pHE水平。这同意刘等人的研究。[54,两者都被激活了朋友在损坏的水稻植物中检测到基因表达和增加的PHE水平N. LuGens..另一种重要氨基酸-氨基丁酸(GABA)的含量也在后期增加c . suppressalis幼虫。同样的结果也在水稻中发现N. LuGens.[54].一致的结果进行了报道,通过喂养美国littoralis幼虫引起GABA在叶片中的积累拟南芥,这种积累减少了昆虫的进食[55].GABA在稻瘟病患者中的作用需要进一步调查。虽然食草动物诱导的氨基酸积累可支持抗防御性代谢物的产生,但氨基酸的积累也可能使食草动物有益[1那7.].为了支持后一种推论,我们观察到米布朗·帕特霍普N. LuGens.被米养殖植物吸引了c . suppressalis(Wang et al.,未发表的数据)。
次生代谢产物在植物对昆虫摄食的防御反应中起着重要作用。苯丙素主要通过莽草酯途径生物合成,已被广泛报道由昆虫摄食诱导,作为对草食动物的直接抗性[5.那12.].在目前的研究中,我们发现涉及莽草酸途径的基因,如莽草酸激酶(SK)、伴音突变酶(厘米)、玫瑰酸脱水酶(ADT)、预苯酸脱水酶(PDT)、苯丙氨酸解氨酶(朋友)、肉桂酸4-羟化酶(C4H)的诱导和对4-羟基肉桂酸和阿魏酸等苯丙素的积累作为攻击反应c . suppressalis.这些结果表明,莽草酸介导的次生代谢对水稻抗病具有重要作用c . suppressalis幼虫取食。萜类是最常见的次级代谢物,可直接影响昆虫的表现,或间接吸引食草动物的天敌[1那4.那56那57].在植物中,所有的萜类化合物都来自甲戊酸(MVA)途径和甲基赤藓糖醇磷酸(MEP)途径[58].在米饭中,通过咀嚼食草动物的侵染,如c . suppressalis那美国frugiperda, 要么Cnaphalocrocis medinalis诱导释放一种混合挥发物的复合物,增加对天敌的搜索效率[14.].在目前的工作中,HMGR的表达是MVA途径中催化HMG-CoA转化为甲戊酸的关键调控因子[58,由c . suppressalis喂食。法尼基二磷酸(FPP)、香叶基二磷酸(GPP)和香叶基香叶基二磷酸(GGPP)是生物合成单萜类、倍半萜类、三萜类和二萜类的主要前体[58].本研究还发现,催化二甲基烯丙基焦磷酸(DMAPP)/异戊烯基焦磷酸(IPP)合成FPP或GPP以及催化FPP合成GGPP的酶编码基因也上调。此外,参与二萜和类胡萝卜素通路的关键基因也被激活c . suppressalis喂食(图。8.).以前的研究表明,水稻植株受到c . suppressalis≥24 h,增加了柠檬烯、copaene、β-石竹烯、α-bergamotene、germacrene D、δ-selinene和α-雪松烯等萜类化合物的释放[8.那57].
缩写
- 4CL:
-
4-香豆素 - COA连接酶
- 阿巴:
-
脱落酸
- ACC:
-
1-氨基环丙烷-1-羧酸(乙烯的代谢前体)
- 抗利尿激素:
-
乙醛脱氢酶
- ADT / PDT:
-
Arogenate / prephenate脱水酶
- 美国国际集团:
-
拟南芥基因识别
- AGL:
-
Asalpha-glucosidase
- agls:
-
4-alpha-glucanotransferase
- AOC:
-
丙二烯氧化环化酶
- AP2-EREBP:
-
APETALA2 - 乙烯 - 反应元件结合蛋白
- ASL:
-
Adenylosuccinate裂合酶
- 男朋友:
-
Beta-fructofuranosidase
- BGLU:
-
Beta-glucosidase
- bhlh:
-
基本helix-loop-helix
- BR:
-
Brassinosteroid
- bZIP:
-
基本区域/亮色拉链图案
- C4H:
-
肉桂酸4-hydroxylase
- 计算机辅助设计:
-
肉桂醇脱氢酶
- CCR:
-
肉桂-CoA还原酶
- CDP-ME:
-
4-diphosphocytidyl-2-C-methyl-D-erythritol
- CDP-ME-2P:
-
4-diphosphocytidyl-2-C-methyl-D-erythritol 2-phosphate
- CM:
-
酸毒素蛋白酶
- CMK:
-
4-二磷苷酰基-2- C-甲基-D-赤藓糖醇激酶
- 注册会计师:
-
N-carbamoylputrescine酰胺酶
- CPP:
-
柯巴基磷酸
- CPS:
-
CPP合酶
- 与原:
-
细胞分裂素
- 度:
-
差异表达基因
- DMAPP:
-
焦磷酸催化dimethylallyl
- DXP:
-
1-deoxy-D-xylulose 5-phosphate
- DXR:
-
1-deoxy-d-xylulose 5-phosphate reductoisomerase
- DXS:
-
1-deoxy-d-xylulose 5-phosphate合酶
- 功能性:
-
一类果糖二磷酸醛缩酶
- 罗斯福:
-
错误发现率
- FPP:
-
通过二磷酸
- 帧:
-
通过二磷酸合酶
- Ga2o:
-
GA 2-oxidase
- 赤霉素:
-
赤霉酸3
- GABA:
-
γ-氨基丁酸
- 迦得:
-
谷氨酸脱羧酶
- GAL:
-
Andalpha-galactosidase
- 差距:
-
Glyceraldehyde-3-phosphate
- GC-MS:
-
气相色谱分析-质谱法
- 国民幸福指数:
-
谷氨酸脱氢酶
- GGPP:
-
Geranylgeranyl二磷酸
- GGPS:
-
Geranylgeranyl二磷酸合酶
- gg:
-
L-glutamate gamma-semialdehyde
- 走:
-
基因本体论
- GPP:
-
二磷酸香叶酯
- 全球定位系统(GPS):
-
香叶基焦磷酸合成酶
- g:
-
谷氨酸合酶
- GSEABase:
-
基因集富集分析基础
- GST:
-
谷胱甘肽S-transferase
- HB:
-
偻
- HDIK:
-
ENT-2-alpha-hydroxyisokaureene
- HDS:
-
4-hydroxy-3-methylbut-2-enyl二磷酸合酶
- HMBPP:
-
4-羟基-3-甲基丁基-2-烯基二磷酸二磷酸
- β-:
-
Hydroxymethylglutaryl-Coenzyme一
- HMGR:
-
Hydroxymethylglutaryl——辅酶a还原酶
- HST:
-
Shikimate O-hydroxycinnamoyltransferase
- 国际宇航科学院:
-
Indole-3-acetic酸
- 伊迪:
-
IPP异构酶
- IPP:
-
Isopentenyl焦磷酸
- JA:
-
茉莉酸
- JAZ:
-
茉莉酮酸酯ZIM含有结构域的蛋白
- KEGG:
-
京都基因和基因组百科全书
- KH:
-
Ent-isokaurene C2-hydroxylase
- ks:
-
kaurene合成酶
- LASPO:
-
l-aspartate氧化酶
- MCT:
-
4-二磷苷酰基-2- C-甲基-D-赤藓糖醇激酶
- MEcPP:
-
2-C-甲基-D-赤藓糖醇2,4-环二磷酸酯
- MEP:
-
Methylerythritol磷酸
- MEP:
-
Methylerythritol磷酸
- 答:
-
甲基jasmonate
- MVA:
-
Mevalonicacid
- 南京:
-
NAM、ATAF1-2和CUC2的缩写
- nced:
-
9-CIS-环氧丙酮蛋白二氧化酶
- 非:
-
9“-cis-Neoxanthin
- ODC:
-
鸟氨酸脱羧酶
- P5CS:
-
Delta-1-pyrroline-5-carboxylate合成酶
- 朋友:
-
苯丙氨酸氨 - 裂解酶
- PAO:
-
多胺氧化酶
- PDT:
-
Prephenate脱水酶
- PFK:
-
6-phosphofructokinase 1
- PFPA:
-
Pyrophosphate-fructose-6-phosphate 1-phosphotransferase
- PlnTFDB:
-
植物转录因子数据库
- PMD:
-
15-diene Pimara-8 (14)
- 采购经理人指数:
-
Mannose-6-phosphate异构酶
- PP:
-
磷酸酶
- 插件可以:
-
过氧化物酶
- PS:
-
八氢番茄红素合成酶
- PSY:
-
八氢番茄红素合成酶
- qPCR:
-
定量实时聚合酶链反应
- RFS:
-
棉子糖合成酶
- RNA-Seq:
-
RNA-sequencing
- RPKM:
-
读取每千碱基的外显子模型,每百万映射读取
- 山:
-
水杨酸
- SK:
-
莽草酸激酶
- 干:
-
短时间序列表达式矿工
- SUS:
-
蔗糖合酶
- TFs:
-
转录因子
- TGA:
-
TGACGTCA独联体元件结合蛋白
- TPS:
-
海藻糖6-磷酸合酶
- TREH:
-
α,alpha-trehalase
- UHPLC-MS:
-
超高效液相色谱-串联质谱
- 冯:
-
9-顺式 - 紫黄质
- 齐柏林飞艇:
-
Zeaxanthin环氧酶
参考文献
- 1。
李永华,李永华,李永华,李永华。植物与多种昆虫的相互作用:从群落到基因。植物学报。2014;65(1):689-713。
- 2。
Ray S, Gaffor I, Acevedo FE, Helms A, Chuang W, Tooker J, Felton GW, Luthe DS。玉米植物从毛虫草中识别出与草食相关的线索。acta Chem Ecol. 2015;41(9): 781-92。
- 3.
Howe Ga,Jander G.植物免疫食草动物。Annu Rev植物Biol。2008; 59:41-66。
- 4.
迪克男,鲍德温IT。对于虫害诱导植物挥发物演化背景:超越“的呼救声”。趋势植物SCI。2010; 15(3):167-75。
- 5.
黄旭,陈杰,肖华,肖勇,吴杰,吴杰,周俊,张颖,郭勇陆地棉对棉铃虫的反应Helicoverpa Armigera.Sci众议员2015;5:11867。
- 6.
通过转录组分析揭示了棉花对韧皮部取食昆虫侵害的综合抗性反应机制烟(粉虱)。植物Biotechnol J..2016年DOI:10.1111 / pbi.12554
- 7.
zin V, Fernandez-Pozo N, Richter A, Schmelz EA, Schoettner M, Schafer M, Ahern KR, Meihls LN, Kaur H, Huffaker A, et al.;玉米对蚜虫摄食的动态反应是通过时间序列的转录组学和代谢组学分析揭示的。植物杂志。2015;169(3):1727 - 43。
- 8.
周刚,王雪峰,王雪峰,李瑞,程建军,娄艳艳。水稻对条纹螟虫侵染的全基因组转录变化和防御相关化学分析卡勒suppressalis.杂志。2011;143(1):意向。
- 9.
齐军,孙刚,王丽,赵超,Hettenhausen C, Schuman MC, Baldwin IT,李军,宋建军,刘铮,等。口腔分泌物Mythimna separata昆虫特异性诱导防御反应在玉米高维生物数据所揭示。植物细胞环境。2016; 39(8):1749至1766年。
- 10。
Barah P, Bones AM。从生态学到组学和合成生物学的多维植物防御研究。J Exp Bot. 2015;66(2): 479-93。
- 11.
周松,娄玉玲,靳V,詹德。植物初级代谢对昆虫食草性的响应。植物杂志。2015;169(3):1488 - 98。
- 12.
Ehlting J, chowrra SG, Mattheus N, Aeschliman DS, Arimura G, Bohlmann J.比较转录组分析拟南芥蒂利亚纳钻石背蛾出没(小菜蛾)幼虫表现出应激反应、次级代谢和信号传导的特征。BMC基因组学。2008;9:154。
- 13。
库什GS。将采取什么在2030年植物分子生物学养活5.0十亿大米的消费者。2005; 59(1):1-6。
- 14.
娄y,张克,张某,胡y,张继。中国水稻害虫的生物控制。BIOL控制。2013; 67(1):8-20。
- 15.
陈敏,本德JS,香KL,叶光。BT.大米在亚洲:潜在的好处,影响和可持续性。在:RomeisĴ,谢尔顿上午,肯尼迪GG,编辑。昆虫抗性的集成IPM方案中遗传修饰的作物。多德雷赫特:Springer科学与商业媒体B.V;2008. p。223-48。
- 16.
刘勇,吴华,陈辉,刘勇,何军,康辉,孙震,潘刚,王强,胡建军,等。一个编码凝集素受体激酶的基因簇在水稻中具有广谱和持久的抗虫性。生物科技Nat》。2015;33(3):301 - 5。
- 17.
王Y,郭H,李华,张H,与通过微阵列表达谱水稻抗褐飞虱转录因子潜在的苗X.鉴定。BMC基因组学。2012; 13:687。
- 18.
王颖,李慧,司勇,张辉,郭辉,苗晓霞。籼稻品种抗稻瘟病的基因芯片分析。足底。2012;235(4):829 - 40。
- 19.
杨L,张W.植物耐水稻耐水稻遗传和生化机制。植物细胞代表2016; 35(8):1559-72。
- 20.
华H,Lu Q,Cai M,Xu C,周D,Li X,张Q.条纹茎沟诱导的水稻基因分析(卡勒suppressalis)攻击鉴定出一个启动子片段对昆虫摄食高度敏感。植物学报。2007;65(4):519-30。
- 21.
孙颖,张勇,曹刚,顾胜,吴科,高旭,郭勇。水稻1 ~ 2龄螟虫幼虫取食对水稻基因表达的影响。昆虫科学。2011;18(3):273 - 81。
- 22.
韩,李士,刘p,彭y,侯m。新的人工饮食连续饲养卡勒suppressalis(鳞翅目:Crambidae)。Ann Entomol Soc Am。2012; 105(2):253-8。
- 23.
刘志强,李旭,张健,蔡勇,程涛,程超,王勇,张超,聂勇,陈智,等。过度表达MeCP2的转基因猴子的自闭症行为和种系传播。自然。2016;530(7588):98 - 102。
- 24.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相对基因表达数据。方法。2001;25 (4):402 - 8。
- 25.
Jain M, Nijhawan A, Tyagi AK, Khurana JP。利用实时荧光定量PCR技术研究水稻基因表达的内控基因验证。生物化学学报。2006;45(2):646-51。
- 26.
刘志强,刘志强,刘志强,等。改进的奥雅萨苜蓿Nipponbare参考基因组使用下一代序列和光学地图数据。大米。2013;6(1):4。
- 27.
Wang K, Singh D, Zeng Z, Coleman SJ, Huang Y, Savich GL, He X, Mieczkowski P, Grimm SA, Perou CM, et al.;MapSplice:精确mapping RNA-seq reads for splice junction discovery。核酸学报2010;38(18):e178。
- 28.
王磊,冯志强,王昕,张晓霞。基于RNA-seq数据的差异表达基因鉴定。生物信息学,2010,26(1):136 - 8。
- 29.
基于RNA-Seq的哺乳动物转录组的定位和定量研究。Nat冰毒。2008;5(7):621 - 8。
- 30.
Benjamini Y,Hochberg Y.控制虚假的发现率:多种测试的实用和强大的方法。J R统计SOC系列B STAT方法。1995年; 57:289-300。
- 31。
Usadel B, Nagel A, Steinhauser D, Gibon Y, Blasing OE, Redestig H, Sreenivasulu N, Krall L, Hannah MA, Poree F,等。PageMan:一个交互式的本体工具,用于生成、显示和注释概要图,用于分析实验。BMC生物信息学。2006;7:535。
- 32。
Oliveros JC。VENNY。用于与维恩图表比较列表的交互式工具。2007。
- 33。
Ernst J,Bar-Joseph Z. Stem:用于分析短时间序列基因表达数据的工具。BMC生物信息学。2006; 7(1):191。
- 34。
激素测量仪:一种用于识别激素作用的转录标记的工具拟南芥转录组。植物杂志。2009;150(4):1796 - 805。
- 35。
Reimand J, Arak T, Vilo J. g:Profiler——基因列表功能解释的web服务器(2011年更新)。核酸Res. 2011;39(Web Server issue): W307-15。
- 36。
DeHaven CD, Evans AM, Dai H, Lawton KA。将GC/MS和LC/MS代谢组学数据组织到化学库中。J Cheminform。2010;2:9-9。
- 37。
Kucharzewska P,克里斯蒂安HC,皮带M.全球仿形代谢适应对缺氧应激在人成胶质细胞瘤细胞。公共科学图书馆·之一。2015; 10(1):e0116740。
- 38.
Pérez-Rodríguez P, Riaño-Pachón DM, Corrêa LGG, Rensing SA, Kersten B, Mueller-Roeber B. PlnTFDB:植物转录因子数据库的更新内容和新特征。核酸Res. 2010;38(数据库版):D822-7。
- 39.
植物芳香族氨基酸合成途径的新认识。摩尔。2010;3(6):956 - 72。
- 40.
引用本文:王志刚,王志刚,王志刚,王志刚,王志刚。转录反应的研究进展[J]拟南芥蒂利亚纳咀嚼和吮吸昆虫食草动物。植物科学学报2014;5:565。
- 41.
artio S, Ribeiro-Alves M, Oliveira-Neto OB, de Macedo LL, Silveira S, Grossi-de-Sa MF, Martinelli AP, Alves-Ferreira M.转录组分析陆地棉花蕾受棉铃象甲侵害(Anthonomus茅)幼虫。BMC基因组学。2014;15:854。
- 42.
王飞,宁东,陈永华,党昌,韩宁,刘永华,叶国光。水稻对褐飞虱侵害的响应。植物科学学报2015;6:1181。
- 43.
王Y,王X,陈元H, R,朱L R, g .反应的两种截然不同的基因型水稻褐飞虱。植物生态学报。2007;21(1):122-32。
- 44.
Dubey NK, Goel R, Ranjan A, Idris A, Singh SK, Bag SK, Chandrashekar K, Pandey KD, Singh PK, Sawant SV。比较转录组分析陆地棉对吸汁昆虫的反应:蚜虫和粉虱。BMC基因组学。2013;14:241。
- 45.
Giri MK, Swain S, Gautam JK, Singh S, Singh N, Bhattacharjee L, Nandi AK。的拟南芥At4g13040基因是AP2/EREBP家族的一个独特成员,是水杨酸积累和抵抗细菌病原体的基础防御的正调控因子。植物生理学报。2014;171(10):860-7。
- 46.
胡L,YE M,Li R,张T,周G,王Q,Lu J,Lou Y.通过用作丝裂原激活蛋白激酶活性的负反馈调节剂来抑制食草诱导的防御。植物理性。2015; 169(4):2907-21。
- 47.
李瑞敏,张建军,李军,周刚,王强,卞伟,Erb M, Lou Y.通过WRKY调控植物防御优先于生长有利于非目标食草动物的侵害。eLife。2015; 4: e04805。
- 48.
Wu J, Baldwin IT。植物对昆虫食草动物攻击反应的新见解。acta photonica sinica, 2010;44(1):1 - 24。
- 49.
Lu J, Robert CA, Riemann M, Cosme M, Mene-Saffrane L, Massana J, Stout MJ, Lou Y, Gershenzon J, Erb M.诱导茉莉酸盐信号对植物根系损伤和植食性能的影响。植物杂志。2015;167(3):1100 - 16。
- 50.
娄阳,杜敏,杜林,程军,单伟。外源茉莉酸对水稻挥发性排放的影响摘要研究选择性虫卵由寄生蜂寄生anagrus nilaparvatae..化学学报。2005;31(9):1985-2002。
- 51.
De Vleesschauwer D,Xu J,HöfteM.致力于激素介导的国防网络:从米饭到拟南芥.植物科学学报2014;5:611。
- 52.
De Vos M, Van Oosten VR, Van Poecke RM, Van Pelt JA, Pozo MJ, Mueller MJ, Buchala AJ, Metraux JP, Van Loon LC, Dicke M等。信号特征和转录组变化拟南芥在病原体和昆虫攻击时。植物营养与肥料学报。2005;18(9):923-37。
- 53。
Schwachtje J, Baldwin IT。为什么食草动物的攻击会改变初级代谢?植物杂志。2008;146(3):845 - 51。
- 54。
刘超,郝芳,胡军,张伟,万丽,朱丽,唐华,贺国华。水稻对褐飞虱侵害的不同系统响应。中国生物医学工程学报。2010;9(12):689 - 693。
- 55。
肖尔茨SS,艾香德男,Mekonnen DW,LUDEWIG楼Mithofer A.昆虫植物中取食,引起GABA积累是一个的伤口诱导的,直接的,系统性的,和茉莉无关的防御反应。前植物SCI。2015; 6:1128。
- 56。
黄志强,王志强,王志强,等。棉花对节肢动物的抗性机制及其与天敌的相互作用。植物学报,2013;32(6):458-82。
- 57。
刘Q,RomeisĴ,俞H,张颖,李Y,彭Y.BT.水稻不会干扰寄生蜂寻找寄主的行为Cotesia chilonis.SCI代表2015年; 5:15295。
- 58。
D.萜类化合物在植物中的生物合成和生物学功能。Adv .生物化学工程,2015;148:63-106。
- 59。
Matsye PD,库马尔R,胡赛尼P,琼斯CM,特伦布莱A,Alkharouf NW,马修斯BF,克林克VP。映射期间大豆防御反应发生的细胞命运决定。植物mol biol。2011; 77:513-28。
- 60.
Matsye PD, Lawrence GW, Youssef RM, Kim K-H, Matthews BF, Lawrence KS, Klink副总裁。自然发生的α-SNAP基因的截短等位基因的表达抑制植物寄生线虫感染。植物学报。2012;80:131-55。
- 61.
Matthews Bf,Beard H,Macdonald MH,Kabir S,Youssef RM,Hosseini P,Brewer E.通过在大豆中100种基因的功能性代谢研究到其主要病原体,大豆囊肿线虫的功能代谢研究。Planta。2013; 237:1337-57。
致谢
我们感谢彭伟侯和戴陈从新的Bioinformatics有限公司,有限公司在生物信息学分析中为其技术援助。
资金
这项工作得到了中国天然科学基金的支持(授予第31272041)。
数据和材料的可用性
支持这篇文章的结果数据集包括在项目和其他文件中。
作者的贡献
YL、QL和XW设计了本研究。QL和XW完成了所有的实验。QL, XW, VT, JR, YP, YL分析数据并撰写稿件。YP和YL提供实验材料。所有作者都已阅读并批准该手稿出版。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
同意出版
不适用。
伦理批准和同意参与
本研究使用的水稻种子由华中农业大学林永军教授(中国武汉)提供。由于植物材料不是从野生来源收集的,不需要任何许可/许可。幼虫的c . suppressalis在本研究中使用的昆虫是从我们自己的实验室玩具中维护的实验室菌落中获得的,迄今为止没有任何关于饲养昆虫的指南,因为它们是稻田中常见的害虫。
作者信息
从属关系
通讯作者
附加文件
附加文件1:表S1。
基因和引物对用于实时定量PCR。(XLS 34 kb)
附加文件2:表S2。
RNA测序和使用水稻基因组的测绘概述(奥雅萨苜蓿)作为参考。(XLS 29 kb)
附加文件3:表S3。
基因结构概述。(XLS 31 kb)
附加文件4:表S4。
所有样本中检测到的基因。(XLS 14574 kb)
附加文件5:表S5。
所有两组之间的差异表达基因。(XLS 1102 kb)
附加文件6:表S6。
五类差异表达基因。(XLS 342 kb)
附加文件:7
比较喂养过的水稻植株的代谢变化卡勒suppressalis幼虫不同的持续时间。(a)中24小时比0小时。(b)中48小时比0小时。(C)72小时比0小时。颜色强度表示在对数刻度的表达比(红色:上调,蓝色:下调)。(TIF 1806 KB)
附加文件8:表S7。
与所述分组相关联的DEGS显著(FDR <0.01)的GO术语(生物学过程)。(XLS 54 KB)
附加文件9:表S8。
直向同源拟南芥以及用于激素分析的水稻基因。(XLS 2918 kb)
附加文件10:表S9。
的列表卡勒suppressalis响应性转录因子(TFs)。(XLS 61 kb)
附加文件11:表S10。
代谢的二化螟受损水稻植物(感染后0,48,72和96小时)。(XLS 103 KB)
附加文件12:图S2。
4个时间点151种大米代谢物的功能分类(TIF 377 kb)
附加文件13:表S11。
基于KEGG通路图,RNA-seq衍生的基因参与代谢。(XLS 33 kb)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
刘强,王旭东,靳V。et al。结合转录组和代谢组分析来了解水稻植株对螟虫攻击的动态响应卡勒suppressalis(鳞翅目:Crambidae)。BMC植物杂志16日,259(2016)。https://doi.org/10.1186/s12870-016-0946-6
已收到:
公认:
发表:
关键字
- 奥雅萨苜蓿
- 引起的反应
- 新一代测序
- 同种
- 激素
- 苯丙醇丙烷
- 碳水化合物
- 氨基酸
- Terpenoids.