摘要
背景
NAC转录因子家族是植物中最大的转录因子基因家族之一,针叶树的NAC基因家族至少和针叶树的NAC基因家族一样大,或者可能更大拟南芥.这些转录因子控制植物的发育和胁迫诱导过程。然而,针叶树的NACs控制胁迫诱导过程受到的关注相对较少。本研究研究了参与对病原体反应的NAC家族转录因子Heterobasidion annosum(Fr) Bref。理智lato。
结果
NAC蛋白的系统发育和结构域结构可用于组织功能特异性,在III-3中发现了几种具有较好的胁迫相关的NAC蛋白拟南芥詹森等。生物化学学报,2010)。挪威云杉基因组包含7个与亚群III-3 NACs相似的基因。基于表达式模式PaNAC03被选中进行详细分析。挪威云杉线条过度表达PaNAC03在增殖培养中鉴定出响应成熟起始的异常胚胎发育和482个调控错误的基因。类黄酮生物合成途径中的三个关键基因:aCHS,一个F3'H而且PaLAR3是否在过表达系中持续下调.相应地,过表达系显示特异性类黄酮水平降低,这表明PaNAC03作为该途径的抑制因子,可能通过直接与被抑制基因的启动子相互作用。然而,转活化研究巴勒斯坦权力机构NAC03和PaLAR3在烟草benthamiana显示,巴勒斯坦权力机构NAC03激活PaLAR3A,这表明PaNAC03并不是通过与目标类黄酮生物合成基因直接相互作用而作为黄烷-3-醇生产的独立负调控因子。
结论
PaNAC03及其直系同源分子与具有良好胁迫相关特征的被子植物NAC基因形成姐妹群PaNAC03对生物应激反应,似乎在控制防御相关的次生代谢产物的生产。
背景
在植物中,NAC[用于NAM(无顶端分生组织),一个TAF(拟南芥转录激活因素),CUC (cup-shaped cotyledon,杯形子叶)转录因子家族是植物中最大的转录因子基因家族之一。据估计,该基因家族有117个成员拟南芥水稻和杨树分别为144和161。1,2].在针叶树中NAC基因家族似乎至少和在针叶树中一样大拟南芥甚至可能会扩大[3.].北半球的针叶林以针叶树为主,其中许多针叶树具有重要的经济和生态意义。然而,对于针叶树和其他裸子植物如何感知和应对非生物和生物压力,人们所知相对较少。关于诱导防御反应及其调节途径的一般知识主要来自被子植物模型植物的研究,在某些情况下可以推断裸子植物系统[4- - - - - -9],尽管它们在进化上存在差异[10].最近的一项研究表明,挪威云杉类黄酮的积累和类黄酮途径中的基因诱导模式与根腐病真菌的抗性水平相关Heterobasidion annosum(Fr) Bref。感官(以下简称为h . annosums.l。)9].h . annosumS.l.是五个近亲物种的复合体[11,12]它们的宿主范围部分重叠。这些结果表明抗性和敏感基因型之间的防御反应有差异控制。
NAC tf首次在正向遗传筛选中被确定为发育过程的关键调控因子[13- - - - - -16].NAC蛋白已被证明在被子植物和裸子植物中调节中枢发育过程,如胚胎模式和血管模式[15- - - - - -18].然而,NAC蛋白也是植物防御中最重要的差异调控tf之一[19- - - - - -21].NAC tf通常在n端具有保守的dna结合NAC结构域,其中包括近160个氨基酸,这些氨基酸被分为5个亚结构域(a - e) [22].NAC蛋白的c端区域高度发散[13,22]并赋予转录激活的调节特异性[1].根据NAC蛋白的系统发育和结构域的结构,可以构建和组织保守的NAC结构域和发散的c末端的功能特异性。1,17,22].NAC亚群,如拟南芥中的III-3亚群,包含胁迫相关的NAC蛋白,ANAC019, ANAC055, ANAC072, ATAF1和ATAF2,具有共同的独特的c端基序,由带负电荷的矩阵主导,带有少量保守的笨重的疏水氨基酸残基,形成转活化域[1].拟南芥NAC基因对胁迫激素的共同表达[20.,21,23],其中一些成员是植物对非生物[19,20.,23]和生物[20.,24,25)压力。过度表达该亚群成员(ATAF1, ATAF2, ANAC019或ANAC055)的转基因植物对坏死性病原体的易感性增加葡萄孢菌或尖孢镰刀菌[20.,21,24,25当anac019 anac055双突变[21]或ATAF1抑制因子结构的表达[24导致增强抵抗力灰质。综上所述,这表明亚群III-3 NAC转录因子可能是生物和非生物胁迫之间重要的转录整合因子。在近期云杉对生物胁迫响应的转录组研究中,一些差异调控的转录因子与拟南芥III-3亚群的NAC转录因子相似[9,26]表明特征良好的拟南芥NACs的云杉直系同源不仅在植物发育中控制云杉和拟南芥的相似程序[17,18以及植物对压力的反应。
本研究的目的是:I)分析的分类和应激诱导表达模式h . annosumsll诱导的挪威云杉NAC tf;II)研究的下游靶基因PaNAC03挪威的云杉;III)调查是否巴勒斯坦权力机构NAC03具有调控启动子的能力PaLAR3,下游调控模块中的一个基因。为了解决第一个目标,我们查询了序列数据库来识别同源序列,确定了同源序列的模块结构和系统发育位置h . annosumsll诱导的挪威云杉NACs。我们还确定了的表达模式h . annosumsll诱导的NAC tf对不同应激源的反应。目的:研究PaNAC03挪威云杉细胞系过度表达PaNAC03并将其转录组与野生型挪威云杉细胞系进行比较,以识别调控不当的基因。为了达到我们最后的目的,我们分离了的启动子PaLAR3并将其与GUS报告基因融合,并进行了转激活研究巴勒斯坦权力机构NAC03和PaLAR3在烟草benthamiana.
方法
序列搜索和系统发育
六种与被子植物NAC转录因子相似的假定唯一转录本(PUT)(表1)在之前的RNAseq实验中发现的[9,26]用于查询挪威云杉基因组门户(http://congenie.org/)使用Blastn [27]及TAIR (https://www.arabidopsis.org/)和Genbank使用Blastx。下载了显著的命中,并进行了核苷酸和氨基酸序列比对云杉序列从Genbank和p .冷杉属1.0 [3.].为了对已鉴定的挪威云杉NAC基因进行系统发育分析,从挪威云杉基因组门户下载了挪威云杉基因模型,从TAIR下载了拟南芥NAC亚群III-1、III-2和III-3氨基酸序列。序列被修剪到保守的n端区域,并与MEGA 5.0中的Clustal W算法对齐[28].在同一程序中使用Neighbor-joining算法创建了系统进化树,该算法具有1000个bootstrap值,p-distance估计作为统计模型,均匀替代率和基于截断值为95%的部分序列的估计。
我们检查了预测的挪威云杉NAC蛋白III-3亚群序列是否存在一个保守的n端[22]和c端结构域[1].EMBOSS法测定了预测蛋白的电荷和疏水性Pepinfo软件(29],利用Kyte & Doolittles疏水性指数(窗口为11种氨基酸)绘制了预测氨基酸序列的疏水性。对鉴定的挪威云杉NAC蛋白全长区和c端区序列进行了同源性分析鉴别而且sim卡序列操作套件的功能[30.].
基因表达模式的测定
生物和非生物压力
8种独立挪威云杉基因型的30年树龄树木,属于瑞典克隆林业计划的一部分,生长在瑞典Årdala(北纬59°01′,东经16°49′)[31接种h . annosums.l. Danielsson等人详细描述了接种和取样程序。[9]:简单地说,在实验中,每个基因型使用三个分株,每个分株使用两个根。在一根上,一个木塞被h . annosums.s. (Sä 16-4) [32]用parfilm贴在根表面的人工伤口上;另一根只受伤,用保鲜膜封住。韧皮部样品(约90毫米)2分别在实验开始(接种后0天)、接种后5天和15天(dpi)收获,保存在RNAlater (Ambion)中,用于后续RNA提取。
总RNA根据Chang等分离。[33].使用MessageAmpIII (Ambion)纯化并扩增Poly (A) + RNA。用iScript™cDNA合成试剂盒(Bio-Rad)反转录各基因型纯化的扩增RNA (aRNA, 1 μg)。cDNA合成物在去离子水中1:1稀释。每个基因型被用作独立的生物复制。
植物应激激素治疗
分析候选基因对应激激素的反应,并将其与对应激激素的反应进行比较h . annosums.l,两周大的挪威云杉幼苗(Rörby FP-65, 09 L022-1001)在无菌条件下转移到带滤纸的培养皿(每盘5株),并用施肥液体介质湿润[34]并经过均质处理Heterobasidion parviporum(Rb175)。对于Arnerup等人先前描述的茉莉酸甲酯(MeJA)或水杨酸甲酯(MeSA)处理。[7].每项治疗均重复三次。72 h后,幼苗立即在液氮中冷冻,并在−80°C保存,直到进一步使用。总RNA根据Chang等分离。[33]经DNAse I处理后,用iScript™cDNA合成试剂盒(Bio-Rad)反转录1 μg总RNA。
体细胞胚胎成熟处理
分析样品PaNAC03在胚胎发育期间的表达水平,是来自博士的慷慨礼物。Irena Molina和Malin Abrahamsson。简单地说,从五个连续的发展阶段收集样本(基于Zhu等人的分类。35]): +PGR(增殖培养+植物生长调节剂(PGR)继代5天后),-PGR(增殖培养-PGR继代5天后),EE(早期胚胎在成熟培养基上一周后分化);LE1和LE2(晚期早期胚胎分别在成熟培养基上2周和3周后发育)。每个阶段收集三个独立的样品,并在液氮中冷冻,在−80°C保存,直到提取。DNAse I处理后,用Spectrum Plant Total RNA试剂盒(Sigma Aldrich)提取总RNA,用Quanta cDNA合成试剂盒(Quanta Biosciences)反转录1 μg总RNA。
定量反转录PCR (qPCR)
为了分析基因表达水平,使用SSoFast EVAGreen Supermix (Bio-Rad),每20 μL PCR反应使用相当于25 ng RNA的cDNA,每个引物的最终浓度为0.5 μM。引物使用Primer3软件设计(http://primer3.wi.mit.edu/),熔点温度(Tm)在58℃~ 60℃之间,扩增子长度在95 ~ 183 bp(附加文件)1).在iQ™5多色实时PCR检测系统(Bio-Rad)上运行的热循环条件参数如下:95°C 30 s;95°C持续5秒,58或60°C持续20秒。每次试验后进行熔体曲线分析,以验证反应的特异性。每次实验均采用线性质粒标准曲线来衡量PCR效率,效率低于95%的引物对将被丢弃。每个样品制备两个技术重复。
相对表达式计算使用2ΔΔCT-method [36,37],转录丰度归一化至内参基因phosphoglucomutase[38],真核翻译起始因子4A(elF4A) [39),延伸因子1-α(ELF1α) [5].每个实验分别使用Bestkeeper工具评估内参基因表达的稳定性[40].使用GraphPad Prism5软件(GraphPad Inc.)进行Kruskal-Wallis- u -和Mann-Whitney u -test测试各处理之间的差异表达。
挪威云杉的改造
的全长cDNA序列PaNAC03用特异性引物PaNAC03FL扩增得到(附加文件1),是根据基因的全长或部分序列的比较而设计的P. abies, P. glauca而且p . sitchensis同源体,来自挪威云杉树皮的cDNA池接种h . annosum对于PCR反应,我们使用Dream-Taq聚合酶(Fermentas)。通过Dream-Taq聚合酶PCR将AttB1和attB2适配器添加到1148 bp的产物中。PCR产物重组到pDONR/Zeo (Thermofisher)载体,LR重组到pMDC32载体[41].所得到的载体通过试验消解和测序进行验证。
组成型表达的细胞系PaNAC03是由农杆菌属挪威云杉体细胞胚胎发生细胞系95:61:21的介导转化,如Minina等所述[42].简言之,pMDC32:: PaNAC03和pMDC32:: GUS [42被改造成根癌土壤杆菌C58C1菌株加上毒力质粒pTOK47。将转化后的细菌经适当选择培养过夜,离心收集,重悬于浸润缓冲液(10 mM MgCl2、10 mM MES、pH 5.5和150 μM乙酰丁香酮)中至OD60010。7天挪威云杉悬浮液培养农杆菌属以5:1的比例混合,加入乙丁香酮至终浓度150 μM。共培养4 h后,将细胞镀于滤纸上,滤纸上放置有PGR的固化增殖培养基[43],在室温黑暗中培养48 h。然后将过滤器转移到含有400 μg ml PGR的固化增殖培养基上−1Timentin, 250 μg ml−1头孢噻肟在相同条件下孵育5天。随后将滤纸转移到含有20 μg ml PGR的新鲜固化增殖培养基上−1湿霉素,400 μg ml−1Timentin, 250 μg ml−1每周将头孢噻肟传代到新鲜培养基上。1个月后从培养皿中取出转基因愈伤组织,转移到含20 μg ml PGR的固化增殖培养基中−1湿霉素,400 μg ml−1Timentin, 250 μg ml−1头孢噻肟。在添加PGR和20 μg ml的增殖培养基上培养转基因植株−1潮霉素。
选择9个转基因株系进行DNA和RNA提取,分别验证插入量和表达量。为了验证DNA的转化,将直径为3 ~ 5mm的愈伤组织置于Eppendorf管中,用20 μl 0.5 M氢氧化钠在95℃下均质煮沸,快速离心,取5 μl上清液用495 μl 10 mm Tris-HCl pH 8稀释。使用DreamTaq (Thermo Scientific)和Hyg引物进行25 μl PCR反应,稀释5 μl1).
采用改进的CTAB提取方案提取总RNA [33].经DNase I处理(Sigma-Aldrich)后,用iScript cDNA合成试剂盒(BioRad)从1 μg总RNA合成cDNA。表达水平PaNAC03采用iQ5多色实时荧光定量PCR检测系统(BioRad)和SsoFast EvaGreen Supermix (BioRad)进行qRT-PCR检测,选取表达水平为WT细胞株1.7倍的两个独立细胞株(4.1和4.2)进行成熟启动、RNA测序和化学分析。在过表达系和对照系中,体细胞胚胎成熟的启动是根据Filonova等人描述的方案进行的。[44],将每一株预称重的愈伤组织片在半强度LP培养基上放置一周,然后将外植体转移到成熟培养基上,在成熟培养基上放置4周和6周后,对成熟反应进行评分,胚胎类似LE2、ME1和ME2阶段[35被注意到。
PaNAC03过表达系的转录组分析
RNA提取和Illumina测序
选择两个过表达(OE)株系4.1和4.2,以及WT株系(95:61:21),在含有PGR的固化增殖培养基上,在室温下黑暗中培养6天左右。取直径7mm的大愈伤组织,冷冻于液氮中。样品在液氮砂浆中研磨,使用RNeasy Plant Mini Kit (Qiagen)使用RLT缓冲液并按照制造商的说明提取,然后用DNase I (Sigma-Aldrich)处理样品。每系3个生物重复用于Illumina测序。RNA完整性使用Agilent RNA 6000 Nano试剂盒(Agilent Technologies Inc.)进行分析。测序文库在SNP&SEQ技术平台(sciilifelab, Uppsala)使用TruSeq链mRNA样本制备试剂盒,按照TruSeq链mRNA样本制备手册进行制备。测序使用HiSeq 2500,配对端段长度为125 bp,化学序列为v4。
滤波,映射和微分表达式
使用nesoni剪辑过滤原始序列的读对Nesoni0.128 (http://www.vicbioinformatics.com/nesoni-cookbook/index.html#)(参见附加文件2对于使用的脚本)。为了能够对参考数据库进行比对,我们从挪威云杉基因组门户网站下载的“Trinity无污染”数据集(http://congenie.org/)使用Bowtie22.2.4版本(http://bowtie-bio.sourceforge.net/bowtie2/index.shtml).剪切的读对对齐到Trinity使用大礼帽2.0.13版本[45].的结果对齐文件大礼帽提供给袖扣版本2.2.1为每个示例生成一个程序集。然后使用cuffmerge(包括在袖扣包装)。然后我们通过运行应用更新的工作流cuffquant(http://cole-trapnell-lab.github.io/cufflinks/manual/),计算从单个程序集文件和由大礼帽分别为每个样本运行。进行差异表达分析cuffdiff[45,46].
挪威云杉过表达系的化学分析
挪威云杉OE线(4.1和4.2)过表达PaNAC03基因和95:61:21野生型细胞系在无PGR的液体增殖培养基中培养2周。然后,收集细胞并在液氮中快速冷冻,然后对样品进行冷冻干燥。冷冻干燥的样品用球磨机研磨。一旦粉碎,就记录样品重量。利用Hammerbacher等人描述的方法评估特化代谢物含量。[47].
p的转活化巴勒斯坦权力机构LAR3由巴勒斯坦权力机构NAC03
PaNAC03激活PaLAR3
的PaLAR3启动子有两种等位基因,PaLAR3A而且PaLAR3B.使用pPaLAR3A和pPaLAR3B引物组从基因组DNA中扩增(附加文件)1和附加文件3.).扩增后,使用克隆jet PCR克隆试剂盒(Thermo scientific)将其克隆到pJET1.2质粒中。从该质粒出发,用pPaLAR3A_2和pPaLAR3B_2引物进行PCR扩增1).这两个PCR产物随后被克隆到目的质粒pCF201中,目的质粒pCF201是由用于农杆菌属变换(48重叠扩增PCR。为了做到这一点,目的质粒被扩增成两个单独的PCR产物。第一个PCR片段使用引物TetA2正向和PUV5反向,第二个PCR片段使用GUS正向和TetA2反向(附加文件)1).所有PCR产物片段均按照制造商的规程使用GeneJet PCR纯化试剂盒(Thermo Scientific)进行纯化。启动子片段分别与这些目的片段结合,采用(Bryksin and Matsumura 2010)的方法和适应PCR方案进行三片段重叠扩展PCR扩增:98°C初始变性2分钟,随后98°C变性15秒,60°C退火2分钟,72°C伸长5分钟,然后98°C变性15秒,60°C退火30秒,72°C伸长5分钟,72°C最终伸长10分钟3.)在PaLAR3A双片段重叠扩增PCR扩增启动子。将Mut_XbaI_F或Mut_KpnI_F与TETA2_reverse引物组合得到第一个片段,将Mut_XbaI_R或Mut_KpnI_R与TetA2 forward组合得到第二个片段。将两个相应的片段结合在OEPCR中,并按照上述相同的PCR条件进行PCR。使用Mut_XbaI_KpnI引物与相应的TETA2引物进行双突变,重复同样的方法。
新形成的质粒用DpnI限制性内切酶[49].限制性混合物在37℃下孵育15 min,在80℃下灭活5 minDpnI经处理的OE-PCR产物转化为化学成分大肠杆菌细胞(One Shot®TOP10 Competent cells, Invitrogen),在37°C下孵育至少3小时。用筛选引物进行菌落PCR筛选(附加文件)1).在添加四环素(5 μg ml)的琼脂板上选择阳性克隆−1),质粒用GeneJet Plamid Miniprep Kit (Thermo Scientific)分离。的变换根癌土壤杆菌(具有辅助质粒pCH32的菌株C58C1-RS)采用所述的热融法进行[50].用四环素(5 μg ml)接种琼脂板−1)、卡那霉素(5 μg ml−1)和利福平(50 μl ml−1),采用与实验相同的引物,采用集落PCR法选择转化子大肠杆菌.
转活化实验是(Leborgne-Castel et al. 1999)中描述的实验的改编版本。4到6周烟草bethaminiana植物在23°C的16小时光周期下生长。浸润发生如(Voinnet et al. 2003)所述。以下1:1混合农制备了不同的效应器和报告结构。72 h后取叶片,测定GUS表达和总蛋白含量。在Wilson等人的一份方案中描述了GUS比色法。[51],在250 μl GUS测定缓冲液和6 mM 4-硝基苯β- d -葡萄糖苷(PNPG) GUS测定缓冲液中加入20 μl清除后的提取物。该反应在铝箔中孵育了一夜。OD405海里用荧光星Optima型微板阅读器测量。GUS活性以mol PNP / min和克蛋白为单位测定。蛋白浓度由Bio-Rad蛋白测定法测定[52].进行学生t检验,根据每次测量的6-12个生物重复计算显著变化。
结果
挪威云杉含有多个分支III-3NAC转录因子基因家族成员
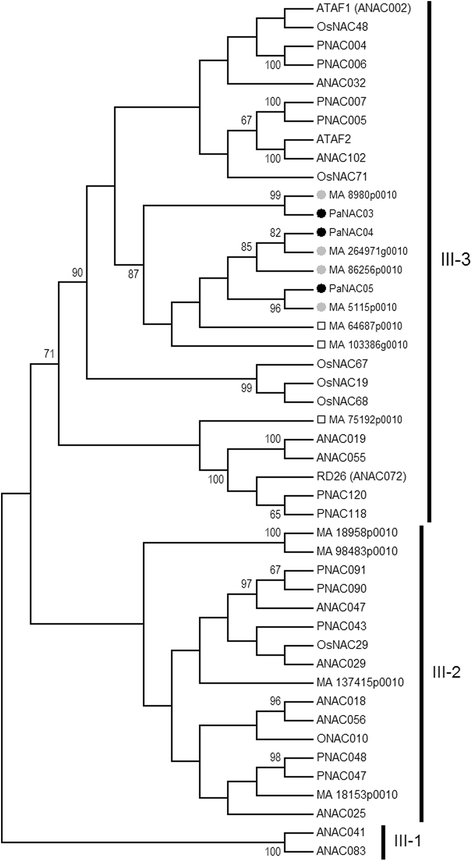
RNAseq数据集来自于时间过程研究h . annosum轮船接种挪威云杉[9,26]包含6个假定唯一的转录本(put),与NAC tf相似,所有的put至少有一次爆炸命中p .冷杉属基因组1.0版高信度基因目录。三个put,命名为PaNAC03, PaNAC04而且PaNAC05,所有的都有高度显著的爆炸命中独特的基因模型p .冷杉属v1.0基因目录和对拟南芥NACs的显著blastx命中(表2)1).PaNAC03, PaNAC04而且PaNAC05在拟南芥的第三-3支NACs中都有同源。查询p .冷杉属基因组v1.0基因目录和对挪威云杉、水稻、杨树和拟南芥蛋白质序列的系统发育分析表明,挪威云杉基因组至少有7种NAC基因模型(图2)。1),属于Jensen等人所描述的子组III-3。[1].我们基本上在III-3亚群中看到了四个分支,其中六个基因的预测氨基酸序列,包括PaNAC03 PaNAC05,形成一个分支的姐妹群,成员来自所有被子植物物种,包括ANAC032, ATAF1, ATAF2, ANAC102。挪威云杉支系和另外两个支系(其中一个是水稻特有的)从ANAC019、ANAC055、ANAC072、PNAC118和PNAC120蛋白序列中明显分离出来。1).挪威云杉分支中的6个序列之间的氨基酸相似性高于MA_75192p0010,后者更接近ANAC019, ANAC055, ANAC072, PNAC118和PNAC120分支(附加文件)4和附加文件5).
挪威云杉和拟南芥NAC家族转录因子亚群iii - 1,2,3邻近连接树基于挪威云杉基因模型中鉴定的分支iii - 1,2,3 NAC家族转录因子氨基酸序列预测的邻域连接树P.abies1.0和Jensen及其同事报道的iii - 1,2,3 NAC家族转录因子[1]即AT1G77450.1 (ANAC032)、AT1G01720.1 (ATAF1)、AT5G63790 (ANAC102)、AT5G08790 (ATAF2)、AT4G27410.2 (RD26)、AT1G52890 (ANAC019)、AT3G15500 (ANAC055)、AT1G61110 (ANAC025)、AT3G15510 (ANAC056)、AT1G52880 (ANAC018)、AT2G33480 (ANAC041)和AT5G13180 (ANAC083)。对挪威云杉分支III-3 NAC蛋白产生显著命中的杨树和水稻序列:XP_002306280.1 (PNAC005)、XP_002309945.1 (PNAC007)、XP_002307447.1 (pnac006)、xp_002330972.1 (PNAC043)、XP_002305677.1 (PNAC048)、XP_002316635.1 (PNAC047)、xp_002316143.2 (PNAC090)、XP_002325400.1 (PNAC091)、XP_006387160.1 (PNAC120)、XP_002316917.1 (PNAC118)、XP_015645677.1 (ONAC010)、XP_015630558.1 (OsNAC29)、xp_01562093.1 (OsNAC29)、XP_015620920.1 (OsNAC67)、XP_015623706.1 (OsNAC68)和XP_015617286.1 (OsNAC71)。挪威云杉序列以其基因模型号表示。黑色填充圈表示亚群III-3挪威云杉基因,该基因在树状图中既存在基因模型,又存在胁迫诱导的PUT,灰色填充圈表示仅存在部分PUT的基因。开方格表示亚组III-3挪威云杉基因模型,该模型中没有胁迫诱导PUT。引导值(1000个复制)显示在相关节点上
PaNAC03(MA_8980g0010),PaNAC04(MA_264971g0010),PaNAC05(MA_5115g0010)分别对应isogroup00240、isogroup00812和isogroup020381)在挪威云杉的转录反应的时间过程研究中发现h . annosum轮上。9,26].预测的蛋白质来自PaNAC03而且PaNAC04在保守的N端结构域上共享最多81%的同源性和90%的相似性,在完整的预测蛋白序列上共享59%的相似性(附加文件)5).这两个序列在系统发育中与其他三个潜在的NAC基因紧密聚集在一起,都高度相似(附加文件)5).第三个表达挪威云杉分支III-3,如NAC, PaNAC05,聚在这组高度相似的NAC序列之外(图5)。1),该蛋白与PaNAC03和PaNAC04蛋白在氨基酸水平上约有40%的同源性。
保守的n端A-E基序[22]在所有已确定的挪威云杉NACs中都存在(附加文件4).C端区域高度保守,位于PaNAC04, MA_103386p0010和MA_86256p0010之间,主要由极性和带电氨基酸组成4).PaNAC03共享一个共同的c端基序(SEKEE (V/I) QSSFRLE,附加文件4)除PaNAC05外,所有挪威云杉枝III-3 NACs.挪威云杉III-3亚群NACs的C端基序不同于带负电荷的基质,在其结构中有少量保守的大块疏水氨基酸残基拟南芥亚组III-3 NACs [1].
病原诱导的进化枝iii -3样挪威云杉NACs的表达
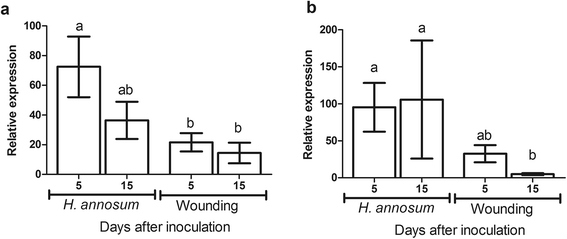
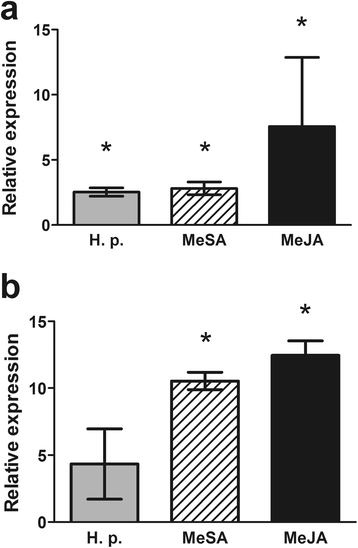
我们选择PaNAC03而且PaNAC04作为NACs对伤害和接种反应的代表进行表达分析(PaNAC03)和主要对接种反应的NACs (PaNAC04)在挪威云杉转录应答的时间过程研究中h . annosum轮上。9,26],因为这些put在这两类中表达量最高。qRT-PCR分析表明PaNAC03对接种和损伤处理均有显著的诱导反应(P两种处理均<0.05),尽管接种后诱导水平显著高于5dpi时的损伤诱导水平(P= 0.01)2).PaNAC04伤后和接种后5 dpi均显著诱导h . annosum轮上。P= 0.008,P分别为0.004)。qRT-PCR数据也显示了这一点PaNAC04与15 dpi的损伤处理相比,接种后的转录水平显著升高(P= 0.02)2 b).响应性PaNAC03而且PaNAC04来h . parviporum在幼苗上接种或接种植物防御激素(MeJA和MeSA)。MeJA和MeSA处理显著诱导了这两种基因(图2)。3而且b)但只PaNAC03对真菌接种的反应显著诱导(图;3).
PaNAC03挪威云杉的过表达导致发育和代谢谱的改变
PaNAC03过表达系胚胎发育异常
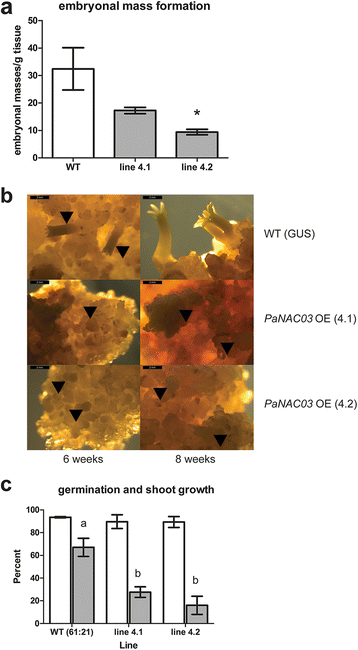
8个耐湿霉素系经pMDC32:: PaNAC03转化验证。其中5行被显示为中度过度表达PaNAC03, 1.2-2.2倍WT行(附加文件6).在WT线中,PaNAC03在早期胚胎发育期间,表达达到或低于检测限,直到LE2 (ABA处理后3周)才检测到真正可量化的表达(附加文件)7).两条OE线,4.1和4.2,表示PaNAC03以相同水平(是WT的1.7倍)用标准成熟方案测试成熟能力[44(Filonova et al. 2000)。在ABA处理下,两个品系均形成了明显的胚块,尽管其频率低于WT品系(分别为OE品系4.1和4.2的t检验,P = 0.095和P = 0.048,图。4).然而,胚胎团块似乎缺乏正常的原皮,很少发育成正常的成熟胚胎(图。4 b).因此,增殖的OE株系4.1和4.2以及WT被选择用于转录组和代谢物分析(附加文件)6).从OE系中获得了少量成熟胚胎,子叶数量减少(图2)。4摄氏度).OE系胚胎经标准干燥处理后,萌发反应正常[44],但有一小部分发芽胚胎表现出上胚轴的形成和生长(图2)。4摄氏度).
在过表达系中发现了有限数量的持续错误调控基因
转录组PaNAC03OE系和WT系用Illumina HiSeq测序,每个通过Illumina贞节过滤器的样品产生15.6-17.9 M reads,之后保留15.4 - 17.8 M reads对Nesoni过滤(附加文件)8).的总体读映射速率大礼帽是28-63%,其中大多数样本有大约60%的映射(附加文件9).
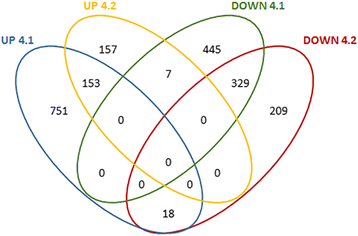
对RNA-seq数据集的分析表明,与WT相比,4.1和4.2系分别有1683和740个差异调控基因,482个基因在这两个ne系中始终存在误调控(图2)。5).其中,153例在4.1和4.2中均一致上调,329例在两个OE系中均一致下调(图2)。5).转录组数据的下游分析集中在这些持续错误调控的基因上,以了解影响PaNAC03挪威云杉基因表达模式的OE研究。
与基因一致上调相关的GO项的Fischer精确检验(FDR <0.05)PaNAC03OE系表明,与细胞壁大分子生物合成过程(GO:0044038)、碳水化合物代谢过程(GO:0005975)、半纤维素代谢过程(GO:0010410)和发育过程(GO:0032502)等基因本体(GO)类别相关的基因在持续上调的基因中占比过高(附加文件)10)与整个数据集相比。5个上调最多的基因模型中的两个编码同源结构域蛋白,MA_122121g0010和MA_114226g0010,这可能与挪威云杉的发育模式有关(附加文件)11)第三个同源结构域蛋白MA_10427484g0010也在持续上调的基因中被发现。MA_122121p0010与PaHB2和拟南芥基因GLABRA2[53- - - - - -55]并且是最强烈和最一致的上调基因模型,因为它与野生型相比上调了大约45倍。MA_114226g0010编码的蛋白与巴勒斯坦权力机构KN4 (AAV64000)。
持续下调的基因PaNAC03与GO相关的OE品系类别:蛋白质折叠(GO:0006457)、代谢过程(GO:0008152)、光刺激反应(GO:0009416)、非生物刺激反应(GO:0009628)、应激反应(GO:0006950)和过氧化氢反应(GO:0042542) (Fischer精确检验FDR <0.05;额外的文件10).同样,在持续下调区域中调控最强的基因是一个基因模型MA_10251997g0010,与基因模型相似拟南芥转录因子KANADI(AT5G16560.112).与GO术语GO:0042542相关的四种过氧化物酶在OE系中下调,其中三种是III类过氧化物酶MA_195910g0010 (PabPrx132)、MA_195775g0010 (PabPrx131)和MA_185755g0010 (PabPrx01)11).
PaNAC03过表达系显示黄酮类化合物水平降低
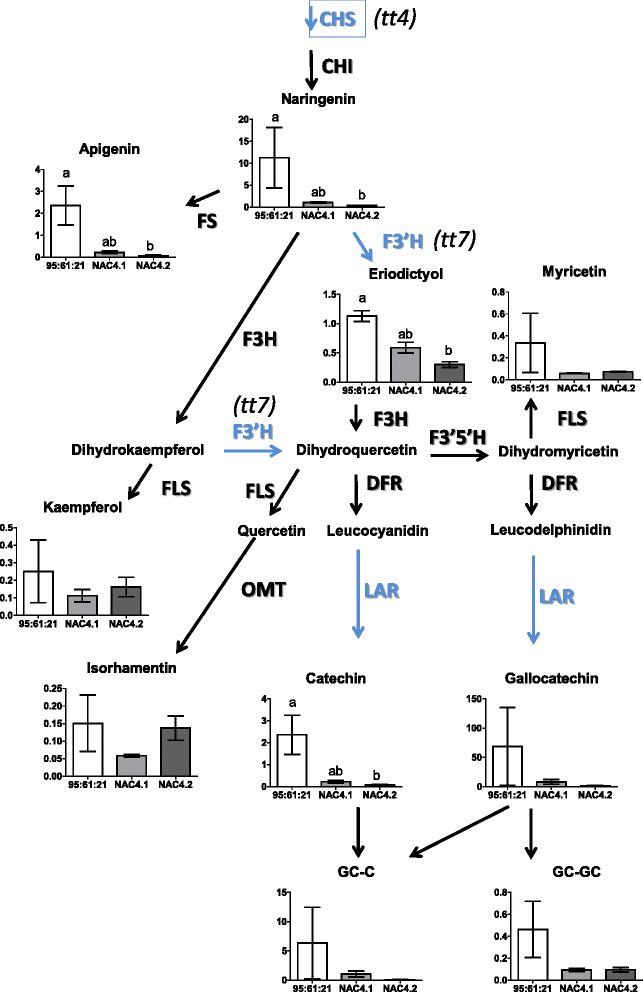
有趣的是,黄酮生物合成途径中的三个关键基因同时下调PaNAC03OE-lines:查耳酮合酶,MA_10359605g0010,与拟南芥基因透明testa 4(TT4, AT5G13930), a类黄酮3 ' -羟化酶(F3'H, MA_10434709g0010)拟南芥基因透明测试7(TT7, AT5G07990)和前面描述的PaLAR3基因(MA_10001337g0010) [47,56](附加文件12).我们只检测到一个与苯丙烷通路相关的持续诱导基因MA_10429470g0020,它编码an异黄酮还原酶与AT4G39230相似,可能参与木质素生物合成。
考虑到挪威云杉类黄酮途径中关键基因同源物的下调,我们分析了特定的特化代谢产物的水平PaNAC03oe系即二苯乙烯类的主要直接催化产物巴勒斯坦权力机构LAR3,儿茶素和没食子儿茶素,最后是一些类黄酮。挪威云杉中主要的二苯乙烯类化合物收敛素在野生云杉和野生云杉中无显著差异PaNAC03eo -lines,黄酮山奈酚和异鼠李素也没有。6).oe - 4.2系中柚皮素、芹菜素、碘二酚、儿茶素、没食子儿茶素及其二聚体含量均较低(P <0.05, One- way-ANOVA)和4.1线(0.1 > P > 0.05, One-way ANOVA)(图6).
巴勒斯坦权力机构NAC03不抑制PaLAR3启动子
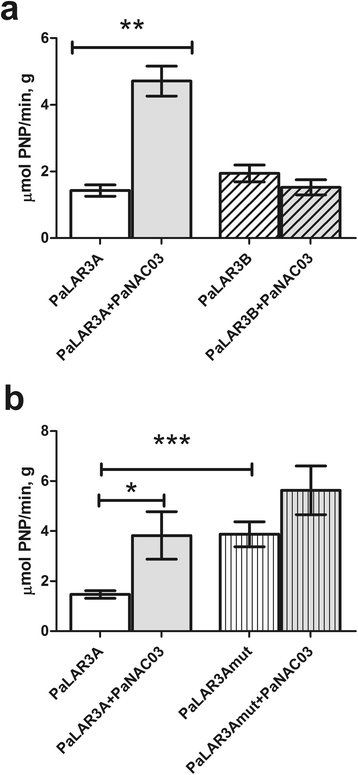
其中一个持续下调的基因(PaLAR3, MA_10001337g0010)已经被深入研究过[47,56]和来自两个不同等位基因的启动子,PaLAR3A而且PaLAR3B,已被分离,启动子显示出较高的整体相似性,它们的主要区别是存在于PaLAR3A仅启动子,包含两个假定的NAC结合位点(Nemesio-Gorriz 2016)。本实验中使用的WT系95:61:21为纯合子PaLAR3A等位基因(数据未显示),因此我们假设PaNAC03被抑制PaLAR3A(MA_10001337g0010),也可能是MA_10359605g0010和MA_10434709g0010直接与这些基因的启动子相互作用。为了验证这一假设,PaLAR3A而且PaLAR3B启动子克隆到a格斯报告载体和用于转活化实验n bethamiana有叶子和没有叶子巴勒斯坦权力机构定量分析了NAC03、启动子的基础活性以及PaNAC03对这些启动子的影响。的基本表达PaLAR3A而且PaLAR3B启动子相似(图7a)。然而,PaNAC03的共表达强烈激活PaLAR3A启动子(P <0.05),但不影响血清活性PaLAR3B启动子(无花果。7一个),表明PaNAC03与两个启动子之间存在不同的相互作用。
Transactivation的PaLAR3PaNAC03的启动器。数字一个,原生的活化PaLAR3A(开放和浅灰色条)和PaLAR3B促进者(开放和浅灰色散列条)由PaNAC03在n benthamiana,图中显示了三个代表性实验之一的结果(N =12)。数字b展示了一个具有代表性的原生转活化实验PaLAR3A(开放和浅灰色条)和PaLAR3A_mut推广器(开放和浅色条纹条)由PaNAC03在n benthamiana(N =9)。每个测量值的平均值为+/−SE。星号表示差异显著* =P <0.05;* * =P <0.01;* * * =P <0.001 (Mann-WhitneyU以及)
研究这两个假定的NAC结合位点在吲哚区是否是唯一的PaLAR3A启动器(附加文件)3.)是PaNAC03的靶点,引起PaLAR3A启动子我们使这些位点突变,构建启动子pPaLAR3A_mut。突变的启动子被克隆到格斯记者向量。之后PaNAC03与其中任何一个共表达pPaLAR3A_mut或者本地人pPaLAR3A在n bethamiana叶子。有趣的是基础活动pPaLAR3A_mut比当地人的高吗PaLAR3A启动子(无花果。7 b)表明这些假定的NAC结合位点可以影响PaLAR3A然而,NAC结合位点的缺失并不影响基因的转活化pPaLAR3A通过巴勒斯坦权力机构NAC03的相对活性无显著差异pPaLAR3A_mut(1.5 +/−0.8倍启动子单独)或原生pPaLAR3A(2.6 +/−1.8倍单独启动子)。
讨论
在这项研究中,我们在挪威云杉基因组组装v 1.0中鉴定了7个基因模型,它们与胁迫诱导的NACs亚群III-3具有同源性拟南芥[1].一般来说,挪威云杉III-3 NAC基因家族成员高度相似,显示出NAC结构域蛋白的保守n端A-E基序[22]和一个相对保守的c端区域,包括一个保守的c端基序SEKEE (V/I) QSSFRLE,该基序也出现在大多数标记Sb29扩增的序列中[57].挪威云杉亚群III-3成员的保守c端区不同于c端基序拟南芥亚组III-3成员和挪威云杉成员可能不具有类似的转激活域拟南芥成员(1],目前尚不清楚挪威云杉亚群III-3 NAC的功能是否与拟南芥子组III-3成员。挪威云杉亚群III-3 NACs至少部分地与挪威云杉有相同的胁迫诱导因子拟南芥成员基于挪威云杉基因组门户网站的表达数据。挪威云杉亚群III-3的三个基因模型与put相同PaNAC03, PaNAC04而且PaNAC05从一个新创挪威云杉与挪威云杉相互作用的转录组组装h . annosum轮上。9,26].第四个基因模型MA_86256p0010显示出与另一个PUT的相似性。综上所述,这表明某些挪威云杉亚群III-3 NACs,如他们的拟南芥矫形师,对生物压力做出反应。有趣的是,(PaNAC03, PaNAC04, PaNAC05和MA_86256p0010)的生物胁迫响应基因模型与MA_103386p0010和MA_64687p0010在系统发育中聚集在一起,而MA_64687p0010对生物胁迫不响应h . annosumS.l.接种,形成了姐妹组拟南芥ANAC032、ATAF1、ATAF2和ANAC102蛋白,以及已知对非生物胁迫有反应的一组水稻NAC基因[58].挪威云杉副系在表达模式方面的差异与亚功能化的概念是一致的[59].
为确定其对生物和非生物胁迫的响应性,对PaNAC03而且PaNAC04分析是为了回应h . annosum用qRT-PCR检测挪威云杉树韧皮部s.s.感染或损伤。这两种基因对任何一种治疗都显示出显著的诱导反应,但正如先前报道的其他挪威云杉基因一样,[5,7,9,60],接种诱导率高于损伤诱导。然而只有PaNAC03转录显著诱导h . parviporum治疗。这种差异见于诱导模式PaNAC04实验之间可能是几个不同因素的影响;显然,针叶树不同器官对病原体的转录反应不同,这种反应似乎更具有器官特异性而不是病原体特异性[4表明所分析的器官韧皮部和幼苗根可以解释两者之间的诱导差异PaNAC03而且PaNAC04。此外,寄主年龄是影响针叶树防御反应的另一个因素。这两种真菌,h . annosum轮和h . parviporum都有不同的主机偏好(详见[11])及产生植物毒素的能力不同[61],这表明它们与宿主的相互作用可能不同,并可能导致不同的调节PaNAC04.然而,在我们以往的研究中,面对挪威不同年龄的云杉植物h . parviporum而且h . annosum轮上。5,7,9,60]我们发现,在不同年龄和不同组织的测试中,两种不同的真菌都诱导出了一致的防御相关基因。因此,基因诱导模式可以表明PaNAC03可能与挪威云杉对生物胁迫的转录反应有更密切的联系PaNAC04。因此我们选择了PaNAC03用于体细胞胚胎发生培养中过表达的功能分析。
尽管被子植物和裸子植物大约在3亿年前分离,但它们胚胎发育的总体计划是相似的。然而,在两个植物谱系之间的胚胎发育程序有几个明显的差异。在被子植物中,胚胎发生过程中最先分化的组织是原胚层,原胚层是由早期球状胚胎的细胞在周鞘分裂形成的[62].限制细胞扩张的原皮层的形成对其余的发育过程至关重要[63].相反,在裸子植物中,胚块的表层在斜周和斜周分开。然而,挪威云杉胚胎中胚胎团的外层细胞层定义了一个有功能的原皮层[63,64].发育中的胚块PaNAC03oe系的团块似乎缺乏正常针叶树的“原皮”,即光滑的外表面,胚胎表面的粗犷使人联想到其他转基因挪威云杉系的表型,其原皮形成紊乱[35,63,64].胚胎团一般不会发育成成熟的胚轴胚胎。从oe系中恢复了少量成熟但外观异常的胚胎。这些胚表现出正常的萌发反应,但有一小部分萌发胚表现出上胚轴的形成和生长。基于这些观察,我们得出结论,胚胎发育程序在胚胎发育的早期阶段就受到了干扰PaNAC03OE-lines。
在这两种基因的转录组测序鉴定出的482个持续调控错误的基因模型中PaNAC03我们在挪威云杉中发现了一些已知的控制模式和胚胎发育的基因。诱导最强的基因模型是MA_122121g0010,其编码的HD-ZIP IV蛋白高度相似巴勒斯坦权力机构HB2 [53和拟南芥基因GLABRA 2而且ANTHOCYANINLESS2[54,55,65]与挪威云杉和拟南芥的模式有关PaHB1,控制原皮的形成[64],在OE线略有下调。巴勒斯坦权力机构wt -系中HB2在胚胎发育早期不表达[53MA_122121g0010也不是。因此,MA_122121g0010基因的调控异常可能是导致eo -系胚胎形态异常的原因。在oe -系中,其他基因模式被强烈上调,可能导致胚胎形态异常编码HBK4(MA_114226g0010),PaPIN1(MA_100472g0010)和PaACT4(MA_135063g0010),它们都已被证明可以控制挪威云杉体胚的发育[18,66- - - - - -68],特别是茎尖分生组织和子叶的分化[18,69进程,该进程似乎在PaNAC03OE线。与拟南芥基因相似的基因模型MA_10251997g0010KANADI1(AT5G16560.1)的表达降低了3倍PaNAC03OE-lines。在拟南芥胚胎中KANADI1最初表达于球状胚后期的中心结构域原皮层,并在发育中的拟南芥胚胎中与HD-ZIP III蛋白相互作用,在确定外周身份方面发挥作用[70- - - - - -72].值得注意的是,如前所述,PaPIN1挪威云杉HD-Zip III基因模型(MA_10427484g0010)与ATHB15 (AT1G52150)相似,与AT1G52150相比显示出不同的诱导水平KANADIoe -系中的类基因;这些表达模式让人联想到KANADI1, HD-ZIP III和PIN1之间的相互作用拟南芥[71,73].结合成熟和RNA-seq数据表明,异位表达PaNAC03通过控制这些过程的转录模块的错误调节干扰原皮层形成和早期胚胎模式。这种多效性效应必须考虑到进一步检查的一贯错误调节基因PaNAC03oe -line和任何基因调控异常一样,都可能是早期胚胎发育异常的影响。
大约三分之二的持续错误调控基因在过表达系中持续被抑制。持续抑制的基因通常与氧化石墨烯有关,与对非生物刺激的反应、应激反应和对过氧化氢的反应有关。有三种持续下调的III类过氧化物酶,包括PaPrx01这是一种持续失调的基因。在此之前,PaPrx01对什么有反应h . parviporum挪威云杉栽培的处理[74,建议贡献给H2O2在挪威云杉悬浮培养中,PaNAC03在胁迫下氧化还原稳态中的潜在作用h . parviporum挪威云杉培养的处理似乎抑制了几种过氧化物酶[74].
我们在过表达系中观察到黄酮生物合成途径中三个关键基因的一致调控异常,aCHS与拟南芥基因透明testa 4(TT4, AT5G13930), 1F3'H同源于拟南芥基因透明测试7(TT7, AT5G07990)和前面描述的PaLAR3基因(47].的变化PaLAR3与增强抗性相关的基因座h . parviporum随着酶(+)儿茶素催化产物的增加[56].
黄烷-3-醇途径中关键基因的失调与oe系中黄烷-3-醇水平的降低有关;柚皮素和芹菜素,它们是CHS下游形成的产物,但在f3’h或催化的步骤之前巴勒斯坦权力机构LAR3在小鼠体内下调巴勒斯坦权力机构NAC03过表达线(如图;6).f3’h的催化产物碘二醇也被还原。的催化产物巴勒斯坦权力机构LAR3,(+)-儿茶素在OE系中也显著降低。而其他与黄烷-3-醇生产不直接相关的代谢物积累到与WT系相同的水平,这表明黄烷-3-醇途径中关键成员的下调导致这些化合物的特异性减少。尽管NAC tf对花青素或原花青素通路的调控在文献中并不常见。NAC tf提单,ANAC078控制桃血红肉表型拟南芥似乎控制花青素或原花青素途径的某些成员[75,76].OE系的代谢产物和转录组分析似乎表明了这一点巴勒斯坦权力机构NAC03可能是挪威云杉3-黄烷醇生产的负调控因子,可能直接作用于调控不当的黄烷醇生物合成基因。为了测试这种可能性,我们共同表达了PaNAC03两个等位基因中的任何一个的启动子PaLAR3轨迹(56在n bethamiana叶子;假设,巴勒斯坦权力机构NAC03会减少PaLAR3启动子活性,如果它起抑制作用。然而,在这个系统中巴勒斯坦权力机构NAC03强烈激活的启动子PaLAR3A等位基因表明巴勒斯坦权力机构NAC03不作为黄烷-3-醇生产的负调控因子直接与PaLAR3。然而,下调了CHS转录,类黄酮生物合成限速步骤编码[77]可能对下游代谢物生物合成的底物可用性有影响,这解释了我们研究中观察到的较低的转录和代谢物水平。转录谱分析还显示了一个可能参与木质素生物合成的异黄酮还原酶基因的上调[78].木素和木质素生物合成直接竞争类黄酮途径中使用的底物,因此也可能负调控类黄酮生物合成,正如我们在本研究中观察到的巴勒斯坦权力机构NAC03过表达行。这是可能的下调CHS, F3'H而且PaLAR3基因在PaNAC03过表达系可能由上游调控基因的调控错误或本构干扰等其他因素介导PaNAC03早期胚胎模式的表达。需要注意的是,黄烷醇和透明的外种皮突变体与生长素稳态和生长素极性转运有关[79,80]在植物中。对于过表达实验和转激活实验之间的差异,另一种可能的解释是巴勒斯坦权力机构NAC03在异源二聚体中起作用,这已在其他应激反应型naac中得到证实[81,82],用一个目前身份不明的TF来下调CHS, F3'H而且PaLAR3oe系的基因。这种可能性可以通过酵母双杂交筛选胚性培养的cDNA文库来验证巴勒斯坦权力机构NAC03作为诱饵。
结论
PaNAC03及其直系同源分子与具有良好胁迫相关特征的被子植物NAC基因形成姐妹群PaNAC03对生物应激反应,似乎在控制防御相关的次生代谢产物的生产。然而,意想不到的胚胎表型PaNAC03OE系强调了植物特化代谢和模式之间仍然神秘的联系,提出了关于亚群III-3 NAC tf在发育和胚胎模式中的作用的问题。
参考文献
Jensen MK, Kjaersgaard T, Nielsen MM, Galberg P, Petersen K, O 'Shea C, Skriver K.拟南芥NAC转录因子家族:ANAC019胁迫信号的结构-功能关系和决定因素。生物化学学报,2010;
朱涛,孙东,彭娟。植物nac蛋白的系统发育分析。中国生物医学工程学报,2012;26(6):344 - 344。
Nystedt B, Street NR, Wetterbom A, Zuccolo A, Lin Y-C, Scofield DG, Vezzi F, Delhomme N, Giacomello S, Alexeyenko A,等。挪威云杉基因组序列与针叶树基因组进化。自然。2013;497(7451):579 - 84。
Adomas A, Asiegbu FO。器官特异性反应分析抗旱性射(Gremmeniella abietina)和根(Heterobasidion annosum)病原体。《植物病理学杂志》2006;69(4-6):140-52。
杨志强,李志强,李志强,李志强。白腐菌对挪威云杉树皮非特异性防御反应的影响。树物理学报,2011;31(11):1262-72。
Fossdal CG, Nagy NE, Hietala AM, Kvaalen H, Slimestad R, Woodward S, Solheim H.在成熟的挪威云杉无性系中,木质素途径转录本和酚类物质受到增强的本构或启动宿主反应的影响。树物理学报,2012;32(9):1137-47。
Arnerup J, Nemesio-Gorriz M, Lundén K, Asiegbu FO, Stenlid J, Elfstrand M.挪威云杉对H. annosum s.l.防御信号的主要模块似乎是茉莉酸介导的信号,而没有水杨酸介导的信号拮抗作用。足底。2013;237(4):1037 - 45。
雅库布N,雅可夫列夫IA,克罗肯P,克瓦伦H,索尔海姆H,化石CG。挪威云杉树皮和边材防御相关基因表达对小刺虫和茉莉酸甲酯的响应。中国植物病理学杂志,2012;26(1):1 - 6。
Danielsson M, Lunden K, Elfstrand M, Hu J, Zhao T, Arnerup J, Ihrmark K, Swedjemark G, Borg-Karlson AK, Stenlid J.挪威云杉不同易感性基因型对异黑杆菌侵染的化学和转录应答。中国生物医学工程学报,2011;29(4):529。
Davies TJ, Barraclough TG, Chase MW, Soltis PS, Soltis DE, Savolainen V.达尔文可恶的谜团:来自被子植物超级树的洞见。中国科学院学报(自然科学版),2004;21(3):344 - 344。
李志强,李志强,李志强,等。松柏根腐病真菌的进化历史。分子生物学,2010;19(22):4979-93。
西部异黑刺蝽和不规则异黑刺蝽:北美异黑刺蝽的一种分布。中国生物医学工程学报,2010;29(1):344 - 344。
李志强,李志强,李志强。NAC转录因子的研究进展。植物科学进展,2005;10(2):79-87。
山口勇,张志刚,张志刚,等。NAC结构域蛋白调控次生壁形成的转录调控。植物学报。2010;27(3):237-42。
Kubo M, Udagawa M, Nishikubo N, Horiguchi G, Yamaguchi M, Ito J, Mimura T, Fukuda H, Demura T.原木质部和后木质部血管形成的转录开关。基因工程学报2005;19(16):1855-60。
拟南芥杯状子叶1基因调控茎尖分生组织的形成。戴夫(剑桥,英国)。2001年,128(7):1127 - 35。
Duval I, Lachance D, Giguere I, Bomal C, Morency MJ, Pelletier G, Boyle B, MacKay JJ, Seguin a .云杉转录因子-启动子相互作用的大规模筛选揭示了参与血管发育的转录网络。中国生物医学工程学报,2014;26(3):344 - 344。
Larsson E, Sundstrom JF, Sitbon F, von Arnold S.云杉杯状子叶同源基因PaNAC01的表达受生长素极性转运的调控,并与茎尖分生组织的分化和分离子叶的形成有关。学报学报。2012;11(4):923-34。
Puranik S, Sahu PP, Srivastava PS, Prasad M. NAC蛋白在胁迫耐受中的调控和作用。植物科学进展,2012;17(6):369-81。
吴勇,邓忠,赖军,张勇,杨超,尹斌,赵强,张磊,李勇,杨超,等。拟南芥ATAF1在非生物和生物胁迫响应中的双重功能。细胞科学进展,2009;19(11):1279-90。
卜强,姜辉,李cb,翟强,张娟,吴霞,孙娟,谢强,李超。拟南芥NAC转录因子ANAC019和ANAC055在茉莉酸信号防御应答调控中的作用。细胞科学,2008;18(7):756-67。
Ooka H,佐藤K, Doi K,永田T,大友Y,村上K,松原K,大藤N,河合J, Carninci P,等。水稻和拟南芥NAC家族基因的综合分析。中国生物医学工程学报。2003;10(6):379 - 379。
Jensen MK, Kjaersgaard T, Petersen K, Skriver K. NAC基因:拟南芥激素信号的时间特异性调控因子。植物信号与行为研究。2010;5(7):907-10。
王X, Basnayake BM,张H,李,李W, Virk N, Mengiste T,歌f .拟南芥ATAF1, NAC转录因子,是一种消极的监管机构对necrotrophic真菌和细菌病原体的防御反应。Mol植物-微生物相互作用:MPMI。2009; 22(10): 1227 - 38。
Delessert C, Kazan K, Wilson IW, Van Der Straeten D, Manners J, Dennis ES, Dolferus R.转录因子ATAF2抑制拟南芥致病相关基因的表达。植物JCell Mol biology, 2005;43(5): 745-57。
Lunden K, Danielsson M, Durling MB, Ihrmark K, Nemesio-Gorriz M, Stenlid J, Asiegbu FO, Elfstrand M.挪威云杉互作对毒力和防御的转录应答。科学通报2015;10(7):e0131182。
Altschul SF, Madden TL, Schaffer AA, Zhang JH, Zhang Z, Miller W, Lipman DJ。gapping BLAST和PSI-BLAST:新一代蛋白质数据库搜索程序。中国生物医学工程学报,1997;25(17):3389-402。
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:利用最大似然,进化距离和最大简约方法进行分子进化遗传学分析。分子生物学与进化2011;28(10):2731-39。
Rice P, Longden I, Bleasby A. EMBOSS:欧洲分子生物学开放软件套件。植物学报,2000;16(6):276-7。
序列操作套件:用于分析和格式化蛋白质和DNA序列的JavaScript程序。生物学技术。2000;28(6):1102。
卡尔松B, Högberg KA。挪威云杉(Picea abies (L.))克隆试验的基因型参数和克隆x位点互作岩溶)。Genet, 1998; 5:21-30。
Stenlid J, Karlsson J o。异黑僵菌的部分间性。中国科学(d辑:自然科学)。
张志强,张志强,张志强,等。一种提取松材中RNA的方法。植物摩尔生物学报告,1993;11(2):113-6。
摄取T, Kähr M.不同相对氮添加量下针叶树幼苗的营养和生长。植物科学。1985;65(2):109-16。
朱涛,Moschou PN, Alvarez JM, Sohlberg JJ, von Arnold S. wuschell相关HOMEOBOX 2在挪威云杉裸子植物原皮层和胚柄发育中的重要作用。BMC植物学报,2016;16(1):1 - 14。
Pfaffl MW, Horgan GW, dempple L.相对表达软件工具(REST (c)),用于实时PCR中相对表达结果的分组比较和统计分析。中国生物医学工程学报,2002;30(9):e36。
Livak KJ, Schmittgen TD。使用实时定量PCR和2(T)(−Delta Delta C)方法分析相关基因表达数据。方法。2001;25(4):402 - 8。
Vestman D, Larsson E, Uddenberg D, Cairney J, Clapham D, Sundberg E, von Arnold S.挪威云杉体胚分化和早期发育过程中基因表达变化的研究。树Genet基因组,2011;7(2):347-62。
杨晓明,王晓明,王晓明,等。针叶树WOX2的同源结构域转录因子及其表达动态挪威云杉体细胞胚胎发生。植物化学学报,2008;49:533 - 49。
王志强,王志强,王志强。稳定管家基因、差异调控靶基因和样本完整性的测定:基于BestKeeper - excel的工具,使用成对相关性。生物技术通报2004;26(6):509-15。
植物基因高通量功能分析的网关克隆载体集。植物科学进展。2003;33(2):462 - 466。
Minina EA, Filonova LH, Fukada K, Savenkov EI, Gogvadze V, Clapham D, Sanchez-Vera V, Suarez MF, Zhivotovsky B, Daniel G,等。自噬和元胱天冬酶决定植物细胞死亡的方式。中国生物医学工程学报,2013;23(6):917-27。
Bozhkov PV, von Arnold S.聚乙二醇促进云杉体胚成熟,但抑制进一步发育。中国生物医学工程学报。1998;40(2):344 - 344。
杨晓明,杨晓明,杨晓明,等。云杉体细胞胚胎发生发育途径的研究。中国科学(d辑),2000;26(4):344 - 344。
Trapnell C, Roberts A, Goff L, Pertea G, Kim D, Kelley DR, Pimentel H, Salzberg SL, Rinn JL, Pachter L.用TopHat和Cufflinks进行rna测序实验的差异基因和转录本表达分析。网络学报。2012;7(3):562-78。
崔文杰,刘志刚,王志刚,王志刚。基于RNA-seq的基因调控差异分析。中国生物工程学报。2013;31(1):46-53。
Hammerbacher A, Paetz C, Wright LP, Fischer TC, Bohlmann J, Davis AJ, Fenning TM, Gershenzon J, Schmidt A.挪威云杉黄烷-3-醇:对树皮甲虫相关真菌Ceratocystis polonica1 C W OPEN攻击的生物合成、积累和功能。中国生物医学工程学报,2014;29(4):344 - 344。
植物转化和启动子分析的二元Ti载体。方法酶重组DNA。1987; 153:292 - 305。
Gomez-Eichelmann MC, Lark KG。体外合成大肠杆菌DNA Endo R DpnI酶切。冈崎碎片的末端是由模板脱氧核苷酸序列决定的证据。中华分子生物学杂志,1977;117(3):621-35。
陈海华,宋国强,薛文杰。农杆菌冻融转化后转化子回收率的提高及药物选择。生物学技术。1994;16(4):664 - 8。670.
Wilson KJ, Hughes SG, Jefferson RA。大肠杆菌gus操纵子:gus操纵子在大肠杆菌中的诱导和表达以及gus在其他细菌中的发生和利用。进:加拉格尔SR,编辑。GUS方案采用GUS基因作为基因表达的报告基因。圣地亚哥:Acad出版社;1992.7-22页。
一种利用蛋白质-染料结合原理快速而灵敏地定量微量蛋白质的方法。《肛门生物化学》1976;72:248-54。
Ingouff M, Farbos I, Wiweger M, von Arnold S.挪威云杉胚胎发育过程中表达的HD-GL2家族同源盒基因PaHB2的分子特征。中国机械工程学报,2003;29(3):344 - 344。
Di Cristina M, Sessa G, Dolan L, Linstead P, Baima S, Ruberti I, Morelli G.拟南芥Athb-10 (GLABRA2)是调控根毛发育所需的HD-Zip蛋白。中国生物医学工程学报,1996;10(3):393-402。
Masucci JD, Rerie WG, Foreman DR, Zhang M, Galway ME, Marks MD, Schiefelbein JW。同源盒基因GLABRA2是拟南芥根表皮位置依赖细胞分化所必需的。戴夫(剑桥,英国)。1996年,122(4):1253 - 60。
Nemesio Gorriz M, Hammerbacher A, Ihrmark K, Kallman T, Olson A, Lascoux M, Stenlid J, Gershenzon J, Elfstrand M.白花青素还原酶(PaLAR3)基因的不同等位基因对云杉(Picea abies)对真菌Heterobasidion parviporum抗性的影响。植物科学进展,2016,26(4):344 - 344。
杨晓东,李志强,李志强,等。黑云杉任意基因的序列标记位点(sts)标记:建立、表征和连锁分析。遗传学。1998;149(2):1089 - 98。
García-Morales S, Gómez-Merino FC, Trejo-Téllez LI。盐胁迫对优质水稻NAC转录因子表达、氨基酸浓度及生长的影响。植物物理学报,2014;36(7):1927-36。
王子VE,皮克特FB。分裂对:重复基因的不同命运。植物学报。2002;3(11):827-37。
Oliva J, Rommel S, Fossdal CG, Hietala AM, Nemesio-Gorriz M, Solheim H, Elfstrand M.挪威云杉(Picea abies)内边材对异黑孢子虫(Heterobasidion parviporum)的转录应答。树物理学报,2015;35(9):1007-15。
韩松D,吴bshet S, Olson A, Karlsson M, sterk D, Broberg A.异黑刺蝽复合体中次生代谢产物的比较。植物化学。2014;108:243-51。
10张文杰,刘志刚,刘志刚,等。拟南芥早期胚胎细胞命运的研究进展。戴夫(剑桥,英国)。142(3): 420 - 2015; 30。
Sabala I, Elfstrand M, Farbos I, Clapham D, von Arnold S.挪威云杉(Picea abies)胚胎发育过程中脂质转移蛋白基因Pa18的组织特异性表达。植物分子生物学杂志,2000;42(3):461-78。
Ingouff M, Farbos I, Lagercrantz U, von Arnold S. PAHB1是一个进化保守的HD-GL2同源盒基因,在挪威云杉胚胎发育过程中表达。《创世纪》。2001;30(4):220 - 30。
Kubo H, Peeters AJM, Aarts MGM, Pereira A, Koornneef M.影响拟南芥花青素分布和根系发育的同源箱基因。植物细胞学报。1999;11(7):1217-26。
Hakman I, Hallberg H, Palovaara J.在云杉体胚发育过程中,极性生长素转运抑制剂NPA破坏胚胎形态,增加生长素外流促进蛋白PIN的表达。树物理学报。2009;29(4):483-96。
Palovaara J, Hallberg H, Stasolla C, Luit B, Hakman I.裸子植物PIN同源基因的表达与云杉体胚发育过程中子叶形成、原形成层划分和幼苗组织中生长素免疫定位模式的相关性树物理学报。2010;30(4):479-89。
Schwarzerová K, Vondráková Z, Fischer L, Boříková P, Bellinvia E, Eliášová K, Havelková L, Fišerová J, Vágner M, Opatrný Z.挪威云杉肌动蛋白异型体在体细胞胚胎发生中的作用。植物学报。2010;10(1):1 - 13。
杨晓明,杨晓明,杨晓明,等。挪威云杉(Picea abies)茎尖分生组织建立过程中knotted1基因的差异调控。植物细胞学报,2012;31(6):1053-60。
黄T, Harrar Y, Lin C, Reinhart B, Newell NR, Talavera-Rauh F, Hokin SA, Barton MK, Kerstetter RA。拟南芥kanadi1作为转录抑制因子,通过与特定的顺式元件相互作用,调节生长素的生物合成、运输和信号通路,与hd-zipiii因子相反。植物学报。2014;26(1):246-62。
Izhaki A, Bowman JL。Kanadi和iii类hd-zip基因家族在拟南芥胚胎发生过程中调控胚胎模式和生长素流动。植物学报。2007;19(2):495-508。
Kerstetter RA, Bollman K, Taylor RA, Bomblies K, Poethig RS. KANADI调控拟南芥器官极性。大自然。2001;411(6838):706 - 9。
Ilegems M, Douet V, Meylan-Bettex M, Uyttewaal M, Brand L, Bowman JL, Stieger PA。生长素、KANADI和III类HD-ZIP转录因子在维管组织形成中的相互作用戴夫(剑桥,英国)。2010, 137(6): 975 - 84。
Kärkönen A, Warinowski T, Teeri T, Simola L, Fry S.培养云杉细胞木质素形成和诱导过程中过氧化氢生成的机制——诱导后过氧化物酶。足底。2009;230(3):553 - 67。
Morishita T, Kojima Y, Maruta T, Nishizawa-Yokoi A, Yabuta Y, Shigeoka S.拟南芥nac转录因子anac078在强光下调控类黄酮生物合成植物生理学报。2009;50(12):2210 - 2222。
顾周H, lin Wang K,王H, C,敢美联社,Espley房车,他H,艾伦AC,汉族y blood-fleshed桃子显示激活的分子遗传学花青素生物合成的NAC转录因子。中国植物学报,2015;29(1):344 - 344。
类黄酮生物合成。遗传学、生物化学、细胞生物学和生物技术的彩色模型。植物科学进展。2001;26(2):366 - 366。
王志强,王志强,王志强,王志强。(+)-松树脂醇/(+)-落叶松树脂醇还原酶蛋白质的纯化,cDNA的克隆,异黄酮还原酶的异源表达及比较。中国生物医学工程学报。1996;21(4):379 - 379。
布尔CS,科尔德巴赫F,张龙TT,霍卡特CH,德约杰维奇MA。透明种突变体中类黄酮积累模式的改变会干扰生长素的运输和重力反应,并对根和茎的结构产生长期影响。足底。2013;238(1):171 - 89。
韦佩文,程毅,马文辉。生长素信号的氧化衰减证据。中国机械工程学报,2013;29(2):344 - 344。
郑俊杰,朴依特,郑浩,朴世华,金继科。水稻NAC蛋白具有同源二聚体和异源二聚体的作用。植物生物技术通报。2009;3(2):127-34。
Hegedus D, Yu M, Baldwin D, Gruber M, Sharpe A, Parkin I, Whitwill S, Lydiate D.甘蓝型油菜NAC结构域转录激活子在生物和非生物胁迫下的分子表征。植物化学学报,2003;26(3):389 - 397。
确认
我们感谢Kanita Orozovic博士在实验室的技术协助。感谢Malin Abrahamsson和Irena Merino与我们分享他们胚胎发育阶段的cDNA样本。我们也要感谢Nathaniel Street博士和Sara von Arnold教授分别就转录分析和挪威云杉体细胞胚胎发育进行了宝贵的讨论。
资金
瑞典战略研究基金会(SSF),批准号R8b08-0011;瑞典研究理事会FORMAS,批准号2012-1276;为研究提供资金支持。资助者在研究设计、数据收集和分析、发表决定或手稿准备中没有任何作用。
数据和材料的可用性
NAC OE线产生的短读数据保存在NCBI的BioProject PRJNA350779的SRR5022423-SRR5022431中。如欲索取资料,请与机电工程师联络(Malin.Elfstrand@slu.se)。
作者的贡献
ME, IE和KL构思了这项研究。KD在MNG的协助下计划并执行了实验工作。AH和MNG对NAC OE系进行化学分析。JJW计划并执行了在n benthamiana.KD, ME和MNG起草稿件,所有作者阅读并批准最终稿件
相互竞争的利益
作者宣称他们之间没有利益冲突。
发表同意书
不适用。
伦理批准并同意参与
不适用。
作者信息
从属关系
相应的作者
附加文件
附加文件1:
研究中使用的引物序列。(xlsx11kb)
附加文件2:
脚本用于Nesoni, tophat,袖扣和袖扣。(xlsx14kb)
附加文件3:图S2。
结构示意图PaLAR3A启动子(Genbank登录号;KX574229.1)PaLAR3B启动子(KX574230.1)为红色,白色区域为PaLAR3B启动子对应于序列中的缺失PaLAR3A启动子。两个NAC结合位点(TTTCGT)存在于该区域PaLAR3A启动子用黄色表示。在PaLAR3A_mut启动子中只有这两个位点发生了突变PaLAR3A启动子完好无损。(xlsx69 kb)
附加文件4:
挪威云杉亚群III-3 NAC蛋白簇W序列的研究。彩色盒子对应于保守的n端图案A(浅蓝色),B(淡绿色),C(淡红色),D(淡紫色)和E(淡金色)。阴影残基表示残基保存在c端区域。(xlsx21 kb)
附加文件5:
NAC蛋白III-3亚群氨基酸的同源性和相似性。在完整的蛋白质序列(A)或蛋白质的c端部分(B)中,氨基酸同一性(对角线上方)和相似性(对角线下方)的百分比。
附加文件6:
假定的相对表达式PaNAC3超表达。相对表达量与未转化野生型系95:61:21相关。(docx53.1 kb)
附加文件7:
转录调控PaNAC3响应野生型线95:61:21的标准成熟处理。(PDF 447kb)
附加文件8:表S7。
Nesoni滤波后的RNAseq度量。(docx19kb)
附加文件9:
来自tophat的对齐摘要。(docx11kb)
附加文件10:
基因中持续下调或上调的基因中富集GOPaNAC3超表达。(TIF 45020kb)
附加文件11:
基因持续上调PaNAC3超表达。(docx15kb)
附加文件12:
基因的持续下调PaNAC3超表达。(docx17 kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
达尔曼,K.,温德,J.J.,涅墨西奥-戈里兹,M.。et al。过度的PaNAC03胁迫诱导的NAC基因家族转录因子导致挪威云杉黄酮醇生物合成减少和胚胎发育异常。BMC植物生物学17日,6(2017)。https://doi.org/10.1186/s12870-016-0952-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-016-0952-8
关键字
- 树皮
- 云杉
- 转录组
- NAC[用于NAM(无顶端分生组织)
- ATAF(拟南芥转录激活因素)
- 杯状子叶
- 抵抗Heterobasidion annosum
- ATAF1
- 类黄酮
- 白花青素还原酶
- Homeodomain蛋白质