抽象的
背景
木瓜蛋白酶样半胱氨酸蛋白酶(PLCPs)和液泡加工酶(VPES)是在拟南芥叶子衰老过程中最高度表达的蛋白酶之中。使用基于活动的蛋白谱(ABPP),即使用化学探针使得复杂样品中活性酶的检测的方法,PLCPs和VPES的活动在拟南芥的单独变暗叶进行了调查,以及它们在衰老作用在空测试突变体。
结果
ABPP和质谱分析显示几种PLCPs活性增加,尤其是RD21A和AALP。相比之下,尽管增加了VPE.单株变暗叶片中活性VPE水平下降。对8个蛋白酶敲除系和2个蛋白酶过表达系进行衰老表型分析,以确定单个蛋白酶活性对衰老的重要性。出乎意料的是,尽管在这些植物中没有主要的PLCP活性,但单个变暗叶片中的rubisco和叶绿素下降和整个植物衰老的开始没有改变。然而,在全株衰老过程中发现了明显的延迟aalp-1和rd21A-1 / aalp-1突变体,可见于数量减少的衰老叶片中。
结论
主要CYS蛋白酶的活动对黑暗诱导和发育衰老至关重要,并且只有缺乏AALP的爆震线显示出植物衰老的轻微但显着的延迟。
背景
衰老是细胞、组织和器官发育的最后阶段,对于单果种来说,是整个植物的最后阶段。叶子衰老的特征是大量的蛋白质降解,这使得营养物质,特别是氮,能够用于植物的其他部分,如新发育的器官,种子或贮藏组织。衰老过程中的蛋白质降解包括光系统、代谢途径和活细胞中所有其他蛋白质的分解和降解,直到没有蛋白质留下来循环利用[1].叶绿体破裂的四个途径已在拟南芥中被发现。这些途径涉及自噬,衰老相关液泡(SAV中),叶绿体囊泡形成和选择性破坏叶绿体经由13-脂氧合酶[2-5.].然而,尽管该过程的重要性,但蛋白酶尚未确定并表征。
基因表达研究表明,Cys蛋白酶是叶片衰老期间最丰富的蛋白酶[6.].衰老相关的Cys蛋白酶木瓜蛋白酶样半胱氨酸蛋白酶(PLCPs,蛋白酶家族C1A在MEROPS数据库[7.]),豆荚蛋白或液泡处理酶(VPE,家族C12),元糖酶(家族C14),钙蛋白酶(家族C2)和泛素依赖途径相关的蛋白酶(家族C13,C19和C85)[6.那8.-15.].在用Cys蛋白酶抑制剂治疗后,可以在小麦的衰老叶片中降低蛋白质降解,表明Cys蛋白酶在衰老中的参与[16.].
PLCPs是衰老过程中与体蛋白降解相关的主要酶[14.].然而,PLCPs也参与其他生理过程,如萌发和植物防御[17.].拟南芥AALP(SAG2)和SAG12.,两个编码PLCPs被用作叶子衰老的标记标准[18.-20].SAG12.专门在衰老叶中表达,编码的蛋白质局限于衰老相关的液泡(SEVS)[2].相比之下,AALP(SAG2.)转录叶片在自然和应激相关的衰老(综述在所有发育阶段,但增加发生[8.])。在红薯,增加2个PLCPs的表达,SPCP2和SPCP3(同源物的RD19和RD21A分别发生在天然和应激诱导的调节组织中发生[21那22类似地,以大豆PLCP称为GMCP3[23].此外,四种推测的PLCPs编码cdna (Bocp1,Bocp2,Bocp3,Bocp4)已从Sucescing Croccoli Floret组织中分离,类似于Arabidopsis RD19和RD21A [24]. 拟南芥RD21A存在于衰老叶片的液泡中,作为57kDa前体合成,通过38kDa中间体(iRD21A)缓慢加工成33kDa成熟蛋白(mRD21A)[25]. 这些中间产物聚集在液泡中,但在叶片衰老过程中,当颗粒蛋白结构域去除后,它们以可溶性蛋白酶的形式释放[25].以类似的方式,SOCP是一种41kDa蛋白酶,其具有在衰老叶中转录诱导的粒细胞域Spinacia oleraceae.[26].
在拟南芥中,VPES介导种子萌发和发育或病原体介导的程序性细胞死亡[期间处理液泡定位的蛋白的27-30].有人提议γ.VPE也可能激活衰老过程中参与蛋白质循环的蛋白酶[27].转录水平γ汽相外延拟南芥的发育过程中叶片增大31].而且,γ汽相外延在烟草的花瓣中高度诱导,因为它们的发展进展,并且建议使用它作为花瓣衰老的衰老标志物[32].
蛋白酶活性受转录和翻译过程调控,但也受翻译后修饰和蛋白酶抑制剂调控[33].PLCP用自动抑制的前蛋白合成,必须果断除去以激活酶[34]. 从菠菜叶片中纯化出与衰老相关的PLCP,其颗粒蛋白结构域与半胱氨酸蛋白酶抑制剂复合物,并通过从复合物中释放半胱氨酸蛋白酶抑制剂激活该蛋白酶[35].类似地,在大麦中提出了在衰老期间在衰老过程中调节半胱氨酸蛋白酶活性的作用[36].水稻胱抑素在烟草中的过表达抑制Cys蛋白酶活性,延缓Rubisco和两种Rubisco激活酶蛋白的下降[37].AtSerpin1与RD21A相互作用,预计其他serpins可能调节衰老[38].
由于这种翻译后调控,蛋白酶或蛋白酶编码转录本的积累并不一定与蛋白酶活性相关。为了研究蛋白酶的活性,而不是转录或蛋白质积累,我们应用了基于活性的蛋白酶谱(ABPP)。ABPP是基于荧光或生物素化化学探针的使用,它们以一种机制依赖的方式与酶的活性位点发生不可逆反应[39-41].本研究利用ABPP研究拟南芥叶片单独变暗诱导的叶片衰老过程中蛋白酶的活性,并利用PLCP、VPE突变体和过表达系确定这些信号的来源,确定这些蛋白酶对叶片衰老的相对贡献。
方法
植物材料和生长条件
所有拟南芥转基因株系和敲除株系均为哥伦比亚生态型1:表S2。这个RD21-1,AALP-1,SAG12-1,ctb3-1突变体[42];的rd21-1 / aalp-1双突变体[43]; γVPE过表达蛋白(35 s:γ汽相外延,(44]),VPE四重淘汰(qvpe.)缺失所有四种VPEs的突变体[45]和三重突变体ctb1/2/3(线#65-4,[46])先前已被描述。在35S :: RD21过表达系由转化产生的Col-0与pRH628 [43]使用FlowerDip方法。在卡那霉素和纯合线上选择转基因植物,其特征是ABPP(附加文件2:图S3)。植物在受控的生长箱中生长6至8周。采用三组生长条件:24°C/20°C温度下12/12小时的昼/夜循环,22°C/18°C温度下16/8小时的昼/夜循环(长昼),22°C/18°C温度下8/16小时的昼/夜循环(短昼)。
叶绿素定量
利用土壤植物分析开发(SPAD)仪(502 Plus叶绿素仪,Spectrum Technologies)测定叶绿素相对含量[47].SPAD分析仪测量两个波长(650和940 nm)的叶片透射率。测量总是从叶子的顶部和5个最大的莲座叶片的值取平均值。每个处理分析了8个重复植株。野生型和突变型植株在相同的生长条件下在同一托盘中生长。采用双尾分布的学生配对t检验来分析数据。
衰老试验和开发过程中的其他形态特征
整株植物衰老的开始被定义为绿叶数量开始减少的那一天[48那49].当叶片面积超过一半呈黄色时,叶片即为衰老;否则树叶就被归类为绿色。对16株复制植株进行了分析。突变体和野生型随机分布在同一托盘中。采用双尾分布的学生配对t检验来分析数据。
半定量rt-PCR
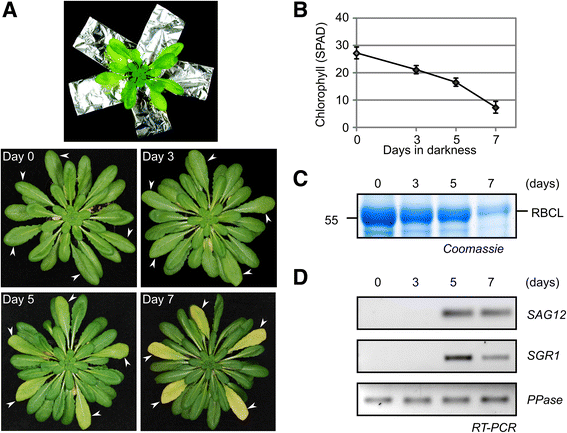
使用QIAGENRNEASY试剂盒从叶中提取RNA。用涡轮DNA酶(AMALION)DNA消化后,使用上标III逆转录酶(Invitrogen)合成第一链cDNA。对于SGR1(AT4G22920):SGR1-L,5'-ACAAGTCCATCTCCATGC-3',对具有基因特异性引物进行30-35个循环的基因特异性引物进行。和SGR1-R,5'-GGAAAATGTCGCTTCACGTT-3'。对于SAG12(AT5G45890):SAG12-L,5'-TCCTTACAAAGGCGAAGACG-3';和sag12-r,5'-tcattaaccggggacatcctc-3'。对于ppase(AT1G13320):PPAS-L,5'-TAACGTGGCCAAATGATGC-3'和PPASE-R,5'-GTTCTCCACAACCGCTTGGT-3'。在用溴化乙锭染色的琼脂糖凝胶上可视化PCR产物。SGR1(141bp),SAG12(93bp)和ppase(61bp)的片段尺寸都是预期尺寸。
样品制备、探针标记和蛋白质分析
探针以前合成:DCG-04 [50],AMS101 [51]及MV151 [43].将蛋白质从100mg均化的冷冻叶中提取,以在0.5ml水中用于DCG-04标记或100μl水,用于用其他探针标记。通过离心(2分钟为16000g)除去碎片。用探针依赖性pH值,1mM DTT和0.2或2μMDCG-04,2μMAMS101和2μMMV151,在含有70mM乙酸钠缓冲液(NaOAc)的60μl蛋白质提取物中进行标记。用DCG-04标记的提取物在室温(22-25℃)下,连续混合孵育5小时,而用荧光探针AMS101和MV151标记的样品在黑暗的室温下在室温下孵育2小时。将DMSO的等于稀释液加入到NO探针控制中。用1mM E-64预孵育作为与DCG-04和MV151一起孵育的样品进行检测,以检测PLCP。通过加入含有β-巯基乙醇的4倍SDS-PAGE加载缓冲液停止标记反应,然后通过12%SDS页分离蛋白质。使用台风9000扫描仪(GE Healthcare Life Science),通过凝胶荧光扫描可视化标记的蛋白质(GE Healthcare Life Science,http://www.gelifesciences.com),分别在532和580 nm激发和发射,或转移到膜上,用链霉亲和素- hrp分析。抗rd21和抗aalp抗体之前已有描述[25那52].
标记蛋白质的亲和纯化和鉴定
选取生长在12/12小时光照条件下的6周龄植株叶片,用铝箔覆盖7 d诱导衰老。然后从5片叶子中提取蛋白质到2- 4ml水中,然后在20000 g离心5分钟。用1 M标记缓冲液(1 M NaOAc, pH 6)稀释上清至最终浓度50 mM,蛋白浓度5 mg/mL。蛋白提取液用1 μM DCG-04标记,室温下用1 mM DTT温和搅拌2小时。将标记的蛋白提取液应用到PD10色谱柱上,用50 mM Tris-HCl平衡,pH为8。脱盐样品用100 μl亲和素微珠轻轻搅动孵育1小时。2000 rpm离心5 min,收集亲和素珠。用1% SDS洗涤两次,用6 M尿素洗涤两次,用50 mM Tris pH 8洗涤一次,用0.1% (w/v)吐温20洗涤一次,用水洗涤一次。然后在100 mM DTT中轻轻搅动孵育20分钟,然后在100 mM碘乙酰胺中轻轻搅动孵育20分钟。水洗3次后,加入上样缓冲液,用12% SDS-PAGE分离蛋白。Sypro Ruby染色显示凝胶中标记蛋白。 The visualized protein bands were excised and placed into 1.5 ml Eppendorf tubes. The slices were washed with 500 ml of 100 mM ammonium bicarbonate (Sigma) twice for 15 min. Proteins were reduced with Tris(2-carboxyethyl)-phospine (Sigma) for 30 min at 62 ° C and alkylated with 55 mM iodoacetamide for 30 min at room temperature. Gel fragments were washed three times for 15 min in 50:50 acetonitrile: 100 mM ammonium bicarbonate and dehydrated with 50 μl of 100% acetonitrile. Acetonitrile was removed and gel fragments were dried using an Eppendorf SpeedVac for 5 minutes. Gel slices were incubated in 25 mM ammonium bicarbonate and 10 ng μL-1胰酶在37°C下过夜。将上清转移到新的试管中,凝胶切片在室温下用5%甲酸处理15分钟,使胰蛋白酶失活。凝胶切片用100%乙腈洗涤3次,持续5分钟。所有上清液混合并在Eppendorf SpeedVac中浓缩至约10 μl的最终体积。使用Thermo Scientific LTQ XL质谱仪分析胰蛋白酶肽,根据[53].
结果
plcps和vpes是叶子中主要衰老诱导的基因
为了筛选与叶片衰老有关的蛋白酶,我们比较了最近发表的叶片发育时间过程中绿色和衰老叶片中拟南芥蛋白酶编码基因的转录水平[54].根据Merops肽酶数据库,我们将这些蛋白酶送入41个蛋白酶家族[7.].平均而言,对于天冬氨酸蛋白酶(氏族AA,Family A1),PLCPS(Clan Ca,Family C1a),VPE(氏族CD,家庭C13,持续衰老叶片(> 1000个千兆,FPKM)中的最高转录水平(每千克/百万,FPKM)。(氏族CA,家族C13)和CLP内肽酶(氏族SK,家庭S14)(附加文件2:图S1A)。我们将注意力集中在VPEs和PLCPs上,因为这些家族包含了最多的衰老诱导蛋白酶基因,而且它们的平均表达变化超过2倍,而且我们有工具来监测它们的活动。
在PLCP C1A组中,转录水平的最大增长是SAG12.那which showed a 1934-fold induction, dominating the PLCP transcript levels at 2145 ± 690 FPKM (Additional file2:图S1B和附加文件3.:表S1),与SAG12.是一个主要的衰老特异性标记基因[18.-20].除了SAG12.衰老叶片中的转录水平也很高,诱导的转录水平是正常叶片的两倍以上RD21A(3.。7.-fold, 945 ± FPKM),CTB3.(9.5倍,427±108 FPKM),RD19A.(2.1倍,814±73 FPKM),RD19C.(2.6倍,1038±42 fpkm)和AALP(3.0倍,721±96 FPKM)(附加文件2:图S1B和附加文件3.:表S1)。然而,在总的mRNA水平上,转录产物RD21A,SAG12,RD19A,RD19C,AALP和CTB3.在衰老叶片的PLCP转录组中占优势。所有的转录水平VPE.在衰老过程中,基因会上调,但只有γ汽相外延转录物在调节叶片的转录组中相对较高(963±100 fpkm)(附加文件2:图S1B和附加文件3.:表S1)。
叶片衰老使PLCP活性升高,VPE活性降低
为了在拟南芥中诱发衰老,通过用铝箔覆盖长达七天的叶片,我们在大约8周龄拟南芥植物(分别生长在12/12和8/16小时/夜光循环中,我们单独变暗的叶子55] (无花果。1a).铝箔内衬深色塑料,叶子仍然附着在植物上。每棵植物都选择了大小和年龄大致相同的5到6片最大的叶子来覆盖。这个系统类似于自然界的遮荫,诱导叶绿素和Rubisco大亚基的自然降解(图。1B和C.). 在这些条件下,衰老标记基因的表达SAG12.和SGR1.(保持绿色基因1,[56)诱导(图。1d),证明这种治疗诱导古典衰老计划。我们使用这些单独变暗的叶子进行后续实验。
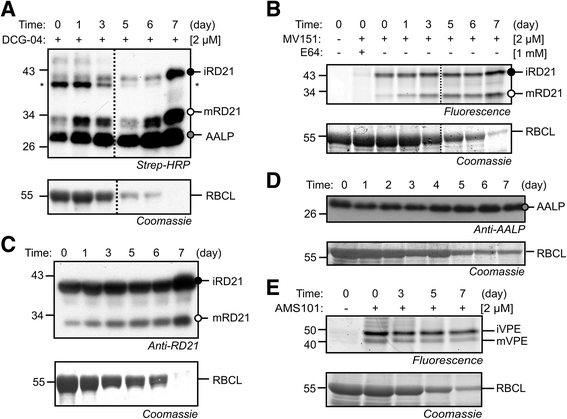
为了研究通过ABPP叶片衰老过程PLCPs的活动,我们单独标记黑暗的叶子叶提取物具有DCG-04的基础上,PLCP抑制剂E-64 [生物素的化学探测器50那57].对生物素化蛋白的检测显示信号在25、30和40 kDa迁移的强度增加,分别代表AALP、成熟(m)和中间(i) RD21A(图)。2a,(43那57])。过量的E-64预孵育阻止了这些蛋白的标记,提示信号代表PLCPs(附加文件2:图S2)。为了确认增加的PLCP标记,我们用MV151标记相同的蛋白质组,MV151是一种荧光探针,可以标记PLCP的一个子集,包括RD21A [43].MV151标记显示的增加的30和40kDA信号的强度分别代表MRD21A和IRD21A(图。2b,(43])。为了研究RD21A和AALP蛋白的积累,我们使用RD21A和AALP抗体进行了西方分析[25那52].与标记增加一致,我们发现RD21A和AALP蛋白也在单独变暗的叶片中积累,伴随着Rubisco大亚基数量的减少(图。2 c和d).
诱导PLCP和降低VPE活性分别使叶片变暗。DCG-04增加(一种)及MV151 (B.)标记衰老过程中的plcp。分别在pH 6.5和pH 4.5条件下用2 μM DCG-04和2 μM MV151标记5小时,用链霉亲和素- hrp (一种)或荧光蛋白通过扫描(B.),分别。*,内源性生物素化蛋白。C,DRD21A的积累(C)和aalp(D.)单独变黑的叶子中的蛋白质。分别使用RD21A和AALP-特异性抗体从蛋白质印迹中分离和检测等鲜重的单独变黑叶片的蛋白质提取物。E.减少了AMS101在单独变暗的叶片中的VPE标记。在PH5.5的2μMAMS101中标记2小时的单独变暗的叶片的叶子提取物,并通过荧光扫描分析。膜的Coomassie污渍(广告)还是蛋白质凝胶(E.)被用作对照,以显示Rubisco(RBCL)的大亚基的降解。虚线(a、b)表示来自Western Blot的删除车道
为了监测单个变暗叶片中VPEs的活性,我们用基于VPEs荧光活性探针AMS101标记叶片提取物[51].AMS101检测到40和43kDA的信号,这可能代表γVPE的未成熟和成熟同种型,因为这导致绿叶中的主要VPE活性(图。2e,(51]), 和γ汽相外延转录水平在衰老叶中显着增加(附加文件2:图S1B)。然而,该信号的强度在衰老期间减少(图。2e)尽管上调了VPE.转录水平。
许多PLCP在Suchescing叶子中增加了活性
为了识别标记有从个别地变暗衰老叶子中提取DCG-04的蛋白质,在0和7天产生的叶的萃取物标记的使用和不使用DCG-04并进行纯化和蛋白凝胶上分离生物素化的蛋白。生物素化的蛋白质大大在丰度在第7天相比天0对照叶子时图增加,大多数信号是在无探针的控制不存在(。3a).八个蛋白带区域被切除,用胰蛋白酶处理,并进行质谱分析。检测从11个PLCPs肽,包括SAG12(图3b).衰老叶片中光谱计数最多的是RD21A,其次是CTB3、AALP、RD21C、RDL2、SAG12、RD19C、ALP2、CTB2、CTB1和RD21B(图2)。3c).值得注意的是,XCP1和XCP2的肽只在绿叶中检测到,而在衰老的叶子中没有检测到(图。3c),与减少的转录水平一致(附加文件2:图S1B)。所有其他检测到的蛋白酶似乎在Sinescing叶中具有更高的活性水平(图。3c).
RD21A和AALP是参培叶中的主导活动PLCP
确认蛋白酶的身份,导致衰老叶的DCG-04活性谱中的主要信号,我们用DCG-04标记了绿色和衰老叶的叶子提取物SAG12-1那RD21A-1那ctb3-1和aalp-1null突变体[42].我们只检测到蛋白酶活性改变RD21A-1和aalp-1突变体(无花果。4).40信号缺失,30 kDa信号明显减弱RD21A-1突变体中缺失25kda信号aalp-1突变,表明这些信号分别是由RD21A和AALP引起的。始终如一,rd21A-1 / aalp-1双突变体缺乏三大信号(图4 b),表明RD21A和AALP是参培叶中的主要PLCP活性,并且其他PLCP没有补偿该双突变体中的PLCP活性降低。重要的是,尽管在这些植物中没有主要的PLCP活动,但鲁米斯科水平的下降不会减少rd21A-1 / aalp-1突变植物(图4 b, 底部)。
PLCP和VPE蛋白酶突变体没有很强的衰老表型
为了研究在个别叶片变黑进一步PLCPs和VPES衰老的贡献,我们受到如下PLCP突变株系衰老检测:RD21A-1那aalp-1那SAG12-1那ctb3-1那rd21A-1 / aalp-1双突变体,和ctb1/ctb2/ctb3三突变体(42那46].我们还在35s启动子的控制下包括RD21A过度表达式(35S :: RD21A,附加文件2:图S3)。此外,我们包括四肢vpe null突变体(qvpe.),没有所有四种vpe [45]γvpe的过度表达源(35s ::γvpe,[44])这可能会在衰老期间防止γVPE下降。
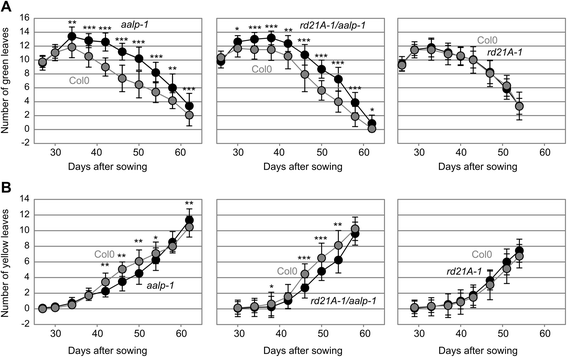
我们在植物在短日条件下持续八周的情况下,在植物生长后七天以七天单独变暗的叶片中的叶绿素比。数据没有显示测试线与其野生型控制之间的任何显着差异(图。5.). 然而,这种衰老试验显示的是单个叶片的衰老,而不是整个植株的衰老。因此,我们将衰老试验扩展到长日照条件下生长的植物(16/8小时昼夜循环),以研究开花时诱导的莲座叶自然衰老。在长日照条件下,我们在发育过程中的不同时间点监测了绿色和衰老叶片的数量。有趣的是aalp-1和rd21A-1 / aalp-1与野生型相比,突变体在发育衰老的早期表现出更多的绿叶和更少的衰老叶。图6a和b).相比之下,其他突变体(rd21A-1, sag12-1, ctb3-1, ctb1/2/3和qvpe.突变体)和过表达RD21A或γVPE(35S :: RD21A和35S ::γVPE)的线在绿色和衰老叶片数量上没有显示出显着差异(附加文件2:图S4)。两者都是这样的事实aalp-1和rd21A-1 / aalp-1变种人,但不是RD21A-1突变体,表明该植株整体衰老表型表明aalp-1突变与衰老表型的延迟发展有关。我们无法确定是否独立aalp-1缺失突变等位基因这种表型的验证。因此,在这个阶段,我们不能排除的衰老表型是由缺少AALP或从辅助,未鉴定突变起源的原因造成的共分离到rd21A-1 / aalp-1双突变体。
讨论
在这项研究中我们发现,虽然帕尔克和γ汽相外延-编码基因在衰老过程中被转录诱导,ABPP探针显示只有PLCPs在单个变暗的拟南芥叶片中活性增加。山田等等。[25研究表明RD21A蛋白水平在拟南芥发育衰老过程中升高。此前,在拟南芥和小麦叶片的发育衰老过程中,利用DCG-04探针也观察到了PLCPs活性的增加[57那58].然而,在衰老拟南芥叶子这些活性蛋白酶的身份以前并不知道。在这项工作中,积极11种蛋白酶纯化和衰老叶片鉴定:RD21A,CTB3,AALP,RD21C,RDL2,SAG12,RD19C,ALP2,CTB2,CTB1和RD21B。四检测PLCPs(SAG12,RD19C,CTB2和CTB1)以前没有被DCG-04标记的绿叶或其他拟南芥器官[检测57那59].我们的数据表明,这些蛋白酶在衰老叶的提取物中是活性的。
我们分析了衰老相关PLCP的突变体γ.VPE蛋白酶对衰老的表型,如单独黑暗的叶绿素含量,绿色和衰老叶片的自然衰老的植株数量。出人意料的是,没有一个突变系的表现在个别叶片变黑任何表型,尽管明显缺乏这些线路的DCG-04标记显示主要蛋白酶活性。下面的几行也没有表现出不发育衰老过程中的任何明显的表型:RD21A-1那SAG12-1那ctb3-1那ctb1/2/3 qvpe 35 s:: RD21A和35 s:γ汽相外延,与以前公布的结果一致sag12和CTB3.突变体[2那45].
该单个PLCP和VPE突变体没有表现出衰老表型的事实,可能是由于蛋白酶之间的冗余。例如,拟南芥CTB.据报道,基因在叶片衰老中有冗余作用,因为只有三重ctb1/2/3突变体在黑暗中培养的离体叶片中表现出延迟衰老[45].然而,在我们的衰老试验中ctb1/2/3突变体没有衰老表型,可能是因为不同的衰老测定诱导不同的调节途径[60].例如,50kDa Rubisco裂解片段仅存在于脱离的叶片和低光下,但不在暴露于高光线的叶片段中,并在N-剥夺对Senesce诱导的完整植物中[16.].叶片衰老也与水损失有关,因此有可能响应响应性RD19A.和RD21A基因[61在黑暗诱导衰老的后期,由于水分的流失而上调,而不是因为它们参与衰老过程本身。
衰老的延迟进展aalp-1和rd21A-1 / aalp-1突变体表明AALP有助于衰老过程。我们的观察与抑制的报告一致AALP花椰菜的同源物延缓小花的衰老[62].AALP是一种类似于哺乳动物组织蛋白-H的预测氨肽酶。该蛋白酶不能用作内肽酶,因为基板结合槽的一侧被源自前植物的小肽阻断,并且通过二硫桥保持共价结合[63]. AALP具有这些特征,因此可能在液泡中的大量蛋白质降解过程中作用于(neo)N-末端。植物衰老的延迟aalp-1无突变体可能是氨基酸可用性不平衡的结果。
结论
衰老的拟南芥叶片中含有大量的Cys蛋白酶,特别是液泡加工酶(VPEs)和类木瓜蛋白酶(PLCPs)。蛋白酶活性分析表明,相对于VPE转录水平的增加,VPE活性没有被诱导。与此相反,衰老叶片的PLCP活性增加,MS和突变体分析表明,这种PLCP活性增加的主要是RD21和AALP。VPE和PLCP突变体和过表达系没有显示改变的rubisco降解或叶绿素比率表型。然而,在全植物衰老试验中,aalp-1和aalp-1 / rd21-1突变体显示出延迟的衰老,表明AALP在发育衰老中的作用。连同,这些数据表明CYS蛋白酶在叶片衰老中发挥冗余作用。
缩写
- AALP:
-
Arabidopsis alleurain样蛋白酶,Alp,含有紫皮兰蛋白酶
- ABPP:
-
基于活性的蛋白质分析
- CTB:
-
组织林B.
- PAO:
-
伯苯酚 - 氧酶
- PLCP:
-
Papain-like半胱氨酸蛋白酶
- RD19:
-
响应于干燥19
- RD21:
-
响应到干燥21
- RDL:
-
RD21样蛋白酶
- SAG12:
-
衰老相关的基因12
- SGR1:
-
入住绿色基因1
- 汽相外延:
-
在液泡加工酶
- XCP:
-
木质部特异蛋白酶
参考
- 1。
谢Q,Michaeli S,Peled-Zehavi H,加利利G.叶绿体降解:一个细胞器,多重降解途径。趋势植物SCI。2015; 20:264-5。
- 2.
Otegui MS,卢YS,马丁内斯DE,维拉佩特罗夫MG,施特赫林LA,Amasino RM,Guiamet JJ。以强烈的蛋白水解活性衰老相关的液泡中的拟南芥,大豆叶片发展。植物杂志2005; 41:831-44。
- 3.
Wada S,Ishida H,Izumi M,Yoshimoto K,Ohsumi Y,Mae T,Mae T,Makino A. Autophagy在单独变暗的叶片中衰老期间在叶绿体降解中起作用。植物理性。2009; 149:885-93。
- 4.
王S,Blumwald E.通过独立于自噬和衰老相关的液泡的方法调节拟南芥中的应力诱导的叶绿体降解。植物细胞。2014; 26:4875-88。
- 5.
斯普林格A,康C,Rustgi S,冯的Wettstein d,Reinbothe C,珀尔曼S,叶片衰老过程Reinbothe S.编程叶绿体破坏涉及13-脂肪氧合酶(13-LOX)。国家科学院院刊美A. 2016; 113:3383-8。
- 6.
Bhalaerao R,Keskitalo J,Sterky F,Erlandsson R,BjörkbackaH,Birve SJ,Karlsson J,GardeströmP,Gustafsson P,Lundeberg J,Jansson S.基因表达在秋叶。植物BIOL。2003; 131:430-42。
- 7.
罗林斯ND,巴雷特AJ,芬兰人R.二十多年的蛋白水解酶,它们的底物和抑制剂的MEROPS数据库。核酸研究。2016; 44:D343-50。
- 8。
Diaz I,Martinez M.植物C1A半胱氨酸肽酶萌发和衰老。在:罗林斯ND,Salvesen G,EDS,蛋白水解酶的手册。阿姆斯特丹:学术出版社,elestvier。2013. PP 1853-1858
- 9。
Roberts In,Caputo C,Criado MV,Funk C.植物中的衰老相关蛋白酶。physiol植物。2012; 145:130-9。
- 10。
Gepstein S,Sabehi G,鲤鱼MJ,Hajouj T,内舍MF,Yariv I,多尔C,叶衰老相关基因巴萨尼M.大规模鉴定。植物杂志2003; 36:629-42。
- 11.
郭Y,蔡Z,甘S.转录拟南芥叶片衰老。植物学报2004;27:521-49。
- 12.
菲舍尔AM。衰老的复杂调控。暴击启植物科学。2012; 31:124-47。
- 13
Gregersen PL, Holm PB。小麦旗叶衰老的转录组分析(小麦L.)。Plant Biotechn J. 2006; 5:192-206。
- 14
帕罗特DL,Martin Jm,Fischer Am。大麦分析(大麦芽)叶片衰老和蛋白酶基因表达:一个C1A半胱氨酸蛋白酶家族是在高碳水化合物但中低氮水平的条件下特异性诱导的。新植物醇。2010;187:313–31.
- 15
关键词:小麦,小麦旗叶,衰老,氮素转化,调控基因J Exp Bot. 2014; 65:3963-73。
- 16.
麦叶的衰老:半胱氨酸内肽酶是否参与Rubisco大亚基的降解?植物生理学报。2007;29:339-50。
- 17.
van der Hoorn Ral。植物蛋白酶:从表型到分子机制。Annu Rev植物Biol。2008; 59:191-223。
- 18。
Hensel LL,Grbic V,Baumgarten DA,Bleecker AB.影响植物光合组织寿命和衰老的发育和年龄相关过程拟南芥.植物细胞。1993;5:553 - 64。
- 19。
罗曼·克恩,甘S,阿马西诺·J,阿马西诺·RM,马诺玛·C.植物叶片自然衰老分子分析拟南芥.physiol植物。1994年; 92:322-8。
- 20.
卢三世,Amasino RM。对发育衰老的调节是保守的拟南芥和芸苔栗鸟.植物mol biol。1999; 41:195-206。
- 21.
陈海族,黄迪,侯WC,刘杰,林毅。来自甘薯的粒蛋白半胱氨酸蛋白酶SPCP3的分子克隆与表征(Ipomoea Batatas.)衰老的叶子。植物生理学报。2006;63:863 - 76。
- 22。
陈慧娟,苏春春,林超,黄国杰,林玉华。甘薯半胱氨酸蛋白酶SPCP2的表达改变了转基因拟南芥植株的发育特性和胁迫反应。acta botanica sinica(植物研究),2010;
- 23。
引用本文:Esteban-García B, Garrido-Cárdenas JA, Alonso DL, García-Maroto甘氨酸最大.J植物理性。2010; 167:1101-8。
- 24。
cocoupe SA, Sinclair BK, Watson LM, Heyes JA, Eason JR.椰菜小花采后衰老脱水反应半胱氨酸蛋白酶的鉴定。J Exp Bot. 2003; 54:1045-56。
- 25
黄志强,王志强,王志强,等。拟南芥叶片中半胱氨酸蛋白酶的成熟机制。植物杂志。2001;127:1626-34。
- 26
菠菜衰老相关半胱氨酸蛋白酶-半胱氨酸抑制素复合物的分子生物学特性。杂志。2011;141:97 - 116。
- 27
Rojo E,MartínR,卡特C,Zouhar J,Pan S,Plotnova J,Jin H,Paneque M,Sánchez-Serrano JJ,Baker B,Ausubel FM,Raikhel NV。VPEγ表现出一种类似的胱天蛋白酶的活性,有助于防御病原体。Curr Biol。2004; 14:1897-906。
- 28.
Hara-Nishimura I,Hatsugai N,Nakaune S,Kuroyanagi M,Nishimura M.真空加工酶:植物细胞死亡的执行者。CurrOp植物BIOL。2005; 8:404-8。
- 29.
Hatsugai N,Kuroyanagi M,Nishimura M,Hara-Nishimura I.一种植物的蜂窝自杀策略:芳啉介导的细胞死亡。细胞凋亡。2006; 11:905-11。
- 30.
Hara-Nishimura I,Hatsugai N.液泡在植物细胞死亡中的作用。细胞死亡差异。2011; 18:1298-304。
- 31.
Kinoshita T,Yamada K,Hiraiwa N,Kondo M,Nishimura M,Hara-Nishimura I.衰老在衰老和各种压力条件下的植物组织的裂解液泡中抑制了真菌。工厂J. 1999; 19:43-53。
- 32.
Muller GL,DRICOVICH MF,ANDREO CS,Lara MV。光合作用的作用及分析在烟草花的寿命终生中涉及初级代谢的关键酶。J Exp Bot。2010; 61:3675-88。
- 33.
半胱氨酸蛋白酶和蛋白酶抑制剂基因在植物细胞程序性死亡调控中的作用。植物细胞。1999;11:431-43。
- 34。
Hayashi Y,Yamada K,Shimada T,Matsushima R,Nishizawa N,Nishimura M,Hara-Nishimura I.一种蛋白酶储存体,用于在表皮细胞的表皮细胞中准备细胞死亡或胁迫拟南芥.植物生理学杂志。2001;42:894-9。
- 35。
Tajima T,Yamaguchi A,Matsushima S,Satoh M,Hayasaka S,Yoshimatsu K,Shioi Y.菠菜叶片衰老相关半胱氨酸蛋白酶 - 胱抑素复合物的生化和分子特征。杂志。2011;141:97 - 116。
- 36。
Diaz-Mendoza M,Arroyo-Velasco B,Gonzalez-Melendi P,Martinez M,Diaz I. C1A半胱氨酸蛋白酶 - 叶片衰老中的相互作用。J Exp Bot。2014; 65:3825-33。
- 37
Prins A,Van Heerden PDR,Olmos E,Kunert KJ,Foyer Ch。半胱氨酸蛋白酶调节烟草蛋白含量和组合物中的烟叶:一种与核糖糖-1,5-双磷酸羧酶/氧酶(Rubisco)囊泡体的动态相互作用的模型。J Exp Bot。2008; 59:1935-50。
- 38
拟南芥AtSerpin1的晶体结构及其与反应于干燥-21 (RD21)的靶蛋白酶的体内相互作用J Biol Chem. 2010; 285:13550-60。
- 39
克雷瓦特男友,赖特AT,科扎里奇JW。基于活性的蛋白质图谱:从酶化学到蛋白质组化学。生物化学学报2008;77:383-414。
- 40.
科洛德齐耶克一世,范德胡恩·拉尔。挖掘植物科学和生物技术中的活性蛋白质组。柯罗平生物技术公司。2010;21:225–33.
- 41.
Morimoto K,Van der Hoorn Ral。基于活性的蛋白质分析在植物科学中的影响。植物细胞生理。2016; 57:446-61。
- 42.
王Z,谷C,科尔比T,新藤T,Balamurugan R,沃达迈H,凯瑟男,范德瓦霍恩RAL。β-内酯探针识别木瓜蛋白酶样肽连接酶在拟南芥.Nat Chem Biol. 2008; 4:557-63。
- 43.
Gu C,Shabab M,Strasser R,Wolters PJ,Shindo T,Niemer M,Kaschani F,Mach L,Van der Hoorn Ral。翻译后调节和贩运粒细胞蛋白酶RD21拟南芥.Plos一个。2012; 7,E32422。
- 44.
Rojo E,Zouhar J,Carter C,Kovaleva V,Raikhel NV。蛋白质加工和降解的独特机制拟南芥.美国国家科学研究院2003;100:7389-94。
- 45.
半胱氨酸蛋白酶液泡加工酶家族的研究进展。植物细胞。2004;16:270 - 90。
- 46。
Mclellan H,Gilroy Em,Yun BW,Birch Pr,Loake GJ。Arabidopsis Codepsin B基因家族中的功能冗余有助于基础防御,过敏反应和衰老。新的Phytolt。2009; 183:408-18。
- 47。
凌Q,黄W,Jarvis P.使用Spad-502仪表来测量叶片叶绿素浓度拟南芥.Photosynth的水库。2011; 107:209-14。
- 48。
莱维S,温格勒A。拟南芥叶片衰老调控的自然变异及其与其他性状的关系。植物细胞环境。2015;28:223–31.
- 49
Balazadeh S, Parlitz S, Mueller-Roeber B, Meyer RC。叶的自然发育变化与植物衰老拟南芥.植物生物学。2008;10:136-47。
- 50.
Greenbaum DC、Baruch A、Grainger M、Bozdech Z、Medzihradszky KF、Engel J、DeRisi J、Holder AA、Bogyo M。恶性疟原虫蛋白酶1在人疟原虫侵入宿主细胞中的作用。科学。2002;298:2002–6.
- 51.
Misas-Villamil JC,Toenges G,Kolodziejek I,Sadaghiani Am,Kaschani F,Colby T,Bogyo M,Van der Hoorn Ral。真空加工酶的活性分析揭示了oomycete感染期间VPE的作用。工厂J. 2013; 73:689-700。
- 52.
艾哈迈德苏,罗乔e,kovaleva v,Venkataraman s,Dombrowski Je,Matsuoka K,Raikhel NV。植物真空分选受体ATELP参与NH(2)含有含有NH(2)的含有含有氨肽的真空蛋白的运输拟南芥.细胞生物学杂志2000;149:1335-44。
- 53.
卡沙尼F、古C、尼森S、胡佛H、克雷瓦特BF、范德胡恩拉尔。未感染葡萄孢菌和未感染葡萄孢菌丝氨酸水解酶活性的多样性拟南芥.细胞蛋白质组学。2009;8:1082-93。
- 54.
Woo HR, Koo HJ, Kim J, Jeong H, Yang IO, Lee IH, Jun JH, Choi SH, Park SJ, Kang B, Kim YW, Phee BK, Kim JH, Seo C, Park C, Kim SC, Park S, Lee B, Lee S, Hwang D, Nam HG, Lim PO。拟南芥叶片衰老的时间和器官间转录组协调程序。植物杂志。2016;171:452 - 67。
- 55.
韦弗LM,阿马西诺RM。衰老在单个变暗的拟南芥叶片中被诱导,但在整个变暗的植株中被抑制。植物杂志。2001;127:876 - 86。
- 56.
Aubry S, Mani J, Hörtensteiner S.保持绿色蛋白,孟德尔绿色子叶突变体的缺陷,独立和上游的phobide一种含氯蛋白分解代谢途径的氧气。植物mol biol。2008; 67:243-56。
- 57.
Van der Hoorn RAL,Leeuwenburgh MA,Bogyo M,Joosten MH,Peck SC.植物中木瓜蛋白酶样半胱氨酸蛋白酶的活性分析。植物生理学。2004;135:1170–8.
- 58。
Martínezde,Bartoli CG,Grbic V,Guiamet JJ。小麦的真空半胱氨酸蛋白酶(小麦L.)是常见的不同因素诱导的衰老。J Exp Bot。2007; 58:1099-107。
- 59。
Richau KH、Kaschani F、Verdoes M、Pansuriya TC、Niessen S、Stüber K、Colby T、Overkleeft HS、Bogyo M、Van der Hoorn RAL。植物木瓜蛋白酶样半胱氨酸蛋白酶的亚类化和生化分析显示出亚家族特异性。植物生理学。2012;158:1583–99.
- 60。
范德格拉夫E,Schwacke R,施耐德A,德西蒙男,喜草UI,发展和诱发叶片衰老过程拟南芥膜转运和激素途径的孔泽R.转录分析。植物理性。2001; 141:776-92。
- 61.
关键词:干旱,干旱,基因,分子标记,分子生物学拟南芥:一种编码推定跨膜通道蛋白的一种cDNA克隆的序列分析。植物细胞生理。1993年; 33:217-24。
- 62.
Eason JR, Ryan DJ, Watson LM, Hedderley D, christy MC, Coupe SA。抑制半胱氨酸蛋白酶,糊朊蛋白,延缓小花衰老Brassica oleracea.. 植物分子生物学。2005;57:645–57.
- 63.
Vasiljeva O,Dolinar M,Turk V,Turk B.重组人组织蛋白酶H缺乏迷你链是一种内肽酶。生物学习。2003; 42:13522-8。
致谢
我们要感谢原西村Ikuko博士提供RD21A抗体;Natasha Raikhel博士检测AALP抗体和35S::γVPE线;请达伦·格鲁伊斯医生qvpe.四极变异;加里·洛克医生提供的ctb1/2/3三突变体;Dr. Hermen Overkleeft提供DCG-04和MV151;感谢马修·博乔医生提供了AMS101。
资金
这项研究由Humboldt基金会,Marie Curie Prodoctoral奖学金,Max Planck Society和牛津大学的财务支持。RVDH由ERC Consolidator授予616449'GreenProTaess'的支持,AP和AHM由澳大利亚研究委员会(DE120102913; CE140100008; FT110100242)支持。融资机构在研究和撰写稿件中的研究和收集,分析和解释方面没有作用。
可用性数据和材料
将根据要求提供种子和基于活动的探针。
作者的贡献
AP和RvdH设计实验;AP进行的实验;TS选择的T-DNA敲除线;RT进行生长测定;SN和FK进行MS分析;AP,HM和RvdH与其他作者的输入写的稿子。所有作者阅读并认可的终稿。
利益争夺
两位作者宣称他们没有相互竞争的利益。
同意出版物
不适用。
伦理批准和同意参与
不适用。
作者信息
从属关系
相应的作者
附加文件
附加文件1:表S2。
本研究中使用的拟南芥敲除和过度迎膜线。(Doc 32 KB)
附加文件2:图S1。
拟南芥成熟和衰老叶片中蛋白酶编码基因的转录水平。(一种)每种蛋白酶家族分组的基因的FPKM中的转录水平。从GSE43616中提取FPKM中的转录物水平(Woo等,2016),并根据Merops数据库的蛋白酶家族为每种蛋白酶总结。(B.)编码PLCPs(顶部)和VPES(底部)的基因的转录水平。显示的是在成熟的绿色叶子的转录水平(左,16D + 18D),衰老叶片(中间,28D + 30D)和绿色叶子衰老之间的比率(右)。误差棒代表(N = 4)样品的标准偏差(STDEV)。图S2。E-64抑制DCG-04标记的成熟和衰老叶片。单独地变暗叶等于鲜重的叶提取物用2μME-64进行30分钟分别预温育,然后在pH 6.5的标记5小时,用2μMDCG-04和使用链霉亲和素-HRP或荧光扫描进行检测生物素化的蛋白质,.*,内源性生物素的蛋白质。图S3。转基因拟南芥35S::RD21的特性。将携带35S::RD21的pRH628转化的col0植株的纯合子后代与野生型(col0)和两株进行了比较RD21敲除突变体:rd21-1和rd21-2.用DCG-04标记叶片提取物,用链霉亲和素- hrp进行蛋白印迹检测生物素化蛋白。图S4。其他PLCP/VPE突变体和过表达系的自然衰老没有改变。长日生长的野生型和突变型植株在不同时间点的绿叶数。误差棒表示n=16个生物重复的STDEV。(PDF 469 kb)
附加文件3:表S1。
不衰老和衰老叶片中蛋白酶的转录水平(XLSX(24 kb)
权利和权限
开放存取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Pružinská,A.,Shindo,T.,Niessen,S。等等。主要CYS蛋白酶的活动对单独变暗的拟南芥叶片衰老至关重要。植物生物学17日,4(2017)。https://doi.org/10.1186/s12870-016-0955-5
收到了:
公认:
发表:
关键词
- 衰老
- 基于活性的蛋白质分析
- 像素类似的蛋白酶
- 液泡加工酶