- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发布:gydF4y2Ba
microRNA 157目标gydF4y2BaSPLgydF4y2Ba基因调控棉花花器官大小和胚珠的产生gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba17.gydF4y2Ba文章编号:gydF4y2Ba7gydF4y2Ba(gydF4y2Ba2017gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
microrna (mirna)参与了多种植物发育过程的调控。在棉花中,很少有mirna在花器官发育中被很好地描述。花器官是影响棉花产量的关键因素,需要对花器官进行精细调节。因此,mirna在调控花器官发育中的作用值得深入研究。本文报道了miRNA156/157在棉花花器官大小调控中的作用。gydF4y2Ba
结果gydF4y2Ba
Ghmirna157前体在棉花上过度表达(gydF4y2Bagossypium hirsutumgydF4y2Ba)抑制细胞增殖和伸长,导致花器官变小,胚珠减少,种子产量下降。五个gydF4y2BaSQUAMOSA promoter-binding蛋白质像gydF4y2Ba(gydF4y2BaSPLgydF4y2Ba)基因经RNA连接酶介导的cDNA末端快速扩增方法鉴定为GhmiRNA157的靶基因,并以mir157为靶点的表达量为靶点gydF4y2BaGHSPL.gydF4y2BaS在MIR157过表达线中减少,表明MIR157的存在/gydF4y2BaSPLgydF4y2Ba棉花轴。两个疯子箱基因,orthologsgydF4y2BaAtAGL6gydF4y2Ba和gydF4y2BaSITDR8.gydF4y2Ba与花器官开发和生殖生产相关的,在MIR157过表达线上被压抑。此外,疾病诱导型基因也被下调,并通过DR5 ::可视化的生长素信号gydF4y2Ba格斯gydF4y2Ba记者在miR157过表达线中衰减。gydF4y2Ba
结论gydF4y2Ba
我们的结果表明MIR157 /gydF4y2BaSPLgydF4y2Ba轴通过调控MADS-box基因和生长素信号转导来控制花器官的生长和胚珠的产生。本研究进一步阐明了棉花花器官发育的机理,为提高棉花产量提供了有益的分子基础。gydF4y2Ba
背景gydF4y2Ba
种子数是作物产量的重要因素。因为种子源自受精胚珠,所以花器器官的发育,尤其是患有胚珠的雌蕊直接影响最终的种子数。虽然环境因素可以调节花器官的发展,但内在机制控制了花卉器官的最终尺寸[gydF4y2Ba1gydF4y2Ba].gydF4y2Ba
建立了共同原始原始后,器官生长可分为两阶段:细胞分裂,然后进行细胞扩张[gydF4y2Ba2gydF4y2Ba- - - - - -gydF4y2Ba5gydF4y2Ba].许多基因,如转录因子gydF4y2BaGRFS / GIFgydF4y2Ba和gydF4y2BajgydF4y2Ba,细胞色素p450(gydF4y2BaKLUgydF4y2Ba),泛素受体gydF4y2BaDA1.gydF4y2BaE3泛素连接酶gydF4y2BaDA2.gydF4y2Ba和gydF4y2BaBBgydF4y2Ba,调节细胞增殖率或控制增殖滞留的时间,以维持正常的细胞数和最终器官尺寸[gydF4y2Ba6gydF4y2Ba- - - - - -gydF4y2Ba10.gydF4y2Ba].其他基因,如转录因子bHLH和中介复合物亚基8,通过调节细胞膨胀率来控制细胞面积,从而影响器官的大小和形状[gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba12.gydF4y2Ba].gydF4y2Ba
此外,据报道,茉莉酸、赤霉素、油菜素内酯和细胞分裂素等激素参与了器官大小的调控网络[gydF4y2Ba3.gydF4y2Ba- - - - - -gydF4y2Ba5gydF4y2Ba,gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba14.gydF4y2Ba].生长素在花器官的大小和发育中起着非常重要的作用。生长素信号直接诱导基因表达gydF4y2Ba涉及器官尺寸的生长素调节基因gydF4y2Ba(gydF4y2Baargos.gydF4y2Ba),进一步推动下游基因转录因子gydF4y2BaAINTEGUMENTAgydF4y2Ba(gydF4y2Ba蚂蚁gydF4y2Ba)[gydF4y2Ba15.gydF4y2Ba].表达的gydF4y2Baargos.gydF4y2Ba或者gydF4y2Ba蚂蚁gydF4y2Ba能延长细胞分裂的时间,从而产生更大的叶和花器官和更多的种子gydF4y2Ba拟南芥gydF4y2Ba.相反,突变的gydF4y2Baargos.gydF4y2Ba或者gydF4y2Ba蚂蚁gydF4y2Ba减少了最终的器官大小和种子数量[gydF4y2Ba15.gydF4y2Ba- - - - - -gydF4y2Ba17.gydF4y2Ba].此外,gydF4y2Ba小生长素上升RNAgydF4y2Ba(gydF4y2BaSaur.gydF4y2Ba)通过养肝诱导促进细胞伸长和最终器官尺寸[gydF4y2Ba18.gydF4y2Ba].一些生长素反应因子介导了生长素的转录反应,调控花器官的大小和发育。gydF4y2BaARF8gydF4y2Ba被报道通过与bHLH转录因子的相互作用抑制花瓣细胞增殖、细胞伸长和最终花瓣大小[gydF4y2Ba19.gydF4y2Ba].gydF4y2BaARF2gydF4y2Ba可以抑制gydF4y2Ba蚂蚁gydF4y2Ba限制细胞增殖和器官大小的转录[gydF4y2Ba20.gydF4y2Ba].除了控制花器官尺寸外,疾病还规定了花卉器官的正常发展。在生长素生物合成和运输中有缺陷的突变体中,雌蕊是卵巢减少或瓣膜组织的薄而圆形的茎,表明植物素是早期建立Carpel原始的必要条件[gydF4y2Ba21.gydF4y2Ba].gydF4y2Ba国会议员gydF4y2Ba(gydF4y2BaARF5gydF4y2Ba),介导生长素信号转导,通过调控胚珠原基形成gydF4y2Ba蚂蚁gydF4y2Ba,gydF4y2BaCUC1.gydF4y2Ba和gydF4y2BaCUC2.gydF4y2Ba表达 [gydF4y2Ba22.gydF4y2Ba].gydF4y2Ba
疯狂箱基因是花器官分化和发展的主要参与者。来自Mikc型Mad-Box基因的花卉归气蛋白形成组合季度复合物,以控制不同的花动器官的分化,用于解释ABC(D)E型的原理[gydF4y2Ba23.gydF4y2Ba,gydF4y2Ba24.gydF4y2Ba].除了花器官的特性外,mic型MADS-box基因还通过调节细胞分裂和扩张来控制花器官的大小和形状[gydF4y2Ba25.gydF4y2Ba].通过染色质免疫沉淀(ChIP),许多生长调节基因被证明是MADS-box转录因子的靶点[gydF4y2Ba26.gydF4y2Ba- - - - - -gydF4y2Ba28.gydF4y2Ba].例如E类MADS-box基因(SEP3)可以直接结合gydF4y2BaGRF.gydF4y2Ba基因和gydF4y2BajgydF4y2Ba基因,调节细胞分裂。此外,疯子箱转录因子与其他转录因子相互作用,例如ARF2和SPL8 [gydF4y2Ba29.gydF4y2Ba].gydF4y2Ba
三个疯箱转录因子基因,gydF4y2BaApetala1.gydF4y2Ba(gydF4y2BaAP1.gydF4y2Ba),gydF4y2BaFruitfull.gydF4y2Ba(gydF4y2Ba富裕gydF4y2Ba), 和gydF4y2Ba常量过表达抑制因子1gydF4y2Ba(gydF4y2BaSOC1gydF4y2Ba),直接由mir156 /157靶向诱导gydF4y2BaSPLS.gydF4y2Ba[gydF4y2Ba30.gydF4y2Ba- - - - - -gydF4y2Ba32.gydF4y2Ba].通过促进gydF4y2BaAP1.gydF4y2Ba,gydF4y2Ba富裕gydF4y2Ba和gydF4y2BaSOC1gydF4y2Ba表达,mir156 / 157-targetedgydF4y2BaSPLS.gydF4y2Ba可以加速相转变。不同的mir156 / 157目标gydF4y2Ba奥斯普尔gydF4y2Ba据报道据报道,调节分蘖和穗架和粒度在水稻中[gydF4y2Ba33.gydF4y2Ba- - - - - -gydF4y2Ba36.gydF4y2Ba].与miR157s高度相似的MiR156s统称为miR156/157家族。许多研究报道miR156/157家族可以调节根系发育,增加对热盐胁迫的耐受性,促进毛状体分布和地上部再生能力[gydF4y2Ba37.gydF4y2Ba- - - - - -gydF4y2Ba40.gydF4y2Ba].在这里,我们鉴定了miR156/157家族通过过度表达miR157前体在棉花花器官生长和胚珠产生中的另一个作用。至少5个mir156 /157靶向gydF4y2BaSPLS.gydF4y2Ba和两个疯狂的转录因子,这是orthologsgydF4y2BaAtAGL6gydF4y2Ba和gydF4y2BaSITDR8.gydF4y2Ba,在过表达线上被下调。同时,在MiR157过表达线中衰减了植物素信令。我们假设mir157 /gydF4y2BaSPLgydF4y2Ba轴可能调控MADS-box转录因子,影响生长素信号转导,最终调控花器官的生长和胚珠的产生。gydF4y2Ba
结果gydF4y2Ba
GHMIR157在棉花减少的花尺寸和种子生产和改变植物建筑中的过度表达gydF4y2Ba
MiR156/157家族是植物界最保守的miRNA家族之一,在植物发育中具有多种功能[gydF4y2Ba41.gydF4y2Ba,gydF4y2Ba42.gydF4y2Ba].通过小RNA测序,在棉花中分析了GhmiR156/157家族[gydF4y2Ba43.gydF4y2Ba- - - - - -gydF4y2Ba46.gydF4y2Ba].gydF4y2Ba
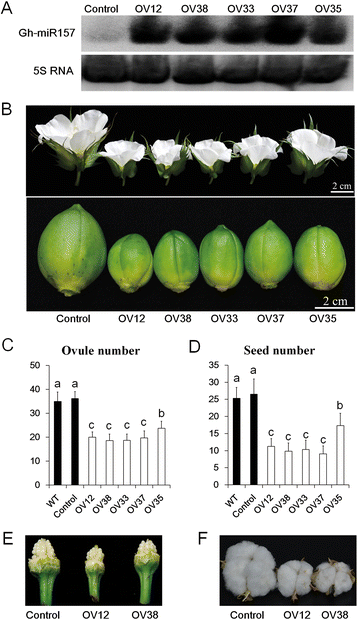
为了进一步分析GhmiR156/157家族在棉花中的功能,我们选择了GhmiR156/157家族中丰度最高的一个GhmiR157进行分析,然后克隆了一个含有miR157前体的372 bp基因组序列gydF4y2Bagossypium hirsutumgydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba)使用预测的参考序列gydF4y2BaGossypium raimondii.gydF4y2Ba[gydF4y2Ba46.gydF4y2Ba].过度表达gydF4y2Baghmir157gydF4y2Ba,我们使用35S启动子驱动miR157前体,并将构建物转移到YZ1 (gydF4y2Bagossypium hirsutumgydF4y2Ba).获得了七种转型体(附加文件gydF4y2Ba2gydF4y2Ba),其中五个显着增加了成熟的miR157表达水平(图。gydF4y2Ba1AgydF4y2Ba).与非转基因植物(对照)相比,过表达线(OV12,33,35,37,38)显示出更强的营养生长活力并产生更多的蔬菜分支和叶子(附加档案gydF4y2Ba3.gydF4y2Ba).然而,来自过表达线的开花和棉铃的尺寸特别小(图。gydF4y2Ba1B.gydF4y2Ba和额外的文件gydF4y2Ba4gydF4y2Ba此外,与对照相比,过表达品系每子房胚珠数显著减少,进一步导致过表达品系每铃种子数减少(图2)。gydF4y2Ba1氟gydF4y2Ba和额外的文件gydF4y2Ba4gydF4y2BaD, F)。因此,我们得出结论,过度表达gydF4y2Baghmir157gydF4y2Ba改变了植物架构和急剧增强容量。gydF4y2Ba
过度表达的gydF4y2Baghmir157gydF4y2Ba前体导致小花和更少的种子。gydF4y2Ba一个gydF4y2Ba花卉芽中成熟miR157表达的Northern印迹分析用作RNA负载控制。gydF4y2BabgydF4y2Ba开放花和30 DPA铃图像。gydF4y2BacgydF4y2Ba和gydF4y2BadgydF4y2Ba每颗子房的胚珠数和每颗铃的种子数。不同的字母表示在统计学上有显著差异gydF4y2BaPgydF4y2Ba基于方差分析(ANOVA) < 0.05 (Tukey的多重比较检验)。误差棒表明至少20个生物重复的标准偏差。gydF4y2BaegydF4y2Ba和gydF4y2BafgydF4y2Ba摘除瓣和成熟铃后的卵巢图像。OV12, 38, 33, 37和35,35S::gydF4y2Baghmir157gydF4y2Ba转基因线。对照,从35S分离的非转基因植物::gydF4y2Baghmir157gydF4y2Ba转基因线。野生型(gydF4y2Bagossypium hirsutumgydF4y2Ba简历。YZ1)gydF4y2Ba
棉花GhmiR157过表达抑制花器官发育gydF4y2Ba
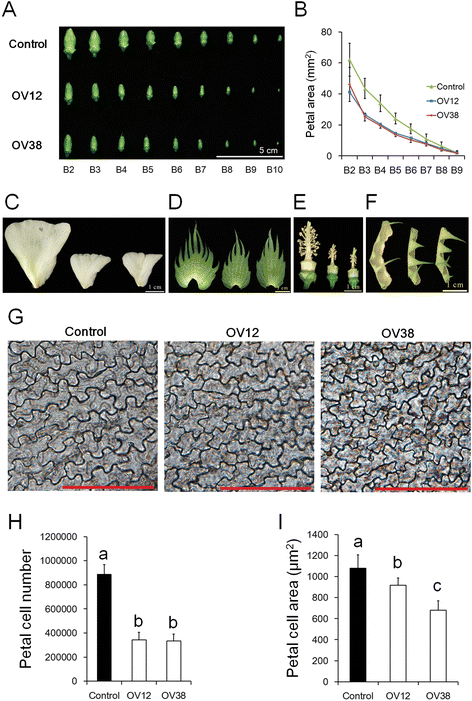
由于在过表达品系中,开放的花朵尺寸明显较小,因此我们进一步比较了OV12、OV38和对照在不同发育阶段的花蕾尺寸(图3)。gydF4y2Ba2AgydF4y2Ba).当第一分支上的第一节点花打开时,我们按顺序将第一节点芽从第二分支(B2)中的第一节点芽进行采样到第十分支(B10)。因此,来自不同分支的芽在不同的发育阶段。结果表明,在非常早期的出苗(B10)时,OV12和OV38的花蕾的尺寸变得越来越小。花瓣大小的运动学分析还表明,在花芽出苗后,在OV12和OV38中捕获花瓣发育(图。gydF4y2Ba2B.gydF4y2Ba).除了花瓣,其他花器官,包括苞片,萼片,柱头和雄蕊,也被检查。在过表达线中,开放花的苞片、萼片和花瓣的面积较小(图。gydF4y2Ba2 c, d, fgydF4y2Ba, 桌子gydF4y2Ba1gydF4y2Ba和额外的文件gydF4y2Ba4gydF4y2BaG)。在过表达线中,花药数和颗粒长度也更小(图。gydF4y2Ba2egydF4y2Ba, 桌子gydF4y2Ba1gydF4y2Ba和额外的文件gydF4y2Ba4gydF4y2BaG).这些数据表明,在过表达系中,花器官的四个轮的发育受到抑制。由于细胞数量和细胞大小都是最终器官大小的决定因素,因此我们对成熟花瓣正面的表皮细胞进行了研究。gydF4y2Ba2胃肠道gydF4y2Ba).过表达细胞株的细胞数较低,细胞体积较小,表明过表达细胞株的细胞增殖和扩张受到抑制。gydF4y2Ba
过度表达gydF4y2Baghmir157gydF4y2Ba抑制花器官发育。gydF4y2Ba一个gydF4y2Ba开发从不同的果子分支的花卉芽的图象。gydF4y2BabgydF4y2Ba开发花瓣区的运动学分析。gydF4y2BacgydF4y2Ba-gydF4y2BafgydF4y2Ba花瓣的图像(gydF4y2BacgydF4y2Ba),苞片(gydF4y2BadgydF4y2Ba)、雄蕊及雌蕊(gydF4y2BaegydF4y2Ba)和萼片(gydF4y2BafgydF4y2Ba),从开放的管制花(gydF4y2Ba左gydF4y2Ba), OV12 (gydF4y2Ba中间gydF4y2Ba)及OV38 (gydF4y2Ba对gydF4y2Ba)植物。g成熟花瓣正面表皮细胞图像。比例尺,100 μm。gydF4y2BahgydF4y2Ba和gydF4y2Ba我gydF4y2Ba成熟花瓣细胞的数量(gydF4y2BahgydF4y2Ba)和成熟的花瓣细胞区域(gydF4y2Ba我gydF4y2Ba).B2-B10代表了从第二个到第十果枝的显影花蕾的位置。对照,从35S分离的非转基因植物::gydF4y2Baghmir157gydF4y2Ba棉花中的转基因品系。OV12和OV38, 35S::gydF4y2Baghmir157gydF4y2Ba棉花中的转基因品系。不同的字母表示在统计学上有显著差异gydF4y2BaPgydF4y2Ba基于方差分析(ANOVA) < 0.05 (Tukey的多重比较检验)。误差条表示至少八个生物学重复的标准偏差gydF4y2Ba
Arabidopsis中GHMIR157前体的异位表达也被逮捕了花发育gydF4y2Ba
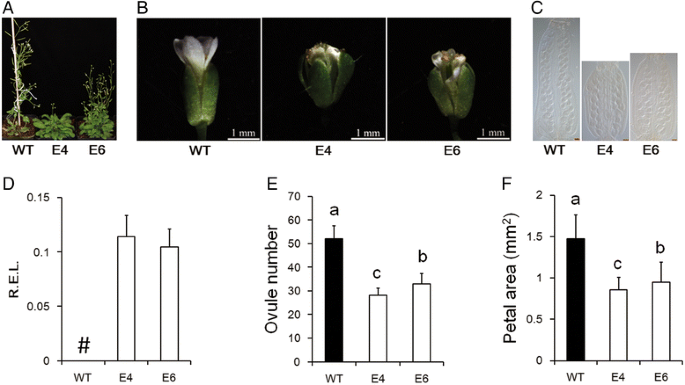
MiR156 / 157家族在植物王国中受到高度保守[gydF4y2Ba47.gydF4y2Ba].为了验证MIR157在花器官发展中的功能是否在其他物种中是普遍的,GHMIR157前体在术中表达gydF4y2Ba拟南芥gydF4y2Ba.对两个成功的异位表达系(E4和E6)进行了分析,转基因系显示miRNA157前体高表达(图1)。gydF4y2Ba3dgydF4y2Ba).与野生型相比,E4和E6具有更多的玫瑰花叶(图。gydF4y2Ba3AgydF4y2Ba),花器官大小,特别是花瓣,在E4和E6中变小。gydF4y2Ba3 b和fgydF4y2Ba).与此同时,E4和E6雌蕊较短,胚珠含量较少。gydF4y2Ba3 c和egydF4y2Ba).因此,GHMIR157中的异位表达gydF4y2Ba拟南芥gydF4y2Ba几乎在棉花中复制了表型,这表明MIR156 / 157家族在花器官发展中的功能在棉花之间保守gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba
GhmiR157前体异位表达gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba表型为35s ::gydF4y2Baghmir157gydF4y2Ba转基因线gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2BabgydF4y2Ba和gydF4y2BacgydF4y2Ba舞台13阶段花和鹅卵石的表型。规模棒(gydF4y2BacgydF4y2Ba), 100μm。gydF4y2BadgydF4y2BaGhmiR157前体在花序中的相对表达。#表示无表达式。r.e.l.,计算的相对表达水平gydF4y2BaAtact7.gydF4y2Ba(AT5G09810.1)作为控制。误差棒表示四个生物重复的标准偏差。gydF4y2BaegydF4y2Ba和gydF4y2BafgydF4y2Ba每卵巢的卵子数量(gydF4y2BaegydF4y2Ba)和花瓣区(gydF4y2BafgydF4y2Ba).不同的字母表示在统计学上有显著差异gydF4y2BaPgydF4y2Ba基于方差分析(ANOVA) < 0.05 (Tukey的多重比较检验)。误差柱(gydF4y2BaegydF4y2Ba和gydF4y2BafgydF4y2Ba)表示至少15个生物重复的标准偏差。E4、E6表示35S::gydF4y2Baghmir157gydF4y2Ba转基因线gydF4y2Ba拟南芥gydF4y2Ba
GhmiR157在棉花中过表达降低了雌性的育性gydF4y2Ba
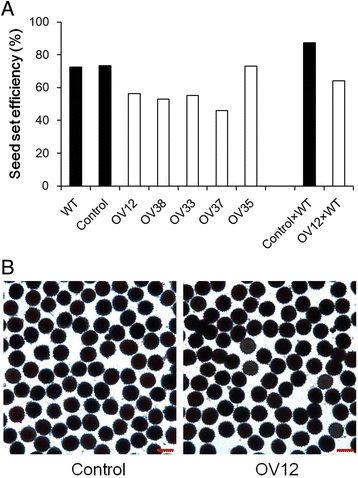
因为过度表达gydF4y2Baghmir157gydF4y2Ba阻滞花器官发育,评估配子生育是否受到影响。因此,我们首先在田间检测了野生型、对照和过表达系的结实率。野生型和对照的结实率约为70%,但过表达系(除OV35外)的结实率降低了46 ~ 56%(图3)。gydF4y2Ba4AgydF4y2Ba),表明在过表达线中有缺陷的配子生育能力。为了确定女性或男性生育能力是否在过表达系中有缺陷,然后我们在温室中使用野生型花粉对授粉控制和OV12植物。在对照×WT植物中,种子设定效率约为87%,但在OV12×WT植物中减少至64%,证明在过表达线中减少了雌性生育率(图。gydF4y2Ba4AgydF4y2Ba).然后用2,3,5-三苯基四唑氯盐测定花粉活力,但对照与OV12无明显差异(图3)。gydF4y2Ba4B.gydF4y2Ba).因此,非雄性不育性的降低导致了过表达系结实率的降低和最终种子数的减少。gydF4y2Ba
35秒的生育试验::gydF4y2Baghmir157gydF4y2Ba转基因线。gydF4y2Ba一个gydF4y2Ba结实率计算(100% ×种子/胚珠)。gydF4y2BabgydF4y2Ba用2,3,5-三苯基四唑氯染色的花粉图像。对照,从35S分离的非转基因植物::gydF4y2Baghmir157gydF4y2Ba转基因线。OV12, 38, 33, 37和35,独立35S::gydF4y2Baghmir157gydF4y2Ba转基因线。野生型(gydF4y2Bagossypium hirsutumgydF4y2Ba简历。YZ1)。对照×wt和ov12×wt表明植物在温室中用野生型花粉与野生型花粉授粉gydF4y2Ba
开发花蕾的RNA测序分析gydF4y2Ba
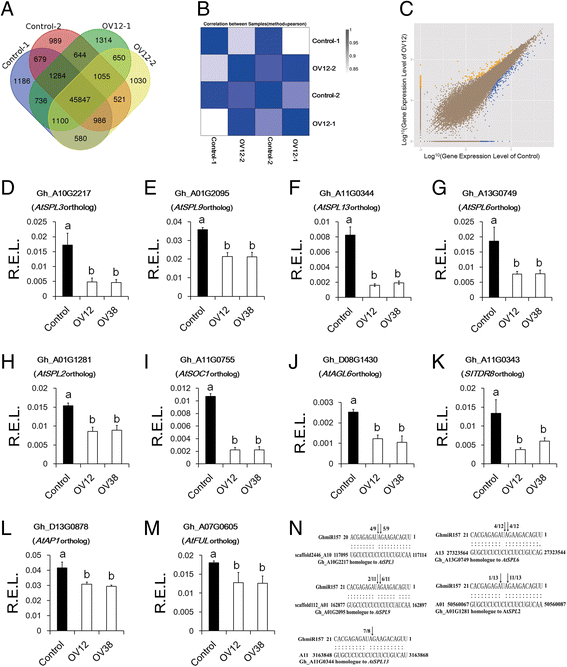
探索如何表达gydF4y2Baghmir157gydF4y2Ba通过rna测序鉴定过表达系(OV12)与对照之间的差异表达基因。由于Control和OV12在极早羽化时花芽大小不同,因此取花芽(长度≤2mm)进行rna测序分析。从OV12和Control(附加文件)的两个生物重复库中生成了大约1200万个干净读取gydF4y2Ba5gydF4y2Ba).所有清洁读数的超过85%可以映射到棉花基因组[gydF4y2Ba48.gydF4y2Ba[来自OV12和对照植物的文库中,在文库中表达52,005至52,398个基因(附加文件gydF4y2Ba5gydF4y2Ba).所有文库中有45,847个基因表达,Control和OV12中分别只有679和650个基因特异表达(图2)。gydF4y2Ba5AgydF4y2Ba).在OV12和对照的两个生物重复之间的基因表达水平的相关性大于0.97,表明生物重复是可信的(图。gydF4y2Ba5B.gydF4y2Ba).为了筛选控制和OV12之间的差异表达基因,我们使用了噪音封装[gydF4y2Ba49.gydF4y2Ba].基因筛选标准为:fold change≥2,divergence probability≥0.8。我们鉴定了539个差异表达基因,其中368个基因在对照中表达上调,而只有171个基因在对照中表达下调gydF4y2Ba6gydF4y2Ba).基于另一种方法,EBSeq包[gydF4y2Ba50.gydF4y2Ba[结果还表明,在对照中发现比在OV12中更高调节的基因(图。gydF4y2Ba5CgydF4y2Ba).gydF4y2Ba
对照与35S ::差异表达基因的RNA测序分析::gydF4y2Baghmir157gydF4y2Ba转基因系列。gydF4y2Ba一个gydF4y2Ba样本间共表达基因的维恩图。gydF4y2BabgydF4y2Ba样本间相关性分析。gydF4y2BacgydF4y2Ba检测对照和35s ::之间的差异表达基因::gydF4y2Baghmir157gydF4y2Ba基于噪声方法的转基因线。黄色图表示对照控制上调的基因,蓝色图表示控制下调基因,棕色图表示没有改变的基因。gydF4y2BadgydF4y2Ba-gydF4y2Ba米gydF4y2Ba花盆中差异表达基因的实时PCR分析。r.e.l.,计算的相对表达水平gydF4y2BaHISTONE3gydF4y2Ba(AF024716)作为控制。误差棒表示四个生物重复的标准偏差。图中不同的字母表示有统计学意义的差异gydF4y2BaPgydF4y2Ba基于方差分析(ANOVA) < 0.05 (Tukey的多重比较检验)。gydF4y2BangydF4y2Ba使用RLM-RACE确定GHMIR157目标。黑色箭头表示目标裂解位点的位置。黑色箭头旁边的数字表示切割频率。对照,从35S分离的非转基因植物::gydF4y2Baghmir157gydF4y2Ba棉花中的转基因品系。OV12和OV38, 35S::gydF4y2Baghmir157gydF4y2Ba棉花转基因品系gydF4y2Ba
在上调的对照基因中,有些是转录因子,如SPL和MAD-BOX基因。有趣的是,所有差异表达gydF4y2BaSPLS.gydF4y2Ba已被预测为GHMIR157的目标,但是非MIR157目标的丰富gydF4y2BaSPLS.gydF4y2Ba在Control和OV12之间没有不同(附加文件gydF4y2Ba6gydF4y2Ba和gydF4y2Ba7gydF4y2Ba).SPL系列有59个成员,可以基于正交基因分为八个亚组gydF4y2Ba拟南芥gydF4y2Ba和八个子组中的五个可以预测为GHMIR157的目标(附加文件gydF4y2Ba8gydF4y2Ba和gydF4y2Ba7gydF4y2Ba).五个gydF4y2BaSPLS.gydF4y2Ba,通过RLM-RACE进一步验证为GhmiR157靶点(图5)。gydF4y2Ba5N.gydF4y2Ba).采用实时荧光定量PCR验证这5种蛋白的丰度gydF4y2BaSPLS.gydF4y2Ba.结果表明,与对照相比,3个gydF4y2BaSPLS.gydF4y2Ba(GH_A10G2217,GH_A11G0344和GH_A13G0749在OV12和OV38中显着下调,以及其他表达水平gydF4y2BaSPLS.gydF4y2Ba(Gh_A01G2095和Gh_A01G1281)在OV12和OV38中略有下降(图3)。gydF4y2Ba5 d - hgydF4y2Ba).这些数据表明GHMIR157目标gydF4y2BaSPLS.gydF4y2Ba通常在过度表达线上被抑制。gydF4y2Ba
MADS-box转录因子基因,如gydF4y2BaATSOC1.gydF4y2Ba,gydF4y2BaAtAP1gydF4y2Ba和gydF4y2BaAtFULgydF4y2Ba的直接调控gydF4y2BaSPLS.gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba30.gydF4y2Ba- - - - - -gydF4y2Ba32.gydF4y2Ba].我们的数据显示,三种疯狂箱转录因子,GH_A11G0755,GH_D08G1430和GH_A11G0343,其是直际gydF4y2BaATSOC1.gydF4y2Ba,gydF4y2BaAtAGL6gydF4y2Ba和gydF4y2BaSITDR8.gydF4y2Ba分别与对照相比,分别在OV12和OV38中显着下调(图。gydF4y2Ba5 i (kgydF4y2Ba).Gh_D13G0878和Gh_A07G0605的水平与gydF4y2BaAtAP1gydF4y2Ba和gydF4y2BaAtFULgydF4y2Ba,OV12和OV38略低于对照(图。gydF4y2Ba5L和M.gydF4y2Ba).相似地,gydF4y2BaAtAP1gydF4y2Ba,gydF4y2BaAtFULgydF4y2Ba,gydF4y2BaATSOC1.gydF4y2Ba, 和gydF4y2BaAtAGL6gydF4y2Ba在35秒内也被下调::gydF4y2BaGhmiR157拟南芥gydF4y2Ba转基因线与野生类型相比(附加文件gydF4y2Ba9gydF4y2Ba).所有数据都表明疯子箱基因,作为GHMIR157目标的候选下游基因gydF4y2BaSPLS.gydF4y2Ba,在过度表达线上被下调。gydF4y2Ba
花芽发育过程中GhmiR157和mir157靶向GhSPLs的表达模式gydF4y2Ba
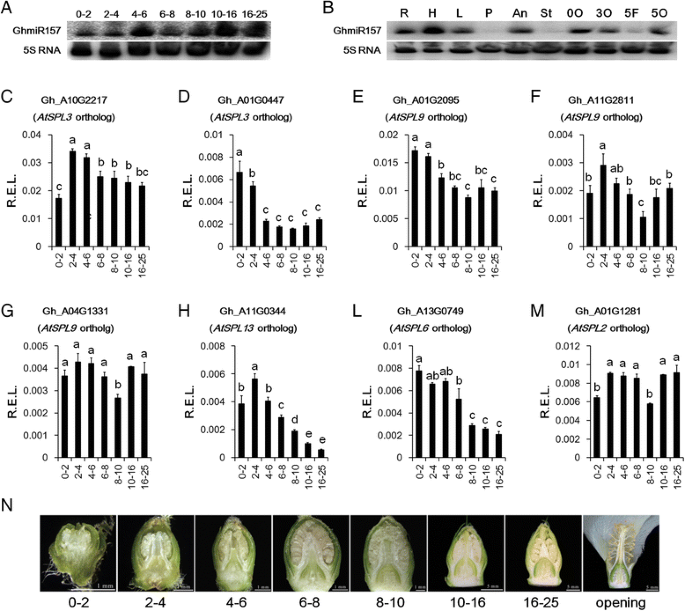
棉花的花器官发展持续大约一个月从花蕾出现到花开口。基于花蕾长度,我们在开花前确定了七个花卉芽开发的阶段(图。gydF4y2Ba6N.gydF4y2Ba).胚珠出现在4-6毫米的花芽阶段。之后,在花朵打开之前,包括差异化的四轮花螺纹,包括差异化的四轮花螺纹的花芽在长度上持续到大约25毫米。GHMIR157表达在0-2 mm和2-4mm阶段非常低,但它在10-16mm和16-25mm阶段的级别高得多。通常,GHMIR157在花器官发展期间增加了丰度(图。gydF4y2Ba6AgydF4y2Ba).在开放的花中,GhmiR157主要在花药和胚珠中表达,表明GhmiR157可能在花药和胚珠成熟过程中发挥作用。在幼苗的根、下胚轴和叶片中也可以检测到高水平的GhmiR157(图。gydF4y2Ba6B.gydF4y2Ba).gydF4y2Ba
qRT-PCR分析GhmiR157gydF4y2BaGHSPL.gydF4y2Ba表达式模式。gydF4y2Ba一个gydF4y2Ba成熟GHMIR157表达的北印迹分析在花器官芽发展阶段。gydF4y2BabgydF4y2BaNorthern blot分析GhmiR157在不同组织中的成熟表达。R、H、L、P、An、St、0O、3O、5f、5O分别代表根、下胚轴、叶、花瓣、花药、柱头、0 DPA胚珠、3 DPA胚珠、5 DPA纤维、5 DPA胚珠。gydF4y2BacgydF4y2Ba-gydF4y2Ba米gydF4y2Ba定量分析gydF4y2BaGHSPL.gydF4y2Ba不同花芽发育阶段的表达。r.e.l.,计算的相对表达水平gydF4y2BaHISTONE3gydF4y2Ba(AF024716)作为控制。误差棒表示三个生物重复的标准偏差。图中不同的字母表示有统计学意义的差异gydF4y2BaPgydF4y2Ba基于方差分析(ANOVA) < 0.05 (Tukey的多重比较检验)。gydF4y2BangydF4y2Ba不同长度(mm)花芽和开花的纵向截面的图像。数字0-2,2-4,4-6,6-8,8-10,10-16,16-25表示不同长度(mm)的花蕾gydF4y2Ba
八个差异表达miR157目标的表达式模式gydF4y2Baghspls.gydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Ba和额外的文件gydF4y2Ba6gydF4y2Ba)在花器官发育过程中进行了分析。在方差分析的基础上,分析了花器官发育阶段间表达水平的显著差异。由于GhmiR157可以触发其靶向mrna的降解,大多数mir157靶向的表达模式gydF4y2Baghspls.gydF4y2Ba在花器官发育过程中呈下降趋势。Gh_A01G0447、Gh_A01G2095、Gh_A11G0344和Gh_A13G0749在花芽发育阶段明显下调(图1)。gydF4y2Ba6 d、e、hgydF4y2Ba和我)。GH_A10G2217和GH_A11G2811的丰度也略微降低(图。gydF4y2Ba6 c和fgydF4y2Ba).而Gh_A04G1331和Gh_A01G1281在花芽发育过程中表达模式并没有明显的变化趋势(图2)。gydF4y2Ba6 g和mgydF4y2Ba).根据GHMIR157和大多数MIR157目标之间表达模式的负相关性gydF4y2Baghspls.gydF4y2Ba推测GHMIR157可以触发其有针对性的MRNA的降低以抑制MIR157目标的表达式是合理的gydF4y2Baghspls.gydF4y2Ba在花器官发展期间。gydF4y2Ba
在过表达线中衰减了助生信号传导gydF4y2Ba
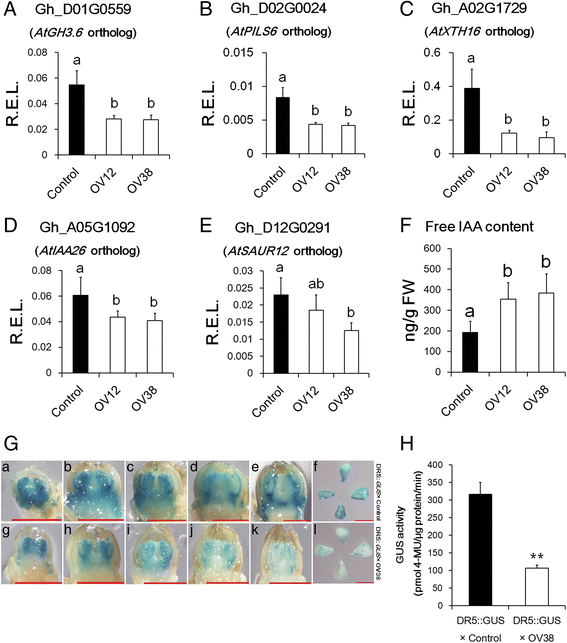
生长素在花发育和花器官大小中起重要作用[gydF4y2Ba21.gydF4y2Ba,gydF4y2Ba51.gydF4y2Ba,gydF4y2Ba52.gydF4y2Ba].有趣的是,与对照相比,在两个过表达系中基本上向下调节一些生长素诱导基因,例如IAA-Amido合酶,促进蛋白酶载体家族蛋白和木糖葡聚糖内凝血糖基酶(图。gydF4y2Ba7得了gydF4y2Ba).其他众所周知的疾病诱导型基因,IAA和Saur,在OV38系中的表达略低于对照管线(图。gydF4y2Ba7D和E.gydF4y2Ba).为了进一步验证Control和过表达系之间生长素信号的差异,我们使用转染了DR5的植物::gydF4y2Ba格斯gydF4y2Ba载体分别杂交OV38和Control植物。自gydF4y2BaDR5.gydF4y2Ba启动子由七个助素响应元素的重复组成[gydF4y2Ba53.gydF4y2Ba],DR5 ::gydF4y2Ba格斯gydF4y2Ba记者可用于监测疾病响应级别。在DR5 ::中,在花蕾和胚珠中的GUS信号较低,gydF4y2Ba格斯gydF4y2Ba × OV38 than DR5::格斯gydF4y2Ba × Control, indicating that auxin signalling was attenuated in the over-expression lines (Fig.7G和H.gydF4y2Ba).然而,关键蟾蜍蛋白生物生物生物生物生成基因石油单氧基酶的转录物丰度(gydF4y2Ba尤卡斯gydF4y2Ba),根据rna测序结果,Control和OV38之间没有显著差异(附加文件gydF4y2Ba6gydF4y2Ba).另外,游离IAA含量在控制中比在OV12和OV38中较低(图。gydF4y2Ba7F.gydF4y2Ba),这可能表明存在反馈监管的存在,因为下调gydF4y2BaAtGH3.6gydF4y2Ba过表达系的同源基因可能会减少IAA与氨基酸的自由结合。因此,我们认为生长素的信号转导在过表达系中减弱。gydF4y2Ba
超表达线的助生信号传导比对照较低。gydF4y2Ba一个gydF4y2Ba-gydF4y2BaegydF4y2Ba花盆中疾病诱导基因的实时PCR分析。r.e.l.,计算的相对表达水平gydF4y2BaHISTONE3gydF4y2Ba(AF024716)作为控制。误差棒表示四个生物重复的标准偏差。不同的字母表示在统计学上有显著差异gydF4y2BaPgydF4y2Ba基于方差分析(ANOVA) < 0.05 (Tukey的多重比较检验)。gydF4y2BafgydF4y2Ba定量分析Control、OV12和OV38花芽中IAA在−1 DPA的含量。误差条表明至少6个生物重复的标准偏差。不同的字母表示在统计学上有显著差异gydF4y2BaPgydF4y2Ba基于方差分析(ANOVA) < 0.05 (Tukey的多重比较检验)。gydF4y2BaggydF4y2BaGus染色花芽和胚珠图像。来自DR5 ::的花蕾的图像(长度≤2mm)gydF4y2Ba格斯gydF4y2Ba × Control (a-e) and DR5::格斯gydF4y2Ba × OV38 (g-k) and ovules from DR5::格斯gydF4y2Ba× Control (f)和DR5::gydF4y2Ba格斯gydF4y2Ba× OV38 (l)在−1 DPA。比例尺,1毫米。gydF4y2BahgydF4y2Ba−1 DPA时胚珠的GUS定量检测。星号表示有统计学意义的差异gydF4y2BaPgydF4y2Ba < 0.01 based on Student’stgydF4y2Ba测试。对照,从35S分离的非转基因植物::gydF4y2Baghmir157gydF4y2Ba棉花中的转基因品系。OV12和OV38, 35S::gydF4y2Baghmir157gydF4y2Ba棉花中的转基因品系。DR5::gydF4y2Ba格斯gydF4y2Ba× Control和DR5::gydF4y2Ba格斯gydF4y2Ba× OV38为DR5的F1代植株::gydF4y2Ba格斯gydF4y2Ba分别与控制和OV38交叉gydF4y2Ba
讨论gydF4y2Ba
最近,通过棉花中的小RNA测序,已经鉴定出了许多mirna [gydF4y2Ba43.gydF4y2Ba- - - - - -gydF4y2Ba46.gydF4y2Ba].然而,他们的一些功能已经在棉花中验证。在这项研究中,我们发现GHMIR157在棉花上的过度表达可以抑制细胞增殖和细胞扩张,这些细胞增殖和细胞扩张是压抑花器官的发展和减少最终器官尺寸(图。gydF4y2Ba1gydF4y2Ba和gydF4y2Ba2gydF4y2Ba, 桌子gydF4y2Ba1gydF4y2Ba和额外的文件gydF4y2Ba4gydF4y2Ba).由于在早期出现的芽芽的芽芽增长,可以在过表达线上抑制胚珠原始建立,从而导致胚珠产生减少。所有这些结果表明Ghmir157可能在花器官发展中发挥重要作用,尽管需要进一步阐明机制。GhmiR157前体异位表达gydF4y2Ba拟南芥gydF4y2Ba还降低了花瓣区域,雌蕊长度和胚珠数,其类似于棉花中的表型。由于还发现了短牙粒细胞和少量胚珠gydF4y2Ba35S:Atmir156B.gydF4y2Ba转基因植物gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba54.gydF4y2Ba],似乎在MiR156 / 157的物种之间保守花器官尺寸和生长的调节功能。过度表达的gydF4y2BaATMIR156B.gydF4y2Ba番茄中的前体没有减少花器官尺寸,但导致果实发育缺陷严重,表明MiR156 / 157家族在不同物种之间的生殖器官发展中发挥着重要作用[gydF4y2Ba55.gydF4y2Ba].gydF4y2Ba
据报道,SPL转录因子在许多物种中作为miR156/157靶标[gydF4y2Ba42.gydF4y2Ba,降解组测序也证明了这一点gydF4y2Baghspls.gydF4y2Ba是棉花MiR156 / 157的目标[gydF4y2Ba43.gydF4y2Ba,gydF4y2Ba56.gydF4y2Ba].此外,在过表达系和Control之间的所有差异表达基因中,只有SPL转录因子被预测为miR157的靶基因,5个gydF4y2Baghspls.gydF4y2Ba进一步验证使用RLM-RACE的MIR157靶标(图。gydF4y2Ba5N.gydF4y2Ba和额外的文件gydF4y2Ba7gydF4y2Ba).GHMIR157的表达式模式和几个目标gydF4y2Baghspls.gydF4y2Ba通常在花器官发育阶段期间呈负相关(图。gydF4y2Ba6gydF4y2Ba).因此,假设这一点是合理的gydF4y2Baghspls.gydF4y2BamiR157在花器官发育中起重要作用。gydF4y2Ba
在gydF4y2Ba拟南芥gydF4y2Ba, AtSPLs可以直接促进MADS-box转录因子,如gydF4y2BaATSOC1.gydF4y2Ba,gydF4y2BaAtAP1gydF4y2Ba, 和gydF4y2BaAtFULgydF4y2Ba,以控制相变[gydF4y2Ba30.gydF4y2Ba- - - - - -gydF4y2Ba32.gydF4y2Ba].在我们的研究中gydF4y2BaATSOC1.gydF4y2Baortholog和另外两个疯子箱转录因子,gydF4y2BaAtAGL6gydF4y2Ba直接同源,gydF4y2BaSITDR8.gydF4y2Ba与对照相比,在过表达系中显著下调(图3)。gydF4y2Ba5 i (kgydF4y2Ba和额外的文件gydF4y2Ba6gydF4y2Ba).AGL6疯狂箱基因的潮流箱基因与紧密相关的E类疯箱基因非常相似,可以用作与其他A,B,C和D类MAD-BOX转录因子相互作用以形成组合第四节复合物的脚手架[gydF4y2Ba57.gydF4y2Ba- - - - - -gydF4y2Ba59.gydF4y2Ba].通过将保守的抑制基序融合到蛋白质的疯狂箱基因的AGL6型湿箱基因的功能丧失导致较小的花粉和部分不含蛋白质gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba58.gydF4y2Ba,gydF4y2Ba60.gydF4y2Ba].gydF4y2BaSITDR8.gydF4y2Ba是MADS-box基因的另一个分支,在gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba61.gydF4y2Ba].的主要功能丧失gydF4y2BaSITDR8.gydF4y2Ba导致卵巢形状和无籽水果的改变[gydF4y2Ba62.gydF4y2Ba].Mad-Box转录因子在花器官分化和开发中发挥着至关重要的作用,并且在棉花上过度表达MiR157导致较小的花粉,更少的胚珠和种子,并且减毒的女性生育能力,这部分再现了这两个基因的突变体的表型在gydF4y2Ba拟南芥gydF4y2Ba和番茄。因此,MIR157 / SPL轴可能会调节原子表gydF4y2BaAtAGL6gydF4y2Ba和gydF4y2BaSITDR8.gydF4y2Ba在棉花控制正常的花器官生长。但是,通过MiR157目标直接调节棉花中的这两种疯子箱基因gydF4y2Baghspls.gydF4y2Ba应该在将来得到验证。gydF4y2Ba
除了MADS-box转录因子外,一些生长素诱导基因在过表达品系中与对照相比也出现了下调(图2)。gydF4y2Ba7A-E.gydF4y2Ba).此外,生长素信号通路可被DR5监测::gydF4y2Ba格斯gydF4y2Ba记者,过度表达线的过度表达较低(图。gydF4y2Ba7G和H.gydF4y2Ba).然而,免费的IAA含量不低(图。gydF4y2Ba7F.gydF4y2Ba).因此,在过表达系中生长素信号的减少不是由于IAA的含量,而是由于信号转导的缺陷。miR157/SPL轴在生长素信号转导中的作用机制尚不清楚。有趣的是,有报道称E类MADS-box转录因子SEPALLATA3可以结合多个ARF识别基序,例如gydF4y2BaAtGH3.3gydF4y2Ba启动子区域(gydF4y2Ba26.gydF4y2Ba].另一项研究报道MADS-box转录因子可与ARF2相互作用[gydF4y2Ba29.gydF4y2Ba].鉴于AGL6在功能上类似于Sepallata3和Ortholog的gydF4y2BaAtAGL6gydF4y2Ba我们有理由假设MADS-box转录因子可能被mir157靶向的SPLs调控,可能作为ARF样或ARF伴侣样分子,转导生长素信号通路,调控正常器官的分化和生长。gydF4y2Ba
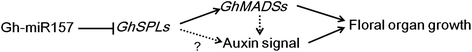
最后,我们提出了一种可能的花器官生长调控网络,如图所示。gydF4y2Ba8gydF4y2Ba.在花芽出现,GHMIR157的含量较低,其目标的降低几乎没有降低,gydF4y2Baghspls.gydF4y2BaMRNA。高度表达的mir157目标gydF4y2Baghspls.gydF4y2Ba可能激活MADS-box基因的转录,如gydF4y2BaAtAGL6gydF4y2Ba和gydF4y2BaSITDR8.gydF4y2Ba.这些疯狂箱转录因子或一些未知因素可以结合下游基因启动子的植物蛋白响应基序,以转换助长素信号传导。活化的养肝信号传导和疯箱基因可以进一步调节下游基因,以建立正常器官原基(例如胚珠)并促进细胞增殖和细胞膨胀。在晚期花式器官发展阶段,高丰富的GHMIR157减少gydF4y2BaGHSPL.gydF4y2Ba降低生长速度和加速花器官(如花药和胚珠)成熟受精的表达。gydF4y2Ba
结论gydF4y2Ba
花器官是影响许多作物收获的关键因素,也是受许多转录因子和激素调控的复杂生殖器官[gydF4y2Ba51.gydF4y2Ba].在这里,我们发现MiR157 / SPL轴通过调节MAD-BOX基因和生长素信号转导,可以影响花卉生长和大小形成。该工作进一步阐明了花器官发展的分子基础,这有助于提高棉花产量。应进行MiR157 / SPL轴与其他因素之间的串扰的未来研究,应进行在花式器官发展调节中。gydF4y2Ba
方法gydF4y2Ba
植物材料与RNA分离gydF4y2Ba
gossypium hirsutumgydF4y2Ba简历。YZ1作为野生型和转基因受体。所有转基因和非转基因棉花都在武汉华中农业大学的试验田和温室中种植,使用标准的农业管理措施,按照国家有关生物技术研究的批准。采集花蕾长度≤2mm和花蕾花期后- 1天(- 1 DPA)的花蕾,立即浸泡在液氮中,置于- 80℃保存。采用硫氰酸盐法提取总RNA [gydF4y2Ba63.gydF4y2Ba].gydF4y2Ba
拟南芥蒂利亚纳gydF4y2Ba生态型哥伦比亚作为野生型和转基因受体。植物在20°C-22°C长日照条件下(16 h光照/8 h黑暗)的温室中生长。采收花序,液氮浸泡,−80℃保存。总RNA提取使用TRIzol®试剂根据协议(Thermo Fisher Scientific)。gydF4y2Ba
质粒构建及基因转化gydF4y2Ba
一种372bp含有miR157前体的基因组序列gydF4y2Bagossypium hirsutumgydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba)被克隆并连接到PGWB402载体中以过度表达miR157前体[gydF4y2Ba64.gydF4y2Ba].将DR5启动子片段连接到pGWB433载体上构建DR5::gydF4y2Ba格斯gydF4y2Ba向量(gydF4y2Ba64.gydF4y2Ba].用于产生上述质粒的寡核苷酸在附加文件中列出gydF4y2Ba10.gydF4y2Ba.gydF4y2Ba
根癌土壤杆菌gydF4y2Ba(GV3101)携带载体,转化下胚轴gydF4y2Bagossypium hirsutumgydF4y2Ba简历。YZ1。如前所述处理受感染的次杆子[gydF4y2Ba65.gydF4y2Ba].gydF4y2Ba根癌土壤杆菌gydF4y2Ba(GV3101)介导的变换gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba采用花浸法测定生态型哥伦比亚植株[gydF4y2Ba66.gydF4y2Ba].gydF4y2Ba
Southern印迹,Northern印迹和QRT-PCR分析gydF4y2Ba
Southern印迹如下进行:基因组DNA分离,酶消化,电泳和杂交。先前描述了详细方法[gydF4y2Ba67.gydF4y2Ba].的PCR-generatedgydF4y2BaNPTII.gydF4y2Ba碎片作为探针。相关的引物在附加文件中列出gydF4y2Ba10.gydF4y2Ba.gydF4y2Ba
根据之前的报道进行了miRNA的Northern blotting [gydF4y2Ba43.gydF4y2Ba].首先,在15%的变性聚丙烯酰胺凝胶中电泳,将20μg总RNA电泳,含有8米的尿素,并转移到Immobilon-Ny +膜(Merck Millipore)中。然后,使用T4多核苷酸激酶(新英格兰Biolabs)用γ32P-ATP标记探针。在杂交和膜洗涤后,将印迹暴露于磷光体成像筛网,并在旋风分离器加磷光体成像仪(PerkinElmer)中检测信号。gydF4y2Ba
为了定量mRNA的表达,使用SuperScript II逆转录酶(Invitrogen)将总RNA逆转录为cDNA。qRT-PCR采用7500实时系统(Applied Biosystems),采用Sso-Fast EvaGreen Supermix with Low ROX (Bio-Rad)。计算相对表达量(R.E.L.)gydF4y2Ba——ΔCTgydF4y2Ba方法。gydF4y2BaHISTONE3gydF4y2Ba(AF024716)和gydF4y2BaAtact7.gydF4y2Ba(AT5G09810.1)用作棉花的内源参考基因gydF4y2Ba拟南芥gydF4y2Ba分别。gydF4y2Ba
形态学和细胞分析gydF4y2Ba
为了对棉花花瓣的发育进行运动学分析,当第1枝的第1节花开放时,手工从第2枝的第1节花蕾切回第9枝的第1节花蕾。gydF4y2Ba
对于花瓣,萼片和苞片区域的测量,器官被压平并扫描以产生数字图像。imagej软件(gydF4y2Bahttps://imagej.nih.gov/ij/download.htmlgydF4y2Ba)来计算器官面积。人工计算棉花胚珠数、种子数、花药数和柱头长度。用于测定中胚珠数gydF4y2Ba拟南芥gydF4y2Ba,雌蕊在70%乙醇中洗涤两次,在水合氯醛:dH中清除gydF4y2Ba2gydF4y2BaO:甘油(8:3:1)。使用差分干扰对比显微镜(Zeiss)观察胚珠。gydF4y2Ba
在花瓣顶部的关于曲线侧测量花瓣细胞尺寸。根据来自显微镜(Zeiss)的每单位图像区域的细胞数来计算平均细胞尺寸。花瓣数根据细胞尺寸和花瓣区域计算。gydF4y2Ba
测序数据的生物信息学分析gydF4y2Ba
从温室生长的对照和过表达mirna157的OV12植株中取样花蕾(长度≤2mm)。通过Illumina HiSeq生成RNA库并进行测序gydF4y2BaTMgydF4y2Ba2000年在深圳的北京华大基因研究所(BGI)工作。测序后,原始阅读被过滤成干净的阅读,然后映射到参考基因组gydF4y2Bagossypium hirsutumgydF4y2Ba[gydF4y2Ba48.gydF4y2Ba)使用gydF4y2Ba领结gydF4y2Ba[gydF4y2Ba68.gydF4y2Ba].使用RNASeq软件包通过Expectation Maximization量化基因表达水平[gydF4y2Ba69.gydF4y2Ba].利用NOISeq包筛选具有两个生物重复的Control和OV12品系之间的差异表达基因[gydF4y2Ba49.gydF4y2Ba].gydF4y2Ba
miR157目标预测在使用默认标准的网站工具上进行[gydF4y2Ba70gydF4y2Ba].gydF4y2Ba
RNA连接酶介导的cDNA末端的快速扩增(RLM竞争)gydF4y2Ba
RLM-RACE使用GeneRacer试剂盒(Invitrogen公司)绘制目标转录本的切割位点。将不含犊牛肠碱性磷酸酶的花蕾总RNA (5 μg)连接到RNA适配器上。利用genacer Oligo dT引物转录cdna。根据说明书使用5条ˈadaptor引物和3条ˈ基因特异性引物进行PCR。RACE产品被克隆,大约10个插入片段被测序和分析。gydF4y2Ba
GUS活性的组织化学分析和定量gydF4y2Ba
花芽(长度≤2mm)和胚珠(- 1 DPA)在37℃GUS染色缓冲液中孵育4 h,然后用75%乙醇洗涤1次或多次。染色样品使用立体显微镜(徕卡微系统)拍照。染色缓冲液0.9 g LgydF4y2Ba−1gydF4y2Ba5-溴-4-氯-3-吲哚基葡萄糖,50mM磷酸钠缓冲液(pH7.0),20%(v / v)甲醇和100mg lgydF4y2Ba−1gydF4y2Ba氯霉素。gydF4y2Ba
为了定量Gus活性,使用含有50mM磷酸钾缓冲液的GUS提取缓冲液在pH 7.0,11m乙二胺四乙酸,0.1%十二酸钠X-100和10mMβ-巯基乙醇中使用GUS提取缓冲液提取来自样品的总蛋白质。离心匀浆,收集上清液以测量如前所述的GUS活性[gydF4y2Ba71.gydF4y2Ba].gydF4y2Ba
内源性IAA的量化gydF4y2Ba
花芽(100 mg新鲜重量)在−1 DPA下均质,在1 mL 80% (vol/vol)甲醇中含有10 ng/mLgydF4y2Ba2gydF4y2BaHgydF4y2Ba5gydF4y2Ba-iaa(Oichemlm Ltd,CAS:76937-78-5)作为内标,然后在4°C下摇动过夜。将上清液蒸发并重新溶解在10%(Vol /体积)甲醇中,随后通过0.22μm尼龙膜过滤。根据前一份报告进行内源性IAA的定量[gydF4y2Ba72.gydF4y2Ba].gydF4y2Ba
缩写gydF4y2Ba
- AP1.gydF4y2Ba:gydF4y2Ba
-
Apetala1.gydF4y2Ba
- 富裕gydF4y2Ba:gydF4y2Ba
-
Fruitfull.gydF4y2Ba
- Saur.gydF4y2Ba:gydF4y2Ba
-
小生长素上升RNAgydF4y2Ba
- SOC1gydF4y2Ba:gydF4y2Ba
-
常量过表达抑制因子1gydF4y2Ba
- SPLgydF4y2Ba:gydF4y2Ba
-
SQUAMOSA启动子结合蛋白样gydF4y2Ba
参考文献gydF4y2Ba
- 1。gydF4y2Ba
王志强,王志强,王志强,等。植物侧器官生长与细胞生长的关系。植物学报。2014;17:36-42。gydF4y2Ba
- 2。gydF4y2Ba
王志强,王志强。植物器官大小的控制。咕咕叫医学杂志。2012;22:R360-7。gydF4y2Ba
- 3。gydF4y2Ba
陈志强,张晓东,张志强,等。茉莉酸盐通过抑制细胞增殖和核内复制的发生来控制叶子的生长,同时保持一种潜在的备用模式。植物杂志。2013;161(4):1930 - 51。gydF4y2Ba
- 4.gydF4y2Ba
黄蜂,江WB,胡yw,吴p,朱耶,梁wq等。BR信号影响gydF4y2Ba拟南芥gydF4y2Ba通过通过BZR1调节相关基因来调节相关基因的胚珠和种子数。莫尔植物。2013; 6(2):456-69。gydF4y2Ba
- 5。gydF4y2Ba
Zhiponova MK,Vanhoutte I,Boudolf V,Betti C,Dhondt S,Coppens F等人。芸苔类固醇生产和信号差异控制细胞分裂和叶片的膨胀。新植物。2013; 197(2):490-502。gydF4y2Ba
- 6。gydF4y2Ba
Lee BH, Ko JH, Lee S, Lee Y, Pak JH, Kim JH。的gydF4y2Ba拟南芥GRF-INTERACTING因素gydF4y2Ba基因家族在决定器官大小和多种发育特性方面具有重叠功能。植物杂志。2009;151(2):655 - 68。gydF4y2Ba
- 7。gydF4y2Ba
Sauret-GüetoS,Schiessl K,Bangham A,Sablowski R,Coen E.锯齿控制gydF4y2Ba拟南芥gydF4y2Ba花瓣的生长和形状与一个分散的极性场相互作用。公共科学图书馆杂志。2013;11 (4):e1001550。gydF4y2Ba
- 8。gydF4y2Ba
Anastasiou E, Kenz S, ger蜇丁,MacLean D, Timmer J, Fleck C,等。KLUH/ cyp78a5依赖的细胞间信号对植物器官大小的控制Dev细胞。2007;13(6):843 - 56。gydF4y2Ba
- 9。gydF4y2Ba
XIA T,Li N,Dumenil J,Li J,Kamenski A,Bevan Mw等。泛素受体DA1与E3泛素连接酶DA2相互作用以调节种子和器官尺寸gydF4y2Ba拟南芥gydF4y2Ba.植物细胞。2013;25(9):3347 - 59。gydF4y2Ba
- 10。gydF4y2Ba
李永华,郑丽丽,郑丽丽,李永华。控制最终种子和器官的大小gydF4y2BaDA1.gydF4y2Ba基因家庭gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.基因Dev。2008;22(10):1331 - 6。gydF4y2Ba
- 11.gydF4y2Ba
Xu R, Li Y. mediator complex subunit 8调控器官大小gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.植物信号表现。2012; 7(2):182-3。gydF4y2Ba
- 12.gydF4y2Ba
Ikeda M,Fujiwara S,MITSUDA N,OHME-TAKAGI M.一个局直基本的基本螺旋环 - 螺旋系统调节细胞伸长率gydF4y2Ba拟南芥gydF4y2Ba.植物细胞,2012;24(11):4483 - 97。gydF4y2Ba
- 13。gydF4y2Ba
细胞分裂素调控生殖分生组织的活性、花器官的大小、胚珠的形成,从而影响种子产量gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.植物细胞。2011;23(1):69 - 80。gydF4y2Ba
- 14。gydF4y2Ba
Nelissen H,Rymen B,Jikumaru Y,Demuynck K,Van Lijsebettens M,Kamiya Y等。吉布林素水平的局部最大调节通过细胞分裂的空间控制来调节玉米叶生长。Curr Biol。2012; 22(13):1183-7。gydF4y2Ba
- 15.gydF4y2Ba
胡y,谢q,chua nh。的gydF4y2Ba拟南芥gydF4y2Baauxin-inducible基因gydF4y2Baargos.gydF4y2Ba控制横向器官尺寸。植物细胞。2003; 15(9):1951-61。gydF4y2Ba
- 16。gydF4y2Ba
Krizek B.gydF4y2BaAINTEGUMENTAgydF4y2Ba和gydF4y2BaAINTEGUMENTA-LIKE6gydF4y2Ba以冗余的方式来管理gydF4y2Ba拟南芥gydF4y2Ba花卉生长和图案化。植物理性。2009; 150(4):1916-29。gydF4y2Ba
- 17。gydF4y2Ba
Mizukami Y,Fischer RL。植物器官尺寸控制:gydF4y2BaAINTEGUMENTAgydF4y2Ba在器官发生过程中调节生长和细胞数量。中国科学(d辑:地球科学)2000;97(2):942-7。gydF4y2Ba
- 18。gydF4y2Ba
等。的SAUR19亚家族gydF4y2Ba小生长素上升RNAgydF4y2Ba基因促进细胞膨胀。工厂j . 2012, 70(6): 978 - 90。gydF4y2Ba
- 19。gydF4y2Ba
varaud e,brioudes f,szécsij,leroux j,棕色s,perrot-rechenmann c等。助线响应因子8调节gydF4y2Ba拟南芥gydF4y2Ba通过与BHLH转录因子Bigplepp相互作用来瓣增长。植物细胞。2011; 23(3):973-83。gydF4y2Ba
- 20.gydF4y2Ba
Schruff MC, Spielman M, Tiwari S, Adams S, Fenby N, Scott RJ。的gydF4y2Ba助线响应因子gydF4y2Ba2基因gydF4y2Ba拟南芥gydF4y2Ba链接养灵信令,细胞分裂和种子和其他器官的大小。发展。2006; 133:251-61。gydF4y2Ba
- 21.gydF4y2Ba
刘志强,刘志强。植物生长素在植物生长发育中的作用gydF4y2Ba拟南芥gydF4y2Ba雌蕊形态发生。植物科学学报。2014;5:327。gydF4y2Ba
- 22。gydF4y2Ba
等。控制胚珠原基形成的综合模式。植物j . 2013; 76(3): 446 - 55。gydF4y2Ba
- 23。gydF4y2Ba
TheißenG.花卉器官身份的发展:疯子屋的故事。CurrOp植物BIOL。2001; 4(1):75-85。gydF4y2Ba
- 24。gydF4y2Ba
Theiszen G,Saedler H.植物生物学:花卉四重奏。自然。2001; 409:469-71。gydF4y2Ba
- 25。gydF4y2Ba
Dornelas MC, Patreze CM, Angenent GC, Immink RG。身份认同与成长之间缺失的环节?植物科学进展。2011;16(2):89-97。gydF4y2Ba
- 26.gydF4y2Ba
Kaufmann K, Muiño JM, Jauregui R, Airoldi CA, Smaczniak C, Krajewski P, et al.;MADS转录因子SEPALLATA3的靶基因:发育和激素途径的整合gydF4y2Ba拟南芥gydF4y2Ba花。公共科学图书馆杂志。2009;7 (4):e1000090。gydF4y2Ba
- 27.gydF4y2Ba
Folter SD,Angenent GC。在Mads Science中遇见CIS。趋势植物SCI。2006; 11(5):224-31。gydF4y2Ba
- 28.gydF4y2Ba
Ó ' Maoiléidigh DS, Wuest SE, Rae L, Raganelli A, Ryan PT, Kwaśniewska K,等。生殖花器官鉴定规范的控制gydF4y2Ba拟南芥gydF4y2Ba由C函数稳压器静止。植物细胞。2013; 25(7):2482-503。gydF4y2Ba
- 29.gydF4y2Ba
Smaczniak C,Immink Rg,MuiñoJM,Blanvillain R,Busscher M,Busscher-Lange J等。浊域转录因子复合物的特征gydF4y2Ba拟南芥gydF4y2Ba花卉发展。Proc Natl Acad Sci U S A. 2012; 109(5):1560-5。gydF4y2Ba
- 30.gydF4y2Ba
Yamaguchi A, Wu MF, Yang L, Wu G, Poethig RS, Wagner D. The microRNA-regulated SBP-Box transcription factor SPL3 is A direct upstream activator of leaves, FRUITFULL, and APETALA1。Dev细胞。2009;17(2):268 - 78。gydF4y2Ba
- 31。gydF4y2Ba
Wang JW, Czech B, Weigel D. mir156调控SPL转录因子的内源性开花途径gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.细胞。2009;138(4):738 - 49。gydF4y2Ba
- 32。gydF4y2Ba
徐米,胡t,赵杰,公园我,earley kw,wu g等。MIR156监管的发展职能gydF4y2BaSquamosa启动子结合蛋白样gydF4y2Ba(gydF4y2BaSPLgydF4y2Ba)基因gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.Plos Genet。2016; 12(8):E1006263。gydF4y2Ba
- 33。gydF4y2Ba
陈建军,黄旭,罗建军,等。gydF4y2BaOSSPL13gydF4y2Ba控制栽培水稻的晶粒尺寸。NAT Genet。2016; 48:447-56。gydF4y2Ba
- 34。gydF4y2Ba
王L,Sun S,Jin J,Fu D,Yang X,Weng X等人。稻米植物生殖分支的协调调节。Proc Natl Acad Sci U S A. 2015; 112:15504-9。gydF4y2Ba
- 35。gydF4y2Ba
王某,吴k,元q,刘x,刘z,林x等。控制晶粒尺寸,形状和质量gydF4y2Baosspl16.gydF4y2Ba在大米。Nat麝猫。2012;44:950-4。gydF4y2Ba
- 36。gydF4y2Ba
娇y,王y,薛d,王继,燕m,刘g等。规范gydF4y2BaOSSP1gydF4y2Ba由OsmiR156定义了水稻理想的植株结构。Nat麝猫。2010;42(6):541 - 4。gydF4y2Ba
- 37。gydF4y2Ba
张TQ,连H,唐H,Dolezal K,Zhou Cm,Yu S等人。内在的MicroRNA定时器调节植物中射击再生能力的逐步下降。植物细胞。2015; 27:349-60。gydF4y2Ba
- 38。gydF4y2Ba
于宁,牛庆伟,吴克宏,蔡恩华。miR156/SPLs模块在gydF4y2Ba拟南芥gydF4y2Ba侧根开发。工厂J. 2015; 83(4):673-85。gydF4y2Ba
- 39。gydF4y2Ba
Stief A,Altmann S,Hoffmann K,Pant Bd,Scheible WR,BäurleI。gydF4y2Ba拟南芥gydF4y2BaMiR156通过SPL转录因子调节对重复环境压力的耐受性。植物细胞。2014; 26(4):1792-807。gydF4y2Ba
- 40。gydF4y2Ba
崔LG,山爵士,石米,高JP,林HX。的gydF4y2BamiR156gydF4y2Ba-gydF4y2BaSPL9gydF4y2Ba-gydF4y2BaDFRgydF4y2Ba途径协调植物中发育与非生物胁迫耐受性的关系。工厂J. 2014; 80:1108-17。gydF4y2Ba
- 41。gydF4y2Ba
陈X,张Z,刘德,张克,李A,毛泽东氏菌促进剂结合蛋白样转录因子:植物生长和发展的星级球员。J Intent Plant Biol。2010; 52(11):946-51。gydF4y2Ba
- 42。gydF4y2Ba
Wang H, Wang H. miR156/SPL模块,一个调节枢纽和多功能工具箱,为作物的农艺性状增强提供了齿轮。摩尔。2015;8(5):677 - 88。gydF4y2Ba
- 43.gydF4y2Ba
刘,涂,唐w,gao w,gao w,lindsey k,张x。小的RNA和降低组分布揭示了miRNA和它们在显影纤维中的靶向的作用gydF4y2Ba海岛棉gydF4y2Ba.工厂J. 2014; 80(2):331-44。gydF4y2Ba
- 44.gydF4y2Ba
薛W,王Z,杜米,刘啊,刘Jy。小RNA的基因组分析显示延长棉纤维细胞中的八种纤维伸长率和257个新微大RNA。BMC基因组学。2013; 14:629。gydF4y2Ba
- 45.gydF4y2Ba
龚l,kakrana a,Arikit S,Meyers Bc,Wendel JF。类二倍体棉中保守的microRNA基因的组成和表达(gydF4y2BaGossypiumgydF4y2Ba)的物种。基因组生物学进展。2013;5:2449-59。gydF4y2Ba
- 46。gydF4y2Ba
Pang M,Woodward AW,Agarwal V,Guan X,Ha M,Ramachandran v等。基因组的分析显示了MiRNA和siRNA序列的快速和动态变化,在胚轴和纤维发育过程中的表达和纤维棉花(gydF4y2Bagossypium hirsutumgydF4y2BaL.)。基因组Biol。2009; 10:R122。gydF4y2Ba
- 47。gydF4y2Ba
Cuperus JT,Fahlgren N,Carrington JC。miRNA基因的进化与功能多样化。植物细胞。2011; 23(2):431-42。gydF4y2Ba
- 48。gydF4y2Ba
张特,胡y,江w,方l,guan x,chen j等。分子素棉花的测序(gydF4y2Bagossypium hirsutumgydF4y2Bal . acc。TM-1)为纤维改良提供资源。生物科技Nat》。2015;33:531-7。gydF4y2Ba
- 49。gydF4y2Ba
Tarazona S, García-Alcalde F, Dopazo J, Ferrer A, Conesa A. RNA-seq的差异表达:一个深度问题。基因组研究》2011;21(12):2213 - 23所示。gydF4y2Ba
- 50.gydF4y2Ba
Leng N,Dawson Ja,Thomson Ja,Ruotti V,Rissman Ai,Smits Bmg等。EBSEQ:RNA-SEQ实验中推断的经验贝叶斯分层模型。生物信息学。2013; 29(8):1035-43。gydF4y2Ba
- 51.gydF4y2Ba
b.a.,安德森·JT。控制花的大小。中国生物医学工程学报。2013;64(6):1427-37。gydF4y2Ba
- 52.gydF4y2Ba
Sundberg E,ØstergaardL.生殖发展中的独特和动态的养羊酸活动。冷泉harb持猪肉。2009; 1(6):575-83。gydF4y2Ba
- 53.gydF4y2Ba
徐吉,霍夫乌斯H,Heidstra R,Sauer M,Friml J,Scheres B.植物再生的分子框架。科学。2006; 311:385-8。gydF4y2Ba
- 54。gydF4y2Ba
兴S,Salinas M,Garcia-molina A,Hohmann S,Berndtgen R,Huijser P.gydF4y2BaSPL8gydF4y2Ba和miR156-targetedgydF4y2BaSPLgydF4y2Ba基因冗余规范gydF4y2Ba拟南芥gydF4y2BaGynoecium差动图案。工厂J. 2013; 75(4):566-77。gydF4y2Ba
- 55。gydF4y2Ba
Ferreira GF, Silva EM, Azevedo MS, Guivin MA, Ramiro DA, Figueiredo CR, et al. microrna156靶向SPL/SBP box转录因子调控番茄子房和果实发育。植物j . 2014; 78(4): 604 - 18。gydF4y2Ba
- 56。gydF4y2Ba
杨X,王L,元D,Lindsey K,张X.小RNA和降低测量测序在棉花体胚胎发生过程中显示复杂的miRNA调节。J Exp Bot。2013; 64(6):1521-36。gydF4y2Ba
- 57。gydF4y2Ba
Dreni L,张D.花卉发展:进化史和功能gydF4y2BaAGL6gydF4y2Ba亚科MADS-box基因。J Exp Bot. 2016;67(6): 1625-38。gydF4y2Ba
- 58。gydF4y2Ba
Hsu wh,yeh tj,huang ky,李杰,陈熟,杨ch。gydF4y2Ba静态似的13.gydF4y2Ba, E功能基因的假定祖先,指定雄性和雌性配子体形态发生。植物j . 2014; 77(1): 1 - 15。gydF4y2Ba
- 59。gydF4y2Ba
利吉普科玛,泽瑟夫J,杰拉茨T,范登布谢M.矮牵牛花gydF4y2BaAGL6gydF4y2Ba基因有gydF4y2Basepallata.gydF4y2Ba- 般的花卉图案中的功能。工厂J. 2009; 60(1):1-9。gydF4y2Ba
- 60.gydF4y2Ba
Koo Sc,Bracko O,Park Ms,Schwab R,Chun Hj,Park Km,等。控制横向器官发展和开花时间gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba疯盒基因gydF4y2Ba艾奇马特6.gydF4y2Ba.工厂J.2010; 62(5):807-16。gydF4y2Ba
- 61。gydF4y2Ba
Smaczniak C,Immink RGH,Angenent GC,Kaufmann K.植物疯子域因素的发展和进化多样性:最近研究的见解。发展。2012; 139(17):3081-98。gydF4y2Ba
- 62。gydF4y2Ba
玛格丽塔·D,西蒙娜·M,弗朗西斯卡·R,亚历山德罗·L,乔治·cgydF4y2BaTM8gydF4y2Ba, MADS-box基因在番茄花中表达。BMC Plant Biol. 2014;14:319。gydF4y2Ba
- 63。gydF4y2Ba
朱立峰,屠丽丽,曾富良,刘迪强,张晓丽。一种改进的、简单的分离高质量RNA的方法gydF4y2BaGossypiumgydF4y2Ba适用于cDNA文库的构建。作物学报2005;31:1657-9。gydF4y2Ba
- 64。gydF4y2Ba
Nakagawa T, Suzuki T, Murata S, Nakamura S, Hino T, Maeo K,等。改进的门户二元载体:在植物转基因分析中创建融合结构的高性能载体。生物技术与生物化学。2007;71(8):2095-100。gydF4y2Ba
- 65。gydF4y2Ba
Jin S,张X,NIE Y,Guo X,梁S,朱H.棉花体外培养和遗传转化新的精英基因型鉴定。BIOL植物。2006; 50(4):519-24。gydF4y2Ba
- 66。gydF4y2Ba
张x,亨罗基r,林ss,niu qw,chua nh。农杆菌介导的转化gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba使用花卉DIP方法。NAT PROTOC。2006; 1(2):641-6。gydF4y2Ba
- 67.gydF4y2Ba
李永军,刘德强,屠丽丽,张晓丽,王磊,朱立峰,等。抑制gydF4y2BaGHAGP4.gydF4y2Ba基因表达抑制了棉纤维的起始和伸长。植物细胞代表2010; 29(2):193-202。gydF4y2Ba
- 68.gydF4y2Ba
人类基因组短DNA序列的超快和记忆效率比对。基因组医学杂志。2009;10(3):1 - 10。gydF4y2Ba
- 69.gydF4y2Ba
李斌,杜威出版社。RSEM:从有或没有参考基因组的RNA-Seq数据中准确的转录本定量。BMC生物信息学。2011;12(1):93 - 9。gydF4y2Ba
- 70。gydF4y2Ba
戴旭,赵PX。psRNATarget:植物小RNA目标分析服务器。核酸学报2011;39:W155-9。gydF4y2Ba
- 71。gydF4y2Ba
关键词:棉花,PGbEXPA2, GA, ABA,基因工程,基因工程abstractgydF4y2Ba拟南芥gydF4y2Ba.植物学报2015;34(9):1539-49。gydF4y2Ba
- 72。gydF4y2Ba
刘海波,李晓华,肖建华,王素平.一种同时测定多种植物激素和代谢产物的简便方法:在水稻-细菌互作研究中的应用。工厂方法。2012;宣告。gydF4y2Ba
确认gydF4y2Ba
感谢新加坡国立大学生物科学系徐健提供DR5启动子,感谢岛根县大学Nakagawa Tsuyoshi提供pGWB402载体。感谢华中农业大学作物遗传改良国家重点实验室刘洪波、李东琴对IAA含量测定的帮助。gydF4y2Ba
资金gydF4y2Ba
这项工作是由中国纪律人才的经济支持(Grant No.B14032)和中央大学的基本研究资金(2013YB06)的基本研究资金。gydF4y2Ba
可用性数据和材料gydF4y2Ba
从温室生长的Control和过表达mirna157的OV12植物中采集的花蕾(长度≤2mm) RNA序列数据已提交至NCBI序列读取档案(BioProject: PRJNA341749)。gydF4y2Ba
作者的贡献gydF4y2Ba
NL,LT和XZ设计了研究;NL进行实验并分析数据;LW,HH和JX供应材料;NL写了稿件和XZ修订了Maunscript。所有作者都批评并批准了稿件的最终版本。gydF4y2Ba
利益争夺gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
通讯作者gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:gydF4y2Ba
ghmir157前体gydF4y2Bagossypium hirsutumgydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba)含有GhmiR157前体的基因组序列。下划线表示成熟的miR157序列。(gydF4y2BaBgydF4y2Ba)GHMIR157前体的二级结构。红线表示成熟的miR157序列。(docx 2223 kb)gydF4y2Ba
额外的文件2:gydF4y2Ba
35S阳性检测::gydF4y2Baghmir157gydF4y2Ba转化株。(gydF4y2Ba一个gydF4y2Ba)南部污染35s ::gydF4y2Baghmir157gydF4y2Ba转化株。(gydF4y2BaBgydF4y2Ba) 35S的PCR分析:gydF4y2Baghmir157gydF4y2Ba转化株。对照,从35S分离的非转基因植物::gydF4y2Baghmir157gydF4y2Ba棉花中的转基因品系。数字11,12,33,35,37,38,40表示不同的35s ::gydF4y2Baghmir157gydF4y2Ba棉花中的转基因品系。多克斯(287 kb)gydF4y2Ba
附加文件3:gydF4y2Ba
过度表达gydF4y2Baghmir157gydF4y2Ba前体导致更多的营养枝。(gydF4y2Ba一个gydF4y2Ba-gydF4y2BaEgydF4y2Ba)对照(gydF4y2Ba一个gydF4y2Ba), OV12 (gydF4y2BaBgydF4y2Ba), OV38 (gydF4y2BaCgydF4y2Ba),OV33(gydF4y2BaDgydF4y2Ba), OV35 (gydF4y2BaEgydF4y2Ba).(gydF4y2BaFgydF4y2Ba和gydF4y2BaGgydF4y2Ba)对照(gydF4y2BaFgydF4y2Ba)和OV12(gydF4y2BaGgydF4y2Ba).(gydF4y2BaHgydF4y2Ba绿房子在平方阶段的植物分支测量。对照,从35S分离的非转基因植物::gydF4y2Baghmir157gydF4y2Ba转基因线。OV12, 38, 33, 37和35,独立35S::gydF4y2Baghmir157gydF4y2Ba转基因线。不同的字母表示在统计学上有显著差异gydF4y2BaPgydF4y2Ba基于方差分析(ANOVA) < 0.05 (Tukey的多重比较检验)。多克斯(748 kb)gydF4y2Ba
额外的文件4:gydF4y2Ba
过度表达gydF4y2Baghmir157gydF4y2Ba前体抑制了生殖器官的发展。(a)花芽成熟MiR157表达的QRT-PCR。r.e.l.,计算的相对表达水平gydF4y2BaHISTONE3gydF4y2Ba(AF024716)作为控制。误差棒表示三个生物重复的标准偏差。不同的字母表示在统计学上有显著差异gydF4y2BaPgydF4y2Ba基于方差分析(ANOVA) < 0.05 (Tukey的多重比较检验)。(B-F)花(B)、雄蕊和柱头(C)、剥瓣后的子房(D)、30 DPA铃(E)和成熟铃(F)的图像。(G) WT和过表达的花器官大小gydF4y2Baghmir157gydF4y2Ba线条。值显示为平均值±标准偏差。在每个列中,基于Tukey的多个比较测试,具有不同字母的值gydF4y2BaPgydF4y2Ba < 0.05). OV12, 38, 33 and 35, independent 35S::ghmir157gydF4y2Ba转基因线。野生型(gydF4y2Bagossypium hirsutumgydF4y2Ba简历。YZ1)。对照,从35S分离的非转基因植物::gydF4y2Baghmir157gydF4y2Ba转基因线。(DOCX 400 KB)gydF4y2Ba
额外的文件5:gydF4y2Ba
测序和映射概述统计。(XLSX 10.1 KB)gydF4y2Ba
附加文件6:gydF4y2Ba
Control和OV12基因的丰度和注释。(XLSX 8040 kb)gydF4y2Ba
额外的文件7:gydF4y2Ba
预测MIR157的目标。(XLSX 11.8 KB)gydF4y2Ba
附加文件8:gydF4y2Ba
所有的无根谱系图gydF4y2BaSPLgydF4y2Ba基因在gydF4y2Bagossypium hirsutumgydF4y2Ba和gydF4y2Ba拟南芥gydF4y2Ba.利用MEGA6软件基于邻居连接算法绘制无根系统图。红线表示亚家族成员是通过psRNATarget网站工具预测的miR157靶点候选者[gydF4y2Ba69.gydF4y2Ba].(多克斯48.2 kb)gydF4y2Ba
附加文件9:gydF4y2Ba
异位表达GhmiR157前体系和野生型MADS-box基因的定量分析花序MADS-box基因(A-D) qRT-PCR分析E4、E6表示35S::gydF4y2Baghmir157gydF4y2Ba转基因线gydF4y2Ba拟南芥gydF4y2Ba.r.e.l.,计算的相对表达水平gydF4y2BaAtact7.gydF4y2Ba(AT5G09810.1)作为控制。误差棒表示四个生物重复的标准偏差。(DocX 88.3 KB)gydF4y2Ba
附加文件10:gydF4y2Ba
在研究中应用的底漆。(XLSX 12.7 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
刘娜,涂磊,王莉。gydF4y2Baet al。gydF4y2BamicroRNA 157目标gydF4y2BaSPLgydF4y2Ba基因调节棉花的花器官尺寸和胚珠生产。gydF4y2BaBMC植物BIOL.gydF4y2Ba17,gydF4y2Ba7(2017)。https://doi.org/10.1186/s12870-016-0969-z.gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-016-0969-z.gydF4y2Ba
关键词gydF4y2Ba
- 花器官尺寸gydF4y2Ba
- gossypium hirsutumgydF4y2Ba
- MADS-box转录因子gydF4y2Ba
- miR157gydF4y2Ba
- SPLgydF4y2Ba基因gydF4y2Ba
- 胚珠生产gydF4y2Ba