摘要
背景
植物和昆虫之间的化学交流是实现成功的共同适应所必需的。作为对食草性的反应,植物会产生特定的化合物,而食性昆虫也会对植物产生的分子做出充分的反应。在这里,我们展示了薄荷甲虫肠道微生物群落的作用Chrysolina herbacea在化学串扰中各种aquatica(或watermint)。
结果
通过二维气相色谱-质谱联用,我们首先评估了两者的化学模式m . aquatica叶和渣渣挥发物提取c . herbacea雄性和雌性以植物为食,并观察到雄性和雌性挥发物的显著差异。粪便的性别特异性化学模式与可培养肠道细菌的性别特异性分布平行。事实上,所有从女性身上分离出来的肠道细菌都属于α-或γ-变形菌门,而从男性身上分离出来的细菌则属于γ-变形菌门或厚壁菌门。然后我们证明了这五个粘质沙雷氏菌来自雌性的菌株对来自雄性厚壁菌门的细菌具有抗菌活性,这表明它们通过生产抗菌化合物进行竞争。通过体外实验,我们最后表明,两性微生物群落与特定的代谢模式有关,就其生物转化能力而言m . aquatica萜类化合物,并将它们代谢成一系列可能具有信息素活性的化合物。
结论
我们的数据表明,可培养的肠道细菌Chrysolina herbacea雄性和雌性影响草食诱导的挥发性混合物各种aquatica挥发物以性别特定的方式。
背景
在漫长的进化过程中,植物已经进化出了一系列针对食草动物的防御机制,可分为两大类:预先形成的构成性防御和诱导性防御[1].昆虫攻击前存在的物理和化学屏障是构成性防御,而直接和间接防御是由昆虫攻击引发的诱导性防御。直接防御是指能够直接干扰攻击昆虫的植物性状,而间接防御则是指植物性状本身不影响寄主植物的敏感性,但可以作为攻击昆虫天敌的引诱剂[2- - - - - -7].昆虫对植物防御的反应包括选择性选择不同的取食地点、改变取食速度或诱导生理/解毒酶[8].
积累特殊代谢物的植物,如芳香植物各种aquatica通过直接防御机制,通过在腺状毛状体(一种专门的分泌组织)中产生组成性萜类化合物来阻止食草[5].尽管这种分泌结构含有有毒成分,专门的食草动物不仅以具有这些结构的植物为食,而且还进化出了识别特定化合物并被其吸引的能力。这种摄食适应已经在几种昆虫中被描述过[9].因此,这些昆虫和它们的寄主植物之间的相互作用偶尔会导致高度特定的关系,例如m . aquatica而且Chrysolina herbacea.
正如Zebelo等人所证明的。[10的腺毛状体释放挥发性化合物m . aquatica主要特征是存在单萜类pulegone。pulegone,这是发生在健康的未受损的叶子的主要化合物,显示是一个强有力的引诱c . herbacea嗅觉生物测定显示。植物对c . herbacea草食性是萜类生物合成基因的激活,最终将大部分单萜生产从普莱酮转移到薄荷呋喃的合成。后一种化合物被发现具有明显的排斥作用c . herbacea在生物测定试验中。尽管存在较低数量的许多其他单萜,但在被感染和未被感染的植物中,没有发现这组分子的显著差异,因此主要限制甲氧呋喃的威慑作用。由于这是典型的植物-昆虫相互作用,机械损伤不能诱导m . aquatica同样的反应引起了c . herbacea食草性。因此c . herbacea是否被未受损的pulegone所吸引m . aquatica,但被植食动物产生的甲甲呋喃所阻止m . aquatica.这些结果表明对c . herbacea来m . aquatica单萜;然而,解毒机制和分解代谢/生物转化能力使昆虫能够耐受大量摄入的萜类化合物仍然是一个悬而未决的问题。
科尔德罗和同事们[11],采用顶空固相微萃取(HS-SPME)耦合综合二维(2D)气相色谱-质谱联用(GCxGC-MS)相结合的方法,分析了部分单萜类化合物的分解代谢命运各种通过萜类含量的测定c . herbacea进食新鲜树叶后的粪便。的carvone-richm . spicatal . (12],含有薄荷醇和薄荷酮M. x piperital . (13的化学型m .叶L.,特别富含辣椒酮氧化物[14用来证明…的能力c . herbacea代谢植物萜类化合物,以及昆虫分解/生物转化它们从而产生新化合物的惊人能力。比如香芹酮和Z-carveol在c . herbacea吃完后的FrassM. x piperita,一种薄荷,不积累这两种萜烯,但积累柠檬烯[15].生活在昆虫肠道中的微生物可能参与了叶片挥发性萜类化合物的生物转化[16].确实,有明确的证据表明微生物将柠檬烯转化为Z-香芹醇和香芹酮[17- - - - - -21].已知微生物能够激活昆虫所没有的分解代谢和代谢过程,因此充当“微生物中间人”,这一策略使携带此类细菌的植食性昆虫能够克服食草性的生化障碍[22,23].最近描述的例子是咖啡浆果蛀虫的肠道微生物对咖啡因的解毒[24],树皮甲虫细菌共生体代谢山松甲虫产生的有毒单萜和二萜酸以应对食草动物损害的能力[25],以及白菜根蝇幼虫肠道微生物组催化植物毒素2-苯乙基异硫氰酸酯转化的能力[26].因此,植物有毒化合物的微生物降解可以发生在昆虫肠道中,并有助于宿主的碳和能量需求[27].
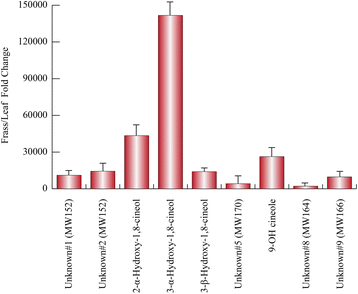
以植物或/及其相关微生物为食的昆虫的代谢活动经常导致叶片挥发物的含氧衍生物的释放。例如,一些以植物为食的昆虫m . aquatica,贮存1,8-桉树脑,一种单萜类含氧化合物,显示出蚊虫摄食威慑和产卵驱避活性,并对储粮甲虫有毒性作用[28,29],显示出将1,8-桉树脑代谢成几种羟基衍生物的显著能力,如3-羟基桉树脑[30.,31].正如Southwell和同事们[31]建议,一个有趣的挑战是评估1,8-桉树脑羟基化是否代表一种解毒或代谢策略,以产生半化学物质。事实上,有人认为有几种昆虫,如负鼠[32),Paropsisterna tigrina[33]和Leichhardt的蚱蜢[34],可能使用羟基桉树脑作为信息素标记。这一假设可以扩展生活在昆虫肠道中的微生物可能发挥的作用,这些微生物可能参与半化学物质的生物合成。
在这项研究中,我们通过描述居住在肠道的可培养细菌群落来验证这一假设c . herbacea雌的和雄的都在吃m . aquatica,然后研究两性微生物群落与生物转化能力相关的特定代谢模式的可能性m . aquatica精油和释放潜在的半化学物质。
结果
化学指纹图谱m . aquatica叶和c . herbacea蛀屑挥发物
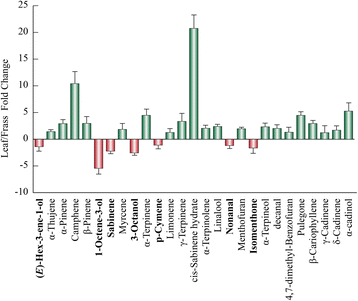
区分生物间相互作用过程中产生的化学模式是多营养相互作用所带来的主要挑战之一[16,35- - - - - -38].化学模式和它们对新陈代谢相互作用的贡献m . aquatica它特有的食草动物c . herbacea这里分析了昆虫微生物群落,以阐明这些多营养相互作用。如表中所述,发现了叶片和昆虫残渣挥发物的清晰化学指纹1.GCxGC-MS分析允许对60多种化合物进行表征(包括绿叶挥发物、单倍半萜和倍半萜)。
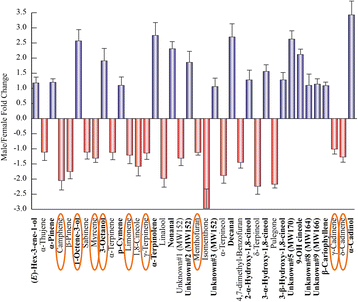
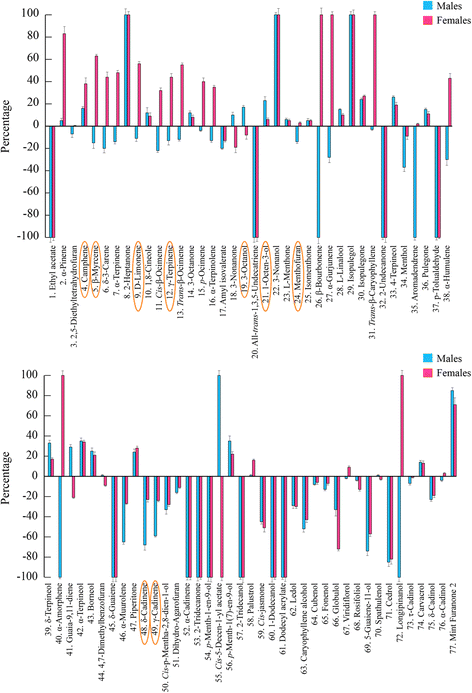
通过使用Table的数据集1,计算了区分叶片和粗屑分量的褶皱变化值。考虑到叶片成分,独联体-水合萨比烯、莰烯、α-cadinene、α-萜烯和pulegone在叶片中含量较高,而1-辛烯-3-醇在渣油挥发物中含量较高。1).另一方面,通过考虑特征的粗纤维化合物,我们发现四种羟基化桉树脑衍生物和五种未知的单萜烯在叶片成分中几乎不存在。2).男性和女性挥发物之间的差异被观察到在他们的frass提取物中,具有特定的化学模式,包括所有类别的挥发性化合物(图。3.).
在相互作用中区分男性和女性成分的折叠变化值各种aquatica而且Chrysolina herbacea.蓝色条和加粗的化合物指的是男性提取物。折叠变化表示为男性值/女性值。为了表示负值,当A/B值<1时,数据用−1/(A/B)表示,其中A表示Male值,B表示Female值。误差条表示标准差。图中也表示的化合物。7用橙色圈起来
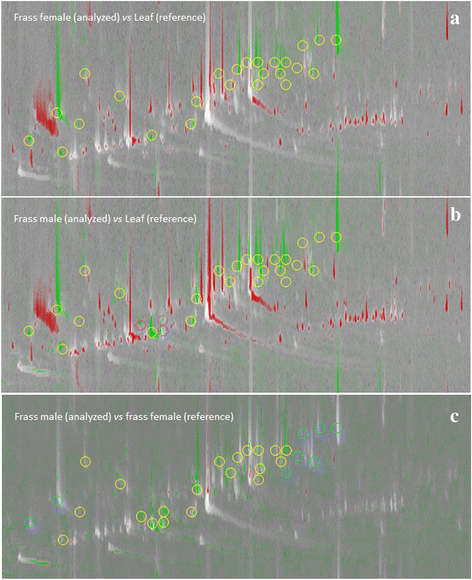
从渣油和叶挥发物中高度详细的分离模式被用作初步指纹调查的化学特征,旨在定位信息性分析物(指纹)细节),其丰度在样品(frass vs. leaf)之间的高度变化可以被认为是相互作用的信息c . herbacea而且m . aquatica.对于二维色谱图的初步处理,使用了“视觉”特征方法;它由来自参考样品(或分析的)2d色谱图的算术减法得出的比较可视化,以揭示化学模式中的成分差异。
无花果。4的伪彩色比较m . aquatica叶片挥发物(参考图)与粗屑挥发物分布比较c . herbacea雌性种群以m . aquatica叶,而无花果。4 b描述的比较可视化c . herbacea男性人口不稳定。红色表示二维峰值在参考图像中更丰富(即图的叶子)。4而且b),而强烈的绿色峰是指在分析色谱中含量较多的峰。图中的黄色圆圈。4而且b表明细节作为潜在的生物转化和/或降解产物进行研究的特征,而粉红色圆圈表示分析物的性别特异性,因为它们在男性人群中仅存在于检测限以上。无花果。4摄氏度显示女性和男性挥发物的对比图(参考图)。在这种情况下,对比可视化证明了与性别相关的(半)定量差异之间的frass挥发物分布。浅蓝色圆圈表示二维峰值不变的函数c . herbacea性别,黄圈表示参考图中较多的峰(即雌性frass)。
动物肠道可培养细菌群落的特征c . herbacea雌的和雄的都在吃m . aquatica
10名男性和10名女性的肠道微生物c . herbacea在Luria-Bertani (LB)、酵母提取物蛋白胨葡萄糖(YEPD)和营养琼脂(NA)固体培养基上采用标准稀释镀技术进行纯培养分离。30°C培养24 h后可见菌落。女性肠道微生物滴度约为107在NA和LB板上的菌落形成单位(CFU)/mL(=每条肠道)5CFU/mL在YEPD板上。男性有10个7LB和NA板CFU/mL, YEPD板CFU约为103.CFU /毫升。共分离鉴定了形态各异的245个菌落,其中200个来自雌性,45个来自雄性(其差异是由于来自雌性的菌落比来自雄性的菌落具有更高的形态多样性)。
所有微生物分离株都采用BOX- pcr指纹图谱技术进行初步分组,该技术基于单个BOX- a1r引物,该引物针对细菌基因组中分散的重复BOX区域,并产生菌株特异性指纹图谱[39,40].该技术已成功用于分析细菌群落的微生物多样性[41].指纹由8-13个主要波段组成,大小约为250 ~ 3000 bp。在三个独立的实验中,BOX-PCR的重复性与分离株一样好。这些分析的结果表明,在女性分离株中存在10种不同的基因组模式(附加文件)1:图S1a,车道1-10)和男性分离株之间的6(补充文件1:图S1b, 11-16车道)。
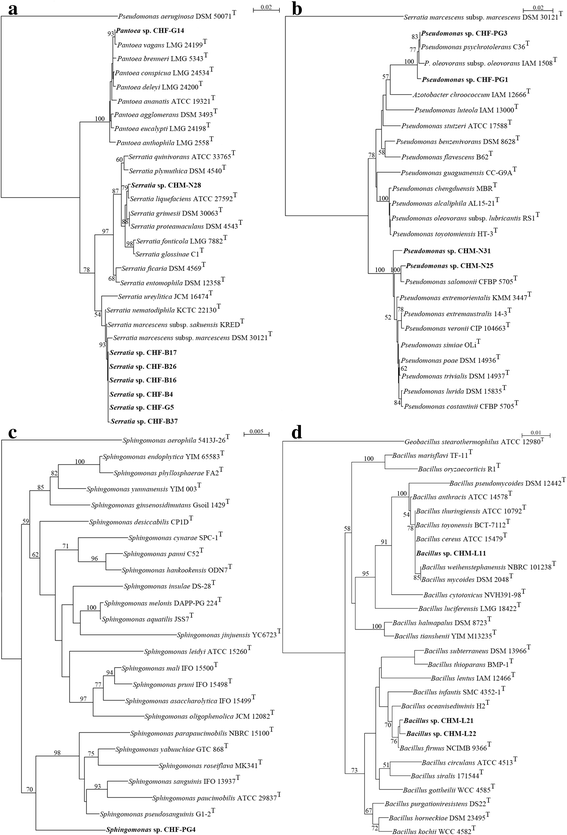
通过16S rrna编码基因测序对分离株进行鉴定。肠道分离株设计时使用CHF或CHM的缩写(用于c . herbacea女性或男性,隔离来源)后面跟着一个字母和序列号。分子数据显示,所有从女性肠道分离的细菌都属于α-或γ-变形菌门,属于以下属:沙雷氏菌属(chf-b4, chf-b16, chf-b17, chf-b26, chf-b37, chf-g5),Pantoea(CHF-G14),假单胞菌(CHF-PG1, CHF-PG3)和Sphingomonas(CHF-PG4)。而雄性肠道为γ-变形菌门假单胞菌(CHM-N25, CHM-N31)和沙雷氏菌属(CHM-N28)或厚壁菌属芽孢杆菌(CHM-L11, CHM-L21, CHM-L22)2).
可栽培品种16S rRNA基因序列的系统发育关系c . herbacea肠道细菌群落及其密切相关的参考菌株如图所示。5模拟。系统发育分析肠杆菌科树(图。5CHF-B4、CHF-B16、CHF-B17、CHF-B26、CHF-37和CHF-G5的16S rRNA基因序列与基因序列高度相似粘质沙雷氏菌无性系种群。sakuensis基米-雷克南T[42),美国marcescens无性系种群。marcescensDSM 30121T[43].CHM-N28分离株与型株聚在一起沙雷氏菌属liquefaciens国际马铃薯中心103238T[44(图。5),而分离出的CHF-G14序列的16S rRNA基因序列与的密切相关Pantoea vagans液化沼气24199T[45(图。5).
基于16S rRNA基因测序的可培养肠道细菌NJ系统发育树的女性(CHF)和男性(CHM)c . herbacea.的系统发育关系沙雷氏菌属CHF-B4, CHF-B16, CHF-B17, CHF-B26, CHF-B37, CHF-G5, CHM-N28和Pantoeasp. CHF-G14 (一个),假单胞菌CHF-PG1、CHF-PG3、CHM-N25及CHM-N31 (b),Sphingomonassp. CHF-PG4 (c),芽孢杆菌CHM-L11、CHM-L21及CHM-L22 (d)相对于参考菌株显示。引导值(以1000个重复的百分比表示)≥50表示在分支点。铜绿假单胞菌DSM 50071T,粘质沙雷氏菌无性系种群。marcescensDSM 30121T,Sphingomonas aerophila5413年J-26T而且Geobacillus stearothermophilus写明ATCC 12980T分别在A、B、C和D中作为外组。条形图,每个核苷酸位置的取代
系统发育分析假单胞菌科树(图。5 b)显示分离株CHF-PG1和CHF-PG3在包括参考株在内的集群中分枝假单胞菌psychrotoleransDSM 15758T[46),假单胞菌oleovorans无性系种群。oleovorans写明ATCC 8062T[47].并对分离株CHM-N25和CHM-N31进行了配置假单胞菌salomoniiCFBP 2022T集群(48].
系统发育分析Sphingomonadaceae树(图。5度)强调分离株CHF-PG4在一个新的分类簇中分枝。其16S rRNA基因序列与参比株相似度较低(97.62%)Sphingomonas pseudosanguinisG1-2T[49)(表2).
最后,对CHM-L11的系统发育数据进行了比对蜡样芽胞杆菌包括八个近亲物种的一组:b的仙人掌[50),炭疽杆菌[51),b基因[52),b . toyonensis[53),b . mycoides[54),b . pseudomycoides[55),b . weihenstephanensis[56),b . cytotoxicus[57(图。5 d).CHM-L21和CHM-L22与参比株聚在一起芽孢杆菌firmusNCIMB 9366T[58(图。5 d).
肠道相关细菌群落的有限培养无关分子分析
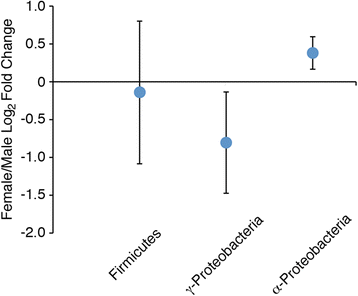
可培养肠道细菌的性别特异性分布使我们通过针对厚壁菌门、α-和γ-变形菌门16S rRNA基因序列的有限培养独立分子分析来探索细菌群落的多样性。分析首先采用标准PCR中细菌广谱引物对扩增男性和女性肠道菌群16S rRNA基因序列,然后采用门/亚门特异性引物对,采用半定量实时PCR分析可扩增厚壁菌门、α-和γ-变形菌门16S rRNA基因序列的相对数量(图。6和附加文件2:文件S1)。与培养依赖分析一致,实时PCR实验结果证实了所有样本中存在γ-Proteobacteria 16S rRNA基因序列,男性样本的定量值高于女性个体(图2)。6和附加文件2:文件S1)。此外,针对α-变形菌门(α-Proteobacteria)无法从雄性个体中分离出,采用特异性引物进行实时PCR扩增,雄性个体的定量值低于雌性个体。然而,与培养依赖分析的数据显示女性培养的肠道群落中不存在厚壁菌门相比,用厚壁菌门特异性引物进行实时PCR扩增,在男性和女性的DNA样本中产生了可扩增的信号,两者的定量值几乎相似。这种差异可以追溯到男性和女性厚壁菌门结构可能的性别特异性差异,以及不适宜的培养条件下分离的一些厚壁菌门成员(包括厌氧菌株),这些成员的存在可以通过实时PCR检测到。
用分离的肠道细菌进行交叉抑制试验c . herbacea女性和男性个体
在两性中发现的可培养肠道细菌群落的定性差异可能反映了两性的二态性(女性通常比男性大)c . herbacea因为内脏的解剖结构不同。然而,为了更好地理解这方面,我们通过执行一系列交叉抑制试验来测试分离株之间可能的生长不相容性,具体见方法(表2)3.和附加文件1:图S2)。如表所示3., 5个肠道分离物c . herbacea雌性(CHF-B4, CHF-B16, CHF-B17, CHF-B26和CHF-B37),系统发育与γ-变形菌门有关粘质沙雷氏菌无性系种群。sakuensis结果表明,3株雄性分离株(CHM-L11、CHM-L21、CHM-L22)均存在生长抑制区芽孢杆菌厚壁菌门,直径为0.52至3.52厘米。此外,这五种细菌对其他三种革兰氏阳性测试微生物如金黄色葡萄球菌[59),微球菌危害[60和放线菌链霉菌属ambofaciens[61].被测微生物能够在直径为0.90 ~ 2.93 cm的被测菌株上产生生长抑制区(表2)3.).相比之下,它们对雄性γ-变形菌分离物(CHM-N25, CHM-N28和CHM-N31)或两种γ-变形菌测试微生物没有显示出任何抗菌作用,大肠杆菌[62),美国血清[63].相反,从男性分离的肠道菌株对来自女性的菌株和测试微生物没有显示出可检测到的抗菌活性。值得注意的是,利福霉素B的生产者答:mediterraneiS699对3株雄性革兰氏阳性菌株(CHM-L11、CHM-L21、CHM-L22)的生长抑制作用直径为2.2 ~ 2.8 cm。这些抑制值与从女性肠道分离的5个菌株(CHF-B4, CHF-B16, CHF-B17, CHF-B26和CHF-B37)的抑制值相似,支持其强大的抗菌活性。
肠道细菌代谢的能力m . aquatica精油
为了阐明肠道细菌群落的可能作用c . herbacea女性和男性个体的适应c . herbacea来m . aquatica挥发物,我们分析了这些分离的肠道细菌利用精油作为唯一的碳(和能量)来源单独或在群落中生长的能力。所有16株菌株在固态或液态srm -油培养基上均能良好生长。特别是在液态srm -油介质中,所有被测细菌均达到1.0 OD的平均值60030°C孵育24小时后/mL(数据未显示)。肠道细菌使用精油作为唯一碳源单独生长的能力促使我们研究两种细菌群落使用体外方法对精油成分进行的可能修改。来自雄性或雌性的细菌被共同培养m . aquatica然后用搅拌棒吸附萃取(Stir Bar Sorptive Extraction, SBSE)技术从耗尽的生长介质中提取精油成分,并用气相色谱-质谱(GC-MS)进行定量分析(图。7).
生物转化的m . aquatica精油由c . herbacea性别特有的肠道微生物群落。m . aquatica精油与肠道细菌共培养从c . herbacea通过SBSE和GC-MS测定男性和女性个体,以及男性(蓝色)和女性(红色)特异性萜烯谱。与无细菌对照相比,数值以增加/减少的百分比表示。检测化合物:1、乙酸乙酯;2,α蒎烯;3、2、5-diethyltetrahydrofuran;4、莰烯;5、β月桂烯;6δ3-carene;7α萜品烯;8、2-heptanone; 9, (−)-limonene; 10, 1,8-cineole; 11, cis-β-ocimene; 12, γ-terpinene; 13, trans-β-ocimene; 14, 3-octanone; 15, p-ocimene; 16, α-terpinolene; 17, amyl isovalerate; 18, 3-nonanone; 19, 3-octanol; 20, all-trans-1,3,5-undecatriene; 21, 1-octen-3-ol; 22, 3-nonanol; 23, (−)-menthone; 24, (+)-menthofuran; 25, isomenthone; 26, β-bourbonene; 27, α-gurjunene; 28, L-linalool, 29, isopulegol; 30, isopulegone; 31, trans-β-caryophyllene; 32, 2-undecanone; 33, 4-terpineol; 34, menthol; 35, aromadendrene; 36, (+)-pulegone; 37, p-tolualdehyde; 38, α-humulene; 39, δ-terpineol; 40, α-amorphene; 41, guaia-9,11-diene; 42, α-terpineol; 43, borneol; 44, 4,7-dimethylbenzofuran; 45, δ-guaiene; 46, α-muurolene; 47, piperitone; 48, δ-cadinene; 49, γ-cadinene; 50, cis-p-mentha-2,8-dien-1-ol; 51, dihydro-agarofuran; 52, α-cadinene; 53, 2-tridecanone; 54, p-menth-1-en-9-ol; 55, cis-5-decen-1-yl acetate; 56, p-menth-1(7)-en-9-ol; 57, 2-tridecanol; 58, palustrol; 59, cis-jasmone; 60, 1-dodecanol; 61, dodecyl acrylate; 62, ledol; 63, caryophyllene alcohol; 64, cubenol; 65, fonenol; 66, globulol; 67, viridiflorol; 68, rosifoliol; 69, 5-guaiene-11-ol; 70, spathulenol; 71, cedrol; 72, longipinanol; 73, τ-cadinol; 74, carvacrol; 75, δ-cadinol; 76, α-cadinol; 77, mint furanone 2. Error bars represent standard deviations. Compounds that are also indicated in Fig.3.用橙色圈起来
气相色谱-质谱分析强调了肠道细菌修饰萜类成分的能力m . aquatica与不含细菌的对照组相比(图;7).3-壬烯醇(#22)、β-波旁烯(#26)、异丙烯醇(#29)、α-亚苯胺(#40)和长皮醇(#72)仅在女性肠道细菌群落上清中检测到(图2)。7).相比之下,3-nonanol(#22)和异丙烯醇(#29)是男性群落上清液中发现的新化合物(图。7).这些化合物在对照精油中完全不存在。7).此外,这两个群落能够改变主要的精油成分,如薄荷呋喃(#24),薄荷酮(#23),1,8-桉树脑(#10),柠檬烯(#9)和pulegone(#36)。如图所示。7,男性和女性肠道细菌群落都能降解薄荷呋喃。相比之下,对于薄荷酮、1,8-桉树脑和普莱贡化合物,两种肠道菌群的浓度均高于对照精油。d -柠檬烯在雄性群落中被降解,而在雌性群落中被代谢活性增强。这些结果表明,肠道细菌的潜在能力,以修改萜烯的概况m . aquatica精油可以调节植物和昆虫的相互作用。
讨论
细菌和昆虫之间的相互作用正在成为一个主要的讨论话题,特别是当细菌通过参与食物消化来促进昆虫的健康时。这种相互作用为昆虫提供了更好的营养、解毒、信息素的产生、pH值的调节、维生素和固醇的合成、耐温性、对病原体和拟寄生物的抵抗力。肠道细菌甚至可以改变植食性昆虫对寄主植物的利用[22,64- - - - - -66],从而影响昆虫的发育、抵御天敌、免疫、繁殖和物种形成[22,67- - - - - -73].
在目前的研究中,可培养的肠道细菌的作用c . herbacea雄性和雌性个体之间的高度特异关系,这种食草动物和m . aquatica被调查。通过结合化学模式和培养依赖的方法,我们发现在两性中有显著的定性差异。有趣的是,作为差异代谢的初步信息,女性frass分析物(30.05 μg/g±2.63)的浓度高于男性frass分析物(17.41 μg/g±2.05)。在这项工作中使用的算法实现了高度可靠和特定的指纹识别方法,已被证明是成功的复杂模式调查:包括乳腺癌代谢组学[74],生物油特性[75]和小鼠尿液代谢物谱[76],而峰区特征方法由前面详细描述的一系列操作组成[77- - - - - -80].
粪便的性别特异性化学模式与可培养肠道细菌的性别特异性分布平行。细菌分离程序显示α-和γ-变形菌门在女性肠道中选择性存在;相反,雄性肠道中同时含有γ-变形菌门和厚壁菌门2).这一结果仅与针对厚壁菌门、α-和γ-变形菌门16S rRNA基因序列的有限培养无关分子分析的结果部分一致。6和附加文件2:文件S1)。分析证实了男性和女性肠道中γ-变形菌门的存在,并表明在男性的可培养肠道群落中α-变形菌门的丰度较低。然而,它揭示了男性肠道中大量厚壁菌门的存在,强调了基于培养的方法的众所周知的局限性。
大多数来自两性的肠道细菌分离物在分类上与以前作为昆虫肠道细菌发现的物种有关[81].女性分离株CHF-B4、CHF-B16、CHF-B17、CHF-B26、CHF-B37和CHF-G5亲缘关系较近美国marcescens(无花果。5),是一种γ变形菌门,属于直翅目(蟋蟀和蚱蜢)、等翅目(白蚁)、鞘翅目(甲虫和象鼻虫)、鳞翅目(飞蛾)、膜翅目(蜜蜂和黄蜂)和双翅目(苍蝇)的许多种和属[81].从雄性分离的CHM-N28与美国liquefaciens(无花果。5),与美国marcescens甜菜根蛆(Tetanops myopaeformis)发育阶段,表明昆虫与微生物共生,以及营养上的相互依赖[82].另一方面,美国marcescens而且美国liquefaciens也被认为是70多个物种的潜在昆虫病原体[83].正如Stephens [84],昆虫的血淋巴通常对非病原体具有杀菌作用,但不能阻止潜在病原体的繁殖。食用叶片中的抗菌物质可能会干扰细菌的繁殖,但发现该属的菌株对这些物质有抗性[85].卵磷脂酶、蛋白酶和几丁质酶在毒力中起着至关重要的作用沙雷氏菌属对昆虫,并进行净化沙雷氏菌属蛋白酶或几丁质酶注射入血腔后毒性很大[86,87].
CHF-G14分离株与革兰氏阴性γ-变形菌系有亲缘关系p . vagans(无花果。5).p . vagansC9-1菌株最近被发现与生长真菌的蚂蚁有关[88].CHF-PG1与CHF-PG3在16S rRNA基因测序基础上似乎接近假单胞菌psychrotolerans而且p . oleovorans无性系种群。oleovorans(无花果。5 b),而分离株CHM-N25和CHM-N31为密切相关p . salomonii(无花果。5 b).据我们所知,这些属的物种假单胞菌从未被发现是昆虫肠道的殖民者。分子数据表明分离的CHF-PG4不属于该属先前的特征种Sphingomonas并占据了一个明显的分类位置(图;5度).Sphingomonas从动物内脏中分离得到Manduca sexta[89),按蚊stephensi[90),Helicoverpa armigera[91),Homalodisca vitripennis[92].最后,CHM-L11在分类上接近b基因;而CHM-L21和CHM-L22被生物化学和系统发育鉴定为b . firmus(图。5 d).菌株的b基因已从世界各地的许多生境中分离出来,包括土壤、昆虫、储存产品粉尘、落叶和针叶[93].值得注意的是,b基因在杀死宿主之前在各种昆虫的内脏中增殖[94].b . firmus是通过可栽培技术从鳞翅目害虫的内脏中分离出来的吗Helicoverpa armigera[91].
为了更好地阐明细菌群落存在质的差异的原因,我们测试了它们可能的生长不相容。我们证明了从女性肠道分离的5个菌株(CHF-B4, CHF-B16, CHF-B17, CHF-B26, CHF-B37)在分类和生物化学上被鉴定为无色素美国marcescens菌株对属于该属的雄性分离株具有抗菌活性芽孢杆菌(CHM-L11, CHM-L21, CHM-L22)(附加文件1:图S2)。类似的抗菌活性被发现对其他革兰氏阳性细菌用作测试微生物,包括金黄色葡萄球菌,m .危害而且美国ambofaciens(表3.).在所有其他病例中,未发现可检测到的生长抑制。这些结果与没有菌株属于美国marcescens从男性肠道中分离出来,在那里发现了许多革兰氏阳性细菌。
我们提供的证据表明肠道细菌c . herbacea能代谢吗m . aquatica精油成分。有趣的是,在男性和女性个体的frass挥发物分布模式之间发现了相关性(图2)。3.)和可培养的微生物群落对石油化合物的生物转化(图。7).特别是,32个样品中有9个(约28%)鉴定出了frass挥发物(即,莰烯、1-辛烯-3-醇、月桂烯、3-辛醇、柠檬烯、γ-松烯、薄荷呋喃、γ-cadinene和δ-cadinene;用橙色圈起来的无花果。3.而且7)在生物转化实验中表现出差异增减百分比,与它们在渣油中的相对丰度一致。这一结果可以提供一个间接的措施,如何培养微生物群落是具有代表性的实际原位社区。
来自女性和男性个体的两个细菌群落能够在体外利用并将许多萜类化合物转化为一系列新的化合物,这些化合物在对照样品中不存在(图2)。7).其中,在雌性和雄性细菌群落的耗尽培养基中分别检测到5个新化合物(3-壬烯醇、β-波博纳烯、异丙烯醇、α-亚苯、长皮醇)和2个新化合物(3-壬烯醇、β-波博纳烯)。3-nonanol(图中化合物#22)7)在蚂蚁的下颚腺分泌物中发现种蚂蚁sjostedti,这可能有助于物种识别,并导致物种特有的警报和防御反应,影响它们的竞争相互作用[95].β-波旁烯(图26号)7)被发现是一种植物来源的信息素化合物[96食草昆虫释放出来的Euceraphis punctipennis[97].异丙二醇(图中#29)7)是一种信息素[96]在蚂蚁的扁桃腺分泌物中发现阿兹台克chartifex[98].α-非苯基(图40号)7)存在于受干扰产生的幼虫体分泌物中Pachliopta aristolochiae个体为了躲避众多捕食者[99].大量已发表的研究证明了细菌在植物萜烯和萜类代谢中的作用[One hundred.- - - - - -105].虽然我们只关注可培养的肠道细菌,但我们假设这些新的挥发性有机化合物可能是肠道细菌代谢的结果,来自植物萜类化合物,可以被昆虫用作招募信号(由两个细菌群落产生)或性信息素(由细菌群落从女性个体产生)。在这方面,值得注意的是,从女性个体培养的细菌群落比从男性个体培养的细菌群落产生了更多样化的混合物,包括具有潜在性信息素活性的新化合物(即在对照样品中不存在的化合物)(β-波博纳烯[图26号])。7, α-amorphene[图中#40;7])。
此外,我们发现这两种细菌群落改变了两种主要精油成分薄荷呋喃(#24)和普莱酮(#36)的特征。与对照精油相比,这两种细菌群落都能降解薄荷呋喃,并提高pulegone的浓度(图2)。7).Pulegone是由完整的萜烯产生的m . aquatica植物吸引个体c . herbacea;相比之下,薄荷呋喃是由受感染的植物产生的,对其有很强的驱避活性c . herbacea[10].
方法
动植物材料
匍匐茎的各种aquaticaL.取自生长在Cambiano(意大利都灵省,alt 240 m a.s.l.)的野生种群。植物按先前报道的方式生长[10].的成年人Chrysolina herbacea(Duftschmidt 1825)(鞘翅目,金蝇科,金蝇科)采用手采法采集m . aquatica字段。采集后,在22°C的通风玻璃室中饲养m . aquatica岩屑。实验前对甲虫进行24小时的饥饿处理。
精油蒸馏
一公斤新鲜树叶m . aquatica用改良的Clevenger装置对岩屑进行水蒸馏[106],收集精油,在无水硫酸铵上干燥,并在5°C保存,以供进一步研究。
收集植物挥发物m . aquatica叶子和c . herbacea蛀屑
鲜活植物的新鲜叶子(约50毫克)m . aquatica在分析前立即小心采摘,轻轻放置在密封的2.0 mL小瓶中进行HS-SPME采样。采集的岩浆液Chrysolina herbacea饲养的种群m . aquatica叶片立即转移到精确称重的2.0 mL顶空瓶中,并放置在环境条件下固定时间。30分钟后,在HS-SPME取样前,将小瓶精确称重(以估计由于水/样品蒸发造成的重量损失)并密封。将二乙烯基苯/Carboxen/聚二甲基硅氧烷(DVB/CAR/PDMS) df 50/30 μm、2 cm长的SPME纤维装置手动插入密封瓶中,将纤维暴露在基体顶空进行挥发性采样。内部标准(ISTD)加载到SPME设备的过程已按前面所述执行[77使用α-丁烯酮。然后,将纤维在室温下暴露于顶空20分钟。ISTD加载后,再次在室温下暴露于frass顶空20分钟。
Frass分析物浓度计算基于外部校准曲线使用单萜和倍半萜。
挥发物GC × GC- ms分析
GC × GC分析在Agilent 6890气相分析仪和Agilent 5975质谱检测器在70 eV的EI模式下进行(Agilent, Little Falls, DE, USA)。传输线设置在270℃,离子源设置在230℃。使用Standard Tune选项,扫描范围为35-250 m/z,频率为12500 amu/s,采集频率为30 Hz。该系统配备了一个两级热调制器(美国德克萨斯州休斯顿的Zoex公司的KT 2004环调制器),用液氮冷却,热射流脉冲时间设置为250 ms,调制时间为4 s。热喷射温度方案为160°C至250°C,速度为3°C/min。失活的1.0 m × 0.10 mm的熔融硅环dc是使用。GC × GC列集由1D SE52色谱柱(95%聚二甲基硅氧烷,5%苯基)(30 m × 0.25 mmdc, 0.25 μmdf)连同2D OV1701色谱柱(86%聚二甲基硅氧烷,7%苯基,7%氰丙基)(1 m × 0.1 mmdc, 0.10 μmdf);柱子来自MEGA (Legnano(米兰)-意大利)。GC S/SL注入器:1/10分裂模式;温度:250°C;载气:恒流量、初始扬程压力280kpa的氦气;烘箱编程:从45°C(1分钟)到260°C(5分钟),2.5°C/min。数据由安捷伦- msd化学站ver .02.00.275(安捷伦科技,美国德州小瀑布市)获取,并使用GC Image软件,ver . 2.5 (GC Image, LLC Lincoln NE,美国)进行处理。
精油的GC-MS分析
精油采用气相色谱-质谱分析,系统由Agilent 6890 N气相色谱单元和在70 eV的EI模式下工作的5973A质谱检测器组成(Agilent, Little Falls, DE, USA)。转移线设定在280°C。Standard Tune选项用于35-250 m/z的扫描范围。气相色谱柱为ZB-5MS Zebron (Phenomenex, Torrance, CA, US)(95%聚二甲基硅氧烷,5%苯基)(30 m × 0.25 mmdc, 0.25 μmdf).GC S/SL注入器:无分路模式;温度:250°C;载气:恒流量氦气1.0 mL/min;烘箱编程:从60°C(51分钟)到270°C(5分钟),3°C/min。
微生物的媒体
采用LB (10.0 g/L NaCl, 10.0 g/L色氨酸,5.0 g/L酵母浸膏,15.0 g/L琼脂)、YEPD (10.0 g/L酵母浸膏,20.0 g/L蛋白胨,20.0 g/L d -葡萄糖,20.0 g/L琼脂)和NA (5.0 g/L色氨酸,3.0 g/L牛肉浸膏,15.0 g/L NaCl, 15.0 g/L琼脂)固体培养基分离雌雄个体肠道微生物c . herbacea.化学定义的SRM介质(1.0 g/L NH4H2阿宝4, 0.2 g/L KCl, 0.2 g/L MgSO4以1.0 g/L葡萄糖,15.0 g/L琼脂(根据需要)为基础,用乳剂代替葡萄糖,配制SRM-0培养基(不含葡萄糖)或srm -油培养基m . aquatica精油:DMSO (0.002%:0.25%, [v:v])在精油作为唯一碳源和能源的情况下测试细菌的生长情况。采用LB、NA、hickey - treresner (HT) (1.0 g/L酵母浸膏、1.0 g/L牛肉浸膏、2.0 g/L N-Z胺A、10.0 g/L淀粉、15.0 g/L琼脂)和GYM (4.0 g/L葡萄糖、4.0 g/L酵母浸膏、10.0麦芽浸膏、2.0 g/L CaCO3、琼脂15 g/L)固体培养基进行微生物测定。
可培养肠道细菌的分离c . herbacea女性和男性个体
将两个昆虫池(雄性和雌性),每个池由10只个体组成,放置在无菌生理溶液(0.9% NaCl)中。用10ml 0.9% (w/v)无菌NaCl溶液将每个虫池悬浮液换液,冲洗3次。然后,用3% (v/v) H处理冲洗过的昆虫池2O2保持20秒,最后用70% (v/v)乙醇冲洗并快速燃烧。每只昆虫的喉咙都用无菌手术刀切开,头部被取出。将切下的昆虫的腹部压紧,将整个肠道收集在含有2-3 g无菌玻璃微珠(φ 0.5 mm)的5 mL LB肉汤中,强烈涡旋4 - 5分钟,然后在4°C下洗脱过夜。为了去除肠道碎屑,样品以2000 × g离心1 min,然后将1:10连续稀释的上清液转移到LB、NA和YEPD固体介质表面并镀上。样品在30°C的好氧或微嗜氧条件下孵育24小时。在此培养时间后,从每种琼脂培养皿培养基中提取一些具有不同形态的菌落,并将其划入新鲜培养皿中。仅使用菌落数量在50至200之间的培养皿分离纯培养物。用显微镜检查纯培养物,并在−80°C保存在上述琼脂斜面中或在加20% (v/v)甘油的肉汤中。
DNA程序
所有肠道细菌(200个来自女性,45个来自男性)在上述20 mL液体培养基中旋转摇摇至对数期晚期。2000 × g离心20 min后,在500 μL SET缓冲液(75 mM NaCl, 25 mM EDTA, 20 mM Tris-HCl pH 7.5)中重悬。加入溶菌酶终浓度为1mg /mL (w/v), 37℃孵育1 h。然后分别加入十二烷基硫酸钠(SDS)和蛋白酶K,终浓度分别为1% (v/v)和0.5 mg/mL (w/v), 55℃水浴孵育2 h,定期搅拌。按标准程序采用苯酚:氯仿:异戊醇(25:24:1 [v/v/v])法提取总核酸[107]和RNase A(终浓度15 μg/mL)去除污染物RNA。提取后,以高分子量DNA为模板进行聚合酶链反应(pcr),扩增重复性外基因回文(REP)或BOX区域[108]和16S rRNA编码基因的部分长度。
对于不依赖培养的分析,如上所述,取出男性和女性个体的总肠道,并在装有玻璃珠(直径0.55 mm)和0.5 mL SET缓冲液的无菌管中均质,使用无菌杵将其均质15分钟。采用标准苯酚-氯仿-乙醇沉淀法提取总DNA [107].
BOX-PCR基因组指纹图谱
如前所述,对所有分离株进行BOX-PCR基因组指纹分析[109]使用BOXA1-R引物(5 ' -CTACGGCAAGGCGACGCTGACG-3 ')。PCR产物用1% (w/v)琼脂糖凝胶在1× TBE缓冲液中分离[107].这项分析使我们确定了16种不同的基因组模式(10种来自女性,6种来自男性)。为了更好地表征这16株具有不同BOX谱的肠道分离菌,进行了分子鉴定。
16S rRNA基因测序及系统发育分析
几乎整个16S rRNA基因(从核苷酸20到核苷酸1488的对应大肠杆菌使用引物16SE20-42-F/16SEB683-R(对应于大肠杆菌位置20至683)[109,110], Com1-F/Com2-R(对应于大肠杆菌职位519至926)[111], 16SEB785-F/16SEB1488-R(对应于大肠杆菌职位785至1488)[109,110].这些引物对扩增了连接(部分重叠)的DNA区域。PCR产物在1× TAE缓冲液(40 mM Tris-acetate, 1 mM EDTA, pH 8.0)中用琼脂糖凝胶分离,使用Qiaex II凝胶提取试剂盒(Qiagen)进行回收,并使用MWG生物技术客户测序服务(德国)用于各自扩增的相同引物对进行测序。将分离菌株的序列与EzTaxon-e server中与其密切相关的参考菌株的序列进行比较[112].利用京都大学生物信息中心的ClustalW程序对每对序列进行多序列比对(http://www.genome.jp/tools/clustalw/),如上文所述[113].使用SeaView软件构建系统发育树[114]根据相邻连接(NJ) [115],以及Kimura双参数算法[116].基于1000次重采样数据的自举分析确定树的鲁棒性[117].
有限的肠道细菌培养无关分析
用细菌广谱引物Com1-F和16SEB1488-R(扩增子长度969 bp)分别从3个男性和3个女性个体(生物三复制)的肠道群落中扩增16S rRNA基因序列。采用门/亚门特异性引物对,采用半定量实时荧光定量PCR法测定可扩增厚壁菌门、α-和γ-变形菌门16S rRNA基因序列的相对数量。
引物设计基于SILVA rRNA数据库项目中经过质量检查和对齐的序列的代表性系统发育数据集[118) (http://www.arb-silva.de).引物序列和扩增子长度报告如下。
对于半定量实时PCR,每个反应都在SmartCycler系统(Cepheid)上运行,该系统包含SsoAdvanced Universal SYBR Green Supermix (BIO-RAD)和以下引物对:Firm934-F/Firm1060-R(针对厚壁菌门16S rRNA,扩增子长度126 bp) [119], Gamma877-F/Gamma1066-R (γ-变形菌门16S rRNA特异性,扩增子长度189 bp) [119], ADF681-F/ADF1362-R(针对α-Proteobacteria 16S rRNA,扩增子长度681 bp) [120].以Com1-F/16SEB1488-R引物对为对照进行归一化。
实时PCR样本在以下条件下运行:94°C下3 min, 94°C下30 s, 55°C下30 s, 72°C下30 s,共35个循环。使用门/亚门特异性引物的雄性和雌性样品的周期阈值(ΔCt)值差异归一化为ΔCt与对照引物的差异。
微生物化验
为了确定分离出的肠道细菌是否能抑制其他细菌的生长,进行了如下的微生物实验。用于测定抗生素活性的菌株(在表中称为“测定菌”)3.生长后,使用直径为1厘米的无菌金属圆筒,取出装有检测细菌的琼脂盘,放置在含有用于检测抗生素活性的细菌悬浮液的固体琼脂培养基上(如上所述)(在表中称为“测试细菌”)3.),最终浓度为0.03 OD600海里/毫升。所有来自男性和女性的肠道细菌都以不同的组合交叉作为“测定”和“测试”微生物。另外,以以下参比菌株作为检测微生物:大肠杆菌菌株FB8 [62),美国血清无性系种群。血清血清型鼠伤寒毒株LT2 ATCC 700720T[63),金黄色葡萄球菌菌株SA-1 [59),m .危害菌株ML-1 [60),美国ambofaciens菌株ATCC 23877 [61].利福霉素B生产者Amycolatopsis mediterraneiS699被用作产生抗生素的对照菌株[121].使用以下固体培养基:LB用于所有肠道细菌的培养,大肠杆菌菌株FB8和美国血清无性系种群。血清血清型鼠伤寒毒株LT2;NA对金黄色葡萄球菌菌株SA-1和m .危害应变ML-1;HT的美国ambofaciens菌株ATCC 23877;健身房的答:mediterraneiS699。每个平板在不同的温度下孵育24小时,温度取决于所利用的测试细菌菌株:28°C美国ambofaciens菌株ATCC 23877, 30°C为所有肠道细菌,37°C为大肠杆菌应变FB8,年代.鼠伤寒LT2菌株,金黄色葡萄球菌菌株SA-1和m .危害应变ML-1。在此培养时间后,琼脂盘周围可见生长抑制区,表明所测菌株对被测微生物的抑菌活性。在含有被测细菌的琼脂圆盘上减去1 cm直径后,测量生长抑制带的直径,并根据三个独立的实验计算平均值±SD。
肠道细菌在化学培养基上的生长
通过用溶解dmso的葡萄糖替代葡萄糖,我们评估了肠道细菌在化学定义的SRM、SRM-0(不含葡萄糖)或SRM-油介质中生长的能力m . aquatica精油(0.002%:0.25% [v:v])。初步,二甲基亚砜(DMSO)对细菌生长/存活的最终副作用已被Del Giudice等人先前描述。[One hundred.作了一些修改。简单地说,在30°C不摇晃生长的对数相细菌细胞接种于6 mL SRM培养基中,最终浓度约为1 × 105细胞/毫升。加入DMSO以达到所需的最终浓度,混合物在30°C下旋转振荡孵育。在不同时间间隔(24、30、36 h)取0.1 mL培养样品,适当稀释(1:10、1:100、1:100在SRM中),镀于SRM琼脂上,测定细菌效价。评估…的效果m . aquatica精油对细菌生长的抑制作用,将精油溶解在0.25% (v/v) DMSO中,合适的浓度对细菌生长无抑制作用。当DMSO取代葡萄糖而没有精油时,没有菌株能够生长。
肠道细菌的生长m . aquatica精油
我们还测试了细菌分离物在个体和社区中生长的能力m . aquatica精油作为唯一的碳(和能源)来源并对其进行生物转化。在SRM培养基中,30°C旋转震动,单独培养至对数期中期。在此培养时间后,将细胞离心,洗涤两次,重新悬浮在SRM-0培养基中(不含葡萄糖),并以适当的稀释度(1:10,1:100,1:1000在SRM中)镀于添加了a的SRM固体培养基上m . aquatica精油:DMSO乳液(0.002%:0.25%,[v/v])。然后,将在固体srm -油培养基上生长的微生物分别接种到液态srm -油培养基中,30℃,旋转振荡48 h,直至对数相中期,达到平均值1.0 OD600海里/毫升。最后,取之前每个个体生长的0.1 mL,用于将两个细菌群落接种到液态srm -油培养基中。其中一个菌落包含从女性肠道分离的菌落(CHF-B4、CHF-B16、CHF-B17、CHF-B26、CHF-B37、CHF-G5、CHF-G14、CHF-PG1、CHF-PG3、CHF-PG4),另一个菌落包含从男性肠道分离的菌落(CHM-L11、CHM-L21、CHM-L22、CHM-N25、CHM-N28、CHM-N31)。两个菌种在30℃下孵育约40 h。去除细菌细胞,上清液经Millipore过滤器(0.22 μm)进一步纯化后提取(见下图)。
细菌代谢转化的SBSE-GC-MS分析
菌株在SRM中生长至对数生长后期(约30 h), 28°C,摇晃。细菌离心,洗涤两次,在OD下重新悬浮于SRM-0中6002 ml SRM-0培养基中加入8.0 mM l -谷氨酸,20 μg/ml dmso溶解m . aquatica精油在28°C浸泡40小时。将细菌细胞旋转,上清液经Millipore过滤器(孔径为0.22 μm)进一步纯化后提取。如前所述,使用SBSE直接浸泡并将SBSE搅拌到上清液中,以提取被细菌生物转化的化合物[One hundred.].
16S rRNA GenBank登录号
16株细菌的16S rDNA核苷酸序列存入GenBank,登录号如下:沙雷氏菌属sp. CHF-B4 (KP325087),沙雷氏菌属sp. CHF-B16 (KP325088),沙雷氏菌属sp. CHF-B17 (KP325089),沙雷氏菌属sp. CHF-B26 (KP325090),沙雷氏菌属sp. CHF-B37 (KP325091),沙雷氏菌属sp. CHF-G5 (KP325092),Pantoeasp. CHF-G14 (KP325093),假单胞菌sp. CHF-PG1 (KP325094),假单胞菌sp. CHF-PG3 (KP325095),Sphingomonassp. CHF-PG4 (KP325096),芽孢杆菌sp. CHM-L11 (KP325097)芽孢杆菌sp. CHM-L21 (KP325098)芽孢杆菌sp. CHM-L22 (KP325099)假单胞菌sp. CHM-N25 (KP325100),沙雷氏菌属CHM-N28 (KP325101),假单胞菌sp. CHM-N31 (KP325102)。
统计分析
总的来说,所有实验都至少重复了三次。对于化学分析,实验重复三次(生物重复),每次实验至少15株植物和30-50只昆虫。每个生物重复进行3个技术重复。折叠变化数据以平均值表示,所有测定的标准差一般小于10%。采用方差分析(ANOVA)和Tukey检验评估样本间的差异。
缩写
- 方差分析:
-
方差分析
- 菌落:
-
菌落
- DMSO溶液:
-
二甲亚砜
- DVB /汽车/ PDMS:
-
二乙烯基苯/ Carboxen /聚二甲硅氧烷
- EDTA:
-
乙二胺四乙酸
- 气相:
-
一维气相色谱-质谱法
- GCxGC-MS:
-
二维气相色谱-质谱联用
- 健身:
-
葡萄糖酵母麦芽
- HS-SPME:
-
顶空固相微萃取
- HT:
-
Hickey-Tresner
- ISTD:
-
内部标准
- 磅:
-
Luria-Bertani
- MVOCs:
-
微生物挥发性有机化合物
- 拿拿淋:
-
营养琼脂
- NJ:
-
Neighbour-joining
- 代表:
-
重复的基因外回文
- SBSE:
-
搅拌棒吸附萃取
- SD:
-
标准偏差
- SDS:
-
十二烷基硫酸钠
- 设置:
-
EDTA三盐酸钠
- TAE:
-
三乙酸EDTA
- 此种:
-
三硼酸EDTA
- YEPD:
-
酵母提取物蛋白胨葡萄糖
- ΔCt:
-
循环阈值
参考文献
- 1.
陈淑梅。诱导植物直接防御植食性昆虫的研究进展。昆虫学报2008;15:101-14。
- 2.
凯斯勒A,鲍德温IT。食草动物诱发植物挥发性排放物的防御功能。科学。2001;291:2142-3。
- 3.
Van Poecke RMP, Dicke M.植物对食草动物的间接防御:利用拟南芥作为一个模范植物。植物学报2004;6:387-401。
- 4.
植物对昆虫食草动物的免疫。植物物理学报。2008;59:41-66。
- 5.
马费伊。植物挥发物的合成、生物化学和功能作用部位。中国生物医学工程学报(英文版),2010;
- 6.
植物诱导挥发物:从基因到气候变化。植物科学进展,2010;15:115-7。
- 7.
迪克M,鲍德温IT。食草动物诱导植物挥发物的进化背景:超越“呼救”。植物科学进展,2010;
- 8.
划线器JM。昆虫-植物关系的进化:化学约束、共适应和昆虫/植物性状的一致性。中国昆虫学报,2002;26(4):344 - 344。
- 9.
法雷尔BD,米特C.适应辐射在昆虫和植物-时间和机会。Amer Zool. 1994; 34:57-69。
- 10.
Zebelo SA, Bertea CM, Bossi S, Occhipinti A, Gnavi G, Maffei ME。Chrysolina herbacea调节萜类生物合成各种aquatica科学通报。2011;6:e17195。
- 11.
Cordero C, Zebelo SA, Gnavi G, Griglione A, Bicchi C, Maffei ME,等。HS-SPME-GC × GC-qMS挥发性代谢物谱分析Chrysolina herbacea蛀屑和各种种虫害的叶子。生物化学。2011;402:1941-52。
- 12.
劳伦斯BM。薄荷:薄荷属。博卡拉顿:CRC;2007.
- 13.
马菲梅,萨可。2种薄荷无形态的化学和形态测量比较。植物医学杂志,1987;53:214-6。
- 14.
马费伊。的化学型各种叶(l)哈德逊中特别富含辣椒酮氧化物。风味Fragr . 1988; 3:23-6。
- 15.
马菲梅,Chialva F,萨科T.在发育薄荷叶腺毛和精油。一、叶片中盾状毛状体数量和萜烯分布的变化。新植物化学。1989;111:707-16。
- 16.
Kanchiswamy CN, Malnoy M, Maffei ME。微生物挥发物的化学多样性及其对植物生长和生产力的潜力。前沿植物科学2015;6.doi: 10.3389 / fpls.2015.00151
- 17.
王志刚,王志刚,王志刚,王志刚。单萜类化合物和倍半萜类化合物的微生物转化。汽巴发现公司1985;111:146-60。
- 18.
杜志刚,王志刚,王志刚,王志刚。d -柠檬烯生物转化为(+)反式香椿醇的研究红球菌属蔽光的PWD4细胞。应用环境微生物学,2001;67:2829-32。
- 19.
Duetz WA, Bouwmeester H, van Beilen JB, Witholt B.柠檬烯在细菌、真菌、酵母和植物中的生物转化。中国生物医学工程学报,2003;
- 20.
毕克思,冯塔尼,彭志强。单萜类生物转化的研究进展。中国生物医学工程学报。2008;29(5):531 - 531。
- 21.
克林斯·尤,伯杰,RG。萜烯生物转化——它的未来前景如何?电子学报。2010;5:1507-22。
- 22.
Dillon RJ, Dillon VM。昆虫的肠道细菌:非致病性相互作用。昆虫学报2004;49:71-92。
- 23.
Hammer TJ, Bowers MD.肠道微生物可能促进化学防御植物的昆虫食草。环境科学。2015;179:1-14。
- 24.
Ceja-Navarro JA, Vega FE, Karaoz U, Hao Z, Jenkins S, Lim HC, Kosina P, Infante F, Northen TR, Brodie EL。肠道菌群介导咖啡主要害虫咖啡因解毒。Nat Commun. 2015;6:7618。
- 25.
布恩CK,基弗-环K,梅普斯AC,亚当斯AS,波尔曼J,拉法KF。2013.与杀死树木的昆虫有关的细菌会降低植物防御化合物的浓度。化学学报。2013;39:1003-6。
- 26.
Welte CU, de Graaf RM, van den Bosch TJ, Op den Camp HJ, van Dam NM, Jetten MS.白菜根蝇幼虫肠道微生物群中的质粒编码SaxA,催化植物毒素2-苯乙基异硫氰酸酯的转化。环境微生物,2016;18:1379-90。
- 27.
布伦A,迈阿密比E,布雷兹纳克JA。氧气和肠道菌群在白蚁代谢木质素衍生苯丙烷和其他单芳香族化合物中的作用。应用环境微生物学。1995;61:2688-95。
- 28.
克罗托R,阿隆索WR,科普AE,约翰逊MA。单萜的生物合成:1,8-桉树脑合酶的部分纯化、表征和作用机制。生物化学,1994;309:184-92。
- 29.
李志刚,李志刚,李志刚,等。桉树精油中主要成分1,8桉树脑的生物活性研究罗勒属kenyense(Ayobangira)对抗储存产品甲虫。应用昆虫学报,1997;21(3):337 - 344。
- 30.
施密特S,沃尔特GH,摩尔CJ。以桃金娘为食的紫叶锯蝇的寄主植物适应:精油及其形态和行为Pergagrapta幼虫(膜翅目,叶蜂科,叶蜂科)。中国生物医学工程学报,2000;
- 31.
索思韦尔IA,罗素MF,马多克斯CDA,惠勒GS。1,8-桉树脑在昆虫体内的差异代谢。化学学报,2003;29:83-94。
- 32.
卡门RM,克利卡KD。部分外消旋化合物,如帚尾负鼠尿代谢物。化学工程学报。1992;45:651 - 651。
- 33.
索思韦尔内务部,马多克斯CDA,扎鲁基议员。1,8-桉树脑在茶树中的代谢(白千层属灌木alternifolia而且白千层属灌木linariifolia) by pyrgo beetle (Paropsisterna tigrina).化学学报,1995;21:439-53。
- 34.
弗莱彻MT,洛LM,基钦W,科尼格WA。Leichhardt 's grasshopper的化学,Petasida ephippigera,及其寄主植物,Pityrodia jamesii,p . ternifolia,p . pungens.化学学报,2000;26:2275-90。
- 35.
Kanchiswamy CN, Malnoy M, Maffei ME。可持续农业中细菌和真菌挥发物的生物勘探。植物科学进展,2015;20:206-11。
- 36.
Zebelo SA, Maffei ME。早期信号事件在植物-昆虫相互作用中的作用。中国生物医学工程学报,2015;
- 37.
马菲,李志刚,李志刚。植物反应的自然激发子、效应子和调制器。陈国强,2012;29:1288-303。
- 38.
有村G,小泽R,马菲ME。植物早期信号响应食草性的最新进展。中国生物化学杂志,2011;
- 39.
卢斯,傅布赖特DW,斯蒂芬斯CT,德布鲁因FJ。利用重复测序和PCR技术,获得植物病原黄单胞菌和假单胞菌及菌株的特异性基因组指纹图谱。应用环境微生物学,1994;
- 40.
郭志刚,李志刚,李志刚,等。离散重复序列的微分子序列守恒链球菌引起的肺炎不同细菌中的BOX元素。基因组决议1995;5:408-18。
- 41.
Berg G, Krechel A, Ditz M, Sikora RA, Ulrich A, Hallmann J.马铃薯内生和外生细菌群落对植物病原真菌的结构和拮抗功能差异。中国生物医学工程学报,2005;
- 42.
Ajithkumar B, Ajithkumar VP, Iriye R, Doi Y, Sakai T.孢子形成粘质沙雷氏菌无性系种群。sakuensis无性系种群。11月,从生活污水处理槽中分离出来。中国生物医学工程学报,2003;23(3):329 - 329。
- 43.
比齐奥B. Lettera di Bartolomeo比齐奥al chiarissimo canonico Angelo Bellani sopra il现象della polporina玉米。圣经科学与艺术1823; 30:275 - 95。
- 44.
Bascomb S, Lapage SP, Willcox WR, Curtis MA。Klebsielleae族的数量分类。微生物学杂志。1971;66:279-95。
- 45.
Brady CL, Venter SN, Cleenwerck I, Engelbeen K, Vancanneyt M, swinging J,等。Pantoea vaganssp. 11月。Pantoea桉树sp. 11月。Pantoea deleyi十一月及Pantoea anthophila中华微生物学杂志,2009;59:2339-45。
- 46.
侯泽华,张志强,张志强。假单胞菌psychrotoleranssp. nov. Int J Syst evolol microbiology, 2004; 54:1633-7。
- 47.
李敏,钱德勒。切割化合物中细菌的性质、生长和控制的研究。《细菌学杂志》,1941;41:373-86。
- 48.
贾丹·L,贝拉·P,梅尔·JM,克里斯滕·R,罗特·P,阿楚克·W,等。假单胞菌salomonii对大蒜的致病性较强假单胞菌palleronianaSp. 11月,从水稻中分离。中国生物医学工程学报。2002;42(2):366 - 366。
- 49.
张志刚,张志刚,张志刚。Sphingomonas pseudosanguinisSp. 11,与空气加湿器的水箱隔离。中国生物医学工程学报,2007;29(3):342 - 342。
- 50.
空气中几种新微生物的研究。Philos Trans Roy Soc B. 1887; 178:257-87。
- 51.
Cohn F. Untersuchungen über Bakterien。生物学报。1872;1:127-224。
- 52.
柏林人E. Über die Schlaffsucht der Mehlmottenraupe (Ephestia kuhniellaZell) und ihren Erreger苏云金杆菌n sp. Zeitschrift fur angewandte Entomologie Berlin 1915; 2:29-56。
- 53.
Jimènez G, Urdiain M, Cifuentes A, Lopez-Lopez A, Blanch AR, Tamames J,等。的描述芽孢杆菌toyonensis属一新种蜡样芽胞杆菌类群,以及通过ANI计算对该类群的种进行两两基因组比较。生物工程学报。2013;36:383-91。
- 54.
Flügge KGFW, Flügge C. Die Mikroorganismen: mit besonderer Berücksichtigung der Aetiologie der Infektionskrankheiten。沃格尔,莱比锡:F.C.W;1886.
- 55.
中村路。芽孢杆菌pseudomycoides中华微生物学杂志1998;48:1031-5。
- 56.
Lechner S, Mayr R, Francis KP, Prüss BM, Kaplan T, Wiessner-Gunkel E,等。芽孢杆菌weihenstephanensisSp . Nov.是一种耐冷新种蜡样芽胞杆菌组。中华微生物学杂志,1998;48:473 - 482。
- 57.
Guinebretière MH, Auger S, Galleron N, Contzen M, De Sarrau B, De Buyser ML,等。芽孢杆菌cytotoxicusSp . Nov.是一种耐热新种蜡样芽胞杆菌群体偶与食物中毒有关。中国生物医学工程学报,2013;
- 58.
Werner W. Botanische Beschreibung haufiger am Buttersaureabbau beteiligter sporenbildender Bakterienspezies。中国寄生虫病防治杂志,2003,26(1):1 - 7。
- 59.
Lee JC, Michon F, Perez NE, Hopkins CA, Pier GB。从粘液中分离得到的荚膜多糖的化学性质及免疫原性金黄色葡萄球菌.《感染Immun》1987;55:21 191 - 7。
- 60.
小电视,Majo JA,斯皮策WP。DNA的合成微球菌危害对6-(对羟基苯偶氮)尿嘧啶耐药。中华微生物学杂志,1980;26:640-2。
- 61.
coar C, Ninet L, Pinnert-Sindico S, Preud 'Homme J.一种抗生素产生的锥虫杀灭作用链霉菌属.《学术期刊》1952;234:1498-9。
- 62.
Kasai T.组氨酸操纵子表达的调控鼠伤寒沙门氏菌.大自然。1974;49:523-7。
- 63.
Tindall BJ, Grimont PAD, Garrity GM, Euzèby JP。属的命名法和分类学沙门氏菌.中华微生物学杂志,2005;5:521 - 4。
- 64.
根达FA,狄龙,泰拉WR,费雷拉C.肠道菌群在细胞壁消化和葡萄糖苷解毒中的潜在作用Tenebrio莫利托幼虫。中国昆虫学报。2006;26(2):529 - 529。
- 65.
细菌共生体作为昆虫寄主重要生态性状的介质。昆虫学报。2011;36:533-43。
- 66.
Ferrari J, Vavre F.昆虫中的细菌共生体或群落影响群落的故事。中国生物医学工程学报(自然科学版)2011;
- 67.
赫斯特GD, Werren JH。自私基因元件在真核生物进化中的作用。《中国日报》2001;2:597-606。
- 68.
brendle C, Miura T, Bickel R, Shingleton AW, Kambhampati S, Stern DL。蚜虫细菌细胞的发育起源和进化Buchnera共生关系。公共科学图书馆。2003;1:E21。
- 69.
Koropatnick TA, Engle JT, Apicella MA, Stabb EV, Goldman WE, McFall-Ngai MJ。宿主-细菌互惠共生中的微生物因子介导的发展。科学。2004;306:1186-8。
- 70.
支持F, Ley RE, Sonnenburg JL, Peterson DA, Gordon JI。人类肠道中的宿主-细菌互惠共生。科学。2005;307:1915-20。
- 71.
植物吸吮昆虫细菌细胞相关内共生生物的生物学。微生物学,2005;59:55-89。
- 72.
Macdonald TT, Monteleone G.肠道免疫、炎症和过敏。科学。2005;307:1920-5。
- 73.
道格拉斯AE。昆虫营养生态学中的微生物维度。生态学报2009;23:38-47。
- 74.
Reichenbach SE, Tian X,陶qp, Ledford EB, Wu ZP, Fiehn O.综合二维气相色谱-高分辨率质谱(GCxGC-HRMS)交叉样品分析的信息学。Talanta。2011;83:1279 - 88。
- 75.
赖兴巴赫SE,田X,博阿滕AA,马伦CA,科德罗C,陶QP。可靠的峰选择多样品分析与综合二维色谱。《肛肠化学》2013;85:4974-81。
- 76.
Bressanello D, Liberto E, Collino M, Reichenbach SE, Benetti E, Chiazza F,等。平行双二级柱-双检测二维综合气相色谱法对饮食代谢紊乱小鼠尿代谢指纹图谱的研究。中国生物医学工程学报(英文版);2014;
- 77.
Cordero C, Zebelo SA, Gnavi G, Griglione A, Bicchi C, Maffei ME,等。HS-SPME-GCxGC-qMS挥发性代谢物谱分析Chrysolina herbacea蛀屑和各种种虫害的叶子。生物化学。2012;402:1941-52。
- 78.
陶强,田鑫,李晓霞,陶强。综合二维色谱技术在非目标交叉样品分析中的应用。中国生物化学学报(英文版);2012;
- 79.
Cordero C, Liberto E, Bicchi C, Rubiolo P, Reichenbach SE, Tian X,等。GCxGC-qMS复杂自然样品分析的目标和非目标方法。环境科学学报,2010;
- 80.
Cordero C, Liberto E, Bicchi C, Rubiolo P, Schieberle P, Reichenbach SE,等。综合二维气相色谱-质谱分析食品挥发物:比较分析烤榛子挥发性成分的先进指纹识别方法(Corylus avellanaL.)来自不同的来源。中国生物医学工程学报(英文版);2010;
- 81.
格里蒙特F,格里蒙特PAD。属沙雷氏菌属.中国科学院学报(自然科学版);2006;6:19 - 44。
- 82.
艾弗森KL,布罗梅尔MC,安德森AW,弗里曼TP。甜菜根蛆中的细菌共生体Tetanops myopaeformis(冯·罗德)。应用环境微生物学。1984;47:22-7。
- 83.
通用电气机械舞。昆虫潜在的细菌病原体及其特征。《昆虫病理学杂志》1960;2:172-95。
- 84.
斯蒂芬斯JM。部分正常昆虫血淋巴的杀菌活性。昆虫病原学杂志。1963;5:61-5。
- 85.
叶中青,李志刚。植物叶片中的抗菌物质及其在昆虫抗病性中的作用。昆虫病理学杂志。1962;4:155-84。
- 86.
细菌胞外蛋白酶的毒性粘质沙雷氏菌大蜡蛾幼虫。中华民国医学杂志。1976;27:7 7。
- 87.
几丁质酶粘质沙雷氏菌以及对昆虫的毒性。中华病理学杂志。1976;27:38 6 - 6。
- 88.
Aylward FO, Suen G, Biedermann PHW, Adams AS, Scott JJ, Malfatti SA,等。昆虫真菌农业系统中的聚合细菌微生物群。MBio。5 (6): e02077-14。2014;doi:10.1128 / mBio.02077-14.
- 89.
范德胡芬R, Betrabet G, Forst S.肠道细菌群落的特征Manduca sexta以及抗生素对细菌多样性和线虫繁殖的影响。FEMS微生物学杂志2008;286:249-56。
- 90.
Djadid ND, Jazayeri H, Raz A, Favia G, Ricci I, Zakeri S.中肠菌群的鉴定一个。stephensi而且一个。maculipennis用于对抗疟疾的副转基因工具。PLoS ONE。2012; 6: e28484。
- 91.
贾亚丽·普里亚N, Ojha A, Kajla MK, Raj A, Rajagopal R.寄主植物诱导肠道细菌变异Helicoverpa armigera.科学通报。2012;7:e30768。
- 92.
Rogers EE, Backus EA.利用个体昆虫的16S rRNA基因测序探索玻璃翼神枪手的前前肠微生物群。科学通报,2014;9:e106215。
- 93.
卢建勇,崔志勇,李淑梅,金宝荣,济永。苏云金杆菌作为一种特殊、安全、有效的害虫防治工具。生物工程学报。2007;17:547-59。
- 94.
杨晓明,杨晓明,杨晓明。土壤腐生植物生命周期分析蜡样芽胞杆菌在液体土壤中提取,在土壤中提取。应用环境微生物学。2006;72:4970-7。
- 95.
伍德华,彭志强,陈志强。三种不同类型下颌腺挥发物的比较种蚂蚁蚂蚁的共生体是刺槐。生物化学学报。2002;30:217-22。
- 96.
El-Sayed。信息素数据库:信息素和半化学物数据库。http://www.pherobase.com.访问2016年2月9日。
- 97.
Francis F, Vandermoten S, Verheggen F, Lognay G, Haubruge E.是(E)-β-法尼烯在蚜虫中仅为挥发性萜类?应用昆虫学报,2005;29(4):529 - 531。
- 98.
Do Nascimento RR, Billen J, Sant 'Ana AEG, Morgan ED, Harada AY。附属腺的阿兹台克NR。二色的而且阿兹台克chartifex:挥发性成分的形态和化学鉴定。化学学报,1998;24:1629-37。
- 99.
黄志刚,李志刚。凤蝶属幼虫分泌物的化学性质Parnassius,Sericinus而且Pachliopta.化学学报,1995;21:859-67。
- One hundred.
杜丽娟,张志强,张志强,等。香根草根的微生物群落及其与精油生物发生的关系。环境微生物学报。2008;10:2824-41。
- 101.
维亚诺J,盖都E, Smadja J.关于细胞内细菌存在的研究香根草属zizanioides(l)葡萄球菌。植物学报1991;14:65-70。
- 102.
Adams RP, Habte M, Park S, Dafforn MR.清洗(无细菌和真菌)与未清洗(正常)香根草植物的香根草根精油的初步比较。生物化学学报,2004;32:1137-44。
- 103.
Banchio E,谢晓,张华,Pare PW。土壤细菌促进甜罗勒精油的积累和释放。农学通报。2009;57:653-7。
- 104.
阿里法诺P, Talà A.在香水中的微生物:来自生活在植物和人类身上的自由生活和共生细菌的气味化合物。H&PC今日香水,2010;5:20-9。
- 105.
Alifano P, Del Giudice L, Talà A, De Stefano M, Maffei ME。在香水中起作用的微生物:香根草根的微生物群落及其在精油生物发生中的参与。风味Fragr J. 2010; 5:121-2。
- 106.
Bicchi C, Maffei ME。植物挥发物:分析方法。在:诺曼利J,编辑。植物的高通量表型:方法和协议。托托瓦,新泽西州:分子生物学方法。胡玛纳出版社;2012.p . 289 - 310。
- 107.
《分子克隆:实验室手册》第3版。纽约冷泉港:冷泉港实验室出版社;2001.
- 108.
王晓明,王晓明,王晓明。基于聚合酶链反应的细菌基因组指纹图谱研究。方法Mol细胞生物学,1994;5:25-40。
- 109.
陈志伟,陈志伟,陈志伟,等。暗烤烟发酵微生物群落结构与动态研究。应用环境微生物学。2007;73:825-37。
- 110.
Vigliotta G, Nutricati E, Carata E, Tredici SM, De Stefano M, Pontieri P,等。厚膜菌属fuscaRoze 1896,一种丝状,鞘状,甲烷营养-变形菌。应用环境微生物学。2007;73:3556-65。
- 111.
Lane DJ, Pace B, Olsen GJ, Stahl DA, Sogin ML, Pace NR.用于系统发育分析的16S核糖体RNA序列的快速测定。中国科学院学报(自然科学版),1985;
- 112.
金美生,赵玉杰,李凯,尹帅,金敏,罗华,等。介绍EzTaxon:一个原核16S rRNA基因序列数据库,具有代表未培养物种的系统型。中国生物医学工程学报,2012;
- 113.
Talà A, Lenucci MS, Gaballo A, Durante M, Tredici SM, Debowles DA,等。Sphingomonas cynaraeSp. nov.,一种变形杆菌,产生一种不寻常的鞘蛋白。中国生物医学工程学报,2013;
- 114.
Gouy M, Guindon S, Gascuel O. SeaView版本4:用于序列比对和系统发育树构建的多平台图形用户界面。分子生物学杂志,2010;27:21 4 - 4。
- 115.
齐田,李志刚,李志刚。邻接法:一种重建系统发育树的新方法。生物化学学报,1987;4:406-25。
- 116.
通过核苷酸序列的比较研究估计碱基取代的进化速率的一种简单方法。中华药理学杂志,1980;16(4):344 - 344。
- 117.
布朗JK。进化树和其他树状图的自举假设检验。中国科学院学报(自然科学版),1994;
- 118.
Quast C, Pruesse E, Yilmaz P, Gerken J, Schweer T, Yarza P,等。SILVA核糖体RNA基因数据库项目:改进的数据处理和基于网络的工具。nuacids res 2013;41:59 - 6。
- 119.
杨永文,陈明凯,杨宝安,黄学军,张学荣,何丽琴,等。利用16S rRNA基因靶向群特异性引物对小鼠粪便中优势菌进行实时PCR分析。环境微生物学学报。2015;
- 120.
布莱克伍德CB,橡树A,买家JS。门和类特异性PCR引物用于一般微生物群落分析。应用环境微生物学。2005;71:6193-8。
- 121.
Peano C, Damiano F, Forcato M, Pietrelli A, Palumbo C, Corti G,等。比较基因组学揭示了关键的分子靶点,可以通过基因工程将一个产利福霉素的参考菌株迅速转化为过量的细菌菌株。中国机械工程,2014;26:1-16。
致谢
我们感谢Fulvia Stanzione的校对支持和Mariarosaria Aletta的书目支持。我们也感谢Alessio Aprile博士在实时PCR技术方面的技术支持,以及Marco Di Salvo博士在统计学上的支持。
资金
这项研究得到了圣保罗公司特别拨款“iniziativa”L. Del Giudice的支持。P. Pontieri获得了那不勒斯银行基金会的博士后资助。
数据和材料的可用性
在当前研究期间生成和/或分析的原始数据和/或数据集可根据合理要求从相应作者处获得。在“附加文件”一节中介绍了几个支持性数据集。
作者的贡献
构思设计实验:LDG, CB, MEM, PA。进行实验:GP、CC、SMT、DV、AC、PP、CNK、SAZ。分析数据:LDG、CC、PR、CB、GP、MEM、PA。撰写论文:GP, MEM, PA。所有作者都阅读并批准了最终的手稿。
相互竞争的利益
作者宣称他们没有竞争利益。
发表同意书
不适用。
伦理批准并同意参与
不适用。
作者信息
从属关系
相应的作者
附加文件
附加文件1:图S1。
A)女性和B)男性肠道细菌分离株的BOX-PCR基因组指纹图谱c . herbacea使用BOXA1-R底漆。M, 1 Kb DNA Ladder Invitrogen;1、CHF-B26;2、CHF-G5;3, CHF-B37;4, CHF-PG1;5, CHF-PG3;6, CHF-B4;7, CHF-PG4;8、CHF-G14; 9, CHFB16; 10, CHF-B17; 11, CHM-L11; 12, CHM-L21; 13, CHM-L22; 14, CHM-N25; 15, CHM-N28; 16, CHM-N31.图S2。抗菌活性的例子(由被测微生物周围的生长抑制晕证明)。一个、检测菌:CHF-B4、CHF-B16、CHF-B17、CHF-B26、CHFB37、CHF-G5;测试菌:CHM-L11。B、检测菌:CHF-B4、CHF-B16、CHF-B17、CHF-B26、CHF-B37、CHF-G5;测试菌:CHM-L11。C,被测细菌:答:mediterraneiS699;试验菌(从左至右):CHM-L11、CHM-L21、CHM-L22。有关详细信息,请参阅方法部分。(PDF 154kb)
附加文件2:文件S1。
厚壁菌门、α-和γ-变形菌门16S rRNA基因序列的相对丰度c . herbacea通过门/亚门特异性引物对实时PCR检测男性和女性肠道。该文件报告了实时PCR实验的原始数据(黄色背景)、数据分析和统计处理。样本#1、#2和#3代表生物三副本。(xlsx47 kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
皮佐兰特,G.,科德罗,C.,特雷迪奇,S.M.et al。可培养的肠道细菌为细菌的适应提供了途径Chrysolina herbacea来各种aquatica挥发物。BMC植物生物学17,30(2017)。https://doi.org/10.1186/s12870-017-0986-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-017-0986-6
关键字
- 各种aquatica
- Chrysolina herbacea
- 萜类化合物
- 昆虫信息素
- 肠道微生物群落
- 微生物有机挥发性化合物
- 抗菌化合物