摘要
背景
微管(MTs)是极化聚合物,具有高度动态的正端,在生长和收缩阶段之间随机切换。在真核细胞中,大量的mt相关蛋白(MAPs)调节MTs的动力学和高阶组织,从而介导不同的细胞功能。+端跟踪蛋白(+TIPs)是一组特异性积累在生长的MT +末端的map,它们调节MT +末端的行为并介导与细胞靶标的相互作用。虽然在酵母和动物中已经发现了几种具有重要功能的+ TIP蛋白,但在植物中对这类蛋白知之甚少。
结果
本文报道了来自拟南芥growth Plus-end Tracking 1 (GPT1)和GPT2(以下简称GPT1/2),在其中心和c端含有基本的mt结合区域,并在体外直接与MTs结合。有趣的是,GPT1/2在间期拟南芥细胞皮层MTs的生长正端优先积累。当gpt1 /12修饰的生长+端发生快速解聚时,GPT1/2从MT +端解聚。相反,当解聚端恢复并再次开始聚合时,GPT1/2立即被招募到不断增长的MT尖端。GPT蛋白的末端追踪行为不依赖于两个已建立的植物+ TIPs, End-Binding protein 1 (EB1)和SPIRAL1 (SPR1)。
结论
拟南芥MAPs GPT1和GPT2通过其基本区域直接与MTs结合。这些map追踪独立于EB1和SPR1的MTs生长的正末端,代表了一个新的植物特异性+ TIP家族。
背景
微管(MTs)是一种高度保守的极化细胞骨架聚合物,在真核细胞中介导细胞运动、细胞分裂、极性、细胞内运输和信号转导等细胞过程。gtp结合的α/β-微管蛋白异二聚体以头尾叠加的方式形成极性原丝,这些原丝横向结合形成极性空心MT圆柱体,具有高度动态的正端和更稳定的负端。与β-微管蛋白结合的GTP在MT组装过程中水解为GDP。在水解发生之前,gtp结合的微管蛋白形成一个帽,稳定MT的正端,从而促进其生长。稳定帽的随机损失使gpd束缚的微管蛋白的MT晶格变得不稳定,并导致MT解聚,这一过程被称为突变。当gtp微管蛋白亚基在解聚正端重新组装时,MT恢复生长,这一过程被称为“拯救”。这种MT在灾难和救援之间交替的行为被称为动力不稳定性[1,2].
gtp -微管蛋白二聚体在溶液中采用弯曲构象,并被认为在极正端组装成向外弯曲的薄片[3.].随着侧向结合原丝数量的增加,弯曲的gtp -微管蛋白片逐渐变直,形成管状结构。微管蛋白加入原丝后,GTP水解和随后的磷酸盐释放很快发生,导致短GTP帽[4].
一亚组MT相关蛋白(MAPs)的特点是能够在MT末端聚集[5,6].正端跟踪蛋白(+TIPs)识别并结合到MT的正端,并可能调节MT装配动力学以及MT正端与亚细胞靶标之间的相互作用。可以区分两类+ TIPs;“自主提示跟踪器”独立于其他map绑定MT末端,而“搭便车者”通过绑定到一个自主提示跟踪器以MT末端为目标,它们通常也与MT晶格有相当大的绑定亲和力。末端结合蛋白(EBs)是一种自主的末端追踪器,通过在生长的正末端招募各种搭便车的+ TIPs来调节动物细胞中的+ tip网络[7].EBs在微管蛋白的可交换GTP结合位点附近结合,被认为可以感知MT的核苷酸状态(GTP或GDP) [8,9].EB1可能与GTP cap和GTP样微管蛋白有关,其中水解的GTP保持在中间的GDP-Pi状态[10].在成长型MT末端,EBs呈现出特有的定位模式;它们的丰度在MT尖端区域达到峰值,并向MT主体逐渐下降,形成一个“彗星”样的模式。
植物有两种类型的EBs,定位于细胞质或细胞核。在拟南芥,细胞质EB1a和EB1b以及细胞核EB1c均在MTs的生长正末端积累[11- - - - - -15].击倒或击倒EB1c破坏了拟南芥根细胞中纺锤体和成片体MTs的排列,并导致培养后期染色体分离频繁滞后烟草(烟草)细胞15].然而,拟南芥的突变体EB1a而且EB1b,以及它们的双突变体,在生长和形态上与野生型植物几乎没有区别,这表明在间期植物细胞中,EBs可能对MT功能并不重要[14,15].
除了EB1,其他几种植物的map在MT +末端显示部分积累[16].SPIRAL1 (SPR1)是拟南芥中一种植物特异性蛋白,属于功能重叠的六家族[17- - - - - -19].SPR1定位在MT晶格上,并在拟南芥细胞中MTs的生长正端积累,形成一种延伸的彗星状图案,比EB1 [18].SPR1与皮质MTs的体内关联不需要EB1 [20.].目前尚不清楚SPR1如何与MTs关联,以及它如何优先被招募到正末端,因为从拟南芥细胞提取物中提取的MAP制剂中无法回收SPR1 [21],重组SPR1蛋白在体外不显示MT结合[16].拟南芥的spr1突变体显示拉长轴器官呈右手螺旋状生长[22],这种螺旋表型在多种突变体中被夸大SPR1基因家族(19].
我们之前从拟南芥培养细胞中分离出了几种新型的map [21].其中,一个由At3g53320编码的MAP在瞬时表达为GFP融合时定位于皮层MTs洋葱(洋葱)表皮细胞[21].在拟南芥中,存在另一个与该假设MAP同源的基因(编码为At2g37070)。我们将这种同源蛋白命名为GPT1(即生长加末端跟踪蛋白1)和之前鉴定的MAP [21GPT2。GPT1和GPT2的氨基酸序列相似性为59.8%,同源性为46.1%,不包含任何已知功能的结构域。在这篇报道中,我们证明了这些GPT蛋白是新的植物特异性+ TIPs,它们独立于EB1和SPR1跟踪生长中的MT +末端。
结果
GPT1/2中的mt结合区域
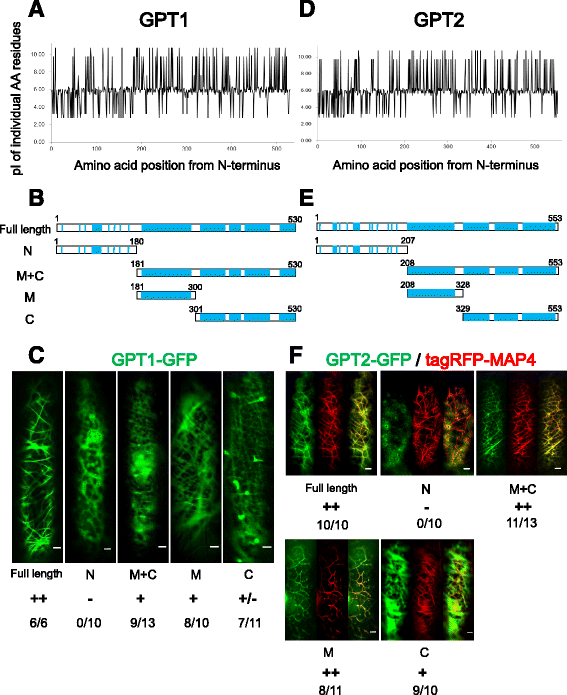
虽然GPT1/2在氨基酸上与功能特征蛋白没有明显的同源性[21],我们注意到这些蛋白的中间(M)和C末端(C)区域富含基本氨基酸残基Arg、Lys和His(在GPT1中为18.9%,在GPT2中为17.9%;无花果。1 a和b).而N端(N)区域则富含酸性Asp和Glu (GPT1/2中均为22.2%)。因此,GPTs是极性蛋白,其n端带负电荷的区域较短(GPT1的pI值为4.4,GPT2的pI值为4.5),而其中部和c端带正电荷的区域较长(GPT1的pI值为10.7,GPT2的pI值为10.6)。
在洋葱表皮细胞中,GPT1/2带正电荷的结构域与MTs结合。GPT1/2全长和截短片段在c端与GFP融合,在洋葱表皮细胞中瞬时表达。一个而且dGPT1 (一个)及GPT2 (d).b而且eGPT1 (b)及GPT2 (e).碱性氨基酸残基的位置用蓝线表示。N端(N)区域带负电荷,而中间(M)和C端(C)区域带正电荷。c而且fgfp融合GPT片段与皮层MTs的定位表现为++(强定位)、+(实质定位)、+/-(弱定位)和-(无定位)。分子和分母分别表示具有阳性定位模式的细胞数量和表达GFP融合蛋白的总细胞数量。GPT2-GFP融合(f)与tagRFP-MAP4共表达,显示MTs。中间板,tagRFP-MAP4;右面板,合并图像。比例尺为10 μm
为了鉴定这些蛋白中的MT结合区域,我们将全长和截短的GPT1和GPT2融合到GFP中,并与红色荧光MT标记tagRFP-MAP4一起在洋葱表皮细胞中瞬时表达。1).GPT1- gfp和tagRFP-MAP4的双色显示比较困难,这可能是由于GPT1与MT结合能力较弱,或者GPT1与MAP4在重叠MT结合位点上存在竞争,或者两者兼有。因此,GPT1-GFP的mt结合能力是基于细丝的存在而确定的(可能代表由GPT1-GFP装饰的皮层MTs)。GFP和RFP信号的共定位证实了全长GPT2定位于皮层MTs(图1)。1 f).GPT1(1-180)和GPT2(1-207)的N端(N)区域没有定位到MTs,而N端缺失(M + C) (GPT1为181-530,GPT2为208-553)和中间(M) (GPT1为181-300,GPT2为208-328)片段明确定位到皮层MTs(图)。1 f).C端(C)片段(GPT1为301-530,GPT2为329-553)与MTs有一定的相关性,但其程度低于含有M区的片段。这些瞬时表达实验结果表明,在体内,带正电的基本氨基酸残基(尤其是在M区)介导GPT1/2与MTs的结合。
太co-sedimentation化验
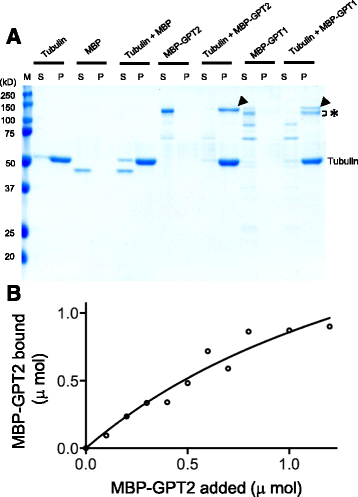
为了验证GPT1/2是否能直接与MTs结合,我们将全长的GPT1和GPT2与麦芽糖结合蛋白(maltose-binding protein, MBP)融合,在细菌中表达重组蛋白,并用直链淀粉树脂进行亲和纯化。在纯化过程中发生了一些降解,尤其是MBP-GPT1。将1 μM纯化蛋白与牛脑微管蛋白组装成的MTs孵育后,经超离心制成微管颗粒(P),可以发现完整的MBP-GPT1和MBP-GPT2(图中箭头所示)。2).MBP-GPT1的部分降解产物(图中星号)。2)也被颗粒化,而进一步降解的MBP-GPT1和MBP-GPT2片段没有被颗粒化。在MTs不存在的情况下,MBP- gpt1和MBP- gpt2仍然存在于上清(S)中,我们也单独评估了MBP来验证它不是GPT1/2与MTs结合的原因。2,超离心后,MBP残留在上清液中。这些结果表明GPT1/2可以直接与MTs结合。
重组GPT1和GPT2在体外与MTs结合。(一个)纯化的mmp融合的GPT1和GPT2蛋白分别与紫杉醇稳定的MTs孵育或不孵育,超离心成球,SDS-PAGE和考马斯亮蓝染色分析。全长MBP-GPT1和MBP-GPT2的位置用箭头表示,MBP-GPT1的mt结合部分降解产物用星号表示。微管蛋白也有提示。年代,浮在表面的分数;P,颗粒分数;M,标记尺寸。(b) MBP-GPT2与MTs结合的定量分析不同浓度的纯化MBP-GPT2与紫杉醇稳定的MTs混合,然后进行共沉淀分析,如a。假设微管蛋白二聚体上有一个GPT2结合位点,结合方程(见a)方法)安装
为了测定GPT对MTs的化学计量学和亲和性,将不同量的mmp - gpt2与恒定量的1 μM微管蛋白异二聚体聚合的MTs离心,得到结合曲线(图2)。2 b).mmp -GPT2以浓度依赖的方式与MTs结合,并以大约2.5 +/−0.9 mol的GPT2 / mol的微管蛋白二聚体饱和。解离常数Kd计算值为1.9 +/−1.0 μM。但是,如果GPT2以多种具有不同亲和力的绑定模式与MTs关联(如下所示),这个简单的回归分析不能提供真正的绑定值。
亚细胞定位
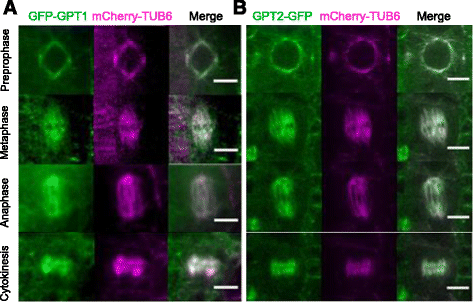
为了确定GTP1/2的亚细胞定位并监测其在体内的动态变化,我们将GFP融合到GPT1的n端或c端,并在构成型花菜花叶病毒35S启动子下表达,因为GFP的5 ' -调控区域GPT1而GFP融合在GPT2的c端,并在其本地启动子下表达。在洋葱表皮细胞瞬时表达试验中,定位于MTs的GPT1的n端和c端GFP融合(附加文件1),表明GFP的定位不影响融合蛋白的亚细胞定位。以表达mCherry- β-微管蛋白6融合荧光蛋白的拟南芥MT标记系(mCherry- tub6)为转化宿主。
GFP-GPT1和GTP2-GFP与mCherry-TUB6共定位,修饰了根分生组织有丝分裂细胞的核膜和前前期带、纺锤体和成膜(图4)。3.).GFP-GPT1的标记与mCherry-TUB6的标记略有不同,尤其是在扩张的成膜体上。这一观察结果促使我们仔细研究GPT1和GPT2在皮层MT阵列中的定位和动态,在这里单个MTs的动态可以清晰地显示。
GPT1和GPT2是新型的+ TIPs
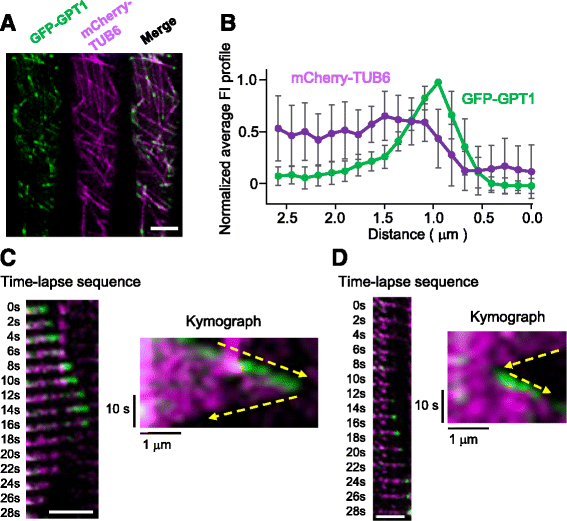
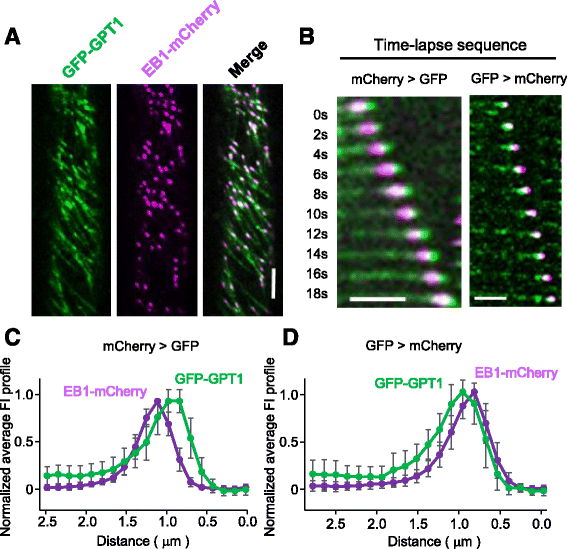
利用旋转盘共聚焦显微镜对根表皮细胞的时间推移成像显示,GFP-GPT1和GPT2-GFP不仅修饰了MT晶格,而且在MT上以颗粒的形式积累(图2)。4和额外的文件2MTs (mchry - tub6)和gfp标记的GPT1/2双强度图显示,GPT1/2定位于MT端呈彗星状,MT端信号强度最高,离MT端越远信号强度越低。与GPT2-GFP相比,GFP-GPT1的mt端定位更为明显。GFP标记的MT末端高度动态,表明GPT1/2标记皮质MTs的正端。GFP- gpt1与聚合的正端相关,突变一发生即解离(图1)。4摄氏度).然而,当MTs再次开始聚合时,GFP-GPT1立即被招募到生长端(图1)。4 d).与GFP-GPT1相比,GPT2-GFP表现出相似但较弱的标记模式2).这些结果表明,GPT1和GPT2优先识别生长中的MTs的正端。
GPT1追踪皮层MTs的生长正端。一个GFP-GPT1的亚细胞定位(绿色)和mCherry-TUB6,标记皮质MTs (品红色的),在拟南芥根表皮间期细胞中进行分析。比例尺:5 μm。b通过对20 MT图像进行分析和绘图,获得GFP-GPT1和mCherry-TUB6的平均荧光强度(FI)谱图。数据归一化,GFP-GPT1的峰值强度设为1。误差条表示扫描电镜。c在t = 14 s时发生突变的MT的典型延时序列和对应的记谱。MT开始解聚后,GFP-GPT1立即从尖端消失。冲黄色箭头指出发生突变的点。比例尺为2.5 μm。dt = 12s时进行抢救的MT的典型延时序列及对应的记谱。MT生长恢复后,GFP-GPT1立即定位于尖端。黄色虚线箭头指示救援发生的地点。比例尺为2.5 μm
附加文件3:电影S1。皮质MTs动态(洋红色;拟南芥幼苗根部表皮细胞的mCherry-TUB6)和GFP-GPT1(绿色)。图像序列对应于图。4.(AVI 14800 kb)
附加文件4:电影S2。拟南芥幼苗子叶表皮细胞皮质MTs (mCherry-TUB6标记品红)和GPT2-GFP(绿色)的动态。图像序列对应于附加文件2:图S2A。(AVI 11123 kb)
EB1是一个+ TIP家族成员,识别生长MTs的GTP-cap区域[7].为了比较GPT1/2和EB1的标记模式,我们在拟南芥植株中稳定共表达gfp标记的GPT1或2和mcherry标记的拟南芥EB1b (EB1- mcherry)。正如先前报道的那样,EB1-mCherry显示出强烈的正端标记[11- - - - - -15].许多,但不是全部,EB1粒子与GFP-GPT1共定位(图。5;附加文件5)。在绘制GFP和mCherry的相对荧光强度时,GFP- gpt1和EB1-mCherry的彗星状荧光信号部分重叠。在我们的共聚焦显微镜装置中,在交替激发每个荧光团后,依次检测到GFP和mCherry发出的两个荧光信号。当mCherry荧光检测0.2 s,再检测GFP信号0.5 s时,与EB1-mCherry信号相比,GFP- gpt1信号强度最高的位置接近MT端约0.2 μm(图1)。5 b, c).然而,当检测顺序相反时,EB1-mCherry信号强度最高的位置在GFP-GPT1信号强度最高的前面约0.15 μm。5 b, d).在目前的空间分辨率下,与我们的检测系统相关的光学伪影使我们很难最终确定EB1和GPT1是否完全在生长的MT正末端共定位。在两次观测中,EB1彗星的荧光信号强度逐渐下降,并在尖端后1.5 μm处达到背景水平。相比之下,大量的GFP-GPT1信号(大约是最高强度的20%)仍然与彗尾后面的MT晶格有关。
附加文件5:电影S3。拟南芥幼苗根部表皮细胞EB1-mCherry(品红)和GFP-GPT1(绿色)的动态研究在一次图像采集中,首先记录mCherry荧光0.2 s,然后记录GFP荧光0.5 s。图像序列对应于图。5.(AVI 13786 kb)
GPT的提示跟踪不需要EB1或SPR1
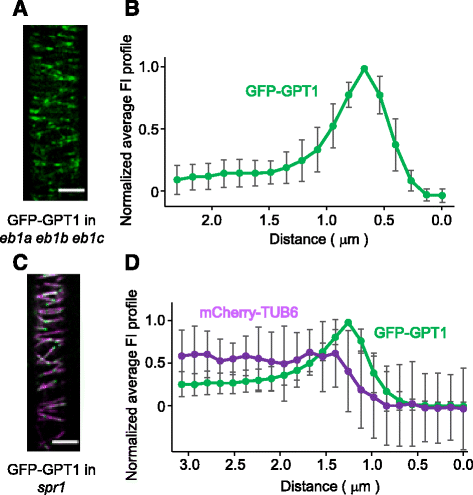
EB1识别出MT GTP帽的一个结构特征,并在体外和体内直接与生长的MTs的正端结合[7].许多动物+ TIPs在体内不直接与MT +末端结合,而是被EB1招募到该区域。为了验证GPT是直接积累在MT +端还是通过与EB1相互作用的搭便车机制积累,我们分析了拟南芥GPT的tip-tracking行为eb1零变异。因为拟南芥基因组包括三个EB1可能具有冗余功能的基因[14),三eb1用敲除突变体研究GFP-GPT1和GPT2-GFP的表达。GPT1/2定位于生长中的MTs的正端,与野生型背景中观察到的模式相同(图1)。6 a、b;附加文件6, 7和8)。
GPT1不需要EB1或SPR1来跟踪MT端。一个而且bGFP-GPT1在拟南芥中表达eb1a eb1b eb1c三突变体。一个分析了GFP-GPT1在拟南芥根表皮间期细胞中的亚细胞定位。比例尺:5 μm。b通过分析和绘制20 MT图像的数据,获得了GFP-GPT1的平均FI剖面。数据归一化,GFP-GPT1的峰值强度设为1。误差条表示扫描电镜。c而且dGFP-GPT1表达于spr1同时表达mCherry-TUB6作为MT标记的突变体。c分析了GFP-GPT1和mCherry-TUB6在拟南芥根表皮间期细胞中的亚细胞定位。比例尺:5 μm。d通过分析和绘制20 MT图像,获得GFP-GPT1和mCherry-TUB6的平均FI谱。数据归一化,GFP-GPT1的峰值强度设为1。误差条表示扫描电镜
附加文件7:电影S4。GFP-GPT1在植物根表皮细胞中的动态变化eb1拟南芥三重突变体。图像序列对应于图。6.(AVI 14176 kb)
附加文件8:电影S5。水稻子叶表皮细胞中GPT2-GFP的动态eb1拟南芥三重突变体。图像序列对应于附加文件6:图S3A。(AVI 13792 kb)
SPR1和它的同源物是植物特异性的MT定位蛋白,结合到生长的正末端和MT晶格[17,18].拟南芥含有7个可能是冗余的SPR1同源体,SPR1主要参与幼苗根系的各向异性生长[19].因此,我们用aspr1null突变体来测试GPT的加端跟踪行为是否需要SPR1。用mCherry-TUB6标记皮层MTs。在spr1突变体GPT1/2在间期表皮细胞中标记生长的MT +末端,形成彗星样图案(图1)。6 c, d;附加文件69和10)。中gfp标记的GPTs的小费跟踪行为spr1无突变体与野生型表皮细胞无差异。
附加文件9:电影S6。根表皮细胞中MTs (mCherry-TUB6标记品红色)和GFP-GPT1(绿色)的动态变化spr1在拟南芥突变体。图像序列对应于图。6摄氏度.(AVI 8429 kb)
附加文件10:电影S7。根表皮细胞皮层MTs (mCherry-TUB6品红标记)和GPT2-GFP(绿色)的动态变化spr1在拟南芥突变体。图像序列对应于附加文件6:图S3C。(AVI 14930 kb)
这些结果表明,GPT1和GPT2的MT正端跟踪功能不需要EB1和SPR1。
讨论
GPT1/2通过基本区域与MTs结合
除了n端区域,GPT1/2的Lys、Arg和His残基相对丰富,平均pI值分别为10.7和10.6。这些带正电的残基是GPTs的独特生化特征;然而,这些值低于一些高度基本的map域,如BPP1, BPP2和BPP3,它们的pI值为12.9-13.4 [21].通过在洋葱表皮细胞中瞬时表达gpfp标记的全长和截短的GPT1/2蛋白,发现GPT1/2的基本区域在体内定位于皮层MTs,而中央和c端基本区域在体内独立定位于MTs,提示GPT1/2中存在多个mt结合区域。由于重组GPT1/2蛋白在体外与MTs结合,碱基区似乎直接与MTs结合。
在MAPs中发现了多种mt结合区域,并且发现某些MAPs的mt结合区域具有由碱性氨基酸残基产生的高pI值[16].正电荷区域被认为与α-和β-微管蛋白c端富含Glu和asp的高酸性尾部静电相互作用。因为酸性的c端是所有真核微管蛋白的共同特征[23],这种基于电荷的mt结合模式在各种生物中被MAPs频繁使用。
GPT优先在生长中的MTs的正端积累
gfp标记的GPT不仅标记MT晶格,而且在皮层MTs的生长正端富集,GFP-GPT1的正端定位强于GPT2-GFP。我们不知道GPT1/2与GPT1/2之间对正极的亲和性是否有本质上的差异,也不知道是否融合GFP分子的位置影响了GPT1/2的生化性质。虽然GPT1/2具有高度相似的基本氨基酸分布和相当水平的氨基酸序列一致性,但我们注意到,当MT标记物在洋葱表皮细胞中共表达时,GPT1-GFP与MTs的关联效率低于GPT2-GFP。需要进一步的生化分析来确定GPT1/2在MT加端靶向之间可能存在的差异。
通过在拟南芥植株中共表达不同荧光标记的GPT1/2蛋白和典型+ TIP的拟南芥EB1蛋白,比较它们的TIP跟踪行为。EB1特异性识别生长中的MT正端,并在距离MT尖端1.5 μm处几乎完全解离,在MT尖端没有EB1的结合位点[8- - - - - -10].相比之下,GPT1/2末端跟踪荧光信号随距离MT正端增加而减少,但仍有相当比例的GPT1/2分子与gdp -微管蛋白MT晶格结合。GPT1/2与MT晶格结合的这种倾向可能阻碍在密集的有丝分裂MT阵列中观察到末端定位的GPT1/2。虽然需要进一步的高分辨率分析,但我们目前的定位数据表明,EB1和GPT1在生长的MT +末端具有不同的结合位点。EB1识别GTP-cap末端,以及生长MT末端数百个微管蛋白分子的延伸区域[8,9].最近使用冷冻电子断层成像技术对EB1定位的成像显示,EB1与MT晶格中向外弯曲和直的区域相互作用,这些区域可能分别代表GTP-和gdp - pi -微管蛋白二聚体,在MT末端[10].EBs在两个相邻原丝的四个微管蛋白二聚体的交叉点结合[8,9].这个结合位点非常适合于感知周围微管蛋白二聚体的核苷酸状态。为了自主跟踪MT末端的生长,a + TIP应识别微管蛋白的细微结构变化,这些变化与核苷酸状态和原丝闭合成圆筒状有关。预测的酸性微管蛋白c端gpt结合位点不足以实现这种识别机制,可能还需要与MTs相关的其他成分,如n端非碱性区域。
EB1在MT晶格中的有效解离部分是由EB1的c端带负电荷引起的。当c端被中性电荷基序取代时,EB1突变体修饰了MT晶格,而不影响其与生长的MT端相互作用[24].GPT1/2的生化性质可能使这些分子比EB1更难以区分MT末端和晶格。
EB1并不是唯一与MT端自主相互作用的+ TIP。非洲爪蟾蜍光滑的XMAP215(或人类的ch-TOG)可以识别MT +端,但不区分聚合端和解聚合端[6].在体内和体外实验中,XMAP215/ch-TOG与极端MT尖端结合,而EB1定位于距离XMAP215/ch-TOG几十纳米的尖端区域[25,26].在正端识别不同结构特征的+TIPs有望在MT端装饰不同的子区域。
GPT不需要EB1或SPR1来跟踪尖端
EB1通过其c端EB同源域招募非自治+ TIPs到生长的MT端[7].CAP-Gly域(27和SxIP主题[28在eb1相互作用的蛋白质中,在生长的MT末端积累。有趣的是,GPT1/2仍然追踪拟南芥的MT末端eb1三重突变背景,缺乏EB1功能。GPTs中CAP-Gly结构域和SxIP基序的缺失表明它们的亚细胞定位独立于EB1。GPT1/2定位到MT端也不需要SPR1,另一种植物特异性+ TIP [17,18].虽然目前尚不清楚SPR1是否会自动跟踪生长中的MT末端,但这些结果表明,如果GPT确实通过搭便车机制与生长中的MT末端结合,那么它一定会与EB1或SPR1以外的+ tip蛋白结合。
结论
拟南芥的MAPs、GPT1和GPT2能够独立于EB1和SPR1,稳定地追踪MTs生长的正末端,从而定义了一个新的植物特异性+ TIP家族。
方法
植物材料、生长条件和植物转化
拟南芥生态型Columbia取自ABRC砧木中心,并用于整个实验。拟南芥种子用0.1%吐温-20和10%次氯酸钠溶液消毒15 min,用消毒液洗涤3次,播种在拟南芥琼浆培养基(2.5 mM KNO)上3., 1.25 mM KPO4, 1 mM Ca(NO .3.)2, 1mm MgSO4, 35 μM Fe-EDTA, 7 μM MnCl2, 5 μM NaCl, 0.5 μM ZnSO4, 0.25 μM CuSO4, 0.1 μM NaMoO4, 0.005 μM CoCl2, 1.5% (w/v琼脂,1% [w/v]蔗糖)。4°C黑暗分层4天后,种子在23°C长光周期(16 h光照/8 h黑暗)下萌发并垂直生长。转基因幼苗在½MS培养基(日本制药公司:50 μg/mL肌醇,0.2 μg/mL硫胺素,0.05% [w / v] MES-KOH pH5.7, 0.7% [w / v琼脂,1% [w / v(蔗糖)含有适当的抗生素。种子在含抗生素的培养基上发芽,14天后进行评分。
拟南芥利用花浸法转化[29].根癌土壤杆菌在添加了适当抗生素的LB平板上选择携带目的载体的GV3101 (pMP90)。用离心法收集细菌[29],并悬浮于含5% [w / v蔗糖和0.05% [v / v] Silwet l - 77。将植物的花部分浸入转化溶液后,让植物正常生长,直到种子收获。
为了实现双色显示,将表达gfp标记的GPT蛋白的转基因拟南芥植株与含有mCherry的植株进行杂交。为了观察有丝分裂的MT结构,mCherry-TUB6在表皮特异性启动子的控制下表达,该启动子是一个3.4 kb的5 ' -上游区域,从推测的转录起始位点AtML1[30.].为了分析根表皮细胞的皮层MT阵列,mCherry-TUB6在一个表皮特异性启动子(即2.0 kb片段,位于翻译起始位点的上游)控制下表达WRKY72)[31].基因组中的GFP标记EB1b-GFP构造(15]通过反式PCR去除,然后在EB1终止密码子前连接mCherry生成EB1b-mCherry.用mCherry-TUB6标记子叶表皮细胞的皮质MT阵列,并在此对照下表达mCherry-TUB6泛素10启动子(32].
GPT-GFP构造(下面描述)被直接转换为eb1a-2 eb1b-3 eb1c-2三重突变,是在我们实验室产生的[15].转化子首先筛选潮霉素耐药,然后筛选GFP荧光。的spr1-3我们实验室已经筛选过的突变体[17],用pWRKY72::mCherry-TUB6进行转化,然后与GPT-GFP表达线交叉。纯合子的spr1筛选表达mCherry- tub6和GPT-GFP的突变株系进行根倾斜表型和mCherry和GFP同时荧光检测。
向量构造
拟南芥中gfp标记蛋白的表达,全长GPT1cDNA和一个基因组片段GPT2包含2.5 kb 5 ' -上游区域和基因组区域,位于第8外显子终止密码子之前,分别克隆到pGWB5和pGWB4 [33],分别使用Gateway克隆系统(Invitrogen公司)。利用Gateway克隆系统将合适的cDNA片段与表达蛋白c端GFP融合,构建pUGW5 [33].PCR生成截断的cDNA片段,ATG起始密码子位于截断的cDNA n端之前。
重组蛋白纯化和MT共沉淀实验
将GPT1/2全长cdna克隆到pCold-MBP载体[34]使用适当的限制性内切酶的切割位点。重组MBP-GPT蛋白在Rosetta (DE3)菌株中表达大肠杆菌并根据制造商的说明书(New England BioLabs),使用直链淀粉树脂柱进行收获和纯化。用离心过滤器(Amicon Ultra过滤器;(Merck Millipore),缓冲液改为BRB80 (80mm管,1mm MgCl)2, 1 mM EGTA, pH 6.8)。最后的蛋白制剂放入液氮中冷冻,-80°C保存。
在MT共沉淀试验中,解冻的蛋白质在4°C, 100,000 x g离心15分钟,以除去蛋白质聚集物。牛脑微管蛋白聚合成MTs [35],在1x BRB80缓冲液中加入1 mM GTP和10 μM紫杉醇(紫杉醇;在30°C, 100,000 x g离心30分钟,将聚合的MTs从未聚合的微管蛋白二聚体中分离。将沉淀好的MTs悬浮在添加了10 μM紫杉醇的1倍BRB80缓冲液中。将MBP- gpt1或MBP- gpt2与MTs(相当于1 μM微管蛋白)在50 μL的含10 μM紫杉醇的1 × BRB80缓冲液中混合,室温孵育1 h。MBP按上述方法纯化并作为阴性对照。孵育1小时后,样品在30°C, 100,000 x g离心30分钟。将颗粒和上清组分与SDS-PAGE样品缓冲液混合,用SDS-PAGE(使用10%聚丙烯酰胺凝胶)分析,然后用考马斯亮蓝G-250 (Nacalai Tesque)染色,如前所述[35].根据公式计算绑定值问= (问马克斯xc) / (Kd+c),问是与微管蛋白二聚体结合的蛋白质数量,c为溶液中游离MBP-GPT2的浓度,Kd解离常数是和吗问马克斯是使用Prism 7软件(GraphPad software Inc.)在饱和水平上绑定的MBP-GPT2的数量。
粒子轰击介导的瞬时表达
质粒(2 μg)含有全长或截短的GPT1-GFP或GPT2-GFP和tagRFP-MAP4 MT标记质粒(2 μg) [21]与1.5 mg 1.0 μm金颗粒(Bio-Rad)混合30 min, Bio-Rad悬浮在19.2%甘油、962 mM氯化钙中2, 1.5%亚精胺,用70%乙醇洗涤,然后用100%乙醇洗涤。包覆质粒的金颗粒被轰击成洋葱(洋葱)表皮剥皮,使用PDS-1000/He生物粒子输送系统(Bio-Rad),配备1100磅/盎司。破裂磁盘。在潮湿的培养皿中暗孵育16小时后,用D-ECLIPSE C2共聚焦显微镜(尼康)观察表达gfp的细胞。GFP在488nm激发,使用ET514/30带通发射滤波器观察,而tagRFP在543 nm激发,使用ET585/65滤波器观察。
用共聚焦旋转圆盘显微镜观察MTs
荧光蛋白定位的延时成像在倒置显微镜(ECLIPSE Ti;横河)连接到EM-CCD相机(iXon3 DU897;和或)。图像采集采用数值孔径油浸物镜(Apo TIRF 60x/1.49;尼康)。荧光团的激发使用激光(Andor)在488 nm与GFP的520/35过滤器或在561 nm与mCherry的617/73过滤器完成。间期细胞每隔2秒采集图像,有丝分裂细胞每隔30秒采集图像。所有图像均采用单通道顺序采集。在双色显示中,mCherry被激发并在0.2 s的曝光时间内收集其发射。 GFP was subsequently excited and its emission signals collected with an exposure time of 0.5 s. In another set of experiments, GFP was visualized first, followed by mCherry. The observation time lags for laser swapping caused temporal separation between the two fluorophores. Trajectories of individual MTs were traced on images and converted into kymographs using ImageJ. See Additional file11为程序的示意图。
缩写
- +技巧:
-
左端的跟踪蛋白质
- BPP:
-
基本的脯氨酸蛋白
- EB1:
-
End-binding蛋白1
- 绿色荧光蛋白:
-
绿色荧光蛋白
- GPT1:
-
增长的加端跟踪
- GPT2:
-
增长的加端跟踪
- 地图:
-
Microtubule-associated蛋白质
- MBP:
-
Maltose-binding蛋白质
- MT:
-
微管
- 招标书:
-
红色荧光蛋白
- SPR1:
-
SPIRAL1
- TUB6:
-
β微管蛋白6
参考文献
Desai A, Mitchison TJ。微管聚合动力学。中国生物医学杂志。1997;13:83-117。
刘志强,刘志强,刘志强,等。微管动力学不稳定性:GTP水解与多步突变耦合的新模型。Bioessays。2013;35:452 - 61。
Rice LM, Montabana EA, Agard DA。晶格作为变构效应:αβ-和γ-微管蛋白的结构研究阐明了GTP在微管组装中的作用。中国科学(d辑)2008;
Alushinn GM, Lander GC, Kellogg EH, Zhang R, Baker D, Nogales E.高分辨率微管结构揭示了GTP水解αβ-微管蛋白的结构转变。细胞。2014;157:1117-29。
微管尖端相互作用蛋白:从两端观察。细胞生物学。2010;23:94-101。
微管组织和动力学的控制:聚光灯下的两端。中国生物医学杂志。2015;16:711-26。
TIPs:沿微管末端sxiping。中国生物医学杂志2012;22:418-28。
Maurer S, Fourniol FJ, Bohner G, Moores CA, Currey T. EBs在生长微管末端发现核苷酸依赖的结构帽。细胞。2012;149:371 - 83。
张荣,张志强,张志强,等。EB蛋白调控微管动力学不稳定性的机理研究。细胞。2015;162:1-11。
刘志强,刘志强,刘志强,等。EB1与微管晶格中向外弯曲和直的区域相互作用。Nat Cell Biol. 2016(出版中)。
Chan J, Calder GM, Doonan JH, Lloyd CW。EB1显示移动微管成核位点拟南芥.中国生物医学杂志2003;5:967-71。
Mathur J, Mathur N, Kernebeck B, Srinivas BP, Hűlskamp M.一种新的eb1样蛋白定位模式连接微管动力学和内膜组织。咕咕叫医学杂志。2003;13:1991-7。
张志强,张志强,张志强,等。植物皮质微管阵列组织中极性的建立。生物化学。2006;17:1298-305。
Bisgrove SR, Lee YR, Liu B, Peters NT, Kropf DL。微管加端结合蛋白EB1在根对触摸和重力信号的反应中起作用拟南芥.植物细胞。2008;20:396 - 410。
小木木,安倍T, Coutuer S, Inzé D, Russinova E,等。末端结合蛋白1的核定位亚型调节纺锤体的组织拟南芥.中国生物医学工程学报,2010;23(3):417 - 422。
植物中的微管。拟南芥的书。2015;13:e0179。
中岛K,古谷I,立本H,松原H,桥本TSPIRAL1编码一种植物特异性微管相关蛋白,用于定向控制快速扩张拟南芥细胞。植物细胞。2004;16:1178 - 90。
刘志强,刘志强,刘志强。拟南芥拟南芥的生物信息学研究SKU6 / SPIRAL1基因编码一个参与定向细胞扩张的正末端定位的微管相互作用蛋白。植物细胞。2004;16:1506-20。
中岛K、川村T、桥本TSPIRAL1各向异性生长的基因家族拟南芥.植物生理学报。2006;47:513-22。
Galva C, Kirik V, Lindeboom JJ, Kaloriti D, Rancour DM,等。微管末端跟踪蛋白SPR1和EB1b相互作用维持细胞极性伸长和定向器官生长拟南芥.植物细胞。2014;26:4409-25。
张志勇,张志勇,张志勇,等。新微管相关蛋白的纯化和鉴定拟南芥细胞悬液的文化。植物杂志。2013;163:1804-16。
陈志明,陈志明,陈志明,陈志明,等。的螺旋基因是定向调控细胞伸长的关键拟南芥.发展。2000;127:4443-53。
本质上无序的微管尾部:微管功能的复杂调谐器?中国生物医学杂志。2015;37:11-9。
张志强,张志强,张志强,等。EB1结构及其c端区域在区分微管尖端与晶格中的作用的研究。生物化学。2011;22:2912-23。
张志强,张志强,张志强,等。分析间期HeLa细胞中微管末端结合蛋白EB1和ch-TOG的纳米级分布和功能。PLoS ONE。2012; 7: e51442。
王志强,刘志强,刘志强,等。EB1加速了微管成熟和动力学中两个重要的构象转变。咕咕叫医学杂志。2014;24:372 - 84。
利用CAP-Gly结构域捕获蛋白质尾部。生物化学。2008;33:535 - 545。
刘志强,刘志强,刘志强,等。eb1结合基序作为微管尖端定位信号。细胞。2009;138:366 - 76。
花浸渍:一种简化的方法农杆菌属介导的变换拟南芥芥。植物j . 1998; 16:735-43。
高田s, Jűrgens G.转录调控的表皮细胞命运拟南芥胚胎。发展。2007;134:1141-50。
Bhattarai K、Atamian HS、Kaloshian I、Eulgem T. wrky72型转录因子参与番茄和拟南芥的基础免疫以及番茄介导的基因对基因抗性R基因Mi-1.植物j . 2010; 63:229-40。
张志强,张志强,张志强,等。拟南芥中一个非典型微管蛋白激酶介导应激诱导的微管解聚。咕咕叫医学杂志。2013;23:1969 - 78。
张志勇,张志勇,张志勇,等。开发一系列通道二元载体pgwb,实现植物转化融合基因的高效构建。生物工程学报。2007;104:33-41。
Hayashi K, Kojima C.利用冷休克表达载体的可溶性蛋白标签制备NMR高效蛋白的方法。J Biomol NMR。2010; 48:147-55。
张志强,张志强,张志强,等。拟南芥和烟草悬浮细胞中功能微管蛋白的亲和纯化及特性研究。植物杂志。2016;170:1189 - 205。
确认
我们非常感谢dr。Satoshi Fujita和Noriyoshi Yagi(奈良科学技术研究所)为我们提供了MT标记线,pAtML1::mCherry-TUB6和pWRKY72::mCherry-TUB6, Chojiro Kojima博士(大阪大学)pCold-MBP质粒,以及Dr. Kojima博士。中岛圭二(Keiji Nakajima)和加藤武英(奈良科学技术学院)获得有用的评论。
资金
本研究获得了教育部创新领域科学研究资助项目(批准号:24114004 T.H.)。资助人在研究设计、数据收集和分析、决定发表或准备稿件中没有任何角色。
数据和材料的可用性
所有支持数据都包含在附加文件中。
作者的贡献
构思和设计实验:TH进行实验:WJH撰写论文:TH和WJH两位作者均已阅读并认可了本文的最终版本。
相互竞争的利益
作者声明他们之间没有利益冲突。
同意出版
不适用。
伦理认可和同意参与
不适用。
作者信息
从属关系
相应的作者
附加文件
附加文件1:图S1。
体内GPT1的n端和c端GFP融合均定位于MTs。全长的GPT1蛋白在其n端(A)或c端(B)与GFP融合,并在洋葱表皮细胞中瞬时表达。比例尺为50 μm。(PDF 103 kb)
附加文件2:图S2。
(A)在拟南芥子叶表皮间期细胞中分析了GPT2- gfp(绿色)和标记皮层MTs(品红)的mCherry-TUB6的亚细胞定位。比例尺:5 μm。(B) GPT2-GFP和mCherry-TUB6的平均荧光强度(FI)剖面通过分析和绘制20 MT图像的数据得到。数据归一化,GPT2-GFP的峰值强度设为1。误差条表示扫描电镜。(C)生长MT的正端区域有代表性的延时序列和相应的记谱仪。GPT2-GFP跟踪生长MT的正端。黄色虚线箭头表示正端位置。比例尺为2.5 μm。(PDF 173 kb)
附加文件6:图S3。
GPT2不需要EB1或SPR1来跟踪MT端。(A和B) GPT2-GFP在拟南芥中表达eb1a eb1b eb1c三突变体。(A)分析了拟南芥子叶表皮间期细胞中GFP-GPT1的亚细胞定位。比例尺:5 μm。(B) GPT2-GFP的平均FI剖面通过分析和绘制20 MT图像的数据得到。数据归一化,GPT2-GFP的峰值强度设为1。误差条表示扫描电镜。(C和D) GPT2-GFP在拟南芥中表达spr1同时表达MT标记mCherry-TUB6的突变体。(C)分析了GPT2-GFP和mCherry-TUB6在拟南芥子叶表皮间期细胞中的亚细胞定位。比例尺:5 μm。(D)通过分析和绘制20 MT图像的数据,获得GPT2-GFP和mCherry-TUB6的平均FI剖面。数据归一化,GPT2-GFP的峰值强度设为1。误差条表示扫描电镜。(PDF 142 kb)
附加文件11:图S4。
生成两种不同标记蛋白质合并强度图的程序示意图。(PDF 136 kb)
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许不受限制地在任何媒体上使用、分发和复制,前提是您要适当地注明原作者和来源,提供创作共用许可的链接,并说明是否进行了更改。知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
黄建华,王俊华,Hashimoto, T. .新型拟南芥微管相关蛋白跟踪生长的微管正末端。BMC植物杂志17日,33(2017)。https://doi.org/10.1186/s12870-017-0987-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-017-0987-5
关键字
- 拟南芥
- EB1
- GPT1
- GPT2
- 左端的跟踪蛋白质
- SPIRAL1