摘要
背景
柳枝稷蚜虫侵扰(黍virgatum)有可能降低产量和生物质质量。虽然柳枝绿虫(Schizaphis graminum;在植物整体水平上对植物的相互作用进行了研究,但在分子水平上对植物的防御反应知之甚少。
结果
采用RNA-Seq技术,对柳枝草(cv Summer)在侵染后5、10和15天收获的侵染和对照(未侵染)植株进行转录组学检测。分析各时间点侵染植株与对照未侵染植株的差异表达基因(DEGs)。5-DAI诱导的gb侵染植物的deg包括反应性爆发氧化酶和几种细胞壁受体的上调。5-DAI还观察到氧化还原代谢、细胞壁结构和激素生物合成相关基因的表达变化。在10-DAI时,网络分析表明防御相关基因大量上调,包括NAC、WRKY和MYB类转录因子和潜在的辅助信号分子,如亮氨酸氨基肽酶。在这个时间点也检测到叶绿体功能丧失的分子证据。10-DAI侵染植株的叶绿素含量显著降低,ROS水平升高,支持这些分子变化。10-DAI侵染植株总过氧化物酶和漆酶活性明显高于未侵染植株。最终结果似乎是大规模的防御反应,导致C和N同化明显减少,10-DAI可能将营养物质从GB转向产生防御性化合物,如薄荷酸、绿原酸和海藻糖。通过15-DAI,根据与碳、氮和营养同化相关基因的转录丰度,发现了初级代谢恢复的证据。
结论
在一个山地柳枝稷品种中,观察到植物转录组的广泛重塑以及活性氧和几种防御性代谢物的产生。15-DAI对初级代谢的早期损失和明显恢复表明,这些转录变化在GB侵染后期可能是该柳枝稷品种恢复反应的基础。这些结果可用于开发对GB和潜在的其他蚜虫具有更持久抗性的柳枝稷品系。
背景
植物对昆虫食草的反应是精细而有力的先天免疫反应,引发了大量的可诱导防御,包括局部细胞死亡、结构强化,如细胞壁强化(通过胼胝质、木质素和纤维素沉积)、生化和分子相关防御。1,2],以及将植物养分重新分配到远离取食地点的地方,这对植物的营养品质产生了负面影响[3.,4].这些对草食的先天免疫反应是由组织损伤和营养物质的去除刺激的,其程度受植物基因型的显著影响。这些产生的反应被归类为抗性(对害虫生物学和/或行为的负面影响)、易感和耐受性(克服害虫造成的损害的能力)。植物克服生物压力(包括昆虫取食)的程度与植物的抗性基因(R基因)[5- - - - - -7].例如:33 NBS-LRRR小麦对瘿蚊侵害的响应基因被诱导,并与防御反应的激发有关[8,9].除了可能与植物相互作用R-基因,蚜虫的食草性可以引起其他短期和长期的植物生理变化,这些变化塑造了寄主的适应性,并有助于其克服食草性的能力。
蚜虫,如绿虫(Schizaphis graminum;(GB),主要以韧皮部为食,在摄食过程中通过清除营养物质和分泌有毒唾液化合物到韧皮部,对植物的适应性和健康产生负面影响。因此,蚜虫食草可导致广泛的植物损害,如叶片变黄和/或死亡,植物活力下降,并最终导致产量下降[10,11].蚜虫也通过它们的蜜露分泌大量的糖,为真菌和细菌在叶片表面定植提供了基质,这可能对植物造成进一步的直接或间接伤害[12- - - - - -14].
蚜虫对草食的最初反应似乎包括钙、细胞壁激酶和活性氧(ROS)应答信号网络[2,7,15,16],随后的反应会影响光合作用和生长。抗性植物似乎激活了一些防御反应,但这些反应通常不会持续下去,因为害虫不会以这些植物为食或繁殖[17,18].在易感植物中,通常会产生强烈的防御反应,但植物无法维持这种反应,最终死亡[18,19].相比之下,耐受性强的植物似乎要么具有更强的防御反应,要么能够维持诱导的防御反应,这两种情况都允许植物通过恢复生长来补偿草食[18].
先前的研究表明,柳枝稷(黍virgatum)种群对黄蔗蚜和黄蔗蚜的反应(Sipha黄颜色) [20.- - - - - -22].然而,这些反应背后的分子机制尚未被阐明。这里,柳枝稷品种夏季植物的全球转录响应,一种适应美国中西部北部的陆地四倍体品种[23],在15天的评估期内,使用RNA-Seq对GB侵染进行鉴定。该品种可以作为GB的寄主,对GB的草食反应中等敏感,尽管GB花了相当长的时间以叶片韧皮部为食,这表明该品种对GB的草食有耐受反应[j]。20.- - - - - -22].例如,与其他植物蚜虫系统不同,拟南芥-绿桃蚜虫[15,16],玉米-玉米叶蚜[24,25],大豆蚜虫[26- - - - - -28],关于柳枝稷对昆虫草食的潜在生理反应的信息有限,尽管植物木质素含量、过氧化物酶和对活性氧的反应在最近的几篇论文中都有涉及[29- - - - - -31].本研究的目的是发现柳枝稷对GB反应的分子特征,并将这些特征与未受侵染的对照植物在实验过程中发生的发育变化进行对比。
方法
植物生长条件和样品采集
该品种的种子来自美国农业部农业研究中心在美国东北部米德附近的田间种植的植物。经认证的夏季品种种子的原始来源是位于堪萨斯州曼哈顿的曼哈顿植物材料中心,随后种子由位于新墨西哥州林肯的美国农业部农业研究所的科学家进行验证。50株柳枝稷来自栽培品种Summer,在单独的集装箱中种植(Ray Leach SC10;Stuewe & Sons, Inc, Tangent, OR)到L2阶段[32]在温度为23°±4°C的400瓦高强度灯下,白天和黑夜各有16小时的光周期[21].采用2 × 3因子设计,包括2个处理(侵染和对照)和3个收获时间点:侵染后5、10和15天(DAI)。在第0天,将10 GB初始放置在受感染的植物上。用管状塑料笼分别圈养侵染植物和对照植物,管状塑料笼通风口覆盖有机纱布,将GB限制在侵染植物上。在每个时间点采集叶片样本前,对GB进行计数和去除,并按1 ~ 5的等级对植株进行危害等级评价[21,22,33],其中1 = 10%或更少的叶面积带红色或黄色变色;2 = 11-30%叶面积泛红或泛黄;3 = 31-50%叶面积泛红或泛黄;4 = 51-70%叶面积泛红或泛黄;5 = 71%或更多的叶面积严重变色,或死组织。收集植株上的所有叶子,用液氮速冻,保存在- 80°C,以备将来处理。
RNA提取与测序
每个时间点和处理处理4个生物重复(单株)。从闪蒸冷冻叶片样品中共分离出24个RNA样品,如前面[34,35],然后用RNeasy进行纯化TM试剂盒按照制造商的协议(Qiagen, Valencia, CA)进行RNAseq实验。RNA的纯度和浓度使用Take3板和直接RNA定量协议(Bio-Tek, Winooski, VT)进行测定。使用RNA 6000纳米试剂盒和植物总RNA纳米测定(Agilent, Santa Clara, CA)验证纯化RNA的质量。从干净的RNA样本中,24truseqTM利用唯一索引的RNAseq库根据制造商协议(Illumina Inc ., San Diego, CA)生成。将单个样品稀释至10 nM的浓度,并以每车道5个样品进行多路复用。在Illumina HiSeq 2000系统上进行单读100 bp测序。所有RNA-Seq文库、索引和测序均在内布拉斯加州大学医学中心的DNA微阵列和测序核心设施进行。
RNA-Seq分析
本研究中分析的RNA-Seq数据集可在SRA数据库中获得,登录号为SRP070829;(https://www.ncbi.nlm.nih.gov/sra/?term=SPR070829),并以附加文件形式提供其他资料1表S1,附加文件2表S2,附加文件3.:数据S1和附加文件4:数据S2。单端100 bp reads被映射到柳枝稷基因组(v1.1, phytozome.jgi.do .gov) [36]使用Tophat2 [37使用默认参数。具有多个比对的Reads被丢弃,并使用Subread中的featureCounts函数计算基因表达计数[38].采用DESeq2进行差异基因表达分析[39,40].使用似然比检验确定数据集中至少一个处理中差异表达的基因(FDR < 0.05),并使用标准的多因素设计工作流与nbinomWaldTest测试特定对比。热图使用重复平均值的z分数进行组装,这表明每个基因的表达水平与所有处理中基因的平均表达水平的标准差数量。z-score小于0表示基因表达水平小于平均值,z-score大于0表示基因表达水平高于平均值。
转录组作图统计
所有转录组相关分析均来自附加文件中显示的数据1表S1。从每个样品中分离的RNA在5-,10-和15-DAI(附加文件)中平均产生4440万个100-bp单端读取,范围为(3490至5460万)1:表S1),并映射到参考柳枝稷基因组(1.1版;www.phytozome.org)。在整个时间过程中,侵染样本和对照样本之间的总读取量、映射读取量或映射到注释区域的读取量之间没有显著差异(附加文件1:表1)。
基因本体富集分析
使用GOseq进行基因本体(GO)富集分析[41].这个R包是专门设计用于分析RNA-Seq数据集中氧化石墨烯的富集。最初的GO注释取自柳枝稷基因组注释(v1.1),并通过添加亲本术语进行扩展。在进行GOseq分析之前,去除少于5个基因的GO分类。基因按长度和类别加权,fdr校正p-值≤0.05被认为富集了作为参考数据集中所有表达的基因。
网络分析
加权基因共表达网络分析[42,43]来鉴定基因共表达模块。本研究中产生的共表达模块也与柳枝稷旗叶中鉴定的模块进行了比较[34]以识别任何重叠的表达模式,特别是那些与衰老有关的表达模式[44].在DESeq2中使用似然比检验鉴定差异表达基因(DEGs)。通过要求FDR≤0.05和对数来过滤deg2最高和最低归一化(方差稳定变换)表达值之间的倍数变化≥2。然后从得到的18581个基因中创建一个签名网络,软阈值(β)值为18,最小模块大小为30,合并阈值为0.25。Cytoscape(3.2.0版本)[45]被用来可视化生成的网络。使用WGCNA计算的拓扑重叠度量(TOM)作为基因对的共表达度量。每个基因的前四个TOMs,以及所有TOMs的前0.4%,被用来生成网络,使用AllegroLayout插件和边缘加权Allegro Fruchterman-Reingold算法在Cytoscape中绘制。连接基因对的边用各自的TOM值加权。
代谢物和酶分析
另一项单独的实验进行了鉴定防御代谢物和酶积累在gb感染的植物。5株植物分别在单独的容器中生长到L2期,要么被GB侵染,要么保持为RNA-Seq实验中描述的未侵染的对照。所有植物在10-DAI收获,与RNA-Seq数据集中观察到的基因表达峰值一致。如前所述,可溶极性代谢物被提取和衍生化[46].抽提液20 μL在真空下蒸发至干燥,加入50 μL吡啶和80 μL n -甲基- n -三甲基硅基三氟乙酰胺(MSTFA, #TS-48910 Thermo Scientific, Waltham, MA)衍生化,60℃下培养2 h。衍生化样品(1 μL进样)在Agilent 7890B GC上分析,MSD为5977A, HP-5MS超惰性柱(30 m × 250 μm × 0.25 μm)。GC运行条件为250℃进气口和300℃质谱传输线,初始烤箱温度为60℃,每分钟增加10℃至325℃,保持10 min。载气为氦气,流速为0.6 mL min−1.使用Agilent GC-MS MassHunter软件进行推测峰鉴定和定量。细果酸(P2519)、绿原酸(C3878)、海藻糖(T9531)的正品标准来自美国圣路易斯Sigma-Aldrich公司。
ROS为H2O2使用Amplex Red Ultra (ThermoFisher, A36006;沃尔瑟姆,马萨诸塞州)基本上根据[47].简单地说,将pH为7.5的0.1 M磷酸钠缓冲液300 μL加入到50±2 mg液氮地面植物组织中。组织在布兰森数字超声仪(450型;布兰森超声波公司,丹伯里,CT),连接到一个微尖端,振幅设置为20%。在超声循环之间,管子被放置在冰上。样品在超声后旋转30秒,并在冰上保存10分钟,然后在4°C下以14,500 rpm离心15分钟。每个样品取三份50 μL的等分液检测ROS。一个0到2000pmol H的标准曲线2O2用于计算组织提取物中的ROS当量。所有样品的荧光在Bio-Tek Synergy平板阅读器(Bio-Tek, Winooski, VT)上测定,使用530±25 nm的激发滤光片和590±35 nm的发射滤光片。
整除的50±2毫克的液氮地面植物组织获得五株(控制或出没)收获10戴化验了过氧化物酶和漆酶活动如下:大约10毫克的不溶性polyvinylpolypyrolidone (Sigma-Aldrich PVPP, 77627年,圣路易斯,密苏里州)被添加到植物样品在冰上,紧随其后的600μL 0.1钠磷酸盐缓冲剂,pH值7.0包含1.6毫米PMSF (P7626 Sigma-Aldrich,圣路易斯,密苏里州)。将两个不锈钢球(3mm和1mm)添加到每个管中,并将管放置在2010 Geno/Grinder (SPEX SamplePrep, Metuchen, NJ)的预冷(- 20°C)冷冻箱中。机器在1500转/分钟的转速下进行两次30秒的搅拌,每次搅拌间隔60秒。样品在4°C下14,500 rpm离心15 min。上清用作酶的来源。所有实验均在96孔微滴板中进行,总体积为200 μL,温度为30℃。使用Bio-Tek Synergy高温平板阅读器(Bio-Tek美国,Winooski, VT)测量吸光度的变化。过氧化物酶测定,样品用0.1 M磷酸盐缓冲液1:5稀释,pH 7.0。漆酶测定采用未稀释的上清液。用5 μL稀释提取物,在含20 mM HEPES-NaOH缓冲液、pH 6.0、6.75 mM愈创木酚、0.1 M H的溶液中测定过氧化物酶活性2O2(最终浓度)如前所述[48,49].漆酶活性测定采用10 μL未稀释的提取物,在100 mM醋酸钠缓冲液中,pH 5.0,含1.82 mM 2,2′-氮基-双(3-乙基苯并噻唑啉-6-磺酸)和10 μg过氧化氢酶(C-1345, Sigma-Aldrich, St. Louis, MO),总体积为200 μL [50].在30°C下,每5分钟增加吸光度420 nm,持续30分钟。消光系数为3.6 × 104米−1厘米−1用于计算漆酶活性[51].
cDNA合成及实时qPCR验证
用于RNA- seq实验的RNA亚样本被用于生成cDNA文库,用于在Fluidigm生物标记HD仪器(Fluidigm, South San Francisco, CA)上使用Evagreen化学生成实时qPCR验证的cDNA文库,使用制造商提供的协议(可在线在https://www.fluidigm.com/)。产品的基因,引物和扩增子大小在附加文件中提供2表S2。使用Fluidigm免费提供的Biomark & EP1软件对仪器数据进行分析。四个管家基因被用来产生ΔCt值,随后用于统计评估,如下所述。
统计分析
采用Excel中的方差分析(ANOVA)对GB数与植株损伤、酶和代谢物进行统计分析。根据制造商的方案(Fluidigm)完成基因表达分析的实时qPCR数据。相对表达值采用方差分析进行统计学分析,然后采用Tukey 's诚实显著差异(HSD)事后分析,以p≤0.05为显著性截止值。
结果
GB累积和损坏等级
最初在第0天,每株植物上放置10个无翅片GB,随着试验的进行,GB的数量不断增加。在侵染后15天(DAI)观察到最高的GB数(表2)1)。同样,植物的伤害等级也随着时间的推移而增加,在15代时明显更高。15-DAI的平均危害等级为2.4±0.2,表明侵染植物受到了中度以上的危害。对照植物上未发现GB(或其他昆虫)。
gb侵染显著改变柳枝稷植物的转录组
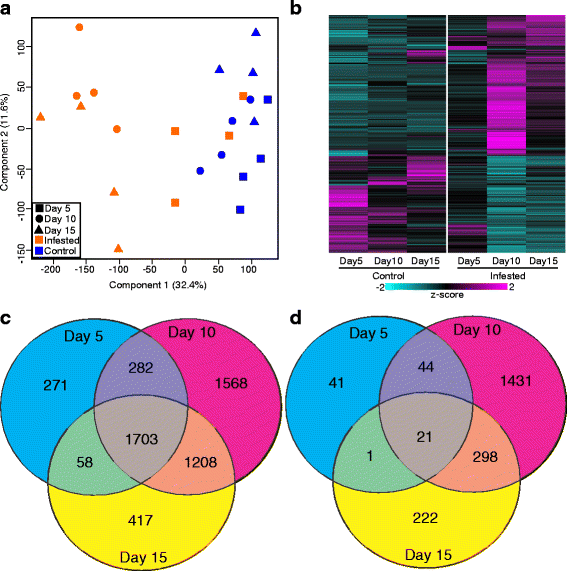
主成分分析(PCA)通过处理有效地分离了不同的转录组样本,并在每次处理中按时间点部分分离了样本(图2)。1),这表明在15天的时间过程中,转录谱的变化是由与发育相关的变化和与GB侵染相关的应激条件引起的。通过5-DAI,侵染植株的转录组通过第一主成分(PC1)与对照植株部分分化,占方差的32.4%;通过10-DAI,未侵染植株的转录组沿PC1轴(圆形,图2)与侵染植株的转录组完全分化。1)。通过15-DAI分析,未侵染植株的转录组在PC2轴上与未侵染植株的转录组有部分分化(占差异的11.2%),这可能与发育变化有关。
GB侵染过程中差异表达基因的鉴定
差异表达基因(DEGs)的全局变化采用FDR≤0.05和倍数变化≥2进行鉴定(图2)。1 b),此外,对选定的差异表达基因进行qPCR,以证实RNA-Seq实验的结果(图2)。7)。在对照植物中,相对于10- dai和15-DAI, 762和779个基因在5-DAI分别有差异表达(图2)。1 b),这可能是由于植物随着时间的推移而发生的发育变化。在受侵染的植物中,与未受侵染的对照相比,10-DAI的deg数量最多(6558),与PCA数据一致。然而,在5(2425)和15-DAI(3931)也观察到较少数量的deg;无花果。1 b)。
将每个侵染时间点与相应的未侵染对照进行比较,共鉴定出7565个独特基因因GB侵染而差异表达。与2058个基因下调相比,这些基因中的大多数在GB饲养下上调(5507个基因)。在上调的deg中,271;1568;和417分别在5、10和15 dai时完全上调,而1703在所有时间点持续上调,21在所有时间点持续下调(图2)。1 c,d)。与其他时间点相比,10代和15代植物之间共享了更多的deg(图2)。1 c)。10 dai时下调的deg数量最多(1431个),而5 dai(41个)和15 dai(222个)抑制的deg数量要少得多;无花果。1 d)。
GB侵染激活细胞氧化反应途径,抑制光合作用相关途径
进行了四种不同的基因本体(GO)富集比较,以确定GO生物过程中的上调/下调:(1)在蚜虫侵染植物的所有时间点上,DEGs都是共同的;(2) 5 DAI的温度;(3) 10-DAI处的温度;(4) 15-DAI的温度(附加文件)3.:数据S1)。
这55个氧化石墨烯生物过程术语在受gb侵染的植物的所有三个时间点上都富含上调基因,包括:氧化还原过程(GO:0055114)、对生物刺激的反应(GO:0009607)和防御反应(GO:0006952)。侵染植物中富集了18个生物过程氧化石墨烯项5-DAI (271 deg);无花果。1 c),包括基因表达(GO:0010467)和细胞生物合成过程(GO:0044249;额外的文件3.:数据S1)。通过10-DAI,侵染植物中与上调基因相关的7个富集氧化石墨烯术语包括跨膜运输(GO:0055085)、单生物过程(GO:0044699)和氧化还原过程(GO:0055114)。相比之下,在417个上调的deg中,有9个显著富集的项是15-DAI植物特有的(图2)。1 c)与蛋白磷酸化相关(GO:0006468)(附加文件3.:数据S1)。
在所有三个时间点下调的基因或侵染植物的5-DAI中,没有GO项显著富集(分别为21个和41个基因)。1 d)。在gb侵染植物中,10-DAI后下调的1431个DEGs在24个生物过程项中富集,包括生物调控(GO:0065007)、肽转运(GO:0015833)和氮化合物转运(GO:0071705)(附加文件)3.:数据S1)。细胞氧化还原稳态过程(GO:0045454)和光合作用(GO:0015979)是在15-DAI侵染植物中被下调的四个富含DEGs的过程之一。
与叶绿素、碳和氮代谢相关的基因受草食GB显著影响
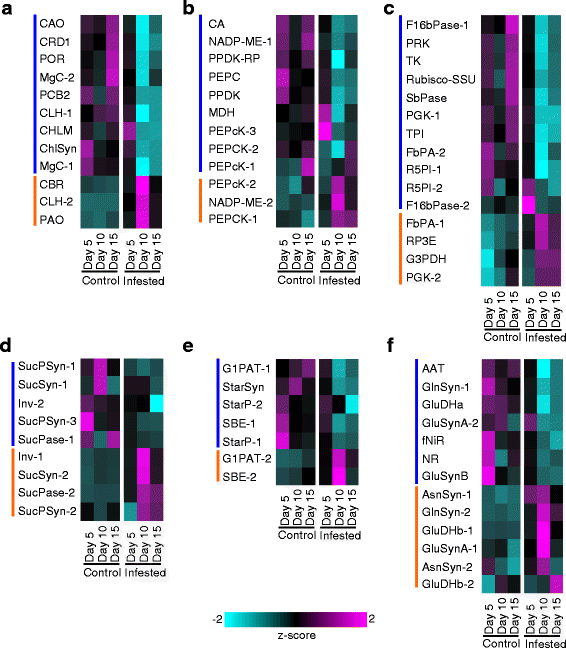
图中描述的所有基因的表达水平(平均归一化映射读数)。2,3.,4,5,6,7,8和9的附加文件4:数据S2。在对照植株中,叶绿素生物合成基因的表达在15天的时间内普遍增加(图2)。2叶绿素降解基因的表达水平变化很小(图2)。2(橙色条)。相比之下,在受gb侵染的植物中,参与叶绿素生物合成的基因被10-和15-DAI显著下调,叶绿素分解代谢基因,即叶绿素(ide) b还原酶(CBR)、叶绿素酶2 (CHL2),以及磷A氧化酶(PAO)被5-DAI诱导(1.2 - 2倍),被10-DAI上调(2.8 - 4倍)(图2)。2;额外的文件4:数据S2)在受感染植物中。虽然与10-DAI相比,侵染植物中参与叶绿素分解代谢的基因表达水平降低了15-DAI(图2)。2(橙色条),但仍显著高于15-DAI未侵染对照植株(图2)。2(蓝色条)。与gb侵染植物叶绿素分解代谢上调和叶绿素生物合成减少一致,gb侵染植物10-DAI的叶绿素含量显著低于可比未侵染对照植物(附加文件)5:图S1a)。
与植物初级代谢相关的基因在对照和被gb侵染植物中的差异表达。蓝色的条形图表示对照植物中上调的基因橙色条形图表示受感染植物中上调的基因。在所有情况下,基因的差异表达基于z分数,其中青色是低表达和品红色的高表达(一个叶绿素的生物合成和降解。b光合作用。c卡尔文循环。d蔗糖代谢。e淀粉代谢。f氮代谢。基因缩写,身份,和标准化转录计数提供在附加文件4:数据S2
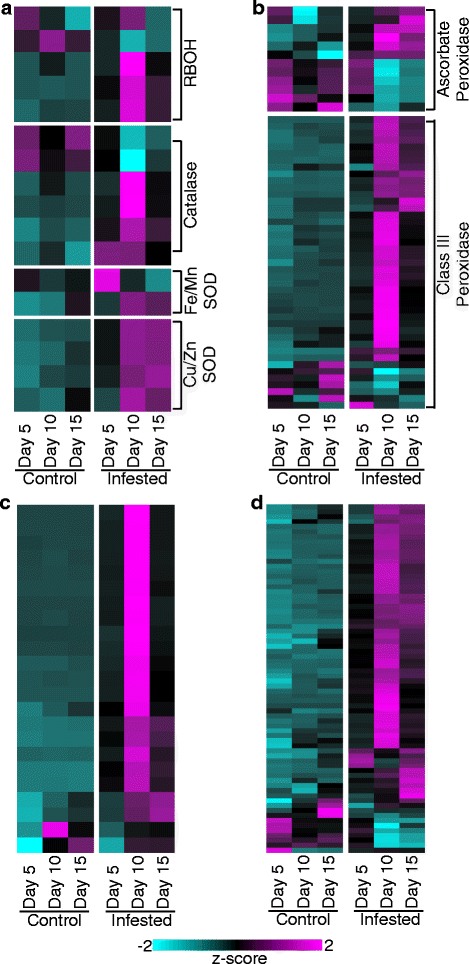
与植物氧化还原代谢相关的基因在对照和gb侵染植物中的差异表达。一个RBOHs,过氧化氢酶和sod。b抗坏血酸过氧化物酶和III类分泌过氧化物酶。c漆酶。d消费税。图5所示的其他细节。2
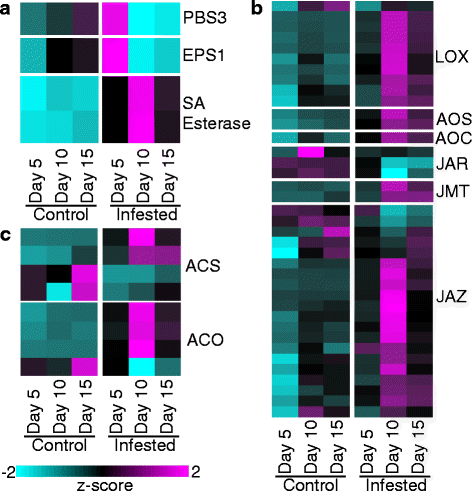
与三种植物激素代谢途径相关的基因在对照和受gb侵染植物中的差异表达。一个水杨酸代谢。b茉莉酸代谢。c乙烯代谢。图5所示的其他细节。2
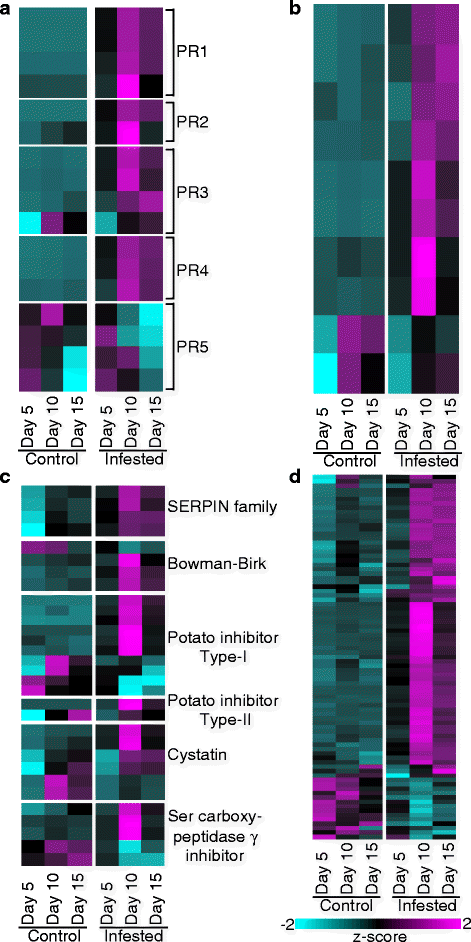
与植物防御相关的基因在对照和gb侵染植物中的差异表达。一个公关的基因。bChitin-related基因。c蛋白酶抑制剂。dNB-LRRs。图5所示的其他细节。2
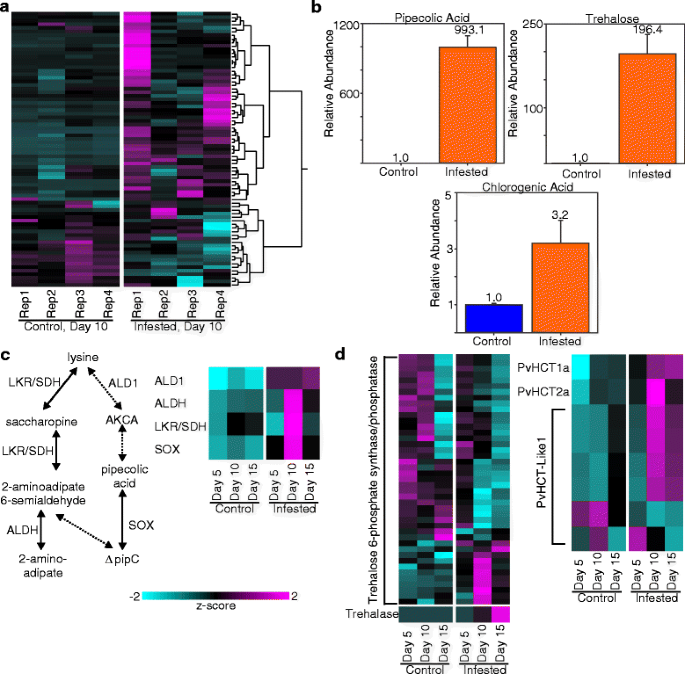
对照植物和gb侵染植物中防御相关代谢物水平和相关生物合成途径的转录物丰度。一个利用GCMS分析了柳枝稷10-DAI 4个生物重复(Rep1-4)中代谢物的差异水平。b对照和gb侵染植物在10-DAI下的特定代谢物水平,使用真实标准验证。cpipiolic acid的生物合成代谢途径(ΔpipC),改编自Zeier, 2013;左和转录本丰度(正确的面板)。d海藻糖代谢相关基因转录物丰度(左面板)和绿原酸(正确的面板)。图5所示的其他细节。2
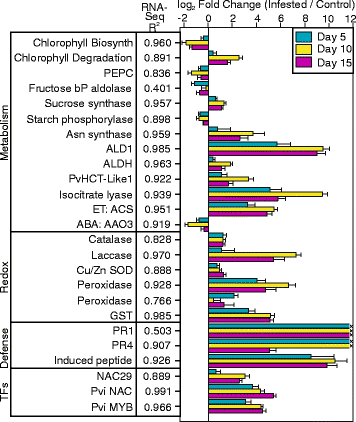
实时qPCR基因表达验证。通过real-time qPCR分析RNA-Seq数据集中选择的上调/下调基因的表达水平。将用于RNA- seq研究的输入RNA作为qPCR分析的源材料。基因注释提供在第一列,并按功能类别分开:代谢,氧化还原,防御和转录因子(tf)。第二列列出了RNA-Seq和qPCR分析中单个基因表达的相关系数。日志2基因变异(感染/对照)为5 (青色), 10 (黄色的),以及15个DAI (品红色的)所示。基因id,引物和扩增子大小在附加文件中提供2表S2
组合旗叶发育的基因共表达网络和模块分配[j]。34],以及当前的RNA-Seq数据集。一个17637个基因(节点)共检测到23个模块。网络的上半部分(黄色的圆圈)由主要在旗叶中表达的基因组成(右侧为早期发育,左侧为衰老开始)。白色箭头.底白色的圆该网络主要由在当前研究中使用的幼苗中表达的基因组成(左下角为gb诱导的宿主基因;红色的圆圈)。模块2 (M2,橘色点)含有与GB侵染相关的共表达基因网络。模块7,(M7,黄点)含有在gb侵染植物和旗叶衰老过程中共表达的基因。模块18 (M18,绿点)由在扩大的旗叶和在gb侵染后期共同表达的基因组成。该网络中的模块配置文件显示在支持附加文件中6:图S2。b与不同模块相关联的sag;圆点颜色编码如面板一个.cWRKY转录因子;圆点颜色编码如面板一个.dMYB转录因子;圆点颜色编码如面板一个.基因缩写,身份,和标准化转录计数提供在附加文件4:数据S2
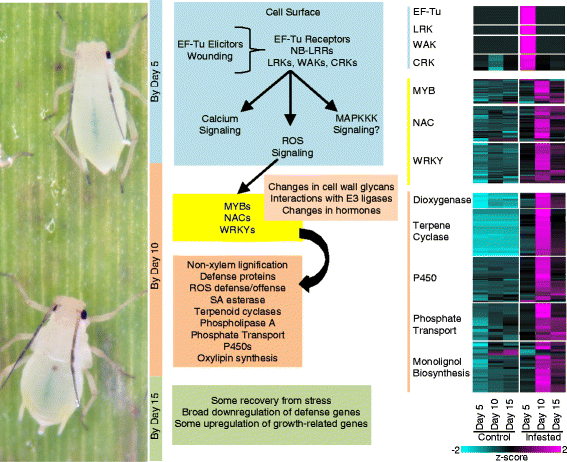
陆地四倍体柳枝稷对GBs的反应是稳健的,包括过多的途径。左面板,GBs在吃柳枝稷叶子。中图总结了转录和一些代谢物证据,表明在实验的时间过程中,gb侵染植物中发生的预测变化。浅蓝色的条形和方框表示5-DAI内发生的变化;光赭色条形和方框表示10-DAI内发生的变化;黄色的框突出显示了一些关键的转录家族,它们是deg的一部分。亮绿色条形图和框形图为支持从gb诱导的应激和15-DAI恢复的转录组的变化。正确的面板,与每个收获日期相关的deg热图。酒吧的颜色描述为中心面板。图5所示的其他细节。2
叶绿素代谢的变化反映在大多数参与碳固定的基因的下调上(图2)。2 b)和卡尔文循环(图2)。2摄氏度),尽管其中一些基因的转录水平似乎在15-DAI的作用下有所恢复(图2)。2 b,c)。然而,一些基因的转录水平,包括pep羧基化酶激酶(PEPcK-2)、苹果酸nadp酶(NADP-ME-2)和磷酸烯醇丙酮酸羧激酶(PEPCK-1)在10-DAI植物中表达上调(图2)。2 b(橙色条)。此外,胞质性,而非叶绿体,果糖二磷酸醛缩酶(FbPA-1)、磷酸核酮糖3二聚苯胺酶(RP3E)、甘油醛3-磷酸脱氢酶(G3PDH)和磷酸甘油酸激酶(PGK-2)与卡尔文循环相关,在受感染植物中也随着时间的推移而持续升高(图2)。2摄氏度(橙色条)。
参与蔗糖合成和降解的基因转录谱如图所示。二维.三个蔗糖-磷酸合酶基因(SucPSyn)均有表达,其中2个基因在对照植株中的表达量高于侵染植株。相反,一对蔗糖合酶基因(SucSyn-2)在所有三个时间点上,与对照植物相比,在gb侵染植物中表达得更高。伴随而来的转化酶(Inv1;无花果。二维)的转录水平。可以想象,由于受侵染植物的光合能力降低,这些转录变化表明蔗糖分解增加,蔗糖产量减少(见图2)。2 b,c)。与此同时,淀粉合成也明显受到GB草食的影响(图2)。2 e)。一个主要的葡萄糖-1-磷酸腺苷基转移酶基因(G1PAT-1;无花果。2 e与对照植物相比,侵染植物的淀粉生物合成基因和其他几个淀粉生物合成基因显著下调。淀粉生物合成转录本的下调早在5-DAI时就发生了(图2)。2 e)。可以想象,一些与蔗糖代谢相关的基因表达的差异模式是受植物发育控制的(在未侵染的植物中较高),而另一些则是对GB草食的响应。
氮代谢也受到GB草食的显著影响(图2)。2 f)。硝酸还原酶转录本(NR)和铁氧还蛋白依赖的亚硝酸盐还原酶(fNiR)在gb侵染植物中被5-DAI下调,即使是15-DAI也保持下调(图2)。2 f)。在受gb感染的植物中,叶绿体中将氨同化为氨基酸所需的基因也下调,包括谷氨酰胺合成酶1 (GlnSyn-1),铁氧还蛋白依赖性谷氨酰胺-2-氧葡萄糖酸氨基转移酶(GluSynA-2)和NADP +−依赖性谷氨酸脱氢酶(GluDHa)(图。2 f(蓝色条)。相反,胞质谷氨酰胺合成酶(GlnSyn-2)、天冬酰胺合成酶(AsnSyn-1和AsnSyn-2),以及依赖NAD +−的谷氨酸脱氢酶(GluDHb-1和GluDHb-2)在受侵染植物中表达上调,通常以10-DAI的表达量最高(图2)。2 f(橙色条),表明蛋白质周转增加。这些数据表明叶绿体内氮同化的潜在下降,与前面描述的光合作用的明显减缓一致。
受侵染植物上调与ROS信号传导和缓解相关的基因
参与ROS代谢的基因家族表达谱如图所示。3..在侵染植物和未侵染植物中均检测到5种反应性爆发氧化酶(RBOH)基因的表达。其中,只有一个基因在对照植物中上调,而3个RBOHs在侵染植物中被10-DAI显著上调(图2)。3)。同样,两种过氧化氢酶在对照植物中表达上调,但在10-DAI侵染植物中有四种酶被显著诱导。在5-DAI侵染植物中,只有一个Fe/Mn超氧化物歧化酶(SOD)基因表达强烈上调,而在10-和15-DAI侵染植物中,该基因表达下调。另一种Fe/Mn超氧化物歧化酶在10-DAI时表达上调,并在15-DAI期间保持表达水平。然而,在15-DAI未侵染植物中也检测到这种特异性Fe/Mn SOD的高丰度转录本,这表明该基因的表达升高可能与发育过程有关,并且可能与侵染植物的生长恢复有关(图2)。3)。4个Cu/Zn SOD基因在10-DAI侵染的GB侵染植物中显著上调,而在15-DAI侵染的植物中转录数仍然升高,这表明这些SOD可能是GB侵染植物防御反应产生的过量ROS解毒的强有力候选基因。支持这些发现,细胞ROS(如H2O210-DAI(附加文件)在受gb感染的植物中显著增加5:图S1b)。
共有12个柳枝稷抗坏血酸过氧化物酶基因差异表达(图2)。3 b)。其中6个基因在对照植物中至少两个时间点表达水平较高,6个基因在侵染植物中显著上调,最大表达水平出现在较晚的时间点(10-和/或15-DAI)。3 b)。在被侵染植物中,6个上调的基因中有4个编码抗坏血酸过氧化物酶,目的是细胞质,相反,在对照植物中,6个上调的基因中有4个靶向质体(附加文件)4:数据S2)。
43个III类过氧化物酶基因差异表达(图2)。3 b)。这些基因中的大多数早在5-DAI (5-DAI呈黑色,对照植物呈青色)时就因GB摄食而上调,表达高峰通常出现在10-DAI(图2)。3 b),但3个过氧化物酶基因在侵染植株15-DAI中表达上调。相比之下,其他七种过氧化物酶的转录本在未感染的植物中表达得更高,这表明它们参与了发育过程(图2)。3 b)。最近,在柳枝稷、高粱(高粱二色的)和谷子(Setaria italica)对GB摄食有不同的反应[29],支持这里报道的研究结果。
观察到大量漆酶基因表达的增加和减少(图2)。3 c)和谷胱甘肽- s转移酶(GSTs;无花果。3 d)作为对GB草食的反应。
在gb侵染植物中,总过氧化物酶(以愈创木酚为底物)和漆酶活性均显著升高,支持过氧化物酶和漆酶在gb草食反应中的作用5:图S1c、S1d)。
与JA, SA和ET生物合成相关的基因在侵染期间上调
植物激素代谢途径通常被植物用来防御害虫和病原体。四种与水杨酸(SA)代谢相关的基因的表达水平在GB侵染期间显著改变,包括羟基苯甲酸-谷氨酸连接酶(PBS3)、BAHD酰基转移酶(EPS1)和两种SA酯酶(图2)。4)。在侵染期间,SA酯酶被显著诱导,而对照样品的转录水平较低。对茉莉酸(JA)代谢相关基因的影响更大,在整个时间过程中共鉴定了38个deg(图2)。4 b)。这些基因包括10脂氧合酶(液态氧)、二烯氧化物合酶(先进的)和一种氧化二烯环化酶(重获)基因,这些基因都是由gb侵染诱导的(图2)。4 b)。相反,三种茉莉酸酰胺合成酶(JAR)在受侵染植物中下调(图2)。4 b)。还有20个茉莉酸- zim域(JAZ)基因(图2)4 b)的表达水平变化,大多数在侵染期间上调,但也有一些在随后的两个时间点下调,这表明JAZ基因可能在GB防御反应中进行微调。除SA和JA相关的DEGs外,还观察到与乙烯(ET)代谢相关的DEGs。其中包括四种乙酰辅酶a合成酶(ACS)和四种ACC氧化酶(华)基因,其中大部分在10-DAI表现出最大的上调(图2)。4摄氏度)。
柳枝稷植物对GBs有明显的防御反应
害虫和病原体的入侵可引起一些与防御有关的植物基因家族的上调,包括发病机制反应性(公关)基因、几丁质酶、蛋白酶、昆虫消化酶抑制剂,以及任何一种抗性基因同系物(RGHs)属于NB-LRR蛋白家族的[24,52].在受GB胁迫的夏柳枝稷植株中,所有类别的防御基因都有显著的上调,包括PR1通过PR4,但不是PR5家庭(图。5)。
GB诱导的几丁质酶(PF00182)和几丁质识别(PF00187)结构域基因转录本(图2)。5 b)的最大表达水平通常比对照非侵染植物的表达水平高5至10倍(附加文件)4:数据S2)。其中一些基因在5-DAI中被显著诱导,尽管两种几丁质酶(Pavir。Aa01411和Pavir。Ab02160)的表达谱表明发育或年龄相关的调节(图2)。5 b底部),并在稍后的时间点(对照植物的10或15 dai)上调。
GB饲养诱导了6个主要的蛋白酶抑制剂家族(pi),包括SERPIN、Bowman-Birk、马铃薯抑制剂i型和ii型、胱抑素和丝氨酸羧肽酶-γ-抑制剂家族(图2)。5度)。通常10-DAI的表达量最大,尽管在许多情况下,它们的诱导作用显著提高了5-DAI的表达量(与对照植物的青色相比,5-DAI中的黑色显色;额外的文件4:数据S2)。这些PI家族中似乎没有一个在GB防御中起独家作用,因为每个PI类中至少有一个基因在未侵染的植物中表达更高(图2)。5度)。
差异表达的nb - lrs (PF00931)谱如图所示。5 d.观察到NB-LRR基因表达变化与年龄相关和gb诱导的证据。在侵染植物中,观察到两种不同的表达谱:(1)几种NB-LRR基因在侵染植物中被10-DAI强烈上调,15-DAI表达水平下降;(2)其他NB-LRR基因在侵染植物中被10-DAI强烈诱导,并通过15-DAI保持高表达(图2)。5 d)。
GB引起柳枝稷组织防御代谢物的变化
在代谢物分析中共检测到70个假定鉴定质量评分>70的特征。尽管在对照和侵染植株的生物重复中观察到代谢组有轻微的变化,但很明显,代谢组受到了GB草食的显著影响(图2)。6)。3个GCMS峰在gb侵染植物中大量富集,得到了归属于细果酸、绿原酸和海藻糖的质谱。这三种化合物都与植物防御有关[53- - - - - -55并因此使用真实的标准进行验证。果酸在对照植株中含量较低,但在侵染植株中含量升高近1000倍。海藻糖在侵染植物中富集了近200倍,绿原酸在侵染植物中富集了约3倍(图2)。6 b)。接下来对参与这三种途径的基因进行了分析。
赖氨酸生成胡椒果酸的预测途径如图所示。5度(改编自[56])。柳枝稷基因编码l -二氨基草酸氨基转移酶/醛脱氢酶(ALD1)及肌酸氧化酶(袜)在受5-DAI影响的侵染植物中显著上调了约100倍,并且这些基因的高表达水平在15-DAI中保持不变(附加文件)4:数据S2)。此外,柳枝稷赖氨酸降解途径的另外两个基因,即赖氨酸酮戊二酸还原酶/糖精脱氢酶(/ SDH斯里兰卡卢比)和l -氨基己二酸半醛脱氢酶(ALDH),被10-DAI强烈上调,并在15-DAI时保持比对照植物更高的表达(图2)。6摄氏度;额外的文件4:数据S2)。
在柳枝稷基因组中发现了大量海藻糖-6-磷酸合成酶和海藻糖-6-磷酸磷酸酶基因,但由于它们的结构相似性和缺乏生化表征,仅用氨基酸序列来区分编码这两种酶的基因是不可能的。然而,当作为一个群体考虑时,在对照和侵染植物中都记录了显著的表达变化(图2)。6 d)。其中一组海藻糖-6-磷酸合成酶/磷酸酶基因在gb侵染植物10-DAI中显著上调。相比之下,在所有三个收获日期的对照植株中,这些基因的表达谱似乎存在更大的多样性(图2)。6 d)。转录本被定位到两种海藻糖酶,这两种酶在15-DAI侵染植物中均显著上调,而这两个基因的转录本水平在对照植物中相对不变(图2)。6 d、附加文件4:数据S2)。
柳枝稷植物也通过特定的羟基肉桂酰基辅酶a -shikimate/quinate羟基肉桂酰基转移酶(hct)的作用产生绿原酸[55])。HCT1a和HCT2a早在5-DAI时,这些基因就在受gb感染的植物中表达上调,而10-DAI的转录本则大幅增加(图2)。6 d)。在这六种表达中HCT-Like1在侵染植物中,4个基因被10-DAI显著上调,尽管这4个基因在对照植物中的表达水平也随着时间的推移而增加(图2)。6 d)。两个HCT-Like1基因在对照植株中的表达水平高于侵染植株(图2)。6 d)。
实时qPCR验证基因表达谱
选择25个代表关键途径的基因,包括叶绿素生物合成和降解、C和n代谢、激素、氧化还原、植物防御和三种特定转录因子,使用用于RNA- seq研究的相同输入RNA,通过实时qPCR进行验证(图2)。7)。四个管家基因(附加文件)2:表S2)计算ΔCt和log2-折叠变化(感染/控制)。Real-time qPCR与大多数被查询基因的RNA-Seq表达值的相关系数一般大于0.7,在许多情况下大于0.9(图2)。7)。果糖二磷酸醛缩酶(右2= 0.401)和PR1(右2= 0.503)是两个例外。在…的情况下PR1,在对照样品中几乎没有发生扩增。Real-time qPCR基本上验证了RNA-Seq结果。
网络分析确定了与叶片衰老和叶片功能恢复相关的基因集
由于RNA-Seq数据表明,与衰老相关的叶片代谢途径在受gb侵染的柳枝稷中发生了显著的变化,因此与旗叶发育和衰老相关的基因网络的比较[34]和GB草食(本研究),以发现这两个过程独特而共同的网络。
在旗叶和GB组合草食数据集中,共检测到17637个基因中的23个共表达模块(M1 ~ M23)。8、附加文件6:图S2)。总体而言,与旗叶发育相关的基因网络(顶部黄色虚线圈)与在gb侵染和未侵染幼苗中发现的网络是可分离的(图2)。8(底部白色虚线圈)。此外,旗叶发育(早期到晚期,白色箭头,旗叶)和对GB摄食的响应在15天的时间过程中(品红点圈;无花果。8这表明一些基因表达网络只与旗叶发育(模块1、4和21)、gb侵染(模块2、7、12和18)或植物生长早期的发育事件(模块11、15、20和22)以及旗叶衰老(模块7、8、12)相关。
在旗叶中鉴定出65个与衰老相关基因(SAGs)的推定柳枝稷同源物[34],其中54个在旗叶发育和GB饲养组合数据集中(图2)。8 b;额外的文件4:数据S2)。这些sag大部分出现在模块2(橙色点)、7(黄色点)和8(洋红色点)(图2)。8 b)。在被gb侵染的植物中,sag的表达模式显示出有限的衰老进展,因为只有一部分sag被诱导。例如,模块2含有18个由GB侵染诱导的sag。这些基因中有3个与拟南芥SAG2 (AT5G60360编码淀粉蛋白样硫醇蛋白酶;[57]),三个过氧化氢酶基因包括过氧化氢酶2直接同源(34]和一种拟南芥的同源物ANAC029,是一种已知的叶片衰老调节剂[58].触发衰老途径的某些成分可能导致叶片代谢从养分同化转向防御分子的生物合成。模块7包含16个sag,在gb诱导的胁迫和旗叶衰老过程中表达水平相似。这些sag中的大多数包括ANAC029和叶绿素降解相关基因的同源物,它们在衰老过程中都有确定的作用[34,59,60].模块8包含5个sag(附加文件)4:数据S2)仅在旗叶衰老期间表达[34而不是在受gb感染的植物中诱导,这支持了昆虫压力下有限的衰老进程。
总共83个WRKY250个基因中的一个WRKYs在柳枝稷基因组中发现[44]在组合网络中发现(图2)。8 c)。WRKYs是植物生物和非生物胁迫反应的关键调控因子[61],并提出了WRKYs在柳枝稷叶片衰老中的可能作用[44].模块2中有42个wrky(附加文件)4:数据S2;GB-infested)。这42个WRKYs中有18个也与旗叶衰老有关(见图2)。5在[44])。同样,在分配给模块18的14个wrkey中(图2)。8 c、附加文件4:数据S2), 13个也存在于膨胀的旗叶的转录组中(见图2)。5在[44])。这些数据为黄芪的衰老和防御反应之间的重叠和分化提供了证据。为例,PviWRKY29和PviWRKY117在模块2中发现的,与拟南芥WRKYs同源,与叶片衰老、生物胁迫反应和磷营养有关[44,62,63].PviWRKY54,见模块7(附加文件)4:数据S2),显然是与ATWRKY28,通过调节SA生物合成影响植物对逆境的反应[64].在模块18中,PviWRKY175是同源的ATWRKY33该基因编码一种转录调控因子,通过直接调控SA、JA和ET信号传导和串扰基因来调节对真菌感染的反应[65].然而,这些特定的PviWRKYs在柳枝稷植物防御和生长过程中的实际作用仍有待确定。
MYB的网络分析检测到136个MYB基因与旗叶发育或GB摄食相关的表达模式(图2)。8 d、附加文件4:数据S2)。与WRKY基因的分布相反(图2)。8 c), myb在整个网络中都有代表,突出了它们在调节植物过程(包括次生细胞壁形成)中的广泛作用[66,67].柳枝稷植物细胞壁强化似乎是对GB草食的强烈反应,特异性MYBs可能调节了这一过程。模块2包含27mb(附加文件)4:数据S2),以及其中两个myb (Pavir。Aa01159和帕韦。J10932)编码与高粱相近的同源物SbMyb60(Sobic.004G273800)。构成性的过度表达SbMyb60在高粱植物中,单脂素生物合成基因的表达水平较高,叶片中脉和维管束周围的异位木质素沉积也较高[29].此外,模块2富集了几个编码木质素生物合成酶的基因(附加文件)4:数据S2),这表明柳枝稷的同源物SbMyb60也可能与单素生物合成有关,以刺激细胞壁强化。模块7包含7个myb,其拟南芥同源物在植物生理学中的作用已被大量描述[68,69].相比之下,模块18只包含一个MYB,Pavir。J12840(无花果。8 d、附加文件4:数据S2),与ATMYB12明显同源。ATMYB12调节许多不同的途径,包括提供抗虫性的黄酮醇的合成[70].可能,柳枝稷同源物可能会影响类似防御化合物的产生。总体而言,该网络分析提供了柳枝稷侵染导致的转录变化的详细图谱,并突出了可能构成柳枝稷防御反应的关键转录因子的表达谱。
讨论
柳枝稷的转录组受到GB饲喂的显著调节
早在5-DAI时,从侵染gb和未侵染gb的植物中获得的转录组已经明显差异。防御反应的早期迹象之一是受侵染植物体内碳和氮代谢的变化。抑制光合作用和碳转移似乎是植物对蚜虫取食的普遍早期反应[j]。2,16,49,71],在这方面,柳枝稷对GB的反应似乎相似。侵染植物中5-DAI的其他分子特征暗示了机械触发和激发剂触发的植物反应。前一节课讲了一些壁相关激酶,包括,Pavir.Ab01425;Pavir.Ib00075;Pavir。J04391,其编码的蛋白与FERONIA (FER)和HERCULES RECEPTOR KINASE 1 (HERK-1)同源。FER和HERK-1都能在拟南芥中传递机械信号,并通过调节钙通量发挥作用,从而导致后续的下游效应[j]。72].拟南芥伸长因子Tu (EF-Tu)受体的两个假定的柳枝稷同源物(Pavir。J26110和Pavir。J27646)仅在侵染植物5-DAI中显著上调。EF-Tu受体是植物微生物相关分子模式(MAMP)识别的已知组分[73,74]并识别细菌分泌的EF-Tu。蚜虫蜜露也含有EF-Tu蛋白,并被认为参与植物与蚜虫的相互作用[75].我们的数据支持这个假设。然而,这种特定的相互作用在生化水平上的确认尚未完成。
对蚜虫摄食反应的其他早期标记是编码壁相关激酶和防御相关NB-ARC结构域(NB-LRR)蛋白的基因特异性上调(Pavir.J15505;Pavir。J19633)。在其他植物中,nb - lrr已被鉴定为抗性基因(R特定昆虫的基因(17,24].细胞壁结构和细胞骨架相关基因的表达升高,特别是在5-DAI收获的gb侵染植物中(Pavir。Ib01358,Pavir。Ia03598,毛状双折射,资源描述;Pavir。Aa00167在拟南芥中,与柳枝稷同源的TBLs通过与纤维素合酶的相互作用影响了次级细胞壁中结晶纤维素的形成[7677]、核的形状和植物的姿势[78].Myosin IX通过指导细胞壁强化所需物质的运输,帮助形成有效的抵抗病原体的屏障[79],提示Myosin IX在柳枝稷对gbbs的反应中起类似的作用。
活性氧信号和缓解是柳枝稷对GB草食反应的一个组成部分
活性氧是植物对昆虫食草反应的一个公认组成部分[16,80,81].事实上,植物有效清除过量ROS的能力已经被假设为区分易感基因型和耐受基因型[26,82- - - - - -84].虽然细胞ROS可以由多个隔室产生,但质膜结合的反应性爆发氧化酶(RBOHs)是最先对外部刺激做出反应的酶之一,是ROS介导的信号传导的核心环节[85,86].rboh介导的ROS生成可以激活许多壁结合蛋白和细胞质蛋白,引发多种细胞反应。在柳枝稷中检测到RBOHs、下游信号蛋白上调,以及编码sod(特别是Cu/Zn sod)、过氧化物酶、漆酶和谷胱甘肽- s转移酶(GSTs)的一些基因上调,这表明在GB侵染植物中发生了ROS信号传导和可能增加的ROS水平调节需求。Cu/Zn sod可定位于细胞壁和细胞质等多个区室[87],在受感染的植物中表达得更高,这表明活性氧可能在几个细胞区室中得到缓解。在其他植物中也有类似的观察[2,80].抗坏血酸过氧化物酶和III类分泌过氧化物酶是柳枝稷细胞中主要的活性氧解毒酶[88].编码细胞质抗坏血酸过氧化物酶的四个基因在受gb感染的植物中显著上调,同源物与伤口反应有关[86].过氧化物酶在对食草动物的防御反应中也有很好的作用[88- - - - - -90]和漆酶,通常与细胞壁加固有关[91],可能在柳枝稷和其他相关的草类中起着类似的作用[29].10-DAI侵染GB的柳枝稷植株活性氧含量、过氧化物酶和漆酶活性显著升高,支持了ROS的整体作用,以及对GB侵染柳枝稷植株活性氧的抑制作用。这些数据与本文其他地方引用的许多文献报告一致。
激素防御信号通路
植物激素SA、JA和ET在包括植物与蚜虫相互作用在内的非生物和生物胁迫过程中作为信号分子发挥关键作用[j]。92- - - - - -95].取食韧皮部的蚜虫和蜘蛛螨可诱导SA生物合成和SA依赖途径[96],而SA已被证明是JA途径的负调制剂,但它也可以起加法或协同作用,这取决于系统[97].在易感大豆植株中,蚜虫通过激活脱落酸(ABA)相关通路,抑制JA和sa介导的防御反应[j]。27].相比之下,GB草食在夏季柳枝稷中引发了大规模的防御反应,包括参与SA、JA和ET生物合成的基因上调(图2)。4- - - - - -c)以及这些植物激素的下游靶点,包括公关基因(图。5)。
JA代谢相关基因包括液态氧,先进的,重获,JAR,在受伤,昆虫摄食以及坏死性病原体的反应中被证明是上调的[96,98- - - - - -101].除了三个JAR其他所有JA通路基因在gb侵染柳枝稷中均被显著诱导(图2)。4 b),这与其他研究结果一致[96].JA已被证明可以调节植物的生长和发育,其下调与昆虫侵害期间易感性的增加有关[1].因此,这些基因的上调表明,防御水平的提高可能与柳枝稷品种夏季的耐受行为有关。然而,需要完成更多的工作来阐明这些诱导基因是在对GB的反应中特异性上调的,还是在对刺吸昆虫或一般生物胁迫的反应中更广泛的植物防御系统的一部分。
在蚜虫食草的植物中,与SA和JA相关的基因明显同时上调,这在文献中有报道[102- - - - - -105].可以想象,在柳枝稷中,至少对于夏× GB品种,SA、JA和ET之间的相互作用是相加或协同的。最终,对柳枝稷对不同蚜虫或其他节肢动物害虫的响应进行类似的研究,将揭示SA、JA和ET途径在寄主植物防御中相互作用的共性或独特性。
抗营养基因和代谢物在GB侵染期间被诱导
与基因表达谱一致的是,夏季柳枝稷植物对GBs的广泛防御反应也被草食反应中产生的代谢物所证实,这些代谢物包括薄荷酸、海藻糖和绿原酸。
胡椒果酸对植物防御包括蚜虫的食草性很重要[54,106,107],是系统性获得性耐药(SAR)所需的已知信号化合物[108- - - - - -110].同样,绿原酸与植物防御有关[55]并会对昆虫健康产生负面影响[111].海藻糖可调节叶片碳水化合物代谢[112,113],其水平随着昆虫食草性的增加而增加[24,53].在拟南芥中,海藻糖也调节植物抗毒素缺乏(AtPAD4)表达,并改变葡萄糖对淀粉合成的通量,使其远离蔗糖合成,从而使蚜虫失去可获得的能量来源[53].AtPAD4柳枝稷同源物在所有收获日期在对照和侵染植株之间没有差异表达,这可能与柳枝稷侵染植株中淀粉和蔗糖合成相关基因的下调相一致。与初级代谢相关的基因调控模式似乎同时依赖于植物和食草动物,本研究中观察到的转录组学事件应在Zhou等人提出的框架内进行解释。[qh]114].
转录证据也支持在gb侵染的柳枝稷植物中参与乙醛酸循环的酶的上调。其中包括两种异柠檬酸水解酶(Pavir。Ba00758 Pavir。Bb02888)、两种苹果酸合成酶(Pavir。Gb01372 Pavir。J04298)和一个苹果酸脱氢酶(Pavir。Aa03554)。柳枝稷叶片衰老过程中,乙醛酸循环被上调[34]并且也被证明是植物与微生物相互作用的一部分[115].因此,乙醛酸盐代谢可能是草食动物防御的另一个重要方面,正如对其他病原体的预测或引发防御相关的衰老[115- - - - - -117].
结论
柳枝稷对GB的响应模型
基于我们的数据集,我们提出了柳枝稷对GB摄食的响应模型(图2)。9)。在最早发生的转录变化中,5-DAI与许多细胞壁受体有关,包括细胞壁相关激酶。这些变化似乎与文献中报道的其他研究相似(例如[7])。GB的感知可能通过RBOHs和其他壁锚定蛋白的上调潜在地触发细胞内信号传导。与细胞壁结构和聚糖相关的基因以及与JA、SA和ET的生物合成和信号传导相关的基因的表达也发生了变化。在gb侵染植物中,10-DAI显著提高了ROS水平、过氧化物酶和漆酶活性,并伴随着NACs、WRKYs和MYBs等基因以及亮氨酸氨基肽酶(LAP)等潜在辅助信号分子的大量上调。94])。最终结果似乎是一个广泛的防御反应,从初级代谢的下调到潜在的营养物质和矿物质的饥饿,到防御代谢物的产生和细胞壁强化(可能通过异位木质化),以及在10-DAI诱导许多细胞色素p450,萜烯环化酶和几种双加氧酶。有趣的是,萜烯环化酶和双加氧酶对植物抵御昆虫都很重要[118,119].
与10-DAI相比,在10-DAI中观察到的这些强烈的防御反应之后,15-DAI中与光合作用、C、N和营养代谢相关的叶片功能明显恢复,与这些途径相关的基因表达水平较高。未来有必要对抗性、易感和耐受基因型进行转录组尺度的比较,以最终将这些途径与柳枝稷和其他禾本科植物中可能的宿主抗性途径联系起来。总的来说,这些研究提供了新的信息和基因,可以为持续改善暖季温带C4多年生生物量草对草食的响应提供有用的信息。
缩写
- AAT:
-
谷草转氨酶
- 阿坝:
-
脱落酸
- 华:
-
ACC氧化酶
- ACS:
-
乙酰辅酶a合成酶
- ALD1:
-
二氨基磺酸氨基转移酶/醛脱氢酶
- ALDH:
-
l -氨基己二酸半醛脱氢酶
- AOC:
-
烯氧化物环化酶
- 代谢:
-
氧化丙烯合成酶
- AsnSyn:
-
天冬酰胺合成酶
- CA:
-
碳酸酐酶
- 曹:
-
叶绿素内酯一种加氧酶
- CBR:
-
叶绿素(ide) b还原酶
- CHL2:
-
叶绿素酶2
- CHLM:
-
镁-原卟啉IX甲基转移酶
- ChlSyn:
-
叶绿素合酶
- CLH:
-
叶绿素酶1
- CRD:
-
镁-原卟啉IX单甲酯[氧化]环化酶
- 戴:
-
虫害发生后的几天
- 度:
-
差异表达基因
- 等:
-
乙烯
- F16bPase:
-
的特性,6-bisphosphatase我
- FbPA:
-
果糖二磷酸醛缩酶
- 带:
-
FERONIA
- fNiR:
-
铁氧化还原蛋白依赖性亚硝酸盐还原酶
- G1PAT:
-
Glucose-1-phosphate adenylyltransferase
- G3PDH:
-
甘油醛3-磷酸脱氢酶
- GB:
-
Greenbug
- GlnSyn-1:
-
谷氨酰胺合成酶
- GlnSyn-2:
-
胞质谷氨酰胺合成酶
- GluDHa:
-
依赖NADP +−的谷氨酸脱氢酶
- GluDHb:
-
依赖NAD +−的谷氨酸脱氢酶
- GluSynA:
-
铁还毒素依赖谷氨酰胺-2-氧葡萄糖酸氨基转移酶
- GluSynB:
-
谷氨酸合成酶(铁还蛋白)
- 走:
-
基因本体论
- 销售税:
-
Glutathione-S-transferase
- HCT:
-
羟基肉桂酰基辅酶a -莽草酸酯/桂酸酯羟基肉桂酰基转移酶
- HERK-1:
-
大力神受体激酶1
- 发票:
-
转化酶
- 是:
-
茉莉酸
- JAR:
-
茉莉酸酰胺合成酶
- JAZ:
-
Jasmonate-ZIM域
- / SDH:斯里兰卡卢比
-
赖氨酸酮戊二酸还原酶/糖精脱氢酶
- 液态氧:
-
脂氧合酶
- MAMP:
-
微生物相关的分子模式
- MDH:
-
苹果酸脱氢酶
- 德国小姐:
-
镁chelatase
- NADP-ME:
-
NADP-Malic酶
- NR:
-
硝酸还原酶
- PAD4:
-
植物抗毒素缺乏
- PAO:
-
酚A氧化酶
- 主成分分析:
-
主成分分析
- PCB2:
-
二乙烯基叶绿内酯:8-乙烯基还原酶
- PEPC:
-
磷酸烯醇丙酮酸羧化酶磷酸化
- PEPcK:
-
PEPcarboxylase激酶
- PEPCK:
-
磷酸烯醇丙酮酸carboxykinase
- PGK:
-
磷酸甘油酸酯激酶
- PI:
-
蛋白酶抑制剂
- 运动:
-
原叶绿素酸脂还原酶
- PPDK:
-
丙酮酸,磷酸二激酶
- PPDK-RP:
-
丙酮酸,磷酸二激酶调节蛋白
- 公关:
-
发病机理的反应
- PRK:
-
Phosphoribulokinase
- R5PI:
-
核糖5-磷酸异构酶A
- RBOH:
-
Reactive-burst氧化酶
- RGH:
-
抗性基因同源物
- ROS:
-
活性氧
- RP3E:
-
磷酸核酮糖3外聚酶
- Rubisco-SSU:
-
Rubisco-Small亚基
- 山:
-
水杨酸
- 凹陷:
-
衰老相关基因
- 特别行政区:
-
全身获得性抗性
- SBE:
-
淀粉支化酶
- SbPase:
-
Sedoheptulose-bisphosphatase
- SOD:
-
超氧化物歧化酶
- 袜:
-
肌(细果酸)氧化酶
- StarP:
-
淀粉磷酸化酶、蔗糖酶、蔗糖磷酸酶
- StarSyn:
-
淀粉合成酶
- SucPSyn:
-
蔗糖磷酸合成酶
- SucSyn:
-
蔗糖合酶基因
- 资源描述:
-
毛状双折射
- TK:
-
转酮醇酶
- 汤姆:
-
拓扑重叠度量
- TPI:
-
Triosephosphate异构酶
- WGCNA:
-
加权基因共表达网络分析
参考文献
- 1.
凯斯勒A,鲍德温IT。植物对昆虫食草的反应:新兴分子分析。植物学报,2002;33(3):391 - 391。
- 2.
王晓明,王晓明,王晓明,等。植物光合作用、活性氧和激素信号通路的研究进展。植物学报,2012,35(2):441-53。
- 3.
张建军,张建军,张建军,等。植物介导的地上和地下昆虫间的相互作用。Oikos。1993;66(1):148 - 51。
- 4.
恩达拉·MJ,科利警署。资源可用性假说的重新审视:一项荟萃分析。数学学报,2011;25(2):389-98。
- 5.
李建军,张建军,张建军,等。植物对蚜虫抗性的遗传和分子基础研究。中国生物医学工程学报,2010;33(6):566 - 573。
- 6.
史密斯m .,克莱门特l .。植物对节肢动物抗性的分子基础。昆虫学报。2012;57:309-28。
- 7.
卡洛希安I,沃林LL。半翅目和双翅目害虫:效应器和植物宿主免疫调节剂。中国。植物学报,2015;58(4):350-61。
- 8.
刘小明,陈美梅,刘小明,赵建军,吴武切。小麦抗蝇基因的遗传特征及分子定位。理论与应用,2005;11(7):1308-15。
- 9.
Sardesai N, Nemacheck JA, Subramanyam S, Williams CE。小麦抗黑森蝇新基因H32的鉴定与定位。理论与应用,2005;11(6):1167-73。
- 10.
绿虫(半翅目:蚜虫科)的生物型多样性:表征新的毒力和寄主关联。中国生物医学工程学报,2006;30(3):959 - 965。
- 11.
Oerke EC。害虫造成的作物损失。中国生物医学工程学报,2006;44(4):391 - 391。
- 12.
蚜虫唾液蛋白酶能够降解筛管蛋白。实验学报,2015;66(2):533-9。
- 13.
马格,王晓明,王晓明,等。植物防御武器和防御信号的研究进展。BioEssays。37 2015;(2): 167 - 74。
- 14.
史密斯厘米。植物对节肢动物的抗性:分子和常规方法。2005.
- 15.
张建军,李建军,李建军,等。植物对生物和非生物胁迫的交叉抗性研究。生物学报,2016;67(7):2025-37。
- 16.
傅春华,杨建军,李建军,等。拟南芥韧皮部取食昆虫诱导的转录重编程的系统分析,揭示了对专一昆虫和通才昆虫的不同反应。实验学报,2015;66(2):495-512。
- 17.
Smith CM, Chuang WP。植物对蚜虫取食的抗性:行为、生理、遗传和分子线索调节蚜虫的寄主选择和取食。有害生物防治,2014;70(4):528-40。
- 18.
刘建军,李建军,李建军,等。植物对半翅目昆虫的抗性研究。植物科学,2016;7:1363。
- 19.
李建军,李建军,李建军,刘建军,等。大麦对嗜蚜蚜虫的抗性基因表达分析。中国生物医学工程学报,2009;39(2):563 - 563。
- 20.
Koch KG, Palmer N, Stamm M, Bradshaw JD, Blankenship E, Baird LM, Sarath G, hengmoss TM。四倍体柳枝稷抗性和易感群体对绿虫摄食行为和蚜虫寄主偏好的影响。生物质能源学报,2015;8(1):165-74。
- 21.
张晓明,张晓明,张晓明,等。四倍体柳枝稷对4种蚜虫的抗性及寄主适宜性评价。中国生物医学工程学报,2014;31(1):424 - 431。
- 22.
张建军,张建军,张建军,等。四倍体柳枝稷种群对绿虫和黄蔗蚜的抗性分类。生物质能源学报,2014;7(3):909-18。
- 23.
沃格尔KP,萨拉斯G,萨特霍夫AJ,米切尔RB。柳枝稷。能源作物。2011;3:341-80。
- 24.
李建军,张建军。植物对蚜虫的抗性研究。实验学报,2015;66(2):449-54。
- 25.
Tzin V, Fernandez-Pozo N, Richter A, Schmelz EA, Schoettner M, Schafer M, Ahern KR, Meihls LN, Kaur H, Huffaker A,等。通过转录组学和代谢组学的时间序列分析揭示了玉米对蚜虫摄食的动态反应。植物生理学报,2015;39(3):557 - 557。
- 26.
Prochaska TJ, Donze-Reiner T, Marchi-Werle L, Palmer NA, Hunt TE, Sarath G, hengmoss T.大豆蚜虫(Aphis glycine Matsumura)抗性和敏感性的转录响应。节肢动物学报,2015;9(4):347-59。
- 27.
Studham ME, MacIntosh GC。多种植物激素信号控制大豆植株对大豆蚜虫侵染的转录反应。植物微生物学报,2013,26(1):116-29。
- 28.
刘建军,刘建军,刘建军,刘建军。植物蚜虫与豆科植物的相互作用。植物学报,2013;40(12):1271-84。
- 29.
史考利,王海涛,王海涛,王海涛,Baxendale F, Twigg P, Kovacs F, Heng-Moss T, Sattler SE, Sarath G. C4禾本科植物过氧化物酶对绿虫( Schizaphis graminum)食性的响应。植物学报,2016;43(12):1134-48。
- 30.
杜德PF, Sarath G, Mitchell RB, Saathoff AJ, Vogel KP。不同木质素水平下四倍体柳枝稷全兄弟科的抗虫性。遗传资源作物学报,2013;60(3):975-84。
- 31.
杨建军,杨建军,杨建军,等。柳枝稷对秋粘虫的抗性差异研究[j]。遗传资源作物学报,2009;56(8):1077-89。
- 32.
Moore KJ, Moser LE, Vogel KP, Waller SS, Johnson BE, Pedersen JF。描述和量化多年生牧草的生长阶段。杨建军,刘建军,刘建军,等。
- 33.
Heng-Moss TM, Baxendale FP, Riordan TP, Foster JE。牛草种质对夜蛾(半翅目:夜蛾科)抗性评价。中国生物医学工程学报,2009;35(5):1054 - 1058。
- 34.
Palmer NA, donz - reiner T, Horvath D, Heng-Moss T, Waters B, Tobias C, Sarath G.柳枝稷(Panicum virgatum L)旗叶转录组学研究揭示了叶片发育、衰老和矿物动力学的分子特征。函数积分。2015;15(1):1 - 16。
- 35.
乔czynski P, Sacchi N.硫氰酸胍-苯酚-氯仿萃取单步法分离Rna。中国生物医学工程学报,2009;32(1):1 - 6。
- 36.
Goodstein DM, Shu SQ, Howson R, Neupane R, Hayes RD, Fazo J, Mitros T, Dirks W, Hellsten U, Putnam N,等。Phytozome:绿色植物基因组学比较平台。中国生物医学工程学报,2012;39(1):481 - 481。
- 37.
李建军,李建军,李建军,李建军,等。基因融合与转录组序列的研究进展。中国生物医学工程学报,2013;14(4):936。
- 38.
廖勇,史伟。特征计数:一种高效的基因组特征序列分配程序。生物信息学。2014;30(7):923 - 30。
- 39.
Love MI, Huber W, Anders S.使用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。基因工程学报,2014;15(12):550。
- 40.
Anders S, Huber W.序列计数数据的差异表达分析。中国生物医学工程学报,2010;11(10):991 - 996。
- 41.
Young MD, Wakefield MJ, Smyth GK, Oshlack A. RNA-seq基因本体分析:考虑选择偏差。中国生物医学工程学报,2010;11(2):914。
- 42.
王志强,王志强。一种加权相关网络分析方法。中国生物医学工程学报,2008;9:559。
- 43.
张波,郝华。加权基因共表达网络分析的一般框架。植物学报,2005;4:第17条。
- 44.
Rinerson CI, Scully ED, Palmer NA, Donze-Reiner T, Rabara RC, Tripathi P,沈春霞,Sattler SE, Rohila JS, Sarath G,等。柳枝稷WRKY转录因子家族与衰老的关系。生物医学工程学报。2015;16:912。
- 45.
Saito R, Smoot ME, Ono K, Ruscheinski J, Wang PL, Lotia S, Pico AR, Bader GD, Ideker T. Cytoscape插件指南。地理学报,2012;9(11):1069-76。
- 46.
Palmer NA, Saathoff AJ, Tobias CM, Twigg P, Xia Y, Vogel KP, Madhavan S, Sattler SE, Sarath G.生长季后期山地和山地柳枝稷多年生结构代谢的对比。科学通报,2014;9(8):e105138。
- 47.
王国良,王国良,马基D, Bonello P.利用Amplex Red测定植物组织中过氧化氢的含量。方法。2016;109:105-13。
- 48.
hengo - moss T, Sarath G, Baxendale F, Novak D, Bose S, Ni X, Quisenberry S.牛草侵毒后氧化酶的变化特征。中国生物医学工程学报,2009;30(3):391 - 391。
- 49.
李建军,李建军,李建军,等。大豆抗感生殖期大豆对大豆蚜虫取食的生理反应。节肢动物与植物学报,2011;5(1):49-58。
- 50.
李建军,李建军,李建军。不同树种木质部木质素化过程中的氧化酶活性:针叶树漆酶的鉴定。植物物理学报,2000;20(15):1039-47。
- 51.
Sterjiades R, Dean JF, Eriksson KE。梧桐槭漆酶聚合单木质素醇。植物生理学报。1992;99(3):1162-8。
- 52.
基思R,米切尔-欧兹T.对食草动物和植物病原体抗性的遗传变异:假设、机制和进化意义。植物病理学杂志,2013;32(2):122 - 122。
- 53.
Singh V, Louis J, Ayre BG, Reese JC, Shah J.海藻糖磷酸合酶11依赖性海藻糖代谢促进拟南芥对韧皮食性昆虫桃蚜的防御。植物学报,2011;37(1):94-104。
- 54.
Navarova H, Bernsdorff F, Doring AC, Zeier J. Pipecolic acid是一种内源的防御扩增和启动介质,是诱导型植物免疫的重要调节因子。植物学报,2012;24(12):5123-41。
- 55.
Escamilla-Trevino L,沈宏,Hernandez T,尹永波,徐勇,Dixon R.柳枝稷早期木质素途径酶及其绿原酸途径。植物化学学报,2014;31(4):565 - 576。
- 56.
J.氨基酸代谢途径对植物免疫调节的新认识。植物学报,2013;36(12):2085-103。
- 57.
李建军,李建军,李建军,等。拟南芥光合组织衰老和寿命的研究进展。植物学报。1993;5(5):553-64。
- 58.
NAC家族转录因子AtNAP在叶片衰老中起重要作用。植物学报,2006;46(4):691 - 691。
- 59.
郭玉峰,甘世生。叶片衰老:信号、执行和调控。中国生物医学工程学报,2005;31(1):391 - 391。
- 60.
王晓明,王晓明。植物叶绿素分解的研究进展。生物化学学报,2011;07(8):977-88。
- 61.
沈启军,沈启军,沈启军。WRKY转录因子。植物科学进展,2010;15(5):247-58。
- 62.
王辉,徐强,孔玉华,陈毅,段建勇,吴慧,陈云峰。拟南芥WRKY45转录因子激活磷酸盐转运蛋白1;1的表达,响应磷酸盐饥饿。植物生理学报,2014;36(4):2023 - 2023。
- 63.
苏涛,徐强,张飞飞,陈毅,李立强,吴文辉,陈云峰。WRKY42通过调节拟南芥中磷酸盐的转运和获取来调节磷酸盐稳态。植物生理学报,2015,32(4):579 - 591。
- 64.
范维克,鲍俊峰,林涛。参与SA生物合成基因激活的WRKY转录因子。植物生理学杂志,2011;11(1):89。
- 65.
张建平,张建平,张建平。拟南芥WRKY33是对灰霉病菌感染的激素和代谢反应的关键转录调节因子。植物生理学报,2012;39(1):366 - 366。
- 66.
陈晓明,王晓明,王晓明,等。植物MYB转录因子在干旱响应中的作用。中华医学杂志,2015;16(7):15811-51。
- 67.
杨建军,杨建军,李建军,等。基于nac - myb基因的植物细胞壁生物合成的转录调控。植物科学,2015;6:288。
- 68.
Braun P, Carvunis AR, Charloteaux B, Dreze M, Ecker JR, Hill DE, Roth FP, Vidal M, Galli M, Balumuri P,等。拟南芥相互作用组图谱中网络进化的证据。科学。2011;333(6042):601 - 7。
- 69.
Marin-de la Rosa N, Sotillo B, Miskolczi P, Gibbs DJ, Vicente J, Carbonero P, Onate-Sanchez L, Holdsworth MJ, Bhalerao R, Alabadi D,等。大规模鉴定的赤霉素相关转录因子将VII组乙烯反应因子定义为功能性DELLA合作伙伴。植物生理学报,2014,36(2):1022 - 1032。
- 70.
Misra P, Pandey A, Tiwari M, Chandrashekar K, Sidhu OP, Asif MH, Chakrabarty D, Singh PK, Trivedi PK, Nath P等。拟南芥转录因子AtMYB12调控烟草转录组和代谢组,导致烟草抗虫。植物生理学报,2010;32(4):2258 - 2168。
- 71.
李建军,李建军。拟南芥与桃蚜的相互作用:对植物防御韧皮部取食蚜虫的认识。植物科学,2013;4:213。
- 72.
王晓东,王晓东,王晓东,等。植物细胞壁上有“耳朵”:CrRLK1Ls在细胞外信号感知和转导中的作用。实验学报,2011;62(5):1581-91。
- 73.
Cook DE, Mesarich CH, Thomma BP。了解植物免疫作为检测入侵的监视系统。植物学报,2015;53(3):541 - 63。
- 74.
博勒T,何赛。植物先天免疫:植物模式识别受体与微生物病原体效应物之间的军备竞赛。科学。2009;324(5928):742 - 4。
- 75.
Sabri A, Vandermoten S, Leroy PD, Haubruge E, Hance T, Thonart P, De Pauw E, Francis F.蚜虫蜜露蛋白质组学研究揭示了蛋白质的多样性。科学通报,2013;8(9):e74656。
- 76.
Bischoff V, Nita S, Neumetzler L, Schindelasch D, Urbain A, Eshed R, Persson S, Delmer D, Scheible WR。TRICHOME双折射及其同源物AT5G01360编码拟南芥纤维素生物合成所需的植物特异性DUF231蛋白。植物生理学报,2010;33(2):559 - 562。
- 77.
Prokhnevsky AI, Peremyslov v, Dolja VV。科学通报,2008;35(5):394 - 394。
- 78.
植物生态学报,2015;28(3):893 - 893。
- 79.
中国科学:自然科学版,2014;31(3):391 - 391。
- 80.
马建平,王晓明,王晓明,王晓明,等。豌豆幼苗叶片氧化应激对水虱侵染的响应。植物化学,2013;93:49 - 62。
- 81.
Ni X, Quisenberry SS, hengmoss T, Markwell J, Sarath G, Klucas R, Baxendale F.抗性和敏感叶片对有症状和无症状谷物蚜虫摄食的氧化反应。中国生物医学工程学报,2009;19(3):444 - 444。
- 82.
Ramm C, Wachholtz M, Amundsen K, Donze T, hengg - moss T, Twigg P, Palmer NA, Sarath G, Baxendale F.水牛草抗性和易感对西布利斯(blisus Occiduus)采食的转录分析。中国生物医学工程学报,2015;38(3):444 - 444。
- 83.
Marchi-Werle L, Heng-Moss TM, Hunt TE, Baldin ELL, Baird LM。大豆蚜虫侵染大豆耐、易感植株过氧化物酶的变化。中国生物医学工程学报,2014;37(5):385 - 391。
- 84.
hengo - moss T, Macedo T, Franzen L, Baxendale F, Higley L, Sarath G.抗感水牛草对褐蝽捕食的生理反应。中国生物医学工程学报,2006;32(1):444 - 444。
- 85.
Miller G, Schlauch K, Tam R, Cortes D, Torres MA, Shulaev V, Dangl JL, Mittler R.植物NADPH氧化酶RBOHD对多种刺激的快速系统信号传导。科学通报,2009;32(4):444 - 444。
- 86.
张建军,张建军,张建军,等。呼吸突发氧化酶的研究进展。植物学报,2011;14(6):691-9。
- 87.
Alscher RG, Erturk N, Heath LS。超氧化物歧化酶(sod)在植物氧化胁迫调控中的作用。[J] .中国生物医学工程学报,2009;32(3):391 - 391。
- 88.
Saathoff AJ, Donze T, Palmer NA, Bradshaw J, hengg - moss T, Twigg P, Tobias CM, Lagrimini M, Sarath G.柳枝稷过氧化物酶在植物生长过程中的作用。植物科学,2013;4:202。
- 89.
李建军,李建军,李建军,等。玉米抗虫性阴离子过氧化物酶的鉴定与特性研究。植物化学,2010;71(11 - 12):1289 - 97。
- 90.
Passardi F, Cosio C, Penel C, Dunand C.过氧化物酶比瑞士军刀有更多的功能。植物学报,2005;24(5):255-65。
- 91.
Berthet S, Thevenin J, Baratiny D, Demont-Caulet N, Debeaujon I, Bidzinski P, Leple JC, Huis R, Hawkins S, Gomez LD,等。植物漆酶在木质素聚合中的作用。木质素。2012;61:145 - 72。
- 92.
李建军,李建军,李建军,等。植物激素介导草食动物与植物病原体之间的相互作用。化学学报,2014;40(7):730-41。
- 93.
李建军,李建军,李建军,等。植物对蚜虫取食反应的激素信号转导。植物物理学报,2011;33(6):2057-73。
- 94.
墙体会。对病原体和昆虫的适应性防御反应。生物医学工程学报,2009;51:551-612。
- 95.
张建军,张建军,张建军,张建军,张建军。亮氨酸氨基肽酶调控茉莉酸下游番茄的防御和损伤信号。植物学报,2009;21(4):1239-51。
- 96.
李建平,李建平,李建平。植物对草食反应的早期信号研究进展。中华医学杂志,2011;12(6):3723-39。
- 97.
Mur LA, Kenton P, Atzorn R, Miersch O, Wasternack C.水杨酸盐和茉莉酸盐信号之间浓度特异性相互作用的结果包括协同作用、拮抗作用和氧化应激导致细胞死亡。植物生理学报,2006;39(1):559 - 561。
- 98.
博世M, Wright LP, Gershenzon J, Wasternack C, Hause B, Schaller A, Stintzi A.茉莉酸及其前体12-氧植物二烯酸对番茄构成型和诱导型草食性防御的影响。植物生理学报,2014,36(1):396-410。
- 99.
郭惠明,孙顺生,张凤飞,苗XX。利用芯片分析鉴定OPR3过表达水稻抗草食性相关基因。植物物理学报,2015;32(2):391 - 391。
- One hundred.
郭惠明,李合和,周绍林,薛华伟,苗XX。顺-12-氧-植物二烯酸刺激水稻防御昆虫的刺吸反应。植物学报,2014;7(11):1683-92。
- 101.
卢杰,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。植物生理学报,2015;37(3):1109 - 1109。
- 102.
Kloth KJ, Wiegers GL, Busscher-Lange J, van Haarst JC, Kruijer W, Bouwmeester HJ, Dicke M, Jongsma MA。AtWRKY22促进对蚜虫的敏感性并调节水杨酸和茉莉酸信号。实验学报,2016;67(11):3383-96。
- 103.
Stewart SA, Hodge S, Bennett M, Mansfield JW, Powell G.植物激素对短叶紫花苜蓿蚜虫的诱导作用取决于侵染后时间、蚜虫密度和植物和昆虫的基因型。节肢动物与植物学报,2016;10(1):41-53。
- 104.
Selig P, Keough S, Nalam VJ, Nachappa P.茉莉酸依赖植物防御介导大豆蓟马和大豆蚜虫对大豆的抗性。节肢动物与植物学报,2016;10(4):273-82。
- 105.
麦VC, Drzewiecka K, Jelen H, Narozna D, Rucinska-Sobkowiak R, Kesy J, Floryszak-Wieczorek J, Gabrys B, Morkunas I.豌豆蚜虫侵染对豌豆防御信号分子的差异诱导。植物科学,2014;22(1):1 - 12。
- 106.
赖氨酸分解代谢、氨基酸转运和全身获得性耐药:两者之间的联系是什么?植物信号学报,2014;9(7):e28933。
- 107.
Klein AT, Yagnik GB, Hohenstein JD, Ji Z, Zi J, Reichert MD, MacIntosh GC, Yang B, Peters RJ, Vela J,等。利用maldi -质谱成像技术研究大豆蚜虫和水稻细菌相互作用中的化学界面。化学学报,2015;37(10):5294-301。
- 108.
张建军,张建军,张建军,张建军。ALD1调节拟南芥的基础免疫成分和早期诱导防御反应。植物学报,2015;28(4):455-66。
- 109.
Camanes G, Scalschi L, Vicedo B, Gonzalez-Bosch C, Garcia-Agustin P.一项非靶向全球代谢组学分析揭示了茄茄基础抗性和启动的生化变化,并鉴定了1-甲基色氨酸是植物对botrytiscineea和丁香假单胞菌的反应的代谢产物。植物学报,2015;31(1):359 - 361。
- 110.
Shah J, Chaturvedi R, Chowdhury Z, Venables B, Petros RA。全身获得性耐药中小代谢物的信号传导。植物学报,2014;39(4):645 - 658。
- 111.
War AR, Paulraj MG, Hussain B, Buhroo AA, Ignacimuthu S, Sharma HC。植物次生代谢物对豆荚螟、棉铃虫的影响。中国有害生物学报,2013;36(3):394 - 398。
- 112.
王文杰。植物葡萄糖信号网络的研究进展。植物学报,2014;37(2):663 - 668。
- 113.
李建军,李建军,李建军,等。糖信号与植物生长发育的关系。实验学报,2014;65(3):799-807。
- 114.
周松,娄云燕,秦伟,詹德。昆虫取食对植物初级代谢的影响。植物生理学报,2015;16(3):388 - 398。
- 115.
Rech GE, Vargas WA, Sukno SA, Thon MR.豆科植物疾病应答基因的正选择鉴定。植物信号学报,2012;7(12):1667-75。
- 116.
Sexton AC, Cozijnsen AJ, Keniry A, Jewell E, Love CG, Batley J, Edwards D, Howlett BJ。植物病原菌菌核病(Sclerotinia sclerotiorum)三个发育阶段多基因转录比较。微生物学通报,2006;32(1):1 - 6。
- 117.
Scheideler M, Schlaich NL, Fellenberg K, Beissbarth T, Hauser NC, Vingron M, Slusarenko AJ, Hoheisel JD。利用cDNA阵列监测拟南芥从内务代谢到病原体防御代谢的转变。生物化学学报,2002;27(12):555 - 561。
- 118.
李建军,李建军,李建军,等。α - dioxygenase - 1基因在番茄和拟南芥中表达的研究进展。植物微生物学报,2013;26(8):977-86。
- 119.
Schmelz EA, Kaplan F, Huffaker A, Dafoe NJ, Vaughan MM, Ni X, Rocca JR, Alborn HT, Teal PE。玉米诱导型二萜抗菌素的鉴定、调控及活性研究。中国科学:自然科学版,2011;38(3):555 - 555。
致谢
我们要感谢Lois Bernhardson、Katherine Keller、Brittney Reinsch和Raihanah Hassim在实验室和温室的帮助,以及UNMC DNA测序核心设施在下一代测序和实时qPCR方面的帮助。美国农业部,农业研究局,是一个机会均等/平权行动雇主,所有机构的服务都是不受歧视的。文中提及的商业产品和组织仅为提供特定信息。这并不构成USDA-ARS对其他未提及的产品和组织的认可。内布拉斯加州大学DNA测序核心得到了NCRR (1S10RR027754-01, 5P20RR016469, RR018788-08)和国家普通医学科学研究所(NIGMS) (8P20GM103427, GM103471-09)的部分支持。本出版物的内容是作者的唯一责任,并不一定代表NIH或NIGMS的官方观点。
资金
这项工作得到了美国农业部-美国国家癌症研究所(USDA-NIFA)资助号2011-67009-30096 (GS/THM/JDB/PT)、2011-67009-30026 (SES)、美国能源部资助号DE-AI02-09ER64829 (GS)和美国农业部- ars CRIS项目5440-21000-030-00D的部分资助。
数据和材料的可用性
本研究中分析的RNA-Seq数据集可在SRA数据库中获得,登录号为SRX1600826,现可在https://www.ncbi.nlm.nih.gov/sra/?term=SPR070829,以及与此手稿相关的其他文件。
作者的贡献
TDR、NAP、EDS、KGK、TJP、TJP、KGK、GS和THM设计研究,TDR、NAP、EDS、PT、TJP、KGK和GS进行实验,TDR、NAP、EDS、KGK、TJP、THM、KA、JDB、PT、SES和GS分析数据,THM、JDB、GS、PT、KA、SES提供资金,TDR、NAP、EDS、KA、SES、GS和THM撰写稿件初稿,所有作者都认真阅读并批准稿件。
相互竞争的利益
作者宣称他们没有竞争利益。
发表同意书
不适用。
伦理批准并同意参与
这些实验符合进行实验的国家的道德标准。本研究中使用的柳枝稷种子来自美国农业部农业部(USDA-ARS)维护的田间植物。由于植物材料不是从野生来源收集的,因此不需要任何许可/许可。
作者信息
从属关系
相应的作者
附加文件
附加文件1:表S1。
RNA Seq图谱统计(XLSX 12kb)
附加文件2:表S2。
用于RNA-Seq验证的基因鉴定和引物(XLSX 11kb)
附加文件3:
数据S1 GO富集结果(XLSX 12kb)
附加文件4:
数据S2图中数据的基因识别和表达谱(XLSX 909 kb)
附加文件5:图S1。
代谢产物水平(a)叶绿素和(b)活性氧(H2O2)和酶活性(c)过氧化物酶和(d)漆酶。数据是每个处理5株植物提取物的三次分析的平均值(对照;蓝色酒吧);(出没;橙色酒吧)。(EPS 389 kb)
附加文件6:图S2。
图3共表达模块的表达谱。8.(EPS 3010kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有说明。
关于本文
引用本文
Donze-Reiner, T., Palmer, n.a., Scully, E.D.et al。陆地四倍体柳枝稷对绿虫防御机制的转录分析。BMC Plant Biol17日,46(2017)。https://doi.org/10.1186/s12870-017-0998-2
收到了:
接受:
发表:
关键字
- 柳枝稷
- 蚜虫
- GB
- ROS
- RNA-Seq
- 代谢物
- 网络
- 植物防御
- Pipecolic酸
- 绿原酸