摘要
背景
本质上,兰花植物完全依赖于共生真菌以萌发和随后的幼苗(Protocorm)阶段进行营养。然而,目前只有有限的用于评估兰花 - 毒蕈级相互作用的定量方法,目前可获得,这极大地限制了我们对共生的理解。在这里,我们旨在改善和整合在陆地兰花的前菌内的生长和真菌定植的定量评估,Blettila striata在培养皿中生长。
结果
我们为陆地兰花达到了共生和炭疽萌发B. Striata..由两个萌发方法产生的质子导味在前三周几乎同步地同时生长。然而,在第四天,共生质子导体的长度显着降低。有趣的是,共生质子膜的干重没有显着改变在生长期内,这意味着只有有限地将碳化合物从真菌转移到这种关系中的质子膜中。接下来,为了评估兰花 - 真菌的相互作用,我们开发了一种墨水染色方法,以观察到质子导体中的悬垂线圈而不准备薄部分。压碎覆盖物下的Protocorm使我们能够在具有高分辨率的质子形成器中观察所有悬垂线圈。对于这种观察,我们建立了一个标准,用于根据显影和劣化来分类悬垂线圈的阶段。通过计算每个阶段内的共生细胞,可以定量评估兰花 - 真菌共生。
结论
我们描述了通过整合植物生长和真菌殖民的测量来定量评估兰花 - 真菌共生的方法。目前的研究表明,虽然在共生的原子形成型中观察到真菌殖民,但原子形成的重量没有显着增加,这可能是由于真菌在这种共生中的不相容性。这些结果表明,在共生中可以差异调节真菌定植和营养转移。本研究开发的评估方法可用于研究兰花 - 真菌共生的各种定量方面。
背景
兰科是最大的植物科,估计有25,000种[1],它形成菌根,在碱霉菌和Ascomycota中具有各种真菌。兰花植物产生少量营养储存的微小种子[2并在幼苗(原球茎)早期依靠共生真菌提供包括碳化合物在内的营养。这种植物依赖共生真菌的营养模式被称为真菌异养[3.].菌根在兰科植物原球茎中的共生关系是这样建立的:菌丝进入薄壁组织细胞,分枝形成密集的菌丝线圈,称为菌丝团,并最终被降解[3.那4.].一般认为,从真菌到原球茎的碳转移主要发生在团簇降解过程中[5.,表明兰花在原球茎阶段寄生了它们的共生真菌。尽管这种寄生是兰花生命策略的基石[6.],与其共生真菌相互作用的机制仍有待阐明。
在先前的共生兰花前导体的研究中,发芽率,发育阶段,大小和体积的质子导量被用作评估标准[7.-16.].此外,还观察到内部剪码线圈来评估兰花 - 菌根真菌的共生潜力[4.那17.-21.].Hadley和Williamson特别评价了在共生关系中peloton的数量和原球茎的体积dactylorhiza purpurella,显示两个参数之间存在正相关关系[22.].虽然在共生兰花前提下观察到剪悬杂线线圈的各个阶段,从开发到降解,但[3.那4.],很少有研究集中在菌丝圈的阶段对原球茎生长的影响。
陆生兰花,白芨striata,在日本是一种常见的花园植物[23.[迅速生长并产生众多种子。这些功能制作B. Striata.一个潜在有用的模式物种兰花-菌根研究。Masuhara和Katsuya [23.菌根真菌的疗效报告了B. Striata.种子萌发和对策生长,并使用种子萌发率和质子传染长度评估共生。这些作者还基于对质子中的悬垂线圈的观察来评估共生。然而,我们需要更详细的定量证据进行共生的影响,特别是关于共生细胞内部发生的内容,了解兰花 - 真菌相互作用的机制。
在这项研究中,我们发展了一种方法来定量的原球茎生长和真菌定殖B. Striata.-fungus synbiosis。首先,我们实现了明显的同步萌发,没有共生的真菌B. Striata.比较真菌依赖和依赖的生长。对于对质子生长分析,我们测量干重以及长度。此外,我们开发了一种评估共生细胞数量的染色程序,并定量评估螺丝卷线圈的显影和降解。我们的方法使我们能够观察所有悬垂线圈的细节。通过整合测量,我们可以详细评估共生的影响。最后,我们讨论了旨在了解旨在了解这一共同体中的机制的未来研究的前景。
方法
植物材料与共生真菌的分离
种子B. Striata.在这项研究中使用了从花园店购买的植物自我授粉后五个月收集了“Murasakishikibu”。的B. Striata.菌株'穆拉斯卡希基武'最初被选为日本宫崎县的栖息地的特定花色变种,并通过园丁维持了20多年。
共生真菌是从黄芩根中分离得到的Pecteilis radiata.(研究)。英国皇家空军。2003年8月3日,在日本兵库县姬路的私人土地上,得到土地所有人的许可,获得了土地使用权。这种兰花的栖息地是一片粗糙的湿地,直到10年前,这里一直是稻田。采用Warcup和Talbot方法分离出该兰花的真菌[24.],稍作修改如下。用自来水冲洗根部表面,用70%乙醇浸泡30 s,用含1%有效氯的次氯酸钠溶液浸泡30 s消毒。表面消毒的根被切成大约10毫米长的小块。用1ml无菌蒸馏水将碎片放入直径9cm的培养皿中,用无菌玻璃棒将其粉碎以分散胞内菌丝盘(peloton)。蒸压改性Czapek Dox琼脂(0.5 g蔗糖,0.33 g纳米3., 0.2 g KH2阿宝4.,0.1 g mgso4. · 7H2O, 0.1 g KCl, 0.1 g酵母提取物,15 g琼脂,1 l蒸馏水)冷却至45℃,倒入培养皿(每培养皿约20 ml)。盘片在凝固之前要充分混合,以使球团分散在整个介质中。平板在25.0±0.5°C黑暗中培养3 d。使用消毒的手术刀分离菌落,并在马铃薯葡萄糖琼脂(PDA, Difco, Franklin, New Jersey, USA)培养基上培养。本研究利用其中一株真菌HR1-1进行共生萌发。
系统发育分析
根据制造商的说明,使用Prepman Ultra Rement(Applied Biosystems,California,USA)从分离的真菌中提取DNA。通过PCR从提取的DNA中通过PCR扩增其RDNA的其1-OF / ITS4-of [25.使用TaKaRa Ex Taq热启动版本(TaKaRa Bio, Otsu, Japan)。该PCR混合物包含5 μl模板DNA、0.75单位Taq聚合酶、0.25 μmol/l引物、200 μmol/l dNTP和3 μl提供的PCR缓冲液,总体积为30 μl。ITS区域的扩增在PC-818S程序温度控制系统(Astec,福冈,日本)上进行,如下:初始变性在94°C 2分钟后跟35周期94°C的20年代,55°C 30年代,72°C, 1分钟和最后一个伸长步骤在72°C 5分钟。PCR克隆使用pGEM-T简单向量系统产品(Promega、东京、日本),和提取质粒dna的克隆产品使用MagExtractor质粒(TOYOBO)。用测序引物T7和SP6,用染料终止法对质粒插入物进行测序。所有序列均进行BLAST搜索[26.],相关序列从DDBJ/EMBL/GenBank核苷酸序列数据库下载。使用CLUSTAL W程序进行序列比对[27.].用于系统发育分析,邻近分析[28.]使用MEGA版本5执行[29.]引导分析1000复制[30.].进化距离是用γ分布速率估计的。系统发育树用TreeView软件绘制[31.].
共生和共生萌发
用含0.05% Tween 80的1%有效氯浓度的次氯酸钠对种子进行表面消毒2 min,然后用无菌水冲洗。将大约50个无菌种子放入含有燕麦琼脂培养基(燕麦琼脂2.5 g、5.0 g或10.0 g [Difco, Franklin, New Jersey, USA]) 20 ml原始(1×)、2倍(2×)或4倍(4×)强度(燕麦琼脂2.5 g、5.0 g或10.0 g)、6.5 g琼脂、1 l蒸馏水、pH值5.5)与共生真菌precultured在1×燕麦琼脂培养基一周25°C共生萌发或20毫升Hyponex琼脂培养基(3.0 g Hyponex [6.5 6-19] [Hyponex日本,日本大阪],2.0 g蛋白胨,30 g蔗糖琼脂10克、1 l蒸馏水,pH值5.5)asymbiotic发芽。种子萌发试验在25℃黑暗环境下进行,每7天随机采集几株原球茎,连续4周。在每个原球茎采集时,用SZX16立体显微镜(奥林巴斯,东京,日本)拍摄原球茎的图像。
Protocorm生长测量
采集的原球茎的长度和宽度用Image J 1.47版本(http://imagej.nih.gov/ij.),如附加档案所示1:(1)从原球茎基部端到顶端绘制一条直线(折线),测量长度(L);(2)膨大胚的两端绘制一条直线(实线);(3)在最肿处与实线垂直画一条直线(虚线)测量宽度(W)。每个采样时间点测量3个原球茎,每个实验重复5次。
用蒸馏水冲洗原球茎后,将10个原球茎放入单个培养皿中∅5 × 19 mm锡胶囊(Ludi Swiss AG, Switzerland), 60℃干燥1周。然后用微天平测量干重(梅特勒托莱多,哥伦布,OH)。为测定干重,进行了三个独立的发芽试验。
种子萌发的定量评估
在SZX16立体显微镜(日本东京奥林巴斯)计算燕麦琼脂培养基或脓性琼脂培养基上的发芽种子的数量。对于每个萌发方法,观察到至少50种种子,其中发芽被定义为根茎或芽的出现。对萌发率的测量进行三个独立的萌发实验。
原球茎菌丝圈的墨水染色
将萌发的共生原球茎置于4℃的FAA溶液中,用于后续真菌定植的定量评价。faa固定的原球茎用蒸馏水通过40 μm的细胞过滤器(Corning, NY, USA)冲洗,并在121℃下在10% (w/v) KOH溶液中蒸压20分钟。热压处理过的原球茎是盐酸中和在2% (v / v)为5分钟,转移到10% (v / v)墨水染料溶液(10% Pelikan 4001的黑色和3%醋酸),在95°C加热30分钟,浸泡在100%乳酸(Nakarai tesque Inc .,京都,日本)在4°C显微观察。
真菌定植的定量评价
染色原球茎按附加文件处理2.在SZX16立体显微镜(Olympus,Tokyo,Japan)下使用疏松针头除去染色的质子染色的测试,并将质子传递到载玻片。通过覆盖玻璃覆盖,并使用解剖针刺的盖子压碎并压碎。在每个取样时间的BX53光学显微镜(Olympus,Tokyo,Japan)下计数共生细胞的数量。对这种定量评估进行了三个独立发芽实验。
在燕麦琼脂培养基上染色菌丝
在室温下在乳酸的0.05%台盼蓝的溶液中染色燕麦琼脂培养基上的共生真菌的菌丝2小时。用蒸馏水洗涤菌丝三次。在SZX16立体显微镜(日本东京奥林巴斯)下观察到染色的菌丝。为每种菌液(1×,2×和4×)制备五个复制板。
结果和讨论
共生和浅谈的萌发B. Striata.
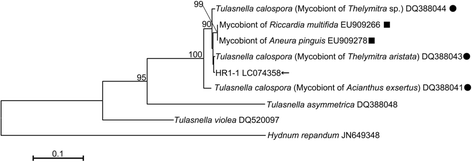
Masuhara等。[32.从根的孤立的菌根真菌B. Striata.,大多数真菌被鉴定为丝核菌被.该真菌是陆生兰科植物中具有代表性的菌根真菌之一,部分真菌是从陆生兰科植物中分离得到的Goodyera schlechtendaliana那Spiranthes sinensis那石斛兰高贵的那Ponerorchis kurokamiana, 和p . graminifolia诱发共生萌发B. Striata.在体外条件下[23.].尽管我们之前试图分离菌根真菌B. Striata.根不成功,我们实现了共生萌发B. Striata.其中一个真菌分离株,HR1-1,从Pecteilis radiata..这种真菌被鉴定为Tulasnella.sp。(Tulasnellaceae)如下所述,众所周知的是丝核菌被是Tulasnella.sp。33.].因此,我们选择使用这种真菌作为本研究中的共生真菌。
HR1-1菌株显示出最高的身份Tulasnella calosporaDQ388043,兰花的一种真菌Acianthus Exsertus.(无花果。1).在共生萌发实验中,根茎形成,种子萌发中的第一分化步骤B. Striata.,在一星期内播种的兰种中,有44.9%的种子被检出,这一比率较以往进行的共生萌发试验中陆地兰种的比率高及快[12.那34.那35.)(见附加文件3.).该结果表明,我们的共生萌发方法是适当的B. Striata..此外,我们使用富含营养素的培养基进行脱乳糖琼脂培养基进行了脱柴萌发,以评估发芽原子形成型的生长潜力。在一周内以58.1%的种子在58.1%的种子中观察到根茎。因此,我们可以通过直接比较共生与浅褐色素的初始生长率来评估共生的影响。
定量评估初始生长B. Striata.Protocorms.
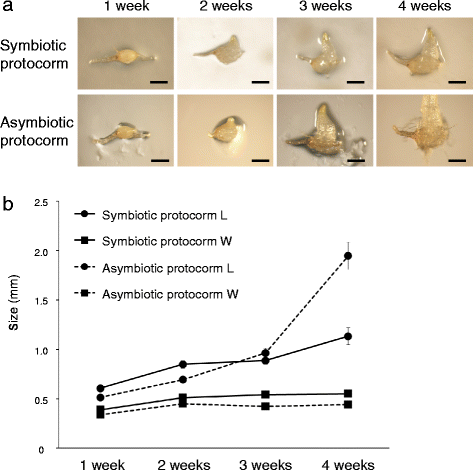
共生原球茎和非共生原球茎在前三周同步生长,随后非共生原球茎比共生原球茎生长活跃(图2)。2A).为了量化原球茎的大小,我们首先尝试测量原球茎的长度和宽度dactylorhiza purpurella哈德利和威廉姆森[22.].但是,这种方法不合适B. Striata.因为Protocorv形态与那方不同d . purpurella.宽度B. Striata.原球茎在生长过程中没有增加很多(图。2B.).因此,我们寻求建立一种更适当的方法来衡量B. Striata.原球茎。我们将原球茎的长度定义为基部和顶端之间的线性距离(见附加文件)1),因为膨大胚胎垂直于椭圆形长轴向外延伸。在前3周,共生和非共生萌发条件下,原球茎长度基本相同。2B.).然而,四周后,炭疽脱节的长度明显大于共生质子膜的长度。因此,我们使用蛋白质长度作为初始生长的评估指标B. Striata..
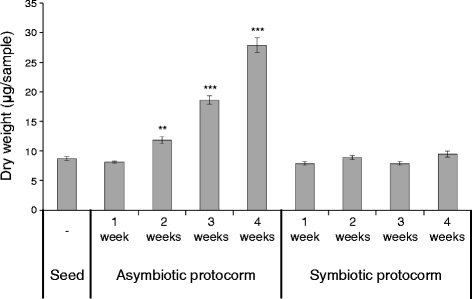
另一种生长评价方法是测定原球茎的干重。非共生原球茎的干重随时间的增加而急剧增加,从1周的8.1 μg增加到4周的27.9 μg(图1)。3.).然而,令人意外的是,共生原球茎的干重在(至少)前4周没有显著变化(图4)。3.).干重增加的肿胀的共生质子可能表明在共生中增强了水摄取。这种结果与先前发现的共生发芽的原子体的干重不一致d . purpurella患有菌根真菌丝核菌在生长四周内,spp约为未接种对照的两倍[17.].为了进一步探索这一点,我们测试了共生质子膜的重量增加是否可以是由于目前研究中使用的燕麦琼脂培养基中的有机碳源的耗尽。我们使用2×和4×燕麦琼脂使用相同的程序调查了共生萌发。在培养基上具有较高浓度的燕麦片(参见附加文件4.a),其中共生真菌菌丝密度也较大(见附加文件)5.).出乎意料的是,干重量B. Striata.1×、2×和4×燕麦培养基间原球茎无显著差异(见附加文件)4.b).同时,已有研究表明原球茎重量与原球茎长度呈正相关[34.].本研究结果表明,燕麦琼脂培养基中的碳源对原球茎重量没有显著影响,但碳源的数量与原球茎长度呈正相关,说明菌株HR1-1向原球茎的碳化合物转移有限B. Striata.在培养基上的共生关系中的质子。这些结果表明,干重也是评估共生质子膜的生长的重要评价指标。
分析中的定量评价B. Striata.Protocorms.
许多研究使用发芽率作为共生效率的指标来描述陆生兰花种子与其伴生真菌的体外共生发芽[7.-9.那12.-16.].与以前的研究一样,我们最初试图使用根茎生产作为测量共生萌发中萌发率的标准B. Striata.种子(图。4).然而,传统的发芽标准不适用B. Striata.,因为种子在燕麦琼脂培养基上有或无真菌菌丝时形成根茎。为了解决这一问题,我们引入了另一个标准,即茎尖(原分生茎)的出现作为指示B. Striata.种子萌发(图。4 b).使用该标准,具有共生真菌的萌发率显着高于燕麦琼脂培养基上所有时间点的没有真菌的萌发率(图。4摄氏度).这一结果表明,在存在与共生真菌的缺失存在中显示出最明显的萌发差异的一个至三周的常量,非常适合研究共生真菌和患有共生真菌的共生协会的生理方面B. Striata..然而,即使没有共生的真菌,最多40.7%的种子也在燕麦片琼脂培养基上射击,表明只有一个参数,例如种子萌发率,似乎不足以评估这种共生。
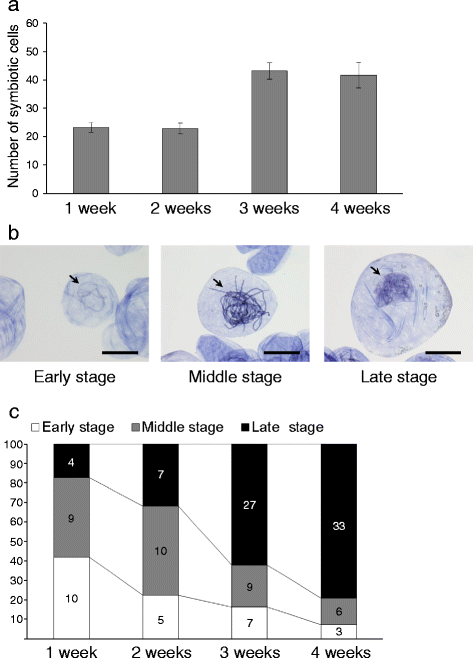
为了表征兰花前置的共生,许多研究使用树脂嵌入方法使用内部菌丝的观察[17.那18.那20.那23.或台盼蓝染法[19.那21.那35.].使用改进的墨水染色技术和压碎质子染色体使我们能够清楚地易于在共生的前菌体中的真菌菌丝可视化,并通过光学显微镜计算含有pelotons的共生细胞总数(参见附加文件2).图2中示出了每种质子传染变性的平均共生细胞总数。5.与菌丝圈共生的细胞在第一周就已经存在。第三周的共生细胞数量大约是第二周的两倍。因此,我们的观察方法可用于定量共生细胞B. Striata.具有高分辨率和高精度的原球茎。
此外,分析亚腿线圈的发育阶段与萌发或初始生长之间的相关性B. Striata.,根据真菌形态特征,我们将悬垂线圈分为三个阶段(图。5 b):早期,以真菌入侵和菌丝盘绕开始为特征;中期,菌丝圈发育良好,真菌细胞壁清晰;晚期,其特征是菌丝线圈的降解导致真菌隔膜破裂。我们测定了每个原球茎各阶段菌丝圈的比例。在第1周和第2周,早期和中期菌丝圈的比例分别为82.7和68.1%(图2)。5度).相比之下,晚期亚腿线圈的比例在第三周(62.2%)和4周(79.2%;图。5度).这些结果表明,在术前期或中间阶段诱导萌发刺激前诱导在脑振荡劣化之前。这些发现与有关共生之间的调查结果一致d . purpurella和Ceratobasidium.S,其中生长刺激可能与碳水化合物的外部供应无关[22.].
为了测试我们的观察方法对其他物种的适用性,p .放射虫纲用相同的共生萌发方法将菌株HR1-1接种种子。在本实验中,19.1%的种子有根状体存在,共生细胞的三个阶段也很容易被观察到B. Striata.两周后(见附加文件)6.).因此,我们的染色和定量方法适用于其他物种B. Striata..
如上所述,生长在2×和4×燕麦片上的原球茎中共生细胞的数量在四周生长期间持续增加,并呈浓度依赖性增加(见附加文件)7.).然而,共生原球茎的干重与共生细胞的数量和/或降解菌丝圈细胞的增加无关(见附加文件)7.).最近,Kuga等人[4.]报道碳主要从降解菌丝圈转移到兰花原球茎;然而,在我们的实验条件下,菌丝圈的发育和降解似乎不影响原球茎的生长。这种对原球茎生长的影响的缺乏表明在这种共生关系中养分转移不能有效地进行。
结论
在这项研究中,我们通过测量了对蛋白质的长度和重量和不同阶段的共生细胞的数量来确定了对兰花共生的定量评估的方法。这种方法可用于研究兰花 - 真菌相互作用的生理方面,例如兼容性,兰花共生中的主要问题之一。事实上,我们能够证明兰花B. Striata.与…形成共生关系Tulasnella.sp。菌株HR1-1,但即使在对策中发现更多的共生细胞,共生质子导体的重量也没有显着变化。这些结果表明,从HR1-1到的碳化合物几乎没有净转移B. Striata.原球茎,这可能是由于在这种共生关系中兰花和真菌之间的不兼容性。在我们的墨水染色技术观察到的菌丝线圈的发育和降解方面,我们没有观察到真菌定植特征的异常。综上所述,我们的结果表明,真菌定植和真菌向兰花的营养转移可能在兰花共生过程中受到不同的调节。需要进一步的研究来量化B. Striata.生长和共生与其本土共生伴侣,并在该共生期间评估碳转移。
随着修饰很少,该研究的方法将广泛适用于其他兰花种类。除了在体外萌发研究之外,目前的方法还可以适用于用于STÖCKEL等人的实地研究。[36.],他在植物碳和氮稳定同位素组合物中检查,兰花的幼苗和成人中的组合物,以评估生长反应。这些研究将有助于提高我们对兰花 - 真菌共生的机制的理解。兰花和菌根真菌之间的特异性是长期争议的主题[37.].绿色陆地兰花可能在发芽阶段表现出低真菌特异性[38.那39.].相比之下,WARCUP和其他研究人员报道,至少存在共生真菌的血液水平特异性可能存在[7.那40那41.].我们用于分析真菌殖民化的定量方法可用于帮助解决各种兰花的这些矛盾的视图,以准确的数据。
缩写
- FAA:
-
福尔马林 - 乙酸 - 酒精
- 它的:
-
内部转录间隔区
- rDNA:
-
核糖体DNA
参考文献
- 1。
阿特伍德JT。兰科植物的大小及附生兰科植物的系统分布。Selbayana。1986;9:171 - 86。
- 2。
Arditti J,Ghani Aka。丹利审查110号:兰花种子的数值和物理性质及其生物学意义。新植物。2000; 145:367-421。
- 3.
真菌异养(腐生)植物的生物学。新植醇。1994;127:171 - 216。
- 4.
Kuga Y, Sakamoto N, Yurimoto H.稳定同位素细胞成像显示,活的和退化的真菌群都将碳和氮转移到兰花原球茎中。新植醇。2014;202:594 - 605。
- 5.
Smith SE, Read DJ。菌根共生关系。剑桥:学术;2008.
- 6.
拉斯穆森HN,拉斯穆森FN。兰花菌根:真菌生活方式的影响。Oikos。2009;118:334-45。
- 7.
warcup jh。一些澳大利亚陆地兰花的共生萌发。新植物。1973; 72:387-92。
- 8。
Zettler LW, Hofer CJ。小棒齿兰的繁殖(platanthera clavellata.)通过共生种子萌发及其生态影响。Environ Exp Bot。1998年; 39:189-95。
- 9。
Zettler JW, Sunley JA, Delaney TW。衰落中的兰花的共生种子萌发(Platanthera Integra.)来自北卡罗来纳州的绿色沼泽。Castanea。2000; 65:207-12。
- 10.
McKendrick SL, Leake JR, Read DJ。真菌异养植物在自然界的共生萌发和发育:外生菌根的碳转移柳树被和Betula Pendula到兰花Corallorhiza Trifida.通过共享的剪字连接。新植物。2000; 145:539-48。
- 11.
McKendrick SL,Leake JR,Taylor DL,阅读DJ。共生萌发和山茱萸的发育Neottia病灶-avis的性质及其对局部分布的需求Sebacina叶绿醇新植物。2002;154:233-47。
- 12.
Stewart sl,zettler lw。三个半水生醋兰的共生萌发(Habenaria repens.那H. Quinquiseta.那H.宏观发生炎)从佛罗里达。Aquat机器人。2002;72:25-35。
- 13。
斯图尔特SL,凯恩ME。共生种子萌发Habenaria macroceratitis(兰科),一种罕见的佛罗里达陆生兰花,植物细胞。组织器官邪教2006;86:159-67。
- 14。
斯图尔特SL,凯恩ME。共生种子萌发和体外真菌生物特异性的证据Spiranthes brevilabris(兰科植物)及其在物种保护中的意义。体外细胞发育生物学杂志。2007;43:178-86。
- 15.
约翰逊Tr,Stewart Sl,Dutra D,Kane Me,Richardson L.浅族和共生种子萌发Eulophia阿尔塔(兰科) - 共生文化优势的初步证据。植物细胞组织器官邪教。2007; 90:313-23。
- 16.
Bustam BM,Dixon Kw,Bunn E.温带澳大利亚陆地兰花的体外传播:与共生萌发相比,重新讨厌炭疽病。Bot J Linn Soc。2014; 176:556-66。
- 17.
关键词:兰科植物,菌根感染,微生物学,微生物学新植醇。1981;87:527-35。
- 18.
关键词:氮素,氮浓度,交互作用dactylorhiza incarnata.(L.)SOO和丝核菌新植物学报1991;117:665-72。
- 19。
Shimura H,Matsuura M,Takada N,Koda Y.涉及共生萌发的抗真菌化合物Cypripedium macranthos.var. rebunense(兰科)。植物化学。2007;68:1442-7。
- 20.
谭学明,王春林,陈学明,周玉青,王玉青,罗爱森,等。一种濒危附生兰花的种子萌发和幼苗生长,Dendrobium Officinale.,利用菌根真菌流行(Tulasnella.sp)。Sci Hortic。2014;165:62-8。
- 21.
Sathiyadash K, Muthukumar T, Murugan SB, Sathishkumar R, Pandey RR。南印度特有兰花Coelogyne nervosa种子的体外共生萌发。Mycoscience。2014;55:183-9。
- 22.
兰科菌根感染后的生长刺激分析。新植醇。1971;70:445-55。
- 23。
Masuhara G,Katsuya K.菌根真菌对三种日本陆地兰花的种子萌发和早期生长的影响。SCI Hortic。1989; 37:331-7。
- 24。
Warcup JH, Talbot PHB。一些与兰花有关的根核体的完美状态。新植醇。1967;66:631-41。
- 25。
担子菌属兰花菌根的内部转录间隔引物和序列。新植醇。2008;177:1020-33。
- 26。
张建军,张志强,张志强,等。gap BLAST和PSI-BLAST:新一代蛋白质数据库搜索程序。核酸Res. 1997; 25:3389-402。
- 27.
Thompson JD,Higgins DG,Gibson TJ,Clustal W.通过序列称量,位置特定的间隙惩罚和重量矩阵选择来提高逐行多序列对准的敏感性。核酸RES。1994年; 22:5673-4680。
- 28.
Saitou N,Nei M.邻居加入方法:一种重建系统发育树的新方法。mol Biol Evol。1987; 4:406-25。
- 29.
田ura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:利用最大似然、进化距离和最大简约法的分子进化遗传学分析。生物化学学报2011;28:2731-9。
- 30.
Felsenstein J. phylogenies上的置信限制:使用自举的方法。进化。1985; 39:783-91。
- 31。
Page rdm。TreeView:在个人计算机上显示系统发育树的应用。计算Appl Biosci。1996年; 12:357-8。
- 32.
Masuhara G,Kimura S,Katsuya K.麦克里希奇的季节变化白芨striata(兰科)。日本天皇会刊1988;29:25-31。
- 33.
Uetake Y,Ogoshi A,Hayakawa S.观察Rhizoctonias的极象(Thantatephorus Orchidicola.和Tulasnella deliquescens)从兰花中分离出来。北海道大学收藏学术刊物1999;22:121-5。
- 34.
纤维素作为兰花菌根的碳源。新植醇。1969;68:933-9。
- 35。
Pereira MC,Rocha di,Veloso Tgr,Pereira Ol,Francino DMT,Meira RMSA,Kasuya MCM。种子萌发的特征及促进萌发Cyrtopodium glutiniferum(兰科)由菌根真菌促进EpulorhizaSPP。Acta Bot Bras。2015; 29:567-74。
- 36。
Stöckel M, Těšitelová T, Jersáková J, Bidartondo MI, Gebauer G.兰花幼苗在自然界生长过程中碳氮积累。新植醇。2014;202:606-15。
- 37。
Masuhara G, Katsuya K。原位和体外特异性之间丝核菌SPP。和Spiranthes sinensis(Persoon)艾姆斯,var。amoena(M. Bieberstein)Hara(兰科)。新植物。1994年; 127:711-8。
- 38。
兰科菌根共生感染的非特异性。新植醇。1970;69:1015-23。
- 39.
植物的菌根相容性与共生繁殖Gavilea australis.是一种来自南巴塔哥尼亚的濒危陆生兰花。菌根。2014;24:627-34。
- 40。
warcup jh。一些澳大利亚陆地兰花的菌根协会的特异性。新植物。1971; 70:41-6。
- 41。
关键词:植物共生Rhizoctonia solani.和双核丝核菌的种子spiranthes sinenses.var。Amoena(orchidaceae)体外。Mycol Res。1993年; 97:746-52。
致谢
我们感谢Kenji Suetsugu博士提供Pecteilis radiata.种子。
资金
这项工作得到了教育,文化,科学技术部(MEXT)的创新领域“遗传基础”的创新区域“遗传基础”(复杂适应性特质的演变)的助学者(MEXT Kakenhi Grant编号25128710)是对促进科学促进(JSPS)(JSPS Kakenhi Grant Number 15 K14550)的挑战探索性研究的授权辅助,促进环境学术研究的鸟瞰县研究基金。
数据和材料的可用性
本研究中所分析的数据集可由通讯作者根据合理要求提供。
作者的贡献
MY和HK设计和构思实验,T Yamamoto, CM, MF, SN, YO和T Yagame进行实验,T Yamamoto, CM, T Yagame, MY和HK分析和解释数据,T Yamamoto, CM, T Yagame, MY和HK撰写手稿。所有作者阅读并批准了最终的手稿。
利益争夺
两位作者宣称他们没有相互竞争的利益。
同意出版物
不适用。
伦理批准和同意参与
Pecteilis radiata.用于分离共生真菌,在私人土地上收集所有者的许可。
作者信息
从属关系
相应的作者
附加文件
额外的文件1:
共生和非共生原球茎长度和宽度的测定方法。虚线表示原球茎的长度(L)。实线通过膨胀的胚的两端绘制。虚线显示原球茎宽度(W),垂直于实线在最膨胀的部位。(PDF 62 kb)
附加文件2:
样品制备用于质子形成中的共生细胞的定量评价。(a)含有油墨溶液的染色质子液。(b)除去睾丸的质子染色体。(c)将压力施加到拆卸促粒细胞进入单层。(d)拆卸质子的细胞。比例尺,500 μm。(PDF 530 KB)
附加文件3:
几种兰花的发芽率。(PDF 58 kb)
额外的文件4:
高浓度燕麦片条件下共生原球茎的长度和干重。(a) 2×-和4×-strength燕麦片播后4周的共生原球茎长度。(b) 2×-和4×-strength燕麦条件下,播后4周的共生原球茎干重。(a)和(b)的误差条分别表示5次生物重复和3次生物重复中平均值的标准误差。(PDF 124 kb)
附加文件5:
燕麦琼脂培养基上真菌菌丝的生长。在(a) 1×-、(b) 2×-、(c) 4×-燕麦片培养基上,用0.05%台虫蓝溶液染色。比例尺,500 μm。这个实验重复了五次,得到了相似的结果。(PDF 977 kb)
额外的文件6:
共生细胞的定量评估Pecteilis radiata.原球茎。(a)有菌丝圈的共生细胞p .放射虫纲原球茎。比例尺,50 μm。(b)共生原球茎各阶段共生细胞数的比例。每个值代表10个原球茎中共生细胞的平均数量。实验重复了六次,得到了相似的结果。(PDF 959 kb)
额外的文件7:
高浓度燕麦片条件下原球茎共生细胞的定量评价。(a)播种后4周,在2×-和4×-strength燕麦条件下,每个原球茎的共生细胞数。(b) 2×-和4×-strength燕麦片条件下共生原球茎各阶段共生细胞数的比例。误差棒表示10个原球茎中平均值的标准误差。实验重复了三次,得到了相似的结果。(PDF 140 kb)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Yamamoto,T.,Miura,C.,Fuji,M。et al。对质子血管生长和真菌定植的定量评价白芨striata(兰科西)揭示了具有非原生共生真菌的较少生产的共生。BMC植物杂志17,50(2017)。https://doi.org/10.1186/s12870-017-1002-x
收到了:
公认:
发表:
关键字
- 白芨striata
- 发芽
- 菌根共生
- 兰花
- 定量评估