- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
代谢组学分析揭示了黄酮类化合物在光敏茶叶中的代谢和功能作用gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba17gydF4y2Ba,文章号:gydF4y2Ba64gydF4y2Ba(gydF4y2Ba2017gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
作为茶树主要的次生代谢途径,类黄酮的生物合成随着温度和光照的增加而增加。而在光照条件下,多数类黄酮在光敏茶叶中的浓度会大大降低,从而进一步提高茶叶品质。为了揭示茶叶中黄酮类化合物的代谢和潜在功能,一种天然光敏茶突变体(gydF4y2BaHuangjinyagydF4y2Ba)在不同光照条件下进行代谢组学分析。gydF4y2Ba
结果gydF4y2Ba
结果表明,褪绿茶叶中积累了大量具有邻二羟基b环的类黄酮(如儿茶素没食子酸酯、槲皮素及其苷等),而总黄酮(如杨梅苷苷、表没食子儿茶素没食子酸酯等)则大量减少,说明不同代谢分支产生的类黄酮成分在茶叶中的作用不同。此外,黄酮类化合物在细胞内的定位和次生代谢通路相关基因的表达模式表明,二羟基黄酮类化合物在光敏茶叶中具有潜在的光保护功能。gydF4y2Ba
结论gydF4y2Ba
我们的研究结果表明,黄酮类化合物清除活性氧(ROS)和抗氧化作用有助于黄酮类化合物在强光胁迫下存活,为阐明黄酮类化合物在茶树中积累到较高水平的功能作用提供了新的证据。此外,具有邻二羟基b环的黄酮类化合物对茶树的光保护作用更大,以促进茶树的驯化。gydF4y2Ba
背景gydF4y2Ba
类黄酮是植物中主要的次生代谢产物,是最重要的品质相关化合物,占茶树幼芽干物质的20-40% [gydF4y2Ba1gydF4y2Ba].这些类黄酮化合物也有助于冲泡茶的颜色、味道和香气。儿茶素(黄烷-3-醇)、黄酮醇、黄酮醇苷、花青素和白花青素的含量占茶树总黄酮的大部分。黄酮类化合物的基本分子结构/碳骨架为C6-C3-C6,根据其羟基化的b环可分为单羟基化、二羟基化和三羟基化。类黄酮的合成和积累是对环境线索的反应[gydF4y2Ba2gydF4y2Ba].大量研究表明,在高光强下,黄酮类化合物的生物合成(结构基因的表达、一些重要酶的活性和黄酮类化合物的浓度)会增加[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].然而,茶树中的黄酮类化合物亚群会受到不同程度的影响[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].黄酮类化合物应对光胁迫的基本作用可能取决于它们的许多潜在功能[gydF4y2Ba6gydF4y2Ba].gydF4y2Ba
类黄酮代谢途径参与植物对各种应激条件的调节机制已被广泛接受[gydF4y2Ba7gydF4y2Ba].类黄酮是植物生长和防御的主要调节剂,是长期自然选择和驯化过程诱导和生物合成的结果[gydF4y2Ba8gydF4y2Ba- - - - - -gydF4y2Ba12gydF4y2Ba].茶树黄酮类化合物的主要生理功能是清除活性氧和增强对环境变化的耐受性,如作为光保护中的抗氧化剂。黄酮类化合物的抗氧化活性是由于它们作为氢供体与自由基反应。但不同分子结构的黄酮类化合物抗氧化活性差异较大,其抗氧化活性与取代基位置和b环上羟基的数量高度相关。黄酮醇的羟基化程度越高,为结合自由基提供的氢原子越多,抗氧化活性越强;如杨梅素的抗氧化活性高于山奈酚。此外,对映二羟基b环类黄酮的互变异构互转换使它们更有效地消耗多余的能量[gydF4y2Ba13gydF4y2Ba]和清除活性氧[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].gydF4y2Ba
茶树gydF4y2Ba(l)O.昆策gydF4y2BaHuangjinyagydF4y2Ba是一种天然的光敏茶突变体,其游离氨基酸含量高,多酚含量低,可提高冲泡绿茶的品质,使含氯气品种比非含氯气品种具有更高的经济价值[gydF4y2Ba16gydF4y2Ba- - - - - -gydF4y2Ba19gydF4y2Ba].嫩叶gydF4y2BaHuangjinyagydF4y2Ba在强光条件下显示黄色,尽管褪绿,但仍显示正常生长[gydF4y2Ba20.gydF4y2Ba].此外,gydF4y2BaHuangjinyagydF4y2Ba与普通茶叶相比,它对光线的代谢反应完全不同。例如,作为茶树次生代谢的主要类型,黄酮类化合物的生物合成随着温度和光照的增加而增加[gydF4y2Ba5gydF4y2Ba].然而,大多数类黄酮的浓度大大降低gydF4y2BaHuangjinyagydF4y2Ba叶子暴露在阳光下。特定基因和化学物质的特征,如总多酚,总氨基酸和色素的生物合成gydF4y2BaHuangjinyagydF4y2Ba已在先前的研究中报道[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].虽然目前对该突变体中黄酮类化合物代谢调控的研究较少,但这一分析可能有助于阐明黄酮类化合物在茶树中大量积累的机制。gydF4y2Ba
光是最重要的环境因素之一,为植物的生长发育提供能量和外部刺激[gydF4y2Ba21gydF4y2Ba].光强的变化改变了叶绿体内一系列复杂的分子事件[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].然而,超出反应中心可接受范围的光能引起光损伤,导致光抑制,降低光化学和碳同化速率[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].因此,光保护,无论是通过清除有害的反应中间体,还是通过消耗多余的能量来保护细胞免于在光胁迫下死亡,都是光合作用所必需的[gydF4y2Ba25gydF4y2Ba].叶绿体定位黄酮类化合物[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba26gydF4y2Ba]、苯丙醇[gydF4y2Ba27gydF4y2Ba]和花青素[gydF4y2Ba28gydF4y2Ba]是有效的阳光衰减剂,在面对过多的辐射能时对保护叶绿体起着至关重要的作用。黄酮类化合物对过量紫外线辐射b (UV-B)/阳光照射的关键抗氧化功能已被充分证明[gydF4y2Ba29gydF4y2Ba- - - - - -gydF4y2Ba31gydF4y2Ba].与具有单羟基取代的黄酮相比,在b环上具有邻二羟基结构的黄酮优先积累,这一事实进一步证实了这些研究[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba].类胡萝卜素或叶黄素循环也通过散热来保护植物免受高光强度的影响[gydF4y2Ba34gydF4y2Ba].此外,当类胡萝卜素生物合成途径中断时,生物体会出现褪绿现象[gydF4y2Ba25gydF4y2Ba]或被诺氟拉松抑制[gydF4y2Ba35gydF4y2Ba].gydF4y2Ba
在此,本研究的假设是,在光敏茶叶中,黄酮类化合物的代谢,特别是“不同分支”的代谢可能受到遗传和环境刺激的调控,并且这与茶叶中黄酮类化合物的潜在功能高度相关。因此,设计了一个实验,用代谢组学分析比较了在两种不同光照条件下培养的一个光敏突变体的茶叶样本。gydF4y2Ba
方法gydF4y2Ba
植物材料和遮阳处理gydF4y2Ba
自然突变体的生根插枝gydF4y2Ba茶树gydF4y2Ba(l)的简历。gydF4y2BaHuangjinyagydF4y2Ba这是2008年在浙江省正式发布的克隆品种,是由突变体余姚德石茶园(位于浙江省余姚县)的所有者免费获得的。2013年5月,在中国农业科学院茶叶研究所(TRI, CAAS, N 30°10′,E 120°5′),每一株幼苗都被种植在装满珍珠岩、蛭石和泥炭的商业生长介质的花盆(约10升容量)中。花盆被放置在阳光充足的地方,并定期浇水。2014年3月,选取幼芽均匀的茶树60壶进行实验:其中一半壶用高密度聚乙烯胶带双针网处理(60%遮阳),其余30壶在充分日照下照射10天。随机选择样品(带芽的嫩枝和两片膨胀的叶子),用液氮冷冻,然后保存在−70°C的超冷冻室中。从荫蔽和无荫蔽的植物中分别重复取样六次。gydF4y2Ba
基于超高效液相色谱四极杆飞行时间质谱(UPLC-Q-TOF/MS)的代谢组学分析gydF4y2Ba
所有12个样本(阴影组和非阴影组各6个生物学重复)均用于代谢组学分析。如Zhang等人所述,使用75%甲醇和1%甲酸的混合物从幼枝中提取代谢物。[gydF4y2Ba5gydF4y2Ba].将2 μL样品注入UPLC-Q-TOF/MS (Waters, UPLC/Xevo G2-S Q-TOF)中,用HSS T3色谱柱进行分离,如Zhang等所述[gydF4y2Ba5gydF4y2Ba].TransOmics软件(1.0版本;Waters)进行数据预处理。如Zhang等人所述,使用在线代谢物数据库将代谢物峰值分配到精确的质量测量中。[gydF4y2Ba5gydF4y2Ba],并将保留时间与已发表的文献进行比较[gydF4y2Ba5gydF4y2Ba].导出一个矩阵用于进一步的统计分析。使用SIMCA-P(版本13.0,Umetrics, Umea,瑞典)对单位方差进行缩放以进行进一步统计分析。采用无监督主成分分析(PCA)和有监督投影到潜在结构判别分析(PLS-DA)分别对样品的代谢产物总体方差和成分差异进行分析。结合p(corr)和PLS-DA投影(VIP)值中的变量重要性作为代谢物选择的系数(VIP > 1.0和|p(corr)| > 0.5)。学生的gydF4y2BatgydF4y2Ba以及(gydF4y2BaPgydF4y2Ba< 0.05),采用SPSS(15.0版,SPSS Inc., Chicago, IL)进行单因素方差分析(ANOVA)进行统计分析。gydF4y2Ba
实时荧光定量PCR分析gydF4y2Ba
使用植物RNA提取试剂盒(Tiangen, China)分离总RNA。采用PrimeScriptTM RT试剂盒(TaKaRa)合成cDNA。定量实时PCR (qRT-PCR)在Applied Biosystems 7300机器(Carlsbad, CA, USA)上进行。用于qRT-PCR的引物对见附加文件gydF4y2Ba1gydF4y2Ba:表S1,和gydF4y2BaGAPDHgydF4y2Ba作为内参基因。对每个靶基因进行三次反应。相对转录水平与内部控制的相对转录水平进行计算gydF4y2BaGAPDHgydF4y2Ba使用公式2gydF4y2Ba——ΔΔCtgydF4y2Ba。所有数据均以均数±标准差(gydF4y2BangydF4y2Ba= 3)。gydF4y2Ba
叶绿素、类胡萝卜素和儿茶素的定量测定gydF4y2Ba
以面积为86.59 mm的叶片为样本,测定叶绿素和类胡萝卜素含量gydF4y2Ba2gydF4y2Ba都是用穿孔的金属圆筒取出来的。在与二极管阵列检测器(Waters 2998)耦合的反相高效液相色谱(HPLC)系统(Waters 2695)上分析茶叶注入,如[gydF4y2Ba5gydF4y2Ba].儿茶素也采用高效液相色谱法定量,如Wu等所述,使用C18反相色谱柱(250 × 4.6 mm id, Phenomenex, Torrance, CA, USA)进行分离。[gydF4y2Ba36gydF4y2Ba].gydF4y2Ba
酚类化合物的组织定位gydF4y2Ba
标准徒手切片制备的样品,并以1% (gydF4y2Baw / vgydF4y2Ba)香草香-盐酸试剂进行酚类化合物的定位研究。染色前后用显微镜(XQT-2, COIC)对样品切片拍照[gydF4y2Ba37gydF4y2Ba].gydF4y2Ba
用NaturstoVreagenz A染色切片,并使用共聚焦激光扫描显微镜(CLSM, Zeiss LSM 710 NLO),采用[gydF4y2Ba38gydF4y2Ba].gydF4y2Ba
结果gydF4y2Ba
黄金亚叶片叶绿素和类胡萝卜素的表型及其含量gydF4y2Ba
如图所示。gydF4y2Ba1gydF4y2Ba,在全日照条件下,茶树叶片呈绿变,而遮荫茶树叶片呈绿色。因此,这两种茶树叶片中叶绿素含量有明显差异(表1)gydF4y2Ba1gydF4y2Ba).与未褪绿茶树相比,褪绿茶树叶片的叶绿素-a和叶绿素-b含量相对较低。类胡萝卜素是植物光合作用系统中的捕光色素,保证植物高效的光合作用,防止光损伤。在我们的研究中,叶黄素和新黄质含量随着褪绿叶片中玉米黄质和胡萝卜素含量的增加而降低(表gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
代谢组学分析概述gydF4y2Ba
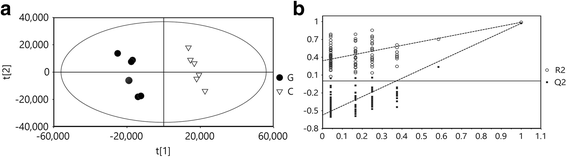
从UPLC-TOF/MS分析的原始数据中共提取出1471个化合物。我们进行了PLS-DA建模,以确定哪些代谢物受褪绿症的显著影响(图。gydF4y2Ba2gydF4y2Ba).PLS-DA模型各分量对预测精度的解释方差为89.3%,累积Q2方差为82.2%,组间差异显著。PLS-DA模型通过7倍交叉验证进一步验证,并采用置换检验严格验证模型的可靠性(图1)。gydF4y2Ba2 bgydF4y2Ba,gydF4y2BangydF4y2Ba= 200)。评分图显示,有第一个成分的绿原叶和阴影绿叶之间有明显的分离(如图X轴所示)。gydF4y2Ba2gydF4y2Ba).根据PLS-DA模型中VIP > 1.0和|p(corr)| > 0.5鉴别差异代谢产物gydF4y2BapgydF4y2Ba< 0.05gydF4y2BatgydF4y2Ba以及。52种差异代谢物被鉴定出来,它们负责类黄酮的生物合成和苯丙氨酸的代谢(表gydF4y2Ba2gydF4y2Ba).这些代谢产物包括黄烷-3-醇(儿茶素)、黄酮醇、黄酮醇苷、花青素、苯甲酸及其衍生物。gydF4y2Ba
褪绿叶与正常绿叶类黄酮代谢的差异gydF4y2Ba
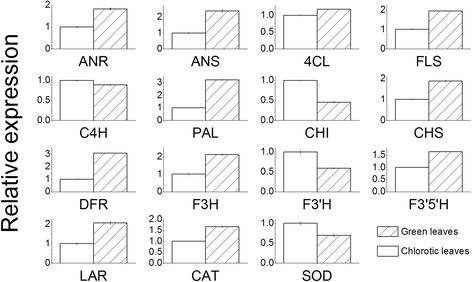
褪绿突变体表现出较低的基因表达水平,如gydF4y2Ba苯丙氨酸解氨酶gydF4y2Ba,gydF4y2Ba4-coumarate——辅酶a连接酶gydF4y2Ba(gydF4y2Ba4 clgydF4y2Ba),gydF4y2Ba花青素还原酶gydF4y2Ba(gydF4y2BaANRgydF4y2Ba),gydF4y2Ba查耳酮合酶gydF4y2Ba(gydF4y2BaCHSgydF4y2Ba),gydF4y2Ba黄酮3-羟化酶(F3H),类黄酮3 ',5 ' -羟化酶(F3 ' 5 ' h)gydF4y2Ba而且gydF4y2Ba黄酮醇合酶(FLS)gydF4y2Ba在从苯丙氨酸到表没食子儿茶素的通路中,有阴影的绿叶的作用更大。然而,gydF4y2Ba查尔酮异构酶gydF4y2Ba而且gydF4y2Ba类黄酮3 ' -羟化酶gydF4y2Ba(gydF4y2BaF3'HgydF4y2Ba,即合成二羟基黄酮的关键基因)上调(图;gydF4y2Ba3.gydF4y2Ba)。gydF4y2Ba
定量RT-PCR验证。苯丙氨酸解氨酶;C4H,肉桂酸4-羟化酶;4Cl, 4-香豆酸-CoA连接酶;CHI,查尔酮异构酶;CHS,查尔酮合成酶;F3 ' 5 ' h,类黄酮3 ',5 ' -羟化酶;F3H,黄酮3-羟化酶;F3'H,类黄酮3 ' -单加氧酶;FLS,黄酮醇合成酶; DFR, dihydroflavonol-4-reductase; ANR, anthocyanidin reductase; ANS, anthocyanidin synthase; LAR, leucoanthocyanidin reductase; CAT: catalase; SOD, superoxide dismutase
使用UPLC-Q-TOF/MS进行代谢组学分析显示,遮荫对黄烷-3-醇、黄酮醇和黄酮醇苷的浓度有很大的影响(表gydF4y2Ba2gydF4y2Ba).与绿叶相比,褪绿叶中15种被标记为类黄酮代谢一部分的代谢物减少,这些代谢物包括(−)-表儿茶素8- c -葡萄糖苷,6-没食子基葡萄糖和表儿茶素-表儿茶素。然而,其他黄酮类化合物(如表儿茶素没食子酸酯、儿茶素)在褪绿叶中并没有显著减少,甚至增加(如花青素、芦丁、儿茶素没食子酸酯)。值得注意的是,褪绿叶中二羟基黄酮类化合物含量高于绿叶,主要是槲皮素及其苷类化合物(槲皮素3-半乳糖苷、槲皮素4 ',7-二葡萄糖苷、槲皮素3-芦丁糖苷7-半乳糖苷等),而杨梅苷类化合物(杨梅素3-阿拉伯糖苷、杨梅素3,3 ' -双半乳糖苷等)含量低于绿叶(表3gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
在HPLC定量分析的验证中,褪绿叶中三羟基儿茶素(尤其是没食子儿茶素,没食子儿茶素没食子酸表没食子儿茶素没食子酸酯)的含量较荫蔽绿叶低。然而,二羟基儿茶素(儿茶素没食子酸酯,表儿茶素)的含量在褪绿叶中显著高于荫蔽的绿色嫩芽(表gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
此外,参与苯类、苯丙类和多酮类代谢的代谢物,儿茶素和类黄酮代谢的上游分支,在褪绿叶中显著下调(表gydF4y2Ba2gydF4y2Ba).如香豆酸、咖啡酸、奎宁酸、莽草酸、菊苣酸等。gydF4y2Ba
黄酮类化合物的细胞内定位及抗氧化系统相关基因的表达gydF4y2Ba
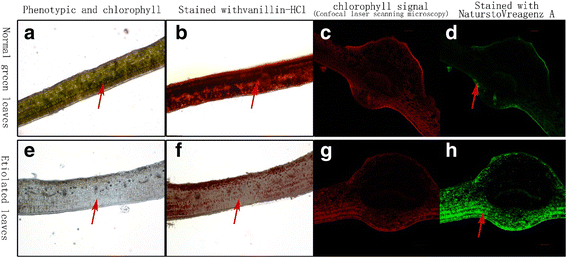
黄酮类化合物(主要是二羟基黄酮类化合物)在细胞内的定位在绿绿叶和阴影叶之间有很大的不同。gydF4y2Ba4gydF4y2Ba).类黄酮(图;gydF4y2Ba4gydF4y2Ba,绿色荧光信号)主要分布在叶表皮细胞和叶片的光接收区,而叶绿素(图中绿色和红色信号)主要分布在叶表皮细胞和叶片的光接收区。gydF4y2Ba4gydF4y2Ba)和儿茶素(图;gydF4y2Ba4gydF4y2Ba(红色信号)分布在绿叶阴影下的细胞中。然而,儿茶素信号(图;gydF4y2Ba4gydF4y2Ba(红色信号)显著减弱,叶绿体退化(图;gydF4y2Ba4gydF4y2Ba,箭头),二羟基黄酮类化合物扩散到所有的叶细胞随着叶子变得褪绿。gydF4y2Ba
儿茶素和黄酮醇的组织化学定位gydF4y2BaHuangjinyagydF4y2Ba叶子。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba显示正常的绿叶gydF4y2BaHuangjinyagydF4y2Ba阴影60% (NG);gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba显示100%阳光(EM)下HJY的褪绿叶片;gydF4y2BabgydF4y2Ba而且gydF4y2BafgydF4y2Ba用香草-盐酸试剂染色;红色信号代表酚类化合物(主要是儿茶素;gydF4y2BadgydF4y2Ba而且gydF4y2BahgydF4y2Ba用NaturstoVreagenz A(共聚焦激光扫描显微镜)染色,绿色荧光信号代表黄酮醇gydF4y2Ba
编码过氧化氢酶(CAT)的基因在荫蔽的绿叶中的表达量比在褪绿叶中的表达量高1.4倍(图2)。gydF4y2Ba3.gydF4y2Ba).而叶绿体中编码超氧化物歧化酶(SOD)的基因则受到抑制。gydF4y2Ba
讨论gydF4y2Ba
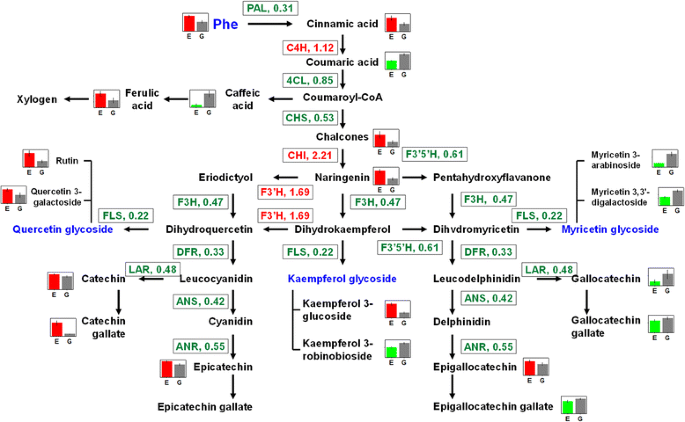
图中显示了受褪绿症突变影响的苯丙烷/类黄酮途径的流程图。gydF4y2Ba5gydF4y2Ba。含量降低的同时,大多数基因的表达水平降低(除gydF4y2Ba气gydF4y2Ba而且gydF4y2BaF3'HgydF4y2Ba)参与从苯丙氨酸到这些代谢物的通路。此外,参与上游莽草酸途径(导致苯丙氨酸生物合成)的基因表达水平也被强烈下调(图。gydF4y2Ba5gydF4y2Ba).这些结果表明,黄酮类化合物的生物合成受到了强烈的抑制。对这种抑制的解释之一是叶绿体的破坏,叶绿体是类黄酮生物合成的场所[gydF4y2Ba32gydF4y2Ba].目前的工作表明,黄酮类化合物在组织中的位置随着叶片变绿而改变,因为黄酮类化合物的合成代谢与叶绿体耦合在一起。gydF4y2Ba4gydF4y2Ba).此外,黄酮类化合物积累的减少可能归因于叶绿体葡萄糖含量低。这一发现证实了Yang等人的发现。gydF4y2Ba39gydF4y2Ba],他们的研究表明,莽草酸、前苯酸和苯丙酮酸的代谢在暗诱导的茶树中受到强烈的抑制。糖的减少也会对儿茶素的糖基化以及类黄酮苷的合成产生负面影响[gydF4y2Ba4gydF4y2Ba].gydF4y2Ba
苯丙烷/类黄酮途径受褪绿病突变影响的示意图表示。gydF4y2Ba红色的gydF4y2Ba而且gydF4y2Ba绿色gydF4y2Ba字体分别表示与荫蔽植物相比,褪绿叶片中上调和下调的基因。显著变化的代谢物用barplot表示(E和G分别表示褪绿和绿叶),而本研究中未鉴定的化合物用灰色字体表示。苯丙氨酸解氨酶;C4H,肉桂酸4-羟化酶;4Cl, 4-香豆酸-CoA连接酶;CHI,查尔酮异构酶;CHS,查尔酮合成酶;F3 ' 5 ' h,类黄酮3 ',5 ' -羟化酶;F3H,黄酮3-羟化酶;F3'H,类黄酮3 ' -单加氧酶; FLS, flavonol synthase; DFR, dihydroflavonol-4-reductase; ANR, anthocyanidin reductase; ANS, anthocyanidin synthase; LAR, leucoanthocyanidin reductase
具有抗氧化活性的小分子的积累在减缓ROS积累中起着重要作用[gydF4y2Ba40gydF4y2Ba].这些低分子抗氧化剂包括糖、a-生育酚、谷胱甘肽、氨基酸(如脯氨酸)、抗坏血酸、类胡萝卜素和奎宁酸衍生物(如绿原酸)。在我们的研究中,茶叶突变体没有发育出功能性叶绿体(数据未显示),并且在光照条件下缺乏叶绿素(表2)gydF4y2Ba1gydF4y2Ba),表明没有遮光的突变体暴露在光胁迫下。许多苯丙烷[gydF4y2Ba27gydF4y2Ba]和花青素[gydF4y2Ba28gydF4y2Ba]化合物是有效的阳光衰减器,并保护光合器官(叶绿体)面对过多的辐射能。类黄酮在保护植物免受过量UV-B或阳光照射方面起着至关重要的作用[gydF4y2Ba29gydF4y2Ba- - - - - -gydF4y2Ba31gydF4y2Ba].在不同的环境条件下,槲皮素和二羟基儿茶素等类黄酮也在高等植物中发挥多种功能[gydF4y2Ba26gydF4y2Ba].b环上具有二羟基结构的类黄酮在高剂量的紫外线辐射或阳光辐射下优先积累[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba].因此,叶片承受光胁迫的生理机制可能与二羟基黄酮类化合物有关。在我们的研究中,褪绿叶中含有较高水平的二羟基黄酮,主要是儿茶素(儿茶素没食子酸酯,表儿茶素)和槲皮素及其苷,而杨梅素和山奈酚苷的含量低于绿叶(图。gydF4y2Ba5gydF4y2Ba、表gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba).对普通茶树进行日光照射和部分遮阳处理也观察到类似的结果[gydF4y2Ba5gydF4y2Ba],这表明黄酮类化合物对ROS的作用不仅存在于褪绿茶叶中,而且存在于所有正常茶叶中。二羟基黄酮类化合物主要分布在叶表皮细胞内和光接收区,而叶绿素和儿茶素主要分布在叶绿体细胞内。gydF4y2Ba
一般来说,植物具有多种光保护机制,包括通过非光化学猝灭(NPQ)将吸收的光能耗散为热能。光抑制猝灭(qI)、状态过渡猝灭(qT)和高能状态猝灭(qE)是NPQ的三个主要成分,其中qI与叶黄素周期色素玉米黄质向紫黄素的缓慢转化有关,qE则依赖于与PSII天线蛋白结合的特殊叶黄素分子(即叶黄素和玉米黄质)的存在[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].我们观察到,尽管类胡萝卜素的总含量下降了54%,但褪绿叶片中的玉米黄质和胡萝卜素含量显著增加gydF4y2Ba1gydF4y2Ba).叶黄素循环通过将紫黄质转化为玉米黄质来保护植物免受高光强的影响,玉米黄质参与了吸收的多余光能的热耗散[gydF4y2Ba34gydF4y2Ba].通过转录组分析,我们还发现,与绿色(阴影)叶相比,褪绿叶中紫黄质去环氧化酶和玉米黄质环氧化酶(EC: 1.10.99.3, 1.14.13.90,一个叶黄素循环中的关键基因,保护植物免受高强度光的影响)的转录水平更高(数据未显示在这里)。这表明叶黄素循环在保护gydF4y2BaHuangjinyagydF4y2Ba’来自高强度的光。这一结果与Li等人的发现高度一致。[gydF4y2Ba20.gydF4y2Ba].茶突变体gydF4y2Ba白叶1号”gydF4y2Ba和“gydF4y2BaHuangjinyagydF4y2Ba与褪绿叶片相比,两者的类胡萝卜素和玉米黄质含量都有所降低gydF4y2Ba福鼎dabaichagydF4y2Ba”(gydF4y2Ba17gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].因此,“gydF4y2BaHuangjinyagydF4y2Ba与其他茶突变体(主要是白化突变体)相比,类胡萝卜素水平有显著差异。我们假设类胡萝卜素组成和生物合成的变化是光敏感茶突变体的一种特殊的光保护机制。然而,对褪绿叶细胞膜结构的严重破坏表明,抗氧化剂和叶黄素循环不足以保护茶树免受光损伤。gydF4y2Ba
在非生物胁迫下,包括轻胁迫,高活性和毒性ROS如超氧阴离子自由基,单线态氧,过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba),以及羟基自由基(gydF4y2Ba•gydF4y2BaOH)被诱导(图;gydF4y2Ba6gydF4y2Ba),而活性氧清除系统可缓解这些影响[gydF4y2Ba24gydF4y2Ba].叶绿体通过组成的显著变化来响应ROS,从而导致快速的形态和功能改变[gydF4y2Ba44gydF4y2Ba].叶绿体中ROS清除系统和生物膜保护功能的失活可能导致膜结构的破坏和叶绿体的解体。叶绿体对高强度光产生的ROS反应剧烈[gydF4y2Ba23gydF4y2Ba].CAT是一种铁卟啉假体结合酶,可清除ROS [gydF4y2Ba45gydF4y2Ba].在我们的研究中,编码CAT活性的基因在褪绿叶中下调,铁含量降低(褪绿叶为1.6 mg/kg,绿叶为1.1 mg/kg)。这些结果表明CAT的合成可能受到铁的利用和螯合的限制。gydF4y2Ba
结论gydF4y2Ba
在本研究中,研究了黄化叶片和正常绿叶(遮荫处理的叶片)之间基因表达模式和代谢产物的差异。gydF4y2BaHuangjinyagydF4y2Ba通过代谢组学分析发现了茶叶突变体。我们的结果表明,高强度光胁迫引起了褪绿叶片的光氧化,并诱导了清除ROS的多重光保护机制,包括激活二羟基黄酮和叶黄素循环通路,这也逆转了突变叶片的光损伤,帮助它们承受光胁迫。此外,代谢物积累的差异和基因表达的差异表明二羟基黄酮在茶叶中的功能作用存在很大差异。特别是槲皮素及其苷(相对于杨梅苷和山奈酚苷)在褪绿叶中的积累和定位,表明其在光保护方面的巨大贡献和在茶叶中清除ROS的独特功能作用。gydF4y2Ba
缩写gydF4y2Ba
- •gydF4y2Ba哦:gydF4y2Ba
-
羟基自由基gydF4y2Ba
- 4 cl:gydF4y2Ba
-
4-coumarate——辅酶a连接酶gydF4y2Ba
- ANR:gydF4y2Ba
-
花青素还原酶gydF4y2Ba
- 答:gydF4y2Ba
-
花青素合成酶gydF4y2Ba
- C4H:gydF4y2Ba
-
肉桂酸4-hydroxylasegydF4y2Ba
- 猫:gydF4y2Ba
-
过氧化氢酶gydF4y2Ba
- 气:gydF4y2Ba
-
查耳酮异构酶gydF4y2Ba
- CHS:gydF4y2Ba
-
查耳酮合酶gydF4y2Ba
- DFR:gydF4y2Ba
-
Dihydroflavonol-4-reductasegydF4y2Ba
- F3’5是什么:gydF4y2Ba
-
黄酮3 ',5 ' -羟化酶gydF4y2Ba
- F3H:gydF4y2Ba
-
黄烷酮3-hydroxylasegydF4y2Ba
- F3'H:gydF4y2Ba
-
类黄酮3 '单氧酶gydF4y2Ba
- 读者:gydF4y2Ba
-
黄酮醇合成酶gydF4y2Ba
- HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba:gydF4y2Ba
-
过氧化氢gydF4y2Ba
- 高效液相色谱法:gydF4y2Ba
-
高效液相色谱法gydF4y2Ba
- 政治:gydF4y2Ba
-
Leucoanthocyanidin还原酶gydF4y2Ba
- NPQ:gydF4y2Ba
-
Non-photochemical淬火gydF4y2Ba
- 朋友:gydF4y2Ba
-
苯丙氨酸ammonia-lyasegydF4y2Ba
- PLS-DA:gydF4y2Ba
-
投影对潜在结构的判别分析gydF4y2Ba
- PSII:gydF4y2Ba
-
光系统IIgydF4y2Ba
- 量化宽松政策:gydF4y2Ba
-
High-energy-state-quenchinggydF4y2Ba
- 气:gydF4y2Ba
-
Photoinhibitory淬火gydF4y2Ba
- 存在:gydF4y2Ba
-
实时定量PCRgydF4y2Ba
- qT:gydF4y2Ba
-
状态转变导致的淬火gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- SOD:gydF4y2Ba
-
超氧化物歧化酶gydF4y2Ba
- UPLC-Q-TOF /女士:gydF4y2Ba
-
超高效液相色谱四极杆飞行时间质谱法gydF4y2Ba
- 紫外线:gydF4y2Ba
-
紫外线辐射gydF4y2Ba
- 贵宾:gydF4y2Ba
-
投影的重要性是可变的gydF4y2Ba
参考文献gydF4y2Ba
张强,阮娟。茶:分析与品鉴。In: Caballero B, Finglas PM, Toldrá F,编辑。食物和健康百科全书牛津大学:学术;2015.p . 256 - 67。gydF4y2Ba
Cheynier V, Comte G, Davies KM, Lattanzio V, Martens S.植物酚类物质:生物合成、遗传学和生态生理学的最新进展。植物化学学报,2013;gydF4y2Ba
Figueiredo-Gonzalez M, Cancho-Grande B, Boso S, Santiago JL, Martinez MC, Simal-Gandara J. Mouraton浆果中黄酮类化合物的进化。食品化学,2013;138:1868-77。gydF4y2Ba
王艳,高丽,王智,刘颖,孙敏,杨东,魏超,单燕,夏涛。光诱导下茶愈伤组织苯丙类生物合成途径相关基因的表达(gydF4y2Ba茶树gydF4y2Ba(l)o . Kuntze)。科学通报。2012;133:72-83。gydF4y2Ba
张强,石勇,马玲,易鑫,阮娟。利用超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF/MS)分析了遮荫处理下光强和温度对茶叶代谢产物的影响。科学通报。2014;9:e112572。gydF4y2Ba
Tattini M, Guidi L, morassii - bonzi L, Pinelli P, relomini D, Degl 'Innocenti E, Giordano C, Massai R, Agati G.黄酮类化合物在综合反应机制中的作用gydF4y2BaLigustrum vulgaregydF4y2Ba而且gydF4y2BaPhillyrea latifoliagydF4y2Ba高太阳辐射。新植物学家。2005;167:457-70。gydF4y2Ba
Agati G, Biricolti S, Guidi L, Ferrini F, Fini A, Tattini M.黄酮类化合物的生物合成在紫外辐射和根区盐度的作用下也有相似的促进作用。中国植物科学,2011;29(3):344 - 344。gydF4y2Ba
杨晓东,张志刚,张志刚,等。植物-环境相互作用中次生代谢产物功能的新证据。环境实验机器人,2015;119:1-3。gydF4y2Ba
杨晓明,李志强,李志强,等。花青素在植物-环境相互作用中的作用。环境科学学报。2015;19(4):344 - 344。gydF4y2Ba
tatutini M, Galardi C, Pinelli P, Massai R, relomini D, Agati G.超光和干旱胁迫下女贞叶黄酮类化合物和羟基肉桂酸酯的差异积累。新植物学家。2004;63:547-61。gydF4y2Ba
黄酮在植物抗氧化剂中的地位及其功能意义。植物科学进展(英文版);2012;gydF4y2Ba
Satou M, Enoki H, Oikawa A, Ohta D, Saito K, Hachiya T, Sakakibara H, Kusano M, Fukushima A, Saito K, Kobayashi M, Nagata N, Myouga F, Shinozaki K, Motohashi rgydF4y2Ba拟南芥白化或淡绿色gydF4y2Ba核编码叶绿体蛋白被破坏的突变体。中国生物医学工程学报,2014;gydF4y2Ba
黄酮醇葡萄糖苷的互变异构——与植物紫外线保护和花卉颜色的关系。光化学学报,1998;18(4):344 - 344。gydF4y2Ba
黄酮-过氧化物酶对植物细胞抗H2O2解毒机制的研究。植物物理学报。1997;115:1405-17。gydF4y2Ba
neil SO, Gould KS。叶子中的花青素:光衰减剂还是抗氧化剂?植物学报,2003;30:865-73。gydF4y2Ba
马春林,陈林,王晓春,金建强,马建强,姚明哲,王志林。安吉白茶不同白化期的差异表达分析(gydF4y2Ba茶树gydF4y2Ba(l)O. Kuntze)使用cDNA微阵列。科学通报,2012;gydF4y2Ba
冯玲,高明梅,侯瑞日,胡晓霞,张玲,万小春,魏松。白化茶树幼叶品质成分的测定。食品化学,2014;155:98-104。gydF4y2Ba
李强,黄娟,刘松,李娟,杨霞,刘勇,刘忠。白化茶树3个发育阶段幼叶蛋白质组学分析。蛋白质组学,2011;9:44。gydF4y2Ba
熊玲,李娟,李艳,袁玲,刘松,黄娟,刘忠。白化茶树儿茶素水平及儿茶素生物合成相关基因表达的动态变化(gydF4y2Ba茶树gydF4y2Bal .)。植物化学学报,2013;gydF4y2Ba
李楠,杨颖,叶娟,卢娟,郑霞,梁艳。光照对光敏白化茶树基因表达和化学成分的影响。植物生长学报。2015;78:253-62gydF4y2Ba
陈敏,陈志勇,陈志强。植物光信号转导的研究进展。年Rev Genet 2004; 38:87-117。gydF4y2Ba
李丽龙,崔志华,孙宁,金硕,朴志杰,张金哲,郑勇,金海杰。遮荫处理对绿茶营养和感官品质影响的代谢组学分析。农学通报。2013;41:332 - 8。gydF4y2Ba
Alboresi A, Dall 'Osto L, Aprile A, Carillo P, Roncaglia E, Cattivelli L, Bassi R.超光处理野生型活性氧和转录分析gydF4y2Ba拟南芥gydF4y2Ba与缺乏玉米黄质和叶黄素的光敏突变体。BMC植物生物学2011;11:62。gydF4y2Ba
Nishiyama Y, Murata N.光抑制机制的修正方案及其在提高光合机制非生物胁迫耐受性中的应用。中国生物医学工程学报,2014;gydF4y2Ba
张志刚,张志刚,张志刚。拟南芥白叶叶绿体光氧化诱导转录组重编程的研究。植物科学学报。2009;30(4):344 - 344。gydF4y2Ba
Agati G, Matteini P, Goti A, Tattini M.叶绿体定位的黄酮类化合物能清除单线态氧。新植物学家。2007;174:77-89。gydF4y2Ba
黄酮类化合物在光保护中的多重功能作用。新植物学家。2010;186:786-93。gydF4y2Ba
高德KS,杜德DA,纽菲尔德HS。为什么有些茎是红色的:茎类花青素保护光系统II免受强光胁迫。中国科学(d辑),2010;gydF4y2Ba
乔丹品牌。综述:植物细胞对UV-B胁迫的分子响应。植物学报,2002;29:909-16。gydF4y2Ba
刘志强,李志强,陈志强,等。沙果属植物叶片抗氧化活性的研究进展。功能植物学报,2002;29:1437-43。gydF4y2Ba
杨晓东,李志强,李志强,李志强,等。中国植物酚类化合物的时空变化特征gydF4y2Ba进行了它们gydF4y2Ba叶子和角质层。植物化学学报,2013;gydF4y2Ba
Agati G, Galardi C, Gravano E, Romani A, Tattini M.用显微荧光光谱法和多光谱荧光显微成像法估算白叶泡茶叶组织中黄酮类化合物的分布光化学。2002;76:350-60。gydF4y2Ba
Hofmann R, Campbell B, Bloor S, Swinny E, Markham K, Ryan K, Fountain D.三叶草对UV - B辐射的反应与植物生产力和水分有效性的生理联系。工厂。细胞与环境,2003;26:603-12。gydF4y2Ba
布坎南BB,格鲁西姆W,琼斯RL。植物生物化学与分子生物学。罗克维尔:美国植物生理学家学会;2000.gydF4y2Ba
Roelfsema MRG, Konrad KR, Marten H, Psaras GK, Hartung W, Hedrich R.白化叶斑块中的Guard细胞对光合活性辐射无反应,但对蓝光、CO2和脱落酸敏感。植物细胞环境。2006;29:1595-605。gydF4y2Ba
吴超,徐华,Héritier J, Andlauer W.中国茶叶品种中儿茶素和黄酮醇苷的测定。食品化学,2012;132:144-9。gydF4y2Ba
刘艳,高丽,夏涛,赵玲。茶树儿茶素在不同部位积累的研究(gydF4y2Ba茶树gydF4y2Ba(l)O. Kuntze)通过香草-盐酸染色。农学通报。2009;57:10371-6。gydF4y2Ba
Hutzler P, Fischbach R, Heller W, Jungblut TP, Reuber S, Schmitz R, Veit M, Weissenbock G, Schnitzler JP。用共聚焦激光扫描显微镜研究植物中酚类化合物的组织定位。中国科学(d辑),1998;29(4):353 - 353。gydF4y2Ba
杨z, Kobayashi E, Katsuno T, Asanuma T, Fujimori T, Ishikawa T, Tomomura M, Mochizuki K, Watase T, Nakamura Y, Watanabe N.茶叶黄化叶中挥发性和非挥发性代谢物的表征(gydF4y2Ba茶树gydF4y2Ba)植物在黑暗中。食品化学,2012;135:2268-76。gydF4y2Ba
夏尔玛,李志强,李志强,等。胁迫下植物氧化损伤与抗氧化防御机制的研究进展。中国科学(d辑),2012;gydF4y2Ba
高桥S,獾先生植物的光保护:光系统II损害的新认识。植物科学进展,2011;16:53-60。gydF4y2Ba
草间Y, Inoue S, Jimbo H, Takaichi S, Sonoike K, Hihara Y, Nishiyama Y.玉米黄质和松果烯酮保护联囊藻PCC 6803光系统II的修复免受单线态氧的抑制。植物细胞物理学报。2015;1556:906 - 16。gydF4y2Ba
王玲,岳超,曹辉,周勇,曾军,杨勇,王霞。缺叶绿素茶树新品种的生化和转录组分析。中国生物医学工程学报。2014;gydF4y2Ba
邢峰,李忠,孙安,邢东。活性氧促进伏马菌素b1诱导细胞死亡的叶绿体功能障碍和水杨酸积累。Febs Letters. 2013; 587:2164-72。gydF4y2Ba
Vanderauwera S, Zimmermann P, Rombauts S, Vandenabeele S, Langebartels C, Gruissem W, Inze D, Van Breusegem F.拟南芥过氧化氢调控基因表达的全基因组分析揭示了高光诱导的花青素生物合成转录簇。植物物理学报,2005;39(2):366 - 366。gydF4y2Ba
确认gydF4y2Ba
感谢陈宗茂教授和张新忠博士在UPLC-Q-TOF/MS的使用上的协助,感谢王凯荣教授提供的突变体克隆。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了中国农业科学院农业科学创新计划(caas - astp -2016- tricaas)和中国农业部中国农业研究系统专项基金(CARS 23)的资助。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在这项研究中产生或分析的所有数据都包括在这篇发表的文章及其补充信息文件中。gydF4y2Ba
作者的贡献gydF4y2Ba
QFZ和MYL收集样本,参与研究设计,进行样本分析,解释结果并起草手稿。JYR构思了这项研究,提供了资金,指导了实验设计,并修改了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的文件gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
黄化茶叶抗氧化系统相关基因定量RT-PCR引物序列(docx16kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
张强,刘敏,阮娟。通过代谢组学分析揭示了光敏茶叶中黄酮类化合物的代谢和功能作用。gydF4y2BaBMC植物生物学gydF4y2Ba17日,gydF4y2Ba64(2017)。https://doi.org/10.1186/s12870-017-1012-8gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-017-1012-8gydF4y2Ba
关键字gydF4y2Ba
- 茶树gydF4y2Ba
- 类黄酮gydF4y2Ba
- 光敏感gydF4y2Ba
- 新陈代谢gydF4y2Ba
- 光保护gydF4y2Ba