- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
猕猴桃细胞分离,不发育特殊的剥离区gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba17gydF4y2Ba文章编号:gydF4y2Ba86gydF4y2Ba(gydF4y2Ba2017gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
不像在脱落或开裂,猕猴桃的果实gydF4y2Ba猕猴桃erianthagydF4y2Ba当它们成熟和柔软时,在没有形态上可识别的脱落带的情况下,发展剥离的能力。两种密切相关的基因型与截然不同的分离行为已被确定。“好的剥皮”基因型的细胞剥离干净,剥离组织不会撕裂。“易剥落”基因型的可分离性较差,细胞在剥离时破裂,组织很容易剥落。gydF4y2Ba
结果gydF4y2Ba
结构研究表明,两种基因型的果皮脱落均发生在真皮下的外果皮。免疫标记在果胶甲酯化反应中表现出差异,在剥离良好的基因型中,标记界面与剥离位置重合,而在剥离不良的基因型中,则不存在这种界面。这种甲基酯化的差异区域是由果皮和外果皮组织之间细胞壁的差异变化而增强的。虽然两种基因型都表达了两种聚半乳糖醛酸酶基因,但在剥离良好的基因型中没有检测到酶活性,表明果胶分解有限,保持细胞壁坚固,在剥离时不会撕裂或撕裂果肉。好的脱皮基因型果皮中壁硬半乳聚糖的位置和数量的差异可能是导致这种表型的原因。半纤维素作用的转糖基酶在良好脱皮基因型中更活跃,这表明在脱皮发育过程中,通过重塑其基质对剥离弹性的影响。高木葡聚糖酶活性在优良的去皮基因型的果皮可能有助于有一个加强作用的纤维素-木葡聚糖网络。gydF4y2Ba
结论gydF4y2Ba
的水果gydF4y2Baa . erianthagydF4y2Ba果皮可脱性是由于果皮和外果皮组织中细胞壁的差异变化导致了果皮机械性能的变化而形成的不连续区。在成熟过程中,果皮变得柔软,细胞继续强烈地相互粘附,防止破裂,而下面的外层果皮在软化过程中失去细胞壁强度。这些结果共同揭示了一种新颖而有趣的细胞分离机制。gydF4y2Ba
背景gydF4y2Ba
在植物细胞分离过程中,连接细胞的细胞壁的多糖网络被“外科手术般精准”地拆除[gydF4y2Ba1gydF4y2Ba].细胞分离可导致器官内部的完全分离(裂开)或器官与亲本植物之间的完全分离(脱落)。细胞分离也可以发生在局部,导致细胞间隙的发展,例如在叶子或水果。一般来说,分离和开裂都发生在预定的等径平坦细胞带,这些细胞带排列在2至50层细胞之间[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].这些细胞在器官分离前的一段时间开始分化,并在这个发育阶段一直处于停滞状态,直到一系列不同的信号,包括乙烯和生长素,触发了一系列基因的表达,这些基因的产物调控了实际的细胞分离。在塞克斯顿和罗伯茨的模型中gydF4y2Ba4gydF4y2Ba研究表明,乙烯是驱动叶片脱落过程的主要信号,而生长素可以降低脱落带细胞对乙烯的敏感性,从而阻止或延缓叶片脱落。gydF4y2Ba
对脱落带酶活性变化的研究主要集中在细胞壁降解酶及其基因[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].第一个在脱落部位促进细胞壁松动的酶是内-β-1,4-葡聚糖酶(EGase),或纤维素酶[gydF4y2Ba4gydF4y2Ba].EGase基因的表达gydF4y2Ba菜豆gydF4y2Ba在乙烯促进的脱落过程中增加,被生长素的应用抑制,并且局限于脱落带组织[gydF4y2Ba5gydF4y2Ba].EGase基因表达的增加也伴随着细胞的脱落gydF4y2BaSambucus黑质gydF4y2Ba传单(gydF4y2Ba6gydF4y2Ba)、西红柿(gydF4y2Ba茄属植物lycopersicumgydF4y2Ba)花gydF4y2Ba7 gydF4y2Ba]及胡椒(gydF4y2Ba甜椒gydF4y2Ba)花和叶[gydF4y2Ba8gydF4y2Ba].在酶水平上,叶片、花朵和果实脱落时EGase活性也有所增加[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba].由于与果胶脱落相关的壁破坏的主要部位是果胶含量丰富的中间板层,因此对果胶水解酶的研究也受到了关注。聚半乳糖醛酸酶(PG)活性在番茄叶片、花朵和果实的脱落区增加[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba),桃子(gydF4y2Ba碧桃gydF4y2Ba)树叶和水果[gydF4y2Ba10gydF4y2Ba]及小册子gydF4y2BaSambucus黑质gydF4y2Ba[gydF4y2Ba14gydF4y2Ba].一般来说,PG活性的增加与区域抗拉强度的损失相一致,并且局限于细胞分离发生的位点。苹果的过度表达(gydF4y2Ba马吕斯x有明显gydF4y2Ba)果特异性PG基因gydF4y2BaMdPG1gydF4y2Ba在转基因苹果植株中,CaMV 35S启动子可降低叶片脱落区细胞粘附并诱导叶片过早脱落[gydF4y2Ba15gydF4y2Ba].在荚果开裂过程中,已鉴定出几个细胞分离所需的PG基因gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba16gydF4y2Ba].扩展蛋白,延伸蛋白和木葡聚糖转糖基化酶/水解酶(XTHs)也被认为在脱落过程中有助于细胞壁松动[gydF4y2Ba3.gydF4y2Ba].gydF4y2Ba
水果脱皮是形成分离带的另一个过程。在这里,果皮下面有一个生物学上设定的分离区负责与果肉的分离。然而,不同于叶子或花的脱落,需要用力分离皮和肉。果皮分离的易度和清洁度是果皮和果肉成熟过程中细胞壁变化的一种功能,因此,对果皮可剥离性的研究重点一直是在可剥离性发生的组织中基因表达和酶活性的变化。对剥皮性的研究最为广泛gydF4y2Ba柑橘类gydF4y2BaSpp.和香蕉(gydF4y2Ba穆萨gydF4y2Baspp)。gydF4y2Ba
在橙子果皮发育的最后阶段(gydF4y2Ba素类gydF4y2Ba)与汁液囊相邻的反照率组织的细胞结构发生了变化。细胞扩大并发育出细长的突起,形成海星或蜘蛛形细胞组成的海绵状网络,具有较大的细胞间隙[gydF4y2Ba17gydF4y2Ba].易皮萨摩柑(gydF4y2Ba柑橘unshiugydF4y2Ba),在发育早期发生的结构变化和果胶的变化会导致反照率对汁液囊的粘附丧失[gydF4y2Ba18gydF4y2Ba].XTH、expansin、extensin、富含甘氨酸的蛋白和果胶乙酰酯酶基因mRNA水平的变化可能促进了反光镜下果皮的发育和大细胞间隙的形成。在组织分离过程中,反照率和黄酮类植物之间的扩张素、富含甘氨酸蛋白和果胶乙酰酯酶的基因表达模式存在差异[gydF4y2Ba19gydF4y2Ba].gydF4y2Ba
在香蕉(gydF4y2Ba穆萨acuminatagydF4y2Ba)时,果皮与果肉的分离发生在皮室,即维管束所在的内表面。与叶或花的离合区一样,果皮和果肉之间的过渡区在幼子细胞中已经很好地区分出来,有一排排等径的小细胞,行与行之间有大的矩形的空隙[gydF4y2Ba20.gydF4y2Ba].果皮组织和果肉组织之间细胞壁的不同变化和细胞壁酶的活性似乎导致了组织分离,果肉软化发生得比果皮快得多。果胶在果肉中的增溶作用大于果皮中的增溶作用。PG在香蕉皮组织中的活性高于果肉,这表明这种酶在香蕉皮软化过程中发挥了重要作用[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].两个与果胶裂解酶成熟相关的基因gydF4y2BaMaXET1gydF4y2Ba在果皮和果肉成熟过程中,一个水果特异的木葡聚糖转糖基化酶(XET)基因表达差异[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].在果肉和果皮中存在两个不同的延伸蛋白基因序列,而且它们的表达也存在差异。在果肉中,extensin mRNA在成熟过程中下调,而在果皮中上调[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba],这也许反映了旨在改变细胞壁结构的生化事件。同样在gydF4y2Ba烟草plumbaginifoliagydF4y2Ba在茎和根中,extensin RNA的上调已被证明会增加需要加强细胞壁的细胞[gydF4y2Ba27gydF4y2Ba].gydF4y2Ba
猕猴桃的果实(gydF4y2Ba猕猴桃gydF4y2Ba)的物种,gydF4y2Ba答:erianthagydF4y2Ba,当它们成熟、变软时,通常可以去皮[gydF4y2Ba28gydF4y2Ba].然而,果皮脱落在外皮细胞层的位置和细胞脱落的干净程度有很大的差异。只有两项研究研究了脱皮性的发展gydF4y2Ba猕猴桃gydF4y2Ba物种。一项初步研究比较了混合的gydF4y2Ba答:对gydF4y2Bavar。gydF4y2BadeliciosagydF4y2Ba而且gydF4y2Ba答:erianthagydF4y2Ba显示良好的果皮剥离与gydF4y2Ba答:对gydF4y2Bavar。gydF4y2BadeliciosagydF4y2Ba栽培品种“海沃德”显示较差的果皮剥离,这是该物种的典型特征[gydF4y2Ba29gydF4y2Ba].这两条线的果皮(死细胞层和类胶原层的真皮)和果皮外层结构非常相似,在脱离发育过程中没有观察到结构差异[gydF4y2Ba29gydF4y2Ba].蒙皮的力学性能gydF4y2Ba答:对gydF4y2Ba和几个gydF4y2Ba答:erianthagydF4y2Ba基因型已经在另一项研究中进行了调查,该研究提供了关于皮肤-肉粘附,皮肤张力顺应性和皮肤撕裂的信息。不同基因型间的果皮可脱性和果皮强度存在显著差异[gydF4y2Ba30.gydF4y2Ba].在本研究中,两者密切相关gydF4y2Ba答:erianthagydF4y2Ba基因型进行调查;“剥皮好”(GP)和“剥皮差”(PP)基因型(Harker等人将其命名为G2和G1, [gydF4y2Ba30.gydF4y2Ba])。这两种基因型已经被证明在剥皮行为上有本质上的不同——GP基因型的果皮从果肉上分离不需要太大的力量,而且果皮具有更高的弹性和塑性成分[gydF4y2Ba30.gydF4y2Ba].gydF4y2Ba
本文研究的目的是确定GP和PP基因型在果胶定位、细胞壁单糖组成、基因表达和酶活性等方面与分离带两侧组织、果皮和外果皮的差异。选择三个时间点,覆盖与可剥离性发展和皮肤强度和柔韧性变化相关的非常窄的紧致范围,以尽量减少与成熟相关的软化变化的发生,并最大限度地提高检测与剥离性相关的免疫学、分子和生化差异的可能性,或修改皮肤强度和柔韧性所需的差异。利用针对果胶表位的单克隆抗体进行免疫定位,研究了果胶在脱离区发育过程中、果皮和外果皮以及脱离区本身的定位和表位变化。通过测定细胞壁单糖组成和细胞壁物质的酯化程度,可以了解两种基因型细胞壁化学组成在脱离区发育过程中的差异变化。检测了与细胞壁破裂和细胞壁松动有关的基因(如PG、XTH、expansin、果胶裂解酶)的表达,并与它们参与果实分离和软化的发展有关。最后,通过比较果胶改性酶(PG, β-半乳糖苷酶)在果皮和外果皮中的活性,我们试图评估它们对细胞粘附的影响,并通过比较半纤维素改性转糖基化酶和水解酶(XET和木葡聚糖酶,甘露聚糖转糖基化酶和内-β-甘露聚糖酶,木聚糖转糖基化酶和木聚糖酶)的活性,我们试图了解它们对这些组织区细胞壁和组织强度的影响。gydF4y2Ba
结果gydF4y2Ba
两个的结构比较gydF4y2Ba答:erianthagydF4y2Ba基因型显示无脱落型分离带gydF4y2Ba
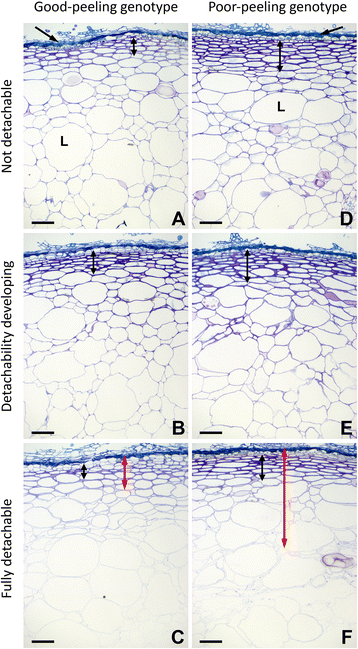
在成熟的GP型果实中,果皮组织分离成一块,干净且厚度均匀,表明果皮组织内的细胞粘附力很强(图3)。gydF4y2Ba1 a, bgydF4y2Ba).在PP基因型中,果皮在分离时经常断裂,留下潮湿的表面和附着在果皮和外皮上的果肉团块。与GP基因型相比,果皮较厚且不均匀(图3)。gydF4y2Ba1 d, egydF4y2Ba).成熟果实的手切显示,GP基因型的大部分细胞似乎都是干净的分离,在分离区细胞壁完全分离(图2)。gydF4y2Ba1 cgydF4y2Ba).PP基因型的细胞破裂和断裂程度更大(图;gydF4y2Ba1 fgydF4y2Ba).gydF4y2Ba
去皮gydF4y2Ba猕猴桃erianthagydF4y2Ba水果图片(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba)和粗糙的手工部分(gydF4y2Bac、fgydF4y2Ba)剥落的果皮。去皮好果皮(GP)基因型(gydF4y2Ba一个gydF4y2Ba)和脱皮不良(PP)基因型(gydF4y2BadgydF4y2Ba),突出了果皮的强度和可撕裂性的差异。果皮剥离后表面干燥的GP基因型(gydF4y2Ba一个gydF4y2BaPP基因型(gydF4y2BadgydF4y2Ba).GP基因型的果皮剥落得很薄,厚度均匀(gydF4y2BabgydF4y2Ba).PP基因型的果皮不均匀且较厚(gydF4y2BaegydF4y2Ba).GP基因型的大多数细胞分离干净,分离区细胞壁完全分离(箭头)(gydF4y2BacgydF4y2Ba),而PP基因型的细胞破裂程度更大(箭头)(gydF4y2BafgydF4y2Ba).条A、条B = 1 mm;Bar C, D = 100 μmgydF4y2Ba
两种水果的外皮和果皮的结构gydF4y2Ba答:erianthagydF4y2Ba通过光学显微镜观察甲苯胺蓝o染色切片的基因型。gydF4y2Ba2gydF4y2Ba).在这两种基因型中,果实表面由几层垂直压缩的死细胞组成,细胞壁增厚,大的多层生毛从细胞壁延伸出来。死细胞层覆盖着一层类似胶原的真皮,这些细胞呈放射状扁平,细胞壁增厚gydF4y2Ba1gydF4y2Ba:图S1)。GP基因型皮下延伸6 - 8个细胞层,PP基因型皮下延伸10-12个细胞层(见图中双箭头)。gydF4y2Ba2 a, dgydF4y2Ba).下皮层以下是外果皮,由大小不一的薄壁细胞组成,细胞壁比下皮层薄。在GP基因型中,果实内部的薄壁细胞大小逐渐增大,400-500处细胞较大gydF4y2BaμgydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Ba).PP基因型真皮下与外果皮较薄薄壁细胞的界面相对突变,在靠近真皮的地方发现较大的细胞(图2)。gydF4y2Ba二维gydF4y2Ba).两种基因型的薄壁细胞最大横截面尺寸均为100 μm,大细胞最大横截面尺寸均为400 μm。gydF4y2Ba
甲苯胺蓝o染色切片和果皮组织从剥皮好的果实(gydF4y2Ba一个gydF4y2Ba-gydF4y2BacgydF4y2Ba)及脱皮不良(gydF4y2BadgydF4y2Ba-gydF4y2BafgydF4y2Ba)gydF4y2Ba猕猴桃erianthagydF4y2Ba基因型。死亡塌陷皮肤的表层呈箭头状gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba.剥离阶段:可分离性未发展(gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba);可拆离性发展(gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba);可完全拆卸的果皮(gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba).每个基因型的皮下组织范围用黑色双头箭头表示(gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba),用红色双头箭头表示剥皮时剥离的果皮宽度(gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba).L,大细胞。Bar = 100 μmgydF4y2Ba
在这两种基因型中,随着果实成熟、软化和可分离性的发展,细胞壁染色发生了变化,但没有观察到两种基因型之间的结构差异(图2)。gydF4y2Ba2 bgydF4y2BavsgydF4y2BacgydF4y2Ba;gydF4y2BaegydF4y2Ba外果皮细胞甲苯胺蓝O染色减少,细胞壁完整性丧失,细胞肿胀和分离(图;gydF4y2Ba2 c fgydF4y2Ba),变化为猕猴桃软化典型[gydF4y2Ba31gydF4y2Ba].染色强度在靠近真皮的细胞中保持较大,在外果皮的大细胞中也较小细胞保持较大。PP基因型中,真皮下细胞染色强度变化不大(图;gydF4y2Ba二维gydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba),而GP基因型的皮下细胞染色似乎随着可脱性的发展而减少(图。gydF4y2Ba2gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba).在任何发育阶段均未发现明显的形态可识别的脱落区。gydF4y2Ba
果胶甲酯化和半乳糖侧链分布的变化与分离的发生有关gydF4y2Ba
采用三种针对果胶不同抗原表位特异性抗体进行免疫定位。JIM5在果胶的半乳糖醛酸(HG)骨架上识别未酯化或部分甲基酯化的表位;JIM7识别部分甲基酯化的HG表位(但不识别未酯化的区域)[gydF4y2Ba32gydF4y2Ba];而LM5在鼠李糖半乳糖醛酸- i果胶的(1-4)-β- d -半乳糖醛酸侧链中识别线性半乳糖醛酸四糖表位[gydF4y2Ba33gydF4y2Ba].gydF4y2Ba
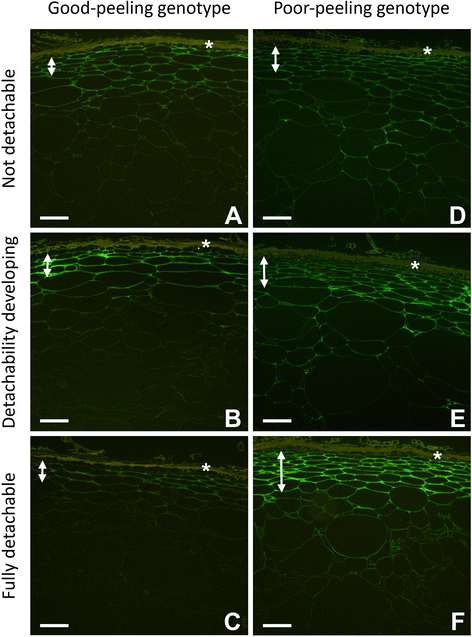
在可脱性发育之前,两种基因型的果实中JIM5的标记都不是特别强(图4)。gydF4y2Ba3 dgydF4y2Ba).在GP基因型中,标记强度似乎只在真皮下层下降,而在PP基因型中,真皮下和外果皮区域的标记强度相似。两种基因型的细胞壁标记模式相似,以三细胞连接标记最强烈(图。gydF4y2Ba3 dgydF4y2Ba).在可分离性开始发展的水果中,两种基因型的标记都增加了,但标记的总体模式保持不变。PP基因型的标记延伸到外果皮,而GP基因型的标记没有延伸到外果皮。gydF4y2Ba3 b, egydF4y2Ba).在可分离性充分发育的果实中(图。gydF4y2Ba3 c fgydF4y2Ba), GP基因型的标记变弱,外果皮上的标记缺失(图3)。gydF4y2Ba3 cgydF4y2Ba).与此相反,PP基因型的标记在皮下区和紧挨着的外果皮区强,在其他外果皮区弱保留。总的来说,在PP基因型中,随着可分离性的发展,外层果皮的下皮层和2-3细胞层的标记似乎增加了,而剩余的外层果皮的标记更弱,但与早期阶段类似(图2)。gydF4y2Ba3 fgydF4y2Ba).gydF4y2Ba
良好脱皮的免疫标记(gydF4y2Ba一个gydF4y2Ba-gydF4y2BacgydF4y2Ba)及脱皮不良(gydF4y2BadgydF4y2Ba-gydF4y2BafgydF4y2Ba基因型的gydF4y2Ba猕猴桃erianthagydF4y2Ba使用结合Alexa™488(绿色)的JIM5抗体检测果胶骨架中未酯化和低酯化的半乳糖醛酸表位。自动荧光死皮层的位置用(*)表示,双箭头表示每个基因型的真皮下组织的范围。剥离阶段:可分离性未发展(gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba);可拆离性发展(gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba);可完全拆卸的果皮(gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba).Bar = 100 μmgydF4y2Ba
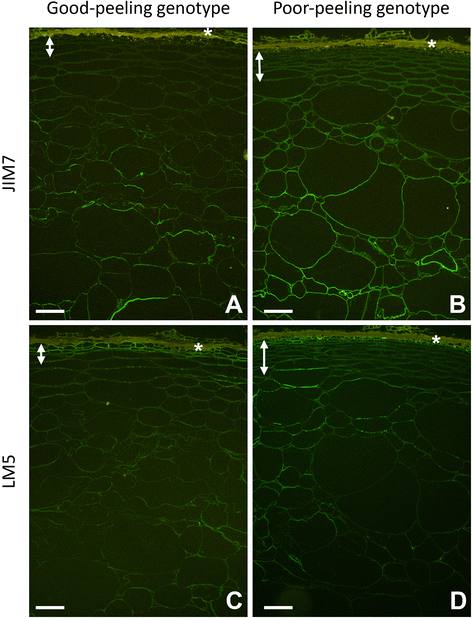
与JIM5相比,JIM7和LM5的免疫标记强度一般较低,并在软化期间下降,尽管每个抗体的总体标记模式保持到可分离性开始发展的阶段(图5)。gydF4y2Ba4gydF4y2Ba).在这一阶段,在GP基因型中JIM7的标记相当弱,真皮下区域和紧邻的外果皮细胞层显示很少或没有标记。虽然只有细胞壁的延伸部分被标记,但外果皮深处的标记强度更强,与大细胞相关的标记强度最高(图1)。gydF4y2Ba4gydF4y2Ba).PP基因型在整个胚层和邻近的外果皮细胞壁上显示微弱但一致的标记。外果皮更深处的标记强度增加,比GP基因型的标记均匀得多(图1)。gydF4y2Ba4 bgydF4y2Ba).在不可分离阶段使用JIM7和LM5进行免疫标记见附加文件gydF4y2Ba2gydF4y2Ba:图S2。gydF4y2Ba
良好脱皮的免疫标记(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba)及脱皮不良(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba基因型的gydF4y2Ba猕猴桃erianthagydF4y2Ba利用JIM7检测果胶骨架中部分甲基酯化的半乳糖醛酸表位(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)和LM5检测鼠李糖半乳聚糖- i果胶(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba).两种抗体均偶联Alexa™488(绿色)。自动荧光死皮层的位置用(*)表示,双箭头表示每个基因型的真皮下组织的范围。Bar = 100 μmgydF4y2Ba
GP基因型的LM5标记主要局限于皮肤以下3 - 4层的下胚层细胞,只有外果皮的弱标记(图5)。gydF4y2Ba4gydF4y2Bac).在PP基因型中,再次对紧接皮肤下方的真皮下细胞进行了标记,其余的真皮下细胞只有微弱的标记。外果皮上的标记较强,但不连续。gydF4y2Ba4 dgydF4y2Ba).gydF4y2Ba
果皮可脱性的差异与细胞壁单糖组成的变化有关gydF4y2Ba
免疫定位结果表明,果胶在细胞壁上的位置和组成的变化与果胶的分离能力的发展有关gydF4y2Ba答:erianthagydF4y2Ba.研究两种基因型细胞壁的单糖组成(表gydF4y2Ba1gydF4y2Ba), PP基因型果皮组织中细胞壁物质总非纤维素单糖含量在脱扣过程中显著降低,而GP基因型和PP基因型外果皮中细胞壁物质总非纤维素单糖含量相对稳定。细胞壁半乳糖含量随可脱性的发展变化不大;PP基因型果皮和外果皮细胞壁的半乳糖残基含量均高于GP基因型。果胶相关的细胞壁半乳糖醛酸-、鼠李糖醛酸-、阿拉伯酰基残基和半纤维素相关的focusyl-、木糖醛酸-、甘露壬基残基在两种基因型中变化不大,但可脱性有所发展,除糖苷含量在两种基因型细胞壁中有所下降外。gydF4y2Ba
在果皮组织的细胞壁材料中,两种基因型的酯化程度(DE)均在55 ~ 65%之间;在PP基因型中,随可脱性的发展而增加。PP基因型在完全脱体期(FD)的DE显著高于不可脱体期(ND)。在外果皮中,GP基因型的DE含量(~70%)高于PP基因型(50 ~ 60%),在'可脱性发育' (DD)和'完全可脱性' (FD)阶段的DE含量显著高于PP基因型(表)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
可脱性发育过程中基因表达的变化gydF4y2Ba
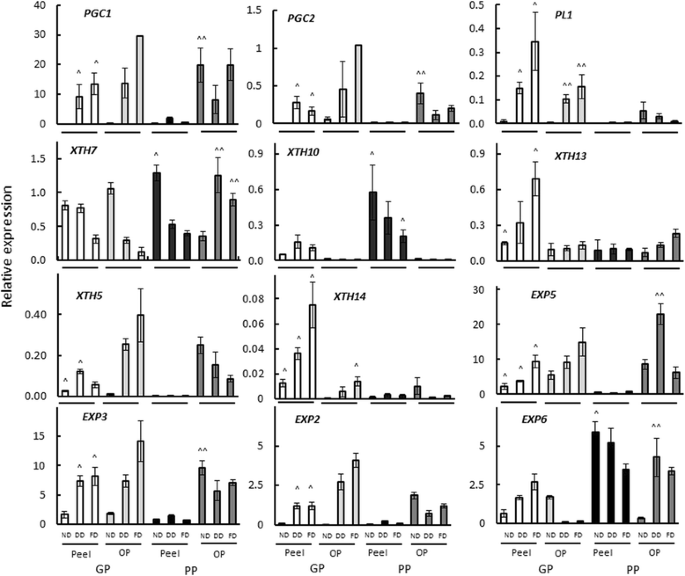
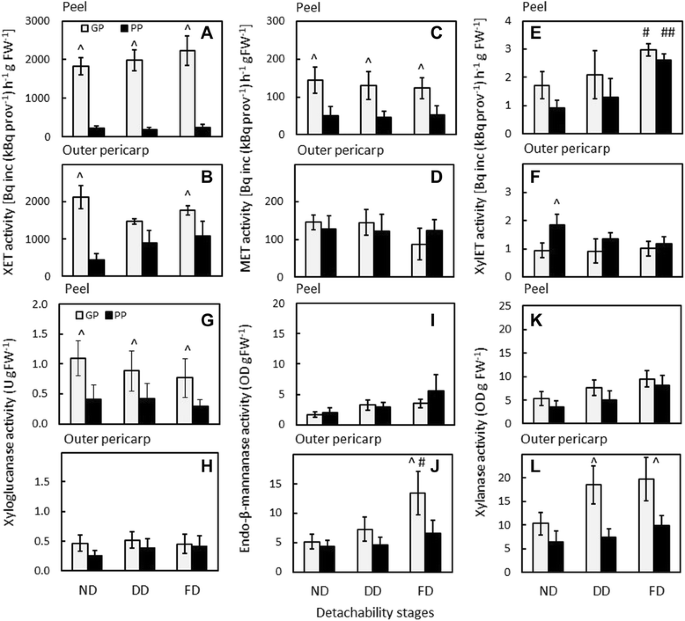
逆转录酶定量PCR (RT-qPCR)使用基因特异性引物(附加文件gydF4y2Ba3.gydF4y2Ba表S1)被用来检查在脱附发育过程中与果胶和半纤维素修饰相关的基因表达的差异。PG基因的表达gydF4y2BaPGC1gydF4y2Ba而且gydF4y2BaPGC2gydF4y2Ba在GP和PP基因型的果皮和外果皮中均有检测(图3)。gydF4y2Ba5gydF4y2Ba).与PP基因型的果皮相应阶段相比,GP基因型果皮在可脱性发育和完全脱果皮阶段PG基因的表达量均显著增加。果胶裂解酶基因(gydF4y2BaPL1gydF4y2Ba),在Atkinson等人,2011年[gydF4y2Ba34gydF4y2Ba]也在两种基因型中表达,但在PP基因型中表达水平较低(图;gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
聚半乳糖醛酸酶(PG)、果胶裂解酶(PL)、木葡聚糖转糖基化酶/水解酶(XTH)和扩张素(EXP)基因的表达gydF4y2Ba猕猴桃erianthagydF4y2Bagood-peeling(全科医生;白色和浅灰色条)和剥落不良(PP;黑色和深灰色条)基因型的发育超过可脱附性。注意面板中的不同比例。外果皮。剥皮阶段:ND,可分离性不发达;DD,可拆离性发展;FD,完全可拆卸剥皮。gydF4y2BangydF4y2Ba= 3±标准误差。(^)表示同一发育阶段(ND、DD、FD) GP和PP的果皮组织和外皮组织(^^)之间的差异有统计学意义(gydF4y2BapgydF4y2Ba值< 0.05)gydF4y2Ba
先前有14个XTH基因在猕猴桃中表达[gydF4y2Ba35gydF4y2Ba].五个这样的基因,gydF4y2BaXTH5gydF4y2Ba,gydF4y2Ba7 gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba13gydF4y2Ba而且gydF4y2Ba14,gydF4y2Ba在两种疾病中都有中度到高水平的表达gydF4y2Ba答:erianthagydF4y2Ba可脱性发育过程中的基因型(图。gydF4y2Ba5gydF4y2Ba).gydF4y2BaXTH7gydF4y2Ba在两种基因型的果皮和外果皮中均有高表达。而gydF4y2BaXTH10gydF4y2BaPP基因型的果皮中gydF4y2BaXTH5 13gydF4y2Ba而且gydF4y2Ba14gydF4y2Ba在GP基因型的果皮组织中含量显著增高。gydF4y2BaXTH1gydF4y2Ba而且gydF4y2BaXTH6gydF4y2Ba只在低水平表达,而gydF4y2BaXth2-4, 8,9,11gydF4y2Ba而且gydF4y2Ba12gydF4y2Ba没有任何表情。gydF4y2Ba
基于表达序列标签(EST)的猕猴桃表达数据[gydF4y2Ba36gydF4y2Ba],八个扩张素基因(gydF4y2BaEXP1-8gydF4y2Ba)在本研究中被检测(GenBank KY496691-98,见附加文件gydF4y2Ba3.gydF4y2Ba:表S1)。四个基因(gydF4y2BaEXP2 3 5gydF4y2Ba而且gydF4y2Ba6gydF4y2Ba)对可分离性的发展表现出高度表达。gydF4y2BaEXP1gydF4y2Ba,gydF4y2Ba4gydF4y2Ba而且gydF4y2Ba7 gydF4y2Ba表达在低到中等水平(附加文件gydF4y2Ba4gydF4y2Ba:图S3),同时gydF4y2BaEXP8gydF4y2Ba未检测到表达。皮,gydF4y2BaEXP2, EXP3gydF4y2Ba而且gydF4y2BaEXP5gydF4y2Ba在GP基因型中,尤其是在可脱性发育和完全可脱性阶段,其表达量显著升高gydF4y2BaEXP6gydF4y2BaPP基因型在各发育阶段的表达量均显著增高。这4个基因的表达在GP基因型的果皮中显著增加,而在GP基因型中gydF4y2BaEXP6gydF4y2BaPP基因型在脱离发育过程中下降。gydF4y2BaEXP2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba5gydF4y2Ba在两种基因型的外果皮均有表达;gydF4y2BaEXP6gydF4y2Ba在PP基因型中高表达,而在GP基因型中不高表达。gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
果胶水解酶和扩张蛋白在可脱性发育过程中丰度和活性的差异gydF4y2Ba
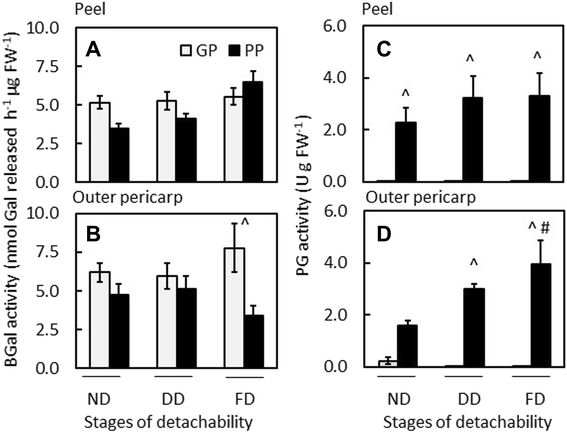
测定了两种果胶水解酶PG和β-半乳糖苷酶(BGal)的活性。两种基因型的BGal活性相似(图1)。gydF4y2Ba6 a、bgydF4y2Ba外果皮中,GP基因型的BGal活性显著高于PP基因型(图2)。gydF4y2Ba6 bgydF4y2Ba).在低盐(LS)缓冲液(80-90%)中提取了大部分BGal酶活性,表明BGal酶活性是自由溶性的,不受细胞壁束缚。使用苹果BGal抗体的Western blotting表明,两种基因型中都存在几种亚型,果皮比外层果皮含有更多的条带(附加文件gydF4y2Ba5gydF4y2Ba:图S4A, B)。gydF4y2Ba
果胶水解酶β-半乳糖苷酶(BGal)的活性(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba);聚半乳糖醛酸酶(PG) (gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)在低盐脱皮效果好的提取物(GP;白色条状)和剥落不良(PP;黑条)gydF4y2Ba猕猴桃erianthagydF4y2Ba基因型与可剥性发育的关系。剥皮阶段:ND,可分离性不发达;DD,可拆离性发展;FD,完全可拆卸剥皮。BGal,gydF4y2BangydF4y2Ba= 4±标准误差;PG,gydF4y2BangydF4y2Ba= 3±标准误差。(^)表示同一发育阶段(ND、DD、FD) GP与PP之间的差异有统计学意义。D中,(#)表示PP基因型内FD与ND的差异有统计学意义gydF4y2Ba
在整个脱离过程中,PP基因型和GP基因型的聚半乳糖醛酸酶活性总体上显著高于GP基因型(图3)。gydF4y2Ba6 c, dgydF4y2Ba).在GP基因型中,在脱离开始发生(DD)之前,只在外果皮检测到少量PG活性(图2)。gydF4y2Ba6 dgydF4y2Ba),但在所有其他阶段和果皮中都检测不到活性(图。gydF4y2Ba6 c, dgydF4y2Ba).PP基因型中,PG活性高于可脱性发育阶段,两种组织中完全可脱性期(FD) PG活性显著高于不可脱性期(ND)。gydF4y2Ba6 c, dgydF4y2Ba).聚半乳糖醛酸酶活性仅在LS提取物中检测到,表明该猕猴桃PG具有自由溶性,不受细胞壁束缚。gydF4y2Ba
在凝胶扩散试验中,PG的一些活性可能来自于果胶底物HG主干上的果胶裂解酶,因为果胶裂解酶基因在两种基因型中都有表达(图)。gydF4y2Ba5gydF4y2Ba).然而,针对猕猴桃果胶裂解酶的抗体的western分析并没有显示两种基因型的蛋白存在,尽管基因表达。gydF4y2Ba
使用针对猕猴桃EXP3蛋白产生的抗体进行Western分析,结果显示在这两种基因型中,外皮和果皮组织中至少存在两种扩展蛋白亚型。第三种分子量较低的亚型存在于GP基因型的果皮中(附加文件gydF4y2Ba5gydF4y2Ba:图S4C, D)。gydF4y2Ba
半纤维素修饰酶在可脱性发育过程中的活性变化gydF4y2Ba
木葡聚糖转糖基化酶/水解酶(XTH)、甘露聚糖转糖基化酶/水解酶和木聚糖转糖基化酶/水解酶是具有双重活性的酶;它们可以通过转糖基化(XET,甘露聚糖转糖基化酶,木聚糖转糖基化酶)改造各自的半纤维素底物,或水解它们(木葡聚糖酶,内-β-甘露聚糖酶,木聚糖酶)。gydF4y2Ba
GP基因型在整个可脱性发育过程中,果皮和外果皮中XET活性水平较高。PP基因型在整个可脱性发育过程中,果皮组织中XET活性水平较低,而在外皮中,XET活性随着可脱性的发展而增加。然而,外皮的XET活性始终低于GP基因型,在可脱性尚未发育(ND期)和完全可脱性(FD期)时显著低于GP基因型(图3)。gydF4y2Ba7 a、bgydF4y2Ba).高盐(HS)缓冲液释放了大量的XET活性,表明XET主要是细胞壁结合的。gydF4y2Ba
转糖基化酶和水解酶对优质脱皮(GP;白色条状)和剥落不良(PP;黑条)gydF4y2Ba猕猴桃erianthagydF4y2Ba基因型。活性:木葡聚糖转糖基酶(HS提取物)(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba);甘露聚糖transglycosylase(见过;海关提取)(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba);木聚糖transglycosylase (XylET;海关提取)(gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba);木葡聚糖酶(LS提取物)(gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba);内-β-甘露聚糖酶(LS提取物)(gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba);木聚糖酶活性(HS提取物)(gydF4y2BakgydF4y2Ba,gydF4y2BalgydF4y2Ba).LS,低盐;海关、高盐。剥皮阶段:ND,可分离性不发达;DD可拆离性发展;FD,完全可拆卸剥皮。gydF4y2BangydF4y2Ba= 3±标准差。(^)表示同一发育阶段(ND、DD、FD) GP与PP之间的差异有统计学意义。E和J中,(#,##)表示FD与某一基因型内ND (# GP, ## PP)比较有统计学意义。gydF4y2Ba
甘露聚糖转糖基酶活性在LS和HS缓冲液中提取,表明自由可溶性和细胞壁结合的亚型。LS和HS提取物的活性变化趋势相同。数据gydF4y2Ba7 cgydF4y2BaHS提取物中甘露聚糖转糖基酶的测定结果。两种基因型在果皮脱扣发育过程中酶活性相似,而GP基因型在各发育阶段果皮组织中酶活性均显著高于GP基因型。gydF4y2Ba
GP基因型果皮木聚糖转糖基化酶活性在可脱性发生前(ND期)和可脱性发生时(DD期)平均高于PP基因型。在这两种基因型中,果皮木聚糖转糖基化酶活性随着可脱性的发展而增加,并且在完全可脱期两种基因型的木聚糖转糖基化酶活性显著高于ND期(图4)。gydF4y2Ba7 egydF4y2Ba).在外皮中,两种基因型在可脱性发育时期(DD)和完全可脱期(FD)的木聚糖转糖基化酶活性相似。在不可分离期(ND), PP基因型木聚糖转糖基酶活性显著高于GP基因型(图3)。gydF4y2Ba7 fgydF4y2Ba).gydF4y2Ba
LS缓冲液主要提取木葡聚糖酶活性。GP基因型果皮的酶活性在各发育阶段均显著高于PP基因型,在脱脱发育过程中GP基因型果皮酶活性略有下降(图3)。gydF4y2Ba7 ggydF4y2Ba).PP基因型的果皮组织和两种基因型的外果皮在所有发育阶段都表现出较低的活性水平。gydF4y2Ba7小时gydF4y2Ba).gydF4y2Ba
内酯-β-甘露聚糖酶活性主要在LS缓冲液中提取。在果皮组织中,活性较低,在两种基因型中,随着可脱性的发展,活性略有增加(图1)。gydF4y2Ba7我gydF4y2Ba).在外果皮中,GP基因型的内-β-甘露聚糖酶活性高于脱脱性发育;该基因型在完全可脱期(FD)活性显著高于不可脱期(ND)活性。在完全分离阶段,GP基因型的外果皮内-β-甘露聚糖酶活性显著高于PP基因型(图3)。gydF4y2Ba7 jgydF4y2Ba).gydF4y2Ba
HS缓冲液提取木聚糖酶活性。在果皮组织中,木聚糖酶活性在可脱性发育过程中略有增加,在所有发育阶段,两种基因型的木聚糖酶活性相似(图4)。gydF4y2Ba7 kgydF4y2Ba).在外果皮中,GP基因型的木聚糖酶活性在可脱性发育过程中明显高于PP基因型;与PP基因型相比,GP基因型在剥离发生时(DD期)和果皮完全脱落时(FD期)活性显著升高(图2)。gydF4y2Ba7 lgydF4y2Ba).gydF4y2Ba
内do-β-1,4-葡聚糖酶对各种可溶性纤维素底物的活性在两种基因型中均未检测到(见gydF4y2Ba方法部分gydF4y2Ba).gydF4y2Ba
对抗猕猴桃XTH7抗体的Western分析显示,两种基因型的果皮和外皮均有多条条带gydF4y2Ba5gydF4y2Ba:图S4E, F),表明抗体与其他XTH蛋白发生交叉反应。GP基因型的条带强度明显强于PP基因型。对来自猕猴桃的XTH5、木瓜内聚糖酶和番茄种子的内-β-甘露聚糖酶的抗体进行Western分析,未发现XTH5、木聚糖酶或内-β-甘露聚糖酶蛋白在两种基因型中均存在。gydF4y2Ba
讨论gydF4y2Ba
香蕉和柑桔果实的脱落和开裂区以及果皮脱落区具有明显的形态结构特征,可以预测细胞分离发生的位置。的水果gydF4y2Baa . erianthagydF4y2Ba然而,无论是皮肤还是外果皮都没有显示出结构特征,这些特征既不能预测细胞脱落会发生在哪里,也不能预测分离会有多干净。虽然两种基因型的真皮下组织与外果皮组织在结构上有很大的差异,但在整个成熟过程中,真皮下细胞层(加上一些位于下的外果皮细胞层)的粘附仍然相对较强。相反,一旦施加剥离力,剥离发生在外层果皮下方的区域。我们的研究表明,对果皮可剥性发展重要的主要方面是甲基酯化程度的差异、半乳糖损失以及PG和XTH酶的作用,导致了空间上不同的软化区(果皮和果肉),一旦水果变软,这些软化区就可以分离。gydF4y2Ba
免疫定位观察到的果胶HG骨干的差异甲基酯化模式使分离发生的位置明显。在GP基因型中,低酯化HG的JIM5标记在发生脱落的外果皮区真皮下处急剧终止。高酯化HG的JIM7标记在同一区域开始,并进一步延伸到外果皮,而皮下几乎没有标记。在PP基因型中,两种抗体的标记显示出逐渐的变化,并从真皮下深入到外果皮。这些结果表明,在GP基因型中,JIM5和JIM7标记界面的细胞提供了强度上的不连续,从而使果皮脱落,而在PP基因型中,不存在这样的区域。HG是中片的主要成分,因此强烈影响组织中细胞粘附的强度。它以高度甲基酯化的形式沉积在细胞壁中,然后被去酯化[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].相邻的去酯化半乳糖醛酸残基区域可以通过钙交联,从而形成凝胶,促进细胞间粘附,并向组织传递不同的机械特性。模型果胶凝胶的体外分析表明,凝胶的抗压强度、弹性、持水能力以及孔隙度都受到DE和HG结构域的酯化模式的显著影响[gydF4y2Ba37gydF4y2Ba].化学测定的汞在gydF4y2Ba答:erianthagydF4y2Ba在所有发育阶段,两种基因型的果皮和外果皮细胞壁均超过50%,表明两种基因型的HG链都高度酯化。然而,只有标记了JIM7的PP基因型对高甲基化汞有特异性,而GP基因型几乎没有标记。这表明,要么是JIM7的表位特异性不符合GP基因型细胞壁的酯化模式,要么是这些表位被细胞壁掩盖,无法与抗体结合。gydF4y2Ba
Galactans被认为可以改变细胞壁的机械性质。在番茄果实中,在绿色、坚硬的番茄果皮中有丰富的半乳聚糖,但在室胶和表皮及下表皮细胞中没有[gydF4y2Ba33gydF4y2Ba].在豌豆子叶中,它们出现在种子成熟和脱水之前的发育后期。半乳聚糖出现前后的子叶的机械压缩试验表明,有半乳聚糖的子叶的细胞壁比没有检测到半乳聚糖的细胞壁坚固两倍[gydF4y2Ba38gydF4y2Ba].在全科医生gydF4y2Ba答:erianthagydF4y2Ba基因型上,只有外胚层半乳糖苷的标记强度高;PP基因型的标记则遍布于果皮和外果皮。PP基因型细胞壁半乳糖含量显著高于PP基因型。这可能意味着PP基因型的果皮更牢固或更硬,加上该组织的转糖基酶活性更低,可能导致果皮容易破裂或撕裂,而GP基因型的果皮则更有弹性或更灵活[gydF4y2Ba30.gydF4y2Ba].虽然BGal活性高,但两种基因型都没有从细胞壁失去大量的半乳糖,而可分离性发展。在番茄中,整个BGal基因家族的异构体可能是在猕猴桃中观察到的半乳聚糖协同降解的原因。在gydF4y2Ba答:erianthagydF4y2Ba与番茄一样,BGal的几种异构体在果实生长和成熟过程中可能起着不同的作用。在番茄中,只有在发育早期出现的BGal亚型(TBG6亚型)受到抑制,才会对番茄的果皮结构产生重大影响,导致果皮严重开裂[gydF4y2Ba39gydF4y2Ba];与野生型相比,只有在果实发育过程中细胞壁半乳糖含量和果实硬度较低,而在果实成熟后则没有变化。gydF4y2Ba
在gydF4y2Ba答:erianthagydF4y2Ba分离发育过程中细胞壁成分变化不大。然而,酶活性的差异被观察到,指出不同的软化果皮和外层果皮组织是发展剥皮的主要因素。GP基因型表现为高表达gydF4y2BaPGC1gydF4y2Ba而且gydF4y2BaPGC2gydF4y2Ba在发育过程中,PP基因型比PP基因型多,但不表现出PG活性。为了检测GP基因型的PG基因是否有突变,我们从两种基因的外果皮组织中都获得了两个全长PG基因gydF4y2Ba答:erianthagydF4y2Ba基因型及其序列比较(见附加文件gydF4y2Ba3.gydF4y2Ba:方法表S1)。第一个基因gydF4y2BaPGC1gydF4y2Ba(GenBank KY496689),与此前从成熟植物中分离到的部分PG基因具有较高的同源性(> 98%氨基酸同源性)gydF4y2Ba答:对gydF4y2Bavar。gydF4y2Ba对gydF4y2Ba水果(AF152756) [gydF4y2Ba40gydF4y2Ba].第二个基因,gydF4y2BaPGC2gydF4y2Ba(KY496690),氨基酸同源性约为75%gydF4y2BaPGC1gydF4y2Ba.对这两个基因型的全长PG序列的测序显示,没有出现导致GP基因型中无功能蛋白的帧移或其他突变。gydF4y2Ba
由于PG活性仅在PP基因型中检测到,果胶域中与酶相关的HG分解可能导致果皮和外果皮的局部软化和弱化。这可能解释了这种基因型的皮肤弹性较低的原因[gydF4y2Ba30.gydF4y2Ba]以及这种组织脱离后容易撕裂和碎裂。凝胶强度和最终细胞粘附受汞链长度的影响。汞链越长,凝胶越强,无论是在低DE时通过钙交联,还是在高DE时通过疏水相互作用[gydF4y2Ba37gydF4y2Ba].因此,在GP基因型中,果皮和外果皮细胞壁形成的HG凝胶可能比PP基因型更强,因为该基因型中缺乏PG活性,因此可以保持高分子量范围的HG链。在“香蕉手指脱落”中也可以看到不同程度的软化,即香蕉成熟后从树冠脱落。手指掉落频繁的基因型与果实很少脱落的基因型相比,在破裂区附近的果蒂组织中,水溶性果胶水平较高,cdta可溶性果胶水平较低,PG和果胶裂解酶活性较高。因此,我们得出的结论是,由于PG介导的细胞壁果胶域的显著变化,导致该组织区域的局部软化和弱化,而其他区域(正常软化变化除外)未受影响[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].gydF4y2Ba
在gydF4y2Baa . erianthagydF4y2BaGP基因型脱皮组织中转糖基化酶活性显著高于PP基因型,且2个XTH基因几乎只在该组织中表达。在GP基因型的果皮细胞壁中,通过转糖基化酶重新排列半纤维素,可以确保组织在完全剥落时保持强大,但也更灵活和有弹性,因此果皮可能更少撕裂。相应的,PP基因型中较低的转糖基化酶活性可能导致皮肤较弱,容易撕裂。据报道,转糖基化酶活性在其他水果的最外层组织中发挥作用。Thompson等人,[gydF4y2Ba44gydF4y2Ba]报告了XET在发育中的番茄表皮细胞壁中的重要性,发现XET活性与果实的相对膨胀率成正比,直到生长停止。Johnston等人,[gydF4y2Ba45gydF4y2Ba]发现苹果皮中木聚糖转糖基化酶活性水平高于皮层组织,Schröder等,[gydF4y2Ba46gydF4y2Ba报道称,甘露聚糖转糖基酶在番茄皮中的活性最高。gydF4y2Ba
两种基因型的外果皮也存在木葡聚糖转糖基化酶活性,并且随着PP基因型脱离的发展而增加。这些活动可能反映了主要与软化相关的变化,因为在软化过程中发现了外皮组织中XET活性的增加gydF4y2Ba答:对gydF4y2BavargydF4y2Ba.deliciosagydF4y2Ba[gydF4y2Ba47gydF4y2Ba二。gydF4y2Ba答:对gydF4y2Bavar。gydF4y2Ba对gydF4y2Ba基因型(gydF4y2Ba48gydF4y2Ba],猕猴桃品种,不可剥皮。在gydF4y2Ba答:erianthagydF4y2Ba,此XET活动可能与gydF4y2BaXTH7gydF4y2Ba,因为只有这个基因在两种基因型的外果皮高度表达。gydF4y2Ba
外果皮中木葡聚糖酶、内β-甘露聚糖酶和木聚糖酶活性均显著高于外果皮。随着分离的发展,外果皮内do-β-甘露聚糖酶和木聚糖酶活性似乎增加,这在GP基因型中发生的比在PP基因型中更早。这些半纤维素在GP基因型的外果皮中的更高级水解可能有助于细胞分离和果皮从外果皮分离。Chanliaud等人,[gydF4y2Ba49gydF4y2Ba研究发现,利用纤维素和木葡聚糖制成的细胞壁复合材料,对转糖基化酶和水解酶有很强的互补机械效应。在该体系中,纤维素与木葡聚糖的广泛交联导致了比单独使用纤维素更弱、更不硬、更可扩展的结构[gydF4y2Ba50gydF4y2Ba].木葡聚糖酶的处理降解了大部分表面纤维素结合和交联的木葡聚糖,由此产生的复合材料变得更硬更强,包括蠕变行为的减少,从而提供了水解酶对细胞壁有强化作用的证据。木葡聚糖转糖基酶活性对复合材料有补充作用,因为它增加了其分子重排的能力,通过蠕变测量。由此得出,木葡聚糖酶和XET作用可以增加木葡聚糖/纤维素网络的强度(水解酶)或增强粘弹性(转糖基化酶)gydF4y2Ba在murogydF4y2Ba[gydF4y2Ba49gydF4y2Ba].在我们的研究中,GP基因型的果皮比PP基因型具有更高的木葡聚糖酶和XET活性。我们可以推测,在削皮过程中,木葡聚糖酶的活性可能是在强化组织以防止断裂,而XET介导的GP基因型果皮组织中木葡聚糖的重排导致了果皮组织的更高柔韧性。这样的效应是否也对水解酶和转糖基酶作用于细胞壁中的甘露聚糖和木聚糖起作用仍有待确定。gydF4y2Ba
结论gydF4y2Ba
一种新的细胞分离机制已经发现在猕猴桃在没有一个形态上可识别的脱落区,使水果可剥皮。通过对两种密切相关的基因型进行对比分离行为的研究,利用免疫定位、基因表达分析和酶活性分析,确定了细胞壁特征在分离发展中的重要作用。不同基因型间的差异主要表现在甲基酯化程度、半乳糖损失程度以及PG和XTH酶的作用。果皮组织中的木葡聚糖-、甘露聚糖-和木聚糖转糖基酶活性高于果肉,确保了果皮组织在剥离过程中保持强大,但也更灵活和有弹性。这些发现扩大了这些酶活动的任务,从参与细胞扩张到参与确定植物组织的机械性质。这些结果为进一步研究转糖基化酶在其他植物表面组织中的作用提供了方向。gydF4y2Ba
方法gydF4y2Ba
水果材料gydF4y2Ba
水果的gydF4y2Ba答:erianthagydF4y2BaBenth。GP和PP基因型是在新西兰特普克的植物与食品研究中心种植的。这两种基因型是1997年从新西兰两代育苗藤本中筛选出的,分别于1991年和1994年进行杂交。用于育种的原始亲本来自于三种从中国引进新西兰的种子:1976年,福建大学李来勇教授赠予;1981年和1988年,广西植物研究所梁秋芬教授授奖。gydF4y2Ba
每个基因型150个果实从大约10年生的多年生藤蔓上收获,硬度为60 N,在不添加外源乙烯的情况下在20°C成熟。对于硬度测量,使用手术刀从水果上取下薄层皮肤,并以4毫米秒的速度将直径为2.5毫米的平头探针插入果肉中测量硬度(Instron Model 4301, Canton, MA)gydF4y2Ba−1gydF4y2Ba.根据GP基因型的剥皮行为,分三个阶段对果皮和果皮组织进行取样:在水果可剥皮前(不可分离的‘ND’;12到16 N);当水果开始剥皮时(可分离性发展为“DD”,特征是果皮成片脱落,但很容易撕裂;9 - 11 N);当水果完全去皮(完全可拆卸的' FD ';4 - 7 N)。gydF4y2Ba
每个发育阶段收集约30个果实组织。取果皮,先去毛,再去皮(约0.4 mm),然后用手术刀取邻近的果皮组织(约1 mm)。将组织切成小块,立即在液氮中冷冻gydF4y2Ba2gydF4y2Ba作为散装样品,并保存在−80°C。从两个季节的果实中采集发育系列;细胞壁分析使用两个季节的果实材料,基因表达和酶活性分析使用一个季节的果实材料。gydF4y2Ba
光镜和免疫标记gydF4y2Ba
为了定位细胞脱落,使用Instron(型号4301)去除有划痕的皮肤条[gydF4y2Ba30.gydF4y2Ba].在0.1 M磷酸盐缓冲液(pH 7.2)中用4%甲醛固定剥皮片段,在缓冲液中洗涤,并用两片覆盖层隔开的安全刀片按与剥皮平行的方向手工切片。将片段安装在缓冲液中,使用Vanox显微镜和Leica FLZIII立体荧光显微镜(Leica显微系统有限公司,Heerbrugg,瑞士)观察,使用尼康Coopix 995数码相机(尼康公司,东京,日本)收集图像。gydF4y2Ba
在脱皮发育的每个阶段,从5个果实上取组织块,包括表皮和下外皮,固定在2%多聚甲醛和0.1%戊二醛的0.1 M磷酸盐缓冲液(pH 7.2)中(免疫标记),或在2%多聚甲醛和2.5%戊二醛的0.1 M磷酸盐缓冲液中(结构观察)。样品真空保存1 h,然后立即处理或在4℃固定液中保存12-18 h。观察材料嵌入LR White Resin (London Resin Co., Reading, UK)。组织在缓冲液中洗涤三次,然后在乙醇系列(20%、30%、50%、70%、90%、100% ×3)中脱水,每一步搅拌15 - 20分钟。然后用乙醇和树脂1:1混合浸泡组织过夜,然后用纯树脂进行三次更换,持续36小时,然后在密封的模具中嵌入树脂,在60°C温度下聚合过夜(约18小时)进行结构观察,在55°C温度下进行免疫标记。gydF4y2Ba
用0.05%甲苯胺蓝O溶液在pH 4.4(0.125%)的苯甲酸缓冲液中染色,对1 μm树脂包埋材料进行结构观察gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba苯甲酸,0.145%gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba苯甲酸钠在水中)。切片被风干,安装在Shurmount(三角生物医学科学,Durham, NC,美国),并使用奥林巴斯Vanox AHBT3显微镜(奥林巴斯光学有限公司,东京,日本)观察。用Photometrics CoolSnap数码相机(Roper Scientific Ltd., Tucson, AZ, USA)收集图像。gydF4y2Ba
利用抗体JIM5、JIM7和LM5 (PlantProbes, Leeds, UK)在0.4 μm厚的树脂包埋组织切片上进行免疫标记[gydF4y2Ba51gydF4y2Ba].切片用PBS-T(磷酸盐缓冲盐水加0.1%吐温80)预处理,然后用0.1%牛血清白蛋白(BSA-c;Aurion, Wageningen,荷兰)在PBS-T中15分钟作为阻断剂。切片置于PBS-T中0.1% BSA-c稀释的适当抗体(JIM5和JIM7 1:10)中孵育gydF4y2BavgydF4y2Ba/ v, LM5 1:200gydF4y2BavgydF4y2Ba/v)置于4°C的潮湿室内过夜。用2-3 mL PBS- t洗涤载玻片,切片在室温潮湿的室内孵育1小时,用山羊抗大鼠二抗偶联Alexa™488荧光探针(Invitrogen, Carlsbad, CA, USA)稀释1:600的PBS溶液。切片用2-3 mL PBS-T洗涤,再用2-3 mL超纯水冲洗,晾干后置于Citifluor中。用Vanox显微镜观察材料,用CoolSnap相机对每个抗体使用固定的曝光时间收集图像。gydF4y2Ba
细胞壁材料的提取与分析gydF4y2Ba
利用采自两个季节的果实材料制备细胞壁材料。用乙醇(最终浓度75%)提取约10 g冷冻组织gydF4y2BavgydF4y2Ba/v),用polytron均匀化2分钟。离心(15分钟,4°C, 3000 xgydF4y2BaggydF4y2Ba)时,上清液被丢弃。不溶性微球在乙醇中重悬三次(90%)gydF4y2BavgydF4y2Ba/v)随后三次在丙酮中使用polytron。样品在洗涤液之间离心,丢弃上清液。最后的颗粒悬浮在水中冷冻干燥。因为水果成熟了,不需要去除淀粉。gydF4y2Ba
每个发育阶段、组织和基因型的中性单糖含量是通过水解两个不同季节的两个样品(gydF4y2BangydF4y2Ba= 4)在2 M三氟乙酸中121°C下1小时,然后将单糖衍生为糖醇乙酸酯[gydF4y2Ba52gydF4y2Ba].以肌醇为内标,气液色谱法分离乙酸糖醇。每个样品(1 μL)进样惠普6860气相色谱系统,该系统配备熔凝硅胶毛细管柱[(30 m × 0.25 mm × 0.2 μm) SP-2380, Supelco],保持在120°C,并配备240°C的火焰电离检测器(FID)。样品注射后,温度保持2分钟,每分钟提高10°C至240°C,再保持35分钟,使用NgydF4y2Ba2gydF4y2Ba作为载气。每个样品进行两次注射。通过比较各单糖标准品的滞留时间和使用Chemstation (Agilent)计算每μL注射样品的数量,对细胞壁单糖进行鉴定和定量。gydF4y2Ba
用96%硫酸水解细胞壁材料测定糖醛酸[gydF4y2Ba53gydF4y2Ba],并使用Blumenkrantz等人的方法用比色反应进行定量,[gydF4y2Ba54gydF4y2Ba]以半乳糖醛酸为标准。每个发育阶段、组织和基因型的UA含量通过水解两个不同季节的两个样品(gydF4y2BangydF4y2Ba= 4),显色反应,每个样品技术重复3次。gydF4y2Ba
果胶皂化后的甲醇气相色谱定量测定果胶甲酯化(DE)的程度,如Ng等人所述[gydF4y2Ba55gydF4y2Ba],并以甲醇与糖醛酸的摩尔比计算。每个发育阶段、组织和基因型的DE使用两个不同季节的每个季节的两个样本(gydF4y2BangydF4y2Ba= 4),每个样品3次技术重复。gydF4y2Ba
基因表达分析gydF4y2Ba
从猕猴桃组织中提取总RNA,方法参考Chang等[gydF4y2Ba56gydF4y2Ba],用RQ1 DNase I (1 μL;Promega)去除污染的基因组DNA。RNA浓度使用NanoDrop®ND-2000紫外可见分光光度计(NanoDrop Technologies, Thermo Scientific, USA)在260 nm处测量。用dnase处理过的RNA (2 μg),用Superscript III (Invitrogen)合成第一链cDNA, oligo d(T)20,总体积为20 μl。将cDNA用水稀释1:10,取2 μL作为模板进行RT-qPCR分析。在ABI 7500序列检测系统(Applied Biosystems)上进行4个重复反应,总体积为10 μL,每个引物5 μM, 2× SYBR Green PCR Master Mix (Applied Biosystems) 10 μL。引物序列列在附加文件中gydF4y2Ba3.gydF4y2BaS1:表。qPCR程序包括初始步骤,94°C 10 min, 94°C 15 s, 60°C 1 min, 40个循环。每个循环中都包含每对引物的无模板对照。以猕猴桃肌动蛋白为内参基因[gydF4y2Ba57gydF4y2Ba].gydF4y2Ba
酶提取gydF4y2Ba
从冷冻组织(0.5 g)中提取木葡聚糖转糖基化酶、木葡聚糖酶、木聚糖酶、甘露聚糖转糖基化酶、endo-ß-甘露聚糖酶和BGal,用50mg聚乙烯基聚吡啶在N液中研磨gydF4y2Ba2gydF4y2Ba用研钵和杵。蛋白质提取采用低盐(LS) -高盐(HS)方法,LS缓冲液提取自由溶蛋白,HS缓冲液提取与细胞壁结合的蛋白。用1ml LS缓冲液(50 mM NaCl, 10 mM二硫苏糖醇,4.9 mM四硫酸钾,0.2 M醋酸钠,pH 4.7)提取研磨组织,解冻后涡旋悬浮,离心(11000 xgydF4y2BaggydF4y2Ba在4°C下离心10分钟)。将颗粒在LS缓冲液(0.5 mL)中进行涡旋重悬,然后离心。将剩余的不溶性物质在1ml HS缓冲液(0.6 M NaCl, 10 mM二硫苏糖醇,2.4 mM四硫酸钾,0.3 M MES pH 6.0)中涡旋悬浮,冰上放置30分钟,离心。将颗粒在0.5 mL HS缓冲液中涡旋重悬,置于冰上20分钟后离心。gydF4y2Ba
从0.2 g细磨组织中提取木聚糖转糖基化酶,使用1 mL缓冲液,其中包含0.1 M MES, 1.3 M NaCl, 0.2 M EDTA和蛋白酶抑制剂(Complete™,Roche), pH 5.5 [gydF4y2Ba45gydF4y2Ba].在冰上融化后,将提取液混合,在冰上放置45分钟,然后离心。gydF4y2Ba
如上所述,使用LS缓冲液提取PG活性。在初步实验中,使用HS缓冲液(1.7 M NaCl, 10 mM二硫舒糖醇,13 mM EDTA酸,0.3 M MES pH 6)对LS提取后的颗粒进行二次提取,但即使使用微浓缩器(Vivaspin 500;分子量截断30kda, GE)。gydF4y2Ba
所有上清液被回收并适当组合,确定体积,并保存在冰中,直到测定其活性。gydF4y2Ba
酶化验gydF4y2Ba
初步实验使用不同的测定ph值,提取体积和测定时间,以确保所有酶测定的线性。最后的测定在最佳pH、体积和时间下进行,提取来自一个季节的大块组织(每个发育阶段约30个果实)的至少3个提取物,每个测定有3至5个技术重复,包括适当的对照。gydF4y2Ba
Transglycosylase化验gydF4y2Ba
转糖基酶通过其吸附[gydF4y2Ba3.gydF4y2BaH]寡糖底物转化为多糖底物。按照Schröder等人的描述,对XET进行了测定和酶活性定量。[gydF4y2Ba58gydF4y2Ba],甘露聚糖转糖基化酶测定如Schröder等所述,[gydF4y2Ba46gydF4y2Ba],以及Johnston等人所描述的木聚糖转糖基化酶测定,[gydF4y2Ba45gydF4y2Ba].转糖基酶活性以每g鲜重每h提供的放射性低聚糖与高分子产物结合的放射性Bq计算。gydF4y2Ba
木葡聚糖酶和PG测定gydF4y2Ba
凝胶扩散法测定木葡聚糖酶和PG活性。对于平板制备,底物罗望子木葡聚糖(Megazyme;0.1%gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)用于木葡聚糖酶测定,或聚半乳糖醛酸(Sigma;0.1%gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)与琼脂糖(Sigma;1%gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)和明胶(25 μg mLgydF4y2Ba−1gydF4y2Ba)溶解于pH 5 (0.2 M NagydF4y2Ba2gydF4y2BaHPOgydF4y2Ba3.gydF4y2Ba, 0.1 M柠檬酸)煮沸。溶液保存在75°C,每培养皿(直径100毫米)吸液4.5 mL。放置(1小时)后,将培养皿置于4°C至少2小时或过夜,使凝胶凝固。用软木钻孔机(木葡聚糖酶直径3.7 mm, PG直径2 mm)在凝胶上钻孔,间隔15 mm,离边缘15 mm。gydF4y2Ba答:erianthagydF4y2Ba分别插入木葡聚糖酶提取液(2 μL)和PG提取液(6 μL),设3个重复。阴性对照为缓冲液和热失活(10 min, 100℃)酶提取物。将提取物扩散到凝胶中后,覆盖培养皿,用Parafilm®密封,倒置,在28°C孵育20小时。gydF4y2Ba
木糖葡聚糖酶板在McIlvaine缓冲液中洗涤30分钟,用刚果红(Sigma;0.2%gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba凝胶分别在水(2分钟)、96%乙醇(10分钟)中洗涤,然后更换三次McIlvaine缓冲液(每次20分钟)。在1 M NaCl中至少2小时后,颜色发展为深粉紫色,至少有3次变化。PG板用10ml钌红(Fluka;0.05%gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba在水中)30分钟至深粉红色,然后用水去色素,直到出现光晕。gydF4y2Ba
为了定量PG和木葡聚糖酶的活性,制备了标准曲线。为定量木葡聚糖酶活性,纤维素内酶来自gydF4y2Ba木霉属longibrachiatumgydF4y2Ba(EC 3.2.1.4;在LS或HS中制备1u - 0.01 U稀释的Megazyme),用于定量PG、endo-PGgydF4y2Ba曲霉属真菌aculeatusgydF4y2Ba(Megazyme), 0.1, 1.0, 2.5, 5.0, 7.5和10.0 mU mL的稀释gydF4y2Ba−1gydF4y2Ba在LS缓冲区。按照上述方法进行凝胶扩散试验。gydF4y2Ba
酶活性在底物被水解的孔周围被认为是无色到苍白的圆圈。为了测量圆的直径,对凝胶进行拍照,对清除区域的直径进行数字测量(Microsoft Paint软件,Microsoft Corporation, USA),并计算平均径向间隙。通过比较清除直径与已知浓度的木葡聚糖酶或PG标准,计算酶活性,以每g鲜重U表示。gydF4y2Ba
内酯-β-甘露聚糖酶和木聚糖酶活性gydF4y2Ba
将azcl -半乳甘露聚糖和azcl -木聚糖底物(Megazyme)悬浮在0.3 M MES pH 5.8 (5 mg mL)中gydF4y2Ba−1gydF4y2Ba).蛋白提取液20 μL,取100 μL底物,28℃孵育过夜,重复3次反应。孵育后,加入3% Tris溶液(150 μL, un-pHed)停止测定,并在11000 x下离心10分钟gydF4y2BaggydF4y2Ba).上清液(150 μL)转移到微量滴定板上,在590nm处测定吸光度。对于背景反应,在酶提取前添加Tris,并从使用活性酶提取得到的值减去值。酶活性以每克鲜重590 nm的相对OD值表示。gydF4y2Ba
β牛乳糖化验gydF4y2Ba
在96孔微滴板中,1 M醋酸钠缓冲液pH 4.6 20 μL,水15 μL, LS或HS提取液20 μL,以2 mg mL的溶液10 μL作为起始反应gydF4y2Ba−1gydF4y2BapgydF4y2Ba-nitrophenyl -β-D-galactopyranoside衬底(σ)。28°C孵育1 h, 20 mM Na 80 μL终止反应gydF4y2Ba2gydF4y2Ba有限公司gydF4y2Ba3.gydF4y2Ba.吸光度为415 nm,酶活性报告为molgydF4y2BapgydF4y2Ba-硝基酚释放每小时每克新鲜重量使用标准曲线构建gydF4y2BapgydF4y2BaLS或HS提取缓冲液中-硝基酚的含量范围为0.01 ~ 0.20 M。gydF4y2Ba
β1,4-Endoglucanase活动gydF4y2Ba
按照制造商的说明制备偶氮-α-纤维素、偶氮-avicel、azcl - mc -纤维素和偶氮- cm -纤维素(Megazyme)作为底物,并在三种不同的ph(4.7、5.3和5.8)下用LS和HS提取物(如上所述制备XET)进行测定。分析中的显色是根据制造商的说明进行测量的。gydF4y2Ba
Western blotting和抗体生成gydF4y2Ba
用0.5 mL提取缓冲液(0.1 M Bis Tris, 2 M甘油,0.3 M十二烷基硫酸钠,0.2 M二硫苏糖醇,0.01%亮蓝G)煮沸100 mg细碎组织,提取总蛋白gydF4y2BaggydF4y2Ba),将上清(10 μL)加载到蛋白凝胶上。蛋白凝胶电泳、western blotting和染色如前所述[gydF4y2Ba59gydF4y2Ba],利用抗木瓜木聚糖酶的多克隆抗体[gydF4y2Ba60gydF4y2Ba],从番茄种子中提取内酯-β-甘露聚糖酶[gydF4y2Ba61gydF4y2Ba,聚半乳糖醛酸酶MdPG1 [gydF4y2Ba62gydF4y2Ba]和β-半乳糖苷酶,猕猴桃木葡聚糖内切糖苷酶XTH5和XTH7,扩展蛋白EXP3和果胶裂解酶PL1。Western印迹用高分辨率扫描仪扫描。gydF4y2Ba
将β-gal、XTH5、XTH7、EXP3和PL1抗体扩增成重组n端his标记蛋白,用Ni纯化表达gydF4y2Ba2+gydF4y2Ba根据制造商说明,变性条件下的亲和层析(GE医疗保健)。用纯化的不溶性重组蛋白(~500 μg)培养兔多克隆抗体(AgResearch, NZ)。gydF4y2Ba
统计分析gydF4y2Ba
采用' R ' version 3.3.2进行方差分析(ANOVA),以确定基因型(GP, PP)、分离阶段(ND, DD, FD)和组织类型(外皮,果皮)的自变量是否对本文提出的酶或细胞壁变量有显著影响。在方差分析中被发现具有显著影响的自变量然后接受事后的杜克诚实显著性差异检验,以确定哪些两两比较显示显著性(gydF4y2BapgydF4y2Ba值< 0.05)的变化。基因表达数据的统计分析同样使用' R '版本3.3.2进行。自变量分别为基因型(GP、PP)、脱离阶段(ND、DD、FD)和组织型(外皮、果皮),分别进行学生t检验。为了简化这个分析,有意义的(gydF4y2BapgydF4y2Ba值<0.05),表达变化仅在每个基因表达集内确定。gydF4y2Ba
缩写gydF4y2Ba
- BGal:gydF4y2Ba
-
β牛乳糖gydF4y2Ba
- 德:gydF4y2Ba
-
methylesterification度gydF4y2Ba
- EGase:gydF4y2Ba
-
Endo -β1,4-glucanasegydF4y2Ba
- 经验值:gydF4y2Ba
-
棒曲霉素gydF4y2Ba
- 医生:gydF4y2Ba
-
Good-peeling基因型gydF4y2Ba
- HG:gydF4y2Ba
-
HomogalacturonangydF4y2Ba
- 海关:gydF4y2Ba
-
高盐缓冲gydF4y2Ba
- LS:gydF4y2Ba
-
低盐缓冲gydF4y2Ba
- 答:gydF4y2Ba
-
Endo -α1,4-polygalacturonasegydF4y2Ba
- 页:gydF4y2Ba
-
Poor-peeling基因型gydF4y2Ba
- RT-qPCR:gydF4y2Ba
-
逆转录酶定量PCRgydF4y2Ba
- XET:gydF4y2Ba
-
Xyloglucan transglycosylasegydF4y2Ba
- XTH:gydF4y2Ba
-
Xyloglucan transglycosylase /水解酶gydF4y2Ba
参考文献gydF4y2Ba
Jarvis MC, Briggs SPH, Knox JP。植物细胞间粘附和细胞分离。植物细胞环境。2003;26:977-89。gydF4y2Ba
作者简介:黄晓明,黄晓明。植物的细胞分离过程-模型、机制和操作。年报机器人。2000;86:223-35。gydF4y2Ba
罗伯茨JA,埃利奥特KA,冈萨雷斯-卡兰萨ZH。分裂:脱落、裂开和其它细胞分离过程《植物学报》2002;5(3):329 - 331。gydF4y2Ba
塞克斯顿R,罗伯茨JA。脱落的细胞生物学。植物生理学。1982;33:133-62。gydF4y2Ba
塔克ML,塞克斯顿R,德尔坎皮略E,刘易斯LN。大豆脱落纤维素酶:一个cDNA克隆的特性及乙烯和生长素对基因表达的调控。植物杂志。1988;88:1257 - 62。gydF4y2Ba
Taylor JE, Coupe SA, Picton SJ, Roberts JA。植物小叶脱落相关β -1,4-葡聚糖酶mRNA的特征和积累模式gydF4y2BaSambucus黑质gydF4y2Ba.植物化学。1994;24:961-4。gydF4y2Ba
2个不同的内-β-1,4-葡聚糖酶基因在果实成熟和花脱落过程中表现出重叠表达。植物细胞。1994;6:1485 - 93。gydF4y2Ba
李志强,李志强,李志强,等。纤维素酶在辣椒植株中的表达。植物化学。1995;29:735 - 739。gydF4y2Ba
塞克斯顿R,德宾ML,刘易斯LN,汤姆森WW。利用纤维素抗体研究叶片脱落。大自然。1980;283:873-4。gydF4y2Ba
Bonghi CN, Rascio A, Ramina A, Casadoro G.纤维素酶和聚半乳糖醛酸酶参与桃叶片和果实外植体脱落。植物化学学报1992;20(3):329 - 331。gydF4y2Ba
Webb STJ, Taylor JE, Coupe SA, Ferrarese L, Roberts JA。乙烯处理的β-1,4葡聚糖酶的纯化gydF4y2BaSambucus黑质gydF4y2Ba.植物细胞环境。1993;16:329-33。gydF4y2Ba
Tucker GA, Schindler CB, Roberts JA。突变番茄植株的花脱落。足底。1984;160:164-7。gydF4y2Ba
Taylor JE, Tucker GA, Lasslett Y, Smith CJS, Arnold CM, Watson CF, Schuch W, Grierson D, Roberts JA。转基因和正常番茄叶片脱落过程中聚半乳糖醛酸酶的表达。足底。1990;183:133-8。gydF4y2Ba
泰勒JE,韦伯STJ, Coupe SA,塔克GA,罗伯茨JA。乙烯刺激叶片脱落过程中聚半乳糖醛酸酶活性和聚醛酸酯溶解度的变化gydF4y2BaSambucus黑质gydF4y2Ba.J Exp Bot. 1993; 258:93-8。gydF4y2Ba
Atkinson RG, Schröder R, Hallett IC, Cohen D, MacRae EA.在转基因苹果树中过表达聚半乳糖醛酸酶会导致一系列涉及细胞粘附变化的新表型。植物杂志。2002;129:122-33。gydF4y2Ba
小川M,凯P,威尔逊S,斯温SM。拟南芥裂带聚半乳糖醛酸酶(gydF4y2BaADPG1gydF4y2Ba),gydF4y2BaADPG2gydF4y2Ba,gydF4y2BaQUARTET2gydF4y2Ba多半乳糖醛酸酶是生殖发育中细胞分离所必需的吗gydF4y2Ba拟南芥gydF4y2Ba.植物细胞。2009;21:216-33。gydF4y2Ba
贝恩JM。“瓦伦西亚”橙果实发育过程中的形态、解剖和生理变化(gydF4y2Ba素类gydF4y2Ba(l)等)。Am J Bot. 1958; 6:1-24。gydF4y2Ba
田文华,田文华。柑橘果皮膨化的研究2。细胞的变化。果皮发育过程中的形态和纤维素酶活性。中国生物医学杂志1975;44:7-14。gydF4y2Ba
黄秋梅,黄秋梅,黄秋梅,等。柑橘果实发育过程中反照率和黄秋梅细胞生长相关基因mrna水平的变化。植物学报2000;19:582-7。gydF4y2Ba
Kheng TY, Ding P, Rahman NA。香蕉物理和细胞结构的变化(gydF4y2Ba穆萨gydF4y2BaAAB)在生长发育过程中。Sci Hortic。2011;129:382-9。gydF4y2Ba
史密斯·NJS,塔克·GA,耶格·MJ。香蕉和大蕉细胞壁软化和变化。应用生物学报1989;20:57-65。gydF4y2Ba
成熟香蕉细胞壁降解酶与软化作用。泰国j·阿格利司。Sci。2003;36:233-42。gydF4y2Ba
Marín-Rodríguez MC, Smith DL, Manning K, Orchard J, Seymour GB。香蕉果实果胶裂解酶基因表达及酶活性研究。植物化学。2003;21(1):59 - 63。gydF4y2Ba
陆文杰,中野荣,久保勇,稻叶A,蒋彦明。香蕉果实成熟软化果皮和果肉中XET cDNA的克隆与表达分析。植物学报。2004;46:355-62。gydF4y2Ba
Domínguez-Puigjaner E, Llop I, Vendrell M, Prat S.一个在成熟香蕉果实中高度表达的cDNA克隆与果胶裂解酶具有同源性。植物杂志。1997;114:1071-6。gydF4y2Ba
Drury R, Hörtensteiner S, Donnison I, Bird CR, Seymour GB。香蕉成熟果皮叶绿素分解代谢及基因表达。杂志。1999;107:32-8。gydF4y2Ba
Tiré C, De Rycke R, De Loose M, Inzé D, Van Montagu M, Engler G. Extensin基因表达通过机械刺激诱导局部细胞壁增强gydF4y2Ba烟草plumbaginifoliagydF4y2Ba.足底。1994;195:175 - 81。gydF4y2Ba
Atkinson RG, Sharma NN, Hallett IC, Johnston SL, Schröder R。gydF4y2Ba猕猴桃erianthagydF4y2Ba:一种新的去皮性和健康性状的猕猴桃育种亲本。浙江大学学报(自然科学版)2009;39:207-16。gydF4y2Ba
Hallett IC, Sutherland PW。猕猴桃皮。水果的天然包装。Acta Hortic。2007;753:89 - 96。gydF4y2Ba
海勒特IC,白A,海豹AG。本属水果剥皮性的测定gydF4y2Ba猕猴桃gydF4y2Ba.J纹理螺柱。2011;42:237-46。gydF4y2Ba
Hallett IC, MacRae EA, Wegrzyn TF。采后成熟过程中猕猴桃细胞壁超微结构与细胞包装的变化。中国植物学报(英文版)1992;gydF4y2Ba
verhertbrugen Y, Marcus SE, Haeger A, ordazs - ortiz JJ, Knox JP。果胶同半乳糖醛酸单克隆抗体的扩展。Carbohydr杂志2009;344:1858 - 62。gydF4y2Ba
琼斯L,西摩GB,诺克斯JP。利用特异于(1→4)-β- d -半乳糖的单克隆抗体定位番茄细胞壁中的果胶半乳糖。植物杂志。1997;113:1405-12。gydF4y2Ba
Atkinson RG, Gunaseelan K, Wang MY, Luo LK, Wang TC, Norling CL, Johnston SL, Maddumage R, Schröder R, Schaffer RJ。更年期乙烯在猕猴桃中的作用解剖(gydF4y2Ba猕猴桃对gydF4y2Ba)使用1-氨基环丙烷-1-羧酸氧化酶敲除线催熟。中国生物医学工程学报。2011;62:3821-35。gydF4y2Ba
黄晓明,黄晓明,黄晓明,夏尔宁,Schröder R.猕猴桃和苹果木葡聚糖内转糖苷酶/水解酶(XTH)基因家族分析。采后生物技术。2009;51:149-57。gydF4y2Ba
李志强,李志强,李志强,李志强,等。表达序列标签的分析gydF4y2Ba猕猴桃gydF4y2Ba:跨物种EST数据库的应用,以发现风味、健康、颜色和成熟领域的基因。BMC基因组学。2008;9:351。gydF4y2Ba
Willats WGT、Orfila C、Limberg G、Buchholti HC、van Alebeek G- jwm、Voragen AGJ、Marcus SE、Christensen TMIE、Mikkelsen JD、Murray BS、Knox JP。植物细胞壁中果胶同半乳糖醛酸甲酯化程度和模式的调节。果胶甲酯酶的作用,基质性质和细胞粘附的意义。生物化学。2001;276:19404-13。gydF4y2Ba
麦卡特尼L,奥默罗德AP,吉德利MJ,诺克斯JP。豌豆子叶发育细胞壁中果胶(1→4)- β - d -半乳糖苷的时空调控:对力学性质的影响植物j . 2000; 22:105-13。gydF4y2Ba
motezuma E, Smith DL, Gross KC.反义抑制一个β-半乳糖苷酶基因(TBG6)增加番茄果实开裂。中国生物医学工程学报2003;54:2025-33。gydF4y2Ba
王志勇,MacRae EA, Wright MA, Bolitho KM, Ross GS, Atkinson RG。猕猴桃聚半乳糖醛酸酶基因表达与果实软化及乙烯产生的关系。植物化学。2000;42:317 - 327。gydF4y2Ba
Imsabai W, Ketsa S, van Doorn WG。香蕉成熟过程中的生理生化变化及手指掉落。生物技术。2006;39:211-6。gydF4y2Ba
香蕉成熟过程中手指掉落的结构和生化变化。中国农业科学。2007;30(4):357 - 357。gydF4y2Ba
Mbéguié-A-Mbéguié D, Hubert O, Baurens FC, Matsumoto T, Chillet M, Fils-Lycaon B, Sidibé-bocs S.香蕉果实成熟过程中细胞壁修饰基因的表达模式及其与手指下垂的关系。中国生物医学工程学报。2009;60:2021-34。gydF4y2Ba
邓文忠DS,王伟杰,何lc。表皮细胞壁酶对番茄果实生长的调控。植物细胞环境。1998;21:589-99。gydF4y2Ba
Johnston SL, Prakash R, Chen NJ, Kumagai MH, Turano HM, Cooney JM, Atkinson RG, paul RE, Cheetamun R, Bacic A, Brummell DA, Schröder R.植物初生细胞壁中存在一种能够内转糖基化杂多糖多糖的酶活性。足底。2013;237:173 - 87。gydF4y2Ba
Schröder R, Wegrzyn TF, Sharma NN, Atkinson RG。成熟番茄果实中的LeMAN4内-β-甘露聚糖酶具有双重酶活性,可作为甘露聚糖转糖基酶和水解酶。足底。2006;224:1091 - 102。gydF4y2Ba
木葡聚糖内转糖基化酶活性在猕猴桃(gydF4y2Ba猕猴桃deliciosagydF4y2Ba)成熟。对水果软化的影响。植物杂志。1993;103:1399 - 406。gydF4y2Ba
富勒顿CG。猕猴桃软化:细胞壁研究。2015.博士论文,新西兰奥克兰大学。gydF4y2Ba
沙利奥德E,德席尔瓦J,斯特朗瑟姆B,杰罗尼米迪斯G,吉德利MJ。植物细胞壁酶对纤维素/木葡聚糖复合材料的力学效应。植物j . 2004; 38:27-37。gydF4y2Ba
Whitney SEC, Gothard MGE, Mitchell JT, Gidley MJ。纤维素和木葡聚糖在决定初级植物细胞壁机械性能中的作用。植物杂志。1999;121:657 - 63。gydF4y2Ba
利用抗体探测细胞壁结构和发育:个人观点。中国科学:地球科学。2009;39:197-205。gydF4y2Ba
张志强,张志强,张志强,等。植物细胞壁多糖中糖类成分的气液色谱分析方法。Carbohydr杂志1967;5:340-5。gydF4y2Ba
一种精确测定细胞壁铀苷含量的简化方法。食品化学。1977;1:361-5。gydF4y2Ba
刘志强,刘志强。糖醛酸含量测定的新方法。学生物化学肛门。1973;54:484-9。gydF4y2Ba
Ng JKT, Schröder R, Brummell DA, Sutherland PW, Hallett IC, Smith BG, Melton LD, Johnston JW。苹果果实发育早期细胞壁果胶增溶与半乳糖流失(gydF4y2Ba马吕斯x有明显gydF4y2Ba)品种‘Scifresh’的软化速度较慢。植物生理学报。2015;35(5):529 - 536。gydF4y2Ba
张志强,张志强,张志强,等。一种简便、高效的提取松木RNA的方法。植物化学杂志1993;11:113-6。gydF4y2Ba
McAtee PA, Richardson AC, Nieuwenhuizen NJ, Gunaseelan K, Hoong L, Chen X, Atkinson RG, Burdon JN, David KM, Schaffer RJ。猕猴桃杂种非乙烯和乙烯成熟反应gydF4y2Ba(猕猴桃对gydF4y2Ba)与差异调控有关gydF4y2Ba麦斯gydF4y2Ba框转录因子。生物工程学报。2015;15:304。gydF4y2Ba
Schröder R, Atkinson RG, Langenkämper G, Redgwell RJ。成熟猕猴桃木葡聚糖内转糖基酶的生化和分子特性。足底。1998;204:242-51。gydF4y2Ba
niuwenhuizen NJ, Beuning LL, Sutherland PW, Sharma NN, Cooney JM, Bieleski LRF, Schröder R, MacRae EA, Atkinson RG。猕猴桃中高度丰富的半胱氨酸蛋白酶——锕系元素的酸性和新型基本形态的鉴定和特征。植物生物学。2007;34:946。gydF4y2Ba
杨文华,李文华。木瓜果实软化、内切木聚糖酶基因表达、蛋白及活性。杂志。2007;131:470 - 80。gydF4y2Ba
李志强,李志强,李志强。番茄种子萌发过程中胚乳内do-β-甘露聚糖酶的研究。杂志。1995;94:328-34。gydF4y2Ba
Atkinson RG, Sutherland PW, Johnston SL, Gunaseelan K, Hallett IC, Mitra D, Brummell DA, Schröder R, Johnston JW, Schaffer RJ。下调的gydF4y2BaPOLYGALACTURONASE1gydF4y2Ba改变苹果的硬度、抗拉强度和水分损失(gydF4y2Ba马吕斯x有明显gydF4y2Ba)水果。中国生物医学工程学报2012;gydF4y2Ba
致谢gydF4y2Ba
我们感谢Neelam Sharma、Amanda Clinton、Janine Cooney和Yar-Khing Yauk的技术援助;Ric Broadhurst (AgResearch, New Zealand)抗体制备;福建大学李来勇教授、广西植物研究所梁秋芬教授赠送原版gydF4y2Ba答:erianthagydF4y2Ba种子材料;David Brummell和Jovyn Frost (née Ng)对手稿有价值的评论。gydF4y2Ba
资金gydF4y2Ba
该项目由新西兰商业、创新和就业部资助。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持本文结论的数据集包含在本文及其附加文件中。本文报道的GenBank序列可以在登录号KY496689-KY496698下找到。gydF4y2Ba
作者的贡献gydF4y2Ba
RS、ICH、AGS和RGA构想了方案并设计了实验;我进行了显微镜;RP进行分子分析、蛋白鉴定和western分析;RP、SLJ、SFW进行酶分析;EMO对DE进行分析;PM做了统计分析;RS进行果实鉴定、组织取样和细胞壁成分鉴定;AGS对葡萄进行了育种,并在育种群体中进行了广泛的表型分析,以确定最适合本研究的基因型;RS和RGA撰写了这篇论文。所有作者阅读并批准最终稿。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们之间没有利益冲突。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
伦理认可和同意参与gydF4y2Ba
不适用。gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格《自然》对出版的地图和机构附属关系中的管辖权要求保持中立。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
去皮好的(A)和去皮差的(D)水果的皮肤和真皮组织甲苯胺蓝o染色切片gydF4y2Ba猕猴桃erianthagydF4y2Ba基因型。S,由死细胞组成的被压缩的表皮层;H1,薄壁下细胞窄层;H2,壁较厚,更像角厚组织的下胚层。Bar = 100 μm。(JPEG 1925 kb)gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
脱皮好(A, C)和脱皮差(B, D)基因型的免疫标记gydF4y2Ba猕猴桃erianthagydF4y2Ba利用JIM7和LM5在不可分离(ND)期对水果进行鉴定。两种抗体均偶联Alexa™488(绿色)。双头箭头表示每个基因型的皮下组织的范围。Bar = 100 μm。(PPTX 1348 kb)gydF4y2Ba
附加文件3:表S1。gydF4y2Ba
RT-qPCR引物序列和克隆gydF4y2BaPGC1gydF4y2Ba而且gydF4y2BaPGC2gydF4y2Ba.此前,Atkinson等人对木葡聚糖糖基化酶(XTH)基因的引物进行了描述[gydF4y2Ba35gydF4y2Ba].果胶裂解酶基因引物gydF4y2BaPL1gydF4y2Ba之前在Atkinson等人[gydF4y2Ba34gydF4y2Ba和McAtee等人的肌动蛋白引物[gydF4y2Ba57gydF4y2Ba].cDNA全长拷贝gydF4y2BaPGC1gydF4y2Ba而且gydF4y2BaPGC2gydF4y2Ba采用白金Taq (Invitrogen公司)按照生产规程从果皮外cDNA中提取基因,并列出寡核苷酸。产品被克隆到pGEM-T Easy (Promega)按照制造商的协议和多个克隆测序(Macrogen Inc.,韩国)。(PPTX 86 kb)gydF4y2Ba
附加文件4:图S3。gydF4y2Ba
Expansin (EXP)基因在脱皮良好和脱皮不良发育过程中中低表达gydF4y2Ba猕猴桃erianthagydF4y2Ba基因型。剥皮阶段:ND,可分离性不发达;DD,可拆离性发展;FD,完全可拆卸剥皮。gydF4y2BangydF4y2Ba= 3±标准误差。表达概要文件类似于gydF4y2BaEXP2gydF4y2Ba(gydF4y2BaEXP1gydF4y2Ba而且gydF4y2BaEXP7gydF4y2Ba),gydF4y2BaEXP5gydF4y2Ba(gydF4y2BaEXP4gydF4y2Ba在无花果。gydF4y2Ba5gydF4y2Ba.外果皮。(JPEG 45 kb)gydF4y2Ba
附加文件5:图S4。gydF4y2Ba
脱皮好的和脱皮不好的总蛋白提取物的Western分析gydF4y2Ba答:erianthagydF4y2Ba基因型。在每个面板中,带模式用黑色条突出显示。剥皮阶段:ND,可分离性不发达;DD可拆离性发展;FD,完全可拆卸剥皮。β-Gal (A, B)在外皮(OP)和果皮的免疫反应条带显示;EXP3 (C, D)和XTH7 (E, F)。其他抗体未见条带。(JPEG 34 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许不受限制地在任何媒体上使用、分发和复制,前提是您要适当地注明原作者和来源,提供创作共用许可的链接,并说明是否进行了更改。知识共享公共领域转让豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
Prakash, R., Hallett, I.C., Wong, S.F.gydF4y2Baet al。gydF4y2Ba猕猴桃细胞分离,不发育特殊的剥离区。gydF4y2BaBMC植物杂志gydF4y2Ba17日,gydF4y2Ba86(2017)。https://doi.org/10.1186/s12870-017-1034-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-017-1034-2gydF4y2Ba
关键字gydF4y2Ba
- 细胞壁gydF4y2Ba
- 超然gydF4y2Ba
- 猕猴桃gydF4y2Ba
- 剥gydF4y2Ba
- 聚半乳糖醛酸酶gydF4y2Ba
- TransglycosylasegydF4y2Ba