摘要
背景
表橄榄(齐墩果欧洲公司L.),尽管它们广泛生产,但仍然是人工采收的。人工收割效率低,劳动力成本上升,降低了这种作物的盈利能力。选择性的脱落处理,诱导果实而非叶片脱落,是采用机械收割餐桌橄榄的关键。在本工作中,我们研究了橄榄树果实和叶片的三个脱落带(AZs)之间的解剖学和分子差异。
结果
位于果实和花梗之间的果实脱落区3 (FAZ3)是成熟果实的活性AZ,对乙烯利敏感,而位于花梗和花轴之间的果实脱落区2 (FAZ2)是花的活性AZ,也是乙烯利诱导的最多的果实脱落区。我们发现叶片脱落区(LAZ)与这两个faz存在解剖学差异。与faz不同,LAZ的特点是细胞小,与相邻细胞相比,果胶较少。为了区分果实和叶片AZs,我们研究了用乙烯利(一种乙烯释放化合物,有或没有抗氧化剂)处理橄榄树对处理5天后果实和叶片分离力(DF)的影响。乙烯利处理提高了果胶酶活性,降低了所有三个橄榄AZs的DF。对乙烯利处理后的三个橄榄AZs的转录组学分析显示,诱导了几个编码激素(乙烯、生长素和ABA)的基因,以及几个细胞壁降解酶。而纤维素酶基因的上调仅发生在LAZ中。在LAZ中,许多与氧化应激相关的基因被乙烯利单独诱导。此外,我们发现活性氧(ROS)只在叶片中对乙烯利的反应中介导脱落。因此,在乙烯利中加入抗坏血酸或丁酸等抗氧化剂可抑制叶片脱落,但增强果实脱落。
结论
我们的研究结果表明,用乙烯利和抗氧化剂的组合处理橄榄树可以减少果实的分离力(DF),而不削弱叶片的分离力。因此,这种选择性脱落处理可以反过来促进橄榄的机械化收获。
背景
橄榄从开花到成熟果实的发育是一个复杂的过程。开花通常发生在北半球的4月,两周后坐果。和许多其他水果一样,橄榄的发育遵循双s型曲线的模式,直到果实在9月中旬开花后150天(DPA)左右达到完全大小。橄榄的成熟是一个漫长而缓慢的过程,持续几个月,大约从十月中旬(DPA 180度)开始。收割通常在11月中旬开始,210 DPA [1].脱落是指一系列分离事件,整个植物器官,如叶子、果实或花器官脱落。在这些过程中,分离通常发生在被称为分离带(AZs)的特殊狭窄的细胞带中,这种细胞带形成于母体植物和上述每个器官之间[2].大多数植物都含有一个果实AZ (FAZ);然而,有些包含不止一个。柑橘类水果中报告了两种faz [3.)、西红柿(4], Longkong [5和其他人。桃果有3个az,其中功能分化的时机和乙烯处理诱导的响应能力取决于果实发育阶段[6,7].同样,橄榄果实的脱落可以发生在三个不同的位置:花梗分枝(FAZ1),花梗轴(FAZ2)和果梗(FAZ3)。成熟橄榄果脱落主要发生在FAZ3中,FAZ2中脱落程度较轻,FAZ1中很少发生[8].在橄榄品种Picual和Arbequina中,FAZ2被认为是未成熟果实AZ [9].在作物中,叶、花、幼果和成熟果的脱落主要是通过乙烯作为诱导性物质和生长素(吲哚-3-乙酸,IAA)作为抑制剂的收缩作用来控制的。然而,脱落酸(ABA)也参与其中,因为ABA水平在脱落前显著增加[10].
外源乙烯诱导大多数脓肿植物系统的脱落。在某些情况下,但不是所有情况下,内源性乙烯产量在脱落前增加。乙烯与生长素相互作用,通过诱导细胞分离相关基因如膨胀素、纤维素酶和果胶酶的表达,调节果实和叶片的脱落[11].AZ中的生长素消耗是AZ细胞响应乙烯作为一个脱落信号所必需的。这是自然脱落和各种应力引起的脱落中普遍存在的现象。应激诱导的生长素耗竭由三种主要中间调节剂介导:乙烯、活性氧(ROS)和碳水化合物饥饿[12].活性氧是在应对多种环境压力时产生的,如紫外线、低温、盐、涝渍、缺氧、脱水和病原体攻击[13].ROS刺激生长素分解代谢[12,以及过氧化氢(H2O2)参与叶片脱落信号传递[14].在皮层水平诱导苹果小果脱落过程似乎是由激素(主要是ABA和乙烯)和其他信号分子(如ROS)之间的多重相互作用网络协调的[15,16].
显然,脱落伴随着蛋白质的一系列变化,包括细胞壁降解酶[17].第一个被认为有助于脱落部位壁松动的酶是β-1,4-葡聚糖酶或纤维素酶。乙烯处理后,编码该酶的基因家族成员的表达在AZ中特异性上调[18].参与脱落过程的其他酶是多聚半乳糖醛酸酶(PGs),其活性在不同器官的脱落过程中增加。膨胀蛋白与膨胀生长和成熟过程中的细胞壁松动有关,并被证明在细胞分离中发挥作用[19].利用微阵列或RNAseq对AZ的转录组分析在许多植物物种中都有特征,如拟南芥[20.- - - - - -22,番茄23,24),柑橘类(25),苹果(26,荔枝27],甜瓜[28和其他人。最近,通过比较果实成熟阶段富含faz的组织和果实之间的变化,对橄榄果AZ转录组进行了表征[9],或花后154天的表橄榄收收期(DPA)和217 DPA的完全成熟期之间FAZ基因表达的变化[29].对成熟橄榄FAZ的基因表达分析表明鞘磷脂可能参与了成熟橄榄果实的脱落过程。涉及小gtpase的囊泡运输的激活可能是脱落过程中细胞壁修饰所必需的,许多MYB和bZIP转录因子在果实AZ中大量表达,并可能调节下游过程,主要与ABA相关[29].
橄榄果实的生长发育持续4-5个月,包括5个阶段,最后一个阶段为非成熟期(大约在开花后180天开始)。与其他水果作物一样,果实脱离力(DF)随着果实成熟而稳步下降。当橄榄达到浅绿色到紫色,果实开始软化时,就可以收获了。与此相反,鲜食橄榄在中果皮发育末期(生理成熟之前)收获,此时DF非常高。这妨碍了水果的收获,增加了执行这一任务所需的努力。
目前,餐桌上的橄榄仍然是人工收割的。发展橄榄机械采收的主要原因是手工采收人手不足,人工成本增加。目前,手工采收是全世界台面橄榄生产中最昂贵的部分[30.].为了实现机械采收,在不影响叶片DF的前提下,选择能够降低果实脱离力(DF)的脱落处理至关重要。乙烯释放化合物如乙烯利(2-氯乙基膦酸)实现了一致的果实松动。然而,使用乙烯利也会导致伴随的叶片脱落和果实松动[31- - - - - -33].本研究的目的是在生理和分子水平上研究这三种橄榄AZs,以便开发一种能导致果实脱落而不脱落叶的差异治疗方法。为此,我们对cv中活性橄榄果实和叶片AZs (LAZ, FAZ2和FAZ3)进行了表征。曼萨尼约橄榄树。FAZ2被乙烯利处理释放的乙烯激活。叶片和果实之间存在明显的解剖差异。与之前的转录组学分析相比,本研究通过乙烯利处理来修饰基因表达,从而诱导器官脱落。转录组学分析表明,叶片和果实AZs中的基因表达对乙烯利刺激有明显的响应。这些差异表现在许多基因的表达上,其中包括一些编码细胞壁降解酶的基因和其他参与ROS反应的基因。抗氧化处理只能抑制乙烯酮诱导的叶片脱落。 Therefore, our findings suggest that the ethephon-induced abscission mediated via ROS is leaf-specific.
方法
植物材料、处理和测量
本研究的工作是在我们的种质收集中选择的橄榄树“Manzanillo”上进行的。我们的种质收集包括119个17年树龄的灌溉橄榄树品种,间隔5 × 6.5米,位于以色列里松勒锡安的博卡尼中心(ARO) [34].种质收集是我们的责任,按照当地法律进行这项实验不需要许可。水果和叶子的分离力(DF)测量使用FG-5000A力计(路创电子企业,台北,台湾)。所有实验和样品采集均在9月进行,9月正是餐桌橄榄的收获季节。通过采摘果实,分析与果实脱落有关的FAZ,测定乙烯利处理后果实的脱落率。虽然我们使用了“脱落”这个术语,但所有的分析都是在人工去除脱落的果实和叶子上进行的。
乙烯利和抗氧化处理
将树上的结果枝浸在一个2升的容器中,容器中充满乙烯利剂(pH = 5.5),其中含有4%磷酸一氢钾(MPK;海法NPK,海法,以色列),0.2%乙烯利(Bayer Cropscience, Monheim,德国)和0.3%石蜡油(Drexel, Memphis, TN, USA)。通过向乙烯利剂中添加0.3%抗坏血酸(Galvit C, Biovac, Or Akiva, Israel)或100 mM丁酸(Sigma-Aldrich, St. Louis, MO),进行抗氧化处理。对照组的树枝同样浸入2升的水容器中。实验期间的所有DF测量都是在附着在树上的树叶和果实上进行的。
ROS识别
ROS检测使用ROS荧光探针2 ',7 ' -二氯荧光素二乙酸(DCFH-DA;西格玛-奥尔德里奇,圣路易斯,密苏里州)。用手将叶片和果实AZs切成约0.1 mm厚的垂直截面。切片用25 μM DCFH-DA在10 mM Tris-HCl (pH 7.4)缓冲液中孵育30分钟,25°C黑暗[35].然后在不含DCFH-DA的10mm Tris-HCl (pH 7.4)缓冲液中洗涤切片,放在载片上,在共聚焦激光扫描显微镜下观察(Olympus IX81;奥林匹斯山,日本东京)。对于每个图像,采样5个不同的区域来测量DCF荧光强度,这是比背景减去。
果胶酶活性测定
果胶酶活性测定根据在线参考方案(http://www.protocol-online.org/).用于果胶酶活性测定的叶片和果实AZ采样,用手工从AZ区域的每一侧切除约1毫米的厚度。将LAZ、FAZ2和FAZ3组织研磨后溶于40 mM醋酸钠(NaAc;pH = 5)。然后将样品离心,将上清液与5%的果胶(Sigma-Aldrich, St. Louis, MO)在40°C等体积下孵卵1小时。通过将1 mL放入玻璃移液管中评估这些混合物的粘度,并与5%的果胶相比,测量混合物在重力下排出的时间。为了将粘度转化为果胶酶活性,我们用0.2和0.4单位的商用果胶酶(Sigma-Aldrich, St. Louis, MO)测定了5%的果胶标准。
解剖分析
用于解剖分析的叶片和果实AZs用手切除到约1厘米大小2由AZ区域和邻近组织组成。AZ样品固定于甲醛:醋酸:乙醇70%,10:5:85,v/ v (FAA)的解决方案。固定后进行乙醇稀释系列和随后的乙醇与组织磷脂的逐步交换。样品用石蜡包埋,用显微刀(徕卡RM2245)切成切片,然后用钌红和阿利新蓝染色[36].染色样品用光学显微镜(Olympus BX50)在5、10、20和40倍倍率下检查。
阿兹转录组分析
用于转录组分析的叶片和果实AZ被手工从AZ区域的每一侧切除到约1mm厚。从树上取下组织,立即切除并冷冻在液氮中。利用富含AZ的组织,从“Manzanillo”的三个被分析AZ (LAZ, FAZ2和FAZ3)的总RNA中制备6个cDNA文库,并在乙利处理前和处理后5天,使用Illumina公司的TruSeq RNA文库制备试剂盒,根据制造商的说明。每个cDNA文库由来自不同果实或叶片的约70个AZs的RNA组成,并在Illumina HiSeq 2000上进行测序。测序由位于以色列海法的Technion基因组中心的测序单元完成。使用FASTX工具包(http://hannonlab.cshl.edu/fastx_toolkit/Index.html,版本0.0.13.2)用于:(1)使用fastq_quality_trimmer删除质量分数<30的读端核苷酸;(2)使用fastq_quality_filter删除质量评分≤30的碱基对小于70%的读。处理后获得的清洗读数,使用Trinity软件从头组装[37使用trimmomaticSE选项移除适配器[38].只对长度最小为200 bp的转录本进行分析。使用bowtie2校准器从RNA-Seq数据中进行转录本量化(每个基因的读取数)[39]和期望-最大化法[40].
数据分析
差异表达分析使用edgeR包[41],差异表达超过两倍且发现错误-校正统计学显著性不超过0.01的转录本被认为差异表达[42].基因表达的层次聚类和热图可视化使用R Bioconductor [43],使用每个基因的log-FPKM值。为了进行基因本体(GO)分析,将de-novo组装序列与UniRef90数据库[44],通过这种方法,每个基因都得到了许多GO注释。基于每个基因的5个最佳GO术语,使用Blast2go接口(https://www.blast2go.com/).维恩图是使用在线Venny 2.0软件(http://bioinfogp.cnb.csic.es/tools/venny/).
奇异富集分析(SEA)
我们分别测试了在每个AZ中监管的转录本列表,以及在LAZ、FAZ2和FAZ3中唯一监管的转录本列表,以及在所有三个AZ中普遍监管的转录本列表。每个列表的SEA为每组成绩单提供了丰富的GO术语列表。SEA为GO的三个类别分别生成了独立的列表:生物过程、分子功能和细胞成分。我们专注于生物过程类别,假设它是我们分析中最具指示性的类别。
统计分析
利用JMP软件对采集到的果叶DF和基因表达数据进行单因素方差分析[45].
结果
树叶和果实分队的年度进程
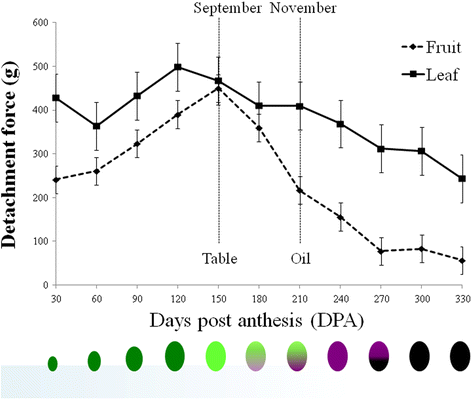
橄榄的年度课程(cv。从2011年5月到2012年3月,根据从不同树木采集的25个叶片和果实的月DF测量结果确定了叶片和果实DF(图1)。1).橄榄果实DF从5月坐果(30 DPA)开始逐渐增加,直到9月食用橄榄收获季节果实丰满。随后,果实DF开始下降,直到1月成熟结束时下降到100 g以下(270 DPA)。叶片和果实DFs的动力学过程相似,只是变化程度不同。叶片DF在秋季和冬季(180 ~ 270 DPA)略有下降。除9月和10月为餐桌橄榄的收获季节外,全年叶片和果实DFs差异显著,而9月和10月期间果实和叶片DFs相似。11 - 12月(210-240 DPA)是油橄榄的收获期,成熟果实的DF显著低于叶片。
三个橄榄az的特性
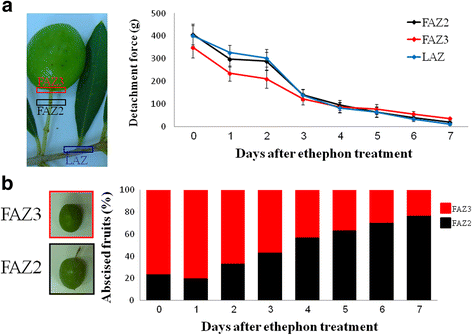
为了研究乙烯利处理对橄榄果实和叶片DF的影响,我们在橄榄采收期(9月)对橄榄树枝条进行乙烯利处理,并在处理后7天内每日测定LAZ、FAZ3和FAZ2的DF。由于所有的测量都是在田间进行的,在处理后的一周内,离体果实和叶片和未处理果实和叶片的DF没有显著差异,第0天作为对照。处理当日,LAZ、FAZ2和FAZ3的DF分别为401、407和350 g。治疗后,各az的DFs均持续下降;4天后,DFs降至100克以下,且在所有az中均处于相似水平。然而,在治疗5天后,FAZ2的DF下降到63,而FAZ3为77 g。这一趋势一直持续到试验结束,即处理7天后,此时FAZ2的DF显著低于FAZ3(图1)。2).这些影响分离区的变化发生在果实采摘时:第0天,80%的分离发生在FAZ3中,第7天,约75%的分离发生在FAZ2中。2 b).
我们对猕猴桃果实脱落部位的研究。9月的“Manzanillo”,橄榄树收获时间(第0天)显示,80%的果实在FAZ3发生了脓肿(图1)。2 b),与olive cv先前的研究结果相似。“Hojiblanca”和“Picual”(Castillo-Lianque和Rapoport, [8])。而乙烯利处理7 d后,果实脱落位置明显向FAZ2方向转移(77%;Prob ChiSq < 0.0006),确定为主要分离区(图5)。2 b).然而,由于两种faz DF已经下降到100克以下,两者都可以被归类为乙烯利响应faz。我们测试了2周龄小果(14dpa)果实脱落的位置,发现这一阶段的主要分离区与成熟果实一样,是FAZ3 (68%;Prob ChiSq < 0.01)(数据未显示)。花期活性AZ为FAZ2 (85%;Prob ChiSq < 3.3X10-6)。这使得我们认为FAZ3是成熟果实AZ,而FAZ2是花活性AZ,在9月份对乙烯利处理更有反应。
乙烯利处理后,三种AZ组织中果胶酶活性均稳步上升,且与DF成反比。在处理后的所有时间点,LAZ中的果胶酶活性都高于faz中的果胶酶活性1:图S1)。FAZ3中果胶酶活性与FAZ2相似,但FAZ2在处理后第7天活性显著高于FAZ3。在水处理的橄榄枝(对照)中,果胶酶活性在所有三个az中保持低和稳定(附加文件1:图S1)。
乙烯利处理对橄榄AZs解剖结构变化的影响
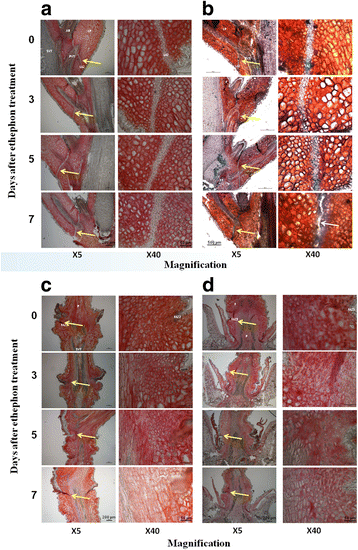
用钌红对未酯化的果胶进行染色,以确定脱落区。与相邻细胞相比,未处理的LAZ层的特征是小细胞层,未酯化果胶较少。3).用这种染色法不能观察到酯化果胶。LAZ在1月龄叶和2年龄叶中均可明显识别。它的染色非常相似,但其特征是比1年和2年生叶子的细胞层数更少2:图S2)。1月龄LAZ平均宽度为21.4 μm,显著(P< 1.4 x10−5)小于1年和2年laz宽度(分别为37.4和34.7 μm)。细胞大小无显著差异(P< 0.08)。FAZ2和FAZ3不含钌红染色可检测到的特异性细胞层。尽管我们预计果胶在脱落过程的早期阶段会降解,但钌红染色并未显示两个faz的任何细胞层中的果胶水平下降,即使在乙烯利处理7天后也是如此。然而,在乙烯利处理后,可以检测到组织从维管束周围分离(图。3 c和d).
我们试图使用阿利新蓝染色来监测细胞壁降解,因为染料被完整的角质层排除在外,因此这种染色突出了角质层在脱落过程中的损失[46].在乙烯利处理前(第0天),阿利新蓝染色主要在维管束中检测到,在其余截面上随机出现小斑点。然而,在乙烯利处理3天后,AZ组织被观察到分布染色。此时染色集中在AZ外层。治疗5天后,整个AZ层被阿利新蓝染色,治疗7天后,阿利新蓝染色达到峰值,可以明显看到组织分离(图5)。3 b).
乙烯利处理对橄榄AZs转录组变化的影响
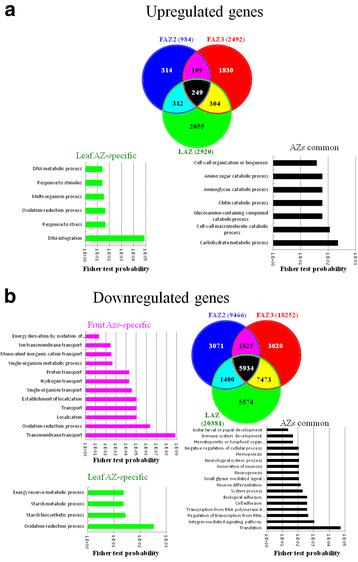
为了识别乙烯利处理下区分叶片和果实脱落过程的不同分子信号,我们分析了三个橄榄AZs的转录组谱。分别在乙烯利处理前和处理后5天分别提取FAZ3、FAZ2和LAZ的RNA,用Illumina技术进行测序。我们从六个分析az中获得了平均34347,262个原始读取,映射率为80.5%(附加文件3.:表S1)。测序数据存入NCBI序列读取档案(Sequence Read Archive, SRA)数据库,作为生物项目PRJNA342541 (FAZ2-0、FAZ2-5、FAZ3-0、FAZ3-5、FAZ3-5的SRR编号分别为SRR4236909、SRR4236910、SRR4236911、SRR4236912、SRR4236913和SRR4236914;https://www.ncbi.nlm.nih.gov/sra?linkname=bioproject_sra_all&from_uid=342541).这些序列共组装成138,824个转录本,其中contig N50为894 bp,平均contig长度为593 bp。然后,通过对组装的序列执行BLAST分析,找到转录本UniProt标识。所有转录本的层次聚类结果显示,FAZ2和FAZ3两个faz的基因表达谱彼此更接近,而非LAZ。此外,样本被分为两个聚类组:对照az和所有乙醚处理az。大多数差异表达的转录本在乙烯利处理5天后下调4:图S3)。具体来说,在所有138,824个转录本中,有34100个对乙烯利应用的响应差异表达。其中,大多数受监管的转录本被下调(28,927个转录本)。在所有三个az中,乙烯利处理只有5173个转录本上调(图。4).差异表达基因中,LAZ中上调或下调的基因比FAZ3中更多,而FAZ2中修饰基因率最低。可能是因为在乙烯利处理5天后,FAZ2细胞已经开始脱落,FAZ2中的大部分细胞已经死亡。大多数对乙烯利反应的上调基因没有重叠(81%)。4),而只有40%的下调基因没有重叠,不同az共享60%的下调基因(图4)。4 b).
为了分析在乙烯利处理后az中受调控的生物功能,我们对各种受调控的转录本组进行了氧化石墨烯富集分析。在三个az中的上调转录本和下调转录本中,我们发现许多GO术语的富集。正如预期的那样,所有三个az中上调的转录本列表显示,参与“细胞壁大分子分解代谢过程”和“细胞壁组织或生物发生”的转录本富集。在faz中唯一上调的转录本中,没有一个GO术语被丰富。然而,在仅在LAZ中上调的2055个转录本中,GO术语如“DNA代谢过程”、“对刺激的反应”、“对应激的反应”和“氧化还原过程”被发现富集(图5)。4).在faz中唯一下调的转录本中,我们发现了参与运输过程的转录本的富集。SEA导致仅在LAZ中被下调的转录本中有4个GO术语被富集。其中包括“能量储备代谢过程”、“糖原生物合成过程”、“糖原代谢过程”和“氧化还原过程”。三个az共有的下调转录本在许多氧化石墨烯术语中被富集,包括“生物粘附”和“细胞粘附”(图1)。4 b).
乙烯利处理对细胞壁降解基因表达谱的影响
叶片和果实的脱落需要细胞壁降解酶的活性。
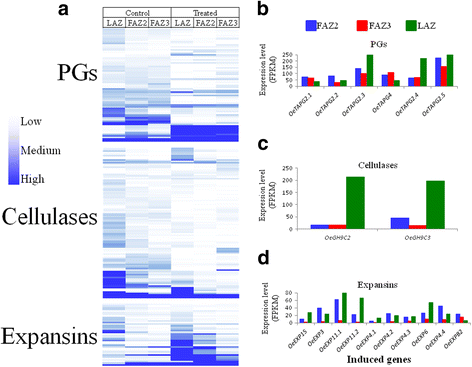
在植物脱落过程中,三种主要的活性细胞壁降解酶是聚半乳糖醛酸酶(PGs)、β-1,4-葡聚糖酶(纤维素酶或EGs)和膨胀酶[11].因此,我们分析了这三个细胞壁降解酶家族的基因表达模式(图5)。5).在乙烯利处理前和处理后5天,三个AZs中三个家族的大多数基因丰度都相当低(FPKM为0-2)。5).在这些基因中,每个家族的几个基因在乙烯利处理后被诱导(图。5罪犯).6个乙烯利诱导的PG基因在3个az中表现出相似的表达模式(图。5 b).两种纤维素酶基因,糖基水解酶9 c2(OeGH9C2),糖基水解酶9 c2(OeGH9C3),在LAZ中乙烯利处理显著诱导约200倍,而在两个faz中仅诱导约15倍(图。5度).在LAZ和FAZ2中,与FAZ3中的低诱导相比,10个乙烯基诱导的膨胀蛋白基因中的大多数在FAZ2和LAZ中都高度上调(图。5 d).
乙烯利处理对参与乙烯、IAA和ABA生物合成及对这些激素响应的基因表达模式的影响
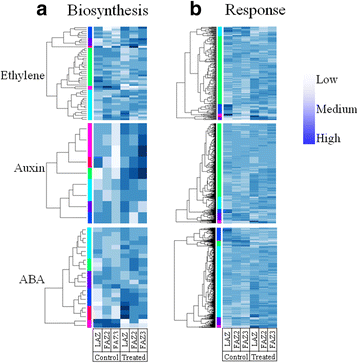
已知参与脱落过程的三种主要植物激素是乙烯、ABA和生长素,它们都能加速脱落,而生长素则能延缓脱落[47].因此,我们分析了参与生物合成的基因的表达模式和对这些激素的反应5:表S2)。结果如图所示。6显示与乙烯、生长素和ABA生物合成过程GO术语相关的所有转录本的表达(GO:000969, GO:0009851, GO:0009688),以及与乙烯、生长素和ABA反应相关的所有转录本的表达(GO:0009723, GO:0009733, GO:0009737)。在乙烯利处理5天后,与未处理的对照相比,分析所有三个AZs中这些转录本的丰度。参与生长素和ABA生物合成以及对这些激素反应的基因在乙烯利处理后显著上调。然而,只有与乙烯反应有关的基因,而不是与乙烯生物合成有关的基因显著上调6:表S3)。我们无法清楚地识别属于各种基因本体论生物过程的基因的组织特异性。
为了分析乙烯生物合成途径中涉及的基因,我们重点研究了该途径中三种主要酶的编码基因:s -腺苷蛋氨酸合成酶(SAMS)、1-氨基环丙烷-1-羧酸合成酶(ACS)和1-氨基环丙烷-氧化酶(ACO)。的表达模式OeSAM,OeACS,OeACO基因家族在附加文件中提出7:图S4。在这些基因中,最丰富的基因被发现是蛋氨酸ADENOSYLTRANSFERASES 1(OeMAT1),OeACS2,OeACO1而且OeACO4.在LAZ中,表达式为OeMAT1而且OeACS2在乙烯利处理后表达下调,而OeACO1而且OeACO4是增强。在faz中,我们无法识别任何乙烯生物合成相关基因的显著调控OeACS2,在乙烯利处理后FAZ2中下调7:图S4)。在生长素生物合成过程GO术语相关的转录本中,我们发现邻氨基苯甲酸合酶1亚基(OeASB1)的表达均在乙烯利处理后诱导。在与ABA生物合成过程相关的转录本中,代表该基因的4个转录本(c10724, c34560, c18527, c9486)的表达玉米黄质环氧酶(OeZEP),在乙烯利处理后所有三个az中均上调。参与对这三种激素反应的基因包括许多基因,其中大多数基因在乙烯利处理后上调。与乙烯的感知和反应有关的基因包括本构三重响应(OeCTR1),乙烯不敏感3(OeEIN3)和许多已知与乙烯相关的GRAS、NAC和MYB转录因子。在与生长素反应过程的GO术语相关的转录本中,有几种生长素反应格雷琴HAGEN 3(GH3)基因,例如OeGH3.1,OeGH3.3而且OeGH3.6.(附加文件8:图S5)。转录本列表还包括生长素诱导蛋白INDOLE-3-ACETIC酸13(OeIAA13),生长素反应因素(OeARF5,OeARF6,OeARF7)和生长素生物合成基因邻氨基苯甲酸合酶亚基1(OeASA1).参与对ABA反应的基因列表包括转录因子脱落酸响应元件结合因子2(OeABF2)和aba诱导剂ABA诱导BHLH(OeAIB).它还包括激酶CBL相互作用蛋白激酶1(OeCIPK1)和更多(数据未显示)。
活性氧(ROS)在叶片和果实脱落过程中的差异参与
在叶片特异性上调转录本中,氧化石墨烯富集的术语之一是“氧化还原过程”(图1)。4).此外,在叶片特异性下调转录本中,四分之三的氧化石墨烯富集项是能量和淀粉代谢和生物合成过程(图1)。4 b).我们还发现,使用乙烯利可以诱导气孔关闭(数据未显示)。这就增加了乙烯利处理诱导ROS产生的可能性,ROS产生进而诱导氧化应激和叶片气孔关闭[48].
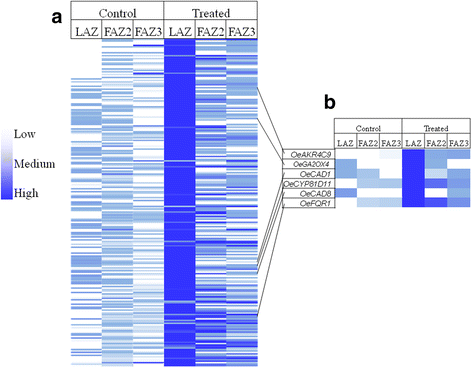
乙烯利处理特异性且显著地诱导了氧化应激相关的LAZ 224基因。7一个).诱导的基因包括氧化应激的多个方面,如:氧化磷酸化途径-atp酶f型亚基B(OeATPF0B),Nadh脱氢酶亚基4l(OeND4L);过氧化物酶体生物发生-脂肪酸氧化基因酰coa氧化酶(OeACOX),过氧化物酶体2,4-二烯基辅酶a还原酶(OePDCR)和氨基酸代谢基因异柠檬酸脱氢酶(OeIDH);相酸生物合成基因细胞色素P450(OeCYP707A3而且OeCYP707A1);超氧自由基降解基因过氧化氢酶(OeCAT2,OeCAT3),超氧化物歧化酶1(OeSOD1)和参与磷酸戊糖通路的基因-葡萄糖6磷酸脱氢酶(OeG6PD2而且OeG6PD5).ROS可由各种酶活性产生,并被一系列ROS清除酶阻断[49].的表达胺氧化酶1(OeAO1)在LAZ中显著上调,而在两个faz中不上调。在参与氧化应激的224个基因中,已知有几个基因受ROS诱导。这些基因包括:赤霉素2氧化酶4(OeGA2OX4),肉桂醇脱氢酶1(OeCAD1),肉桂醇脱氢酶1(OeCAD8),ALDO-KETO还原酶4-C9(OeAKR4C9),细胞色素P450(OeCYP81D11),类醌还原酶1(OeFQR1)(图。7 b).
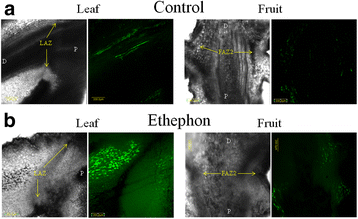
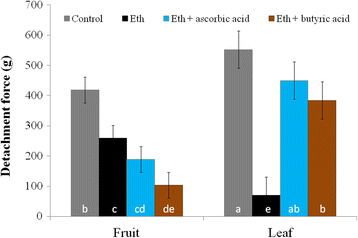
我们使用DCF作为ROS指标来评估乙烯利处理后LAZ和FAZ2中ROS的产生。未经处理的叶片和果实的花梗显示非常弱的DCF荧光。在治疗后的前2天,两组az中ROS的产生均无明显上升(数据未显示)。然而,在乙烯利处理后的第3天,叶柄的DCF荧光增强了4倍,而FAZ2则没有(荧光强度分别为54比12;P< 0.0005)(图8 b).乙烯利处理后叶片的DCF荧光在远端比近端表现出更高的强度,而在AZ细胞中没有观察到信号(图1)。8 b).由于乙烯利对活性氧的反应是在LAZ而不是faz中观察到的,我们推测乙烯利诱导的叶片脱落可能是依赖活性氧的。因此,我们在乙烯利中加入抗氧化剂处理橄榄叶和果实,并比较它们的反应。我们发现,使用乙烯利混合抗氧化剂抑制了乙烯利产生的气孔关闭效应,并将ROS荧光强度降低到未处理叶片的值(数据未显示)。因此,添加0.3%抗坏血酸或100 mM丁酸等抗氧化剂可以抑制叶片中DF对乙烯利的反应减少,但在果实中没有。叶片DF为552 g,乙烯利处理后下降到70 g。然而,在乙烯利与丁酸混合后,叶片DF仅下降到384 g,而在乙烯利与抗坏血酸混合后,叶片DF为450 g,与对照无显著差异。相反,在乙烯利中添加抗氧化剂降低了果实DF,从而促进了果实的脱落。果实DF为419 g,乙烯利处理后为259 g。在乙烯利混合抗坏血酸的反应中,果实DF为189 g,与对照果实DF无显著差异。 However, in a response to ethephon mixed with butyric acid fruit DF decreased to 104 g, which was found to be significantly lower than fruit DF in a response to ethephon (Fig.9).
讨论
大量的研究致力于采用机械收割法来种植食用橄榄[31].对橄榄faz和LAZ之间分子差异的详细描述应该有助于开发选择性的脱落处理方法,减少果实的DF,而不是叶片的DF,从而实现对餐桌橄榄的机械收割。
果实发育过程中橄榄faz的差异活性
橄榄(齐墩果欧洲公司L.)水果有两个faz。我们的研究表明,花梗和花轴之间的AZ (FAZ2)只在开花期间活跃。坐果后,活性转移到花梗和果实之间的成熟果实AZ (FAZ3)。未成熟果实AZ (FAZ2)对外源乙烯高度敏感,而成熟果实AZ (FAZ3)也对外源乙烯敏感,但其敏感程度低于FAZ2(图2)。2).同样,langsat (皮domesticum)果实有两个az:一个位于茎和融合的萼片之间(FAZ2),另一个位于融合的萼片和果实之间(FAZ3)。FAZ3是成熟果实阶段的活性AZ,而FAZ2在年轻果实和成熟果实中都有活性。与橄榄不同的是,这两种az对外源乙烯的敏感性也不同。FAZ2对乙烯处理高度敏感,而FAZ3对乙烯处理不太敏感[5].柑橘类水果在果实发育过程中也有两种活性不同的az: AZ-A在果实发育早期具有活性,AZ-C在果实发育后期具有活性[50].桃子有3个az, 1个在果实发育早期活跃,2个在果实发育后期活跃[51].里德和哈特曼[52]发现,应用2-氯乙基-三-(2-甲氧基乙氧基)-硅烷(CGA 13586)这一乙烯释放化合物后,橄榄果实脱落带发生了许多形态变化。他们观察到果实脱落区细胞浆解和细胞壁的变化、中片层溶解、淀粉粒积累和细胞的普遍分解。乙烯利处理后,我们无法识别这些形态变化。
乙烯苯诱导的果实脱落不同于自然脱落
吉尔-阿马多和戈麦斯-希门尼斯[29比较了橄榄树的简历。Picual的FAZ3转录组存在于脱落前期(154 DPA)到成熟脱落期(217 DPA)。他们发现涉及鞘磷脂和䲟鱼蛋白的膜微域,以及信号蛋白参与了脱落过程。他们的研究结果还表明,长链碱代谢和小gtpase参与调节细胞壁修饰和脱落。尽管他们的研究描述了橄榄中的自然脱落过程,而我们的研究描述了乙烯诱导的脱落过程,但两项研究都比较了非活性faz的转录组和活性faz的转录组。这两项研究也使用了富含az的组织,而没有任何非az对照。吉尔- amado和Gomez-Jimenez根据基因的丰度将差异表达的基因聚成4个簇:A1(在217 DPA时抑制,在217 DPA时有表达),A2(在217 DPA时抑制,在217 DPA时无表达),B1(在217 DPA时诱导,在154 DPA时有表达)和B2(在217 DPA时诱导,在154 DPA时无表达)。我们比较了四个聚类中前10个调控基因的表达模式与三个az (LAZ, FAZ2和FAZ3)在乙烯利处理前和处理后5天的表达模式。我们发现,在大多数情况下,在自然脱落过程中调节的基因对乙烯利没有反应。这些基因包括跑GTPase 3,ENDOMEMBRANE-TYPE Ca-ATPase 4,紫色酸性磷酸酶18(OePAP18),蛋白磷酸酶2摄氏度,ACC氧化酶,ATP柠檬酸裂解酶,苯丙氨酸AMMONIA-LYASE,细胞色素P450和其他的,在成熟过程中都上调,但在所有测试的az中对乙烯利没有反应。此外,基因如CALMODULIN-7(OeCAM7),氧进化增强蛋白1(OeOEE1),细胞色素b6-f复合体亚基4(OePETD),SERINE-THREONINE蛋白激酶,叶绿体HSP70和其他的,都在成熟过程中下调,但在所有测试的az中乙烯利没有反应(附加文件8:图S5)。FAZ3对乙烯利反应的转录水平相关性较低(r= 0.254),无统计学意义(P< 0.109)。我们认为,尽管脱落过程相似,但通过外源乙烯处理的橄榄果实脱落过程中FAZ的激活不同于自然脱落过程的激活,后者发生在成熟反应中。也有可能,其他剂量的乙烯利会导致与自然脱落过程类似的激活,因为已经证明乙烯利剂量影响脱落过程[53].
乙烯利对三种az中细胞壁降解酶编码基因的差异诱导
正如预期的那样,我们的氧化石墨烯富集试验显示,在乙烯利作用下,所有三种AZs中参与细胞壁组织和细胞壁大分子分解代谢过程的基因上调。脱落过程中主要的细胞壁降解酶是纤维素酶、PG和膨胀素[19,54- - - - - -57].我们的研究结果表明,尽管编码细胞壁降解酶的基因在所有三种分析的橄榄AZs中都被激活,但它们在不同的AZs中的表达不同。PG基因在三种被分析的AZ组织中均有表达(图。5 b).另一方面,纤维素酶基因的表达具有很强的lazs特异性(图。5度),而膨胀蛋白基因的表达是LAZ-和faz2特异性的(图。5 d),在FAZ3中表达最少(图。5度, d).我们发现,与FAZ3相比,橄榄FAZ2对乙烯利更敏感。事实上,大部分编码细胞壁降解酶的基因的表达水平,包括OeTAG2.1,OeTAG2.2,OeTAG2.3,OeTAG2.5,OeGH9C3与FAZ3相比,FAZ2中的表达量更高(图1)。5).研究表明,外源乙烯对番茄叶片和花AZs中的pg有诱导作用[58].另一项研究[24],比较脱落过程中从番茄植株FAZ和LAZ中产生的全局转录组,发现在器官移除的反应中,两个AZs中都诱导了pg。然而,与我们在橄榄中的研究结果一致,大多数纤维素酶和膨胀蛋白基因在LAZ中的表达高于FAZ中的表达。
乙烯利不影响乙烯的生物合成,但可诱导乙烯信号转导
我们在乙烯利处理后的橄榄叶或果实中未检测到任何内源性乙烯的产生(数据未显示)。对橄榄叶和果实中内源乙烯产量的测量每月一次,全年一次,包括在成熟后很长时间留在树上的果实中,没有确定叶片或果实中乙烯的产量(数据未显示)。此外,乙烯生物合成相关基因在乙烯利处理后没有被诱导(图。6).然而,乙烯反应相关基因在乙烯利处理后被诱导。6 b).与橄榄的这种情况不同,乙烯的生物合成在许多脱落器官(包括生殖器官)脱落前增加[59].在木本植物中,乙烯在脱落中的作用在很大程度上已通过外源乙烯(乙烯利)及其前体的应用得到证实(Sawicki等,[60])。乙烯产生的自催化是成熟果实和其他衰老组织的一个特征,其中内源性乙烯产生的大量增加是由乙烯暴露引发的[61].在苹果小果中,使用稀释化学物质诱导脱落刺激乙烯生物合成,同时上调关键调控基因[62- - - - - -64].在葡萄花和果实脱落过程中也报告了这种调节[65].在包括番茄在内的许多植物中都发现了乙烯的自催化生产[66),石斛兰花(67),柑橘类(68),猕猴桃69和其他人。我们发现,唯一对乙烯利反应上调的基因是参与乙烯生物合成最后一步的ACC氧化酶——ACC转化为乙烯。这一结果与之前的一篇报道一致,即应用1-氨基环丙烷-1-羧酸(ACC)诱导橄榄果实产生乙烯和脱落[70].然而,与其他果树品种不同,我们的研究结果可能表明,乙烯利诱导的脱落是由外源乙烯的释放介导的,而不是由乙烯利处理诱导的内源乙烯生物合成引起的。治疗的时间可能是这样的,细胞/组织由于其特殊的发展阶段,不能合成乙烯。
乙烯利诱导参与激素生物合成和活性的基因
在许多研究中都有关于脱落过程中激素变化的详细记录。乙烯和ABA是主要的脱落加速信号,生长素和多胺被认为是脱落抑制剂[10,60,62,71].赤霉素对脱落的影响尚不清楚。一些报道认为其具有抑制脱落的作用[72,73],而其他人则认为赤霉素促进脱落[74- - - - - -76].大量调控脱落的基因也是激素生物合成和信号通路的一部分或影响其代谢。生长素已被证明通过降低AZ对乙烯的敏感性来延缓其激活[12,23,77,78].然而,生长素的施用诱导乙烯生物合成和信号转导,导致小果脱落[79].
邻氨基苯甲酸合酶催化色氨酸生物合成途径中的第一个反应[80].两种基因的表达水平弱乙烯INSENSITIVE2(微微/ASA1),WEI7(ASB1),编码邻氨基苯甲酸合酶α-和β-亚基,在拟南芥根中乙烯刺激反应中被上调[81],导致根尖中的生长素水平增加。我们发现OeASB1根据氧化石墨烯的特性,在乙烯利处理后,所有AZ中均诱导生长素生物合成相关基因的表达和其他基因的表达(图1)。6).我们的结果表明乙烯和生长素之间存在相互作用,外源乙烯可能诱导内源生长素的生物合成。然而,这种内源性生长素并不能防止脱落,因为IAA的水平不一定会增加。在我们的20个转录本中,编码基因属于GH3基因家族,最丰富的一个(比这个家族中所有其他基因多10倍以上)编码OeGH3.1.OeGH3.1.2被发现对乙烯利有5倍的诱导反应(附加文件9:图S6)。众所周知,GH3酶能产生与多种氨基酸结合的IAA,这些氨基酸有助于维持生长素的内稳态,既可以使IAA失活,也可以作为水解时释放的IAA的储物库[82,83].考虑到这一点,我们的研究结果可能表明,乙烯利处理释放的乙烯可以促进一定程度的IAA结合,从而影响生长素的稳态。然而,需要进行IAA和共轭IAA定量。
第一个被确定为ABA生物合成酶的酶是玉米黄质环氧化酶(ZEP/ABA1),它将玉米黄质转化为紫黄质[84,是ABA生物合成中的一个关键反应[85].几个ABA生物合成基因包括OeZEP,在乙烯利处理后所有三个橄榄AZs中均上调(图。6).外源乙烯对ABA生物合成的响应增加是可以预期的,因为这些激素之间的相互作用有充分的文献记载[86],已知ABA会加速脱落[60].转录组结果表明,外源乙烯处理后,三种激素、乙烯、生长素和ABA共同作用诱导橄榄果实和叶片脱落。已有研究表明,在皮层水平诱导苹果小果脱落过程是由激素(主要是ABA和乙烯)和其他信号分子(如ROS)之间的多重相互作用网络协调的[16].在我们的研究中,尽管基因表达模式表明乙烯利处理会诱导ABA和生长素,但为了证实这一假设,必须进行激素分析和量化。
乙烯利在LAZ中诱导ROS,而在FAZ中不诱导ROS
ROS是第二类多功能小分子,在广泛的细胞过程中活跃,包括细胞程序性死亡和激素信号传递。以前的报告已将乙烯与ROS信号事件联系起来[25,87,88].我们发现,与两个faz相比,乙烯利在LAZ诱导的ros相关基因明显更多。参与ROS产生的主要基因家族是NADPH氧化酶基因家族,这在我们的转录本中没有发现。然而,表达OeAO1,在细胞外生长组织中产生ROS [89,90],在LAZ中显著上调,而在两个faz中不上调。ROS信号网络通过激活防御基因控制广泛的生物过程,包括生物和非生物应激反应[91].在参与氧化应激的224个基因中,已知有几个基因是由ROS诱导的,是植物防御反应的一部分[92].这些基因包括:OeGA2OX4从而诱导赤霉素(GA)的周转,并被认为在将外部信号整合到发育程序中起作用[93],两个参与木质素生物合成的基因(OeCAD1而且OeCAD8) [94,醛酮还原酶,OeAKR4C9,已知参与多种植物代谢过程和应激防御[95,应激防御基因,细胞色素P450,OeCYP81D11参与类黄酮生物合成的基因,OeFQR1,已知是由ROS诱导的[92(图。7).乙烯酚诱导的ROS倾向于LAZ的远端而不是近端(图。8 b).植物拥有非常高效的酶促和非酶促抗氧化防御系统,通过清除ROS来保护植物细胞免受氧化损伤[96].许多抗氧化剂被证明能有效抑制ros诱导的损伤[97- - - - - -99].其中,抗坏血酸[One hundred.]和丁酸[101]被证明能有效抑制叶片中的ROS损伤。在乙烯利处理中添加抗氧化剂抑制了橄榄叶DF的下降,而增强了果实DF的下降。9).哈特曼等人[102]还发现,在收获前喷洒抗坏血酸或碘乙酸会降低橄榄果实脱离力。因此,我们认为外源乙烯诱导的橄榄叶脱落是由ROS介导的,而果实脱落的途径可能不是由ROS介导的。冷诱导的叶片脱落Ixora coccinea据报道,植物通过氧化应激介导,增加LAZ对乙烯的敏感性。因此,抗氧化剂被证明可以降低LAZ对乙烯的敏感性,从而抑制叶片脱落,这与较高的IAA水平有关[103- - - - - -105].乙烯和ROS对IAA损耗和az对乙烯敏感性的影响在最近的一篇综述中得到了广泛的讨论[12].阿古斯蒂等人。[25的研究表明,在柑橘LAZ中表达的ROS是一般防御程序的一部分,包括物理屏障的产生。研究还表明,ROS在水分亏缺胁迫下木薯叶片脱落过程中发挥了重要的调节作用[106].另一项研究表明,持续生产过氧化氢(H2O2)导致辣椒叶片脱落[14,107].然而,一些研究表明活性氧在果实脱落中起作用。环带诱导龙眼果实脱落的碳水化合物胁迫(花芽龙眼)由ROS介导[108].本研究发现H2O2在治疗2天后,只存在于AZ的细胞壁。在治疗后的第三天,它几乎消失了,并在1天后重新出现在线粒体和细胞壁。在乙烯酮处理的荔枝FAZ中,属于ROS响应的转录本优先受到调控[109].研究还表明,番茄花诱导脱落导致AZ远端骨折面ROS水平明显高于AZ近端骨折面[110].
结论
由于在橄榄收获季节,果实和叶片的DF水平都很高,因此需要一种水果专用剂来实现机械收获餐桌橄榄。我们的研究从各个方面考察了橄榄果实和叶片AZs的独特机制。我们发现,与FAZ不同的是,LAZ的形态特征是与相邻细胞相比含有较少果胶的小细胞。
在本研究中,我们没有使用非az区域作为对照。作为对照,我们使用树枝浸入水中,而不是在乙烯利处理中使用4% MPK和0.3%石蜡油的溶液。然而,我们的主要目标是比较三种类型的AZ及其对乙烯利处理的反应,以确定乙烯利诱导的这些AZ组织中基因表达的变化。因此,乙烯利也可能引起这些组织的不同NAZ的变化,但这与工作的范围无关。外源乙烯处理影响了三个az中许多激素相关基因的表达。我们发现,参与生长素和ABA生物合成以及对它们的响应的基因在乙烯利处理的所有三个分析的脱落带中都上调了。然而,只有参与乙烯反应的基因,而不参与其生物合成的基因在乙烯利反应中上调。在LAZ和faz中,乙烯利处理均诱导编码细胞壁降解酶的基因。然而,纤维素酶基因的诱导是LAZ特异性的。乙烯利处理提高了橄榄果胶酶活性,降低了所有三个AZs的DF。 However, ROS-mediated abscission in response to ethephon is specific to the leaf abscission process, and does not operate in that of fruit. Therefore, addition of an antioxidant such as ascorbic acid or butyric acid to the applied ethephon solution inhibited leaf abscission but enhanced fruit abscission. Future studies should validate that adding the antioxidant does not affect fruit firmness and texture nor does it have phytotoxic effects on leaves remaining on the trees which can affect crop yields. Our findings point the way for developing a commercial application of a differential treatment generating a reduced DF specifically at the FAZ. This would be a significant step in facilitating the mechanical harvesting of table olives.
缩写
- 阿坝:
-
脱落酸
- 阿兹:
-
离层区
- DF:
-
超然的力量
- 分区:
-
开花后的天数
- 《法兰克福汇报》:
-
水果离层区
- 走:
-
基因本体论
- 有没有
-
叶离层区
- 后卫:
-
聚半乳糖醛酸酶
- ROS:
-
活性氧
- 海:
-
奇异富集分析
参考文献
- 1.
Morelló J-R,罗梅罗M-P, Ramo T, Motilva M-J。橄榄核果l-苯丙氨酸解氨酶活性及酚类成分的测定(齐墩果欧洲公司L.)从坐果期到收获期。植物科学。2005;168(1):65 - 72。
- 2.
Lewis MW, Leslie ME, Liljegren SJ。植物分离:离开母亲的50种方法。植物生物学杂志,2006;9(1):59-65。
- 3.
柑橘脱落的解剖、生理和激素方面,《园艺评论》第15卷(J. Janick版)。牛津大学:威利;1993.doi:10.1002/9780470650547.甲烷.
- 4.
番茄花和果实脱落带的组织学及2-氯乙基膦酸(乙烯利)施用的一些影响。芬多精。1980;38:71-9。
- 5.
Taesakul P, Siriphanich J, van Doorn WG。两个离体区近端皮domesticum水果:一种比另一种对外源乙烯更敏感。植物科学进展2015;6:264。
- 6.
纳尔逊JB,阿诺德CE,奥尔德里奇JH,安德森LC。桃3个果实相关脱落带的位置。中国科学(d辑:自然科学版)。
- 7.
Zanchin A, Marcato C, Trainotti L, Casadoro G, Rascio N.桃子花和果实脱落带的特征[碧桃(l)类等)。新植醇。1995;129(2):345 - 54。
- 8.
卡斯蒂洛-连克F,拉波波特HF。确定橄榄果实脱落的位置。Sci Hortic。2009;120(2):292 - 5。
- 9.
Parra-Lobato MC, Gomez-Jimenez MC.橄榄成熟果实脱落过程中乙烯生物合成、信号通路和一氧化氮产生相关基因的多胺诱导调控。实验学报2011;62(13):4447-65
- 10.
泰勒乙脑,怀特洛CA。信号脱落。新植醇。2001;151(2):323 - 40。
- 11.
棕色的公里。乙烯和离层。杂志。1997;100(3):567 - 76。
- 12.
王晓燕,王晓燕,王晓燕,等。植物生长素耗竭及其在植物离体控制中的作用。Stewart post - harvest rev 2015;11(2): 1-15。
- 13.
Baxter A, Mittler R, Suzuki N. ROS是植物胁迫信号的关键分子。中国生物医学工程学报,2013;29(5):369 - 369。
- 14.
坂本明,村村一,富田R,小林林。过氧化氢在辣椒叶片脱落信号传导中的作用,由离体脱落系统分析揭示。植物j . 2008; 56(1): 13-27。
- 15.
Botton A, Eccher G, Forcato C, Ferrarini A, Begheldo M, Zermiani M, Moscatello S, Battistelli A, Velasco R, Ruperti B等。介导苹果小果脱落诱导的信号通路。植物杂志。2011;155(1):185 - 208。
- 16.
Giulia E, Alessandro B, Mariano D, Andrea B, Benedetto R, Angelo R.早期诱导苹果小果脱落的特征是异戊二烯排放和脱落酸含量的增加。植物杂志。2013;161(4):1952 - 69。
- 17.
张晓丽,邱明峰,徐婷,吕晓杰,李婷丽。乙烯诱导番茄花梗脱落的蛋白质组学分析。J蛋白质组。2015;121:67 - 87。
- 18.
番茄花梗断裂强度和纤维素酶基因在花脱落过程中的表达。植物杂志。1996;111(3):813 - 20。
- 19.
罗伯茨JA,艾略特KA,冈萨雷斯-卡兰扎ZH。脱落、开裂和其他细胞分离过程。植物学报2002;53(1):131-58。
- 20.
转录组分析揭示了雄蕊脱落控制的新候选基因:在转基因植物中增强花器官的保留。植物杂志。2008;146(3):1305 - 21所示。
- 21.
拟南芥雄蕊脱落区细胞壁重塑:从转录分析推断对照的时间方面。植物信号行为学报2008;3(9):733-6。
- 22.
拟南芥脱落突变体hae hsl2的RNA-Seq转录谱分析。BMC基因组学。2013;14(1):37。
- 23.
Meir S, ph- hadas S, Sundaresan S, Selvaraj KSV, Burd S, Ophir R, Kochanek B, Reid MS, Jiang CZ, Lers A.番茄花脱落区对生长素耗竭响应的脱落相关转录组的微阵列分析。植物杂志。2010;154(4):1929 - 56。
- 24.
Sundaresan S, ph- hadas S, Riov J, Mugasimangalam R, Kuravadi NA, Kochanek B, Salim S, Tucker ML, Meir S. De novo转录组测序和作为番茄器官脱落分析新分子工具的脱落区特异性微阵列的开发。6 .植物科学进展,2016
- 25.
Agustí J, Merelo P, Cercós M, Tadeo FR, Talón M.乙烯诱导的柑橘叶片脱落过程中差异基因的表达。实验学报2008;59(10):2717-33。
- 26.
朱辉,Dardick C, Beers E, Callanhan A,夏锐,袁锐。苹果脱毛和naa脱毛的转录组学研究(马吕斯有明显)揭示了一个共同的途径,包括光合作用减少、碳水化合物运输的改变以及信号和激素的相互作用。植物生物学杂志,2011;11(1):138。
- 27.
李晨,王颖,黄霞,李娟,王红,李娟。果实转录组的从头组装与表征荔枝果实对遮荫响应差异调控基因的Sonn和分析。BMC基因组学。2013;14(1):1 - 16。
- 28.
Corbacho J, Romojaro F, Pech J- c, Latché A, Gomez-Jimenez MC.甜瓜成熟果实脱落过程中涉及的转录组事件包括细胞壁降解基因的顺序诱导和胞内和胞外作用的刺激。《公共科学图书馆•综合》。2013;8 (3):e58363。
- 29.
j。橄榄成熟果实脱落控制的转录组分析。植物细胞学报,2013;54(2):244-69。
- 30.
Zipori I, Dag A, Tugendhaft Y, Birger R.餐桌橄榄机械收获:收获效率和果实质量。Hortscience。2014;49(1):55-8。
- 31.
Burns JK, Ferguson L, Glozer K, Krueger WH, Rosecrance RC。黑熟加工橄榄果实松动剂的筛选。43 Hortscience。2008;(5):1449 - 53。
- 32.
2-氯乙膦酸和环己酰亚胺对橄榄乙烯进化和果实脱落的促进作用。中国科学(英文版)1970;95:635-40。
- 33.
马丁GC。机械收获橄榄:使用果实松动剂。Acta长的矮。1994;356:284 - 91。
- 34.
Biton I, Doron-Faigenboim A, Jamwal M, Mani Y, Eshed R, Rosen A, Sherman A, Ophir R, Lavee S, Avidan B,等。以色列橄榄种质资源中橄榄品种间系统发育关系的SNP标记的开发。摩尔品种。2015;35(4):1 - 14。
- 35.
Sandalio LM, Rodríguez-Serrano M, Romero-Puertas MC, del Río LA。植物组织体内活性氧和一氧化氮的成像,酶学方法。学术出版社。2008;440:397 - 409。https://doi.org/10.1016/s0076 - 6879 (07) 00825 - 7.
- 36.
Ruzin SE。植物显微技术与显微镜。纽约:牛津大学出版社;1999.
- 37.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I, Adiconis X, Fan L, Raychowdhury R,曾强,等。没有参考基因组的RNA-Seq数据的全长转录组组装。生物科技Nat》。2011;29:644-52。
- 38.
Bolger AM, Lohse M, Usadel B. Trimmomatic:一种用于Illumina序列数据的灵活微调器。生物信息学。2014;30(15):2114 - 20。btu170
- 39.
Langmead B, Trapnell C, Pop M, Salzberg SL.人类基因组短DNA序列的超快和高效记忆对齐。基因组医学杂志。2009;10 (3):R25。
- 40.
杜威中国出版社。RSEM:从有或没有参考基因组的RNA-Seq数据中精确的转录物定量。BMC生物信息学。2011;12(1):323。
- 41.
罗宾逊医学博士,麦卡锡DJ,史密斯GK。edgeR:用于数字基因表达数据的差异表达分析的Bioconductor包。生物信息学,2010,26(1):139 - 40。
- 42.
控制错误发现率:多重测试的一种实用而强大的方法。中国生物医学工程学报,1995;29(1):61 - 62。
- 43.
RC先生,凯里VJ,贝茨DM,博尔斯塔德B,德特林M,杜杜伊特S,埃利斯B,戈蒂埃L,葛y,绅士J,等。Bioconductor:用于计算生物学和生物信息学的开放软件开发。基因组医学杂志。2004;5 (10):R80。
- 44.
Suzek BE, Huang H, McGarvey P, Mazumder R, Wu CH. UniRef:综合和非冗余的UniProt参考集群。生物信息学。2007;23(10):1282 - 8。
- 45.
SAS研究所。JMP®版本7用户指南。Cary: SAS Institute Inc;2007.
- 46.
Gunawardena AHLAN, Greenwood JS, Dengler NG。花边植物中细胞程序性死亡过程中的细胞壁降解和修饰。中国生物学报2007;94(7):1116-28。
- 47.
植物激素对脱落的控制。启杂志1970;45(4):485 - 524。
- 48.
活性氧:代谢、氧化应激和信号转导。植物学报2004;55(1):373-99。
- 49.
Mittler R, Vanderauwera S, Gollery M, Van Breusegem F.植物活性氧基因网络。植物科学进展2004;9(10):490-8。
- 50.
杨晓燕,王晓燕,王晓燕,等。乙烯对柑桔叶片和果实外植体脱落的影响。见:Y. Fuchs和E. Chalutz(编)。乙烯:生化,生理和应用方面,国际研讨会,Oiryat Anavim,以色列,1月9-12日举行。荷兰多德雷赫特:施普林格;1984.p . 241 - 254。
- 51.
Rascio N, Casadoro G, Ramina A, Masia A.桃果脱落的结构和生化研究(碧桃l .蟠桃。足底。1985;164(1):1 - 11。
- 52.
Reed NR, Hartmann HT。2-氯乙基-三-(2-甲氧基乙氧基)硅烷处理橄榄果实脱落的组织化学和超微结构研究。中国园艺学报,2006;38(6):369 - 369。
- 53.
黄晓明,陈晓明,陈晓明,Wünsche J.乙烯利诱导芒果果实脱落的生理效应。植物科学进展2015;6:706。
- 54.
Bonghi C, Rascio N, Ramina A, Casadoro G.纤维素酶和聚半乳糖醛酸酶参与桃子叶片和果实外植体的脱落。植物生物学杂志,1992;20(5):839-48。
- 55.
•DJ。扩展蛋白的新基因和新的生物学作用。植物学报,2000;3(1):73-8。
- 56.
王晓燕,王晓燕。植物细胞分离与粘附过程研究。1 - 7页。植物年鉴第25卷:植物细胞分离和粘附。布莱克威尔出版有限公司
- 57.
塞克斯顿R,罗伯茨JA。脱落的细胞生物学。植物物理学报1982;33(1):133-62。
- 58.
三种不同的多聚半乳糖醛酸酶在番茄叶片和花脱落中表达,每一种都有不同的时间表达模式。植物杂志。1997;113(4):1303 - 8。
- 59.
里德女士,乙烯和脱落。Hortscience。1985;20:45-50。
- 60.
王晓燕,王晓燕,王晓燕。植物生殖器官脱落过程中环境胁迫与代谢的相互作用。中国医学实验学报2015;66(7):1707-19。
- 61.
杨顺丰,霍夫曼。乙烯在高等植物中的生物合成及其调控。为基础。启植物杂志。植物生物学杂志1984;35:155-89。
- 62.
Cin VD、Boschetti A、Dorigoni A、Ramina A在两个不同苹果品种上的应用(马吕斯有明显)显示了新的和意想不到的Fruitlet分离特征。安机器人。2007;99(6):1195 - 202。
- 63.
陈文华,陈文华,陈文华,陈文华,等。苹果果实脱落过程中乙烯的生物合成及对乙烯的感知(马吕斯有明显l . Borck)。中国生物医学工程学报2005;56(421):2995-3005。
- 64.
Dal Cin V, Barbaro E, Danesin M, Murayama H, Velasco R, Ramina a .小果脱落:用cDNA-AFLP方法研究未成熟果实脱落过程中差异表达的基因,揭示了一种推测的苹果生长素氢转运体的参与(马吕斯有明显l . Borkh)。基因。2009;442(1 - 2):26-36。
- 65.
葡萄小果脱落与乙烯生物合成的关系。葡萄。2003;42(1):1 - 3。
- 66.
横谷N,中野R, Imanishi S,永田M,稻叶A,久保y。番茄果实成熟相关乙烯生物合成的自催化和发育调控。实验与应用学报2009;60(12):3433-42。
- 67.
王晓燕,王晓燕。外源乙烯诱导石斛花衰老过程中的自催化乙烯生产。泰国农业科学2008;41:91-9。
- 68.
李立军,杨顺丰。外源乙烯对柑橘叶片组织乙烯产量的影响。植物杂志。1982;70(1):136 - 41。
- 69.
王晓燕,王晓燕,王晓燕。丙烯诱导猕猴桃自催化乙烯生产及成熟的研究。在低等和高等植物中乙烯生产的生化和生理方面。Clijsters H, De Proft M, Marcelle R, Van Poucke M编辑,卷26:施普林格荷兰;1989: 173 - 178。
- 70.
外用1-氨基环丙烷-1-羧酸对橄榄果实脱落的影响。鲁汶:国际园艺科学学会(ISHS);2001.125 - 6页。
- 71.
亚精胺和相关代谢抑制剂调节糖和氨基酸水平葡萄L:可能与最初的小果脱落有关。中国生物医学工程学报2003;54(381):355-63
- 72.
本-谢赫W, Perez-Botella J, Tadeo FR, Talon M, Primo-Millo E.授粉提高柑桔种子品种子房发育中的赤霉素水平。植物杂志。1997;114(2):557 - 64。
- 73.
Mahouachi J, Iglesias DJ, Agustí M, Talon M.柑橘分枝环结延迟早期果实脱落与之前碳水化合物和赤霉素浓度的增加一致。植物生长学报2009;58(1):15-23。
- 74.
生长素和赤霉素对棉花脱落过程中细胞生长和淀粉的影响。41植物杂志。1966;(5):871 - 6。
- 75.
随着年龄的增长,脱落过程的变化。植物杂志。1965;40(1):96 - 101。
- 76.
摩根PW,达勒姆JI。赤霉素促进乙烯诱导的叶片脱落。植物杂志。1975;55(2):308 - 11所示。
- 77.
Blanusa T, Else AM, Atkinson JC, Davies JW。生长素极性转运对甜樱桃果实脱落的调控。植物生长学报2005;45(3):189-98。
- 78.
王晓东,王晓东,王晓东。植物生长素是介导隐性汇脱落的扩散信号吗?植物科学。2003;164(5):689 - 96。
- 79.
朱辉,袁锐,Greene DW, Beers EP。1-甲基环丙烯和萘乙酸对苹果坐果及乙烯合成、感知和细胞壁降解相关基因表达的影响。中国科学(d辑:自然科学版)2010;
- 80.
拟南芥中两个邻氨基苯甲酸合酶基因:色氨酸通路的防御相关调控。植物细胞。1992;4(6):721 - 33所示。
- 81.
斯捷panova AN,霍伊特JM,汉密尔顿AA,阿隆索JM。通过对拟南芥中两个根特异性乙烯不敏感突变体的表征,揭示了乙烯与生长素之间的联系。植物细胞。2005;17(8):2230 - 42。
- 82.
梅勒N,乐队LR, Pěnčík A, Novák O,拉什德A,霍尔曼T,威尔逊MH,沃斯ß U,主教A,国王JR,等。生长素氧化酶和结合酶AtDAO1和GH3的动态调控可调节生长素的内稳态。中国生物医学工程学报(英文版),2016;
- 83.
Park J- e, Park J- y, Kim Y-S, Staswick PE, Jeon J, Yun J, Kim S-Y, Kim J, Lee Y-H, Park C-M。拟南芥gh3介导的生长素稳态将生长调控与胁迫适应反应联系起来。中国生物化学杂志2007;282(13):10036-46。
- 84.
Marin E, Nussaume L, Quesada A, Gonneau M, Sotta B, Hugueney P, Frey A, Marion-Poll A.玉米黄质环氧化酶的分子鉴定烟草plumbaginifolia,一个参与脱落酸生物合成的基因,对应于的ABA位点拟南芥.EMBO j . 1996; 15(10): 2331 - 42。
- 85.
Schwarz N, Armbruster U, Iven T, Brückle L, Melzer M, Feussner I, Jahns P.拟南芥中玉米黄质环氧化酶的组织特异性积累和调控反映了该酶在质体中的多重功能。植物细胞物理学报2015;56(2):346-57。
- 86.
脱落酸信号中的串扰。Sci信号。2002;(140):re10。
- 87.
德西坎R,汉考克JT,布莱特J,哈里森J,韦尔I,胡利R,尼尔SJ。ETR1在气孔保护细胞过氧化氢信号传递中的作用。植物杂志。2005;137(3):831 - 4。
- 88.
D'Haeze W, De Rycke R, Mathis R, Goormachtig S, Pagnotta S, Verplancke C, Capoen W, Holsters m活性氧和乙烯在半水生豆科植物侧根基部结瘤中起积极作用。中国生物医学工程学报,2003;30(4):447 - 447。
- 89.
植物防御中活性氧产生的机制——一个广泛的视角。植物病理学杂志,1997;51(6):347-66。
- 90.
张S, Klessig DF。MAPK在植物防御信号中的级联作用。植物学报,2001;6(11):520-7。
- 91.
Mittler R, Vanderauwera S, Suzuki N, Miller G, Tognetti VB, Vandepoele K, Gollery M, Shulaev V, Van Breusegem f ROS信号:新浪潮?植物学报,2011;16(6):300-9。
- 92.
Vanderauwera S, Zimmermann P, Rombauts S, Vandenabeele S, Langebartels C, Gruissem W, Inzé D, Van Breusegem f拟南芥过氧化氢调控基因表达的全基因组分析揭示了一个高光诱导的花青素生物合成转录簇。植物杂志。2005;139(2):806 - 21所示。
- 93.
Rieu I, Eriksson S, Powers SJ, Gong F, Griffiths J, Woolley L, Benlloch R, Nilsson O, Thomas SG, Hedden P,等。遗传分析表明,C(19)-GA 2氧化是拟南芥赤霉素失活的主要途径。植物细胞。2008;20(9):2420 - 36。
- 94.
金永华,裴建明,许国华。甘薯肉桂醇脱氢酶基因对植物发育阶段和环境胁迫的转录调控。植物细胞学报2010;29(7):779-91。
- 95.
植物醛酮还原酶(AKRs)在多种植物代谢过程和应激防御中的多任务士兵:结构-功能更新。植物生理学报2015;179:40-55。
- 96.
作物植物抗非生物胁迫中的活性氧种类和抗氧化机制。植物生理与生物化学。2010;48(12):909-30。
- 97.
Caverzan A, Passaia G, Rosa SB, Ribeiro CW, Lazzarotto F, Margis-Pinheiro M.植物对逆境的响应:抗坏血酸过氧化物酶在抗氧化保护中的作用中华分子生物学杂志2012;35(4增刊):1011-9。
- 98.
李文华,李文华。环境胁迫下植物活性氧(ROS)及抗氧化剂对ROS清除物的响应。2 .环境科学,2014
- 99.
植物防御反应中的一氧化氮、抗氧化剂和促氧化剂。植物科学,2013;4:419。
- One hundred.
抗坏血酸:一种支持植物生长发育的多功能分子。Scientifica。2013;2013:24。
- 101.
张旭,董芳芳,高建峰,宋春平。过氧化氢诱导的保卫细胞气孔关闭前胞内pH的变化。细胞研究》2001;11(1):37-43。
- 102.
王晓燕,王晓燕,王晓燕,等。抗坏血酸和碘乙酸喷雾诱导橄榄果实脱落的研究。加州阿格利司。1967;21(1):5 - 7。
- 103.
杨建军,张建军,张建军,等。低温诱导的植物叶片脱落Ixora coccinea植物。I.通过增加对乙烯的敏感性诱导氧化应激。杂志。1999;(2)107:166 - 73。
- 104.
米歇利·R,哲思-哈达斯S,里奥夫J,沙哈克Y,拉特纳K,梅尔SIxora coccinea植物。3高光增强通过增加氧化过程。杂志。2001;113(3):338 - 45。
- 105.
杨晓明,李晓明,张晓明,等。低温诱导植物叶片脱落的研究Ixora coccinea植物。2氧化应激对生长素经济的影响。杂志。1999;(2)107:174 - 80。
- 106.
廖伟,王刚,李勇,王斌,张鹏,彭明。活性氧对木薯叶片叶头脱落区细胞分离的调控作用。Sci众议员2016;6:21542。
- 107.
坂本M,宗村I,富田R,小林k。叶片脱落信号中的活性氧。植物信号行为学报2008;3(11):1014-5。
- 108.
杨Z,钟X, Y,粉丝王H,李J,黄X的活性氧在pedicel-mediated水果离层龙眼(碳水化合物供应被切断了花芽龙眼).植物科学进展2015;6:360。doi:10.3389 / fpls.2015.00360.
- 109.
李超,王颖,应萍,马伟,李娟。乙烯利调控荔枝小果脱落相关基因的全基因组数字转录分析。植物科学进展2015;6:502。
- 110.
巴尔·德罗·T,德马斯提亚·M,克拉德尼克·A, Žnidarič MT,诺瓦克·MP,梅尔·S,伯德·S,哲思-哈达斯·S,欧瑞·N,索内戈·L,等。在番茄脱落过程中,程序性细胞死亡是不对称的。植物细胞。2011;23(11):4146 - 63。
确认
作者感谢Yehuda Ben-Ari在撰写和编辑本文方面提供的宝贵帮助。
资金
这项工作得到以色列农业和农村发展部赠款(No. 203101014)的支持。
数据和材料的可用性
测序数据存入NCBI序列读取档案(Sequence Read Archive, SRA)数据库,作为生物项目PRJNA342541 (FAZ2-0、FAZ2-5、FAZ3-0、FAZ3-5、FAZ3-5的SRR编号分别为SRR4236909、SRR4236910、SRR4236911、SRR4236912、SRR4236913和SRR4236914;https://www.ncbi.nlm.nih.gov/sra?linkname=bioproject_sra_all&from_uid=342541).
系统发育树、序列数据和用于产生结果的比对如图所示。6和额外的文件4:图S3已存入TreeBASE (http://purl.org/phylo/treebase/phylows/study/TB2:S20915?format=html;提交ID - 20,913)。
作者的贡献
GCS、BC、BI、BS和SA进行所有分子分析,MY进行田间实验,DFA进行生物信息学分析,ZH进行组织分析,MY、SD、BR、MS、PHS、IV、LS和AB协助数据分析、稿件整理和审稿,研究的原始设计由GBA建立,GCS和GBA撰写稿件。所有作者已阅读并认可最终稿。
相互竞争的利益
作者声明他们没有竞争利益。
同意出版
不适用。
伦理批准和同意参与
不适用。
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
作者信息
从属关系
相应的作者
附加文件
附加文件1:图S1。
乙烯利处理后7 d内3种不同az果胶酶活性的变化。果胶酶活性在LAZ(蓝线),FAZ2(黑线)和FAZ3(红线)在对照或乙醚处理分支中显示。误差条表示基于5个样本的置信区间(p< 0.95)。(TIFF 250 kb)
附加文件2:图S2。
叶片出现后1个月、1年或2年观察到叶片解剖结构的变化。本文给出了在×5、×10和×20等处用钌红染色的LAZ纵断面图像。(TIFF 1295 kb)
附加文件3:表S1。
3个AZs样品在乙烯利处理前和处理后5天的深度测序和制图统计。(多克斯14 kb)
附加文件4:图S3。
在乙烯利处理前和处理后5天,三个az中所有转录本(a)和差异表达转录本(b)的分级聚类。表达水平以绿色到红色的丰度刻度表示。(TIFF 345 kb)
附加文件5:表S2。
所有参与植物激素乙烯、生长素和ABA生物合成和响应的转录本的描述和FPKM值。(XLSX 151 kb)
附加文件6:表S3。
参与植物激素乙烯、生长素和ABA的生物合成和响应的所有转录本的相对丰度。数值是所有三个az的对数相对表达式(5/0)的平均值(FPKM值)。进行统计分析,以确定3个az中所有转录本的平均丰度在处理5天后是否显著高于未处理的样品。每个测试的概率都显示出来了。(多克斯29 kb)
附加文件7:图S4。
乙烯生物合成通路相关基因在乙烯利处理前和处理后5天的表达。表达水平以绿色到红色的丰度刻度表示。只有高度丰富的转录本以其基因名称-出现S-Adenosylmethionine合酶1(OeSAM1;OeMAT1)1-氨基环丙烷-1-羧酸合成酶(OeACS2)1-氨基环丙烷-1-羧酸酯氧化酶(OeACO4)1-氨基环丙烷-1-羧酸氧化酶1(OeACO1).(TIFF 222 kb)
附加文件8:图S5。
我们的结果与Gil-Amado和Gomez-Jimenez [29].图中显示了四个集群中排名最高的基因的表达模式。对于每个基因(行),我们研究中的表达水平出现在左侧,而根据Gil-Amado和Gomez-Jimenez,同一基因在非活性AZ(154)和活性AZ(217)中的表达水平出现在右侧。(TIFF 172 kb)
附加文件9:图S6。
基因的表达属于GH3乙烯利处理前和处理后5 d, 3个az基因家族的变化。表达水平以绿色到红色的丰度刻度表示。不同的列表示不同的组织和治疗方法。(TIFF 116 kb)
权利和权限
开放获取本文根据创作共用署名4.0国际许可协议发布(http://creativecommons.org/licenses/by/4.0/),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于这篇文章
引用这篇文章
Goldental-Cohen, S. Burstein, C. Biton, I.。et al。乙烯利在橄榄叶脱落带诱导氧化应激,使选择性脱落化合物的发展。BMC植物杂志17日,87(2017)。https://doi.org/10.1186/s12870-017-1035-1
收到了:
接受:
发表:
关键字
- 离层
- 超然的力量
- 橄榄
- 机械收割
- 乙烯
- 氧化应激
- ROS
- 抗氧化剂