摘要
背景
类胡萝卜素是橙色果肉枇杷中的主要着色物质。本研究旨在揭示枇杷类胡萝卜素的生物合成途径。通过有针对性的分析和分子方法,在不同的树上发育阶段,在果皮和果肉组织中进行研究。
结果
监测了果皮和果肉之间以及不同发育阶段之间的颜色参数的实质性变化,并伴随类胡萝卜素含量的显著增加。利用分子(RT-qPCR)和先进的分析技术(LC-MS)进一步分析了类胡萝卜素生物合成途径中涉及的关键基因和单个化合物。结果显示果皮和果肉中的类胡萝卜素成分存在显著差异。果皮中发现了32种类胡萝卜素,而果肉中只发现了18种类胡萝卜素。反式叶黄素,反式-β-胡萝卜素是果皮中的主要类胡萝卜素;前者含量随着成熟的进展而降低,后者含量增加7.2倍。然而,枇杷果肉的类胡萝卜素分析表明反式-β-隐黄质,其次为反式-β-胡萝卜素和5,8-环氧-β-胡萝卜素是最主要的类胡萝卜素。大量的反式-β-胡萝卜素在两种组织中均得到了显著的染色体特异性诱导番茄红素β环化酶(CYCB)转录水平。PSY1,ZDS,CYCB而且BCH都是上调的CRTISO,LCYE,决定自而且VDE与未成熟时期相比,皮组织和肉组织在大多数发育阶段均下调。总体而言,类胡萝卜素生物合成途径中下游基因的表达水平随树上果实发育过程的差异调控更为明显。
结论
类胡萝卜素成分在枇杷生长发育过程中受到很大影响,果皮和果肉组织之间存在显著差异。研究人员建立了枇杷果实发育阶段基因上调或下调之间的联系,以及它们的表达如何影响每个组织(果皮或果肉)的类胡萝卜素含量。
背景
枇杷(枇杷Lindl)是蔷薇科的一种,在许多国家都有商业种植[1,2,3.],因其清淡爽口的口感而广受好评[2,4].因此,虽然最初被认为是一种未充分利用的作物,但如今枇杷可以获得附加值,因为它在冬末至早春期间都可以获得[5].枇杷树每年有三次生长,主树的生长可分为8个不同的发育阶段[2].特别是,在地中海气候条件下,这种树在10月至11月初开花,果实在冬季发育,从2月初到5月成熟。水果通常是新鲜的,但众所周知,它也被加工成果酱、果冻、酒、糖浆和果汁。人们也知道,叶子、花和水果在传统上被用于中药,因为它们与促进健康的特性有关[1,6].
类胡萝卜素在枇杷中起着重要的作用,因为它们影响水果的感官特征和健康特性。特别是,类胡萝卜素是枇杷中的主要色素,影响风味的可接受性,因为它们是重要的挥发性风味化合物的前体[7].关于水果类胡萝卜素的营养特性,大量研究描述了它们对促进健康的有益作用,包括预防和/或治疗慢性和心血管疾病[8].特别是富含类胡萝卜素的水果与预防炎症和白内障有直接关系[1,9,10],也可增强免疫反应[1,9,11].枇杷类胡萝卜素的分布受成熟期、环境和最直接的遗传因素的影响。枇杷品种已分离为白色和红色肉质[10,12].然而,根据果肉颜色来区分枇杷品种可能会令人困惑,因为另外还有黄色和橙色果肉的术语。白色肉质栽培品种具有奶油色,淡黄色,而术语红色和橙色肉质可以被认为是同义词。后一种品种的类胡萝卜素浓度高于颜色较浅的品种[1,5,9,10,12].
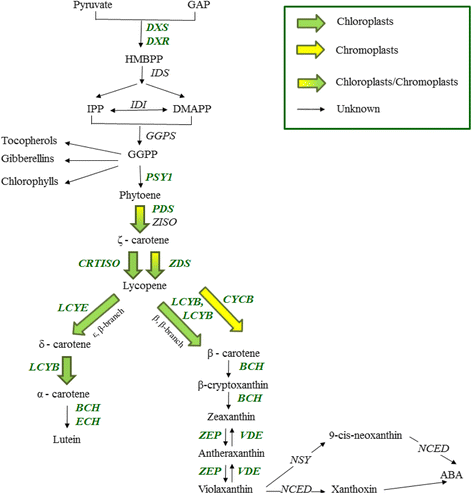
类胡萝卜素由五碳化合物异戊二磷酸(IPP)和其烯丙基异构体二磷酸二甲基烯丙基(DMAPP)形成。这些化合物形成香叶酰香叶酰二磷酸(GGPP),而GGPP又通过酶的活性形成植烯植烯合酶(PSY).植物素通过四次去饱和反应形成番茄红素ζ-胡萝卜素异构酶(ZISO), ζ-胡萝卜素去饱和酶(ZDS)而且胡萝卜素异构酶[13].番茄红素又经过一系列反应,通过ε、β支,即绿色植物中主要的类胡萝卜素,形成叶黄素[13],以及从玉米黄质中提取的紫黄质玉米黄质环氧化酶通过β, β-分支(图;1).这就形成了叶黄素循环,这是一种使植物适应强光胁迫的机制[10].9-顺式新黄质是由紫黄质转化而来新黄质合成酶(NSY),进而形成植物激素脱落酸通过9-顺式环氧类胡萝卜素双加氧酶活动(11,14],控制非生物应激信号通路[14].
枇杷类胡萝卜素的生物合成途径。被检测的基因绿色斜体加粗字母.酶/基因为:DXS, 1-脱氧-d -木酮糖5-磷酸合成酶;DXR, DXP还原异构酶;IDS,异戊基焦磷酸合成酶;IDI,异戊基焦磷酸异构酶;GGPS,香叶酰香叶酰二磷酸合成酶;PSY1,植烯合成酶;PDS,植物烯去饱和酶;ζ-胡萝卜素异构酶;ζ-胡萝卜素去饱和酶; CRTISO, carotene isomerase; LCYB, lycopene β-cyclase; CYCB, chromoplast-specific lycopene β-cyclase; LCYE, lycopene ε-cyclase; BCH, β-carotene hydroxylase; ECH, ε-carotene hydroxylase; ZEP, zeaxanthin epoxidase; VDE, violaxanthin de-epoxidase; NSY, neoxanthin synthase; NCED 9-cis-epoxycarotenoid dioxygenase. The metabolites are: pyruvate; GAP, D-glyceraldehyde 3-phosphate; HMBPP, (E)-4-hydroxy-3-methylbut-2-enyl diphosphate; DMAPP, dimethylallyl pyrophosphate; IPP, isopentenyl pyrophosphate; GGPP, geranylgeranyl diphosphate; Phytoene; ζ – carotene; lycopene; α – carotene; β – carotene; δ - carotene; lutein; β-cryptoxanthin; zeaxanthin; antheraxanthin; violaxanthin; 9-cis-neoxanthin; xanthoxin; ABA, abscisic acid (Figure is modified from [10,11,13,16,17])
类胡萝卜素生物合成途径受关键酶PSY的存在控制(图。1, (10,11,13,15,16,17])。关于枇杷,傅等[10]研究了一种红肉类胡萝卜素的分化机制。“洛阳青”)和白肉(cv。“白沙”)品种;两个品种类胡萝卜素积累的差异与基因表达的差异有关PSYI,CYCB,而且BCH基因。本研究的目的是监测“Obusa”果实(一种橙色果肉品种)果皮和果肉组织中的类胡萝卜素成分与果实成熟进程的相关性。为此,通过RT-qPCR测定了两种组织中类胡萝卜素生物合成基因的高分辨率时间表达谱,并与单个类胡萝卜素相连接,通过LC-MS进行定量。
方法
果实材料与实验设计
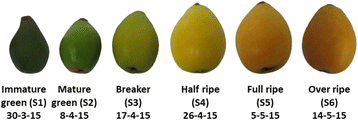
枇杷果“Obusa”大约每10天收获一次,在3月30日至5月14日之间。2),来自一个商业果园(Episkopi, Lemesos, Cyprus),由第一作者拥有。在每个发育阶段,根据大小和颜色选择30个相同的水果;这些果实被分为3个10个果实的亚批,代表生物复制。水果最初用于物理尺寸和颜色的测定,随后用于分子和分析分析,如下所述。使用BBCH量表来定义发展阶段[2].
为了进行分子分析,新鲜的果皮和果肉样品都在液氮中快速冷冻,并在−80°C保持到需要时。为了测定类胡萝卜素谱,样品采用冷冻干燥法(Freeze Dryer-Christ Alpha 1-4 LD plus)。
质量属性
水果的物理尺寸是用分析分级仪和电子口径(IS11112, Insize)测定的。颜色参数CIE L*(亮度或明度;0 =黑色,100 =白色),a*(−a* =绿色,+a* =红色)和b*(−b* =蓝色,+b* =黄色)用色度计(CR-400,柯尼卡美能达)测量每个水果的果皮和果肉组织。
分光光度法测定类胡萝卜素和叶绿素含量
二十毫升丙酮-己烷(4:6,v/v)加入到100 mg冻干植物材料中,并充分混合。两相分离后,测定上清液在453、505、645和663 nm处的吸光度。根据Nagata和Yamashita方程,测定了总类胡萝卜素、叶绿素a和叶绿素b含量[18].
液相色谱质谱(LC-MS)分析类胡萝卜素
枇杷类胡萝卜素的提取与皂化
样品的液-液萃取和皂化按照Minguez-Mosquera和Hornero-Mendez先前的描述进行[19].简单地说,使用UltraTurrax (Ika, Staufen, Germany)将0.5 g冻干组织(果皮或果肉)在丙酮-丁基羟基甲苯- 0.1%中均质,并离心(2000 rpm, 10分钟,4°C)。重复提取步骤,直到样品中的颜色完全去除。使用的内部标准是β-Apo-8 ' -胡萝卜素(Sigma, St Louis, MO, USA)。将提取物与乙醚混合处理。NaCl溶液(10%,w/v)来分离相。下相弃去,剩余相用钠冲洗2所以4(2%,w/v),以清除水残渣。取50毫升KOH(20%)的甲醇溶液,w/v),在黑暗中静置1小时。有机相用去离子水冲洗几次,直到洗涤液呈中性。然后通过无水钠层过滤2所以4并使用快速真空蒸发至干燥(Thermo Scientific Savant SPD121P)。用1ml丙酮:甲醇(7:3,v/v)并保存在−20°C直到需要。为了防止类胡萝卜素的异构化和光降解,所有的过程都是在苍白的光下进行的。
枇杷类胡萝卜素的LC- MS分析
类胡萝卜素分析使用安捷伦1200高效液相色谱法进行,该高效液相色谱法配有光电二极管阵列检测器和单四极质谱仪串联检测器(6120四极,安捷伦科技,圣克拉拉,加州,美国)。在反相Poroshell 120 EC-C上进行色谱分离18柱(100 mm × 3 mm, 2.7 μm粒度)(安捷伦科技),工作温度32℃。以0.05 M醋酸铵水和乙腈:甲醇(70:30)为流动相,流速为0.7 mL min−1.线性梯度从A中溶剂B的60%开始,20min时达到100%;在36 min时重新建立初始条件,在等容条件下保持40 min。注入量为5 μL。所有类胡萝卜素和类胡萝卜素酯的检测和定量是在450 nm的UV-vis下进行的(附加文件1:图S1)。
枇杷中类胡萝卜素的鉴定是在Agilent 1100 HPLC系统上进行的,该系统配备了光电二极管阵列和离子阱质谱检测器(Agilent Technologies, Waldbronn, Germany)。质量检测器是一台配备APCI(常压化学电离)的布鲁克离子阱光谱仪(型号HCT Ultra)。质谱仪参数如下:正离子模式(APCI +);源温度350°C;探头温度450℃,电晕电压4.0 kV;完整的扫描质量覆盖范围从m / z100到m / z1200,目标质量调整为350。用氦作为碰撞气体,在离子阱中进行了碰撞诱导碎片实验,电压从0.3上升到2 V。质谱数据在阳性模式下采集,质谱数据在阳性模式下采集n在自动模式下进行。通过提取离子电流的离子色谱图进行了峰的识别m / z对应于[M-H]的值+离子的个别调查化合物,以及他们的碎片。此外,为了确认类胡萝卜素的鉴定并获得更可靠的鉴定,使用Agilent 1290 Infinity UPLC系统耦合四极(Q-TOF)质谱仪(6550 Accurate-Mass QTOF, Agilent Technologies),使用带有射流技术的电喷雾接口对样品进行分析。色谱分离是在相同的条件下进行的,如上所述。电喷雾界面的最佳条件为:气体温度300℃,干燥气体11 L/min,雾化器65 psi,护套气体温度400℃,护套气体流量12 L/min。光谱是在m / z范围为100-1100,在正模式下,在MS中具有1.5个光谱的采集率,在使用的质量范围内保持超过50,000的质量分辨率。采用同时获取参考离子和质量漂移补偿的内部质量校准,以获得较低的质量误差。Q-TOF质谱数据使用Mass Hunter定性分析软件(版本B.06.00)进行处理。定量使用β-apo-8 ' -胡萝卜素作为内标。叶黄素、β-胡萝卜素和紫黄素(Sigma, St Louis, MO, USA),浓度范围为5-100 μg.mL−1分别用于量化三种不同组的化合物,羟基类胡萝卜素,胡萝卜素和环氧类胡萝卜素。新黄质、新色素、β-隐黄质环氧化物和β-胡萝卜素环氧化物被鉴定为紫黄质。β-隐黄质定量为叶黄素。的独联体用all-的校准曲线对-异构体进行定量反式同分异构体。浓度以每100 g样品鲜重(μg 100 g−1fw)。
RNA提取,cDNA合成,实时RT-PCR定量分析
根据Gambino等人开发的改进的十六烷基三甲基溴化铵(CTAB)方案,从枇杷果实材料的每个发育阶段(S1-S6)的三个膨胀生物重复中提取总RNA。[20.].接下来,用分光光度计(Nanodrop 1000分光光度计,Thermo Scientific)确认RNA完整性,然后进行凝胶电泳,用无rnase - DNase (Cat。不。NU01a, HT Biotechnology LTD, England)去除总gDNA,如其他地方所述[21].
总RNA (0.5 μg)按照制造商的方案(Takara Bio, Japan)使用PrimeScript™RT试剂试剂盒(Takara Bio, Japan)进行反转录。随后,采用BioRad IQ5 real-time PCR循环仪(BioRad, USA)进行实时定量RT-PCR。总共对枇杷皮和果肉的每个发育阶段进行了三个生物学重复分析。反应缓冲液为4 μL cDNA(所有基因的第一链cDNA稀释15倍)VDE而且LCYE引物各0.5 μL (10 pmol/μL)和5 μL SensiFAST™SYBR®荧光素混合物2×(生物啉)。总反应体积为10 μL。初始变性步骤为95°C 5 min,随后扩增40次[95°C 30 s,退火温度(TaoC) 30 s, 72°C 30 s], 72°C 5 min的最终延伸阶段。基因扩增循环之后是熔解曲线运行,从65°C增加0.5°C,共进行61个循环。先前发表的枇杷类胡萝卜素生物合成基因引物的退火温度(58 ~ 65℃)见附加文件1:表S1。枇杷的肌动蛋白基因被用作内参基因(EjACT).
统计分析
根据Duncan 's多路检验(显著性水平为5%)进行方差分析(单因素方差分析),比较各发育阶段的平均值,进行统计学分析(P≤0,05),采用SPSS v.17.0统计分析软件包。
基因表达水平的相对定量和统计分析采用REST-XL软件,采用成对固定再分配随机化检验[22].基因表达水平归一化对照EjACT家政内参基因;用皮和肉组织的初始发育阶段(S1)进行校准。
结果与讨论
定性属性
果实重量、长度和宽度分别为25.3-59.1 g、48.8-57.0 mm和34.4-45.0 mm(附加文件)1:表S2)。果实最大大小和重量出现在S5阶段,与收获的最佳成熟期相吻合。
L*肉的颜色参数为52.12 ~ 74.32,a*为−11.51 ~ 10.67,b*为30.75 ~ 36.67。L的对应值*,一个*b*−17.66-12.42和28.20-49.19(附加文件1:表S3)。前人对枇杷品种的研究表明,a*/b*色度比在未成熟的枇杷果实中为负值,在淡黄色枇杷果实中为零,在橙色枇杷果实中为正值;因此,较高的比例与较高的类胡萝卜素积累有关[1].在我们的研究中,肉中的a*/b*比率在S1阶段为负值-S3表示绿色,S4值表示色差,S5和S6值较高。同样,在剥皮的前三个早期阶段(−0.60至−0.20),a*/b*比值较低,在破皮阶段接近于零,而在最后的成熟阶段(0.24-0.29),a*/b*比值为正值(附加文件)1:表S3)。总体而言,根据以往的研究,a*/b*比值与类胡萝卜素总量的积累及其随树上发育进程的短暂增加有关[1,16].
类胡萝卜素和叶绿素含量
最初,采用快速比色法筛选类胡萝卜素和叶绿素含量。类胡萝卜素总量在0.8-6.1毫克100克和0.1-5.9毫克100克之间变化−1FW β-胡萝卜素等量物分别存在于果皮和果肉中(数据未显示)。Chl a和Chl b在未成熟绿色期的皮组织中浓度最高(18.0和12.1 mg 100 g)−1FW),而它们在肉中的含量则要低得多(0.6和0.5 mg 100 g)−1FW分别在S1期),其后随着树上成熟的进行而退化。在肉质果实成熟过程中,叶绿体转变为染色体;这一过程包括类胡萝卜素的短暂增加和叶绿素的降解[23].Chl a是一种蓝绿色颜料,比黄绿色Chl b更不稳定。
LC-MS法鉴定枇杷果实中的类胡萝卜素
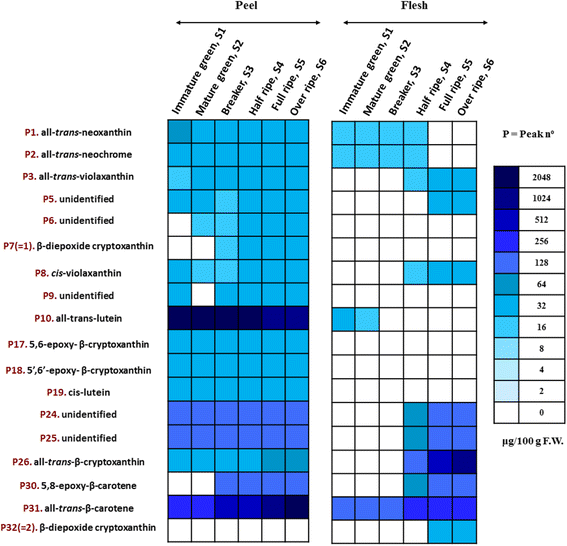
对果皮和果肉中的类胡萝卜素进行了鉴定和定量1,附加文件1:图S1)。HPLC-DAD和LC-MS技术共检测出32种类胡萝卜素。峰的识别是基于它们的相对保留时间值,它们的紫外-可见光谱,它们的质谱,文献信息,并在可能的情况下与真实标准进行比较。表格1总结了每种类胡萝卜素的鉴别数据,包括色谱和光谱值。
所有- - -反式-新黄质(峰1)具有特征性的紫外可见光谱。新黄质的分子质量由质子化分子确定m / z601和连续失去三个羟基从质子化分子,在m / z583, 565和547,经MS/MS验证。新色素的紫外-可见吸收光谱(峰2)在397、420和448 nm处具有较高的光谱精细结构(%III/II 90);这些数值与先前枇杷的研究结果一致[9].通过与标准品比较,鉴定出全反式紫黄素(峰3)。质子化分子在m / z601,碎片在m / z583和565,由于羟基和at的损失m / z221个,都是由601在MS/MS和源内片段形成的。8号峰初步鉴定为独联体-紫黄素具有与峰3相似的质谱、较低的λmax和光谱精细结构值。β-二氧基隐黄质,峰7和32(仅在S5和S6的肉中)]显示[M + H]+在m / z585.二阶质谱实验显示在m / z由于水和离子的流失m / z221和在m / z环氧基团的205特征,其中一个离子分别位于一个羟基环上,另一个离子位于一个未取代环上。所有反式-叶黄素是通过与真实标准品的比较来鉴定的。所有反式-叶黄素(峰值10)和独联体-叶黄素(峰19)具有特征性的紫外可见光谱,低色移8 nm独联体同分异构体。两种叶黄素异构体的鉴定通过质谱与质子化分子在m / z569和片段在m / z551年和m / z533的原因是分别失去了一个和两个羟基。此外,MS/MS还显示在m / z477由于甲苯的损失([M + H-92]+)来自多烯链。在APCI-MS中,片段与m / z551表现出高于质子化分子离子的强度(m / z569)。通过与文献资料比较,结合峰17和峰18的紫外-可见和质谱特征,确定其为β-隐黄素的单环氧化合物[9,24].两种环氧化合物的质谱均在m / z569和片段离子在m / z因为失去了一个羟基。峰17被指定为5 ',6 ' -环氧- β-隐黄质,因为在m / z205与未取代环中一个环氧基团的位置一致,而峰18在m / z221,表明环氧基与羟基成环。β-Apo-8 ' -胡萝卜素为峰21(内标)。质谱显示质子化分子在m / z417.离子的m / z分别检测到399和389对应于水分和一氧化碳的损失。甲苯从质子化分子的消除观察m / z325.建议使用内部标准来估计萃取过程中的损失。氢氧化钾皂化一直是类胡萝卜素分析的一个组成部分。木村等。[25结果表明,β-apo-8 ' -胡萝卜素经醛醇与丙酮缩合完全转化为柠檬黄质(峰22)。β-apo-8 ' -胡萝卜素转化为柠檬黄质的转化率为98%,并考虑它们的总和进行量化。通过对其质子化分子的鉴定,证实了该物质的存在m / z457年(26]及其特征紫外-可见光谱[27].由于存在相同的发色团,β-隐黄质(峰26)和β-胡萝卜素具有相似的紫外可见光谱。不出所料,质子化分子在m / z553和MS/MS显示在m / z551和461对应羟基和甲苯的损失。5,8-环氧-β-胡萝卜素(峰30)的紫外-可见光谱特征无法识别。质谱显示质子化分子在m / z553和MS/MS均显示在m / z551和461分别对应羟基和甲苯的损失,在m / z221对应于3-羟基β环上环氧基团的位置。β -胡萝卜素的质谱峰31显示质子化分子在m / z537和一个片段离子在质谱/质谱m / z444,对应于甲苯从多烯链中流失。
枇杷果实中类胡萝卜素的组成
结果显示果皮和果肉的类胡萝卜素组成存在很大差异。特别是,枇杷皮中发现了32种类胡萝卜素,而果肉中只发现了18种类胡萝卜素。除质性差异外,果皮中类胡萝卜素含量显著高于果肉。当用分光光度法测定总类胡萝卜素时,情况并非如此,这表明这种比色法的局限性。色谱图谱还显示果皮中主要的类胡萝卜素为反式叶黄素,反式-β-胡萝卜素。浓度反式-叶黄素在1621.5 ~ 688.4 μg 100 g之间随成熟的进行而降低−1弗兰克-威廉姆斯。另一方面,反式-β-胡萝卜素含量从151.9 μg 100 g急剧增加到1096.9 μg 100 g−1弗兰克-威廉姆斯。生物合成的一些类胡萝卜素如反式-β-隐黄质,5,8-环氧-β-胡萝卜素,β-二氧基-隐黄质和独联体-紫黄素也被监测(图;3.,附加文件1:表S4)。相反,反式-neoxanthin和反式-新色素随着果皮发育的进展而减少或保持稳定,而在果实发育的最后阶段,在果肉中未检测到。
枇杷果肉的类胡萝卜素图谱与果皮有很大不同。成熟果实中类胡萝卜素含量最高反式-β-隐黄质,其次为反式-β-胡萝卜素,化合物18和31,以及5,8-环氧-β-胡萝卜素(峰30)(表1,无花果。3.,附加文件1:表S4)。所有类胡萝卜素在树上发育期间的浓度增加,除了反式-neoxanthin,反式-neochrome和反式-叶黄素被发现(图;3.,附加文件1:表S4)。总的来说,发育阶段对类胡萝卜素组成有很大的影响。
枇杷果皮和果肉中鉴定的类胡萝卜素(Τable 1)的定量热图(cv。“Obusa”)在六个树上发育阶段(n= 3)。结果以μg 100 g表示−1鲜重(F.W.)颜色强度的刻度以A表示传说.所鉴定的类胡萝卜素的实际量化值见附加文件1表S4
所有- - -反式-neochrome,所有反式黄质,β-diepoxy-cryptoxanthin,独联体黄质,所有- - -反式-叶黄素,5,6-环氧-β-隐黄素,5 ',6 ' -环氧-β-隐黄素反式-β-隐黄质,植烯和全-反式-β-胡萝卜素先前在巴西的五个枇杷品种中被鉴定出来[9].在他们的研究结果中,他们报告说反式-β-胡萝卜素(19 - 55%),反式-β-隐黄质(18-28%)、5,6:5,6 -二氧基-β-隐黄质(9-18%)和5,6-环氧-β-隐黄质(7-10%)是主要的类胡萝卜素。在果肉中,发现β-胡萝卜素和叶黄素是主要的类胡萝卜素,新黄素、紫黄素、叶黄素、9-独联体-紫黄素,植物烯,植物芴和ζ -胡萝卜素也存在。
本研究的类胡萝卜素定量分析表明,果皮的类胡萝卜素含量高于果肉,但β-二氧基-隐黄质在果皮的第3 ~ 6个成熟期出现,范围为15.0±0.8 ~ 21.2±1.7 μg 100 g−1最后成熟期(S5和S6)果肉中FW含量分别为17.6±1.2和21.4±1.8 μg 100 g−1FW,分别(图;3.,附加文件1:表S4)。反式-neoxanthin和反式-新色素出现在果皮的所有发育阶段以及果肉的前4个成熟阶段。另一方面,反式-紫黄素在果皮中的含量随果实成熟的进行而增加(15.6±2.5 ~ 25.2±4.6 μg 100 g)−1FW),最后阶段(S4-S6)在肉中检测到,呈渐进式增加(从12.5±0.2到21.5±1.6 μg 100 g)−1弗兰克-威廉姆斯)。观察到类似的结果和趋势独联体-紫黄素,含量范围为16.2±2.5 ~ 23.2±3.0 μg 100 g−1从S4期开始在果肉中检测到FW(12.3±0.1 ~ 19.1±1.5 μg 100 g)−1弗兰克-威廉姆斯)。5 ' 6 '环氧-β隐黄质独联体-叶黄素只在果皮的所有发育阶段检测到(图。3.).有趣的是,反式果皮中的-叶黄素在发育初期含量最高,之后逐渐下降,同时只有在第1和第2阶段果肉中才有可检测到的含量,但与果皮相比显著降低。柠檬黄质和植物素也被鉴定出来,尽管它们没有被定量(表1).
基因表达谱
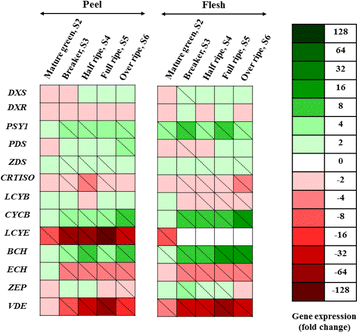
为了阐明枇杷类胡萝卜素生物合成途径,我们对13个已知的类胡萝卜素途径基因的表达谱进行了分析,结果显示枇杷果皮和果肉组织中存在不同的表达模式(图2)。4,附加文件1:表S5-S6和图S2-S3)。对于基因表达分析,每个组织都单独检查,将S1期作为被测组织(果皮或果肉)的校准器。
类胡萝卜素生物合成基因相对表达量热图(Dxs, dxr, psy1, pds, zds, crtiso, lcyb, cycb, lcyo, bch, ech, zep而且VDE)在枇杷果实(cv。“Obusa”),包括果皮和果肉,在五个树上发育阶段(S2-S6) (n= 3)。相对mRNA丰度采用3个生物重复序列进行实时RT-PCR检测。上调表示在绿色;中表示下调红色的.一个盒子里的对角线表示具有统计学意义的值(P≤0.05)。颜色强度的刻度以A表示传说.果皮和果肉的第一发育阶段(S1)被用于校准基因运动值。实际相对表达水平显示在附加文件1:表S5-S6和图S2-S3
类胡萝卜素生物合成途径中下游基因(Cycb, lcy, bch, ech而且VDE)在S2-S6发育阶段的表达水平与其余基因相比存在明显差异。无论是皮还是肉,PSY1,ZDS,CYCB,而且BCH在大多数发育阶段均较S1期显著上调,而CRTISO,LCYE,决定自而且VDE一般都被调低了。PDS在果皮的S6期显著上调,而在果肉组织的S3期显著抑制。ZDS果皮中S3和S5阶段表达量增加,而肉组织中S4和S6阶段表达量增加。表达水平变化无统计学意义dx, DXR(均参与MEP通路)和LCYB与S1期相比,在剥皮阶段进行监测;在肉DXR遵循同样的趋势,dx在S3和LCYB转录水平在S4-S6阶段逐渐下降,这可能是低水平或无法检测到的原因反式-叶黄素在肉中的含量(图;1,3.而且4).齐柏林飞艇果皮中S6期表达抑制最强,而果肉在S3-S5期表达上调。
BCH而且CYCB随着果皮和果肉的发育,转录水平显著上调,在果实发育的最后阶段转录水平最高(图2)。4,附加文件1:表S5、S6)。特别是在肉组织中,增加了8.1倍和11.0倍CYCB而且BCH分别记录最后阶段与初始阶段的成绩单。PSY1在果皮的S3、S4和S6阶段以及果肉的所有阶段(S2-S6)均有统计学意义上的增加;在肉中最显著的基因调控是在S3和S5阶段发现的(附加文件1:表S6)。
相反,CRTISO, LCYE, ECH和VDE在皮和肉组织中均表现出整体的下调表达模式。CRTISO剥皮阶段s3 ~ s5下调;在肉体中监测到类似的趋势(S3-S6阶段)。决定自从阶段S3开始,果皮和果肉都有相似的表达模式(抑制)。LCYE果皮在5个发育阶段均下调;S5期降幅最大(128倍)。有趣的是,在肉中,这种下降在S2阶段就出现了,此后就没有发现。VDE在果皮的S3至S6阶段和果肉的所有发育阶段,表达水平都受到抑制。无论是皮还是肉,VDES5期较S1期明显抑制(分别为36.8倍和49.5倍)。
值得注意的是,PSY1,已知催化类胡萝卜素形成的第一步[14],随着果皮和果肉的发育,表达水平普遍上调;然而,在S3和S5阶段监测到肉组织中最高的转录本值,与总类胡萝卜素积累不同步。在另一种肉质水果(苹果)中,Ampomah-Dwamena等人[28)也假设PSY1不同基因型的类胡萝卜素表达水平与类胡萝卜素含量无直接相关性。另一方面,PDS上游途径基因(S6)仅在果皮的最后发育阶段(S6)表现出较高的转录水平;PDS表达水平与类胡萝卜素含量高和低的苹果品种相关[28].
反式-叶黄素在果皮的前四个阶段积累较多,在成熟和过熟阶段减少,而在果肉中检测到的含量仅在叶绿体开始发育为染色体的初始发育阶段记录。这种减少可以归因于以下事实:(1)LCYE与相应的各组织未成熟阶段相比,在皮和肉的整个发育阶段都明显下调(特别是在肉的S3-S6期间监测不到转录物),(2)LCYB在肉的最后发育阶段(S4-S6)和(3)下调。决定自在果皮和果肉中mRNA的表达普遍下调(S3-S6)。傅等。[10]指出,叶黄素在枇杷品种果肉中的含量随着树上果实发育的进展而出现短暂性下降,而与树上果实发育没有任何联系BCH在红肉品种“洛阳青”中表达明显上调。的提高BCH基因表达也在我们的研究中监测了相似的肉型枇杷品种。Ampomah-Dwamena等人[28显示出密切的相关性LCYE苹果果皮中类胡萝卜素的表达及含量。肉体不是这样的;建议降低管制LCYE与较低的反式-叶黄素的浓度
相反,高BCH最后两个阶段在肉中记录的表达值可以与短暂的类胡萝卜素积累相联系反式-β-隐黄质在这些阶段,伴随较高的mRNA表达CYCB和non-detectableLCYE转录本(阶段S3-S6)。这些发现与Fu等人的研究结果一致。[10],而BCH红肉品种“洛阳青”的数值在破碎期呈短暂性升高。此外,CYCB在S4期后表达水平也较高。加藤等人[11的减少LCYE在柑橘果实中,类胡萝卜素途径的ε、β分支在未成熟向成熟过渡过程中向β、β分支转移,基因表达与β-胡萝卜素含量的增加有关。赵等人。[16发现BCH是柿子果实中β-隐黄质含量高的原因,与其他枇杷品种的研究结果一致[29].后一项研究表明β-隐黄质的合成和积累与β-隐黄质的大量表达有直接联系BCH.的瞬时增加反式-β-胡萝卜素在S6剥皮期也与β-胡萝卜素的上调有关CYCB以及对LCYE,如别处所述[10].张等。[29]也表明枇杷果皮中较高的β-胡萝卜素水平与维生素d含量的大量增加有关PSY1,以及CYCB而且BCHmRNA表达水平。
VDE与校准器(S1阶段)相比,导致紫黄素生物合成的表达在几乎所有阶段都被显著抑制,无论是在果肉中还是在果皮中(因此期望很少的紫黄素);在这种情况下齐柏林飞艇这种色素能将紫黄质转化为玉米黄质等前体分子,主要趋势是它在肉中分几个阶段被诱导。这与代谢物水平一致独联体- - -反式-紫黄质在肉中的几个阶段均处于相当低的浓度和/或无法检测到。3.,4;额外的文件1:表S4)。
结论
在不同的树上发育阶段,“Obusa”果实的类胡萝卜素特征被阐明,这是一种橙色果肉的枇杷品种。结果表明,类胡萝卜素的组成在果实发育过程中受到很大的影响,表明果肉和果皮组织之间存在明显的差异。主要的类胡萝卜素是反式叶黄素,反式-β-胡萝卜素,以及反式-β隐黄质,反式-β-胡萝卜素和5,8-环氧-β-胡萝卜素。据我们所知,他的存在独联体-叶黄素、柠檬黄质和5,8-环氧-β-胡萝卜素在枇杷中未见报道,仅在其他热带水果中见过[30.,31].此外,还试图建立枇杷果实发育阶段基因上调或下调与其表达对类胡萝卜素含量的影响之间的联系。含量升高反式-β-胡萝卜素在果肉和果皮中的含量随着果实发育的进展而升高CYCB,类胡萝卜素的主要生物合成基因。值得注意的是,无法检测到的反式-叶黄素在S3-S6阶段可以与显著抑制LCYB而且LCYE这些阶段的表达水平。与未成熟阶段相比,后者基因的转录本水平在整个果皮发育阶段也显著降低。
缩写
- 阿坝:
-
脱落酸
- BCH:
-
β-胡萝卜素羟化酶
- 的背影,
-
并且
- 的背影b:
-
Chlorophyll-b
- CRTISO:
-
胡萝卜素异构酶
- CYCB:
-
染色体特异性番茄红素β环化酶
- DMAPP:
-
Dimethylallyl焦磷酸
- DXR:
-
DXP reductoisomerase
- dx:
-
1-deoxy-D-xylulose 5-phosphate-synthase
- 决定自:
-
ε-胡萝卜素羟化酶
- EjACT:
-
枇杷膏肌动蛋白
- 弗兰克-威廉姆斯:
-
鲜重
- 差距:
-
d -甘油醛3 -磷酸
- GGPP:
-
Geranylgeranyl二磷酸
- ggp:
-
香叶酰香叶酰二磷酸合成酶
- HMBPP:
-
(E) 4-hydroxy-3-methylbut-2-enyl二磷酸
- 伊迪:
-
异戊基焦磷酸异构酶
- id:
-
异戊基焦磷酸合成酶
- IPP:
-
Isopentenyl焦磷酸
- LCYB:
-
番茄红素β环化酶
- LCYE:
-
番茄红素ε环化酶
- 数控:
-
9-cis-epoxycarotenoid加双氧酶
- NSY:
-
Neoxanthin合酶
- PDS:
-
八氢番茄红素desaturase
- PSY1:
-
八氢番茄红素合成酶
- VDE:
-
黄质de-epoxidase
- ZDS:
-
f-carotene desaturase
- 齐柏林飞艇:
-
玉米黄质环氧酶
- ZISO:
-
ζ-胡萝卜素异构酶
参考文献
- 1.
周超,徐佳杰,孙德昌,李霞,陈克胜。白色和红色果肉枇杷中的类胡萝卜素。农业食品化学。2007;55:7822-30。
- 2.
杨晓明,杨晓明,杨晓明,杨晓明,杨晓明。枇杷物候期的研究进展(枇杷(研究)。采用)。应用生物学杂志,1999;134:353-7。
- 3.
徐海霞,陈建文。12个枇杷品种的商品品质、主要活性物质含量及抗氧化能力(枇杷采用)水果。中国食品科学,2011;91:1057-63。
- 4.
Pinillos V, Hueso JJ, Marcon Filho JL, Cuevas J.阿尔及利亚枇杷果实成熟度指数随收获季节的变化。科学通报,2011;29(6):769 - 76。
- 5.
Goulas V, Minas IS, Kourdoulas PM, Vicente AR, Manganaris GA。两种枇杷的植物化学成分、抗氧化剂及细胞壁代谢(枇杷)不同贮藏条件下的品种。食品化学,2014;155:227-34。
- 6.
费雷雷斯F,戈梅斯D, Valentão P, Gonçalves R, Pio R, Chagas EA,等。改良枇杷(枇杷)品种:酚类物质和抗氧化潜力的变化。食品化学。2009;114:1019-27。
- 7.
Vogel JT, Tieman DM, Sims CA, Odabasi AZ, Clark DG, Klee HJ。类胡萝卜素含量影响番茄的风味接受度(茄属植物lycopersicum).中国食品科学。2010;30(4):339 - 344。
- 8.
Kaulmann A, Bohn T.类胡萝卜素,炎症和氧化应激对细胞信号通路的影响及其与慢性疾病预防的关系。Nutr res 2014; 34:907-29。
- 9.
De Faria AF, Hasegawa PN, Chagas EA, Pio R, Purgatto E, Mercadante AZ.巴西枇杷品种对类胡萝卜素组成的影响。中国食品工业杂志,2009;22:196-203。
- 10.
付旭,孔伟,彭刚,周杰,Azam M,徐超,等。红白肉枇杷质体结构及胡萝卜素基因表达(枇杷)水果。中国科学(d辑),2012;
- 11.
加藤。柑橘类胡萝卜素积累的机理。中国科学(自然科学版),2012;
- 12.
付旭,冯超,王超,尹旭,卢鹏,Grierson D,等。枇杷中多种植物素合成酶基因在组织和品种特异性类胡萝卜素积累中的参与。中国科学(d辑),2014;
- 13.
王晓明,王晓明,王晓明,王晓明。高等植物类胡萝卜素通路的遗传调控。中国生物医学工程学报,2003;26(3):344 - 344。
- 14.
门德斯AF,苏亚雷斯VL,科斯塔MG。类胡萝卜素生物合成基因组学。在:陈c,编辑。水果和蔬菜中的色素。纽约:施普林格;2015.9-29页。
- 15.
Shumskaya M, Wurtzel ET.类胡萝卜素生物合成途径:全方位思考。植物科学进展(英文版);
- 16.
赵东,周成,陶娟。两种柿子果实类胡萝卜素积累及基因表达(Diospyros柿子l .)发展。植物分子生物学杂志2011;29:646-54。
- 17.
Galpaz N, Ronen G, Khalfa Z, Zamir D, Hirschberg J.通过克隆番茄白花位点发现了一条染色体特异性类胡萝卜素生物合成途径。植物细胞。2006;18:47 - 60。
- 18.
张志刚,李志刚,李志刚,等。番茄果实中叶绿素和类胡萝卜素含量的测定方法研究。中国食品科学,1999,19(3):344 - 344。
- 19.
Minguez-Mosquera MI, Hornero-Mendez D.红辣椒类胡萝卜素的分离与定量研究(甜椒L.),辣椒粉和油脂树脂的反相高效液相色谱法。农学通报。1993;41:1616-20。
- 20.
Gambino G, Perrone I, Gribaudo I.一种从葡萄和其他木本植物不同组织中提取RNA的快速有效方法。植物化学学报。2008;19:520-5。
- 21.
Georgiadou EC, Goulas V, Ntourou T, Manganaris GA, Kalaitzis P, Fotopoulos V.连续生长期橄榄果实中树上维生素E生物合成的调控:果实发育和环境线索的影响。前沿植物学报2016;7:1656。
- 22.
Pfaffl MW, Horgan GW, dempple L.相对表达软件工具(REST(C))进行实时PCR中相对表达结果的分组比较和统计分析。核酸研究,2002;30:e36。
- 23.
Lois ML, Rodriguez-Concepcion M, Gallego F, Campos N, Boronat A.番茄果实发育过程中类胡萝卜素生物合成:1-脱氧-d -木酮糖5-磷酸合酶的调节作用。植物学报2000;22:503-13。
- 24.
De Rosso VV, Mercadante AZ. doyalis和tamarillo果实中花青素和类胡萝卜素的HPLC-PDA-MS/MS。农学通报。2007;52:9135 - 41。
- 25.
Kimura M, Rodriguez-Amaya DB, Gody HT。皂化步骤在类胡萝卜素和维生素原定量测定中的评价A.食品化学,1990;35:187-95。
- 26.
杨晓明,杨晓明,杨晓明,等。HPLC和LC-(APCI)质谱法测定蛋黄中叶黄素的含量。农业化学学报。2006;54:2267-73。
- 27.
米特罗斯卡,魏森特,冯霍尔斯特。反相高效液相色谱-等径波长二极管阵列法分离和定量15种类胡萝卜素。中国生物医学工程学报(英文版);2012;
- 28.
杨晓明,杨晓明,杨晓明,杨晓明。苹果代谢及基因表达分析(马吕斯x有明显)主要。中国科学(d辑),2012;
- 29.
张磊,张震,郑涛,魏伟,朱勇,高原,等。黄白枇杷果实发育过程中类胡萝卜素积累及基因表达的研究。Hort Plant J. 2016; 2:9-15。
- 30.
巴西热带水果camu-camu的类胡萝卜素成分(Myrciaria dubia).食品化学。2007;101:1526-32。
- 31.
De Rosso VV, Mercadante AZ.针叶菜两种巴西基因型的类胡萝卜素组成(Malpighia punicifoliaL.)。食品法令2005;38:1073-7。
确认
作者要感谢George Sismanidis先生和Marina Christofi夫人在植物化学分析方面提供的技术援助。
资金
作者要感谢Remedica通过“塞浦路斯科技大学开放获取作者基金”为支付出版费用提供的支持。
数据和材料的可用性
所有支持研究结果的数据都包含在手稿及其补充文件中。
作者的贡献
GAM构思了这个项目并设计了实验。VF、MH、ECG进行分子实验。FB, AM和HMDM进行了分析实验。数据分析包括MH、ECG、VG、VF、AM和HMDM。MH, ECG, AM, HMDM, VG, VF, FB和GAM撰写了论文。所有作者都阅读并批准了最终的手稿。
相互竞争的利益
枇杷果实采自MH拥有的商业果园。作者声明了非经济竞争利益,如果手稿发表后公开,可能会使他们尴尬。
发表同意书
不适用。
伦理批准并同意参与
不适用。
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
作者信息
从属关系
相应的作者
额外的文件
附加文件1:
图S1-S3和表S1-S6说明了文本中引用的额外信息。(ZIP 182 kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
Hadjipieri, M., Georgiadou, e.c., Marin, A.;et al。枇杷果皮和果肉组织中类胡萝卜素生物合成途径的代谢和转录解析。BMC植物生物学17日,102(2017)。https://doi.org/10.1186/s12870-017-1041-3
收到了:
接受:
发表:
关键字
- 枇杷
- 发展阶段
- 成熟
- 成熟
- β-胡萝卜素
- β隐黄质
- 叶黄素
- 质
- 生物合成途径