摘要
背景
转化酶(INV)是调节蔗糖代谢的关键酶,并且在此显示涉及对植物中的环境胁迫的反应。迄今为止,尽管其在蔗糖代谢中具有重要的基因组,但甘蔗的个体成员及其表达模式是未知的。
结果
本研究以比较基因组学为基础,从甘蔗中成功克隆了转化酶基因家族14个非冗余成员中的11个cDNA和12个DNA序列。对转化酶基因家族进行了全面分析,包括基因结构、系统发育关系、功能结构域、蛋白质保守基序等。结果表明,来自甘蔗的14个转化酶成员可以聚为3个亚家族,包括6个中性/碱性转化酶(ShN/AINVs)和8个酸性转化酶(ShAINVs)。甘蔗和高粱分裂后,酸性INVs分化速度快于中性/碱性INVs。在四组酸性inv中至少观察到一次基因重复事件,而β8谱系中的ShN/AINV1和ShN/AINV2是β组N/ ainv副同源基因中最近重复的基因。在干旱、低温、葡萄糖、果糖和蔗糖5种非生物胁迫下,利用实时荧光定量PCR技术对这些基因进行了综合表达分析。结果表明,在5种不同的治疗中,INVs的功能和潜在作用存在差异。在5种非生物胁迫条件下测定了甘蔗幼苗的酶活性,结果表明,在5种不同的非生物胁迫条件下,所有INVs的酶活性均被显著抑制,中性/碱性INVs在非生物胁迫中的作用比酸性INVs更突出。
结论
本研究以高粱为参考,通过PCR克隆确定了甘蔗INV基因家族成员,为甘蔗INV基因家族的研究提供了首次。结合已有的7株植物的INV基因数据,采用比较的方法,包括一系列综合分析,分离和鉴定了INV基因家族成员,证明是非常成功的。此外,在甘蔗中首次报道了与干旱、低温、葡萄糖、果糖和蔗糖相关的INV基因表达量和酶活性变化。本研究结果为进一步研究INVs对甘蔗蔗糖积累的生理作用提供了基础和框架。
背景
甘蔗是世界上最具经济价值的作物之一,占全球蔗糖产量的80%。由于其茎中积累大量蔗糖的能力显著,可达到700 mM或超过干重(DW)的50%,因此可作为研究蔗糖积累的重要模式作物[33.].由于生物燃料生产和生物量生产挑战,随着需求的增加[7.],提高甘蔗的蔗糖产量越来越受到人们的重视。因此,蔗糖在甘蔗中的积累机制是目前甘蔗研究的重点之一。然而,现代甘蔗品种具有最复杂的基因组之一,它既是非整倍体,又是同源多倍体,其倍性从八倍体(x = 8)到十二倍体(x = 12)不等。迄今为止,对蔗糖代谢相关基因的研究尤其有限。
在植物中,转化酶(EC 3.2.1.26,INV)催化蔗糖的不可逆水解成葡萄糖和果糖,因此被认为是蔗糖代谢调节中的枢轴酶[4.].此外,还证明了INV,促进了植物生长和发展的许多方面[49.那51.],器官形成,糖转运,应激反应[56.,碳分配[41.那51.]、韧皮部卸载和源库调节[37.,并调节水池组织中糖的成分和水平[37.].植物INVS由大的基因家族,其可分为酸INV亚家族以及根据用于活动其最适pH的中性/碱性INV子家族编码[46.那55.].酸INV亚家族包括细胞壁转化酶(CWINVs)作为细胞壁结合形式和液泡转化酶(VINVs)作为可溶形式[4.];细胞壁转化酶来源于呼吸真核生物,而液泡转化酶来源于好氧细菌[47.].芳氢转化酶作为可溶性酸转化酶(SAinvs)通常从进化中的细胞壁边酸转化酶中分支[23].Cell Wall Invs可能在生殖发育中发挥多功能调节作用,Phloem卸载,碳分区[41.那51.]及水槽发展[10那46.].液泡INVs调节渗透压、糖信号、蔗糖积累和蔗糖浓度,特别是在库器官扩张阶段[25].酸转化酶(AINVs)的基因结构是高度保守的,并且包含六至八个外显子。在几乎所有的酸转化酶基因,该第二外显子编码仅三个氨基酸,DPN,属于催化结构域的保守基序NDPNG,并且是在植物生物学已知最小的功能性基序[1].成熟酸性转化酶的分子量在55到70 kD之间,在多个位点都有n -糖基化[52.].酸性转化酶包含一个n端结构域、一个成熟多肽和一个c端区域[46.].n端结构域由一个信号肽和一个前肽组成,共约100个氨基酸残基长[47.].中性/碱性反转酶(n / ainvs)只存在于植物和光合细菌中,据信起源于Cyanobacteria [4.].与酸性INV表格相比,中性/碱性INVs定位于多个亚细胞室,包括线粒体,塑性体积[34.]和细胞核[41.].中性/碱性INVs不同于酸性INVs,因为它们不包含n端信号肽,没有糖基化[36.,因此不那么稳定[39.].中性/碱性INVs的作用不如酸性INVs清楚[42.].到目前为止,从龙舌兰、水稻、小麦、番茄、胡萝卜、玉米、杨树trichocarpa和拟南芥4.那9.-11那16那23那27那30.那46.那47.那53.].
在甘蔗中,酶转化符是良好的记录茎中蔗糖积累的关键调节剂[13那17那18那58.];N/ ainv存在于细胞的细胞质或代谢室中,在分生组织中活性低,参与贮藏组织中的糖积累[17].在18个月大的甘蔗品种中,N/ ainv在蔗糖水解中比sainv在收获后茎中糖的早期贮藏中更重要[44.].最近,研究发现转基因甘蔗植株中N/AINVs活性的降低会导致呼吸和蔗糖循环的减少,蔗糖与己糖的比值增加,这表明N/AINVs在引导碳流向甘蔗茎的呼吸过程中至关重要[40.].sainv主要存在于贮藏薄壁细胞的液泡中[13那18,并在快速生长的组织中表现出高活性[17].蔗糖在甘蔗茎中的积累被认为是受SAINVs和蔗糖磷酸合酶活性的差异调节的[58.].甘蔗品种转录水平与酶活性、SAINV活性与己糖含量呈正相关,成熟期和未成熟期节间蔗糖含量与SAINV活性呈负相关[44.].在转基因甘蔗中,胞内和胞外糖组成对INV活性的变化高度敏感,酸性INV活性与蔗糖积累呈负相关[14];在另一项转基因甘蔗的研究中,酸性INV活性降低70%并不改变蔗糖负荷或纯度[5.].
虽然这些长期研究涉及用于调节甘蔗生长和蔗糖积累的主要酶的主要酶,但阐明了甘蔗中蔗糖遗传改性指南的转化酶功能滞后的分子机制。全面了解植物物种中基因家族的分子机制和演化是了解倒置调节的生理作用和代谢机制的第一步。可用的基因组高粱双色,为甘蔗基因组研究提供了一个极好的模型[35.].本研究通过比较基因组学方法预测转化酶基因成员,并通过PCR克隆和测序进一步验证,通过实时PCR检测基因表达水平。本研究的目的是:(1)确定甘蔗转化酶基因家族的成员;(2)表征转化酶基因家族在不同非生物胁迫下的表达模式;(3)分析遗传多样性和分化转化酶基因家族的功能。
方法
植物材料
甘蔗品种FN41在福建农林大学(福州,中国)校园进行了栽培。根据摩尔的方法[32.],从7 ~ 9个月龄的田间甘蔗植株中采集新鲜叶片组织(第三片成熟叶片,从叶卷中数出)进行DNA和RNA分离,进一步用于基因的基因组和cDNA克隆
以4叶期愈伤组织培养的甘蔗幼苗为材料,进行PEG处理、冷处理和糖处理试验。为避免秸秆贮藏营养的本底效应,在试验处理前用无糖MS培养基回收幼苗植株24 h。PEG胁迫处理:将幼苗置于含10% (W./V.)PEG6000在28°C的28°C / 8-H黑色下为16-H光的光电子。低温处理:在无糖培养液中温育幼苗,并在10℃下在15℃/ 8h黑色下在16小时内生长。糖处理:将三组幼苗在MS培养溶液中孵育4小时,24℃,3%(W./W)蔗糖,3% (W./W)葡萄糖,3% (W./ w)分别果糖。对照处理:在24℃下在28℃/ 8h黑暗中在16小时光的无糖培养溶液中温育幼苗。来自五个处理实验中的每一个的新鲜叶组织立即在液氮中冻结,在RNA分离和酶提取之前储存在-80℃。RNA用于INVS基因表达的RT-QPCR分析。
对7种植物的INV基因家族进行BLAST搜索
17个已知INV基因的基因组序列(附加文件)1:表S1)拟南芥(http://www.arabidopsis.org/来自大米的十九岁[23)(附加文件1表S1)作为查询,搜索葡萄、木瓜、Brachypodium distachyon,玉米和高粱。BLAST匹配的相似度评分为>50.0,概率评分<10-4作为候选序列收集。这些INV基因的候选序列通过注释数据库(http://www.phytozome.net/)通过BLAST和BLASTX。此外,利用CD-Search工具(http://www.ncbi.nlm.nih.gov/Structure/cdd/docs/cdd_search.html).
甘蔗的克隆转化酶基因
为获得甘蔗INV基因的ORF和DNA序列,根据Genbank (http://www.ncbi.nlm.nih.gov/genbank/).一个正向引物和反向引物被设计在ORF的相对两端(附加文件2:表S2,可作为本文的补充材料)。
使用TRIzol试剂(Invitrogen Co., Carlsbad, CA, USA)从田间成熟甘蔗的新鲜叶片样品中提取总RNA,然后用RNase-free dnase (Ambion, AM1906)处理后进行逆转录。琼脂糖凝胶电泳分析RNA样本的完整性。根据TIANcombi DNA Lyse&Det PCR试剂盒生产厂家说明书(中国天根),从成熟甘蔗新鲜叶片样品中分离基因组DNA。
cDNA克隆,根据Revert Aid™First Strand cDNA Synthesis Kit (Thermo Fisher Scientific.)的说明,用1 g总RNA合成第一链cDNA。利用基因特异性引物,PCR扩增出覆盖INV基因开放阅读框的cDNA片段。RT-PCR和基因组DNA PCR采用相似的PCR方法。PCR反应体积为10 μL,包括总DNA或cDNA第一链模板1 μL、5 μL 2 × GC LA Taq Buffer、各引物0.2 μL、0.2 μL LA Taq、0.8 μL dNTP (2.5 mmol/L)和2.6 μL ddH2O.将扩增的DNA片段和cDNA片段克隆到pMD19-T Vector Kit (TaKaRa)中,由华大基因技术有限公司(BGI-Tech)进行测序。
转化酶家庭成员的序列分析
基因注释:潜在的INVs的克隆序列是Blast / Blastx到Genbank数据库。确定的基因组序列用FGenesh程序注释(http://www.softberry.ru/berry.phtml)的cDNA序列和EST资料糖.进一步手动检查注释基因。
测序分析:基因组和cDNA的序列是Blast / Blastx至Genbank以确认这些序列是INV。使用在线工具(以下)将确定的cDNA序列翻译成蛋白质序列(http://web.expasy.org/translate/).进一步分析了它们的理论等电点(pI)和分子量(Mw) (http://web.expasy.org/compute_pi/).使用CD-Search工具检测推定的保守域(http://www.ncbi.nlm.nih.gov/Structure/cdd/docs/cdd_search.html),和亚细胞定位是由亚细胞定位预测服务器预测(植物mPLoc,http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/;SignalP 4.1服务器,http://www.cbs.dtu.dk/services/SignalP/;MitoProt,http://ihg.gsf.de/ihg/mitoprot.html;1.1的ChloroP服务器,http://www.cbs.dtu.dk/services/chlorop/).利用模因(http://alternate.meme-suite.org/tools/meme.最大motif数目为15,最小motif宽度为6,最大motif宽度为50,每个序列motif出现的分布为0或1。利用基因结构显示服务器(http://gsds.cbi.pku.edu.cn/index.php) [19].
系统发育分析
8种植物INV基因的氨基酸序列(附加文件)1:表S1)由MEGA5.1构建无根系统发育树[50.].由于使用Clustalw对齐方式运行Mega 5.2,因此生成了邻居加入拓扑作为1000引导对齐对齐的共识。
RT-qPCR分析基因表达
使用RevertAid™第一链cDNA Synthesis Kit (Fermentas)对不同处理的每个样品的总RNA进行逆转录。基于对甘蔗的注释发票S基因组序列,RT-QPCR引物(附加文件3.:表S3),采用Beacon Designer 7软件设计扩增序列,扩增序列至少包含一个内含子,并通过常规RT-PCR检测引物特异性,以进行实验质量控制。对3个生物学重复中的3个技术重复进行了实时PCR。为确定每个引物的扩增效率,采用4倍稀释的cDNA (40.,4-1,4-2,4-3,4-4).RT-qPCR的是在ABIPrism®7300HT快速实时PCR机(Applied Biosystems公司,USA)进行。PCR反应含有10 2X SYBR绿色主混合物的μL(Takara公司),模板cDNA(稀释10倍),引物0.4微升2微升混合(各20mM)和7.6微升双蒸水2o . PCR循环是:3分钟在95°C紧随其后40 95°C的周期为15秒和60°C 45 s和检查个人的特异性PCR扩增使用热离解的协议从65到95°C的最后周期后PCR。25 srrna (E1:5 -CCTATTGGTGGGTGAACAATCC-3”;E2:5 ' -GCAGCCAAGCGTTCATAGC-3 ')作为内参基因,在广泛的甘蔗组织中均有稳定的表达[15那20.那31.].将各样本中所有基因与甘蔗叶片25SrRNA的表达量进行比较,并根据归一化相对量计算各INV在不同处理下的相对表达量。
蔗糖酶活性
提取酶
每个处理的叶片组织在液氮中研磨,然后在4°C或更低的温度下进行样品提取。
可溶性INVs的提取
将0.5g组织用5ml 50mmol / l Hepes萃取缓冲液均化,含有12mmol / L mgcl2、1 mmol/L EDTA、1 mmol/L EGTA、10 mmol/L DTT、2 mmol/L苯甲脒、0.05% Triton-X 100、0.05% BSA、2% PVPP [58.].匀浆通过微滤膜过滤,在9366 g离心10分钟。上清液立即用Sephadex g -25 (Pharmacia PD-10)脱盐和去糖,并保存在冰上,直到检测进行。
细胞壁INVS提取
0.5 g甘蔗叶组织用10 ml 50 mmol/L HEPES缓冲液均质,不含2% PVPP) [58.匀浆以25151 g / rpm离心15分钟。沉淀物(含细胞壁部分)用1.7 ml 50 mmol/L HEPES缓冲液(同上,25151 g /L HEPES缓冲液)均质,随后在25151 g /L HEPES缓冲液中离心15分钟。用Sephadex G-25 (Pharmacia PD-10)脱盐两次,将上清液(对CWI馏分进行富集)保存在冰上直到使用。
inv活动试验
类似于Tang等人[51.), 0.4毫升的脱盐提取物均质与反应混合物在37°C(2.4毫升)(1.2毫升0.1 mol / L磷酸/柠檬酸和0.8毫升0.1 mol / L蔗糖,pH值4.6酸中性/碱性发票发票和pH值7.5)和孵化了60分钟。细胞壁发票活动分析,1毫升的脱盐提取物与6毫升反应均相混合物(3毫升0.1 mol / L磷酸/柠檬酸缓冲(pH值4.6),2毫升0.1 mol / L的脱盐提取蔗糖)和孵化37°C 120分钟煮脱盐提取和葡萄糖的浓度梯度(Sigma-Aldrich)被用作背景控制和标准,分别。加入2.4 mL DNS停止反应,煮沸5 min,在540 nm处测定还原糖的吸光度。以每克总蛋白每分钟形成的产物微克(μg. glc .g . 1. pr .min-1)为酶活单位。
结果
6种植物基因组中INV基因的鉴定
为了获得INV基因的参考序列在甘蔗中用于比较基因组学分析,19和17以及注解发票年代从栽培稻[23),拟南芥(https://www.arabidopsis.org.)分别用于搜索这些家庭成员vitis Vinifera那卡里卡番木瓜那Brachypodium distachyon那Zea Mays.和高粱双色(附加文件1:表S1)。17发票S是在vitis Vinifera,8来自卡里卡番木瓜, 19Brachypodium distachyon21岁的玉米,和19高粱双色(附加文件1:表S1)。研究了7种植物(包括水稻和水稻)INV基因的保守结构域和染色体定位拟南芥)进行了分析,并在其他文件中列出1S1:表。
高粱INVs(高粱INVs)是甘蔗最接近的二倍体近亲SbINV(附加文件1:表S1),以供进一步参考。在我们的研究中,对高粱的INV基因家族进行了全基因组鉴定,发现高粱基因组中有19个INV。在19个binv中,有7个是中性/碱性inv (SBN / AINV.s), 12个为酸性INVs,包含10个细胞壁INVs (SbCWINV或多个),和两个液泡INVS(SbVINVs)。七个SBN / AINV蛋白质含有保守的Glyco_hydro_100,而酸性蛋白蛋白含有甘油蛋白β32n和glyco_hydro_32c的保守结构域。有两组sbcwinv,含有Sbcwinv2 / 3 / 5/6的一组,其他含有SBCWINV8 / 9/10的设置,分别位于未组装的超级Contig_67和染色体6中。观察到两组基因都源自串联重复(附加文件1:表S1)。
甘蔗INV基因家族的克隆与序列分析
使用19SbINVs与甘蔗EST相结合作为引物设计的参考,通过RT-PCR克隆甘蔗中的11个同源Invs的11个CDNA。根据来自SBINV的引物参考,11个CDNA称为SHN / AINV1,2-2,3-2,4-2,5,6-2,SHCWINV6,7-3,8-2,10和SHVINV1序列类似于sbinvs(表1).3个序列(ShCWINV6,ShCWINV8-2,ShVINV1)仅怀有部分开放阅读框(ORF),其余8被预测为包含完整的ORFs(表2).此外,为了研究甘蔗中因维病毒的基因结构,利用基因组pcr技术克隆了甘蔗因维病毒。共获得12条与9个ShINVs对应的DNA片段,其中8条序列(除了ShCWINV3、ShCWINV8-1、ShCWINV9-1和ShCWINV9-2)包含完整的编码区(见表)2).9个shinv7和ShCWINV9分别有2个和3个基因等位基因。共23条序列,包括11个cDNA和12个基因组片段,对应14个INV基因,其中6个N/ ainv, 7个cinvs和1个VINV。将这些DNA和cDNA序列提交到Genbank:SHN / AINV1(KC145794),SHN / AINV2-1(KC145808),SHN / AINV2-2(KC145795),SHN / AINV3-1(KC145809),SHN / AINV3-2(KC145796),ShN / AINV4-1(KC145810),ShN / AINV4-2(KC145797),SHN / AINV5(KC145799),ShN / AINV6-1(KC145807),ShN / AINV6-2(KC145798),ShCWINV1(KC145815),ShCWINV3(KC145801),ShCWINV6(KC145800),ShCWINV7-1(kc145811),ShCWINV7-2(KC145812),ShCWINV7-3(kc145802),ShCWINV8-1(KC145814),ShCWINV8-2(KC145816),shcwinv9-1(KC145803),shcwinv9-2(kc145804),shcwinv9-3.(KC145813),Shcwinv10.(KC145805),Shvinv1.(KC145806)(表1).
将这些INV序列翻译为氨基酸序列,用于蛋白质特性的计算分析(表)2).这些23个士女序列中,含有完整的ORF(开放阅读框)16个士女序列预测为具有分子量范围从62.60到70.23千道尔顿(表2).比较分析同源蛋白质序列的高粱基因显示,中性/碱性发票共享身份(从99%到97)高于酸发票(从94%到87),表明速度散度发生在中性/碱性比酸分离后的发票发票甘蔗和高粱(表2).除没有完整orf的序列外,甘蔗和高粱中同源INV蛋白的分子质量相似(见表)2).根据Plant-mPLoc预测的亚细胞定位,INVs分为三种类型:细胞壁型、液泡型和细胞质型。对于中性/碱性INVs,除ShN/ AINV2-1和ShN/ AINV4-1外,其余中性/碱性INVs均定位于叶绿体。然而,根据ChloroP/MitoProt预测的定位概率,有5个中性/碱性INV蛋白(SbN/AINV5, ShN/AINV5, SbN/AINV6, ShN/AINV6 - 1, ShN/AINV6 - 2)最有可能定位于线粒体,因为线粒体靶向的概率高于叶绿体靶向的概率(表)2).另外,使用在线工具SIGNALP,四套甘蔗和高粱(CWINV1s,CWINV7s CWINV9s和CWINV10s)的同源基因的被预测为具有对分泌蛋白所需要的疏水性的N-末端信号肽(表2).
因为糖杂交种是来自遗传背景的高度全多倍S.officinarum和S.spontaneum,基因等位基因的序列可能来自于这两个中的任何一个糖物种。23序列14 INV基因,7ShINVs (SHN / AINV2.那ShN / AINV3 ShN / AINV4那SHN / AINV6那ShCWINV7那ShCWINV8和ShCWINV9)有2-3个等位基因。这些7ShINVS,等位基因SHN / AINV2.那SHN / AINV3.那SHN / AINV4.和SHN / AINV6共享的蛋白质序列相似性从98%到99%不等(见表)3.).等位基因的ShCWINV7共用蛋白质序列同一性从92到93%,和shcwinv9-1那shcwinv9-2和shcwinv9-3.共用蛋白序列的范围从91〜97%,而等位基因的蛋白质序列同一性ShCWINV8-1和ShCWINV8-2是98%。这些结果表明SHN / AINV2.那SHN / AINV3.那SHN / AINV4.那SHN / AINV6,ShCWINV8可能起源于s . officinarum这导致了大约80%的遗传背景,而基因等位基因ShCWINV7和ShCWINV9可以从两者中衍生出来吗糖由于每个基因内的等位基因呈现序列变异(表4.).
在甘蔗和高粱的INV基因的基因结构和系统发育分析
对甘蔗和高粱INV基因家族的系统发育分析表明,INV可分为两个分支(酸性INV分支和中性/碱性INV分支),每个分支又可进一步细分为α和β亚群(图1)。4.).acid inv分支包含CWINV和VINV,一组CWINV可进一步分为两个亚群(α和β)。在α亚群中,3个CWINVs (ShCWINV1那ShCWINV3和ShCWINV7)与高粱同源基因的基因结构非常保守,其中ShCWINV7有两个等位基因,而ShCWINV7 - 1比ShCWINV7 - 2少10个氨基酸,比ShCWINV7 - 2多1个外显子(表)2,无花果。4.).在亚组β,ShCWINV8共享与高粱其直向同源基因类似的基因结构,虽然它的同源基因SbCWINV8包含一个更9 bp的外显子和一个更最后的外显子,而观察到ShCWINV9的三个基因的等位基因具有在第三外显子分裂如图ShCWINV9-3的全CDS基因结构对应于高粱SbCWIN9的外显子。
在中性/碱性INV分支,从子组的基因α和β分别包含6首4个外显子,(图4.).在α亚组中,基因表现出内含子大小的差异,而在α亚组中,基因表现出内含子大小的差异ShN / AINV6-1具有与其直向性基因相同的基因结构SBN / AINV6在高粱。在β亚群中,基因显示保守的外显子大小,因此,三个ShN / AINVs (SHN / AINV2-1那SHN / AINV3-1和ShN / AINV4-1)共享相同的内含子 - 外显子结构与它们高粱直向同源基因。N / AINVs比较保守AINVs通过对高粱和甘蔗的比较分析那这与上述基于序列相似性对高粱和甘蔗同源基因对的比较分析是一致的。
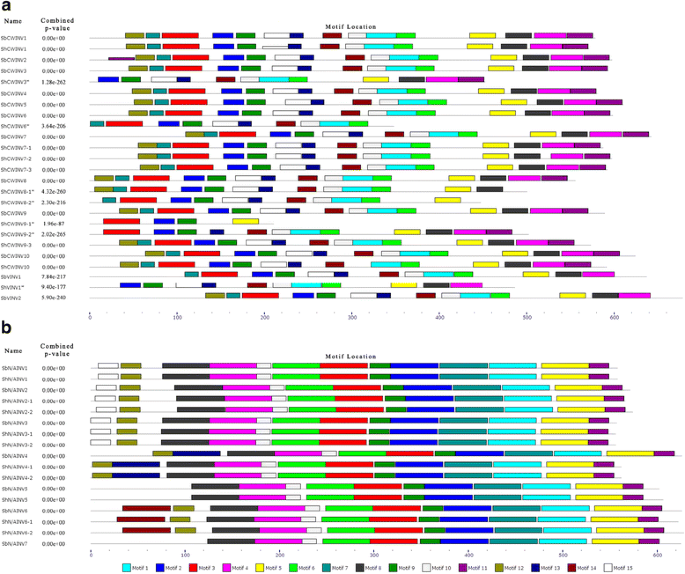
基序在甘蔗和高粱转化酶中的分布
为了比较甘蔗和高粱的INV功能域,我们使用MEME网络服务器结合DNAMAN识别甘蔗和高粱的INV基序。在INVs中发现了15个保存的图案(附加文件)4.:表S4),在这些酸性INV基序中,基序12、基序7和基序14分别含有NDPN、RDP和WECP/VD催化残基[29].总的来说,除了缺少完全CDS的甘蔗INVs外,除了一对同源基因(ShCWINV10/SbCWINV10)略有变异外,ShINVs的基序序列与高粱同源INVs相似。在ShCWINV10/SbCWINV10中,motif 10在ShCWINV10中不存在,而在SbCWINV10中存在(图2)。5.额外的文件5.:图S2和附加文件6.:图S3)。NDPN主题中的DPN由迷你外显子编码,并且易于在马铃薯的冷应力下替代拼接,转晶沉淀能力[6.那43.,但ShCWINV3*, ShCWINV6*, SbCWINV7/ ShCWINV7-1 / ShCWINV7-2, ShCWINV8-1 */ ShCWINV8-2 *, ShCWINV9-1 */ ShCWINV9-2 */ ShCWINV9-3和SbVINV1/ShVINV1*均不存在5.:图S2)。
来自甘蔗和高粱的中性/碱性INV用于其外科基因的推定功能基序。类似地,在副杀酰基基因中,除了在N-末端中的三个基序(图案13,14和15)之外,通常保守来自甘蔗和高粱的中性/碱性INV。12个图案,包括含有催化残基的基序3和基序6(两个ASP)[21那23],观察到在它们的尺寸和分布(图是一致的。5B.额外的文件6.:图S3)。在n端三个变异基序(基序13、14和15)中,基序15分布在SbN/AINV1/ShN/AINV1、SbN/AINV2/ShN/AINV2 - 1、-2和SbN/AINV3/ShN/AINV3 - 1、-2的n端;motif 13特异分布于SbN/AINV4/ShN/AINV4 - 1,-2的n端;motif 14特异性分布在SbN/AINV6/ShN/AINV6 - 1,-2的n端(图6 - 1)。5B.).基于基序比较的这些差异,N/ ainv可以分为四个亚功能分歧。这些基序的变异可能导致不同的生物学特性和功能。
转化酶基因家族和其他植物转化酶同源物的系统发育分析
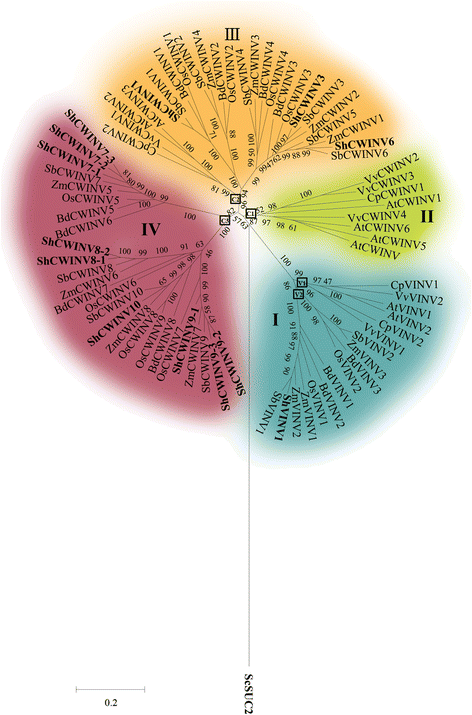
为了理解在甘蔗INV基因之间的进化关系,无根系统发生树被构建用于使用来自八个植物物种的蛋白序列酸INVS和中性/碱性INVS(附加文件1:表S1,图2和图。3.).此外,使用来自的INV构建8棵系统发育树拟南芥那vitis Vinifera那卡里卡番木瓜那栽培稻那Brachypodium distachyon那Zea Mays.那高粱双色和糖果,分别(附加文件7.:图S1)。从这些植物证明INVS在这些植物的系统发育关系是一致的,保守的系统发育树的比较(附加文件7.:图S1)。所有来自这些工厂的INV分为酸性和中性/碱性INV类。酸性INVs可分为液泡型INVs和两个细胞壁亚群(α和β组)。碱性/中性INVs也可进一步细分为α和β亚群(附加文件7.:图S1)。的来自八个植物物种酸INV基因的系统发育树形成的被指定为组I至IV(图4个明显分支。2).在系统发育树中,液泡型INVs (VINVs)分布在由双子叶和单子叶基因组成的独立分支I中,而细胞壁型INVs (CWINVs)可分为3个分支(分别称为II、III和IV)。细胞壁INVs的三个分支中,分支II和分支IV分别由单子叶和双子叶的基因组成,分支III同时包含双子叶和单子叶的基因。这些结果表明,分支III的基因比其他两个分支的基因更古老。此外,分支IV的单子叶基因包含两个亚群,这两个亚群比分支II的双子叶基因更明显,表明单子叶植物的基因重复发生在双子叶植物之前。这一结果也可能表明单子叶植物比双子叶植物具有更高的基因进化速率。甘蔗中,ShVINV1分布在I组,ShCWINV1、ShCWINV3、ShCWINV6分布在III组,ShCWINV7-1/2/3、ShCWINV8-1/2、ShCWINV9-2/3、ShCWINV10分布在IV组。
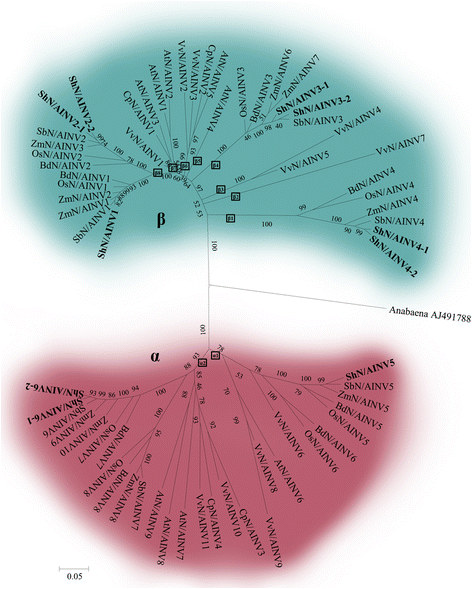
的中性/碱性INV基因来自八个植物物种进化树可以被分离成两个不同的组中,被称为α组和β组(图3.).α组又分为α1和α2两个亚群,其中包含双子叶和单子叶的N/ ainv。在α2亚群中,基因可以分为两个分支,而双子叶植物的基因则分布在其中一个分支中,表明该亚群中单子叶植物的基因复制时间比双子叶植物的基因复制时间更早。β组包含8个亚组(β1-β8),其中β1、β4和β8仅包含单子叶N/ ainv,其余5个亚组仅包含双子叶N/ ainv。有趣的是,每一个单子叶植物的特定亚群(β1, β4和β8)都含有所有单子叶植物的基因,而双子叶植物的基因更分散并分布在不同的亚群中。这些结果表明,β组的N/ ainv在单子叶植物中出现的时间比在双子叶植物中更晚。在甘蔗中,ShN/AINV5和ShN/ AINV6-1/2分别分布在α1和α2中。ShN/ AINV4-1/2、ShN/ AINV3-1/2和ShN/AINV1分别分布于β1、β2和β3。
PEG胁迫、冷胁迫和糖胁迫下INVs的表达
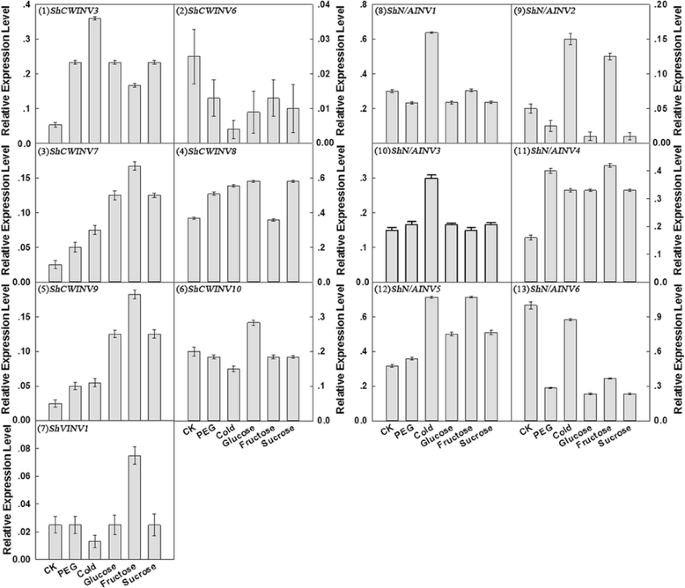
为了测试Invs如何响应干旱和低温应激,并说明INV表达是否由水解产物(葡萄糖和果糖)或其基材(蔗糖)调节,我们检查了1的13个INV中的转录水平- 在PEG应激,冷应激和糖(葡萄糖,果糖和蔗糖)处理下的甘蔗幼苗。这也可以深入了解INV基因家族成员的潜在功能分歧。检查的基因(图。6.),ShCWINV3那ShCWINV7那ShCWINV9和SHN / AINV4.被发现在PEG胁迫、冷胁迫和糖处理下上调(至少是对照的两倍),ShCWINV6和SHN / AINV6PEG胁迫、冷胁迫和糖胁迫下均下调。至于Shvinv1.其中,与对照相比,冷处理降低了0.5倍,果糖处理增加了近2倍,而其他处理无明显变化(图2)。6.).SHN / AINV3.除冷处理外,其他处理均无显著差异。其他5种INVs在5种处理下的相对表达水平差异显著(图2)。6.).在PEG处理下,与对照相比,表达ShCWINV3那ShCWINV7那ShCWINV8那ShCWINV9那SHN / AINV3.那SHN / AINV4.和SHN / AINV5增加了,最重要的是ShCWINV3增加超过3倍。表达ShCWINV6那Shcwinv10.那SHN / AINV1那SHN / AINV2.和SHN / AINV6下降,并与SHN / AINV6与对照相比,下降最显著的是70%(图3)。6.).在冷处理的反应,酸INVsShCWINV3那ShCWINV7那ShCWINV8和ShCWINV9诱导,而诱发ShCWINV6那Shcwinv10.和Shvinv1.被压抑。在特别,ShCWINV3过冷处理后的最大上调(大于5.5倍)。所有中性/碱性INVS表达上调(至少为两个折作为对照)响应于冷处理除SHN / AINV6该呈小幅降解(图6.).在三种不同的糖处理中ShCWINV3那ShCWINV7那ShCWINV9和SHN / AINV5上调,特别是表达ShCWINV7和ShCWINV9在葡萄糖、果糖和蔗糖处理下分别增加约4倍、6.5倍和4倍的表达量。此外,ShCWINV6和SHN / AINV6在3种糖处理下表达下调,而SHN / AINV1和SHN / AINV3.(图。6.).
总的来说,中性/碱性INVs的转录本比酸性INVs的转录本更丰富。在中性/碱性发票,SHN / AINV5是最丰富的形式和表达层次SHN / AINV2.五种处理下最低。在五种处理和对照的酸性INVs中,ShCWINV8显著高于其他基因的表达水平,而ShCWINV6表达水平最低。此外,ShCWINV1在五种治疗中和控制中没有显示表达(图。6.).
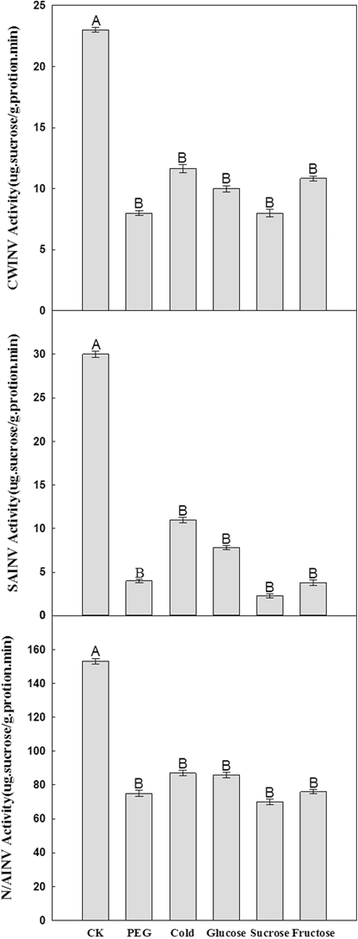
干旱、低温和加糖处理下甘蔗酶活性的变化
在干旱,低温和糖处理下,在甘蔗幼苗中测定细胞壁INV,可溶性酸INV和中性/碱性INV的活性。所有这些INV的活动的变化表现出相同的趋势响应于五种不同的非生物应激(图。7.),各INVs活性均降低(图。7.).更具体地说,与对照相比,5次处理后细胞壁INV活性逐渐下降(约48%-66%)。在PEG和果糖处理下,INV的可溶性酸活性降低了87%,蔗糖处理下降低了92%。此外,中性/碱性INV活性在三个INV类别中下降最小,与对照组相比,蔗糖处理仅下降53%。但在其他处理下,其活性下降幅度小于50%。7.).在不同实验条件下的三个种蔗糖酶活性被抑制显著但相比较而言水溶性酸INV活性的抑制更为明显。中性/碱性INVS在控件中显示高催化能力,具有活性比其细胞壁INVS和5.75倍,比可溶性酸INVS的更高的高4.16倍。然而,随着下五个不同的治疗方法的最高催化能力的中性/碱性INVS更明显,例如,它显示出8.8倍于细胞壁INVS更高的活性,并且比下PEG处理可溶性酸INV 19倍。下冷处理,中性/碱性INVS的水解活性较高6-7倍细胞壁INVS和可溶性酸INVS。此外,中性/碱性INVS分别具有下葡萄糖治疗比细胞壁INV和可溶性INVS 8,9.9倍更高的活性和中性/碱性INVS有27.6,比下蔗糖和果糖的治疗分别(图可溶性酸INVS更高18.2倍的活性。7.).
讨论
INVs在植物的蔗糖积累中起着重要作用,自半个世纪前在甘蔗中就有充分的文献记载[13那17那18].由于缺乏完整的甘蔗基因组内参序列,以高粱为亲缘关系最近的甘蔗作为内参进行PCR克隆,难以确定基因家族成员。本研究在高粱基因模型的基础上克隆了11个cdna和12个与14个甘蔗INVs对应的dna(附加文件)1:表S1,表1),从而为甘蔗INV基因家族的研究提供了首次机会。在甘蔗中,基于高粱基因组的基因组和转录组的PCR扩增无法捕获高度分化的基因,因此无法确定甘蔗中INVs的绝对数量。甘蔗全基因组测序对于全面鉴定甘蔗中的一个基因家族是必要的。1).
糖杂种是高度多倍体,遗传背景来自S.officinarum和美国spontaneum.典型的基因糖可以有多达12个不同的等位基因,其中每个可能来自美国officinarum或美国spontaneum[57.].在该研究中,14个Shinvs中的5个具有2-3个基因等位基因,其变体用于推导每个基因的氨基酸序列。基于基因等位基因中的序列相似性,难以确定基因单倍型的起源糖由于杂种之间的密切关系美国officinarum和S. Spontaneum。随机引物PCR克隆自糖基因功能研究的杂种不适用于潜在的基因功能分歧美国officinarum和美国spontaneum.某些等位基因可能具有特定的功能。例如,抗褐锈病基因(Bru1)在甘蔗中被建议是单剂量,这是Saccharum Hybrid R570中唯一的抗性等位基因[2那12].未来的基因功能研究,应着重于基因等位基因的识别美国officinarum促进的糖表征糖的同源基因的杂种美国officinarum作为参考。
在本研究中,基于对8种植物中酸性INVs的系统发育分析,将酸性INVs分为4个类群(I、II、III和IV,图。2).双子叶和单子叶的液泡型INV均归为ⅰ组,ⅰ组与细胞壁型INV明显分离(图2)。2),表明液泡型INVs起源于细胞壁INVs,发生在双子叶和单子叶的最后共同祖先(LCA)之前。这一结果扩展了先前的推论,即液泡型INVs起源于细胞壁INVs早于水稻和拟南芥的LCA [23].双子叶植物液泡型INV与单子叶植物液泡型INV的分离表明,LCA可能通过两个不同的途径(获得或丢失内含子)含有一个液泡型INV基因,从而在双子叶植物和单子叶植物谱系中产生两个不同的基因。或者LCA可能具有两个液泡型INV基因,LCA的两个前体分别在双子叶和单子叶谱系中发生重复事件。单子叶植物和双子叶植物均有III组基因,但单子叶植物的同源基因数量高于III组双子叶植物,说明双子叶植物中存在单子叶植物特有的重复,双子叶植物中不存在潜在的基因功能冗余。此外,系统发育分析表明,组III的LCA比组II和组IV的LCA更古老,因为组III是在单子叶/双子叶分化之前产生的。综合分析还揭示了酸性INVs的进化历史,按年龄重复递减排序,组I(含ShVINV1)、组III(含ShCWINV6、ShCWINV3、ShCWINV1)、组IV(含ShCWINV7、ShCWINV8、ShCWINV9)。在酸型INVs的四组中至少观察到一个基因重复事件,表明基因有潜在的功能冗余。这一推测与高粱和甘蔗推导出的氨基酸比较的证据是一致的2).
对8种植物中性/碱性INVs进化的分析也揭示了类似的复杂进化关系。在8种植物的N/ ainv系统发育树(图。3.),N / AINVs分布在两个不同的组(α和β基团)。在α组中,双子叶植物和单子叶植物的LCA包含两个中性/碱性INV基因(框标记的α1和α2)。在α1谱系,从葡萄的基因(VVN / AINV6)与单子叶植物的基因组合在一起,虽然在α2谱系,从双子叶植物和单子叶植物的基因分成两个明显的分支,并从单子叶植物的基因也可以被细分为两个分支。因此,甘蔗基因(SHN / AINV6,和SHN / AINV7(不存在于甘蔗))在α2谱系被建议是双子叶植物/单子叶植物的分裂后最近重复和比在α1谱系甘蔗基因较旧的(SHN / AINV5)。在β组,N / AINVs的LCA的具有8个基因(框标记的β1-β8),该双子叶植物和单子叶植物物种的发散之后发生。八周的LCA的,β2和β3分别为葡萄N / AINVs,β5,β6和β7的先驱物双子叶植物特异性N / AINVs,β1,β4和β8的先驱物N / AINVs的单子叶植物特定前身。这是有趣的是,所有的直系同源N /从单子叶植物AINVs归为一类,而中,双子叶植物的基因被分为β2和β3谱系只包含葡萄基因,β5谱系只包含一个拟南芥基因。结果表明,双子叶植物β组的N/ ainv分化程度高于单子叶植物。β8谱系中的ShN/AINV1和ShN/AINV2是β组中最近重复的副同源基因。
高粱和甘蔗的同源基因对N/ ainv的同源性(97% ~ 99%)高于可溶性酸性INVs的同源性(87% ~ 94%),说明在高粱和甘蔗分裂后,酸性INVs的分化速度比N/ ainv快(见表)2).对甘蔗副同源基因的序列比较也显示,N/AINVs的分化度低于酸溶性INVs(表)3.).这些结果表明,N/ ainv比酸溶型inv受到更强的功能约束。甘蔗和高粱在双子叶/单子叶分裂后进行了1 ~ 2轮酸性INVs lca基因重复,但仅有2组平行的N/AINVs (SbN/AINV6/SbN/AINV6, ShN/AINV7(甘蔗中缺失)/SbN/AINV7)是近期重复。因此,高粱和甘蔗的酸性INVs序列变异高于N/ ainv,这可能是由于这些酸性INVs祖先的功能冗余造成的。
为了进一步了解INVs的基因进化,我们分析了高粱和甘蔗的外显子-内含子结构模式,发现ShCWINV3、ShCWINV8-1、ShCWINV9-1和ShCWINV9-2发生了外显子缺失(图)。4.).因此,这一证据进一步证实了它们是截断型基因,这与前面讨论的氨基酸序列分析一致(图。4.额外的文件5.:图S2)。除这些截尾基因外,其他基因的外显子-内含子组织在CWINV基因家族中存在差异。所有CWINV基因都保留了主要的基序(图2)。5.),提示基因结构变异是由外显子分裂或内含子长度变异引起的,而不是伪外显子化,因为伪外显子化会导致基序缺失。该基因在N/AINV基因家族中高度保守,且高梁和甘蔗中性/碱性INVs的进化尤其清晰,α组的外显子-内含子连接位置不同于β组。所有α组成员都有6个外显子,所有β组成员都有4个外显子,外显子-内含子连接完全保守。因此,不同的内含子-外显子连接和不同数量的外显子证明了甘蔗和高粱中中性/碱性INV基因的α和β组来源于不同的祖先基因,具有4和6个外显子,这与图中报道的结果一致。3..基于基序比较,N/AINV基因的第一个外显子可能发生了外显,因为它们的第一个外显子编码变异基序。总体而言,N/ ainv的基因结构比酸性invv更为保守,这也支持了上述结论,即在高粱和甘蔗分裂后,酸性invv的分化速度比N/ ainv快。
干旱胁迫和低温胁迫使甘蔗积累糖分的能力受到损害。我们研究了干旱和低温胁迫下参与蔗糖代谢的蔗糖切割酶的表达模式和活性。这些短期的生理变化导致糖浓度的变化,这可能足以有效地调节基因的表达。除ShVINV1基因的表达不受PEG影响外,几乎所有的INV基因的表达都受到PEG和低温处理的影响。观察到的发票基因的上调表达的甘蔗叶中应对干旱胁迫或冷治疗可能是因为更多的发票需要打通蔗糖为己糖糖和随后为细胞提供更多的能量来维持呼吸活动增加除了解放更多的碳和能量合成不同的化合物[46.],增强对环境压力的抵抗力[53.].也有可能需要提高INVs水平,才能将更多的Suc切割成Glc和Fru,从而大大提高细胞的渗透压以应对压力,这也间接提供了INVs产生如in一样的渗透调节底物的证据拟南芥[24].因此,可以上调一些Invs的表达以应对在干旱和冷应激下切割更多蔗糖的需要,而其他INV的表达可以下调以维持蔗糖稳态。如图1所示。6.其中4个基因(ShCWINV3、ShCWINV7、ShCWINV8和ShCWINV9)在PEG和冷胁迫下表达上调(尤其是ShCWINV3), 2个基因(ShCWINV6和ShCWINV10)表达下调。细胞壁INVs被认为在建立代谢汇中发挥作用,通过不可逆的蔗糖裂解为葡萄糖和果糖代谢糖,为下游代谢功能和糖调节信号[10那38.].虽然可以容易地解释细胞壁INV的上调,以提高将SUC切割成GLC和FRU的能力,并增强细胞的渗透压,因此SHCWINV6的下调表达可能是由于需求其在特定亚细胞隔室中的分布并与糖调制信号相互连接,用于阻断下游代谢以适应干旱和冷应力。在干旱和冷应激下,SHN / AINV6的表达降低,更具体地,在干旱胁迫下降低3倍(图。6.).这一结果可以用以下发现来解释:中性/碱性INVs可能作为维持酶参与蔗糖降解和维持蔗糖浓度[55.].在以前的研究,可溶性酸INVS显露了定位于液泡来控制蔗糖存储和糖组合物[48.].在冷应激下,观察到所有真空INV在杨树的冷应激下上调8.],总INV mRNA水平在郁金香中显著上调(郁金香l .简历。阿珀)灯泡3.].而在本研究中,ShVINV1在干旱胁迫下表达水平没有变化,而在冷胁迫下表达水平几乎减半。因此,ShVINV1和ShN/AINV6在冷胁迫下的下调表明,冷胁迫与PEG胁迫的分子调控机制存在差异(图)。6.).糖参与许多细胞过程。除了在植物生长和发育过程中的能量和形成结构组分之外,它还在信号转导途径中调节糖代谢的基因表达[46.].葡萄糖,蔗糖以及果糖长期被称为糖积累中的重要信号分子[37.].为了响应糖的可用性变化,细胞可以调节糖代谢中涉及的转化酶的数量。以葡萄糖、果糖或蔗糖作为唯一碳源生长的甘蔗显示出INV基因表达模式的改变(图2)。6.).响应于糖的治疗,在甘蔗INV基因呈现不同的表达模式与来自玉米的酸INV基因响应于蔗糖一致,葡萄糖以及其他代谢糖[56.].上INV表达的蔗糖诱导以前的研究都没有解决蔗糖本身或它的部件(葡萄糖和果糖)是否实际诱导剂[26].然而,近年来关于糖信号分子性质对INV调控的研究表明,糖特异性通路可能存在分化。例如,葡萄糖,而不是蔗糖,诱导拟南芥根细胞壁INVs的表达[55.),C. Rubrum.[38.].此外,酸INV活性的调节是由己糖抑制,特别是通过果糖[54.].然而,在该研究中,蔗糖作为INV的基材以及葡萄糖也诱导了5个基因的表达(SHN / AINV4,SHN / AINV5,SHCWINV3,SHCWINV7和SHCWINV9)。外源糖和蔗糖抑制2基因的表达(SHN / AINV6和SHCWINV6)(图。6.).
这些结果表明,糖可以直接调控大多数INV基因的表达。此外,当碳源为葡萄糖或蔗糖时,除ShCWINV10外,所有转化酶mrna的表达水平几乎相同,且低于它们在果糖中的表达水平ShCWINV3那ShCWINV8和SHN / AINV3.(图。6.).该发现表明,INV基因成员具有不同的糖特异性响应机制;随着一些inv基因对果糖的反应比对蔗糖或葡萄糖更敏感。从先前的研究中出现的普遍图片是糖信号降低糖合成和蔗糖代谢的基因的转录,并增加糖储和利用所涉及的基因的转录[22那28那45.那55.].一致考虑到这一结论以及我们的实验结果,我们提出在存在足够的碳源调节基因表达中,SHN / AINV6和SHCWINV6可能在糖合成和蔗糖代谢中发挥枢轴作用,以及SHN / AINV4,SHN /AINV5,SHCWINV3,SHCWINV7和SHCWINV9可参与糖储存和利用率。研究糖储存中的INV的基因表达和活性将是进一步研究这些方面。通常,不同INV的贡献对INV系列的整体酶活性不同。在本研究中,在五种不同的非生物应激下显着抑制了所有INV的活性(图。7.).数字7.表明,与对照和其他处理相比,中性/碱性侵略性比可溶性酸INV和细胞壁INV活性更高。在五种非生物胁迫下,对照中转录水平最高的SHN / AINV6在急性胁迫下急剧下降,导致中性/碱性INV活动的可能降低(图。6.),这表明,它可能对整个中性/碱性INV家族的酶活性贡献最大。同样在细胞壁INV中,在对照组中转录水平最高的ShCWINV8可能对整个细胞壁INV家族的活性贡献最大(图)。6.).ShCWINV1在控制和所有应力下的表达均未检测到,不能排除其时空表达模式非常具体,在我们的实验中没有捕捉到。我们只克隆了一个可溶性酸型INV基因成员ShVINV1,其表达水平在除冷和果糖胁迫外的所有处理下均相同(图2)。6.).在不同的实验条件下,其酶活性均被抑制(图。7.).由此推测,ShVINV1酶活性的下降可能是由非生物胁迫诱导的抑制INV活性的其他基因的表达引起的,也可能是由甘蔗ShVINV1的结构修饰引起的。综上,生物胁迫下基因表达模式和酶活性变化有助于进一步了解干旱、低温和外源糖胁迫下INV基因与糖信号通路的相互调控网络。值得注意的是,寒冷可能会调节基因表达,但寒冷本身也会降低植物的实际酶活性。在我们的研究中,在低温胁迫下,SAINVs的活性高于其他胁迫。在冷胁迫下,酶的增加可能是为了维持实际的酶活性。
结论
这项研究是甘蔗转化酶基因家族14个非冗余成员的首次报道。我们推测有6个中性/碱性转化酶(ShN/AINVs)和8个酸性转化酶(ShAINVs)。本文对甘蔗INV基因家族的等位基因单倍型、系统发育关系、基因结构、功能域、蛋白保守基序、基因表达模式以及在5种非生物胁迫下的酶活性变化进行了全面分析。甘蔗副同源基因序列比较显示,酸性INVs的序列变异高于N/ ainv,说明N/ ainv比酸溶性INVs受到更强的功能约束。此外,N/ ainv比cwv具有更保守的基因结构,这也支持了在高粱和甘蔗分裂后,酸性invv比N/ ainv分化更快的观点。结果表明,尽管具有较高的多倍体水平,但INV基因的基因结构较为保守,等位基因单倍型之间的氨基酸序列相似性较高。在干旱胁迫、冷胁迫和糖胁迫下,中性/碱性INVs的转录本比酸性INVs的转录本丰富。在干旱和寒冷胁迫下,ShCWINV3、ShCWINV7、ShCWINV8和ShCWINV9的表达上调,以应对切割更多蔗糖的需要,而ShCWINV6和ShCWINV10的表达下调,以维持蔗糖稳态。根据我们的实验结果,我们还提出糖可以直接调控大多数INV基因的表达。在有足够的碳源调控基因表达的情况下,ShCWINV9、ShCWINV3、ShCWINV7、ShN/AINV4和ShN/AINV5可能参与糖的储存和利用,ShN/AINV6和ShCWINV6可能在糖的合成和蔗糖代谢中发挥关键作用。 In addition, all INVs’ activities were inhibited significantly under five different abiotic stresses. Based on the accrued data, we speculated that the contributions of neutral/alkaline INV to the overall enzymatic activity of the INV family were more than the sum of those of soluble acid INV and cell-wall INV activity. Further confirmatory experiments such as gene editing through the CRISPR-Cas9 system would be necessary to confirm this hypothesis. This study represents the first investigation of the INV gene family in sugarcane, providing the foundation to understand the physiological roles for each INV gene and unravel the molecular mechanism of sugar accumulation in sugarcane.
缩写
- AINV:
-
酸性转化酶
- BACS:
-
细菌人工染色体
- CWINV:
-
细胞壁转化酶
- inv:
-
转化酶
- N / AINV:
-
中性/碱性蔗糖酶
- SAINV:
-
可溶性酸性转化酶
- VINV:
-
液泡活性
参考文献
- 1.
海洋热菌转化酶(beta-果糖苷酶)的三维结构揭示了保持和转化糖苷酶之间的双模排列和进化关系。中国生物化学杂志。2004;279(18):18903-10。
- 2.
Asnaghi C, D'Hont A, Glaszmann J, Rott P。甘蔗品种R570对黑头锈菌的抗性隔离不同的地理位置。植物DIS。2001; 85(3):282-6。
- 3.
巴尔克PA,德布尔AD。在郁金香快速茎伸长率(郁金香l .简历。Apeldoorn)和冷诱导转化酶和水通道蛋白γTIP的联合作用。足底。1999;209(3):346 - 54。
- 4.
Bocock Pn,Morse Am,Davis C,Davis JM。转化酶基因的进化和多样性杨树trichocarpa.Planta。2008; 227(3):565-76。
- 5。
可溶性酸转化酶活性降低的转基因甘蔗茎中的蔗糖代谢。第二十四届大会论文集,澳大利亚布里斯班,2001年9月17日至21日。国际甘蔗技术学会。2001;2:588-91。
- 6。
马铃薯转化酶基因转录本在低温胁迫下的外显子跳跃性。核酸学报1996;24(12):2347-51。
- 7。
Cheavegatti-Gianotto A, de Abreu HM, Arruda P, Bespalhok Filho JC, Burnquist WL, Creste S, et al.;甘蔗(Saccharum X officinarum):巴西转基因品种调控的参考研究。acta botanica yunnanica(云南植物研究). 2011;4(1):62-89。
- 8。
Chen Z,Gao K,Su X,Rao p,杨树中转化酶基因家族的基因组鉴定。Plos一个。2015; 10(9):1-21。
- 9。
玉米Miniature1种子位点编码胚乳和母细胞正常发育所需的细胞壁转化酶。植物细胞。1996;8(6):971 - 83。
- 10.
李庆波,李庆波,卡尔森。玉米胚乳发育过程中细胞壁转化酶的遗传控制。足底。2006;223(2):159 - 67。
- 11.
关键词:果糖基转移酶,转化酶,分子生物学,分子生物学龙舌兰龙舌兰那.《公共科学图书馆•综合》。2012;7 (4):e35878。
- 12.
dagrois JH, Grivet L, Roques D, Hoarau JY, Lombard H, Glaszmann JC, et al.;甘蔗品种‘R570’的抗锈病主基因。Theor Appl Genet 1996; 92:1059-64。
- 13.
陈志强,陈志强,陈志强,等。蔗糖转化酶在甘蔗生长和贮藏中的作用。杂志。1972;27(1):25-31。
- 14。
甘蔗焦磷酸:果糖6-磷酸1-磷酸转移酶(PFP)活性的下调提高了未成熟节间蔗糖的积累。转基因研究》2008;17(1):85 - 92。
- 15.
郭军,凌华,吴强,徐丽,桂英。干旱胁迫下甘蔗基因表达的内参基因选择。Sci众议员2014;13(4):7042 - 52。
- 16。
Haouazine-Takvorian N, tymowsk - lalanne Z, Takvorian A, Tregear J, Lejeune B, Lecharny A, et al.;的两个元素的特征拟南芥基因家族,在β系列和β系列,编码真空转化酶。基因。1997年; 197(1-2):239-51。
- 17。
Hatch Md,Glasziou Kt。甘蔗中的糖积聚循环。II。转化酶活性与受控环境中生长植物储存组织中糖含量和生长速率的关系。植物理性。1963; 38(3):344-8。
- 18。
Hatch MD, Sacher JA, Glasziou KT。甘蔗中糖的积累循环。3未成熟贮藏组织的生理和代谢方面的循环。植物PHIYSIOLOGY。1963; 36:348-54。
- 19。
胡斌,金娟,郭爱云,张辉,罗娟,高刚。gds2.0:一种升级版的基因特征可视化服务器。生物信息学,2015,31(8):1296 - 7。
- 20。
Iskandar H,Simpson R,Casu R,Bonnett G,Maclean D,Manirs J.参考基因的比较,用于甘蔗基因表达的定量实时PCR分析。植物mol biol报告。2004; 22:325-37。
- 21。
关键词:芽孢杆菌GL1,葡萄糖胺聚糖,不饱和葡萄糖醛酸水解酶,晶体结构中国生物医学工程学报。2004;27(3):31804-12。
- 22。
张建军,León P,周磊,辛京。己糖激酶在高等植物中的应用。植物细胞。1997;9:5-19。
- 23。
季晓东,陈志强,陈志强,等。水稻转化酶基因家族的结构、进化和表达。中国科学(d辑:地球科学)2005;
- 24.
Kim JK, Bamba T, Harada K, Fukusaki E, Kobayashi a拟南芥盐胁迫后的细胞培养。中国生物医学工程学报。2007;58(3):415-24。
- 25.
科赫K.蔗糖代谢:管理机制和糖传感和植物发育关键作用。CurrOp植物BIOL。2004; 7(3):235-46。
- 26.
科赫柯。植物中碳水化合物调控的基因表达。植物生理学报1996;47:509-40。
- 27.
科赫,K. E.,Y.吴J.许。糖和基因蔗糖代谢的代谢调节:玉米蔗糖合成酶和在碳上的分区和糖感测可溶性转化反应的潜在影响。实验植物学。1996; 47规范编号:1179年至1185年。
- 28.
Lalonde S, Boles E, Hellmann H, Barker L, Patrick JW, Frommer WB, et al.;糖载体的双重功能。运输和糖感知。植物细胞。1999;11(4):707 - 26所示。
- 29.
Lammens W, Le Roy K, Schroeven L, Van Laere A, Rabijns A, Van den Ende W. Structural insights into glycoside hydrolase family 32 and 68 enzyme: functional implications. acta optica sinica, 2017, 36(4): 564 - 564。中国农业科学。2009;60(3):727-40。
- 30.
李振华,王锐,金勇,等。番茄生殖器官蔗糖酶活性高与幼果蔗糖输入量增加和耐热性增强有关。中国生物医学工程学报。2012;63(3):1155-66。
- 31.
凌华,吴强,郭军,徐丽,桂英。甘蔗基因实时定量RT-PCR表达标准化内参基因的综合筛选。《公共科学图书馆•综合》。2014;9(5):10。
- 32.
摩尔PH(1987)解剖和形态。在“通过甘蔗育种改良”。(编DJ亨氏)第85-142。(爱思唯尔:阿姆斯特丹,荷兰)。
- 33.
关键词:甘蔗,甘蔗茎,蔗糖积累,时空调控acta botanica botanica(云南植物研究). 1995;22(4):661-79。
- 34.
村山S,手H.基因在水稻碱性/中性转化:碱性/中性转化酶位于植物线粒体以及在质体。Planta。2007; 225(5):1193-203。
- 35.
Paterson AH, Bowers JE, Bruggmann R, Dubchak I, Grimwood J, Gundlach H, et al.;的高粱双色基因组与草类的多样化。大自然。2009;457(7229):551 - 6。
- 36.
Pelleschi S, Rocher JP, Prioul JL。水分限制对成熟玉米叶片碳水化合物代谢和光合作用的影响植物学报1997;20:493-503。
- 37.
Roitch T.通过糖和压力来汇总调节。CurrOp植物BIOL。1999; 2(3):198-206。
- 38。
陈志强,陈志强,陈志强,等。植物外质转化酶的诱导藜癣菌通过d -葡萄糖和一种葡萄糖类似物,组织特异性表达表明其在库源调控中发挥作用。植物杂志。1995;108(1):285 - 94。
- 39。
Roitsch T,Gonzalez MC。植物转化酶的功能和调节:甜美的感觉。趋势植物SCI。2004; 9(12):606-13。
- 40.
Rossouw D, Kossmann J, Botha F.转基因甘蔗茎组织中性转化酶活性降低,导致呼吸和蔗糖循环减少,蔗糖与己糖比例增加。植物学报。2010;37(1):22-31。
- 41.
关键词:蔗糖代谢,碳代谢,糖信号转导植物学报。2014;65:33-67。
- 42.
阮玉玲,金勇,杨永杰,李国杰,博耶君。蔗糖输入、代谢和转化酶介导的信号:在发育、产量潜力和对干旱和热的反应中的作用。摩尔。2010;3(6):942 - 55。
- 43.
Schroeven L,Lammens W,范Laere A,范登恩德W.转化小麦液泡转化成高亲和力蔗糖:蔗糖1-果糖基转移酶。新植物。2008; 180(4):822-31。
- 44。
甘蔗茎贮藏过程中蔗糖含量和蔗糖酶活性的变化。中国农业科学。2007;8(2):75-81。
- 45。
Smeekens植物中基因表达的S.糖调节。CurrOp植物BIOL。1998; 1(3):230-4。
- 46。
Sturm活性。植物发育和蔗糖分配中的初级结构、功能和作用。植物杂志。1999;121(1):1 - 8。
- 47。
Sturm A, Chrispeels MJ。胡萝卜细胞外beta-果糖苷酶的cDNA克隆及其在创伤和细菌感染反应中的表达。植物细胞。1990;2(11):1107 - 19所示。
- 48.
胡萝卜中蔗糖合酶和三种酸同工酶b -果糖苷酶基因的发育和器官特异性表达。足底。1995;195:601-10。
- 49.
蔗糖切割酶在植物发育、生长和碳分配中起着至关重要的作用。植物科学进展,1999;4(10):401-7。
- 50.
田ura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:利用最大似然、进化距离和最大简约法的分子进化遗传学分析。生物医学进展。2011;28(10):2731-9。
- 51.
唐国平,刘建军,刘建军,等。转基因胡萝卜细胞壁和液泡转化酶的反义抑制作用及其对植株发育和蔗糖分配的影响。植物学报。1999;11(2):177-89。
- 52.
Tymowska-Lalanne Z, Kreis M.的表达拟南芥转化酶基因家族。足底。1998;207(2):259 - 65。
- 53.
在环境胁迫下碱性和中性转化酶的差异表达:小麦叶片中作为胁迫响应酶的碱性亚型的特性足底。2007;226(6):1535 - 45。
- 54.
沃克RP,温特斯AL,波洛克CJ。从叶纯化和鉴定转化酶的Lolium temulentum李新民。植物营养与植物营养。1997;
- 55.
冬天H,Huber Sc。高等植物中蔗糖代谢的调节:局部化与关键酶活性的调节。Crit Rev Biochem mol Biol。2000; 35(4):253-89。
- 56.
Xu J,Avigne Wt,McCarty Dr,Koch Ke。类似的糖调制和开发表达的二分法影响蔗糖代谢的两条路径:来自玉米转化酶基因家族植物细胞的证据。1996年; 8:1209-1220。
- 57.
关键词:蔗糖合酶,基因家族,单倍型BMC基因组学。2013;14(314)。
- 58.
甘蔗茎中蔗糖的积累受可溶性酸性转化酶和蔗糖磷酸合酶活性差异的调控。植物杂志。1997;115(2):609 - 16。
确认
作者要感谢乒乓和刘刘(福建农业和林业大学,福州,中国)援助该项目的技术方面。我们还要感谢汉阳蔡(福建农业和林业大学,中国福州)提供参考。
资金
基金资助:863计划(2013AA102604)、国家自然科学基金(31201260)和福建农林大学资助项目。
数据和材料的可用性
所有相关的数据支持的结果可以手稿和其他文件中找到。如在结果部分中所述的研究中使用甘蔗INV家庭的克隆序列的详细情况公开沉积在Genbank中。如方法部分所述,从研究中使用的其他植物物种基因INV的信息是公开可在网上。
作者的贡献
LW和JZ构思并设计了实验。LW, YZ, SD, QZ进行实验。LW, JZ进行数据分析。YC提供了资料和参考。LW和JZ起草了手稿。LW, MR, JZ对手稿进行了修改。所有作者阅读并批准了最终的手稿。
相互竞争的利益
提交人声明他们没有竞争利益。
同意出版
不适用。
伦理批准和同意参与
不适用。
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
作者信息
隶属关系
相应的作者
附加文件
附加文件1:表S1。
8种植物物种中转化酶基因的基本信息。(XLS 49 KB)
附加文件2:表S2。
甘蔗转化酶基因的PCR引物序列及退火温度。(PDF 13 kb)
附加文件3:表S3。
在甘蔗13种转化酶基因的实时PCR引物。(PDF 8 KB)
附加文件4:表S4。
转化酶家族的基序分布。(PDF 22 kb)
附加文件5:图S2。
从高粱和甘蔗公知的酸转化酶的保守区的对准。(TIFF 2153 KB)
附加文件6:图S3。
从中性/碱性转化酶的保守区的对准。(TIFF 1859 KB)
附加文件7:图S1。
单子叶和双子叶植物INVs系统发育树。(TIFF 8393 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
王磊,郑勇,丁绍峰。et al。甘蔗中逆变酶基因家族的分子克隆,结构,文学和表达分析。BMC植物BIOL.17,109(2017)。https://doi.org/10.1186/s12870-017-1052-0
收到了:
接受:
发表:
关键字
- 甘蔗
- 转化酶
- 基因表达模式
- 非生物胁迫
- 定量RT-PCR