摘要
背景
邻氨基苯甲酸甲酯(MA)为草莓(草莓属SPP。),但在现代品种中很少见。其生物合成的遗传基础尚未阐明。了解其合成所需的特定基因可以允许开发基因/等位基因特异性分子标记,以播种美味的草莓。
结果
使用批量分析转录组方法检查由MA生产者和非生产者之间的交叉产生的F1种群中的个体成熟果实。比较MA生产者和非生产者转录om,揭示了用MA生产严格共同地共偏析的五个候选转录物。一个候选物编码注释的甲基转移酶。当使用RNAi抑制该转录物时,MA水平降低,并且在蒽酸存在下表达蛋白质产生的细菌培养物。仅在果粉中检测到转录物,刚刚用蒽酸和甲基供体重构的冷冻水果粉末。开发了一种基于DNA的分子标记,其用MA-产生基因变体进行分离。
结论
这些分析表明甲基转移酶现在已经注意到邻氨基苯甲酸甲基转移酶(Fanaamt),调节栽培草莓中MA生产的最终步骤。该基因及其相关分子标记的鉴定可能会加快将这一重要挥发性物质引入现代栽培品种的育种工作。
背景
甲基氨基甲酸甲酯(MA)是高芳香类二倍体草莓的关键挥发性,F. VESCA.[1,散发出葡萄和水果的芬芳。在商用八倍体草莓(F。X阿纳纳萨)种质,并仅在少数品种中有报道,包括‘Mara des Bois’和‘Mieze Schindler’[2].已经注意到它们具有吸引力的口味和香气的这些八倍体基因型,但它们具有其他限制其大规模生产培养的其他缺点。结合遗传学的增强的香气和卓越的生产性状是一种长期的草莓育种目标,但香气表型是费力且耗时的。对MA合成背后的限制因素的分子理解应使其对高质量的商业草莓的标记驱动的迟钝,而不是单独的表型评估更高的效率。
在草莓中检测到超过360次挥发物[3.].确定最重要的挥发性子集通常依赖于许多因素,包括定量丰度[4.,气味阈值[5.那6.,或气味值和人类感官面板[2那7.那8.那9.].这些报告不包括MA在他们的分析,因为它不存在于检测的基因型。一些报道专门研究了不同品种间香气(包括MA)的差异F. VESCA.和F。X阿纳纳萨[10.].进一步的工作表明,四倍体F. VESCA.“吕根岛”xF。X阿纳纳萨“情人节”了[11.].MA也是一种关键的挥发性物质,用于区分不同类型的草莓香气[2].
MA是Concord葡萄香气中的明显挥发性(唇形葡萄)[12.].它已经在许多植物中被发现,包括一些苹果基因型[13.],柑橘花和蜂蜜[14.那15.那16.那17.],以及在枫叶中释放的玉米以阻止食草动物喂养[18.].对concord葡萄生物化学分析表明,一种蒽酰辅酶A:甲醇酰基转移酶能够由酰基辅酶A和甲醇合成MA [12.].
对草莓MA的遗传分析表明,MA仅在25%的后代中检测到“MIEZE Schindler”(MA-阳性)X'ELSANTA'(MA-Digal)交叉[19.].这一发现进一步表明,需要开发分子标记来预测植物在整个育种过程中产生MA的潜力。在生长季节,已观察到MA丰度的大幅度波动[8.那20.]因此,因此育种努力将受益于与生产化合物的能力相关的分子标记。
该报告分析了在硅中聚集的MA生产者和非生产者的转录组[21]鉴定与MA积累相关的转录物。一种候选者与MA生产良好相关,几种测定表明,同源蛋白能够介导MA生产的最终步骤。
方法
植物材料
两种商业八大胶水草莓属X阿纳纳萨父母是根据他们的挥发性特征来选择的。佛罗里达大学的品种“佛罗里达鞘翅”(以下简称“鞘翅”)是一个果实大、果糖含量高的商品品质基因型,对“葡萄状”挥发性邻氨基苯甲酸甲酯(MA)是阴性的。“玛拉des Bois”的果实相对来说小而软,基因型为MA阳性。位于佛罗里达州威玛市的墨西哥湾海岸研究和教育中心(GCREC)的工厂在现场进行了维护。
Progeny from the ‘Elyana’ x ‘Mara des Bois’ cross were clonally multiplied a temperate summer nursery in 2010. Two runner tips from each of between 130 (+/− 10) seedlings were transplanted into the field at GCREC starting in the 2010–11 growing season. Strawberry fruits were harvested January 20, February 11 and March 18 in 2011, and then January 13, January 31 and March 7 in 2013. The population has been described previously for other volatiles and RNA sequencing analysis [21那22].
草莓挥发性加工
除了2011年12月15日的RNA-SEQ联合收获外,对每个收获的挥发物分析了所有结果的后代。从场上早上,每人每种全熟的水果(按大小和颜色评估),从场上收获并储存在冰包的冷却器中直到样品加工。将来自每种基因型的代表性〜25(+/- 3)G样品与相等的饱和NaCl(35%NaCl)混合,并将内部挥发性标准的3-六己酮加入到终浓度为1ppm。将来自每个基因型的两种5ml等分试样调味成20mL玻璃瓶,并用磁性卷曲盖(Gersel,Baltimore,MD,USA)密封。在加工后立即在-80℃下冷冻样品并在挥发性分析之前保持冷冻。
气相色谱/质谱/质谱(GC / MS)分析
2厘米三相SPME纤维(50/30μmVB/ Carboxen / PDMS,SupeLco,Bellefonte,PA,USA)用于在分析Agilent 6890 GC与5973 N M MS检测器上进行分析之前收集和浓缩挥发物(安捷伦科技,帕洛阿尔托,加州,美国)。在分析之前,在附接到MPS2自动进样器(Gerstel)的珀耳帖冷却托盘中,在10℃下保持样品。所有其他挥发性采样和分析方法如前所述[23].正宗的MA标准(Sigma Aldrich,St.Louis,Mo,USA)在与水果样品相同的色谱条件下运行,用于验证挥发性身份。MA经常在低丰度中发现,因此使用单离子模式方法扫描主要MA离子(离子119)来定量。定量离子119的峰面积并标准化为内标的峰面积。在样品之间比较标准化的峰面积。
组合挥发和RNA-SEQ材料
对2011年12月15日收获的果实进行挥发性和RNA-seq分析。这些藏品包括14个后代和父母(“Elyana”和“Mara des Bois”)。其中3个基因型(‘Mara des Bois’,幼苗098和幼苗103)被选择是因为它们是MA阳性的,其余的是非生产者。从每个基因系中提取8到10个成熟的果实。果实洗净,取去花萼。将果实纵向切开,每果实一半进行挥发性分析,另一半在液氮中冷冻,−80℃保存,用于RNA提取。
RNA-SEQ样品RNA提取
将冷冻浆果磨碎于液体氮气冷却咖啡研磨机(厨房刀片咖啡研磨机,圣约瑟夫,Mi)中的细粉。使用从Chanc等人改性的方法提取RNA。(2003)。将5mL萃取缓冲液(2%CTAB,2%PVP(K30),100mM TRIS,25mM EDTA,2M NaCl,0.5g / L亚胺胺,2%β-巯基乙醇,pH 8.0)与65℃合并两个G果粉和涡旋混合。将样品在65℃下孵育10分钟。五毫升氯仿:异戊醇(24:1V./v)加到每个样品中,用多肽在80%最大速度下均质1分钟。样品在8000 x g室温(RT)下离心10分钟以分离相。将上清液移到新鲜试管中,用5ml氯仿:异戊醇(24:1)旋转V./ v),并再次离心。将上清液转移到新鲜的管中,并将LiCl加入到终浓度为2M的浓度中。然后将样品填充在冰中并在4℃下保持过夜。样品保持冷,并且所有转移均通过该点前向前进行。将样品在4℃下以10,000×g离心,并达30分钟至颗粒RNA。将上清液倾析出,并加入500μlsste缓冲液(1M NaCl,0.5%SDS,10mM Tris,1mM EDTA,pH 8.0)以重悬了RNA颗粒。然后用相等体积的氯仿萃取样品一次:异戊醇(24:1V./ v),涡旋,在4℃下以8000×g以8000×g离心10分钟,并将上清液除去2mL微量离心管。将2.5体积的冰冷100%乙醇加入每个样品中,并在-80℃下将RNA沉淀30分钟。然后将RNA在4℃下以10,000×g沉淀30分钟。滗析上清液,颗粒在500μl76%乙醇中洗涤0.3m Naoac,如上所述离心,并将上清液吸出来。在室温下将RNA沉淀在流动罩中干燥15分钟,然后在30μl10mMTris中重悬,2.5mM EDTA。
转录组分析
基于'Mara des Bois'和'Elyana'阅读,进行两种单独的De Novo转录组件。第一个是使用三位一体算法建造的,并由112,854个Contig组成。第二组件是使用CLC基因组工作台算法建立的,并由65,894个Contig组成。通过CLC基因组学工作台(CLC Bio,Denmark),通过质量检查的读取与两种开关转录组组件对齐。这F. VESCA.田纳西等人的基因组组装[24用于比较候选人Contigs,以及F. VESCA.Genemark Hybrid版本1.1用于基因注释[25].
如前所述,使用Illumina Genome分析仪IIX库制备的协议生成RNA SEQ数据[21那22].在目前的工作中,所有读数都针对来自父母线中的读数的两种De Novo转录组件对齐。使用三位一体算法构建一个组件[26]并且使用CLC基因组学工作台进行。基于MA存在或缺位对读取进行排序和汇总,然后对齐组件。应用了几种过滤器,以鉴定与MA生产一致的转录物。第一个过滤器定义了定义存在(RPKM> 10)和不存在(RPKM <5)的阈值。第二滤器鉴定在至少三种基因型中未检测到的转录物(其中包括'Elyana'),但在至少六个基因型中被检测到。第三个过滤器确定了预测两种不同组件的转录物
候选人表达分析
使用来自RNA-SEQ实验中使用的相同组织的RNA进行定量RT-PCR。用Norgen Biotek植物/真菌总RNA净化试剂盒(加拿大Norgen Biotek)分离RNA。每柱使用150mg组织,并且RNA被DNase处理。根据制造商的说明,使用ImpromTu II逆转录酶试剂盒(Promega,Madison,Wi,USA)合成QRT-PCR的cDNA模板。在QRT-PCR之前将cDNA稀释1:10。使用Evageen QPCR MasterMix-Rox(Applied Biological Material Inc.,Richmond,BC,Canada),所有QRT-PCR反应均以20μL反应中的运行。每次反应含有10μL2×eMAGREEN mastermix,2μl底漆混合物(每次2μm),1μl1:10稀释cDNA,7μlDNase/ RNase游离水。所有QRT PCR引物都是使用在线可用的QRT底漆设计工具设计的所有QRT PCR引物(idtdna.com.),用于扩增95至110个碱基对之间的片段。每个引物-模板组合经过三个技术重复和至少三个生物学重复。一个与保守的假想蛋白FaCHP1对应的转录本;[27])用作组成型参考。QRT PCR在应用的生物系统上运行使用STEPOINE软件(V2.0)(应用生物系统,福斯特城,USA,USA),在应用的生物系统中运行Stepoone实时PCR系统。使用比较C分析QRT-PCR数据T.方法(ΔΔC.T.)遵循制造商的方向。QRT-PCR引物序列列表在附加文件中提供1:表S1。
瞬态表达测定
根据Hoffmann等人的研究,通过农业渗透法在草莓果实中进行瞬时表达[28].简而言之,这是根癌土壤杆菌应变AGL0 [29]含有从3'末端轴承头部构建体的Phellsgate12质粒Fanaamt.在含有适当抗生素的Luria-Bertani (LB)培养基中,在28°C条件下培养。当培养物达到过量时6000.8,农杆菌细胞被捕获并重悬在改良的MacConkey (MMA)培养基中(Murashige和Skoog盐,10 mM吗啡啉乙烷磺酸,pH 5.6, 20 g·L)-1蔗糖)。这农杆菌悬浮液在授粉后约14 d,用无菌的1ml皮下注射器注射到整个果实的多个部位,悬浮液仍然附着在植株上。果实注射后7 ~ 14 d采收,果实成熟后进行试验Fanaamt.成绩单和MA的存在。含有发夹结构的对照质粒Fanfad1.[21[可比较的注射方案用于控制对MA生产的质粒/感染/注射效果。
草莓果实挥发性提取物的瞬时表达测定
草莓果实在收获后立即在液氮中淬火,然后在室温下贮藏−提取前温度为80℃。冷冻浆果被粉碎,然后在液氮冷却的咖啡研磨机(KitchenAid刀片式咖啡研磨机,密歇根州圣约瑟夫)中研磨成细粉。对每个样品进行三次挥发物提取。从样品中提取挥发性化合物,250 mg细磨粉末,使用1 mL含有乙酸壬酯(西格玛-奥尔德里奇)的MTBE(西格玛-奥尔德里奇),浓度为500 ng-mL-1作为替代标准。样品旋转10秒,然后在25°C、1400 RPM下摇晃15分钟(Eppendorf)。4000x g离心5分钟后,MTBE相转移到玻璃样品瓶中。所有样品在氮气下蒸发至100 μL,用于挥发性分析。
气相色谱/质谱(GC/MS)
使用三相SPME纤维(2cm,50/30μmVB/ Carboxen / PDMS,SupeLco,Bellefonte,PA,USA)浓缩挥发物,在Agilent 6890 GC与5973 N M MS检测器(Agilent Technologies,Palo阿尔托,加州,美国)。在分析之前,在连接到MPS2自动进样器(Gerstel)的珀耳帖冷却托盘上在4℃下保持样品。如前所述进行其他挥发性采样和分析[30.].挥发性的3-己酮作为内控物。在相同的色谱条件下,使用真实的邻氨基苯甲酸甲酯标准品(Sigma Aldrich, St. Louis, MO, USA)鉴定正确的峰。
马生产大肠杆菌
序列的全长Fanaamt.克隆到表达载体pET-28b中。然后将该构造插入E.COLI BL21.-codonplus(de3) -RIPL因热休克而紧张。取5ml培养物在37℃摇匀培养过夜。然后用50 mL lb -抗生素稀释培养物,在室温下摇匀。当OD值达到~0.8 ~ 1.0时,在1 mM处加入IPTG进行转录诱导,并在培养物中加入不同浓度的邻氨基苯甲酸。分别在诱导时间(T0)和1、2、3、4、5 d后取2 mL培养物进行MA生产试验。
果实蛋白提取物中甲基丙烯酸酯的生产
从成熟草莓果实中分离出总可溶性蛋白质。使用萃取缓冲液的2:1比例,由100mM k-磷酸盐缓冲液pH 7.8,30mg / ml BSA和2mM DTT组成。对于每个样品,还加入0.75g不溶性PVPP。冷离心后收集上清液。将样品通过缓冲液平衡的PD-10脱盐塔过滤,以除去溶解在提取物中的大部分有机化合物。将半纯化的总可溶性蛋白质在4ml缓冲液中洗脱。对于完全反应,将1ml提取物与2mM氨基嵌体和2mM S-腺苷蛋氨酸(Ado-Met)温育。将样品与适当的阴性对照一起温育至各种时间点。在使用SPME-GC / MS的顶空采样之前,将样品温热至40℃,使100分钟促进挥发。在初始混合和取样一次后立即密封的独立孵育进行前空分析。
分子标记设计
周围的地区Fanaamt.针对的变异可能与“玛拉·德·波伊斯”中存在转录本和“伊莱安娜”中没有可检测的转录本的机制有关。对该基因的测序显示,“玛拉des Bois”和“Elyana”之间的基因组DNA序列发生了变化。亲本等位基因间存在保守性差异。在16个核苷酸中有5个SNPs的区域中,有一个约1.2 kb的产品代表‘Mara des Bois’和MA生产者优先扩增。所有样品均产生一个共扩增产物(~ 300bp)。引物为5 ' gggattgaatgcaatttgtctattttcctttttctgta3 '和5 ' gaacactagcatcccccaatcca 3 '。
结果
‘鞘翅’x‘马拉des Bois’F1种群的MA季节变化
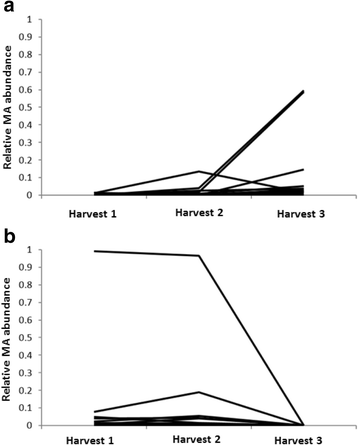
“Mara des Bois”是一种20世纪90年代的法国杂交种,已知能产生MA,而“Elyana”是一种佛罗里达州的品种,不产生MA,他们杂交来测试MA分离。在“Elyana”x“Mara des Bois”果实中以及在两个生长季节内三次独立收获的后代中,在均匀完全膨大的红色成熟期果实中测量MA的季节变化。图形1描述了在连续三次收获中观察到的30个个体的一般趋势的MA变异性。MA产量较低,各基因型的平均MA在整个季节略有增加。数字1 b显示在2012/13赛季中繁殖和生长的18个人的MA挥发性概况。总体而言,114个后代测试产生的MA,但相对MA产生通常低,并且仅鉴定出两个基因型含有相对大量的MA。
父母的大量和选择的后代
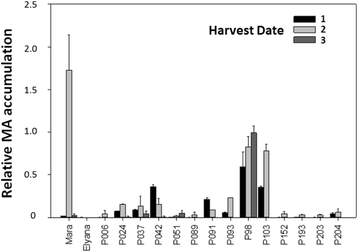
成熟果实中MA丰度的可变性需要重复采样,以获得最佳的收获时间来进行RNA-SEQ实验。无花果。2显示了用于挥发性分析和RNAseq的16种基因型的MA检测,从三个生长季节的三个收获。总的来说,与收获1和收获3相比,在收获2中更经常检测到MA生产。‘玛拉des Bois’的MA水平最高,其次是P098和P103。幼苗P024、P037、P042、P091和P093表现出较低的MA水平。在其他个体中未发现MA。幼苗P098是唯一在三个收获季节中MA产量相对较高的基因型。
批量分析转录池分析
使用材料和方法中描述的过滤器,选择Harvest 2进行转录组分析。不针对MA生产者的转录本被排除,候选名单减少到只有5份转录本(表)1).然后将这些候选人与爆炸进行比较Fragaria Vesca.参考基因组(25]为了从匹配序列推断推定功能。CONDIG 7159和10,605匹配基因组的未谐老区域。Contigs 12,547和5826与预测基因(分别为Gene03636和Gene32346)对齐但未表示预测的转录物的全长。最后,只有CONTIG 1885匹配全长预测,GENE04119。预计该基因是编码茉莉酸盐O-甲基转移酶样蛋白。
成熟过程中候选基因表达
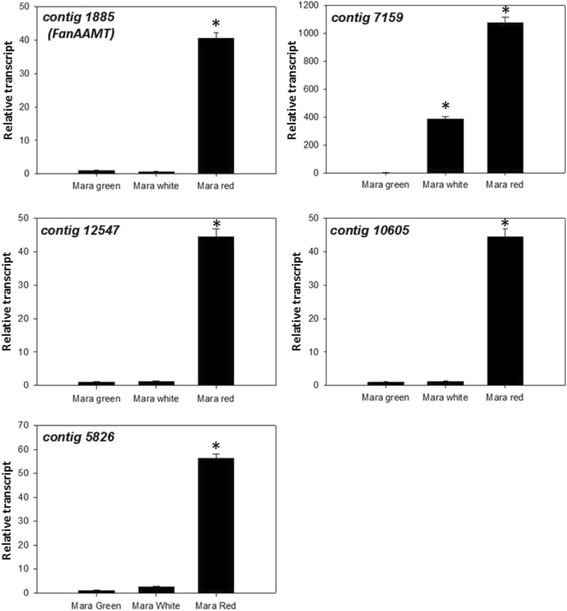
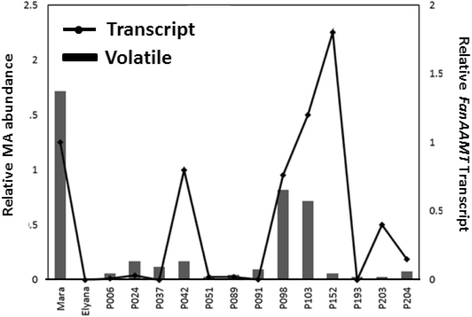
已知甲基氨酸盐在成熟期间积聚,因此候选转录物的重合积累可以在该过程中推断出进一步的功能。使用QRT-PCR测试所有候选转录物用于在“Mara des Bois”果实中致癌诱导。所有候选者都显示出升起的图案,如图4所示。3..Contigs 1885、12,547、10,605和5826的转录本丰度在成熟期显著增加,而contig 7159的转录本丰度在‘Mara des Bois’绿色果实到白色果实和白色果实到红色果实之间呈递增趋势。参考转录本的原始Ct值没有发现差异fachp1.在成熟期间,如前所述[27].比较Fanaamt.转录水平到相对MA水平显示了选择后代(图)。4.).
Fanaamt.从草莓属×阿纳纳萨
由于其假定的功能,康迪格1885被选择作进一步研究并更名Fanaamt.(邻苯二甲酸甲基转移酶).这草莓属×阿纳纳萨DNA序列与...相同的97.12%Fragaria Vesca.序列。在15 - 386氨基酸中预测有一个sam依赖的羧基甲基转移酶结构域。为了证明与其他描述的甲基转移酶的关系和潜在的信息功能,我们使用所有底物特征的、依赖于sam的植物甲基转移酶的氨基酸序列构建了一个邻居连接树甲基转移酶_7域名(附加文件1:图S1)。结果表明风扇aamt最类似于一系列草莓预测的甲基转移酶,其中包括茉莉酸盐合成的函数的一系列草莓[31],其次是茉莉甲酸甲基转移酶Clarkia Brewerii.、拟南芥、咖啡和杨树。该序列与玉米中具有特征的aamt序列相似[18.].
抑制Fanaamt.水果渗透试验
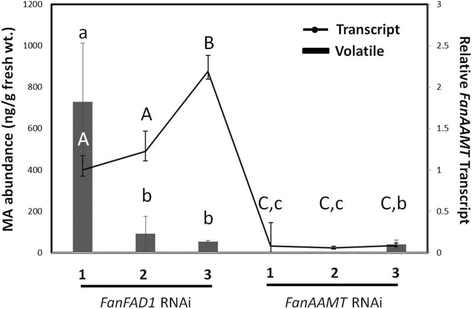
草莓水果可用于瞬态测定以测试基因功能。研发水果注射了农杆菌含有兴趣构建的培养物,用于抑制或诱导靶转录成分积累。几天后,可以测定相关转录物的RNA水平,以及相关的代谢查询。在这里,'Mara des Bois'果实瞬时转化为毛发结构Fanaamt..结果显示,原生转录本的丰度下降(图。5.).在RNAi抑制水果中未检测到MA。用不相关的控制构建处理的果子(Fanfad1.发夹)没有显示RNAi抑制Fanaamt.表达,MA检测。RNAi结构的特异性是通过测量其他类似序列的甲基转移酶的转录水平来评估的。结果显示,他们没有受到强烈的影响(附加文件1:图S3)。在非MA的生产果实中也容易地检测代表这些其他甲基转移酶转录物的RNA-SEQ读数。
的证据Fanaamt.活动中表达大肠杆菌
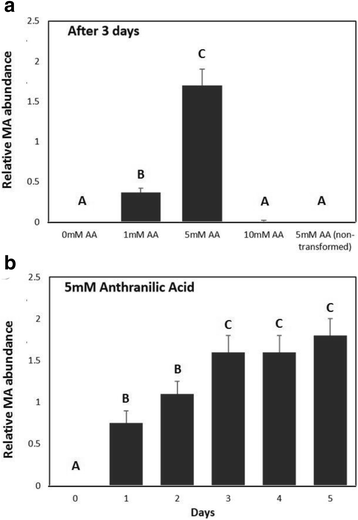
活动的活动Fanaamt.在使用各种微生物表达系统(未示出)的亲和柱纯化酶的亲和柱纯化后不能证明。然而,在粗裂解物中检测到甲基转移酶活性大肠杆菌生产Fanaamt.来自原核表达载体的转录物。只有当用瓦丙酸供应培养物时,才能在顶空中检测到MA(图。6).观察到剂量-反应关系(图。6)并且显示3天后5mM AA培养物产生比1mM AA培养物更多的mA。在10毫米AA培养物中未检测到MA,这也没有良好的培养物。当培养物中不存在蒽酸或未用IPTG诱导基因表达时,未检测到mA。用5mM炭酸进行时间过程(图。6 b).3天后,MA积累达到了一个平台。
检测Fanaamt.植物蛋白提取物中的活性
研究MA生产的潜在基质很有意义。简单的甲基化模型表明邻氨基苯甲酸会被Fanaamt.生成ma的活动。该假设得到了结果的支持大肠杆菌. 为了直接回答这个问题,从代表“Mara des Bois”דElyana”群体MA阳性和MA阴性品系的重组粉末组织中制备蛋白质提取物。定量RT-PCR用于检测同一组织中是否存在Fanaamt.转录物。将提取物与瓦丙酸和甲基供体(ADO-MET)一起温育。来自MA生产者的蛋白质提取物能够从瓦斯酸和ADO-MET生产MA,而非生产者不能(图。7.).在与邻苯二甲酸孵育时,从高mA生产线的蛋白质提取物中容易地检测到MA。对照缺乏酶,瓦斯纳酸或ADO-MET的控制没有产生以上背景水平的MA。
分子标记发育
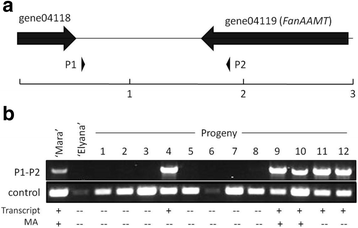
MA积累的环境变异使得难以筛选真正的阳性表型,因为可能在能够产生MA的基因型中发生挥发性分析的阴性结果。在这种情况下,基于DNA的分子标记物可以有助于识别含有与MA生产相关的酶变体的基因型,以及进一步分离负责环境变异的因素。引物被设计用于扩增基因内和下游的上游Fanaamt..一个引物组在群体内的所有线条中扩增了〜350bp的产物。在产生MA的所有基因型中扩增〜1.5kb的第二产物(图。8.).该产物也在一些非生产者中扩增。相同的引物对没有放大对应于MA生产的1.5 kB条带(在所测试的其他群体中(数据未示出)。
讨论
甲基氨基甲酸甲酯(MA)是许多植物中的重要挥发性,包括草莓[10.那12.和一些苹果[13.],并释放形成玉米叶子的叶片响应草食病[18.].它来自大多数葡萄酒葡萄的香气缺席(vitis Vinifera),但在康科德葡萄(唇形葡萄)[12.].分析各不相同,但一些试验发现,MA与消费者对“果味”和“芳香”的好评之间存在关联[32].在二倍体草莓的香气中,MA是一个显著的音符,但在商业八倍体草莓种质中非常罕见[9.].为了增强其在现代水果品种中的存在,由于表型的挑战,首先鉴定其合成所需的基因是有意义的。结构和/或基因表达的变化可能描述性状的生物学基础,并为分子标记的发展提供基础。本报告实现了子代分离MA生产的批量转录组分析,并确定了一组与其存在相关的转录本。其中一个被证明可以编码一种蛋白质,能够催化MA合成的最终步骤。
使用各种遗传方法接近MA生产所需的基因发现,但分析表明其积累需要至少两个基因。由于MA生产高度依赖于环境条件,它们的识别变得复杂,如图2所示。1.在“Frau Mieze Schindler”(MA供体)和“Elsanta”之间的后代中检测到MA的占24%(189人中有46人)[33].这些结果与本研究相匹配,其中MA在“伊丽兰纳”和“Mara des Bois”之间的后代32%(114个)中检测到。轻微的差异可能归因于小于人口大小和/或环境波动,使其挑战识别真正的MA阳性基因型。对于单一遗传的单个基因座控制(在八倍体草莓的单个亚基中分离)和非生产者的生产者的交叉中,预期50%的生产者将在后代预期。由于环境效应,特性的次要基因座或降低的孔隙率的负面影响可能占24-32%的产生后代观察到的。或者,通过非生产者在生产者的交叉中所需的两个单独和未链接基因座的主要等位基因的双基因模型可能导致后代的25%的生产者。
二倍体草莓估计含有〜34,000个基因[25].在八倍体中等位变异的数量被认为是更大的,特别是因为存在多个亚基因组。进行了批量分离转录分析,计算出清晰和一致的生产者与‘Mara des Bois’双亲,并将该数据集与非生产者组装的数据集进行比较。只有5个转录本被检测到是共同的MA生产者。表中列出了这些候选者1.所有五个都是成熟的(图。3.),并在时间上与MA累积相关联。每个候选人在'Mara des Bois'(MA捐赠者)父母中始终如一,并且在MA-Nogal父母'Elyana'中没有检测到的上述阈值。
一个转录本被注释为“茉莉酸-甲基转移酶样”。它与草莓果实中表达的茉莉酸羧基甲基转移酶最相似,并且在成熟过程中转录量增加[31].同源蛋白含有一个预测的甲基转移酶7.领域。转录物代表二倍体草莓基因组中的十三甲基转移酶蛋白中的一种(在额外的文件中显示1:图S1)。这类蛋白质已经在功能性上以其他几种。这Fanaamt.转录物编码与所表征最相似的蛋白质Zea Mays.AAMT1, AAMT2和AAMT3苯基羧基甲基转移酶,它们具有首选的邻氨基苯甲酸底物[18.].由于其与玉米酶的相似性,相应的基因被注释为Fanaamt,随后的分析将证明邻氨基苯甲酸确实可以作为该酶的底物(fig。6.和7.).该转录物在其他收获点和其他遗传背景下的MA积累以及旧品种'Frau Mieze Schindler'(附加文件)1:图。S2)。
这Fanaamt.在一些非生产者中检测到转录本,这与为MA生产提出的双基因模型一致[1].在一些果实中也被检测到在低水平下检测到的一些果实中,表明该酶可以在一些基础水平的果实中存在并活跃,但随后在允许的发育和/或环境条件下的丰富和/或活性增加。与玉米类似,酶被假设以催化蒽酸的甲基化以产生甲基氨酸甲酯,是必要的,但不足以进行其生产。这种假设以几种方式进行了测试。RNAi建筑的农业滤波器Fanaamt.在‘马拉des Bois’果实中,内源转录水平被抑制,同样的果实也没有积累MA。5.).对照水果处理不相关的RNAi结构保持可检测Fanaamt.成绩单累积以及MA生产。
亲和纯化功能性标记酶的努力没有成功。然而,大肠杆菌含有的文化Fanaamt.在邻氨基苯甲酸存在下产生MA(图。7.).如果没有Fanaamt.序列或不含邻苯二甲酸底物。较高浓度的MA抑制培养的生长,与先前的抗微生物活性观察一致。占据这些数据表明Fanaamt.催化通过瓦西酸的甲基化形成甲基氨酸盐。对含有(或不含有)的草莓果实的粗蛋白提取物对粗蛋白提取物进行额外的试验Fanaamt.成绩单。在邻氨基苯甲酸和甲基供体(阿多-met)存在下,从Fanaamt.- 含有基因型的可用于产生MA。这些试验还证明了瓦丙酸是合适的基材Fanaamt.在体内和体外产生的酶。
这些结果表明,草莓中生产方法与其他果实中观察到的方法不同。产生至少两种方法来生产氨基甲酸的羧基甲酯[18.].在康科德葡萄(唇形葡萄) MA是由邻氨基苯甲酸辅酶a连接酶活性催化的,该酶首先在邻氨基苯甲酸辅酶a和邻氨基苯甲酸之间进行ATP依赖的反应,然后乙醇酰基转移酶活性与甲醇形成葡萄香气[12.].醇酰基转移酶活性在Concord葡萄(〜0.5%的总蛋白质)中丰富,并且可以接受一系列底物和醇以产生酯阵列。另一方面,草莓中的机制与SABATH转移酶的机制相同,在体外和体内在ADO-MET存在下已经显示为甲酸甲酸氨酸的甲基转移酶[18.那34].
瓦丙酸代表初级和次生代谢的分歧。它来自酸酸,然后转化为色氨酸。代谢分支点处的该位置可以解释其环境变异性。它对甲基亚甲酸甲酯等次级代谢物的转化可以允许,因为氨基酸合成需要较少的底物,或者甚至可能甚至唾液产生。作为插座膨胀端发生的MA累积。插座膨胀是助规驱动的。MA积累与疾病驱动过程中下降之间的反相关系与源自芳香化合物和激素衍生自共同底物的假设一致,并且芳香的丰度取决于降低对蟾蜍素合成的需求。
结果是显着的,因为了解MA合成中最终步骤所需的基因为栽培草莓中的标记发育奠定了基础。八倍体种质中MA的罕见发生及其环境变异性使MA的育种相当具有挑战性。对应于因果基因或等位基因的分子标记将判断鉴定至少一些MA生产所需的基本遗传成分的植物。发生3'的序列变化Fanaamt.基因可以通过PCR检测,只在能够产生MA的植物中产生扩增子(图。8.).使用面板A中所示的引物对,可以在能够产生的植物中扩增〜1.5kbp产品(面板B),包括“FRAU MEIZE Schindler”(MA阳性)品种(未示出)。序列变化与检测转录物的能力完全相同,但不总是与挥发性一起,表明检测到的变体是必要的,但不足以鉴定MA产生基因型。共同放大频带作为对照,并且在“伊丽兰纳”和一些隔离品种的低水平下重复地放大。其他MA隔离种群的额外乳丝测试并未遵循相同的模式,表明该特定分子标记物的效用可以限制(C.Barbey和K. folta,未发表)。
鉴定与MA合成的最终步骤相对应的转录本、蛋白质、底物和分子标记是更精确地培育这种水果挥发性物质的第一步。了解这一机制也有助于更集中地研究可能导致MA积累及其环境变异的其他基因。这些过程可能受其他四种转录本的控制。最终,这些试验增强了我们对水果和花挥发物分子基础的理解,从而将相关基因引入普通选择中,生产出风味更好的水果。这样的产品会受到消费者的青睐,有利于健康的饮食习惯,增加草莓种植者的利润。
结论
消费者认为草莓味的有改善余地。强烈导致水果 - 花卉挥发性产生和相应基因分子标记的发育的基因的鉴定是加速育种的良良步骤,用于改善的感觉特征。在本报告中,编码甲基转移酶的基因(Fanaamt.通过批量分离转录组分析鉴定出来,设计了分子标记,其可以鉴定具有更高的产生葡萄香气挥发性的基因型。很清楚Fanaamt.可能只是调节MA积累的幅度,这表明基础MA生产需要额外的基因。这些基因将成为未来研究的主题,以追求更美味的浆果,使种植者和消费者都受益。
缩写
- 风扇:
-
Fragaria x ananassa
- FVB.:
-
草莓属vesca ssp。bracteata
- f:
-
Fragaria Vesca.
- 妈妈:
-
甲基邻氨基苯甲酸盐
参考文献
- 1。
Cardello AV。食品质量 - 相关性,背景和消费者期望。食物乐趣。1995年; 6(3):163-70。
- 2.
乌尔里希D、霍伯格E、拉普A、凯克S。草莓风味分析.通过挥发性化合物的定量来区分香气类型。Zeitschrift Fur Lebensmittel是一家集食品和技术于一体的公司。1997;205(3):218–23.
- 3.
食品和饮料中的挥发性化合物。纽约:Marcel Dekker;1991年。
- 4.
陈志强。栽培草莓挥发性成分的定量组成。Senga Sengana, Senga Litessa和Senga Gourmella。农业科学学报。1980;31(5):487-94。
- 5。
Larsen M, Poll L, Olsen CE。用气味阈值评价一些草莓(Fragaria Ananassa Duch)品种的香气组成。Z Lebensm Unters Forsch. 1992; 195:536-9。
- 6。
Larsen M,草莓中一些重要芳香化合物的气味阈值。Z菌陀螺福尔斯。1992年; 195:120-3。
- 7。
Schieberle P,Hofmann T.通过定量测量和模型混合物的定量测量和感官研究评估新鲜草莓汁中的角色冲击气味。JAgric Food Chem。1997年; 45(1):227-32。
- 8.
Carrasco B, Hancock JF, Beaudry RM, reamales JB。草莓和弗吉尼亚草莓后代香气的化学组成及遗传模式。Hortscience。2005;40(6):1649 - 50。
- 9.
Ulrich D,Komes D,Olbricht K,Hoberg E.野生和栽培植物的芳香模式的多样性。遗传资源作物evol。2007; 54(6):1185-96。
- 10。
Pyysalo T, Honkanen E, Hirvi T.比较野生草莓Fragaria- vesca L和栽培浆果Fragaria X Ananassa cv Senga Sengana的挥发物。农业食品化学。1979;27(1):19-22。
- 11.
赫维T,本卡宁E。栽培草莓与野生草莓回交获得的两个新草莓品种Annelie和Alaska Pioneer的挥发物,Fragaria Vesca.吕根岛,Fragaria Virginiana.Z·勒宾奥尔森托运。1982; 175(2):113-6。
- 12.
王家,de luca V.生物合成和调节康德葡萄果酯的生物合成,包括“氟氧基”甲基钽。工厂J. 2005; 44(4):606-19。
- 13.
Krokida Mk,腓立柳柳菌C.空气和冷冻干燥过程中苹果的波动性。J Food Eng。2006; 73(2):135-41。
- 14.
Jabalpurwala Fa,Smoot JM,Rouseff RL。柑橘花挥发物的比较。植物化学。2009; 70(11):1428-34。
- 15.
Flamini G,Cioni Pl,Morelli I.使用固相微萃取作为抽样技术,测定花,孤立的花零件和花粉中排出的挥发物。J ChromatogR A. 2003; 998(1):229-33。
- 16。
Attaway JA, Pieringer AP, Barabas LJ。柑橘风味成分的起源- i:柑橘叶油的气液相色谱、薄层色谱和质谱分析。植物化学。1966;5(1):141 - 51。
- 17。
Nozal MJ, Bernal JL, Toribio L, Jiménez JJ, Martín MT.高效液相色谱法测定蜂蜜中邻氨基苯甲酸甲酯、羟甲基糠醛及相关化合物。acta optica sinica; 2001; 30(1): 97 - 101。
- 18.
KöllnerTG,Lenk C,Zhao N,Seidl-Adams I,Gershenzon J,Chen F,Degenhardt J.草食虫诱导的玉米甲基甲基转移酶,使用S-腺苷-1-甲硫氨酸甲酸甲酸亚甲酸。植物理性。2010; 153(4):1795-807。
- 19.
王志强,王志强,王志强,等。植物香气物质的遗传多样性。植物生态学报。植物品种。2008;127(1):87 - 93。
- 20。
奥尔布里希特K,乌尔里希D,维斯K,格拉夫C。Fragaria x ananassa Duch模式种群中选定挥发物数量的变化。受收获年的影响。农业食品化学杂志。2011;59(3):944–52.
- 21。
Chamber A,Pillet J,Plotto A,Bai J,Whitaker V,Folta K.使用综合遗传基因组分析化学方法鉴定草莓风味基因候选物。BMC基因组学。2014; 15:217。
- 22。
Amaya I,Pillet J,Folta Km。利用下一代测序技术鉴定负责挥发性含量的自然变化的基因。植物信号转换:方法和protoc。2016:37-45。
- 23。
Chambers A,Whitaker VM,Gibbs B,Plotto A,Folta Km。检测不同草莓(Fragaria SPP的Linalool生产NES1变体。植物品种。2012; 131(3):437-43。
- 24。
基于密集靶向捕获连锁图谱的草莓八倍体亚基因组的进化起源和动态。基因组生物学进展。2014;6(12):3295-313。
- 25.
Shulaev V、Sargent DJ、Crowhurst RN、Mockler TC、Folkerts O、Delcher AL、Jaiswal P、Mockaitis K、Liston A、Mane SP等。林地草莓(Fragaria Vesca)的基因组。纳特·吉内特。2011:109–16.
- 26.
舒尔兹MH, Zerbino DR, Vingron M, Birney E. Oases:跨越表达水平动态范围的健壮的从头RNA-seq组装。生物信息学。2012;28(8):1086 - 92。
- 27.
Clancy M,Rosli H,Chamala S,Barbazuk W,Civello P,Folta K.验证草莓(Fragaria SPP)中的参考转录物。Mol Gen Genomics。2013; 288(12):671-81。
- 28。
Hoffmann T,Kalinowski G,Schwab W.RNAIB诱导草莓果(Fragaria x ananassa)的基因表达沉默的沉默,用于基因功能分析的快速测定。工厂J. 2006; 48(5):818-26。
- 29。
Lazo Gr,Stein Pa,Ludwig Ra。农杆菌中的DNA转化主管拟南芥基因组文库。生物技术(N Y)。1991; 9(10):963-7。
- 30.
Jouquand C,Chandler C,Plotto A,Goodner K.对收获日期和季节的新鲜草莓的感官和化学分析揭示了影响饮食质量的因素。J AM Soc Hortic SCI。2008; 133(6):859-67。
- 31。
PreußA,Augustin C,Figueroa Cr,Hoffmann T,Valpuesta V,Sevilla JF,Schwab W.功能性茉莉酸羧基甲基转移酶的表达与草莓果实发育负相关。J植物理性。2014; 171(15):1315-24。
- 32。
Ulrich D,Hoberg e,Olbricht K.草莓繁殖中的风味控制通过感官和仪器方法。Acta Hortic。2006; 708:579-84。
- 33。
王志强,王志强,王志强,等。植物芳香化合物的遗传分析。植物品种。2008;127(1):87 - 93。
- 34。
赵南,关吉,富勒·j-l,engle n,chern m,ronald p,tschaplinski tj,chen f.生物合成和昆虫诱导的水杨酸甲酯和苯甲酸甲酯的发射。植物理性生物化学。2010; 48(4):279-87。
致谢
作者感谢Shane Alan Evans和Christy Evans在水果处理中的帮助下。
资金
这项工作是在佛罗里达州农业和消费者服务中USDA专业作物块赠款(VMW和KMF)的资金进行资金,佛罗里达州植物分子育种计划(VMW和KMF)。
可用性数据和材料
来自父母线的原始RNASEQ数据('MARA DES BOIS'和'ELYANA')和F1工厂可从项目SRP039356下的NCBI短读取存档提供(http://www.ncbi.nlm.nih.gov/sra/?term=SRP039356).
作者信息
隶属关系
贡献
JP对RNASEQ数据和对GC / MS数据的比较进行了计算分析,进行了QPCR验证,克隆了AAMT基因,并在体外表达/底物实验中进行。AHC收集和制备GC / MS的水果样品,用于文库的分离的RNA。CB对甲基转移酶系列和阴茎分析中基因进行了表达分析,以及水果提取物中底物和产物的表征。ZB进行了农业渗透RNAi实验。AP为GC / MS分析提供了GC / MS分析,并提供了稿件。JB提供了GC / MS的技术专业知识。MS和TJ分析了农药过滤后挥发物的水果提取物。BH有助于基因组分析和标记发育。VMW进行了初始遗传杂交,提高了后代,收集的水果并辅助手稿准备。TAC为挥发性分析提供了项目监督。 KMF conceived the concept of the study, supervised and coordinated experiments, and prepared the manuscript. All authors have read and approved the manuscript.
通讯作者
道德声明
伦理批准和同意参与
n / a。
同意出版物
所有作者都同意提交的手稿。
利益争夺
提交人声明他们没有竞争利益。所有贡献作者的资金,酬金和旅行报销都可以通过www.kevinfolta.com/transpareny..
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
额外的文件
附加文件1:
S1。相邻连接树表明草莓中含有甲基转移酶_7结构域的蛋白质之间的相关性,与其他植物中具有类似功能的蛋白质相关。S2。相关性的相关性Fanaamt.转录和MA检测在其他生产者。S3。用类似畴序列的非靶量转录物的RNAi效应示范。(DOCX 310 KB)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
皮莱特,钱伯斯,a.h.,巴贝,C。等等。鉴定一个甲基转移酶催化的最后一步合成邻氨基苯甲酸甲酯栽培草莓。BMC植物BIOL.17,147(2017)。https://doi.org/10.1186/s12870-017-1088.1.
已收到:
公认:
发表:
关键词
- 香气
- 味道
- 草莓属
- 葡萄
- 甲基炭酸酯
- 分子公司
- 草莓
- 挥发物