摘要
背景
小RNA测序和降解组测序已经在植物种子中发现了大量的mirna -靶对。然而,可以反映种子发育和萌发之间联系的mirna介导调控的详细时空研究仍然缺乏。
结果
在本研究中,我们通过对大麦种子成熟和发芽的联合分析,扩展了mirnas参与的基因调控的研究。通过对小RNA测序数据的生物信息学分析,共鉴定出1324个已知miRNA家族和448个新的候选miRNA。其中,基于降解组测序数据确认了16个已知miRNAs和40个靶基因,以及3个新的miRNAs和4个靶基因。miR156、miR168、miR166、miR167和miR894等保守miRNA家族在发育和发芽种子的胚胎中高度表达。一种大麦特异性miRNA, miR5071,被预测可以靶向OsMLA10-like基因,积累在高水平,表明它参与了这两个发育阶段的防御反应。基于目标预测和京都基因与基因组百科的分析,发现9个高表达的miRNAs与植物激素信号和激素串扰有关。Northern blot和qRT-PCR分析表明,这些miRNAs在种子发育和萌发过程中表现出不同的表达模式,说明它们在激素信号通路中的作用不同。此外,我们发现miR393通过靶向大麦中两个编码生长素受体TIR1/AFBs的基因来影响种子的发育,因为过表达miR393导致种子长宽比增加,而靶模拟物(MIM393)介导的抑制其活性会降低种子的千粒重。此外,miR393错表达系中生长素响应基因、脱落酸和赤霉素相关基因的表达在萌发和幼苗早期生长过程中发生改变。
结论
我们的研究表明,mirna -靶对参与大麦胚的基因表达调控和激素相互作用,从而证明mir393介导的生长素反应调控影响籽粒发育,影响萌发过程中赤霉素酸和脱落酸的稳态。
背景
种子发育和萌发是植物生命周期中两个重要的发育阶段。对于大多数开花植物来说,种子成熟和发芽之间隔着一段静默期,这段静默期称为休眠期[1].休眠胚只有在打破休眠状态后,才会在吸胀后萌发。另一方面,这两个过程之间有密切的联系。全基因组表达分析和综合代谢物研究表明,萌发过程中最初的蛋白质合成使用了储存在成熟干燥种子中的已有mrna,而在种子成熟后期就已经开始为萌发进行代谢准备[2,3.].
大多数种子由三个基本部分组成:胚、胚乳和种皮。胚包含萌发后新植物发育所需的基本成分和形态,而胚乳则为胚在萌发期间提供营养[4].生理和分子水平的研究表明,种子的成熟和发芽涉及紧密的基因调控和激素控制,以确保种子不同间隔间信号的持续交换[4,5,6,7].脱落酸(ABA)和赤霉素酸(GA)两种激素在决定种子生理状态和调节种子发育和萌发过程中起着重要作用。ABA水平在种子成熟和休眠期间达到峰值,而GA水平在吸胀期间增加,并在萌发和胚后生长期间保持高水平[1].然而,ABA和GA的平衡似乎并不是绝对浓度,而是决定了这两个事件。此外,另一种激素生长素也被证明在种子发育的第一步以及胚胎结构和大小的确定中起着至关重要的作用[4,8].在拟南芥的研究表明,生长素通过与ABA等其他激素的串扰在种子休眠和萌发中发挥作用,表明在这一重要过程中生长素和ABA信号通路存在协调网络[9].
在种子发育和萌发过程中控制基因表达的一个重要机制是由microRNAs (miRNAs)发挥作用[10,11].miRNAs是一类长度约为21-22 nt的内源性非编码小rna (sRNAs),通过靶向mRNA进行切割或翻译抑制,在转录后调节基因表达[12].高通量小RNA测序与降解组分析相结合,可在水稻、玉米、大麦和水稻种子中鉴定出保守的和新颖的mirna靶对芸苔属植物显著[13,14,15,16,17,18,19,20.].越来越多的证据表明,miRNAs在种子的多种生物和代谢过程中起着至关重要的作用,包括胚胎发生、模式建立、种子休眠、种子萌发和早期幼苗生长。缺乏miRNA生物发生和/或处理成分的突变体表现出严重的种子发育异常甚至致命[21,22].据报道,miR172通过对几种基因的靶向作用影响种子大小和产量APETALA2类转录因子[23];的mir159ab双突变体表现为种子大小减小和形状改变[24].miR159和miR160通过调控ABA敏感性影响种子萌发过程。过度表达抗mir160的转基因植物ARF10对ABA高度敏感,表明ABA与种子中生长素存在交感作用[25].
大麦(大麦芽小麦是世界上最重要的谷类作物之一,产量排名第四,广泛用于酿造和动物饲料。大麦种子的成熟和萌发与作物产量和加工品质密切相关。许多大麦miRNAs已经通过使用早期发育阶段的叶片、幼苗、根系和种子样本进行小RNA测序鉴定出来[20.,26,27,28,29,30.].然而,对于影响种子发育和萌发的重要组织胚胎,尚未进行完整的miRNA表达谱分析。本研究的目的是发现大麦miRNAs的胚胎特异性表达及其潜在靶点,为进一步深入研究大麦miRNAs的功能提供重要线索。
方法
植物材料
大麦(大麦芽L. ' Golden Promise '),来自阿德莱德大学澳大利亚植物功能基因组学中心,用于本研究。这些植物于10月至5月在中国浙江省杭州市浙江大学农业实验站自然条件下的土壤中生长。花后10天(10dpa)的未成熟胚胎从穗上解剖。在第1 DAG(萌发后几天)和第5 DAG收集胚胎,种子表面消毒、漂洗,然后放在9 cm培养皿中潮湿的滤纸上,4°C暗处保存48 h。然后在0.1 mM CaCl容器中生长1 d和5 d2溶液(pH值5.8),24°C, 16 h光照/8 h暗光周期,可控气候室。
大麦中保守和新型miRNAs的小RNA测序和鉴定
每个样本至少3克胚胎的总RNA,如图所示。1根据制造商说明,使用TRIzol试剂(Invitrogen, USA)进行分离。从三个生物重复中提取的RNA组成每个样本进行小RNA测序。采用凝胶电泳(28S:18S比> 1.5)和生物分析仪(Agilent2100, RIN≥8.0)检测RNA质量。然后按照北京基因组研究所(华大基因,深圳,中国)使用的标准协议构建sRNA文库。将符合条件的总RNA样本进行凝胶纯化,选取长度范围为18 ~ 30 nt的片段建立文库。然后,将两种适配器连接到结果片段的两端。将制备的RNA进行逆转录PCR (RT-PCR)扩增,RT-PCR产物装入Hiseq2000平台进行测序。Hiseq测序的原始数据进行数据清洗分析,包括去除低质量标签和5 '适配器污染物,以获得足够清洁的标签。过滤后,大小从18到30 nt的sRNAs被排列到大麦基因组(http://plants.ensembl.org/Hordeum_vulgare/Info/Index)、Genbank和Rfam (http://rfam.xfam.org/),与已知大麦rrna、trna、snrna和snorna匹配的序列被丢弃。然后将未注释的小RNA标记与miRBase 21 (http://www.mirbase.org/),那些可以与miRBase中的miRNA前体对齐且没有错配,或与miRBase中已知的大麦miRNA至少有16 nt重叠对齐的,称为已知miRNA。如果miRBase中没有该物种的miRNA信息,则可以与miRBase中所有植物的任何miRNA前体或成熟miRNA对齐,允许两次错配或自由间隙,并与预测前体对齐的候选miRNA视为已知miRNA。对齐后,mRNA外显子和内含子对应的小RNA标签(用于寻找mRNA降解片段)和未注释的标签通过Mireap软件(http://sourceforge.net/projects/mireap/)由华大基因开发。利用RNAfold软件预测大麦基因组中所有已识别和潜在的pre-miRNAs的二级结构(http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi).新miRNAs的最小折叠能指数(MFEI)被设定为等于或大于0.9。
通过绘制对数-比值图和散点图来鉴别差异表达的miRNAs。miRNAs的表达按照转录本百万分率(TPM)进行归一化。对于每个样本,TPM =(实际miRNA计数/总清洁读取计数)× 106.miRNA表达的折叠变化计算为折叠变化= log2(处理/对照)。差异表达序列计数用在线服务IDEG6 (http://telethon.bio.unipd.it/bioinfo/IDEG6_form/).我们考虑了至少2倍和a倍的变化P截止值的P< 0.00001作为显著变化的指示,并认为给定的miRNA是一种特定的发育阶段相关的miRNA。从Blastall的结果中选择的潜在的pre-miRNA序列,通过基于web的计算软件MFOLD进行Zuker折叠算法在硅二级结构生成。
目标预测和降解组测序数据分析
使用Mireap和psRNATarget (http://plantgrn.noble.org/psRNATarget).Mireap软件分析采用修改后的参数:(1)sRNA与目标之间不超过4个错配(G-U碱基计为0.5个错配);(2) miRNA/目标双工中相邻不匹配不超过两个;(3) miRNA/目标双工(miRNA的5 '端)的2-12位没有相邻的不匹配;(4) miRNA/目标双工的10-11位没有错配;(5) miRNA/target双工(miRNA的5 '端)的1-12位置不超过2.5个错配;(6) miRNA/目标双工的最小自由能(MFE)应大于或等于与完美补体结合的miRNA的MFE的75%。降解组分析基于从NCBI下载的大麦降解组测序数据集(登录号SRR513549、SRR513550和SRR513551)。本研究采用了具有“默认参数”的miRU算法[31].
基因本体论(GO)是一种国际标准化的基因功能分类体系,它为全面描述基因及其产物的特性提供了一套受控词汇。氧化石墨烯有三种本体论:分子功能、细胞成分和生物过程。该方法首先将所有目标基因候选基因映射到数据库(http://www.geneontology.org/),计算每个术语的基因数。然后使用超几何测试在目标基因候选基因中找到显著富集的氧化石墨烯项,并与参考基因背景进行比较。然后,利用WEGO (http://wego.genomics.org.cn/cgi-bin/wego/index.pl).与…谈判P-value <0.05被认为显著富集。
为了便于理解候选靶基因的生物学功能,采用京都基因与基因组百科(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路分析方法,与整个内参基因背景相比,识别靶基因中显著富集的代谢通路或信号转导通路。计算公式与GO分析相同。
miRNA表达的Northern blot分析
总RNA提取使用TRIzol试剂(Invitrogen, USA)。RNA凝胶印迹,30 μg总RNA在含7 M尿素的17%聚丙烯酰胺凝胶上分离,印迹到HyBond-N+膜(Roche, Germany)上,通过UV交联固定。用针对miRNAs设计的地高辛末端标记锁定核酸(LNA)寡核苷酸探针对印迹进行杂交。miRNA水平与rRNA水平标准化。寡核苷酸探针的序列列在附加文件中1:表S5。
实时定量RT-PCR分析mirna及其靶水平
使用TRIzol试剂(Invitrogen)提取大麦胚和幼苗的总RNA,使用1 μg进行第一链cDNA合成,使用Oligo(dT)引物和Super-Script III RT试剂盒(TaKaRa,大连,中国)。使用SYBR PrimeScript RT试剂试剂盒(Perfect Real Time, TaKaRa)在Mastercycler ep realplex2系统(Eppendorf, Hamburg, Germany)上进行实时定量PCR (qRT-PCR)。用ΔΔCt方法计算相对转录水平肌动蛋白或UBQ吉恩被用作参考。使用Mir-X™miRNA第一链合成试剂盒(Clontech Laboratories, Inc., Cat),通过基于聚(a)的实时PCR方法对成熟miRNA水平进行量化。#638315), miRNA水平用U6标准化。引物序列列在附加文件中1:表S5。所示数据来自三个生物重复。
通过RLM-5 ' RACE对靶基因进行验证
RNA连接酶介导的cDNA末端5 '快速扩增(RLM 5 ' -RACE)使用SMART TM RACE cDNA扩增试剂盒(Promega, USA)进行。5 '端分析遵循了制造商的协议。简单地说,总RNA在7 DAG时从叶片组织中分离出来,连接到5 '端RNA适配器上,然后使用寡聚(dT)引物进行逆转录。PCR反应使用两对基因特异性的反向引物进行(附加文件1:表S5)。PCR产物经凝胶纯化后,克隆至T-easy载体(Promega, USA)并进行测序。
载体构建与大麦转化
根据Bian等人的研究,产生了miR393过表达和MIM393构建。[32和Bai等人。[33].用于载体构建的克隆通过测序验证,然后电穿孔根癌土壤杆菌用该菌株对金承诺大麦植株进行了转化。大麦转化使用农Bai等人描述的-介导的共培养方法[33].转化后的植株在24°C, 16 h光照/8 h黑暗的生长室内或在6英寸的自然条件下生长。生长室内的花盆(浙江大学)。
结果
大麦胚成熟和萌发过程中表达的sRNAs综述
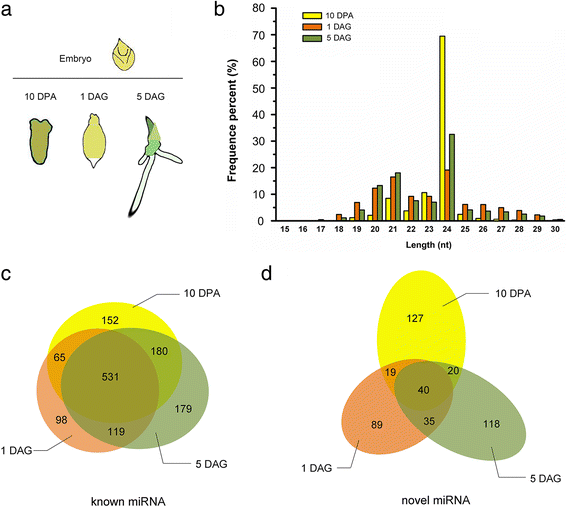
为了获得种子成熟和萌发过程中胚胎中miRNA表达谱的概述,我们利用三个不同发育阶段的样本构建了sRNA文库:种子发育过程中籽粒储存阶段的一个时间点(10 DPA),种子萌发过程中的两个时间点,包括1 DAG(从吸吸到胚根萌发)和5 DAG(萌发后生长)(图1)。1).从原始测序数据中去除低质量和适配器污染物(读数<18 nt)后,总数为17,216,333;17729069;分别从10个DPA、1个DAG和5个DAG的库中获得20,330,126个clean read(附加文件1:表S1)。根据srna的长度,有两种主要的群体(图1)。1 b).在三个文库中,位于24 nt的长度分布峰值分别占69.44%、19.09%和32.5%,说明在这些阶段发生的异染色质修饰和rna定向的DNA甲基化都与sirna相关调控有关。这与之前对水稻的一项研究一致,该研究表明灌浆或发育中的籽粒含有最丰富的24-nt小rna [15].21 nt小rna是三个库中第二丰富的群体,分别占总阅读数的8.48%、16.48%和18.05%。除去可以被注释为rRNA、重复、外显子或内含子的reads后,剩下的reads用于miRNA预测。
大麦胚中表达的已知和新mirna的鉴定
通过生物信息学分析,发现了1324个已知的miRNA家族和448个新的miRNA候选基因,其总RPM (reads per million)高达1(附加文件)2:表S2)。已知的miRNAs通过比对miRBase中已经注册的序列进行识别(Release 21),而新的miRNAs则根据其前体的特征发夹结构进行预测。如维恩图所示,在我们测试的三个阶段,在发育和吸收种子的胚胎中检测到531个保守miRNA家族和40个新的miRNA候选。共有152个和127个、98个和89个、179个和118个已知和新的miRNA家族分别在10 DPA、1 DAG和5 DAG的胚胎中特异性表达。
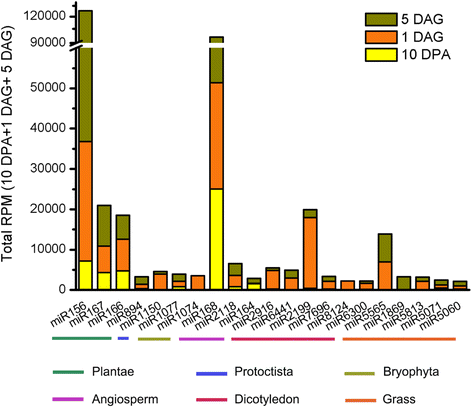
按总RPM(> 2000)计算,已知高表达的前21个miRNA家族根据它们在植物王国中保存的程度进行了分组(图。2).其中,miR156、miR167、miR166和miR894 4个miRNAs在miRBase中注册的所有植物物种中都是保守的;3个mirna (miR168, miR2118和miR164)在被子植物中是保守的;6个mirna (miR2916、miR6441、miR2199、miR7696、miR8124和miR6300)只在双子叶植物中检测到;5个miRNAs (miR5565、miR1869、miR5813、miR5071和miR5060)似乎是跨草科的保守家族。值得注意的是,我们发现miR5565和miR2199在大麦种子萌发过程中显著且高表达,而miR156、miR166、miR167和miR168在种子发育和萌发阶段都有积累(图1)。2).
种子发育和萌发过程中胚胎mirna的差异表达
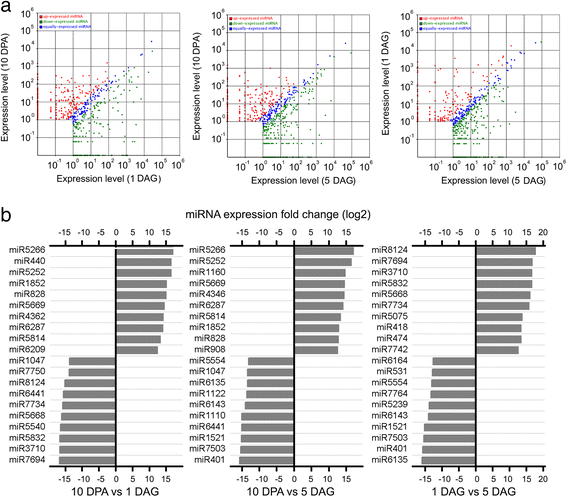
已知mirna的表达水平归一化为TPM(每百万转录本)。在三个发育阶段的每一次成对比较中,发现胚胎中的几种miRNAs发生了显著变化(图。3).其中,两份倍数变化大于12的样本间表达差异显著的miRNAs (p值<0.01)所示。3 b.灌浆期miR5266、miR5252、miR5669、miR1852和miR5814的表达明显高于萌发期。相反,miR6441和miR1047在幼苗生长早期表达水平升高。miR6135和miR401仅在5 DAG时表达高,而miR5832和miR7734在1 DAG时优先表达。
miRNAs的靶标预测与功能分析
使用大麦Unigene文库(Esembl)、Mireap和psRNATarget对miRNA候选靶基因进行预测3.:表S3)。此外,我们从NCBI的可用降解数据中寻找证据,以选择可能由靶mrna切割而产生的miRNAs。共鉴定出16个保守miRNA家族靶向的40个基因1).这些靶点大多被注释为转录因子编码基因,包括SQUAMOSA启动子结合蛋白样基因(:)被miR156、MYB转录因子(MYBs)被miR159,生长素反应因子(东盟地区论坛)和TCP家族转录因子(安全和)靶向miR319。miR444被预测靶向编码无名指蛋白的基因MLOC_16182;miR5051靶向编码丝氨酸/苏氨酸蛋白激酶的MLOC_57965;miR7757靶向MLOC_17471编码一种推测为NBS-LRR抗病蛋白。这些mirna -靶对在大麦中首次被报道。MLOC_24045中miR9863的切割特征编码了一个推测的抗病蛋白(CC-NBS-LRR类)家族成员,与之前的研究一致[33].对于新的miRNAs,降解组测序数据仅证实了4个基因中mirna介导的3个新的切割位点(表22).
通过本体分析对所有潜在的靶基因进行功能注释。预测的靶点主要分为三大类:生物过程、细胞成分和分子功能。其中,细胞组分中的细胞、细胞部分和细胞器部分、分子结合、催化活性、酶调节剂活性、分子换能器活性、代谢过程、结合、催化活性、细胞组分中的转录调控和生物过程中对刺激的响应是观察最多的类别(附加文件4:图S1),表明miRNAs可能在多种重要的生物过程中发挥作用。
在种子发育和萌发过程中参与植物激素信号传递的miRNAs
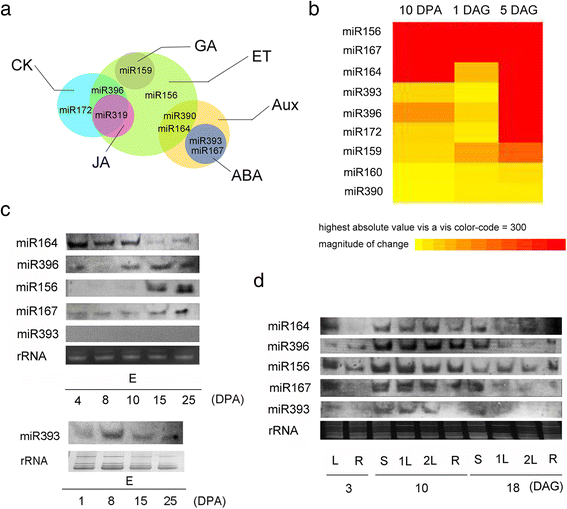
对候选靶基因进行KEGG通路分析。9个miRNAs被预测参与植物激素信号通路(图。4).其中,miR156、miR159、miR390、miR164、miR396和miR319被预测调节乙烯通路,miR159调节GA信号通路;miR172、miR396和miR319可能与细胞分裂素信号有关。包括miR393、miR390、miR164和miR167在内的4个miRNAs似乎参与了生长素通路,而miR393和miR167则调节ABA通路中的基因。miR319也被预测与茉莉酸通路有关。这些miRNAs中的大多数至少参与两个植物激素通路,这表明这两个发育阶段的控制涉及五种关键植物激素之间的相互作用。
植物激素相关的miRNAs参与种子成熟和种子萌发过程。a:通过KEGG通路分析mirna介导的植物激素串扰调控综述;b:显示种子发育和萌发过程中miRNA表达的sRNA测序数据。用BAR HeatMapper可视化表达水平。热图下方的数字表示相对表达强度,表达强度越高用越红的颜色表示;c:种子发育过程中胚胎miRNA水平的Northern blot分析。分别加载30 μg和50 μg(用于miR393)总RNA,用EtBr染色作为加载对照。E,胚胎;d:幼苗生长早期miRNA水平的Northern blot分析。从不同发育阶段的组织中分离总RNA。 L, leaf; R, root; S, stem; 1 L, first leaf; 2 L, second leaf
为了确定这些miRNA的丰度,我们通过测序数据分析结合northern blot确认比较了9个已知miRNA家族的积累情况。如图所示。4 bmiR156和miR167在我们检测的三个发育阶段都有高表达;miR164主要在种子发育和萌发后表达;miR393、miR172和miR396在5 DAG时优先在胚胎中表达。miR159的丰度在萌发过程中逐渐增加。通过northern blot分析进一步验证了5种高表达miRNAs的表达。总体而言,northern blot分析结果与测序数据一致(图1)。4摄氏度).在种子发育过程中,miR164在胚胎中从4 DPA积累到10 DPA,在种子发育后期miR164水平下降。miR396和miR156的丰度随着种子进入成熟期而增加。miR167在整个种子发育过程中表达稳定。miR393水平变化显著,只有当我们增加RNA样本的加载量后,才可以在8 DPA的胚胎中检测到。在幼苗生长早期,miR156、miR396、miR167和miR164在根、茎和叶组织中的丰度增加,特别是在10 DAG时。miR393和miR167在茎和叶组织中表达量较高,而在根组织中表达量较低。4 d).
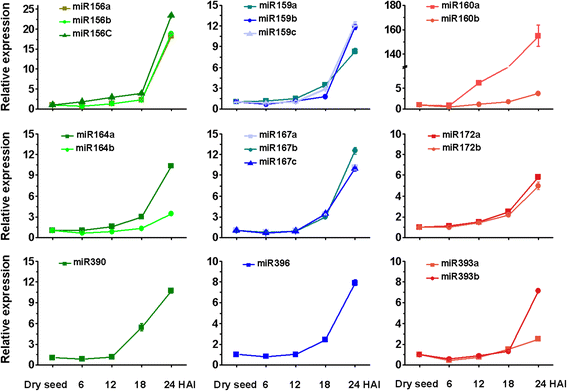
为了区分已知miRNA家族中的不同成员,我们进行了qRT-PCR检测种子吸胀过程中胚胎中成熟miRNA的水平。吸胀后的最初24小时是种子萌发的关键,在此期间胚胎细胞迅速从静止状态切换到代谢活跃状态。与相应的对照(干种子)相比,我们测试的所有miRNA成员在24小时的吸胀早期都增加了它们的水平。5),提示这些miRNAs的表达是动态的,可能参与了种子萌发过程中的基因表达调控。
mirna诱导的靶mrna断裂的验证
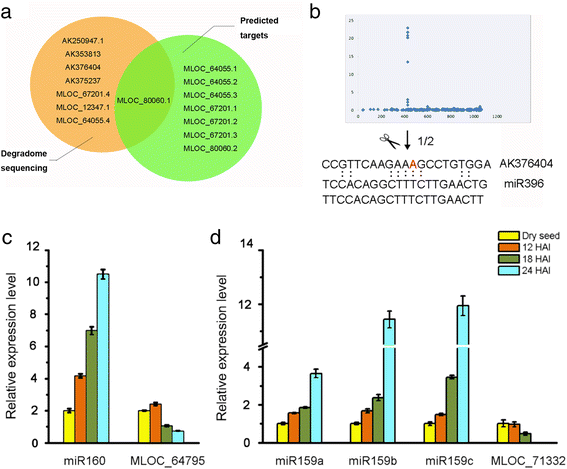
上述植物激素相关miRNAs的靶点在附加文件中有总结1:表S4根据我们的研究和以往的研究。此外,我们通过生物信息学预测和基于降解组测序数据的验证验证了miR396的候选靶标(图。6).两种方法的结果只发现一个基因MLOC_80060重叠。为了进一步检测目标转录物中的裂解位点,我们使用从1周龄野生型植物(WT)叶片中提取的RNA进行了5’-RACE。巢式PCR和凝胶电泳检测到AK376404转录本的两个主要裂解产物。5 ' -RACE克隆的测序显示AK376404转录本中有一个裂解位点。6 b),注释为a平转录因子。
Hvu-miR396、miR160和miR159靶基因的验证。a:通过psRNA Target软件预测的Hvu-miR396靶点与降解组数据分析的重叠;b: Hvu-miR396靶基因的验证。上面一行显示了降解组标签读取沿目标mRNA序列的全长分布。下排显示AK376404 mRNA裂解位点的改良的5 ' RACE-PCR图谱。箭头表示miR396的裂解位点。以上数字描述了在预测裂解位点终止的克隆产物的比例;c-d:实时qRT-PCR检测种子吸胀过程中miR160 (c)、miR159 (d)及其靶基因水平。从胚萌发阶段的不同时间点(干种子、12 HAI、18 HAI、24 HAI)中分离到总RNA。干燥种子中表达量设定为1.0。 Error bars represent the SD from three independent experiments
根据靶基因信息,选择miR160、miR159及其靶基因的表达水平,采用qRT-PCR进行检测(图5)。6 c, d).MLOC_64795 (miR160靶向)和MLOC_71332 (miR159靶向)在萌发种子胚中的转录水平呈逐渐下降的趋势,而miR160和miR159的转录水平在种子开始萌发时呈上升趋势。
mir393介导的生长素信号调控影响种子的发育和萌发
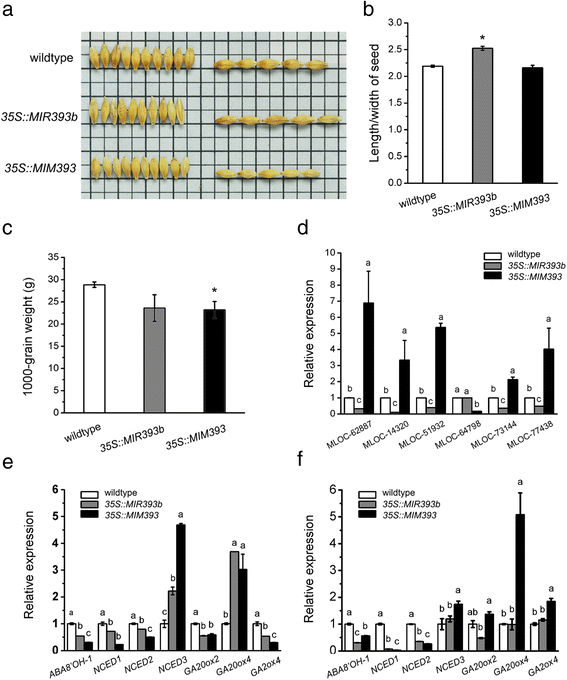
在我们之前的工作中,我们在大麦中发现了两个miR393家族成员,并确认了两个靶基因,HvTIR1(MLOC_9864)和HvAFB(MLOC_56088)通过改良的5 ' -RACE (cDNA末端的快速扩增)以及通过降解组数据分析[34].为了研究miR393/target模块在种子发育中的生物学功能,我们构建了过表达miR393 (35 s:: MIR393b)或通过人工miRNA靶点模拟策略抑制miR393活性(35 s:: MIM393).通过northern blot和qRT-PCR分析,我们发现miR393负调控其两个靶基因的转录水平(HvTIR1而且HvAFB)[34].此外,我们发现miR393影响大麦种子的大小和形状。如图所示。7 a和b与野生型相比,种子长宽比显著增加35 s:: MIR393b植物,虽然千粒重没有明显变化。在35 s:: MIM393植株中,只有千粒重显著降低(图5)。7 c).
mir393介导的生长素信号调控影响种子萌发过程中的籽粒表型和植物激素对偶。一个:野生型种子表型,35 s:: MIR393b而且35 s:: MIM393转基因大麦;b:野生型种子长宽比,35 s:: MIR393b而且35 s:: MIM393转基因大麦;c:野生型千粒重,35 s:: MIR393b而且35 s:: MIM393转基因大麦;星号表示与wildtype有显著差异。*,P< 0.05(学生的t以及);d:野生型生长素反应基因的相对表达量,35 s:: MIR393b而且35 s:: MIM393转基因大麦。总RNA从3 d龄幼苗中分离得到。通配符类型中的表达式级别设置为1.0。误差条表示三个独立实验的标准差;e-f:野生型中ABA和ga相关基因的相对表达量;35 s:: MIR393b而且35 s:: MIM393转基因大麦。总RNA从胚和子叶中分离得到(e)和root (f)。通配符类型中的表达式级别设置为1.0。误差条表示三个独立实验的标准差。不同的字母代表显著不同的值P< 0.05(邓肯多量程检验)
由于miR393靶向两个编码生长素受体TIR1/AFBs的基因,我们随后检测了这些转基因系中生长素信号相关基因的表达。这一分析表明,两个转录本东盟地区论坛成员(MLOC_77438和MLOC_73144),一个阿富汗二月家庭成员(MLOC_62887)和1人辅助/ IAA家族成员基因(MLOC_14320)在MIM393系3龄苗中上调2倍以上,在miR393过表达系中下调(图2)。7 d),说明种子发育的表型变化可能是由于miR393对生长素反应的影响。
然后我们检测了这些转基因系中基因表达的变化,包括ABA分解代谢基因(ABA8'OH-1)、ABA生物合成基因(NCED1、NCED2 NCED3)和三个与GA生物合成相关的基因(GA20ox2、GA20ox4 GA2ox4),在萌芽阶段的胚、子叶和根样品中都有。分析表明,这些基因在miR393错表达转基因系中表现出差异表达(图3)。7 e, f),表明miR393也影响ABA和GA信号通路。
讨论
到目前为止,sRNA和降解组测序已经用于鉴定水稻、玉米、小麦和大麦等作物植物种子中的miRNAs [18,19,20.,35].然而,对mirna介导的调控的详细时空研究仍然有限。在本研究中,我们研究了大麦胚在种子成熟和萌发过程中mirna介导的基因调控。我们选择的三个样本分别是10 DPA, 1 DAG, 5 DAG。10dpa的样品代表种子过渡到贮藏阶段,其特征是戏剧性的转录变化,以调动能量资源和分化将组成成熟粒的组织。1个DAG和5个DAG的样品分别代表萌发期和后萌发期。通过高通量测序和qRT-PCR检测,我们揭示了大麦籽粒发育和萌发过程中胚胎miRNAs介导的调控网络的动态特征。
胚胎组织中高度表达的保守和大麦特异性mirna
通过生物信息学分析,我们发现miR156是发育和发芽种子胚胎中表达最高的miRNA。据报道,miR156是包括苔藓在内的几乎所有陆生植物中保存最丰富的mirna之一[36].在拟南芥, miR156通过靶向调控青春期到成年期和花的转变:[37,38,39].在水稻和玉米中,miR156和miR172共同调节花序和分蘖发育[40,41,42].的监管OsSPL14由OsmiR156定义了水稻的理想植物结构,而OsSPL16miR156的另一个靶标,参与决定粒型的调控模块,可通过调控提高水稻产量和品质[43,44].在本研究中,我们发现miR156在种子发育和萌发过程中表现出动态表达模式。miR156在15dpa和25dpa时优先在胚胎中积累(图。4摄氏度),并在苗期早期呈增加趋势(图5。4 d而且5).通过对降解组测序数据的分析,3SPL基因家族成员包括AK356077, AK374598和MLOC_11199被预测为miR156的靶基因(表1).miR166被预测靶向5个属于III类同源结构域亮氨酸拉链(HD-ZIP III)家族的转录因子(表1和额外的文件1:表S4),在我们检测的三个样本中表达量非常高。miR166/HD-ZIP III模块可调控植物根和茎尖分生组织的细胞分化拟南芥[45,46].这说明miR156和mir166介导的转录因子抑制可能是种子发育和萌发过程中调节细胞分化的保守机制。
另一个保守的miRNA家族miR894,被发现在使用整个大麦种子样本(0-15 DPA)时积累在非常低的水平[20.];然而,我们发现miR894在发育和发芽种子的胚中都有高表达。此外,与1 DAG相比,在5 DAG时表达水平升高了3倍以上(图。2额外的文件2:表S2)。miR5071,只在大麦中被鉴定出来,积累在730;1234;和2484 RPM在10 DPA, 1 DAG,和5 DAG分别(附加文件2:表S2)。miR5071的靶点被预测为OsMLA10-like基因(20.].miR5071主要在胚胎中表达OsMLA10-like在15 DPA时从颖果中分离出的胚乳中转录本高度表达[20.].在大麦中,R基因MLA10据报道,它可作为真菌感染的受体,通过识别致病蛋白并授予对白粉病真菌的抗性[47].这表明在这两个发育阶段,miRNAs参与了防御反应调控。
其他值得注意的miRNAs在胚胎中高度表达,包括miR5565和miR2199。miR5565已在高粱二色的[48,并预测其靶点为大麦中的一个RING/U-box超家族蛋白[20.].至于miR2199,以前只在普通豆中报道过菜豆和柳枝稷(49],其在大麦中的表达及靶基因有待进一步确认。总之,我们的研究结果表明,在种子发育和萌发过程中,保守和大麦特异性miRNAs都参与了胚胎中的基因调控。
胚胎中mirna介导的激素信号调节
ABA和GA是决定种子成熟、休眠和萌发的两个主要因素。种子在母体组织和胚胎的成熟过程中可合成ABA,其含量在吸胀过程中迅速下降[50,51].GA至少在胚胎中被合成和储存,并在吸胀过程中被释放,以触发糊粉层中水解酶的合成和分泌,用于胚乳储存产物的动员[52].在目前的研究中,我们发现miRNAs是籽粒发育和萌发过程中ABA和GA信号的调控因子。ga相关miRNA miR159主要表达于萌发期(图5)。4而且5),它的靶点是编码aMYB转录因子和另一种预测蛋白(表1).qRT-PCR分析显示miR159a/b/c与其靶标MLOC_71332呈负相关(图1)。6),这意味着mir159介导的靶标抑制发生在吸胀后的最初24小时。
miR168是胚胎组织中表达第二高的miRNA,在之前的研究中发现它对盐、干旱和冷胁迫或ABA处理有反应。在拟南芥的转录调控MIR168a而且ARGONAUTE1内稳态在脱落酸和非生物胁迫响应中发挥关键作用[53].尽管由于sRNA测序和降解组分析中使用的样品不同,我们无法识别miR168介导的靶切片产物,但miR168被预测为靶标AGO1基于硼处理大麦幼苗样品的降解组测序[54].此外,我们还发现miR168在三个样品中积累到较高的水平,这表明miR168可能受到种子中ABA的影响,并可能参与种子脱水和萌发过程中的应激反应。
生长素在许多发育过程中都是万能的触发器,在种子发育和萌发中也发挥着关键作用[8].在我们的研究中,总共发现了5种与生长素信号有关的mirna,其中包括miR160(靶向性的)ARF10而且ARF17), miR167(目标ARF30 ARF18,而且ARF9), miR360(目标ARF19)和miR393(靶向AFB2而且AFB3)(表1).两份使用生长素信号报告器的独立报告,DR5:β葡萄糖醛酸酶(格斯)表明生长素依赖性反应在胚胎发生过程中增加,并在发芽种子中保持存在[25,55].因此,我们通过northern blot和qRT-PCR分析观察这些miRNAs的差异表达。在种子发育过程中,miR393从8 DPA累积到高水平,miR167表现出与miR164相反的表达模式,尽管后两者似乎都有调控作用东盟地区论坛与生长素信号有关的基因(图。4摄氏度).在萌发过程中,miR160、miR167和miR393均在吸胀后的24小时内上调(图1)。5).我们认为这些miRNAs可能是由内源性生长素强烈诱导的,并以不同的方式影响生长素信号。
这些mirna在种子发育和萌发中的重要性得到了之前在其他植物物种中的研究的支持。镇压ARF10被认为对种子萌发和萌发后阶段至关重要[25].miR160-directed的监管拟南芥ARF17对正常发育和调节早期生长素反应基因的表达至关重要[25].表达mirna抗性版本的植物ARF17生长素诱导物的改变积累GH3-like有显著的发育缺陷,包括胚胎、花器官发育和不育[56].表达抗osmir160基因的水稻转基因植株OsARF18(mOsARF18)在生长发育过程中表现出多效性缺陷,如身材矮小、叶卷和淀粉积累减少的小种子[57].拟南芥miR167控制的模式ARF6而且ARF8表达并调节女性和男性的繁殖[32].miR393靶向编码TIR1/AFBs生长素受体的F-box基因,参与调控水稻种子发育。过表达miR393的转基因水稻植株籽粒变小,小穗外颖片形状异常,无法闭合[58].
在本研究中,我们发现过表达miR393大大提高了种子的长宽比,而过表达MIM393显著降低了种子的千粒重。结合观察生长素等反应基因的差异表达GH3,辅助/国际宇航科学院而且东盟地区论坛在转基因系中(图5。7 d),这表明miR393通过负调控生长素反应影响种子发育,尽管miR393错表达系表型变化的具体机制还有待进一步研究。
生长素与ABA/GA的相互作用
在种子发育、休眠和萌发过程中,各种激素信号的相互作用在以前的许多研究中都有报道。例如,生长素通过诱导刺激ABA信号,促进休眠和抑制萌发东盟地区论坛介导的ABI3激活拟南芥[9].ABA在种子萌发过程中抑制胚轴伸长,也增强生长素信号[59].不同激素信号的相互作用也涉及mirna。在发芽拟南芥种子中,ABA可诱导miR159的积累ABI3端依赖时尚。miR159的靶点有MYB101而且MYB33编码转录因子作为ABA反应的正调控因子,这表明ABA诱导miR159的积累是幼苗胁迫反应中激素信号脱敏的一种内稳态机制[41].
在本研究中,基于靶基因的KEGG分析,我们发现胚胎中表达的9个miRNAs通过植物激素信号通路的复杂相互作用调节种子的发育和萌发(图1)。4).此外,我们还发现miR393调节生长素信号和激素相互作用。miR393靶向的两个基因编码大麦中的TIR1/AFBs生长素受体,这是Skp1-Cullin1-F-box蛋白泛素连接酶复合体的组成部分。该复合物通过Aux/IAA(生长素/吲哚-3-乙酸)介导的异二聚作用释放ARFs调节生长素信号[60,61].miR393目前被认为是生长素信号的重要调控因子[62它会影响包括种子发育在内的各种发育过程。7)、大麦根系发育及根系生长对有毒铝的响应[34].qRT-PCR检测种子萌发和幼苗早期生长过程中生长素相关基因的表达,表明miR393影响3种推测的表达东盟地区论坛miR393错表达系的基因和两个早期生长素反应基因。7 d).这与之前的数据是一致的拟南芥和大麦(34,62],支持了miR393对生长素稳态有重要影响的观点。我们的数据还显示四个aba相关基因(ABA8'OH-1而且NCED1 2而且3.)和三个与ga相关的基因(GA20ox2 GA20ox4,而且GA2ox4)在miR393错表达系中差异表达(图。7 e, f),比较它们的wildtype控件。我们认为mir393介导的调控对ABA和GA稳态的影响可能是复杂的,取决于相关基因家族的不同亚型和它们表达的特定组织组分。另一种可能是生长素反应的变化可能影响发芽过程中GA/ABA的平衡,而不仅仅是GA或ABA信号。进一步研究确定连接不同激素通路的关键因素将有助于我们更好地理解激素相声的分子机制。
结论
本研究对大麦胚miRNA表达谱和miRNA靶对进行了详细分析,为mir393介导的生长素反应调控及其在种子发育和萌发过程中与ABA和GA途径的相互作用提供了证据。
缩写
- 阿坝:
-
脱落酸
- 空军基地:
-
Auxin-signaling盒蛋白质
- 东盟地区论坛:
-
生长素反应因素
- 辅助/ IAA:
-
生长素/ indole-3-acetic酸
- 等:
-
乙烯
- 遗传算法:
-
赤霉酸
- KEGG:
-
京都基因与基因组百科分析
- 微:
-
microrna的
- 存在:
-
定量反转录PCR
- 种族:
-
cDNA末端的快速扩增
- 自洽场:
-
Skp1-Cullin-F-box
- sRNA:
-
小核糖核酸
- TIR1:
-
转运抑制反应蛋白
参考文献
Sreenivasulu N, Usadel B, Winter A, Radchuk V, Scholz U, Stein N, Weschke W, Strickert M, Close TJ, Stitt M,等。大麦籽粒成熟和发芽:新的MapMan/PageMan分析工具突出了代谢途径和调控网络的共性和差异。植物杂志。2008;146(4):1738 - 58。
中林林,王晓燕,王晓燕,王晓燕。拟南芥种子萌发过程中贮藏mRNA的基因组分析:转录的表观遗传学和遗传调控。植物j . 2005; 41(5): 697 - 709。
Silva AT, Ribone PA, Chan RL, Ligterink W, Hilhorst HW。预测共表达网络识别了控制拟南芥种子到幼苗相变的新基因。植物杂志。2016;170(4):2218 - 31所示。
罗志刚,王文华,王文华,等。拟南芥和玉米种子发育激素调控的研究进展:以生长素为中心。植物科学进展2014;5:412。
古铁雷斯L, Van Wuytswinkel O, Castelain M, Bellini C.调控种子成熟的复合网络。植物科学进展;2007;12(7):294-300。
Graeber K, Nakabayashi K, Miatton E, leuber - metzger G, Soppe WJ。种子休眠的分子机制。植物细胞环境学报,2012;35(10):1769-86。
种子休眠与萌发。拟南芥的书。2008;6:e0119。
舒凯,刘晓东,谢强,何振华。同一种子的两面:休眠和萌发的激素调节。摩尔。2016;9(1):34-45。
引用本文刘旭,张宏,赵颖,冯铮,李强,杨海萍,栾思,李娟,何振华。生长素在拟南芥中通过诱导arf介导的ABI3激活脱落酸信号通路来控制种子休眠。中国生物医学工程学报,2013;38(5):369 - 369。
Das SS, Karmakar P, Nandi AK, Sanan-Mishra N.小RNA介导的种子萌发调控。植物科学进展2015;6:828。
王晓明。植物激素信号通路中相互作用的mirna。中国生物医学工程学报(英文版);2014;
Jones-Rhoades MW, Bartel DP, Bartel B. MicroRNAS及其在植物中的调控作用。植物生物学杂志2006;57:19-53。
刘王濛F,刘H, K, L,王,赵Y,阴J,李Y发展microrna在小麦谷物(小麦L .)。BMC Plant Biol 2013;13:140。
吕鑫,陈东,舒东,张铮,王伟,Klukas C,陈丽丽,范勇,陈明,张晨。玉米种子早期发育过程中胚与胚乳之间的差异转录网络。植物杂志。2013;162(1):440 - 55。
彭T,太阳H,乔米,赵Y, Du Y,张J,李J,唐G,赵问:差异表达microRNA军团在开发可能导致贫穷的粮食种子填充劣质的小穗的大米。植物生物学杂志2014;14:196。
李东,刘铮,高磊,王磊,高敏,焦铮,乔浩,杨洁,陈敏,姚磊,等。玉米籽粒发育过程中microRNAs的全基因组鉴定与特征分析。科学通报,2016;11(4):e0153168。
黄辉,龙杰,郑磊,李勇,胡勇,于刚,刘辉,刘勇,黄铮,张杰,等。利用小RNA测序技术鉴定玉米胚乳对外源蔗糖响应的microRNAs。基因组学。2016;108(5 - 6):216 - 23所示。
韩锐,简超,吕军,闫艳,迟青,李铮,王强,张杰,刘旭,赵辉。小麦旗叶和发育种子中microrna的鉴定与鉴定。BMC基因组学。2014;15:289。
兰勇,苏宁,沈勇,张锐,吴芳,程铮,王杰,张旭,郭旭,雷晨,等。籼稻籽粒发育过程中新型MiRNA的鉴定及表达谱分析。BMC基因组学。2012;13:264。
李志明,李志明,李志明。miRNA在大麦种子早期发育中的调控作用。植物生物学杂志,2012;12:120。
诺丁MD,巴特尔DP。在植物胚胎发生过程中,MicroRNAs可阻止早熟基因的表达并使模式形成。基因Dev。2010;24(23):2678 - 92。
Schauer SE, Jacobsen SE, Meinke DW, Ray A. DICER-LIKE1:拟南芥发育中的盲人和大象。植物学报,2002;7(11):487-91。
唐旭,边思,唐明,吕强,李松,刘旭,田刚,阮伟,曾ew,王安,等。拟南芥营养发育过程中microrna介导的种子成熟程序的抑制。公共科学图书馆麝猫。2012;8 (11):e1003091。
Allen RS, Li J, Stahle MI, Dubroue A, Gubler F, Millar AA。遗传分析揭示了拟南芥miR159家族的功能冗余和主要靶基因。中国科学(d辑:自然科学版)2007;29(5):561 - 561。
刘p - p, Montgomery TA, Fahlgren N, Kasschau KD, Nonogaki H, Carrington JC。microRNA160抑制生长素响应因子10对种子萌发和萌发后阶段至关重要。植物j . 2007; 133 - 46(1): 52。
李文华,李文华,李文华。大麦中microRNAs和其他小rna在水分和干旱条件下的差异表达。植物学报。2015;13(1):2-13。
弗道斯J,桑切斯-费列罗JC,朗里奇P,米尔恩L,乔杜里J,布赖恩C,诡计PJ。干旱胁迫下大麦microRNAs的差异表达及其潜在靶标。植物细胞环境学报2017;40(1):11-24。
史碧娟,黄春春,Langridge P, Baumann U.通过短reads深度测序发现大麦miRNAs。BMC基因组学。2011;12:129。
邓鹏,王玲,崔玲,冯凯,刘峰,杜鑫,童伟,聂霞,季伟,魏宁申。盐胁迫下大麦MicroRNAs及其靶标的全局鉴定。《公共科学图书馆•综合》。2015;10 (9):e0137990。
吕松,聂旭,王磊,杜旭,Biradar SS,贾旭,魏宁申。高通量测序技术鉴定大麦(Hordeum vulgare L.) microRNAs。中华分子生物学杂志2012;13(3):2973-84。
邵晨,陈敏,陈晓燕。植物中microrna -靶对鉴定的逆向框架。短暂的Bioinform。2013;14(3):293 - 301。
边红,谢颖,郭峰,韩楠,马松,曾智,王杰,杨勇,朱明。miRNA393/TIR1同源模块在水稻旗叶倾斜、主根和冠根生长调控中的表达特征及其作用。新植醇。2012;196(1):149 - 61。
白斌,边红,曾铮,侯楠,石斌,王娟,朱敏,韩宁。mir393介导的生长素信号调控参与了大麦对有毒铝胁迫的根系伸长抑制。植物细胞物理学报2017;58(3):426-39。
刘静,程旭,刘东,徐伟,怀哲,沈qh。miR9863家族调节大麦中不同的Mla等位基因,减弱NLR受体引发的抗病性和细胞死亡信号。公共科学图书馆麝猫。2014;10 (12):e1004755。
Galli V, Guzman F, de Oliveira LF, lost - morais G, Korbes AP, Silva SD, Margis- pinheiro MM, Margis R.麻风树种子中microRNAs和转录靶点的鉴定。《公共科学图书馆•综合》。2014;9 (2):e83727。
库珀鲁斯JT,法尔格伦N,卡灵顿JC。MIRNA基因的进化与功能多样化。植物细胞。2011;23(2):431 - 42。
Wang JW, Czech B, Weigel D. mir156调控的SPL转录因子定义了拟南芥内源开花途径。细胞。2009;138(4):738 - 49。
王JW。mir156介导的年龄通路对开花时间的调控。中国生物医学工程学报(英文版);2014;
吴刚,Park MY, Conway SR, Wang JW, Weigel D, Poethig RS. miR156和miR172的顺序作用调控拟南芥发育时间。细胞。2009;138(4):750 - 9。
焦勇,王勇,薛东,王杰,闫明,刘刚,董刚,曾德,陆铮,朱旭,等。OsmiR156对OsSPL14的调控决定了水稻的理想植株结构。Nat麝猫。2010;42(6):541 - 4。
王亮,孙松,金娟,付东,杨旭,翁旭,徐超,李旭,肖军,张强。水稻营养分枝与生殖分枝的协调调控。中国生物医学工程学报,2015;29(5):369 - 369。
Chuck G, Cigan AM, Saeteurn K, Hake S.玉米异慢性突变体Corngrass1是由串联microRNA过表达引起的。Nat麝猫。2007;(4):544 - 9。
王松,李松,刘强,吴凯,张杰,王松,王勇,陈晓,张勇,高超,等。OsSPL16-GW7调控模块决定籽粒形状,同时提高水稻产量和品质。Nat麝猫。2015;47(8):949 - 54。
王松,吴凯,袁强,刘旭,刘铮,林旭,曾锐,朱辉,董刚,钱强,等。OsSPL16对水稻籽粒大小、形状和品质的控制。Nat麝猫。2012;44(8):950 - 4。
Carlsbecker A, Lee JY, Roberts CJ, Dettmer J, Lehesranta S, Zhou J, Lindgren O, Moreno-Risueno MA, Vaten A, Thitamadee S,等。细胞信号通过microRNA165/6指导基因剂量依赖的根细胞命运。大自然。2010;465(7296):316 - 21所示。
朱辉,胡峰,王锐,周旭,司曙华,刘丽伟,Barefoot A, Dickman M,张旭。拟南芥Argonaute10特异性隔离miR166/165调控茎尖分生组织发育。细胞。2011;145(2):242 - 56。
沈qh, Saijo Y, Mauch S, Biskup C, Bieri S, Keller B, Seki H, Ulker B, Somssich IE, Schulze-Lefert p MLA免疫受体的核活性与孤立特异性和基础抗病反应相关。科学。2007;315(5815):1098 - 103。
张磊,郑勇,贾格德斯瓦兰,李勇,高杜,桑卡尔。高粱中保守和新型microrna的鉴定及表达分析。基因组学。2011;98(6):460 - 8。
Pelaez P, Trejo MS, Iniguez LP, Estrada-Navarrete G, Covarrubias AA, Reyes JL, Sanchez F.高通量测序鉴定菜豆小分子rna及其特性。BMC基因组学。2012;13:83。
Jacobsen JV, Pearce DW, Poole AT, Pharis RP, Mander LN。脱落酸、相酸和赤霉素含量与大麦休眠和萌发有关。杂志。2002;115(3):428 - 41。
Millar AA, Jacobsen JV, Ross JJ, Helliwell CA, Poole AT, Scofield G, Reid JB, Gubler F.拟南芥和大麦种子休眠与ABA代谢:ABA 8’-羟化酶的作用植物j . 2006; 45(6): 942 - 54。
布雷JD。种子萌发和休眠。植物细胞。1997;9(7):1055 - 66。
李伟,崔旭,孟Z,黄旭,谢强,吴红,金红,张东,梁伟。拟南芥MIR168a和argonaute1在脱落酸和非生物胁迫应答中的转录调控。植物杂志。2012;158(3):1279 - 92。
Ozhuner E, Eldem V, Ipek A, Okay S, Sakcali S, Zhang B, Boke H, Unver t。大麦中硼胁迫响应的microrna及其靶标。《公共科学图书馆•综合》。2013;8 (3):e59543。
倪达,王立军,丁春,徐志华。拟南芥胚胎发生和种子萌发过程中生长素的分布和转运。细胞研究》2001;11(4):273 - 8。
拟南芥生长素反应因子17的microrna定向调控对其正常发育和调控早期生长素反应基因的表达至关重要。植物细胞。2005;17(5):1360 - 75。
黄军,李智,赵东。水稻OsmiR160靶基因OsARF18的失联导致生长发育缺陷和生长素信号通路的改变。Sci众议员2016;6:29938。
茹萍,徐玲,马红,黄辉。microRNA167基因表达增强诱导的植物育性缺陷。细胞研究》2006;16(5):457 - 65。
脱落酸通过增强生长素信号通路抑制拟南芥胚轴萌发后的生长。植物细胞学报2009;21(8):2253-68。
Dharmasiri N, Dharmasiri S, Weijers D, Lechner E, Yamada M, Hobbie L, Ehrismann JS, Jurgens G, Estelle M.植物生长发育受生长素受体F盒蛋白家族的调控。Dev细胞。2005;9(1):109 - 19所示。
拟南芥F-box蛋白TIR1是一种生长素受体。大自然。2005;435(7041):446 - 51。
Iglesias MJ, Terrile MC, Windels D, Lombardo MC, Bartoli CG, Vazquez F, Estelle M, Casalongue CA. MiR393拟南芥在适应盐度过程中生长素信号和氧化还原相关成分的调控。《公共科学图书馆•综合》。2014;9 (9):e107678。
确认
我们衷心感谢阿德莱德大学澳大利亚植物功能基因组学中心提供野生型大麦(大麦芽L. ' Golden Promise ')用于小RNA测序,张国平博士(浙江大学农学系)提供根癌土壤杆菌用于大麦转化的菌株AGL1。
资金
国家自然科学基金项目(No. 31171543和No. 31,571,645)和中国农业科学研究系统项目(CARS-05)的资助。
数据和材料的可用性
所有与本研究相关的数据都已在稿件中以表格和/或图表形式包含,作者很高兴在合理的要求下分享分析/原始数据和植物材料。小RNA测序数据集已存入NCBI数据库(accession SRX2881684, SRX2881685, SRX2881686)。
作者信息
从属关系
贡献
BB和BS制备小RNA测序样品,进行northern blot、5 ' RLM-RACE和qRT-PCR检测。NHou和YC准备了额外的材料,为保护分析做出了贡献。YM和BB在生物信息学分析方面做出了贡献。NHan设计并协调了这部作品,并与BB一起撰写了手稿。HB和MZ参与了作品的设计和讨论,并协助起草了手稿。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
附加文件
附加文件1:表S1。
总结数据清理和标签长度分布。表S4:高表达的miRNAs及其靶基因与植物激素信号通路相关。表S5。本研究使用的引物和探针。(PDF 195 kb)
附加文件2:表S2。
大麦胚中发现的已知和新的miRNAs。(XLSX 196 kb)
附加文件3:表S3。
已知miRNAs的预测靶点。(XLSX 678 kb)
附加文件4:图S1。
预测miRNA靶基因在胚胎中表达的功能分布。(PDF 151 kb)
权利和权限
开放获取本文根据创作共用署名4.0国际许可协议发布(http://creativecommons.org/licenses/by/4.0/),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于这篇文章
引用这篇文章
白,乙,史,乙,侯,N。et al。在大麦种子发育和萌发过程中,microRNAs参与基因表达调控和植物激素对谈。BMC植物杂志17日,150(2017)。https://doi.org/10.1186/s12870-017-1095-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-017-1095-2
关键字
- 大麦(大麦芽)
- 微
- 种子发展
- 发芽
- 胚胎
- 生长素响应
- 脱落酸
- 赤霉酸