- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发表:GydF4y2Ba
大染色体植物中染色体凝聚的可视化GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba17.GydF4y2Ba文章编号:GydF4y2Ba153GydF4y2Ba(GydF4y2Ba2017GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
大多数关于染色体组织的数据来自对少数模式生物的研究,其中大多数是哺乳动物。在基因组较大的植物中,染色体明显大于迄今研究的动物染色体,这类植物的染色体浓缩可能是在进化过程中被修改的。在这里,我们分析了染色体的凝聚和解凝聚过程,以便找到允许染色体大小增加的结构机制。GydF4y2Ba
结果GydF4y2Ba
我们发现,具有大染色体(平均每条染色体2C DNA含量超过0.8 pg)的植物的后期和末期染色体在其轴向区域含有无染色质空洞,而具有良好特征的动物染色体在轴向区域具有较高的染色质密度。与动物染色体相似,染色质折叠的两个中间部分在染色体的收缩(前期)和收缩(末期)中可见GydF4y2BaNigella Damascena.GydF4y2Ba:大约150nm色度肿瘤和大约300nm的纤维。后一种纤维的空间折叠以与动物染色体的基本不同的方式发生,这导致形成具有轴向染色质空腔的染色体。GydF4y2Ba
结论GydF4y2Ba
不同的压实拓扑结构,而不是压实水平的数量,允许增加染色体大小的植物进化。GydF4y2Ba
背景GydF4y2Ba
大多数关于内部染色体组织的数据来源于少数模式生物的研究,这些模式生物多为基因组相对较小的哺乳动物(人、鼠、仓鼠等)。某些植物和动物的基因组大小GydF4y2Ba有尾类GydF4y2Ba)比哺乳动物大得多[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba].已知的植物中最大的基因组是GydF4y2Ba巴黎粳稻GydF4y2Ba(1C = 152.23 pg) [GydF4y2Ba3.GydF4y2Ba].它是人类单倍体基因组的50倍(1C = 3.50 pg)。一般来说,单倍体染色体组的长度与基因组大小相关[GydF4y2Ba4.GydF4y2Ba].染色体长度受细胞几何形状的限制[GydF4y2Ba5.GydF4y2Ba,因此,增加染色体宽度是增加染色体大小所必需的。允许染色体宽度增加的结构机制尚不清楚。GydF4y2Ba
在染色质中,DNA缠绕在核体周围,形成“串珠式串”10nm染色质纤维[GydF4y2Ba6.GydF4y2Ba]核小体和连接组蛋白之间的相互作用导致形成直径为30 nm的染色质纤维。芬奇和克鲁格[GydF4y2Ba7.GydF4y2Ba证明了在H1连接组蛋白存在的情况下核小体纤维缠绕,这导致染色质组织被称为“螺线管”。也提供了有利于“之字形”核小体包装的数据[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba].但最近的数据表明,核小体的流动性和相邻核小体之间的相互作用导致染色质熔化[GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba11.GydF4y2Ba,其中10nm的纤维不规则折叠,而不形成30nm的染色质纤维[GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba11.GydF4y2Ba那GydF4y2Ba12.GydF4y2Ba那GydF4y2Ba13.GydF4y2Ba那GydF4y2Ba14.GydF4y2Ba那GydF4y2Ba15.GydF4y2Ba].GydF4y2Ba
染色体折叠额外原纤维中间体的预壳和脱裂期间染色体分析,染色体折叠的另外的原纤维中间体:100-130nm色调纤维和200-250nm纤维[GydF4y2Ba16.GydF4y2Ba].染色质在固定在原位的前期和末期细胞的部分解聚染色体中可见[GydF4y2Ba17.GydF4y2Ba那GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba19.GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba那GydF4y2Ba21.GydF4y2Ba那GydF4y2Ba22.GydF4y2Ba].最近,厚度(约70nm)的纤维,似乎与色度肿瘤相对应的纤维GydF4y2Ba果蝇GydF4y2Ba光活化定位显微镜(PALM)的染色体[GydF4y2Ba23.GydF4y2Ba].GydF4y2Ba
在完全浓缩的动物中期染色体中也观察到约200–250 nm的折叠亚单位[GydF4y2Ba24.GydF4y2Ba].对有丝分裂前期染色体凝聚的分析表明,早期前期的染色单体直径为200-250 nm,后期前期的染色单体被折叠形成中期染色单体[GydF4y2Ba25.GydF4y2Ba].因此,在动物染色体的情况下,似乎200-250nm纤维对应于早期预先染色体。200-250nm光纤的空间拓扑研究得很差,但有些数据表明没有任何常规可重复的螺旋折叠[GydF4y2Ba26.GydF4y2Ba].GydF4y2Ba
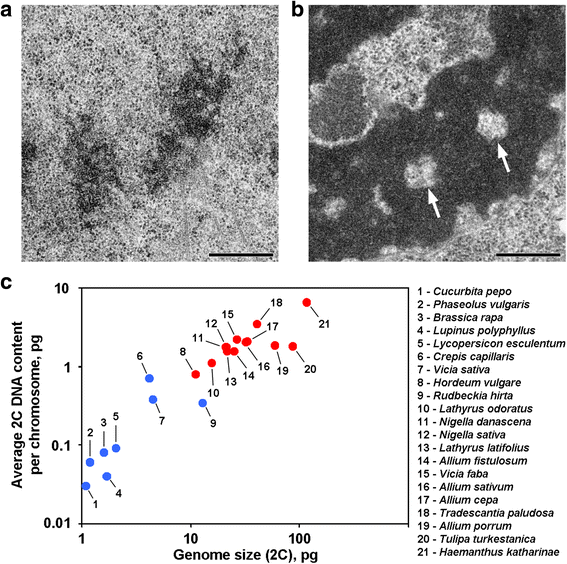
描述动物染色体的染色体凝聚过程只是进化过程中发展的变种之一[GydF4y2Ba27.GydF4y2Ba那GydF4y2Ba28.GydF4y2Ba].根据已发表的数据,一些植物的有丝分裂染色体具有特定的形态特征,这与模型动物和人类的染色体进行了深入研究。特别是,一些植物的后期和末期染色单体的轴向区域的无染色质空腔已经用电子显微镜进行了描述[GydF4y2Ba17.GydF4y2Ba那GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba21.GydF4y2Ba那GydF4y2Ba29.GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba].轴向区域中的腔在活细胞的Telophase染色体中已经看到GydF4y2BaHaemanthus katharinaeGydF4y2Ba相衬不足[GydF4y2Ba31GydF4y2Ba].据我们所知,这些空洞从未在动物染色体上被描述过。相比之下,在体外[GydF4y2Ba19.GydF4y2Ba那GydF4y2Ba32GydF4y2Ba那GydF4y2Ba33GydF4y2Ba那GydF4y2Ba34GydF4y2Ba或在体内[GydF4y2Ba35GydF4y2Ba动物中期染色体解凝聚,最致密的染色质与轴向区域相连。据推测,这些空洞可能是植物染色体内存在额外水平染色质凝聚或染色质纤维拓扑结构不同的迹象。GydF4y2Ba
在本研究中,我们分析了具有大基因组的植物的染色体凝聚。我们发现,大染色体(平均每条染色体2C DNA含量超过0.8 pg)与小基因组植物的染色体组织不同。我们观察了染色体凝聚的中间产物GydF4y2BaNigella Damascena.GydF4y2Ba,具有大基因组(2c = 21.10pg)的植物,使用染色体分段标记和电子显微镜形态学的组合。我们的数据表明,特定的冷凝拓扑,但不允许的凝结水平数量GydF4y2BaN. Damascena.GydF4y2Ba进化成具有更大染色体的生物体GydF4y2Ba
结果GydF4y2Ba
轴向无染色质腔出现在平均2C DNA含量超过0.8 pg/条染色体的植物中GydF4y2Ba
某些植物的神木子和茶酶染色体在轴向区域中含有无染色片空腔,其区分这些植物从大多数其他植物和迄今为止研究的动物(图。GydF4y2Ba1 a, bGydF4y2Ba).据我们所知,描述这种染色体组织的报道仅限于具有大基因组的植物,可以假定这种形态组织是这些植物的一种特殊特征。为了确定这一建议,我们还使用电子显微镜分析了12个物种的后期和末期染色单体(见表)GydF4y2Ba1GydF4y2Ba;无花果。GydF4y2Ba1 a, bGydF4y2Ba;额外的文件GydF4y2Ba1GydF4y2Ba:图S1)。数字GydF4y2Ba1CGydF4y2Ba研究表明,轴向无染色质空洞只有在大基因组和大染色体的植物的染色体内部才能清楚地看到,但似乎平均染色体大小与这些空洞的存在或不存在更好地相关。在具有轴向空腔的植物中,GydF4y2Ba大麦芽GydF4y2Ba具有最小的基因组和每种染色体的最小平均2C DNA含量(0.79pg)。因此,该染色体组织是植物染色体的标志,其2C DNA含量可以大致估计为每条染色体的0.8 pg。GydF4y2Ba
染色体凝结/裂缝可以在半薄部分中可视化GydF4y2BaN. Damascena.GydF4y2Ba4'后的细胞,6-二脒基-2-苯基吲哚(DAPI)染色GydF4y2Ba
根尖分生组织是研究植物染色体最方便的对象,但由于荧光失焦,无法获得高分辨率图像。在这里,我们使用了一种基于半薄(200-250 nm)根切片嵌入LR White介质的方法。即使使用共聚焦显微镜,这些切片的厚度也明显低于光学切片。为了找到能让我们识别不同有丝分裂阶段的细胞的形态学特征,我们分析了DAPI染色的细胞形态。GydF4y2Ba
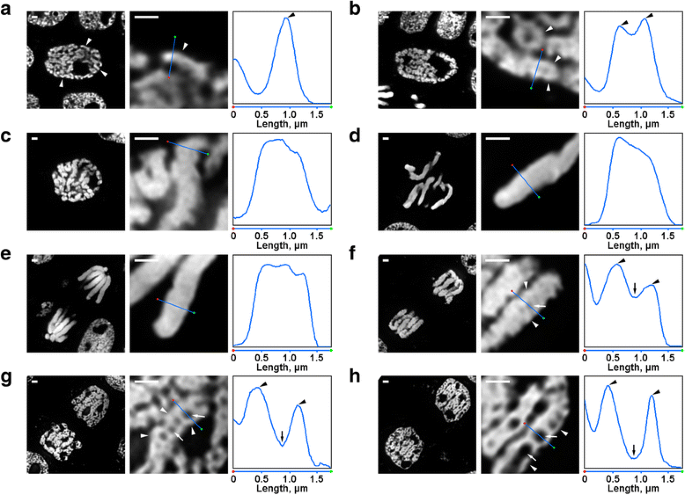
有几个变换GydF4y2BaN. Damascena.GydF4y2Ba即使在荧光显微镜下,染色体组织也很容易可见。在早期预先核中,可见部分薄染色体(直径约0.6μm)(图。GydF4y2Ba2GydF4y2Ba).在中期前期,形成较厚的前期染色体(约1.2 μm),在其内部可以看到较薄的纤维,这可能与折叠的早期前期染色体相对应(图1)。GydF4y2Ba2 bGydF4y2Ba).前期后期(无花果。GydF4y2Ba2摄氏度GydF4y2Ba)、中期(无花果。GydF4y2Ba二维GydF4y2Ba)和后(图。GydF4y2Ba2 eGydF4y2Ba)染色体密集凝聚,未检测到内部组织。在末期解聚期间,直径约为0.4μm的染色质纤维分离导致染色单体轴向区域出现无染色质空腔(图。GydF4y2Ba2 fGydF4y2Ba),其大小在末期逐渐增大(图。GydF4y2Ba2g和h.GydF4y2Ba).末期染色体的染色质纤维的直径与早期前期染色体的大小相当。因此,所有的有丝分裂阶段GydF4y2BaN. Damascena.GydF4y2Ba在DAPI染色的半薄切片上易于检测。GydF4y2Ba
小鼠有丝分裂染色体的形态GydF4y2BaN. Damascena.GydF4y2Ba.左边和中间的图是DAPI染色半薄切片的荧光显微镜图像(全景和碎片);右面板表示密度图通过线在中央面板。GydF4y2Ba一种GydF4y2Ba早期前期(染色体用箭头表示)。GydF4y2BaB.GydF4y2Ba中期前期(形成染色体的纤维,似乎与早期前期染色体相对应,用箭头表示)。GydF4y2BaCGydF4y2Ba已故的预言。GydF4y2BaD.GydF4y2Ba中期。GydF4y2BaE.GydF4y2Ba后期。GydF4y2BaFGydF4y2Ba早期末期(箭头表示轴向无染色质空洞,箭头表示形成末期染色体的纤维)。GydF4y2BaGgydF4y2Ba晚期末期。GydF4y2BaHgydF4y2BaGGydF4y2Ba1GydF4y2Ba步。秤条:1μmGydF4y2Ba
在5-乙炔基-2'-脱氧尿苷(EDU)掺入后分析的染色体凝结/裂缝分析GydF4y2Ba
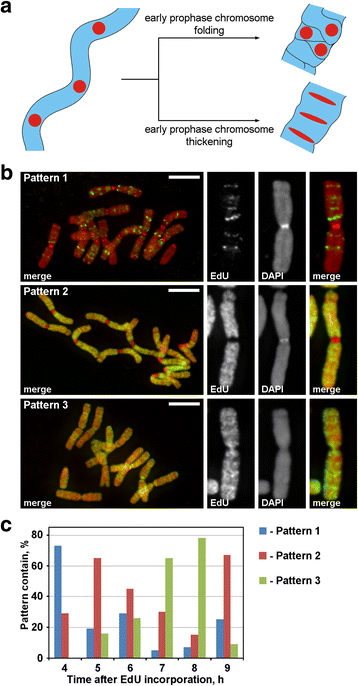
在预壳期间,将薄的早期预先染色体转化为厚的后期预先预染色体。预先染色体的增厚可能是早期预先染色体折叠的结果或其逐渐增厚的结果。为了研究这两种可能的机制,这是必要的,以纪念该直线地安排早前期染色体内的染色体分离病灶,然后前期冷凝时分析它们的空间重排。如图1中的图所示。GydF4y2Ba3GydF4y2Ba,在从早期到后期预先开始的过渡期间,这种焦点将丢失线性排列(折叠)或者将保持线性布置并将焦点拉伸成薄带(增厚)。为了标记染色体区域,我们掺入了合成核苷酸,EDU可以通过点击化学检测到复制期间染色质。GydF4y2Ba
将EdU注入根中30分钟GydF4y2BaN. Damascena.GydF4y2Ba,经过不同的追踪时间(从2 ~ 14 h),染色体展开。检测到三种染色体标记模式:标记离散区域(模式1),标记染色体臂而不标记着丝粒(模式2),同时标记染色体臂和着丝粒(模式3)(图3)。GydF4y2Ba3 bGydF4y2Ba).模式1在加入EdU后4小时更常见,这表明这种标记是s期晚期的典型特征(图。GydF4y2Ba3 cGydF4y2Ba;额外的文件GydF4y2Ba2GydF4y2Ba:图S2)。在模式1的情况下,同源染色体的标记相似(附加文件GydF4y2Ba3.GydF4y2Ba:图S3),表示一个特定的EdU合并模式。染色体臂在剩余的s期被标记(模式2和3),但着丝粒区域也在早期和晚期s期的边界被标记(模式3)(图3)。GydF4y2Ba3 cGydF4y2Ba).GydF4y2Ba
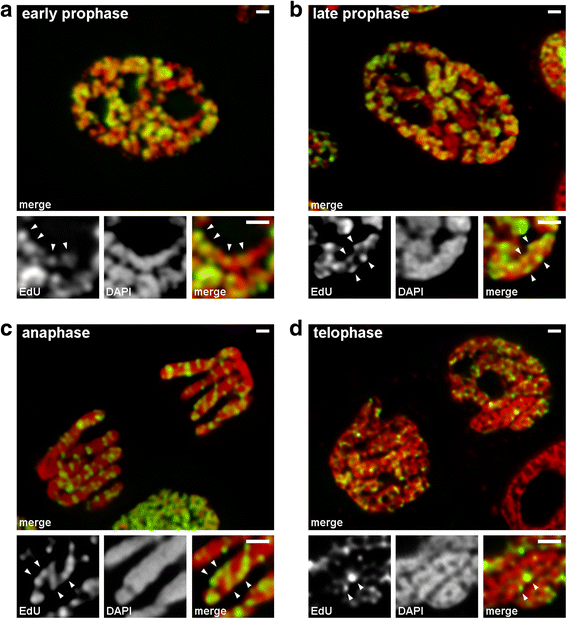
我们使用标记了晚期复制染色质的染色体分析了从早期到晚期前期的转变(模式3)。在早期前期染色体中,标记区域沿薄染色体线性分布(图3)。GydF4y2Ba4GydF4y2Ba).在晚期预先染色体中,与早期预先存在的染色体大致两倍,标记区域丧失了分布的线性度(图。GydF4y2Ba4 bGydF4y2Ba).这种观察并不完全有效,因为前期和中期染色体由两条染色单体组成,它们逐渐分离[GydF4y2Ba36GydF4y2Ba那GydF4y2Ba37GydF4y2Ba],这可能导致标记区域分布的线性的损失。因此,我们进一步分析了染色体偏析后的后染色体(即,完全压实的染色体)。在具有直径大致等于后期预先染色体的直径的后染色体中,标记的染色质区域未线性地布置,但在整个染色体的体积中分布(图。GydF4y2Ba4摄氏度GydF4y2Ba).在末期,染色单体的轴向区域清晰可见无染色质空洞,可以检测到染色质纤维,标记区域在纤维内部呈线性排列(图)。GydF4y2Ba4 dGydF4y2Ba).因此,在早前期向晚前期的转变过程中,早前期染色体发生折叠。这一结果与dapi染色的中期前期染色体的观察结果一致(图。GydF4y2Ba2 bGydF4y2Ba),折叠薄纤维的内部清晰可见。GydF4y2Ba
电子显微镜分析期间染色体凝结/裂缝GydF4y2Ba
为了检测染色质纤维的内部组织,我们使用电子显微镜对染色质纤维的折叠进行了描述。为了检测和测量染色质纤维亚结构,我们分析了无染色质空腔,这些空腔按照我们的假设分离了染色质纤维(附加文件GydF4y2Ba4.GydF4y2Ba:图S4;表格GydF4y2Ba2GydF4y2Ba).GydF4y2Ba
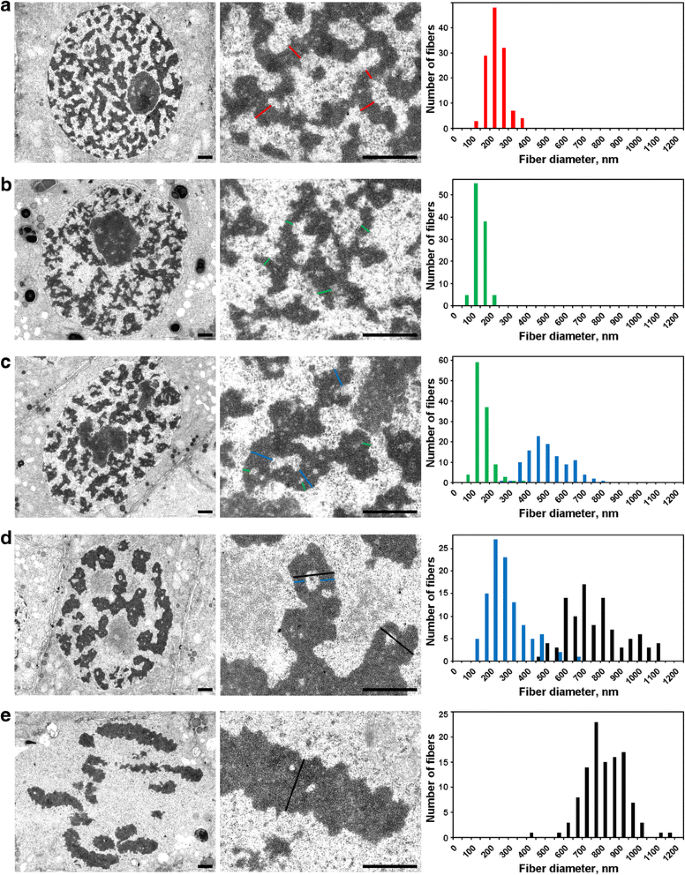
间期细胞核充满234±49 nm(平均值±S.D.)厚的网状纤维(图。GydF4y2Ba5aGydF4y2Ba),它可以被称为“相互关联的色度救护局”,如其他地方所讨论的[GydF4y2Ba16.GydF4y2Ba].电子显微镜允许检测三个阶段的预磷酸染色体缩合,最早是可以使用光学显微镜检测的最早,并且将在此称为“前蛋白酶”。如上所述,第二和第三阶段对应于早期和晚期预先存在(图。GydF4y2Ba2A和C.GydF4y2Ba分别)。GydF4y2Ba
电子显微镜形态计量学GydF4y2BaN. Damascena.GydF4y2Ba染色体:染色体凝结从间差到中期。左和中心板显示超微结构组织(一般视图和碎片),右图显示描绘染色体和染色质纤维宽度分布的直方图。GydF4y2Ba一种GydF4y2Ba间期。GydF4y2BaB.GydF4y2BaPreprophase。GydF4y2BaCGydF4y2Ba早期的前期。GydF4y2BaD.GydF4y2Ba已故的预言。GydF4y2BaE.GydF4y2Ba中期。染色体和/或染色质原纤维的典型横截面用彩色线条表示:红 - 相互形式的色素肿瘤(异铬胺),绿色 - 色素emata;蓝色—“300 nm光纤”;黑色 - 染色体。秤条:1μmGydF4y2Ba
(1)在前期,染色体之间的分离很差,我们不能准确地测量它们的直径(图。GydF4y2Ba5bGydF4y2Ba).前期染色体由直径为148±30 nm的纤维构成(见表)GydF4y2Ba2GydF4y2Ba),最有可能对应于直径为100–130 nm的纤维(染色丝体),这是动物细胞前期和末期染色体的主要染色体亚结构[GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba19.GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba那GydF4y2Ba25.GydF4y2Ba那GydF4y2Ba38GydF4y2Ba].这些数据并不能让我们确定间期和有丝分裂染色单体的身份,但以前的报道数据表明,间期染色单体是由折叠的染色单体形成的复合物[GydF4y2Ba22.GydF4y2Ba].GydF4y2Ba
(2)前期,染色体发生分离(图2)。GydF4y2Ba5cGydF4y2Ba).染色体直径为527±107 nm,染色体由直径为158±46 nm的染色单体组成。GydF4y2Ba
(3)最后,我们分析了晚期前期细胞,其中染色体增厚,直径为809±185nm。GydF4y2Ba5dGydF4y2Ba).一些晚期前期染色体在轴向区域中含有空腔,使我们能够区分直径为285±102 nm的纤维(“300 nm纤维”)。使用标记的染色体片段进行分析表明,早期前期染色体折叠形成较厚的晚期前期染色体(图。GydF4y2Ba4.GydF4y2Ba).因此,可以假设285±102 nm的纤维和527±107 nm的早期染色体是同一根纤维。纤维直径的减小可能与早期前期染色体的染色质压实有关,可见染色单体的消失也表明了这一点。GydF4y2Ba
中期染色体内的染色质(图。GydF4y2Ba5eGydF4y2Ba)和后染色体(图。GydF4y2Ba6aGydF4y2Ba)是高度致密的,尽管在它们内部可以看到罕见的无染色质空洞,但要准确区分任何纤维亚结构是不可能的。在早期末期染色体中,可以清楚地检测到两种类型的空洞(图。GydF4y2Ba6bGydF4y2Ba).染色单体的轴向区域有较大的空洞,使我们能够识别和测量直径为422±78 nm的纤维。在这些纤维的中心区域,我们检测到小空洞,允许识别直径为182±47 nm的第二种纤维。前一种纤维可能与前期晚期染色体内的300 nm纤维相对应,第二种纤维可能与染色单体相对应。GydF4y2Ba
电子显微镜形态计量学GydF4y2BaN. Damascena.GydF4y2Ba染色体:从后期到G期的染色体解聚GydF4y2Ba1GydF4y2Ba步。左侧和中央显示超微结构(全图和片段),右侧显示染色单体和染色质纤维宽度分布直方图。GydF4y2Ba一种GydF4y2Ba后期。GydF4y2BaB.GydF4y2Ba早期的末期。GydF4y2BaCGydF4y2Ba晚期末期。GydF4y2BaD.GydF4y2BaGGydF4y2Ba1GydF4y2Ba步。染色线显示了染色体和/或染色质原纤维的典型横截面:红相间染色线,绿相间染色线;蓝色—“300 nm光纤”;黑色——染色单体。秤条:1μmGydF4y2Ba
末期(图。GydF4y2Ba6cGydF4y2Ba)和GGydF4y2Ba1GydF4y2Ba-phase(图。GydF4y2Ba6dGydF4y2Ba),将染色体稀释到亚核的染色体结构域中,在那里不能容易地观察它们。然而,可以鉴定分离的染色体片段。在该阶段,通过直径为约250nm的纤维形成染色片,其大致对应于相互色谱的直径。这种观察结果除了色素纤维的消失外,表明,在该有丝分裂的阶段,染色质纤维被重新折叠以形成浓缩染色质的差异复合物。GydF4y2Ba
讨论GydF4y2Ba
染色体对于电子显微镜来说太大,对于常规光学显微镜来说太小。在这里,我们使用光学显微镜和电子显微镜相结合的方法来研究具有大基因组的植物的染色体。为了提高光学显微镜的信噪比,我们使用了半薄(200–250 nm)的染色体分析方法在丙烯酸包埋培养基中包埋根的切片。以前也开发过类似的方法[GydF4y2Ba39GydF4y2Ba那GydF4y2Ba40GydF4y2Ba].GydF4y2Ba
几种植物的期间和茶酶染色体在其轴向区域中具有无染色质空腔[GydF4y2Ba17.GydF4y2Ba那GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba21.GydF4y2Ba那GydF4y2Ba29.GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba那GydF4y2Ba31GydF4y2Ba]相反,动物染色体轴向区域的染色质密度增加。扫描显微镜观察到植物中期染色体上有小的空腔[GydF4y2Ba41GydF4y2Ba那GydF4y2Ba42GydF4y2Ba]这些空洞的存在和大小取决于制备程序[GydF4y2Ba42GydF4y2Ba].近年来,有丝分裂的染色体有很大一部分不是由染色质组成的,外周区占整个染色体体积的30%-70% [GydF4y2Ba43GydF4y2Ba].使用培养的人细胞完成这些估计,可以假设植物染色体中的无染色族隔室可能不仅可能具有外围定位。GydF4y2Ba
在这里,我们使用传统的醛固定,在中期染色体中也可以看到小的dna耗尽空洞。这些空洞大小小,分布不规则,因此准确区分中期染色体内的任何纤维亚结构是不可能的。前期和末期染色单体内的空腔较大,光镜和电镜均能较好地观察到。特别重要的是,轴向区域的空腔已在活细胞的末期染色单体中看到GydF4y2BaHaemanthus katharinaeGydF4y2Ba相衬不足[GydF4y2Ba31GydF4y2Ba表明这些空洞不是固定的假象。GydF4y2Ba
我们分析了发表的数据和研究了12种植物物种的染色体,发现这种具有轴向腔的修饰组织特异于具有大染色体的物种(0.8pg /染色体的平均2c DNA含量是染色体改变染色体凝结原理的阈值).似乎这个改进的组织允许植物演化染色体宽度增加的能力,以及染色体尺寸。应该强调的是,在进化的远处物种中检测到这种具有轴向染色质空腔的这种染色体组织,包括单焦点和双点,表明该组织可能在不同的群体中独立地发展。GydF4y2Ba
我们分离了两个较高水平的染色质凝聚,染色单体和纤维,在前期晚期(即最大凝聚状态)有285±102 nm的宽度,可以被称为“300 nm纤维”。后者纤维在早期与染色体相对应。显然,这些缩合水平对应于100-130 nm的纤维(染色剂)和200-250 nm的纤维在动物中描述。GydF4y2Ba
染色丝体纤维的宽度在GydF4y2BaN. Damascena.GydF4y2Ba染色体(约150 nm)比动物染色体中所描述的要多[GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba19.GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba那GydF4y2Ba25.GydF4y2Ba那GydF4y2Ba38GydF4y2Ba使我们推测纤维宽度的增加是导致染色体增大的机制之一。然而,在GydF4y2BaAllium Cepa.GydF4y2Ba前期染色体、纤维平均直径分别为106 nm和122 nm [GydF4y2Ba22.GydF4y2Ba,表明这可能不是植物染色体的普遍特征。GydF4y2Ba
纤维折叠的下一个层次对应于早期前期染色体,类似于在哺乳动物染色体中描述的[GydF4y2Ba24.GydF4y2Ba那GydF4y2Ba25.GydF4y2Ba].这些纤维的直径大于哺乳动物染色体的直径,且在前期明显从527±107 nm缩聚到285±102 nm。这种缩合也导致了在缩合的300 nm纤维中检测色质的可能性。GydF4y2Ba
结论GydF4y2Ba
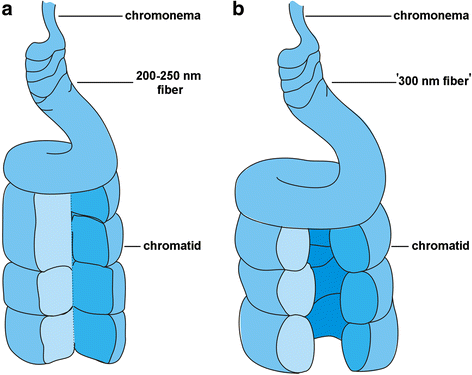
我们的结果表明,“300 nm光纤”的折叠拓扑在GydF4y2BaN. Damascena.GydF4y2Ba与哺乳动物的基本不同(图。GydF4y2Ba7.GydF4y2Ba).虽然我们不能确切地定义有丝分裂染色体的染色质纤维的拓扑结构,但“300 nm纤维”的外围位置在末期染色体中可以清楚地看到。因此,增大的尺寸和直径GydF4y2BaN. Damascena.GydF4y2Ba通过染色质纤维的拓扑变化优先实现染色体,而不是缩合水平的数量的变化。GydF4y2Ba
方法GydF4y2Ba
光学显微镜GydF4y2Ba
N. Damascena.GydF4y2Ba种子购自Gavrish公司(cat。不。002364)(俄罗斯)。种子在25°С的黑暗环境下,在盖有倾倾倒滤纸的培养皿中生长,并使用10mm长的根进行研究。标记染色质时,种子在含有50 μM EdU (Invitrogen)的蒸馏水中孵育30 min。追踪实验时,种子在含有EdU (EdU)的蒸馏水中孵育30 min,然后在蒸馏水中培养1.5-13.5 h(附加文件)GydF4y2Ba2GydF4y2Ba:图S2)。将1.0 mm长的根尖从根中切除,用2%多聚甲醛和0.5倍PBS固定1.5小时。固定后,根据制造商的方案,用PBS冲洗根尖,并将根尖嵌入LR White (Sigma, USA)中。使用Ultratome LKB-III(瑞典)制作半薄切片,并使用Perfect Loop (Ted Pella, Inc., USA)安装在formvar涂层覆盖玻璃上。37°С干燥2-3小时。GydF4y2Ba
为了获得染色体扩散,将edu标记的根固定在3:1的冷乙醇-醋酸溶液中。将1.0 mm长的根尖剪断,在浓度分别为96%、70%、50%、30%和10%的乙醇溶液中再水化5分钟。在蒸馏水中洗涤后,将根尖用由0.10%果胶酶、0.15%纤维素和0.10%细胞解旋酶(Sigma)组成的酶溶液在10 mM柠檬酸缓冲液和0.1 mM EDTA中处理65分钟,37°С。用45%的醋酸溶液将根尖压在盖片下;在液氮中冷冻后,用剃刀将盖片取下。GydF4y2Ba
使用Click-iT EdU Alexa 555 Imaging Kit (Invitrogen)检测EdU。DNA用DAPI染色,用抗漂白剂DABCO (Sigma)固定在Mowiol (Calbiochem)中。使用配备平面消色差100/1.4物镜(卡尔蔡司)和冷却CCD相机ORCAII-ERG2 (Hamamatsu)的Axiovert 200 M显微镜采集图像。在AxioVision 3.1软件(Carl Zeiss)中,根据约束迭代算法进行反褶积。GydF4y2Ba
电子显微镜GydF4y2Ba
在0.1Msörensen的磷酸盐缓冲液中固定在4%戊二醛中,固定在1%OSO中GydF4y2Ba4.GydF4y2Ba,乙醇和环氧丙烷脱水,嵌入Epon 812 (Fluka)。超薄切片用醋酸铀酰和柠檬酸铅染色,用JEM-1400电子显微镜(Jeol)观察。形态学和图像分析使用ImageJ2软件(分析每个有丝分裂阶段的9-18个细胞)。在最后的演示中,使用Photoshop软件(Adobe)对图像的亮度和对比度进行了校正。GydF4y2Ba
缩写GydF4y2Ba
- DAPI:GydF4y2Ba
-
4, 6-diamidino-2-phenylindoleGydF4y2Ba
- EdU:GydF4y2Ba
-
5-ethynyl-2的脱氧尿苷GydF4y2Ba
- N. Damascena.GydF4y2Ba:GydF4y2Ba
-
Nigella Damascena.GydF4y2BalGydF4y2Ba
- 掌:GydF4y2Ba
-
光活化的定位显微镜GydF4y2Ba
参考文献GydF4y2Ba
- 1。GydF4y2Ba
Bennett MD, Leitch IJ。植物DNA c值数据库,2012。(发布6.0,2012年12月)。GydF4y2Bahttp://data.kew.org/cvaluesGydF4y2Ba.GydF4y2Ba
- 2。GydF4y2Ba
gregory tr。动物基因组大小数据库。2017年。GydF4y2Bahttp://www.genomesize.comGydF4y2Ba.GydF4y2Ba
- 3.GydF4y2Ba
Pellicer J,Fay MF,Leitch IJ.其中最大的真核生物基因组?Bot J Linn Soc.2010;164:10-5。GydF4y2Ba
- 4.GydF4y2Ba
Bennett MD, Leitch IJ。植物基因组大小的进化。出自:格雷戈里·TR,编辑。基因组的进化。圣地亚哥:爱思唯尔;2005.p . 89 - 162。GydF4y2Ba
- 5.GydF4y2Ba
舒伯特I,伍德。一个有机体的正常发育有一个染色体大小的上限。细胞。1997;88:515-20。GydF4y2Ba
- 6.GydF4y2Ba
olins al,olins de。Spheroid Chromatin单位(GydF4y2BaνGydF4y2Ba身体)。科学。1974;183:330-2。GydF4y2Ba
- 7.GydF4y2Ba
陈志强,王志强。染色体上层结构的电磁模型。美国国立科学学院1976;73:1897-901。GydF4y2Ba
- 8.GydF4y2Ba
《染色质的高阶结构:螺旋带状排列的证据》,细胞生物学杂志,1984;99:42–52。GydF4y2Ba
- 9GydF4y2Ba
基于核小体相互作用的异型染色质纤维研究。美国国家科学研究院2009;106:13317-22。GydF4y2Ba
- 10。GydF4y2Ba
Eltsov M, Maclellan KM, Maeshima K, Frangakis AS, Dubochet J.低温电子显微镜图像分析不支持30 nm染色质纤维存在于有丝分裂染色体GydF4y2Ba原位GydF4y2Ba.美国国立科学学院学报2008;105:19732-7。GydF4y2Ba
- 11.GydF4y2Ba
Maeshima K,Hihara S,Eltsov M.染色质结构:是否存在30纳米纤维GydF4y2Ba体内GydF4y2Ba?《细胞生物学杂志》2010;22:291-7。GydF4y2Ba
- 12.GydF4y2Ba
玻璃化染色体的低温电子显微镜研究GydF4y2Ba原位GydF4y2Ba.EMBO j . 1986; 5:1395 - 402。GydF4y2Ba
- 13。GydF4y2Ba
Nishino Y,Eltsov M,Joti Y,Ito K,Takata H,Takahashi Y等。人体丝分裂染色体主要由不规则折叠的核小纤维组成,没有30nm染色质结构。2012年禁止J. 2012; 31:1644-53。GydF4y2Ba
- 14.GydF4y2Ba
Fusner E,Strauss M,Djuria U,Li R,Ahmed K,Hart M,等。小鼠基因组中的开放和封闭结构域被配置为10 nm染色质纤维。EMBO Rep.2012;13:992–6。GydF4y2Ba
- 15.GydF4y2Ba
王志强,王志强,王志强,等。核小体阵列自组装成缺乏30nm纤维的超分子球状结构。EMBO j . 2016; 35:1115-32。GydF4y2Ba
- 16.GydF4y2Ba
苏州斯托瓦岛,谢泼尔ev。染色质纤维:从经典描述到现代解释。细胞BIOL INT。2016; 40:1140-51。GydF4y2Ba
- 17GydF4y2Ba
Sparvoli E, Gay H, Kaufmann BP。染色体中染色单体的数量和组合模式GydF4y2Ba紫鸭跖草GydF4y2Ba.Chromosoma。1965;16:415-35。GydF4y2Ba
- 18GydF4y2Ba
陈索夫YS, Polyakov VY。细胞核的超微结构莫斯科:Nauka;1974.1 - 175页。(俄罗斯)GydF4y2Ba
- 19GydF4y2Ba
Zatsepina OV OV, Polyakov VY, Chentsov YS。染色线,染色粒。有丝分裂和间期染色体的结构单位。Chromosoma。1983;88:91-7。GydF4y2Ba
- 20.GydF4y2Ba
Belmont As,Braunfeld MB,Sedat JW,agard da。大规模染色质结构域内有丝分裂和间染色体GydF4y2Ba体内GydF4y2Ba和GydF4y2Ba在体外GydF4y2Ba.Chromosoma。1989;98:129-43。GydF4y2Ba
- 21.GydF4y2Ba
郝胜,焦敏,黄斌。染色体组织结构的研究进展GydF4y2Ba葱属植物GydF4y2Ba.Chromosoma。1990;99:371-8。GydF4y2Ba
- 22。GydF4y2Ba
黄斌,焦敏,赵军,邢明,黄波GydF4y2BaAllium Cepa.GydF4y2Ba.Chromosoma。1994;103:432-40。GydF4y2Ba
- 23。GydF4y2Ba
张志强,张志强,张志强,等。用PALM和EGFP-组蛋白在纳米分辨率下浓缩有丝分裂染色体结构。《公共科学图书馆•综合》。2010;5:e12768。GydF4y2Ba
- 24。GydF4y2Ba
Strukov YG,Wang Y,Belmont AS.序列组成发生改变的工程化染色体区域显示了中期染色体内的分层大规模折叠。细胞生物学杂志。2003;162:23–35。GydF4y2Ba
- 25。GydF4y2Ba
Kireeva N,Lakonishok M,Kireev I,Hirano T,Belmont AS.早期染色体凝聚的可视化:染色体结构的分层折叠轴向胶模型.细胞生物学杂志.2004;166:775-85。GydF4y2Ba
- 26.GydF4y2Ba
斯特鲁科夫,贝尔蒙特公司。有丝分裂的染色体结构:姐妹染色单体之间折叠和对称的再现性。Biophys j . 2009; 96:1617-28。GydF4y2Ba
- 27.GydF4y2Ba
麦卡丹当,奥柏雷,斯柏克特,坎波斯,盛福,凯瑞,等。真核生物中染色质压实的组蛋白2A进化。eLife。2014年,7:3。GydF4y2Ba
- 28.GydF4y2Ba
Iwamoto M, Hiraoka Y, Haraguchi T.独特设计的低等真核生物核结构。《细胞生物学杂志》2016;40:66-73。GydF4y2Ba
- 29GydF4y2Ba
拉方丹,洛杉矶周纳德。有丝分裂期间核仁物质的相关光镜和电子显微镜研究GydF4y2Ba蚕豆根尖GydF4y2Ba.《细胞生物学杂志》1963;17:167-201。GydF4y2Ba
- 30.GydF4y2Ba
郝胜,邢敏,焦明。高等植物后期染色体无染色质区隔及其含量。Cell Biol Int rep 1988; 12:627-35。GydF4y2Ba
- 31.GydF4y2Ba
巴杰尔A.活态染色体的亚染色体结构.染色体组.1965;17:291-302。GydF4y2Ba
- 32.GydF4y2Ba
Marsden MP,Laemmli UK。中期染色体结构:径向环路模型的证据。细胞。1979年; 17:849-58。GydF4y2Ba
- 33.GydF4y2Ba
Maeshima K,伊尔托夫M,Laemmli UK。染色体结构:改善电子显微镜的免疫标记。染色体瘤。2005; 114:365-75。GydF4y2Ba
- 34。GydF4y2Ba
Sheval EV,Polyakov Vy。染色体支架的可视化和提取的有丝分裂细胞中环域压实的中间体。细胞BIOL INT。2006; 30:1028-40。GydF4y2Ba
- 35。GydF4y2Ba
Zatsepina OV OV, Polyakov VY, Chentsov YS。活细胞低渗处理过程中有丝分裂染色体的差异解凝聚可能是g带的一个原因:一项超微结构研究。Chromosoma。1989;98:109-16。GydF4y2Ba
- 36。GydF4y2Ba
梁志强,齐克乐,张福生,等。染色体通过整体压实/扩张周期以多个离散步骤发展到中期。细胞。2015;161:1124-37。GydF4y2Ba
- 37。GydF4y2Ba
姊妹染色单体分辨是早期染色体组织的内在组成部分。Nat Cell Biol. 2016; 18:692-9。GydF4y2Ba
- 38.GydF4y2Ba
张志强,张志强,张志强,等。G1染色体的可视化:间期染色单体结构的折叠、扭曲、超卷曲染色单体模型。细胞生物学杂志1994;127:287-302。GydF4y2Ba
- 39.GydF4y2Ba
Maeshima K, Laemmli UK。有丝分裂染色体组装的两步支架模型。Dev细胞。2003;4:467 - 80。GydF4y2Ba
- 40.GydF4y2Ba
Micheva KD,史密斯SJ。阵列断层扫描:用于成像的新工具,用于成像神经电路的分子结构和超微结构。神经元。2007; 55:25-36。GydF4y2Ba
- 41.GydF4y2Ba
聚焦离子束(FIB)结合高分辨率扫描电子显微镜:一种有前景的染色体结构三维分析工具。J Struct Biol. 2009; 165:97-106。GydF4y2Ba
- 42.GydF4y2Ba
梁志强,王志强,王志强,等。利用离子液体聚焦离子束/扫描电子显微镜(FIB/SEM)观察染色体内部。Microsc Microanal。2014;20:1340-7。GydF4y2Ba
- 43.GydF4y2Ba
Booth DG, Beckett AJ, Molina O, Samejima I, Masumoto H, Kouprina N, et al. 3D-CLEM揭示了大部分有核分裂的染色体不是染色质。摩尔细胞。2016;64:790 - 802。GydF4y2Ba
致谢GydF4y2Ba
感谢Khrustaleva教授提供染色体制备方案,感谢Lasarev教授提供电子显微镜的帮助。我们感谢s.a Golyshev博士绘制了Fig中的模型。GydF4y2Ba7.GydF4y2Ba.GydF4y2Ba
资金GydF4y2Ba
该工作得到俄罗斯科学基金会(授予14-15-00199)的支持。该资助者在研究设计,数据收集和分析中没有作用,决定发布或准备手稿。GydF4y2Ba
数据和材料的可用性GydF4y2Ba
支持本文结论的数据集包含在本文及其附加文件中。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
MAS进行了大部分实验,IAC为电子显微镜准备样品,EVS设计和监督研究并撰写手稿。所有作者阅读并批准了最终的手稿。GydF4y2Ba
相应的作者GydF4y2Ba
伦理宣言GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
本研究不包含任何需要伦理同意或批准的研究。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
作者声明他们没有相互竞争的利益。GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
附加文件GydF4y2Ba
附加文件1:图S1。GydF4y2Ba
不同基因组大小植物的染色体组织。一种GydF4y2BaCucurbita浆果GydF4y2Ba;B.GydF4y2BaBrassica Rapa.GydF4y2Ba;CGydF4y2BaLupinus polyphyllusGydF4y2Ba;D.GydF4y2BaLycopersicon esculentumGydF4y2Ba;E.GydF4y2Ba野豌豆属漂白亚麻纤维卷GydF4y2Ba;FGydF4y2Ba大麦芽GydF4y2Ba;GgydF4y2Ba黄雏菊属hirtaGydF4y2Ba;HgydF4y2BaLathyrus odoratusGydF4y2Ba,我GydF4y2BaLathyrus Latifolius.GydF4y2Ba;jGydF4y2Ba韭葱GydF4y2Ba.轴向无染色质空洞用箭头表示。对每一种植物的后期和末期细胞进行了分析,并给出了最具代表性的细胞图像。比例尺:0.5 μm。(PDF 3315 kb)GydF4y2Ba
附加文件2:图S2。GydF4y2Ba
异步生长细胞GydF4y2BaN. Damascena.GydF4y2Ba根部用EdU脉冲标记30分钟,在200 μM胸腺嘧啶中孵育30分钟,然后在蒸馏水中继续孵育(即在没有EdU的情况下)。短脉冲标记所有s期细胞,初始出现edu标记的有丝分裂象,表示s期晚期细胞穿越到有丝分裂所需的时间。模式1在加入EdU后4小时更常见,表明这种标记是s期晚期的典型特征。(PDF 147 kb)GydF4y2Ba
附加文件3:图S3。GydF4y2Ba
中EdU标记区域的分布GydF4y2BaN. Damascena.GydF4y2Ba中期染色体(模式1)。(pd37kb)GydF4y2Ba
附加文件4:图S4。GydF4y2Ba
染色体和染色质纤维宽度的估计(末期染色单体的纵向切片)。典型的末期染色单体和/或染色质原纤维的横切面用彩色线表示(黑色的染色单体,蓝色的' 300 nm纤维',绿色的染色单体)。比例尺:2 μm。(PDF 2057 kb)GydF4y2Ba
权利和权限GydF4y2Ba
开放访问GydF4y2Ba本文遵循知识共享署名4.0国际许可协议(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条提供的数据,除非另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
张志强,张志强,张志强,等。大染色体植物染色体凝聚的可视化研究。GydF4y2BaBMC植物杂志GydF4y2Ba17,GydF4y2Ba153(2017)。https://doi.org/10.1186/s12870-017-1102-7GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-017-1102-7GydF4y2Ba
关键字GydF4y2Ba
- 有丝分裂GydF4y2Ba
- 染色体GydF4y2Ba
- 缩合GydF4y2Ba
- 色线GydF4y2Ba
- 植物GydF4y2Ba
- 进化GydF4y2Ba