摘要
背景
成熟时,“被盖”的大麦籽粒的外壳牢固地附着在下面的颖果上。果核上的角质层是果皮粘附所必需的,但产生胶结层的品种间粘附质量差异很大,导致了经济上重要的麦芽缺陷——籽粒剥皮。胶结层的组成和籽粒器官的发育被假设影响稻壳粘附的质量。植物的大麦芽“协奏曲”在花期前后的不同温度下生长,以影响果皮、颖果和角质层的发育变化,以确定这些变量如何影响果皮与颖果的粘附质量。
结果
花期前的温热条件降低了籽粒的粘附质量,从而增加了籽粒脱皮的发生率。冷却的花后条件进一步降低了果皮的粘附质量。胶结层的组成,而不是它的结构,不同的外壳粘附质量。这种胶结层是在乳汁后期产生的,发生在花期后的9到29天之间,这取决于温度依赖的生长速度。十八醇、三三醇、菜籽醇、β-谷甾醇等化合物在具有优质果皮粘附性的颖果中含量最高。粘附质量的差异不是由于壳和颖果尺寸不相容影响器官接触。
结论
本研究表明,果皮与颖果的粘附依赖于胶结层的组成,并表明这种组成在籽粒发育前和发育过程中受温度的调节。了解这一规律将是改善壳与颖果粘附的关键。
背景
成熟的大麦籽粒包括颖果(果实),在籽粒发育时粘附在颖果上,并在收获时和收获后的处理中保持粘附。如果谷壳部分或全部脱落,谷粒就“剥皮”了。谷物脱皮,又称“脱皮”,是酿造大麦的一种品质缺陷。在酿造过程中,谷物经历了一个受控萌发的过程,在此过程中,酶通过水解细胞壁和蛋白质基质来“修饰”淀粉胚乳,使淀粉在酿造和蒸馏过程中可被酵母发酵。优质的外壳粘附作用是保护胚胎在收获和麦芽商、啤酒酿造商和蒸馏器的加工过程中免受机械损伤。作为一个有活力的胚胎是麦芽生产过程中必不可少的,高水平的谷物剥皮导致麦芽生产效率低下。此外,如果一粒谷物已经剥皮,但保留了一个存活的胚胎,这样的谷物会更快地吸收水分,与完整的谷物相比可能会过度修饰,从而导致麦芽流失[1,2,3.].果皮粘附质量受环境因素和遗传因素的双重影响,果皮剥落的质量缺陷近年来日益严重,较新的品种更容易受其影响[4].确保当地种植者供应高质量的谷物对全球麦芽大麦供应链的长期可持续性至关重要,减少了长途运输散装谷物以弥补质量不足的需求。通过提高稻壳粘附性的质量来降低谷物剥皮的风险,将有利于大麦种植者、大麦育种者和麦芽加工供应链中的加工者。
大麦颖果由胚、淀粉性胚乳和外糊粉层胚乳组成,胚乳由珠心层、种皮和果皮依次包围。外皮由两个颖片组成,即谷粒背面的外稃和谷粒腹侧的内稃[5,6].有假说认为,大麦大麦的物理损伤,包括颗粒剥皮,可能会因颗粒长度和宽度的变化,以及颗粒大小和外壳组织的机械强度之间的不相容而加剧[7,8].颖果和外壳之间的物理接触可能会随着颗粒或颖片大小的变化而变化。尽管与果皮-颖果粘附过程直接相关的籽粒发育差异数据有限,但研究开花期前后的温差对果皮和颖果发育的影响有助于了解温度如何用于控制这些器官的差异生长,从而控制颖果和颖片之间的接触。例如,在低温条件下,通过增加淀粉积累获得更高的粒重[9]可能增加颗粒尺寸,导致颖果和果皮之间更好的接触,因此粘附。相反,由高温应力引起的重量减少的颗粒[10,11]可能会减少果皮与颖果的接触,导致粘附质量较差。同样,果皮器官的大小也决定了果皮和颖果之间的接触能力。事实上,颗粒大小已被假定为由外壳尺寸的物理限制所决定[12,13],可能是由于花前温度对小花生长的影响[14].
果皮通过一层胶结层附着在下面的颖果上,这层胶结层被认为是由脂质组成的[15,16,17,18].大麦籽粒含有三个内部脂质层。最薄的在珠心层和种皮之间,而最厚的在种皮和果皮之间。这些组织和脂质层是一个整体。第三层脂质层,即胶结层,在果皮角质层形成后发育。胶结层厚度为100 ~ 600纳米[15],覆盖果皮角质层,并在籽粒发育后期粘附于内壳表面。据报道,这种粘稠的胶结物质在开花后10天产生[15,17].然而,这种物质是否总是在花期后10天产生,而与籽粒发育速度无关,或者是否是发育阶段决定了胶结层的产生,目前尚不确定。在胶结层的形成过程中,果皮细胞壁和角质层之间存在一个不规则的网状界面,这表明是果皮的表皮细胞而不是外壳产生胶结物质[8,15].无壳大麦不会产生胶结层,在收获时自然脱壳。裸大麦在无偿(nud)位点在7H染色体上,该位点与WIN1 / SHN1转录因子基因拟南芥被认为调节脂类生物合成途径[18].虽然无壳大麦不产生胶凝层,但它会在果皮表面产生角质层[15不能用苏丹红染料染色,而“有盖”大麦的颖果则用苏丹黑染料染色[18].这表明,胶结物质可能与果皮角质层的溶剂可提取表面脂质层相似,或部分相似。
胶结层的位置,包括或介于外壳和颖果的表面角质层之间,表明它很可能在性质和组成上与其他植物角质层相似。植物表面角质层是由表皮细胞合成的,它们的总体结构可以描述为有两个结构域,尽管它通常被认为是细胞壁本身的脂质嵌入的延续[19,20.].内层含有丰富的聚合物角质层,在物理上与细胞壁相关,通常被称为“角质层”[21].外层结构域富含可溶于有机溶剂的蜡类化合物,被称为“角质层”。蜡质结构域有两层,一层是嵌在角质层基质中的蜡质,另一层是外表皮层的蜡质,覆盖在表皮表面并可能形成晶体结构。角质层和角质层蜡的合成已经得到了很好的评述[22,23,24,25,26].角质层是羟基和羟基环氧C的聚酯16和C18脂肪酸。角质层蜡由复杂的混合物组成,包括醇、烷烃、烯烃、醛、酮、三萜、酯和脂肪酸。植物角质层蜡的生物合成是通过脂肪酸合酶复合体从丙二酰辅酶a前体从头合成脂肪酰链实现的。然后脂肪酸被脂肪酸延长酶延长。主要蜡类化合物的进一步延伸和修饰可通过两种途径中的一种进行:脱碳途径或酰基还原途径。大麦叶表面蜡的主要成分为伯醇,其中1-己醇(C26酒精)占叶中可提取角质层蜡的75%以上[27,28].
虽然同一植物各器官间,甚至品种间,植物角质层的组成不同[29,30.,组成不同器官角质层的复合类通常是相同的。在果实发育成熟过程中,果皮角质层的成分发生了显著变化[31,32,33,34].与其他植物器官的角质层一样,果实角质层的组成也取决于温度、光照、湿度和病原菌侵袭等环境因素[35,36,37].角质层的特性,如蒸腾速率和渗透性,更受其组成的影响,而不是角质层的厚度或蜡的数量。事实上,一些角质层合成相关基因的突变改变了角质层的通透性,并显示出器官融合表型[38,39,40,41,42],它与外壳粘附的过程有相似之处,相邻的器官通过角质层相互粘附[18,43].
本研究利用果皮和籽粒发育过程中的不同温度,分别影响果皮和籽粒尺寸、表面角质层的结构和组成以及胶结层的变化。我们假设,果皮粘附的质量以及颗粒剥皮的严重程度会受到上述一种或所有因素的影响,通过测量这些因素,我们可以了解影响果皮与颖果粘附的关键颗粒和角质层发育阶段。
方法
植物生长及取样
二行春大麦(大麦芽简历。协奏曲)容易剥皮的[4]直接播种在列文顿2号堆肥中,在36个4升的花盆中,每盆种植7株,然后在温室中种植,直到第一片叶子通过鞘翅层(gs10)。研究中所提及的发育生长阶段(GS)是由Tottman和Broad所描述的十进制代码[44].将花盆移入Sanyo Fitotron (SGC097 CSX.F)生长箱中,设置昼夜温度为18°C/13°C、相对湿度为79%、200 μmol m−2年代−1光合有效辐射,并在10小时光周期下生长4周以减少分蘖[10,45].然后将柜体条件更改为“冷”或“暖”温度,分别设置为昼/夜13°C/7°C或28°C/22°C,相对湿度79%,光周期为16 h。花盆在柜内的位置每周都要重新安排,采用MacNicol等人的方法,每周将每个花盆向左移动一个位置,以减少位置影响。[10].采用目测小花法测定开花时间(gs65,花期过半)。每个柜子中有一半(18个)的花盆在开花期在暖柜和冷柜之间切换,根据开花期前后的温度,分别为以下4种处理提供9个花盆:凉,凉=“CC”;cool, warm = " CW ";温暖,温暖=“WW”,温暖,凉爽=“WC”。从孕穗期(GS 45)到收获成熟期(GS 92)进行了监测。开发的热时间(°C天)是用冷柜(16.3°C)和暖柜(26.0°C)的每小时平均温度乘以到达开发阶段的天数来计算的。在花期45、51、65和75、77、85、92四个处理分别收获主枝3穗。每个生长阶段的三个穗从不同的花盆中收获,以确保空间复制。三个中央小花或从每一个穗的一侧的颗粒被处理为电子显微镜。 The five central florets or grains from the opposing side of the ear were used to measure dimensions and fresh weights of the organs (palea, lemma and caryopsis) with a micrometer (accuracy ±0.05 mm) and Mettler Toledo XP6 microbalance (accuracy ±1 μg), and then processed for surface lipid analysis.
一个单独的实验做了检查颖果表面后,胶结层发展使用扫描电子显微镜。植物协奏曲,和无壳品种努丁卡,在花盆在温室如上所述。两个品种的籽粒在GS 77收获,当在有盖大麦中,颖果摸起来是粘的。这些颗粒然后固定和处理扫描电子显微镜描述如下。
剥皮量化
谷粒剥皮采用内部程序进行评估,以面积计算20%或更大的谷壳损失阈值用于区分带皮的谷粒和完整的谷粒(小于20%的谷壳损失)[4].成熟期采收主枝和分蘖剩余穗,测定穗长、小花数、粒数和每穗粒重。然后用Wintersteiger LD 180实验室脱粒机(Wintersteiger AG, Ried,奥地利)进一步脱粒5 s,并对谷粒进行剥皮评分。
透射电镜和扫描电镜
外壳材料的透射电镜观察方法为:从外稃中心切下长3 mm、宽1 mm、厚1 mm的维管束,从内稃延伸至1个维管束。从颖果背侧的中心切下相同大小的片段,注意确保所切除的片段包括所有的细胞层,直到淀粉胚乳,并避免胚胎上方不产生胶结层的区域。固定在4% (w/v)多聚甲醛及2%w/v)戊二醛在100mm 1,4-哌嗪二乙烷磺酸钠(pipe)缓冲液(pH 7.2)中室温下浸泡4小时,然后在4℃过夜(18小时)。用0.1 M cacodyate钠缓冲液(pH 7.3)洗涤固定组织3次,每次10 min。然后将组织在1%四氧化锇的辛酸钠中在室温下固定45分钟,然后用辛酸钠缓冲液洗涤三次,每次10分钟。洗涤后的组织用乙醇(50、70、90和3 × 100%)系列水溶液脱水,每一步脱水15分钟,然后用环氧丙烷脱水两次,每次10分钟。然后样品嵌入TAAB 812树脂(TAAB实验室,伯克,英国)。1 μm厚的切片,在徕卡超微切片组(Leica Microsystems, Milton Keynes, UK)上切割,用1%甲苯胺蓝水溶液在1%硼砂中染色,然后在光学显微镜上观察,以选择合适的研究区域。从选定区域切下60纳米厚的超薄切片,用1%乙酸铀酰和柠檬酸铅溶液染色,然后在飞利浦CM120 BioTwin透射电子显微镜(飞利浦电子光学,埃因霍温,荷兰)下观察。图片是用盖坦·奥里乌斯CCD相机拍摄的(英国,奥克森盖坦)。利用开源软件测量其内外角质层(内稃和外稃)、外角质层(颖果)和胶结层(全粒)的厚度46].对每个重复的5张显微照片分别取5次测量值的平均值,计算每个重复的3个重复耳的角质层的平均厚度。
在扫描电镜下,将组织从颖果背侧切成4 mm × 4 mm的段,按上述方法固定脱水。样品在极化子临界点干燥器(Quorum Technologies Ltd., Lewes, UK)中干燥,安装在铝存根上,并在Emscope SC500A溅射涂布器(Emscope, Kent, UK)中溅射20纳米金钯,然后用日立S-4700扫描电子显微镜(日立,日本)进行检查。
表面脂质分析
根据上述方法,从复制穗的5个中心粒的果核和外稃(聚集的谷壳和外稃)中制备表面脂质提取物。器官浸泡在二氯甲烷中。p.a.等级(GC≥99.9%,Sigma-Aldrich,英国)在室温下20 s,提取液在N2(英国氧气公司,99.995%)。萃取物在含有50 ppm BHT(2,6-二叔丁基-4-甲基苯酚)的异己烷(HPLC Plus, GC≥98.5%,Sigma-Aldrich, UK)中重新溶解,并如上所示蒸发干燥。在每个样品中加入壬烷酸甲酯(0.5 μg) (Sigma-Aldrich, UK)作为内标。添加25 μl后,提取物中含有游离羟基和羧基的化合物衍生为TMSi醚和酯N-O-双-三甲基硅基三氟乙酰胺(BSTFA, ThermoScientific, UK)和25 μl无水吡啶(Sigma-Adrich, UK)在50℃下搅拌90分钟,每30分钟搅拌一次。使用Trace DSQ™II系列四极杆系统(Thermo electronics Corporation, Hemel Hempstead, UK),配备CTC CombiPAL自动进样器(CTC Analytics,瑞士),用气相色谱-质谱(GC-MS)分析蜡的成分。样品(1 μl)注入可编程温度汽化(PTV)注入器,工作在无分裂模式下,安装有Merlin Microseal™高压隔膜和Siltek™钝化金属PTV衬垫(120 mm × 2mm内径× 2.75 mm外径,Thermo Scientific,英国)。PTV条件为注射温度132°C,注射时间1 min,转移速率14.5°C s−1,转移温度320°C 1分钟,清洁速度14.5°C s−1色谱柱为DB5-MS™(15 m × 0.25 mm × 0.25 μm;安捷伦科技,英国)使用氦1.5毫升每分钟−1(恒流)。气相温度分别为100℃2.1 min、25℃min−1至320°C,等温3.5 min。气相色谱-质谱界面温度为325°C。质谱采集条件为:电子冲击(EI)电离70 eV,溶剂延迟1.3 min,源温度230°C,质量范围35 ~ 900 a.m.,扫描6 s−1.采集速率设置为在每个色谱峰上提供大约10个数据点。数据采集和分析使用Xcalibur™2.0.7 (Thermo Electron Corporation, Hemel Hempstead, UK)。通过对果皮和颖果样品的几个原始数据文件的总离子色谱(TIC)分析,选择了包括内标(IS)在内的每种化合物的特定离子特征。离子选择的基础是它们应该具有尽可能高的相对丰度,并且应该是化合物独有的和/或与其他相同离子很好地分离米/z[47].这些离子被用于Xcalibur™中创建的处理方法中的化合物检测和定量。对每个化合物定义一个时间窗口,以色谱峰顶点为中心,并在时间窗口内生成所有选定离子的汇总选定离子色谱图(SIC)。使用两种组分的计算SIC面积计算各分析物相对于IS的响应比。检查处理后的数据是否正确分配峰值,并在必要时进行调整。通过质谱和保留时间对化合物进行鉴定,并与MS库(Palisade 600k, Palisade Corporation, USA;NIST05,美国国家标准协会),通过与已知化合物的保留和MS数据进行比较,并参考已发表的数据。共鉴定了121个化合物,用于化合物鉴定和定量的质量在附加文件中给出1S1:表。每种化合物的“丰度”是通过对该化合物所选离子的相对反应的总和除以该样本所提取器官的数量来计算的;每个化合物的丰度用于如下统计分析,丰度数据在附加文件中给出1S2:表。
对于样品中存在的每一类化合物,具体的离子基团选择如下:
脂肪酸:用两个特征离子基团对脂肪酸作为其TMS酯衍生物进行鉴定和定量。强离子基m / z117、129、132和145是所有脂肪酸所共有的,大多数酸被用于定量。突出分子离子[M]+和[M-15]+离子被用来确认个别酸的鉴定。然而,14-甲基十六烷酸与8-十七烯酸共洗脱,两者都有助于m / z117 129 132和145。的比率m / z117、129、132、145基团到[M]++ (M-15)+对早期的洗脱计算了10-甲基十六烷酸。假设14-甲基十六烷酸的比例相同,则[M]+和[M-15]+用该化合物的离子来估计其丰度m / z117 129 132和145,因此有大量的m / z117 129 132 145,由8-十七烯酸引起。Octacosanoic acid共洗脱与菜籽醇的TMS衍生物,两者共享m / z129.因此,只有离子m / z用117和132来测量辛酸的丰度,测量到的丰度乘以1.76的校正因子来解释缺少m / z129年和145年。根据无菜籽油醇八樱子酸的测定数据,推导出校正因子。
脂肪醇:特征同源特异性[M-15]+离子法测定长链醇的TMS醚衍生物的丰度。
蜡酯:使用两个特征离子,即分子离子来鉴定长链醇酯[M]+从中可以推断出整体碳数,并有明显的McLafferty重排离子[RCO]2H2]+产生于完整酯的酸部分,从中可以推断出单个酸的碳数:醇的组合[48].丰度测量是基于McLafferty离子。
烷烃和烯烃:最突出的烷烃和烯烃同源物的身份是由他们的分子离子确定的[M]+由此可以用插值法推导出次要同调的恒等式。丰度测量基于质量碎片离子的特征系列[CnH2 n + 1]+选项CnH2 n - 1]+对于所有同系物共有的烯烃。
酮,ß-二酮,烯醇和羟基-ß-二酮:这些化合物的质谱碎片模式显示在附加文件2质谱中所见离子用星号标记,用于定量的离子用下划线标记。nonacosan-14-one和hentriacontan- 14,16 -二酮的质谱主要由α或ß裂解羰基产生的离子组成,后者也涉及氢转移,典型的酮和ß-二酮[49,50].在MS ß-二酮中有一个显著的离子m / z从分子的ß到二酮基团的两侧的连续片断形成100。其他诊断碎片包括从分子离子或其他碎片丢失18。在附加文件2质谱中的诊断离子用星号标记,用于定量的离子用下划线标记。不同烯醇和(烯醇)的质谱碎片化方案2汉三康坦-14、16-二酮的互变异构体主要由α或ß裂解至羰基或OTMS基团产生的离子组成,与OTMS结合的片段更受青睐[51].这四种烯醇的质谱看起来非常相似,由于使用相同的离子基团进行鉴定和定量,因此无法根据它们的质谱来区分它们。三(烯醇)也是如此2互变异构体。与其试图将选定离子的选定离子色谱迹线分离为每个互变异构体的单独部分,不如将整个迹线整合起来,以提供所有互变异构体组合的丰度测量。最后,烯醇和(烯醇)的丰度测量2将组分与hentriacontan- 14,16 -dione的组分相结合,以提供ß-二酮的总体丰度测量。在8-和9-羟基三康坦- 14,16二酮质谱中,向OTMS基团裂解α产生了主要的诊断离子,尽管一些向羰基裂解产生的离子也很明显。
5-烷基间苯二酚:这两个同源的5-烷基间苯二酚系列的成员,以强烈的片段离子在m / z268为未取代的同源物和m / z在dditms衍生物的质谱中,甲基取代的同系物为282,这是由于5-烷基链的C1和C2之间的裂解引起的[52,53].从它们相对强烈的分子离子中可以鉴定出个别的同源物。甲基取代化合物中甲基的确切位置不能从质谱上区分,必须在芳环内或在烷基侧链的C1处。
萜烯:以游离角鲨烯、胆甾醇- 3,5 -二烯、甾醇、γ-生育酚等为TMS醚类化合物进行化合物鉴定和表征。对于大多数植物固醇,m / z129作为其中一个离子,但由于与八碳酸共洗脱,被排除为菜籽醇。
统计分析
研究人员使用开源软件R [54].通过将残差与拟合值作图,以及将拟合值与观测值作图,来检查下面描述的模型的拟合情况。通过拟合广义线性模型来分析治疗对皮肤严重程度的影响[55],以“处理”作为预测变量,对每穗的果皮和总谷粒进行二项计数。计算95%谱似然置信区间来确定处理之间的显著差异。通过方差分析(α = 0.05)确定4个处理对收获成熟时穗部测量的影响(α = 0.05),随后进行Tukey 's HSD检验(α = 0.05),发现其影响显著。在植物发育过程中,分别分析了处理和生长阶段对花前壳发育、籽粒发育和壳粘附三个发育阶段器官重量和尺寸的影响。对每个阶段建立一个广义线性混合效应模型,以测量值为响应变量,处理、生长期及其相互作用为固定效应,随机效应在锅内嵌套。通过方差分析,在层次模型的比较中去掉不显著变量(α = 0.05),并通过最小二乘均值比较确定样本间显著差异[56].采用线性混合效应模型分别测定处理和生长期对各器官(果皮和颖果)表面脂质提取物组成的影响。复合丰度为响应变量,处理、生育期及其交互作用为固定效应,盆栽数为随机效应。层次模型通过方差分析进行比较,每个模型依次去掉不显著项(α = 0.05),以找到每个化合物的最低限度模型。样本间化合物丰度的显著差异由最小二乘平均值对比确定(α = 0.05)。
结果
植物的生长
从孕穗期到成熟期,每隔几天记录主芽和分蘖的发育情况,并与开花期相关,在图中用一条水平虚线表示。1.在温暖条件下生长的植株从播种到开花平均需要84天(2184°C天),而在寒冷条件下生长的植株从播种到开花平均需要105天(1715°C天)。四种花期后处理的植株发育速度也不同,在低温花期后条件下生长的植株比在温暖花期后条件下生长的植株成熟所需的时间更长。从开花期到成熟,CC植株需要71天(1160°C天),WC植株需要87天(1421°C天),WW植株需要24天(624°C天),CW植株需要27天(702°C天)。在所有处理中,当颖果接近最大体积时,在GS 77处颖果变得粘着。其中,CC组花29天,GS组花77天(474°C d), WC组花24天(392°C d), WW组花19天(494°C d), CW组花9天(234°C d)。这些数据表明,开花前的生长条件对颖果后续的发育速度和灌浆期长度有影响。在颖果变得明显黏性之前,负责产生黏性胶结物质的代谢过程可能会开始发挥作用,因此图中GS 75和GS 77之间的时期用垂直虚线标出。1为了表明花期后的发育时期和范围,果皮粘附的关键期可能跨越。
温度对晶粒脱皮的影响
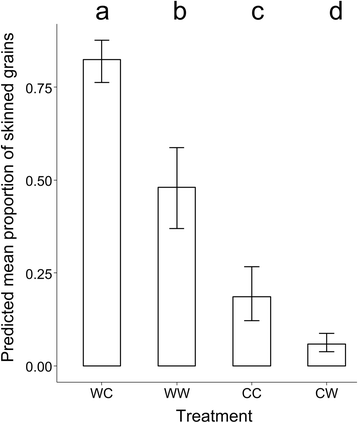
花前和花后温度对脱皮均有显著影响,各处理的穗粒脱皮率(P< 0.001)。图中显示了通过比较广义模型的置信区间确定的不同处理之间的蒙皮差异。2.在开花前温条件下生长的植株穗部带皮粒比例高于低温条件下生长的植株,WC植株的穗部带皮粒比例最高(> 0.75)。
粮食发展
在五个中心小花中,特别是颖果和两个果皮颖片(内稃和外稃)的颗粒组成的重量和尺寸的测量结果总结在表中1.为了比较测量之间的显著差异,数据被分为三个发育阶段:外壳发育、颗粒发育和粘着后。比较线性混合效应模型,以确定处理、生长期及其相互作用在这三个阶段的每项测量的显著性。最后,最低限度充分的模型是通过比较分层模型使用方差分析,每次删除一个变量(附加文件1:表S3)。最低限度充分的模型之间的差异的预测平均值和标准误差在附加文件中给出1:表S4。
在果皮发育期间(即花期前,GS 45、51和65),只有温(W)和冷(C)两种温度处理可以进行比较。P< 0.001),宽度(P= 0.021),重量(P= 0.013)。在gs41,古古生物比gs51或gs65更短,更宽。处理对内耳重量和尺寸没有影响。对于引理长度,GS是唯一显著变量(P= 0.017),但事后检验表明,样品之间没有显著差异。另一方面,外稃宽度仅受处理显著影响(P< 0.001), C植物的外稃比W植物宽。虽然处理和GS之间的相互作用对于外稃重量(P= 0.049),事后检验显示样品之间没有显著差异。
在籽粒发育期间(GS 75和77),处理显著影响了内稃长度(P= 0.011)宽度(P< 0.001),权重(P= 0.003), GS也是内窝宽度的显著影响因素(P= 0.022)。与其他3个处理相比,WW处理的内稃长度最高。在处理内,GS 75和77的回肠宽度差异不显著,但在两个生育期,WC植物的回肠宽度都大于CW植物。长水栽培植物的灌丛重大于长水栽培和长水栽培。处理确实对引理权重有显著影响(P< 0.001), CW外稃的重量显著低于WC、WW或CC条件下生长的外稃。GS与处理之间的互作在两个颖果长度(P< 0.001)和体重(P= 0.047),经处理后颖果宽度受影响(P< 0.001)和GS (P= 0.014)。WW颖果在GS 77处显著短、宽、重。在GS 75 ~ 77之间,WC、CC和CW处理的颖果宽度也显著增加。在GS 75 ~ 77之间,只有CC和WW植株的颖果重量显著增加。
在粘附后阶段,壳不能从颖果上去除,而不损伤颖果的壳或其下层组织;因此,“颖果”的测量包括外壳器官,而更准确的是“粒”的测量。生长阶段对籽粒宽度有显著影响(P< 0.001)和体重(P< 0.001)。处理对颗粒宽度也有显著影响(P< 0.001)和体重(P< 0.001),处理与生育期的交互作用显著影响籽粒长度(P= 0.004)。所有处理的粒长和粒宽在GS 85和成熟期(GS 92)之间均有所下降,其中CC植株在收获成熟期的粒宽高于其他处理。GS 85和92处理籽粒重均显著下降,其中CC植株的籽粒重显著高于其他3个处理。收获时粒重、粒长或粒宽最高或最低的处理与诱导脱皮最高或最低的处理并不对应。
收获时穗部测量
收割成熟穗的测量方法总结于表中2.温度有显著影响(P< 0.001)。花期前条件决定了花穗长度和粒数,在温暖条件下生长的植株花穗明显较短,小花数较低,不育率高,因此与在寒冷条件下生长的植株相比,花期前植株的粒数明显较低。在花前各温度范围内,不同花后处理的穗长、小花数和粒数无显著差异。花后温度对籽粒重有显著影响。穗粒重以CC株最高,其他3个处理穗粒重差异不显著。
果皮和果皮角质层的结构,以及胶结层
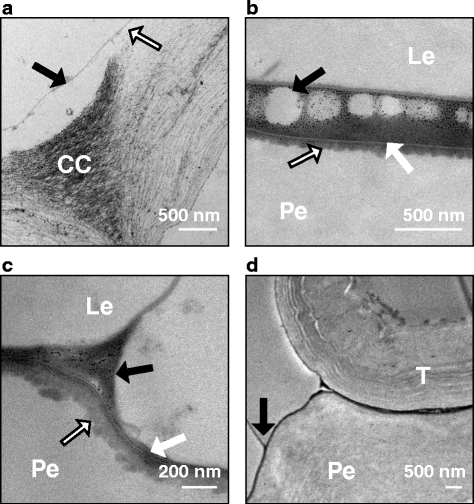
角质层和胶结层的结构在各处理间基本相同,但在不同生育阶段存在差异。在附加文件中提供了大麦颗粒截面后粘附的光显微照片3.,显示了壳和颖果组织组织的低功率方向。在GS 75时,电子致密的角质层与果皮细胞壁之间有一个典型的不规则界面,表明角质层材料正在产生(图75)。3箭头)。在gs77,角质层和细胞壁之间的界面通常是光滑的,尽管角质层本身仍然是典型的电子密度。到GS 85时,果皮粘附完成后,角质层停止产生进一步的角质层物质,角质层包括果皮角质层、果皮角质层和介于角质层之间的一层非晶态的电子致密物质,或电子致密和电子半透明相间的层状结构(图85)。3 b).在果皮粘附的关键时期,果皮内表面和外表面的角质层物质的产生不增加,在任何发育阶段,当果皮仍然可以从果皮上剥离时,表皮都不具有层状结构。内外稃表面角质层的一个例子显示在gs45(图。3 c).对gs77的无壳品种“努丁卡”的果皮表面角质层进行比较,发现有一层约30 nm的薄角质层,如图所示。3 d.努丁卡的角质层和果皮细胞壁之间的界面是光滑的,没有继续生产角质层材料的迹象。
在壳和果皮样品中,表面角质层经常与下壁分离,通常在相邻表皮细胞连接的角落(图2)。4虽然这种分离有时会延伸到整个样本。从gs77开始,果皮和果皮角质层开始粘在一起,有时可以看到果皮和果皮的细胞壁都分离了,但仍然牢牢地粘在一起。在GS 85中,角质层之间的空隙较大时,角质层之间往往有一层电子密集层,当分离距离特别大时,电子密集层并不总是延伸到果皮与果皮之间的空隙(图85)。4 b).这种电子密集的物质后来在壳-颖果分离区域形成平行条纹或随机方向的层状排列(图)。4摄氏度).这些层序的厚度在4到10纳米之间。角质层的分离在“管状”细胞附近是常见的,这很可能是毛状体,并可能造成外壳和颖果之间的一些机械应力(图。4 d).内稃或外稃内外表面的角质层均未见片层。
附着差区域的果皮和颖果角质层的透射电子显微图。一个在低温条件下生长的gs51的内表面角质层。角质层(实心黑色箭头)经常在相邻表皮细胞之间的角质层与下壁分离(黑色和白色箭头表示分离)。b果皮(外稃)和果皮之间的分离区域,在GS 85。胶结层并没有填满果皮和外壳之间的全部空间,这可以从胶结材料上的空隙(黑色箭头)得到证明。果皮细胞壁与果皮角质层的界面不光滑,但不可见球形的角质层沉积(黑白箭头)。一层薄的、电子透光的外角质层将果皮角质层与电子密集的胶结材料(白色箭头)分开。cCC处理后的颖果在GS 85处。果皮和颖果的表面角质层是分开的(黑色箭头)。果皮下角质层有轻微的絮凝外观(黑、白色箭头),角质层本身有电子致密的片层(白色箭头)。在分离点,这些片层不是全部平行的,而是发生在几个方向。片层不发生在外稃的内角质层上。d在CC粒中GS 85处果核和壳之间的分离区域(黑色箭头)的管状细胞。CC =细胞角部,Le =外稃细胞壁,Pe =果皮细胞壁,T =管状细胞
在粘附阶段,胶结层与果皮和外壳细胞壁的频繁分离使其难以测量(见附加文件)3.),只有少数样品保持足够完整的胶结层,以计算平均值的标准误差(表3.).果皮粘附前,果皮器官内外角质层厚度均小于果皮表面角质层;从GS 85开始,在果皮粘附完成后,测量整个胶结层的内壳角质层和果皮角质层,整个胶结层的厚度约为100 nm。然而,在壳-颖果明显分离的区域,胶结层的厚度可达几百纳米。
果皮表面形态
由于表面角质层经常被观察到从细胞壁上脱落,因此通过扫描电子显微镜检查Concerto at GS 77的颗粒,以确定这种分离是否可能在从颖果上物理除去外壳时发生,或在样品处理过程中发生。无壳品种“Nudinka”在gs77(被盖品种果皮表面变粘的生长阶段)进行了检测,以比较产生胶结层的籽粒和不产生胶结层的籽粒之间的果皮表面。在GS 77时,努丁卡果皮表面光滑。5额外的文件3.),而协奏曲果皮的表面是由于将果皮从已经粘着的果皮表面上扯开而受损的。5 b).gs77协奏曲的表面被一层球状材料覆盖。5C),很可能是胶结材料,它不能平滑地覆盖整个果皮表面,可能是由于在这个阶段去除果皮造成的破坏。果皮表面的管状细胞没有被胶凝材料完全覆盖(图1)。5 d透射电镜结果显示,胶结层并没有完全填满这些细胞周围的果皮和外壳之间的空隙。4 d).Concerto在GS 77的颗粒表面损伤程度,加上Nudinka在GS 77的颗粒表面没有损伤,表明胶结层与细胞壁的分离可能是由于通过胶结层的粘附强度高于角质层与细胞壁之间的粘附强度,而不是样品处理的产物。
表面脂质成分
在果皮和颖果的表面脂质提取物中,共鉴定出121种不同的化合物,属于以下结构类:脂肪酸;脂肪酸醇;蜡酯;烷烃和烯烃;酮类、二酮类、羟基二酮类及有关化合物;5-alkylresorcinols;和三萜。在附加文件中,除酯类外,每个样品中化合物的丰度均以碳数分布表示4.共存在20种脂肪酸,主要为饱和直链同源物(C的偶碳数)14C32和C的奇数碳数15C17和C25).两个支链C17根据其等价链长16.72和16.40,酸被鉴定为14-和可能是10-甲基十六烷酸[48,57].在检测到的14种长链醇中,最丰富的是甚至碳同源物(C16C28),以奇碳化合物(C21C31)作为次要成分。C范围内共有37个长链酯32C48以脂肪酸(C14C24)酯化成醇(C16C30.和C21C25).在检测到的22种脂肪烃中,奇数碳链烷烃(C21C37)以偶数碳同源物(C22C38和奇数27C31甚至30.)碳烯烃作为次要成分。Nonacosan-14-one、β-二酮汉三乌坦-14、16-二酮、8-和9-羟基汉三乌坦-14、16-二酮均被检出。此外,检测到的几种成分似乎与4个个体烯醇互变异构体和3个个体(烯醇)一致。2汉三康坦- 14,16 -二酮的异构体。它们之间的相互关系显示在附加文件中5.这些化合物通常不被报道为植物蜡的成分,ß-二酮,不清楚这些成分是否真正的成分在蜡,或人工蜡提取或衍生。酮-烯醇互变异构可以是酸和碱催化的,吡啶在衍生介质中的存在可能促进了该反应。然而,我们有证据表明烯醇和(烯醇)2在没有吡啶的情况下也会出现这种形式(数据未显示)。由于这些异构体都被认为来自于汉三康酮- 14,16 -二酮,它们的丰度被结合在了二酮中。检测到两个同源的5-烷基间苯二酚系列。第一种烷基取代基由奇数碳直链(C15C27),而在第二个分子中,分子携带一个额外的甲基取代基,要么在苯环内,要么在主要是奇碳5-烷基侧链(C15C27C20.).检测到6种萜烯,包括甾醇前体角鲨烯、胆固醇、菜籽醇和ß-谷甾醇,初步鉴定为胆甾醇- 3,5 -二烯和γ-生育酚。此外,样品中还含有6种身份不明的化合物。
虽然在果皮提取物中烷基间苯二酚和酮类化合物最为丰富,但没有发现任何化合物是果皮或果核样品、处理方法或生长期所特有的。几种化合物的丰度在不同处理和生长阶段之间存在显著差异。附加文件中的表S51给出对每种化合物丰度有显著影响的处理、生长阶段或它们的相互作用的概率,以及为确定样品之间丰度的显著差异而选择的最低限度适当的模型。附加文件中的附加表S6、S7和S81给出拟合的平均值,差异的标准误差,以及在外壳和颖果样本的最低限度适当模型的变量之间,化合物是否在丰度上有显著差异。
不同生长阶段复合丰度的差异
许多化合物在GS 75和77之间的丰度显著不同,独立于处理(附加文件1:表S6)。在颖果样品中,四醇、五正烷、七正烷和壬正烷的丰度在gs77中低于75。在GS 77颖果中,9,12 -十八碳二烯酸和二十碳二烯酸含量增加,5-苯二酚间苯二酚、5-戊二酚间苯二酚和甲基-5-戊二酚间苯二酚含量也增加。在GS 75 ~ GS 77之间,化合物“Unknown-3”的丰度也有所增加。在果皮样品中,十六醇和三烷的丰度在GS 77中高于GS 75。GS 77增加了十四酸和支链10-甲基十六酸的丰度。在GS75和77之间的壳样品中,酯和烷基间苯二酚也大量增加,具体来说,这些是:二十二醇十四酸酯,十八酸癸酯,二十二醇四酸酯和烷基间苯二酚:5-五间苯二酚,甲基-5-五间苯二酚和甲基-5-七间苯二酚。
不同处理复合丰度的差异
不同处理间颖果表面脂质中只有少量化合物的丰度变化显著,与生长阶段无关1:表S7)。WC处理的颖果中壬农酚的含量高于CC处理的颖果。与CC颖果相比,CW颖果中十八酸己糖的丰度较高。甲基-5-十五烷基间苯二酚在CC颖果中含量高于其他处理,而甲基-5-十七烷基间苯二酚在CC颖果中含量高于CW或WW。nonacosan -14- 1在CC颖果中比WW更丰富。
与颖果相比,不同生育期处理的果皮表面脂类化合物的丰度有较大的变化。CW果皮中二十二醇含量低于WW果皮,而CW果皮中六醇含量低于WC果皮。CC壳中五羧酸和八羧酸含量高于CW壳,WW壳中二十二羧酸含量高于CC壳和CW壳,WC壳中长链三戊酸含量高于WW壳和CW壳。nonacoson -14- 1,5 -十七烷基间苯二酚和甲基-5-十七烷基间苯二酚在CC壳中的丰度最高,5-十五烷基间苯二酚在CC壳中的丰度仅高于WC和CW。大量酯在处理之间的丰度差异显著,所有化合物的差异见附加文件中的表S31.大麦表面脂质含量最高的六醇类酯在不同处理间丰度存在差异,其中CC壳的六醇类酯丰度始终低于WW和WC壳,而WC的六醇类酯丰度在所有处理间均最高,但差异不显著。化合物“Unknown-4”在CC壳中的丰度高于其他处理。“Unknown-6”在WW壳和WC壳中的丰度高于CC壳和CW壳。
处理和生长期是影响复合丰度的显著因素
那些处理和生长期对化合物丰度均有显著影响的化合物,或单独影响,或相互作用显著的化合物,见附加文件1:表S8。在4个处理中,GS 75和77颖果的十六醇丰度均显著增加,但各生育期各处理间十六醇丰度无显著差异。在GS 75时,WW颖果的三甘醇含量显著高于CC颖果,而在GS 77时WW颖果的三甘醇含量显著高于CC颖果和CW颖果。GS 75和GS 77处理的六醇和八醇丰度均显著降低,但各生育期各处理间丰度差异不显著。在GS 75和77之间,八碳烷的丰度下降,但在各个生育期处理之间没有差异。在GS 75和77处,WW颖果的三烷含量均高于CC颖果。从GS 75到GS 77,未知化合物1和4的丰度显著增加。
在果皮样品中,所有处理的棕榈酸丰度在GS 77处均大于GS 75。同样,在所有四种处理中,gs77比gs75的胆固醇含量最高。在GS 75时,CC和CW处理的八烷基十六酸酯含量高于WW果皮,但在GS 77时,情况相反,WW果皮中八烷基十六酸酯的含量明显高于CC和CW果皮。在GS 75和77处,CW果皮中的六羧酸含量高于CC果皮。在GS 75和77时,CC果皮中的十八酸含量低于WC果皮。
处理与生长期相互作用的复合丰度差异
在GS 77的CW颖果中,十八醇、三三烷、菜籽醇和ß-谷甾醇的丰度显著高于其他所有样品。同样,在gs77处WW颖果中,heptacosanol含量高于其他样品。五甘醇在GS75处WW颖果中含量高于其他样品(WC颖果在GS75处除外)。在GS 75处,六烯、壬烯和三烯烯在CC颖果中含量最高,高于其他样品。在果皮样品中,在gs77的CW器官中,十八醇含量显著增加,颖果中也有相同的趋势。
与剥皮有关的表面脂质组成的变化
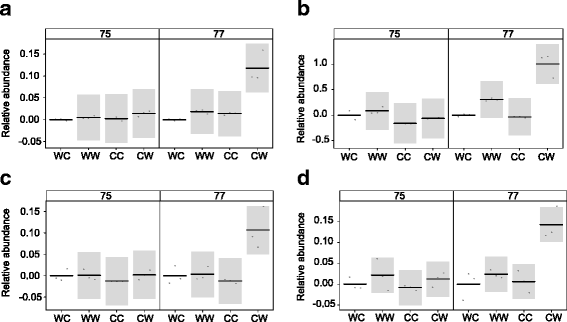
WC组的带皮粒占比最高,CW组的带皮粒占比最低,因此,这些处理在颖果提取物中具有显著不同丰度水平的化合物是特别值得关注的。当果核变得粘稠时,在GS 77处发生显著变化的化合物可能表明哪些化合物与良好的果核粘附性有关。在GS 77处的CW颖果提取物中,有4种化合物的丰度比其他样品显著增加。这些化合物的估计模型系数(相对于WC的丰度)和部分残差如图所示。6;十八醇(无花果。6), tritriacontane(无花果。6 b)、菜油甾醇(无花果。6摄氏度和ß-谷甾醇(图。6 d).
讨论
在果皮和颖果发育过程中,施加不同的温度可以诱发不同严重程度的籽粒剥皮。以前有研究报道颖果上黏质物质的临界产生发生在花期后10天[15,17].然而,通过将发展阶段联系起来[44我们已经证明,这一发育阶段对果皮的粘附至关重要,而且根据发育速度的不同,在花后的许多天内,果皮粘附都可以达到。甚至从开花期到gs77的热时间在不同处理之间也有很大差异,这表明开花期前的条件也通过改变籽粒发育速度来影响胶结层的发育。正如先前利用温度来控制大麦生长的研究所看到的,同样地,升高的温度也缩短了施用大麦的发育阶段,并降低了最终粒重[45,58].Ugarte等人[14研究表明,灌浆期温度对籽粒灌浆速率的影响大于灌浆前温度,因为与相同的灌浆前温度相比,灌浆后温(CW和WW)和冷(CC和WC)处理从GS 65到成熟的时间更相似。造成最严重剥皮水平(WC和WW)的温度处理,虽然对籽粒组分的大小没有显著影响,但对耳生理有显著影响。这些处理导致了更短的穗和更少的受精小花发育成籽粒,可能是由于开花期的热胁迫,这与Shi等人在水稻中报道的类似。[59].此前曾有报道称,大麦和其他在高温条件下生长的谷物每穗产量减少[60].本研究中WW和CW处理的籽粒重较低可能是由于淀粉合成减少,这与其他灌浆过程中温度升高的研究结果一致[45,61].
在果皮生长和心皮发育期间的温暖条件导致更高的剥皮水平,而在颖果发育和籽粒填充期间的寒冷条件进一步加剧剥皮。不太可能像Rajasekaran等人提出的那样,在本研究中,不同的剥皮水平是由谷粒大小和果皮强度之间的不相容造成的[7],因为谷壳组分的重量和尺寸在达到gs77时各处理之间差异不显著,收获时最大、最重籽粒(CC)的处理与籽粒脱皮最严重的处理不相对应。本研究仅对一个品种进行了评估,然而,对许多不同基因型的检查可能会发现,在一些品种中,剥皮严重程度与不同的外壳和颖果尺寸有关。有趣的是,尽管WC处理和CC处理的灌浆时间相近,但花后低温处理的籽粒重量与CC处理的籽粒重量并不相近。这一结果支持了Calderini等人的发现[11从孕穗期到开花期的较高温度显著降低了最终粒重。花期前温度对粒重的影响被认为是由于对小花发育的影响[11,14];目前的研究结果提供了支持数据,表明这种效应与果皮的大小或重量无关,因此可能与心皮的发育有关,正如Xie等人在小麦研究中报道的那样。[62].由于蒙皮在不同处理之间的变化与颗粒组分的大小或重量无关,这可能是通过不同的温度处理对胶结层的影响。
到目前为止,Gaines等人已经完成了对胶结层最详细的研究[15].尽管其他人已经用光学显微镜检查了胶结层[16,18及电子显微镜[8].胶结层非常薄,在100到600纳米之间[15],本研究中不超过120纳米。由于光学显微镜的分辨率极限达到200 nm,因此有必要使用电子显微镜来获得胶结层结构差异的最佳理解。在籽粒灌浆过程中,果皮和外壳角质层的结构发生了变化,这与Jeffree [21,63].gs75处的果皮角质层与果皮细胞壁呈网状边界(图75)。3),与细胞壁扩张过程中表面角质层的持续发展相一致。盖恩斯等[15]将胶结层描述为一层薄薄的电子透光层,其中嵌有细胞壁材料,并认为它早在花期后2天形成。然而,这种描述和伴随的显微照片,与我们目前所知的植物表面角质层发育中期相对应[21,63],并且不一定与与果皮角质层不同的胶结物质的产生相对应。事实上,在GS 77的Nudinka和Concerto角质层的外表面都能看到一层薄薄的电子密度层(图77)。3 d《不播种的协奏曲》),类似于盖恩斯等人的描述[15]作为胶凝材料。在GS 85之前,很难准确区分果皮表面角质层与任何胶结材料的边界,此时果皮与颖果相互粘附,可以观察到Hoad等人报道的两层角质层之间电子透光性对比强烈[64].
从本研究的结果来看,尚不清楚胶凝层中所见的层序,当存在时,是否是果皮或外壳角质层的一部分,还是仅在颖片与颖果接触后形成的。根据Gaines等人的观察,这些lamellations通常是平行的。[15],但在分离最严重的区域,胶结物质没有完全填满外壳和果皮角质层之间的空间,它们就变得无序。通常情况下,层状排列在分离区域的果皮一侧,这表明胶结物质可能存在于它们的表面,而它们本身不是胶结层的一部分。用二氯甲烷和乙醇提取桉叶角质层,使片层无定形[20.],表明这种薄片可能在化学上是不同的,尽管类似的处理桉树叶角质层留下完整的片层[20.].靠近管状细胞的区域,很可能是毛状体,总是在外壳和颖果之间有一定程度的分离。盖恩斯等[15]报道管状细胞不产生明显的胶结层,本研究中这些细胞的角质层明显比周围的果皮表皮角质层薄。虽然角质层lamellations仍然在果皮一侧,Gaines等人[15研究发现,有时果皮和果皮角质层与下层细胞壁同时分离。这说明两个角质层之间的粘附强度大于表面角质层与细胞壁之间的粘附强度,提示角质层与细胞之间的界面可能是影响剥皮严重程度的薄弱环节。Olkku等人[16]报告称,皮肤剥落很可能是由于外壳的大薄壁薄壁组织破裂,而不是沿胶结层的分离。本研究未观察到细胞破损,可能是由于样品制备方法的不同而避免了细胞破损,但由于本研究未测量果皮厚度和果皮薄壁细胞层数,因此无法确定不同处理方式对去皮是否有影响。
大麦颖果表面脂质的组成尚未见报道。然而,Kakeda等人[65]比较了从有盖和裸大麦颖果中提取的表面脂质的薄层色谱,发现很少有证据表明,在裸大麦颖果中存在溶剂可萃取化合物,尽管在裸大麦颖果中存在一层薄薄的角质层。根据Taketa等人的发现[18]表明胶结材料可以用苏丹黑染料染色,这表明胶结材料本身很可能可以用有机溶剂提取。在本研究中,一些化合物的相对丰度在不同处理之间与剥皮严重程度有关,特别是最低剥皮处理(CW)。在本研究中,角质层和胶结层的厚度不太可能影响壳-颖果的粘附质量,这表明这些角质层的粘附能力主要受成分的改变而不是角质层材料的厚度或数量的影响。
角质层厚度和物理特性之间缺乏相关性并不罕见。已有多项研究表明,植物角质层组成与透性、蒸腾等物理或机械特性的关系比角质层大小更密切[66,67,68,69].在这项研究中,三萜及其衍生物甾醇化合物,尤其是ß-谷甾醇和油菜甾醇在导致不同剥皮严重程度的处理中,GS 77的丰度变化最显著。一些角质层中三萜含量较高的植物角质层通透性也较高[66],而表面脂质成分改变导致角质层通透性更高的突变体往往表现出器官融合表型,尤其是花器官之间。长链烷烃三三烷也具有良好的外壳附着力;n-烷烃也与角质层的渗透性有关[66],但在番茄果实中,较高链烷烃与C31C34与较低的角质层通透性有关[67].器官融合以前曾被认为是与外壳粘附相似的表型[43].在玉米ad1在突变体中,花的细胞壁相互粘附,细胞壁之间的角质层似乎保持完整[41],在外观上类似于由外壳和果皮表面角质层组成的胶结层。在这种情况下拟南芥突变体atwbc11而且bdg(保镖)然而,角质层被破坏,细胞壁合并[40,70].本实验未观察到表皮层的破坏和果皮和果皮细胞壁的直接粘附。器官融合已诱导表达真菌角质酶在拟南芥在这种情况下,细胞壁之间的角质层要么保持完整,要么表皮细胞壁直接相互接触[71];器官融合也是由抑制诱导的WIN1 / SHN1,一个与之同源的基因Nud,在拟南芥而且Tourenia fournieri[72].在具有最高质量外壳附着力的样品中,已知化合物丰度的增加会增加角质层的渗透性,这支持了Duan等人的观察结果。[43果皮粘附的过程类似于器官融合,可能是由于角质层通透性的增加。虽然目前的研究表明,角质层蜡质成分对果皮粘附质量有影响,但细胞壁、角质层和角质层蜡质的整个基质都可能促进果皮粘附。
结论
在本研究中,我们能够确定,无论籽粒发育速度如何,大麦外壳与下方颖果的粘附直接取决于籽粒的发育阶段。直到颖果接近最大体积(gs77),胶粘剂胶结层才接触到外壳,开始粘附。因此,在未来的研究中,不仅要考虑花后天数,还要考虑果皮粘附力的发育变化。有证据表明颖果表皮蜡质的组成影响果皮粘附质量,因此对麦芽品质缺陷颗粒剥皮的严重程度有明显的影响。外壳粘附质量受环境条件的影响,但外壳粘附很可能存在遗传影响,因为我们知道不同的麦芽大麦品种对籽粒剥皮的敏感性不同[4].由于目前的工作表明,表皮风险的差异可能是由于角质层组成,而不是不同品种之间的颗粒尺寸的差异,研究工作的重点是确定胶结层组成的遗传控制,以尽量减少未来品种的表皮风险。
缩写
- 方差分析:
-
方差分析
- 答:
-
酷,酷治疗
- 连续波:
-
酷,温暖的治疗
- g:
-
成长阶段
- 经颅磁刺激:
-
三甲基硅烷基
- 厕所:
-
温暖、凉爽的治疗
- WW:
-
温暖,温暖的治疗
参考文献
梅雷迪思我们。注意去皮大麦的麦芽品质。J Inst Brew. 1959; 65:31-3。
阿古·RC, Bringhurst T, Brosnan JM。批间差异对实验室和商业麦芽牛桥大麦品质的影响。酿酒协会。2012;118:49-56。
莱因伯斯E,亨特利DN。影响大麦外壳粘附性的一些因素。植物学报,1997,19(3):357 - 362。
刘志强,刘志强,刘志强,等。环境喷雾屏蔽对春大麦品种籽粒脱皮的影响。中国农业科学。2017;
埃弗斯AD,布莱尼AB,奥布赖恩L.谷物结构与成分。植物生理学报。1999;50:629-50。
黄志强,刘志强,刘志强。小麦籽粒结构与发育对品质的影响。中国粮食科学。2002;26(3):391 - 396。
Rajasekaran P, Thomas WTB, Wilson A, Lawrence P, Young G, Ellis RP。春大麦定位群体籽粒损伤的遗传控制植物品种。2004;123:17-23。
Hoad SP, Brennan M, Wilson GW, Cochrane PM。啤酒大麦壳到颖果的粘附和籽粒剥皮:粘附过程中关键生长阶段的鉴定。中国生物医学工程学报。2016;28(5):532 - 536。
测试仪RF,南JB,莫里森WR,埃利斯RP。灌浆期环境温度对4种大麦基因型淀粉组成及特性的影响中国粮食科学。1991;13:113-27。
Macnicol PK, Jacobsen JV, Keys MM, Stuart IM。热胁迫和水胁迫对箱栽纵帆船大麦麦芽品质和籽粒参数的影响。中国粮食科学。1993;18:61-8。
Calderini DF, Savin R, Abeledo LG, Reynolds MP, Slafer GA。小麦开花前一时期对测定籽粒重量的重要性Euphytica。2001;119:199 - 204。
Scott WR, Appleyard M, Fellowes G, Kirby EJM。基因型和穗位对春大麦心皮、籽粒生长及成熟粒重的影响农业科学学报,1983;100:383-91。
人工诱变截光、粒数和壳缢缩对正常和高赖氨酸大麦籽粒重发育的影响农业科学。1983;101:301-9。
Ugarte C, Calderini DF, Slafer GA。小麦、大麦和小黑麦的粒重和粒数对花前温度的响应性中国农业科学。2007;21(3):329 - 331。
作者:Gaines RL, Bechtel DB, Pomeranz Y.大麦中引起壳-颖果粘附的层发育的微观研究。谷物化学家。1985;62:35-40。
李志强,李志强,李志强,等。大麦壳结构与品质的关系。J Am Soc Brewing Chemists 2005; 63:17-22。
哈伦高压。爱达荷州阿伯丁汉臣大麦从开花到成熟的每日籽粒发育。J农业研究1920;19:393-429。
武田S,天野S,田津野Y,佐藤T,斋正D, Kakeda K,等。粘附性大麦籽粒受一个ERF家族转录因子基因调控脂质生物合成途径。中国科学(d辑)2008;
Fernández V, Guzmán-Delgado P, Graça J, Santos S, Gil L.角质层结构与化学成分的关系:重新评估主流模型。植物学报。2016;31(5):393 - 393。
Guzmán P, Fernández V, Graça J, Cabral V, Kayali N, Khayet M,等。化学和结构分析蓝桉而且大肠camaldulensis叶角质层:一脂质化的细胞壁区域。植物学报。2014;35(5):393 - 393。
Jeffree CE。角质层植物角质层的精细结构In: Riederer M, Muller C, editors。植物年刊:植物角质层生物学,第23卷:Wiley-Blackwell;2008.
叶芝,罗斯JKC。植物角质层的形成和功能。植物杂志。2013;163:5-20。
植物角质层发光:蜡生物合成和出口的进展。植物学报。2009;12:721 - 727。
王晓明,李文华。植物角质层蜡的生物合成与分泌。中国医药科学。2003;42:51-80。
Fich EA, Segerson NA, Rose JKC。植物聚酯角质层的生物合成、结构及生物学作用。植物学报。2016;27(5):477 - 479。
植物蜡。:隧道。威利有限公司,奇切斯特。威利有限公司;2016.1-13页。
Richardson A, Franke R, Kerstiens G, Jarvis M, Schreiber L, Fricke W.大麦生长中的角质层蜡沉积(大麦芽)叶的开始时间与老叶鞘内表皮细胞的出现时间有关。足底。2005;222:472 - 83。
Giese BN。光照和温度对大麦叶片表皮蜡组成的影响。植物化学。1975;14:921-9。
Belding RD, Blankenship SM, Young E, Leidy RB。苹果品种表皮蜡的组成及变异。中国生物医学工程学报1998;23(3):348 - 356。
Holloway PJ。角质的马吕斯pumila水果和树叶。植物化学。1989;12:2913-20。
黄晓明,陈晓明,陈晓明。葡萄果实角质层发育与串腐病易感性的关系。中国植物学报,1997,18(3):329 - 331。
李志强,李志强,李志强,等。发育过程中樱桃果实角质层的组成。植物化学。2007;68:1017-25。
刘大东,曾强,纪庆霞,刘长青,刘世斌,刘勇。野生型“纽荷尔”脐橙果实角质层蜡质超微结构和组成的比较(素类(L。]O年代beck cv. Newhall) and its glossy mutant. Plant Cell Rep. 2012;31:2239–46.
Kosma DK, Parsons EP, Isaacson T, Lü S, JKC R, Jenks MA。番茄成熟突变体发育过程中果实角质层脂质组成。杂志。2010;139:107-17。
Shepherd T, Griffiths DW。胁迫对植物角质层蜡质的影响。新植醇。2006;171:469 - 99。
Matas AJ, Lopez-Casado G, Cuartero J, Heredia A.相对湿度和温度改变了离体番茄果实角质层的力学性能。中国植物学杂志2005;20(3):342 - 342。
Mcdonald RE, Nordby HE, Mccollum TG。柚子表皮蜡的形态和组成与冷害有关。Scientia。1993;28:311-2。
徐文华,刘文华,刘文华。器官融合的遗传分析拟南芥.遗传学。1998;149:607-19。
刘志强,刘志强,刘志强,等。HOTHEAD参与长链α-,ω-二羧酸生物合成和细胞外基质形成的遗传和生化证据足底。2006;224:315-29。
刘志强,刘志强,刘志强,等。拟南芥中表皮特异的细胞外保镖控制角质层的发育和形态建成。植物细胞。2006;18:321-39。
辛哈·N,林奇·madherent1玉米的突变表现为表皮壁的改变,而组织特性没有受到干扰。足底。1998;206:184 - 95。
K、Durst F、Pinot F、Benveniste I、Nettesheim K、Wisman E等。拟南芥LACERATA基因的功能分析为脂肪酸ω-羟基化在发育过程中的不同作用提供了证据。中国科学(英文版)2001;98:9694 - 99。
段荣,熊华,王安,陈刚。覆盖/裸大麦壳-颖果粘附/分离的比较转录组学分析(大麦芽l .)。中国生物医学工程学报。2015;21(4):491 - 496。
Tottman博士,Broad H.谷物生长阶段的十进制代码,附插图。植物学刊1987;110:441-54。
Savin R, Stone PJ, Nicolas ME, Wardlaw IF。大麦籽粒生长与麦芽品质1。热应激和中等高温的影响。农业研究。1997;48:615-24。
Abràmoff MD, Magalhães PJ, Ram SJ。使用ImageJ进行图像处理。生物光子Int。2004;11:36-42。
张志强,张志强,张志强,等。马铃薯GC-MS代谢组学:限制因素是什么?代谢组学。2007;3:475 - 88。
Shepherd T, Robertson GW, Griffiths DW。瑞典叶表皮蜡中完整烷基酯的毛细管气相色谱-电子冲击质谱分析。Phytochem肛门。1995;6:65 - 73。
汉密尔顿RJ。蜡的分析。图片来源:Hamilton RJ,编辑蜡:化学,分子生物学和功能。邓迪:油压出版社;1995.311 - 42页。
张志刚,张志刚,张志刚,等。不同环境条件对羽衣甘蓝和瑞典菜表皮蜡质组成的影响。植物化学。1995;40:407-17。
小麦角质层蜡中多酮类化合物的鉴定。伯利恒。脂质。2016;51:1407-20。
Zarnowski R, Suzuki Y, Yamaguchi I.大麦中的烷基间苯二酚(大麦芽l . Distichon)谷物。Z Naturforsch。2002;57 c: 57 - 62。
卢娜。黑麦和二穗短柄草表皮蜡中极长链烷基间苯二酚的生物合成与积累。温哥华:英属哥伦比亚大学;2014.
R开发核心团队。R:用于统计计算的语言和环境。2008.http://www.r-project.org.
贝茨D, Maechler M, Bolker B, Walker S.利用lme4拟合线性混合效应模型。J Stat Soft. 2015; 67:1-48。
披散下来房车。最小二乘的意思是:R包lsmeans。J Stat Soft. 2016; 69:1-33。
Shepherd T, Robertson GW, Griffiths DW, Birch ANE。红树莓表皮蜡质成分与蚜虫侵染及抗性的关系(悬钩子属植物idaeusl .)。植物化学。1999;52:1239-54。
帕萨雷拉VS,萨文R, Slafer GA。育种对大麦籽粒重量和品质对灌浆过程中高温事件敏感性的影响Euphytica。2005;141:41-8。
陈朱施P Y,唐L, J,太阳T,曹W, et al。水稻开花期和灌浆期温度和热胁迫持续时间的差异效应。环境科学与技术。2016;32(3):329 - 331。
乔杜里SI,沃德劳IF。温度对谷物籽粒发育的影响。农业研究1978;29:205-23。
Wallwork MAB, Logue SJ, MacLeod LC, Jenner CF.灌浆过程中高温对大麦籽粒淀粉合成的影响。植物生理学报1998;25:173 - 173。
谢倩,梅耶斯S,戴斯。心皮大小、籽粒灌浆和形态决定小麦个体粒重。植物学报。2015;34(5):532 - 536。
Jeffree CE。植物角质层的结构和个体发生。插图:Kerstiens G,编辑。植物角质层:综合功能方法。牛津:BIOS科学出版社有限公司;1996.
最佳综艺选择:2016年的关键人物和看点。In: SRUC, AHDB, editors。农学2016。珀斯卡弗莱米尔:因弗里和因弗内斯;2016.
田志田,石原N,泉Y,佐藤K,武田s。大麦的表达与功能分析Nud使用转基因水稻的基因。育种科学。2011;61:35-42。
Oliveira AFM, Meirelles ST, Salatino A. caatinga和cerrado两种植物表皮蜡及其抗失水性能。《中国科学院学报》2003;5:431 - 9。
Vogg G, Fischer S, Leide J, Emmanuel E, Jetter R, Levy AA, Riederer M.番茄果实角质层蜡及其蒸散屏障特性的影响:一个缺乏超长链脂肪酸ß-酮酰基辅酶a合酶的突变体的功能表征。中国植物学杂志。2004;21(5):529 - 531。
防止水分流失:植物角质层屏障特性的分析。中国植物学杂志2001;20(3):322 - 322。
España L, Heredia- guerrero JA, Segado P, Benítez JJ, Heredia A, Domínguez E.番茄(Solanum Lycopersicum)果实角质层在发育过程中的生物力学特性是由其组分相对含量的变化所调节的。新植醇。2014;202:790 - 802。
罗波,薛晓霞,胡文力,王丽娟,陈晓霞。的ABC转运蛋白基因拟南芥,AtWBC11,参与角质层发育和器官融合的预防。植物细胞物理学报。2007;48:1790-802。
张志强,张志强,张志强,张志强,等。转基因的拟南芥植株表达一种真菌角质酶,其角质层和生殖器官融合的结构和性质发生了改变。植物细胞。2000;12:721-37。
Oshima Y、Shikata M、Koyama T、Ohtsubo N、Mitsuda N、Ohme-Takagi M. mixta样转录因子与WAX INDUCER1/SHINE1协同调控角质层发育拟南芥而且Torenia fournieri.植物细胞。2013;25:1609-24。
确认
作者感谢WTB Thomas博士(詹姆斯·赫顿研究所)提供的种子。
资金
这项研究得到了生物技术和生物科学研究委员会作物改良研究俱乐部的资助(赠款BB/J019623/1)。我们也感谢苏格兰政府的农村和环境科学与分析服务部(RESAS)的资助。资助机构没有参与研究设计、收集、分析或解释数据,也没有参与撰写手稿。
数据和材料的可用性
本研究期间产生或分析的所有数据都包含在本文发表的文章[及其补充信息文件]中。
作者信息
从属关系
贡献
MB设计并执行了实验,分析了数据并撰写了手稿。TS对脂质提取物进行衍生,采用GC-MS对化合物进行鉴定和定量。SM和MB制备了用于电子显微镜观察的样品。CFET负责数据的分析,CFET和SH参与了稿件的修改。所有作者都阅读了手稿,给出了意见,并批准了最终版本的手稿。
相应的作者
道德声明
伦理认可和同意参与
本研究中使用的种子是由WTB Thomas博士精心证明的材料培育而成,属于詹姆斯·赫顿研究所维护的英国优良大麦遗传协会(AGOUEB)收藏的一部分。由于AGOUEB的收藏目前仍按上述方式保存,所以该材料的凭证尚未存放在植物标本室。
同意出版
不适用
相互竞争的利益
作者声明他们之间没有利益冲突。
出版商的注意
施普林格《自然》对出版的地图和机构附属关系中的管辖权要求保持中立。
附加文件
额外的文件1:
是一个包含8张表格的excel工作簿,包含数据或分析结果的补充表格。这是编号表S1通过表S8在特克斯语中,每个人都被单独称为,例如“……所示表S2”。(XLSX 301 kb)
额外的文件2:
是一个质谱片段模式的示意图,使读者能够理解某些脂类化合物是如何通过其特征片段被识别的。(PDF 75 kb)
额外的文件3:
图S4a是树脂嵌入大麦颗粒在GS 85染色1% (w/v甲苯胺丁氧复混剂,1:1 . 0.1% (w/v聚乙二醇苏丹红:90% (v/ v)甘油。图中显示的是果皮表皮和外壳之间的界面(胶结层就在这里)(黑色箭头)。种皮被苏丹红(黑白箭头)染红。糊粉层(黑色和灰色箭头)标志着胚乳的开始。b显示果皮角质层的分离(黑色箭头),露出下面的果皮细胞壁(黑色和白色箭头)。c是一个高分辨率的努丁卡果皮光滑表面的GS 77。没有证据表明有胶结材料,角质层表面也没有损伤。(PDF 483 kb)
额外的文件4:
是一个大的系列图表,显示了每个结构类化合物的平均丰度,按碳数排序,为每个处理和生长阶段采样。有些读者可能对这种显示的复合分布感兴趣,尽管我们认为它对文本的主要信息不是必要的。(PDF 97 kb)
额外的文件5:
图S3汉三康坦-14,16-二酮与烯醇及其(烯醇)2异构体的相互关系。(PDF 30 kb)
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许不受限制地在任何媒体上使用、分发和复制,前提是您要适当地注明原作者和来源,提供创作共用许可的链接,并说明是否进行了更改。知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Brennan, M., Shepherd, T., Mitchell, S.。et al。在大麦中,花前和花后温度通过颖果角质层胶结层的变化影响着果皮与颖果的粘附。BMC植物杂志17日,169(2017)。https://doi.org/10.1186/s12870-017-1113-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-017-1113-4
关键字
- 颖果
- 胶结层
- 粮食发展
- 粮食剥皮
- 大麦芽,皮粘连
- 啤酒大麦