抽象的
背景
在动物体内,类固醇激素生物合成的最初阶段发生在产生类固醇的组织的线粒体中,那里有细胞色素P450鳞状细胞癌(CYP11A1)通过对编码CYP11A1基因催化胆固醇转化成孕烯醇酮 - 所有的类固醇激素的前体一般,开始与孕酮。这个阶段是在植物中失踪,其中线粒体细胞色素P450(三刀CYP家族)也没有发现。生成与动物的线粒体类型P450转基因植物将提供一个有趣的选项,以验证植物线粒体是否可以作为类固醇激素生物合成单加氧酶P450反应另一个站点。
结果
为了更详细地比较植物和动物的类固醇生成系统,我们创建并研究了转基因烟草和番茄植物有效地表达哺乳动物CYP11A1互补脱氧核糖核酸。获得的植株的详细表型特征表明,经过四代研究,转基因烟草植株减少了营养发育时期(早花和铃成熟),与仅有的空载体或野生型植物相比,生物量和生产力(种子数量和质量)增加。此外,CYP11A1转基因植物对这些真菌病原体表现出抗性葡萄孢菌.相似的有价值表型(个体发生和/或抗逆性的加速过程)在两个明显不同的转基因番茄株系表达中也可见CYP11A1的cDNA:一条线(第4号)具有营养发育的加速率,而其他(第7号)具有增强免疫力的非生物和生物胁迫。在转基因烟草和番茄叶片的孕酮水平比野生型的对照植株高3-5倍。
结论
我们第一次证明了植物和动物类固醇激素生物合成系统中最特定的成分在体内的相容性。提出并证实了上述哺乳动物转基因植物特殊表型的形成CYP11A1cDNA是由于黄体酮生物合成的增加而产生的,黄体酮可被认为是一种非常古老的植物细胞的生物调节剂,是第一种真正的植物和动物共有的激素。
背景
甾醇及其次生代谢产物和类固醇激素在生物体内几个关键生理过程的调节中发挥着重要作用。直到最近,人们才普遍认为油菜素内酯是一类特殊的类固醇激素,在植物中起着最重要的调节和信号传递作用[1那2那3.那4.那5.].然而,近年来已得到的实验数据的显著量表明,植物甾醇本身(β谷甾醇,豆甾醇,菜油和胆固醇)持有相当大的管理活动,无论其转化为油菜素内酯[6.那7.].此外,固醇是许多次级代谢物(如孕酮)合成的主要底物,这些次级代谢物参与调节植物的生理功能[8.那9.那10.].此外,在控制类固醇化合物的合成方面,不仅在动物中,而且在植物中,最重要的作用是由诸如细胞色素P450依赖性单加氧酶、类固醇还原酶和酮类固醇异构酶等类固醇原蛋白发挥作用[11.那12.那13.那14.那15.那16.那17.].此外,油菜素类固醇和动物的类固醇激素的生物合成的某些阶段是进化保守的。例如,它已经表明,植物(DET2)和动物(5αR)的类固醇5α还原酶是直系同源物和催化类固醇的生物合成的同类型的反应:孕酮与5α孕烷-3,20-转换在动物细胞 - 二酮(5α-dihydroprogesterone,5α-DHP)和campestenone的皈依成5α-campestanone - 在植物油菜素类固醇的生物合成[中间17.那18.那19.].的Δ5羟基类固醇脱氢酶/Δ5-Δ4-类固醇异构酶(3β-HSD),其起着动物的生物合成中起重要作用的类固醇激素也被在植物中发现,其中它执行相同的功能[13.那20.].
尽管在植物和动物中类固醇发生的过程被描述有相似之处,但它们至少有一个基本的区别。动物甾体激素生物合成的最初阶段发生在甾体生成组织的线粒体中,那里有细胞色素P450SCC.编码的CYP11A1adrenodoxin reductase [AdR]和adrenodoxin [Ad]催化胆固醇转化为孕烯酮-所有类固醇激素的一般前体,从孕酮开始。虽然存在与AdR和Ad同源的植物铁还蛋白还原酶[MFDR]和两种线粒体型密切相关的铁还蛋白[mfxs],但已被清楚地证实拟南芥[21那22那23最近也有一些洋地黄和茄科家种[24而在未发现线粒体细胞色素P450 (mito CYP族)的植物中,这一阶段缺失。油菜甾醇的生物合成途径为参与植物生长发育调控的油菜素内酯和植物激素提供前体。与此同时,许多动物类固醇激素(孕烯醇酮硫酸盐、孕酮、17-羟孕酮、16-脱氢孕酮、雄烯二酮)和受体介导动物细胞中线粒体胆固醇摄取,最近也在许多不同的植物物种中被发现(见补充文件)1)[9.那25那26那27].
在这方面,开发和研究表达哺乳动物cDNA的转基因植物CYP11A1线粒体细胞色素P450基因编码鳞状细胞癌(CYP11A1)具有重要意义。这些植物的详细研究首次显示,即使是最具体的组成部分动物类固醇激素的蛋白质的生物合成系统和植物的荷尔蒙系统是兼容的,并可能是积极参与工作,显著提高增长的过程,发展甚至植物免疫力。
方法
植物材料
番茄种子(茄属植物lycopersicuml .简历。全俄罗斯灌溉蔬菜、甜瓜和地面种植研究所(阿斯特拉罕州,Kamyziyak,俄罗斯)提供的。种子表面用96%乙醇消毒30 s,用20%溶液(v/v),加入少量Tween-20漂白剂7分钟,然后用消毒蒸馏水漂洗5次,每次1分钟。种子表面消毒后,在Murashige和Skoog (MS)基础培养基上培养[28]没有添加3% (w/v)及0.7% (w/v)琼脂。高压灭菌前将pH调至5.8。培养温度维持在25±1℃,荧光浓度为65 μmol m .−2年代−1(16 h光照/8 h黑暗)。以前开发的转基因烟草植物烟草的简历。佩蒂特哈瓦那SR1线表示全尺寸CYP11A1细胞色素P450的cDNA鳞状细胞癌从牛肾上腺皮质[29]中,野生型植物和植物转化用空载体pGreen0229 [30.]、新一代Т3、T4和Т5在25℃、光照强度1000-2000 lx、光周期16 h条件下培养。
转基因烟草植株表型分析
为了对比表型分析,我们使用Т4和T5的代工厂。种子在表面消毒并在Murashige和Skoog培养基横卧[28含有选择性试剂膦。抗草丁膦植株露地种植。所有的植物的基因整合和表达通过分子遗传方法进行了测试。在植物生长发育过程中,花期和不同的形态参数的起始时间进行了检查。这项研究是在每行15-25独立工厂进行。
烟草种子发芽和萌发速度的估计
种子在培养皿中发芽滤纸上。培养皿中有缝隙被提上与托盘的烧烤。滤纸的条带在培养皿提供种子的必要水合的底部通过槽通过。在顶部培养皿盖上盖,以防止种子干燥。托盘在25℃的恒温孵育。在每个变体有50个种子4次重复。要确定的发芽种子发芽数量的高速天天被考虑到10天。作为发芽以约1mm的胚芽根种子进行计数。在第10天进行发芽的评价。发育正常苗,异常的人,不发芽的种子被考虑在内。 Statistical data processing was performed using software Microsoft Excel.
测试CYP11A1对于以植物病原真菌抗性的转基因烟草植物葡萄孢菌
真菌属植物的致病真菌葡萄孢菌引起灰霉病用作试验培养物。在挑起条件,中等年龄的和相同尺寸的分离的叶子置于陪替氏培养皿上用水润湿的滤纸。含有2000个孢子病原体的孢子的10微升悬浮液/ ml的施加在片材上6点,在这之后的培养皿叶子盖紧以创建高湿度和置于并保持在气候室在24的温度下°C和16小时光周期。未转化的植物和植物仅含有空载体质粒的叶子(无CYP11A1的cDNA)用作对照。叶子椎板损伤的程度,相对于反比于植物的相对电阻葡萄孢菌植物病原体,是在点按在感染后第10天的数量和坏死斑的大小进行评估。试验也通过了不同的方法,即通过在果汁的从叶的下降计数发芽的孢子数的方法进行。孢子的20微升悬浮液葡萄孢菌(10.5.孢子/ml)和对照(未转化和空载体转化)蛋白提取液20 μlCYP11A1将转基因植株置于微管中,24°C孵育24小时。在显微镜下计数萌发孢子的数量。
农杆菌属应变和质粒
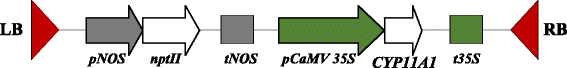
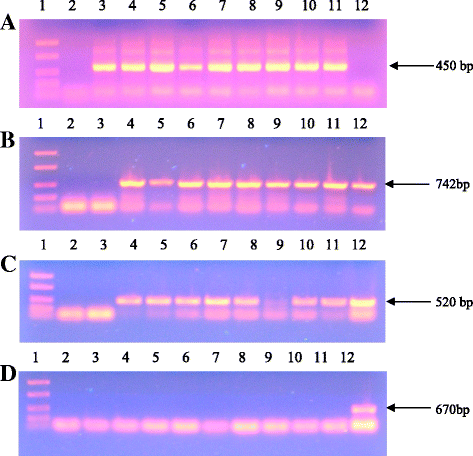
根癌土壤杆菌菌株AGL0 [31,携带二元载体质粒pBI121mod-P450鳞状细胞癌用于番茄转化。质粒pBI121mod-P450的T-DNA鳞状细胞癌包含CYP11A1的cDNA,编码细胞色素P450鳞状细胞癌由花椰菜花叶病毒35S启动子(CaMV 35 s),以及新霉素磷酸II(nptII)基因,其赋予卡那霉素抗性为推定的转化体的选择(图1).的质粒pBI121mod-P450鳞状细胞癌引入一种.农杆菌用冻融法测定AGL0菌株[32].
农杆菌属,番茄介导转化
以10 ~ 12日龄的番茄幼苗带叶柄的子叶为外植体进行转化。共培养前,将子叶外植体在含2 mg/l玉米素和0.1 mg/l吲哚-3-乙酸(IAA)的琼脂凝固MS培养基上预培养3天,外植体的背面与培养基接触。这种激素处理诱导的子叶再生频率最高番茄栽培。Rekordsmen [33].
根癌土壤杆菌AGL0窝藏pBI121mod-P450鳞状细胞癌在容量为250毫升的锥形玻璃烧瓶中,在28°C 50毫升的YEB液体培养基中培养过夜[34含25毫克/升利福平和50mg / l卡那霉素在旋转振荡器(150rpm)下。根癌土壤杆菌因吸毒过量而被重悬600= 0.6-0.7用MS液体培养基。将预培养的外植体浸泡在上述菌悬液中20分钟,用无菌滤纸吸干,转移到含有琼脂凝固MS培养基的培养皿上,表面放置滤纸盘。共培养16℃,避光72 h。共培养后,用添加300 mg/l timentin的MS液体培养基冲洗外植体,冲洗5次,去除细菌过度生长。然后在含2 mg/l玉米素、0.1 mg/l IAA、25 mg/l卡那霉素和300 mg/l timentin的琼脂凝固MS培养基上进行愈伤组织诱导。外植体每15天传代至新鲜培养基。在选择培养基中存活的外植体从其切割端产生愈伤组织。愈伤组织培养于300 cm3.含介质芽再生玻璃培养容器(琼脂固化的补充有2毫克/升玉米素,0.1毫克/升IAA,25 MS培养基毫克/升卡那霉素和150mg / l的特美汀)。当再生的卡那霉素抗性枝条约1.5厘米长,它们从愈伤组织分离,并转移至生根培养基(半强度琼脂固化的MS培养基含有0.2mg / l吲哚-3-丁酸和100mg / l卡那霉素).番茄的植根独立的转基因细胞系无性乘以在体外和适于土壤。转基因和非转基因番茄植物中的塑料盆装满土壤消毒中生长,在标准农业条件(22-25℃白天温度和18-19℃的夜间温度,湿度60-70%,2500照明LX).植物是由形成于成人植物侧枝的嫁接繁殖。
DNA / RNA提取,PCR分析和其他分子遗传技术
根据Edwards等人的研究,从推定转化子和野生型番茄植株的叶片中分离出了总基因组DNA [35],再用饱和酚萃取。为确定分离的DNA用于PCR分析的质量,对其进行序列分析Tom52从番茄中扩增出肌动蛋白基因(NCBI, U60482)。对选择性(nptII)及目标(CYP11A1)基因,以及毒力基因根癌土壤杆菌(VIRB).引物序列、PCR条件和扩增产物的预期大小见附加文件2.该PCR反应在含有2.5微升10X PCR缓冲液,0.5微升10毫摩尔dNTP的,在10 QM 1微升正向和反向引物,1微升5Uμl的25微升体积中进行−1Taq聚合酶,去离子水17微升和DNA模板的2微升(〜60毫微克)。PCR产物在MJ迷你个人热循环仪(Bio-Rad公司)进行。将产物在1.0%在电泳系统中分离的琼脂糖凝胶(Amersham公司电泳电源-EPS 301 + Hoefer说HE 33赠送卧式潜艇单元)。
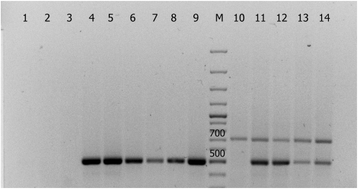
的表达CYP11A1采用RT-PCR技术(PCR +逆转录)对转基因番茄植株的cDNA进行检测。从植物监控室中生长的5周大的植物叶片中分离总细胞RNA,根据[36或使用试剂盒总RNA纯化试剂盒(耶拿生物科学)。使用Maxima First Strand cDNA Synthesis Kit for RT-qPCR (Thermo Scientific)在RNA模板上合成cDNA。用合成的cDNA进行PCR,引物与目的基因序列互补CYP11A1,预计PCR片段大小为520 bp [37].编码番茄大核糖体亚基的基因片段(709 bp) (25S rRNA) [38]被用作“管家”基因。从原Rekordsmen品种中分离的cDNA作为阴性对照。采用标准的分子克隆程序构建重组质粒[34].
透射电子显微镜
野生型烟草植物的种子(烟草简历。小哈瓦那SR1)和两个T4代转基因纯合烟草株系(TR-2和TR-7)CYP11A1的cDNA,编码细胞色素P450鳞状细胞癌从牛肾上腺皮质中分离,在MS基础培养基上无菌发芽[28]补充有3%(w/v)蔗糖和0.7%(W / V)琼脂上。从幼苗子叶的中间切片固定为溶解于0.1M索伦森氏磷酸盐缓冲液(pH 7.2)与1.5%蔗糖2.5%戊二醛(Merck公司,德国)24小时。然后将样品进行洗涤,在1%ОsО4(Sigma-Aldrich公司,美国)后固定,脱水增加浓度(30,50,70,96,和100%)的乙醇和环氧丙烷(Fluka公司,德国)。根据标准程序,将样品包埋在EPON-812和的Araldite(默克,德国)的混合物中。用于TEM嵌入式样品用金刚石刀使用超微切片机LKB-V(LKB,Sweden)的切片,放置在聚乙烯醇缩甲醛涂覆的网格和染色醋酸铀和柠檬酸铅[39].用电子显微镜Н-500(日立,日本)对超薄切片进行检查和拍照。研究了叶肉细胞线粒体的超微结构。用Cell-A软件(Olympus, Japan)测定线粒体的平均横截面积。每次治疗至少对200个线粒体进行了评分。
转基因番茄植株抗旱性的研究
它包括两个阶段:研究样品对长期不灌溉的反应和调查恢复灌溉后植物的恢复。试验在玻璃箱条件下进行,无灌溉,白天高温(35-40℃),夜晚高温(14-16℃)。3 - 4个真叶发育阶段的植株在无灌溉条件下生长3周,分别在第7、14和21天记录生物指标。生物特征参数(株高;意味着增加;比较了转基因4号和7号品系的单株数(50株和100%),以及与亲本record man在相同条件下生长的单株数。样本量:品种记录者15株,转基因品系4号和7号T2代60株。
烟草和番茄叶片甾体组分的分离
将烟草和番茄叶片用液氮冷冻后进行冻干。用CHCl从0.1 g干植物材料中提取总脂3.-MeOH-H2O混合物(5:10:4)3次,每次4 ml。加入提取物,85℃旋转蒸发器干燥,默克公司(200 × 200 mm, 0.5 mm厚)硅胶60f254板在CHCl中TLC分离3.层系统(4:1)。用含茴香醛的试剂(0.5 ml茴香醛置于10 ml 98% H中)对一部分平板着色2所以4.,85毫升MeOH中,和5ml 96%H2所以4.).与胆固醇、孕烯醇酮和孕酮色谱流动相一致的区域被CHCl从平板的未着色部分划掉3.,并使用旋转蒸发器干燥。将干燥的残余物溶解在MeOH中。
转基因植物中孕酮含量的测定
有人进行了使用TLC法和免疫测定法的组合。孕酮酶免疫测定施加到从转基因烟草叶提取物和番茄植物,野生型植物,以及馏分,色谱迁移率,其下通过TLC与孕酮的色谱迁移率一致纯化,根据服务指令(的建议的试剂盒制造商),用于孕酮EIA试剂盒。所述试剂盒在生物有机化学,白俄罗斯国家科学院研究所开发的,旨在用于人血清中定量测定孕酮通过酶联免疫吸附测定。该试剂盒是麻烦由A.G. Pryadko提供。
结果
表达哺乳动物的转基因烟草植物的表型CYP11A1互补脱氧核糖核酸
加速增长和发展的T4产生表达哺乳动物转基因烟草植株的CYP11A1互补脱氧核糖核酸
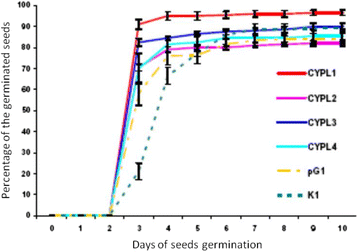
我们一直在继续研究CYP11A1转基因烟草我们之前描述过的植物[29].与前几代转基因株系CYPL1-CYPL4一样,T4和T5代植株的体质明显优于已处于早期发育阶段的对照植株(附加文件)3.).此外,正如我们前面对前几代[注意37],转基因烟草株系CYPLs比对照株系和转化株系pG1平均早2周开花。与对照和空载体植株相比,T4代转基因植株各株系的铃形成均提前至少一周(图1)。2).所述T4代(CYPL1-CYPL4)和对照植物(K1)和植物用空载体(PG1)的转基因植物的所有品系的种子按照方法中所述的方法发芽试验。的生理种子质量的种子萌芽,其表征种子快速和大约发芽一起(同时)的能力的活力这种指标进行了评价。发芽的能量第三天确定。有人指出,在第三天的所有行CYP11A1转基因植物已经萌芽70至种子91%(线条CYPL1-91%,CYPL2-82.5%,CYPL3-70.5%,CYPL4-70%),并且在控制变体(线K1和用空载体线路PG1)- 只有21%和58%,分别为(图3.).
桌子1总结了T4产生独立的转基因植物和对照植物的研究线的主要形态特征。呈现的数据表明的所有行CYP11A1转基因烟草植物从控制野生型和植物通过这样的重要的生理指标,作为植物高度,茎的直径,叶的大小,棉铃和重量的千个种子数用空载体转化的(表显著不同1).
表达哺乳动物的转基因烟草植物CYP11A1cDNA可抵抗真菌病原体的感染葡萄孢菌
表达的转基因烟草植株测试CYP11A1抗非特异性动物源性cDNA茄科病原体,真菌葡萄孢菌,在离体叶片上进行(图。4.),并通过计算叶子上一滴汁液中发芽孢子的数量。获得的结果在附加文件中给出4.结果表明,空白载体转基因对照和非转基因烟草株系的孢子萌发数的算术平均值为80 ~ 96%,而表达哺乳动物cDNA的转基因烟草株系的孢子萌发数的算术平均值为80 ~ 96%CYP11A1基因萌发孢子的数量要低得多(7 - 21%)。这些结果表明,从含有该基因的转基因植物中分离的蛋白质提取物可以抑制病原菌的生长。这也从耐药的生物测定结果中得到了证明葡萄孢属cynerea,通过对感染后10天植株叶片上坏死斑的大小和数量的分析,如图所示。4..在表达cDNA的烟草稳定转基因株系中CYP11A1结果表明,侵染后第10天,侵染部位在叶片上的平均面积约为对照植株的12倍。在某些情况下,坏死区域CYP11A1转基因叶片完全缺失。
透射电子显微镜(TEM)控制的子叶和CYP11A1转基因烟草植物及其线粒体的超微结构
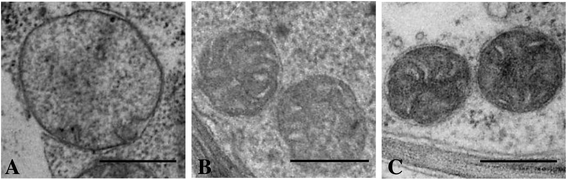
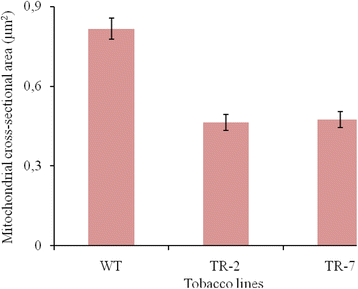
TEM结果显示在从野生型和转基因烟草植物的叶肉细胞的大小和线粒体的结构显著差异。在野生型植物,线粒体呈圆形或椭圆形。线粒体与双层膜,电子光矩阵和几个外围局部和无序嵴是清晰可见的(图5).野生型烟草叶肉细胞线粒体平均截面积为0 817 μm2(无花果。6.).不同于野生型植物,转基因烟草线TR-2和TR-7的线粒体的横截面面积不太1.8和1.7倍。有在转基因线之间的线粒体截面积没有显著差异表达CYP11A1互补脱氧核糖核酸。主要是分布均匀的圆形或细长的线粒体。它们的特征是电子密集的基质,以及大量形成良好和扩大的嵴,其中一些是相互平行的(图。5 b那c).
表达哺乳动物的转基因番茄植株的构建CYP11A1互补脱氧核糖核酸
番茄转换
研究人员进行了两项独立的实验,以产生含有该物质的转基因番茄植株CYP11A1互补脱氧核糖核酸。共使用460个预培养的外植体农杆菌属介导的转换。数字7.示出了从接种子叶外植体的愈伤组织形成和植株再生的不同阶段根癌土壤杆菌菌株AGL0携带pBI121mod-P450鳞状细胞癌质粒。转化2 ~ 3周后,外植体切边开始形成致密的淡绿色愈伤组织。7A).不产生愈伤组织的外植体弃用。在添加25mg /l卡那霉素的选择培养基上转化外植体的愈伤组织形成率为5.2%。从外植体中分离出生长旺盛的愈伤组织,在新鲜培养基上进行继代。愈伤组织培养6周后观察到再生芽(图。7B.).通过超过2月份选择的,获得了(图具有多个芽再生8卡那霉素抗性愈伤组织。7C.).取长1.5 cm的细长枝条,转移到添加100 mg/l卡那霉素的根诱导培养基上。所有独立的假定苗在1-2周内产生根(图。7D.).在离体无性繁殖条件下,番茄根苗适应了土壤环境。
转基因番茄植株的PCR分析
总基因组DNA从所有的卡那霉素抗性番茄植物的幼叶以及野生型(WT)番茄分离。为了评估分离的植物DNA用于PCR分析的适宜性,的序列Tom52扩增(图8A).用特异性引物从所有番茄转化子中均观察到742 bp的片段nptII基因,而在未转化的植物中未检测到相应的条带(图。8B.).在8株转基因植株中,发现有7株已将目的基因整合到茄属植物lycopersicumL.基因组(图8C).要排除的可能性农杆菌属利用PCR方法对转基因植株的总dna进行分析VIRB基因。污染的农杆菌属virB所分析的样品中没有检测到基因(图8D.).根据PCR分析结果,我们计算了转化效率,为1.5%。转化效率以含有选择基因和目的基因的独立转基因番茄株系占转化外植体总数的百分比来评估。
的存在CYP11A1采用RT-PCR (PCR with reverse transcription)技术对转基因番茄植株的cDNA表达进行检测(见方法)。结果如图所示。9.清楚地表明,所有表示的线的个体植物No.4和7号高效表达的哺乳动物CYP11A1的cDNA,并在第4号线这个异源编码序列的表达是比管线第7号(作为判断在泳道11-12&13-14多重PCR带的强度的比较)稍高。这或许可以表明的双插CYP11A1结果表明:转基因番茄4号株系的cDNA。
表达哺乳动物的转基因番茄植株的表型CYP11A1互补脱氧核糖核酸
在T3代转基因番茄植物中的表型的共同特征和具体特征(线4号和第7号)表达的哺乳动物CYP11A1互补脱氧核糖核酸
转基因番茄系(4号和7号)均含有哺乳动物基因组CYP11A1即在种子繁育稳定地传递的cDNA,已经揭示在与原来的西红柿品种Recordsmen比较在生长,发育和形成的水果发作和表型差异的一般模式。总体来说转基因株系是生成系统(花刷发育受损,低水果集)的发育受损。芽的部分都开花(附加文件后下跌5.),有的样品萼片大而不典型,有的样品雄蕊和雌蕊缺失。4号线和7号线在果实中形成的种子不同。7号株系的果实中有相当一部分是无核的或只有种子胚芽,而4号株系的果实有正常的种子形成6.).在转基因番茄系的植物的育性的降低可能是由于花药发育受损,而这又可能是(24R)-brassinosteroids量的减少的结果,正如我们在的情况下,先前识别CYP11A1转基因烟草植物[11.那12.那37].这两种番茄转基因株系的另一个共同特征是对干旱和脱水等非生物胁迫的抗性增强(见下一节)。
有趣的是,我们在CYP11A1在我们所获得的两个转基因番茄株系中,有一个株系(4号)的营养发育速度加快7.),而另一个(第7号)具有增强的免疫力的非生物和生物胁迫。在7号线的植物的特点是应力负荷什么已经可以从他们的叶子深绿色中可以看出,茎枝和大型叶片与波纹表面耐高(附加文件8.),特别是在营养季末的集约化生长(见表)2).
转基因番茄株系(7号和4号)均表达哺乳动物CYP11A1的cDNA,对干旱和长期脱水更具抗性与野生型品种相比Recordsmen
对照和转基因番茄植株在干旱和脱水条件下的生长表明,尽管缺乏水分,番茄植株在3周内仍在2-3厘米的高度上生长。7号株系植株生长最大,单株生长可达7 - 12 cm。对照品种Recordsmen和4号线部分株高3周保持在同一水平。所有研究对象的叶片和茎尖均有不同程度的萎蔫。试验第3周结束时,品种记录员和品系4号植株中枯萎植株数量最多,分别为33%和10%。7号系的植株对缺乏灌溉的抗性最强,15株中有3株轻微枯萎,但没有植株死亡(见表)3.).
因此,与对照品种相比,两种转基因株系均表现出较低的干旱暴露程度,并表现出较强的3周不灌溉抗性。大部分的植物转基因线超过Recordsmen的植物茎的生长在干旱期间:在植物的7号杆高度增长超过3厘米,在植物的行不,4 - 1.8厘米,而平均抑制植物的生长控制各种Recordsmen 0.9厘米(表3.).类似地,在恢复灌溉后的线号7和第4号中观察到更多的主动再生和增强生长。
ELISA法测定转基因烟草和番茄植株中孕酮的含量
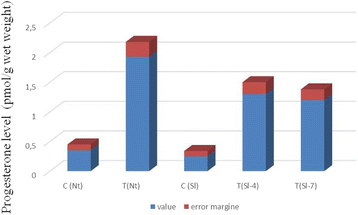
采用酶联免疫吸附法测定了对照、转基因烟草和番茄提取物中孕酮的相对含量。为了进行分析,我们选择了1个转基因烟草株系(TR-7)和2个独立的转基因番茄株系(4号和7号),均稳定地遗传和表达CYP11A1在大多数研究参数上,均与对照植株表现出明显的表型差异。由于植物中可能含有与黄体酮抗体发生交叉反应的甾体化合物,因此我们不仅在植物叶片总提取物中测定了甾体化合物的含量,而且在总提取物经过薄层色谱分离后,在色谱流动度与黄体酮相同的组分中也测定了甾体化合物的含量。结果表明,在两种情况下,转基因植株叶片中黄体酮含量均比野生型植株叶片中黄体酮含量高3-5倍。10.).
讨论
为了更全面地比较植物和动物的甾体生成系统,我们构建并分析了转基因烟草和番茄植株表达CYP11A1的cDNA编码牛细胞色素P450鳞状细胞癌.通过连续5代表达哺乳动物异种序列的转基因烟草植株CYP11A1的cDNA具有鲜明,清晰可辨的表型的特征在于营养发育的降低周期(早期开花和棉桃成熟),放大的生物量和提高生产率(种子的数量和质量),并且还更大的阻力生物胁迫:的积极作用CYP11A1上转基因烟草植物的抗性的感染由植物病原真菌葡萄孢菌第一次被发现转基因线粒体的细微变化烟草植物表达哺乳动物CYP11A1通过透射电镜观察到cDNA的表达,表明细胞色素P450已成功加入鳞状细胞癌进入植物线粒体,类似于先前体外实验所显示的情况[40].这是第一个直接证据表明,细胞色素P450依赖性单加氧酶可纳入活植物细胞成功地在它运行的能力的线粒体。
连同在哺乳动物和植物线粒体P450依赖性单加氧酶的电子传递链的深刻关联其他作者以前发表的数据(负责蛋白 - 蛋白相互作用的氨基酸残基在植物MFDXs和发展结果导向管理蛋白[被完全保守21那22那23那24]),结果支持了我们之前关于植物和动物甾体系统功能相容性的发现[37并表明在植物中存在除油菜素内酯外的另一种类固醇调节系统。此外,我们之前的研究结果表明,在转基因烟草植株表达的种子中24r -油菜素内酯水平下降CYP11A1基因[37表明油菜素内酯和黄体酮激素系统在某些情况下可以作为拮抗剂,对植物细胞的活性和植物的生理过程产生相反的作用。
虽然目前在植物中唯一已知的过程包括线粒体铁氧还蛋白(AtMFDX1和AtMFDX2)和线粒体铁氧还蛋白还原酶(AtMFDR)是维生素B8(生物素)合成的最后阶段[22,这些数据C.阿尔班的组及植物线粒体蛋白质组分析[41的MFDX1、MFDX2和MFDR拟南芥和马铃薯都定位于植物线粒体并发挥作用,因此能够维持线粒体P450反应。因此,我们首次证明了动植物甾体激素生物合成系统的单个组分在体内相互兼容并协同工作,显著改善了生长发育过程,甚至植物免疫过程。这些结果与其他作者早期和最近关于外源孕酮对植物生理和生殖的影响的研究是一致的。特别是,这些研究表明,黄体酮即使在非常低的浓度下也能促进烟草花粉的成熟和花粉管的生长[42,诱导小麦开花和生殖发育拟南芥在光明中加速,在黑暗中成长拟南芥种子(10.,促进…的成长韩-赤霉素(s)突变的豌豆株系[9.,刺激鹰嘴豆中抗氧化酶过氧化氢酶的活性[43],抑制许多病原和腐生细菌和真菌,如生长黑根霉[9.那10.].
值得注意的是,许多动物类固醇激素(孕烯醇酮硫酸盐、孕酮、17-羟基孕酮、16-脱氢孕酮、雄烯二酮)和受体介导动物细胞中的线粒体胆固醇摄取,最近也在许多不同的植物物种中发现了[9.那26那27)(附加文件1).如可从反应的前述方案中可以看出,所有这些类固醇激素化合物的生物合成可以很容易地从经由孕烯醇酮,孕激素为关键类固醇调节器的四个主要植物甾醇(β谷甾醇,豆甾醇,菜油甾醇和胆甾醇)衍生的。从以前的数据可知,黄体酮在许多不同的植物中发现(拟南芥,西红柿,土豆,大米,豌豆,苹果种子,Holarrhena那strophanthus.那夹竹桃那洋地黄那Punica那Erysimum那Haplopappus等)(9.那44那45来自不同家庭(夹竹桃科那Scrophullareaceae那千屈菜科那十字花科那Astraceae等),证明它可能存在于所有植物中。结合所有的数据和事实,膜孕酮结合蛋白(MSBP1),这是一个动物膜孕酮结合蛋白的同源物,在拟南芥[46],黄体酮可以被认为是一种新的真正的激素,在植物细胞中形成一个新颖的核心,但非常古老的由它的进化起源,在植物中调控类固醇系统。孕酮作为细胞膜受体与MSBP1结合,不仅参与调控植物的生长发育,还可能对各种外界刺激如不同的非生物和生物胁迫做出快速反应。
与此同时,甚至我们的纯生物信息学分析也表明,植物和动物的激素“孕酮”系统有重要的差异。尽管植物和动物都有以膜类固醇结合蛋白(MSBP)家族为代表的膜孕酮受体[46或MAPR(膜相关孕酮受体),具有更强结合能力和特异性的孕酮核受体仅存在于动物中。虽然可能是雌激素受体(雌激素受体,ER)的同源物,进化上最早的哺乳动物核类固醇激素受体,至少存在于一些植物中,如茄属植物glaucophyllum[47].
结论
在即使在植物界和动物界的类固醇激素的生物合成系统中最具体组分的体内兼容性证实首次。细胞色素CYP11A1(P450鳞状细胞癌),动物类固醇的一种关键酶,可以在转基因(表达哺乳动物起作用CYP11A1互补脱氧核糖核酸)CYP11A1烟草和番茄加速了植物的生长发育过程,增强了植物对生物和非生物胁迫的抵抗力。提出并证实了上述哺乳动物转基因植物特殊表型的形成CYP11A1cDNA是由于黄体酮生物合成的增加而产生的,黄体酮可以被认为是一种非常古老的植物细胞的生物调节剂,是动植物共有的第一种激素。研究结果表明,植物和动物的甾体化合物生物合成和甾体调节系统具有一定的相似性(真正的基本亲缘关系),可用于农业和药理学的新生物技术。
缩写
- 5αR:
-
5α还原酶
- 广告:
-
皮质铁氧还蛋白
- 美国存托凭证:
-
皮质铁氧还蛋白还原酶
- 中科:
-
细胞质硫酸转移酶
- CYP:
-
细胞色素P450
- DET2:
-
De-etiolated 2
- 设计马力:
-
Dihydroprogesterone
- HSD:
-
羟类固醇脱氢酶
- MFDR:
-
植物线粒体型铁还蛋白还原酶
- MFDX:
-
植物线粒体型铁氧还原蛋白
- P450.鳞状细胞癌:
-
P450侧链裂解
- pCaMV 35 s:
-
花椰菜花叶病毒35S启动子
- 透射电镜:
-
透射电子显微镜法
- WT:
-
野生型
参考文献
- 1。
油菜素内酯:植物生长发育的重要调控因子。安。启植物杂志。植物学报1998;49:427-51。
- 2.
Khripach VA,Zhabinskii VN,德格鲁特A.油菜素内酯:一类新的植物激素/圣地亚哥:学术出版社。1999年263页。
- 3.
植物类固醇激素,油菜素内酯:它们的合成/代谢,运输,感知和反应的分子方面的最新进展。植物生理学报。2001;42(2):114-20。
- 4.
陈志强,陈志强,陈志强,等。植物甾体激素信号转导的分子机制。《细胞发展生物学》2005;21:177-201。
- 5.
Clouse SD。Brassinosteroids。拟南芥的书。2011;9:e0151。
- 6.
Clouse SD。拟南芥突变体揭示了在植物发育固醇多个角色。植物细胞。2002; 14(9):1995- 2000年。
- 7.
植物甾体生成-黄体酮和其他孕烷衍生物的生物合成和转化。类固醇。2015;103:145-52。
- 8。
Geuns J.类固醇激素和植物生长和发育。植物化学。1978; 17(1):1-14。
- 9。
黄体酮:它在植物中的发生及其在植物生长中的作用。植物化学,2007;68(12):1664 - 73。
- 10。
Janeczko A.存在和孕激素的活性的植物王国。类固醇。2012; 77(3):169-73。
- 11.
吴勇,王志强,王志强。一个依赖油菜素的拟南芥突变体在细胞伸长中受阻。植物细胞。1998;10(2):219 - 30。
- 12.
Choe S, Dilkes BP, Fujioka S, Takatsuto S, Sakurai A, Feldmann KA。拟南芥的DWF4基因编码一个细胞色素P450,介导油菜素内酯生物合成中的多个22 -羟基化步骤。植物细胞。1998;10(2):231 - 43。
- 13.
黄洋(5)-3 - β -羟类固醇脱氢酶。类固醇代谢中的多功能酶?足底。1999;209(4):478 - 86。
- 14.
陈志强,张志强,张志强,等。细胞色素P450的多样性对植物代谢的影响。生物医药学报。2012;35(6):824-32。
- 15.
尼尔森d,Werck-DA Reichhart。植物进化的P450为中心的视图。植物杂志2011; 66(1):194-211。
- 16.
p450基因在植物类固醇代谢中的功能和进化。植物化学。2009;70(17 - 18):1918 - 29。
- 17.
李江,Nagpal P Vitart V, McMorris TC, Chory农协。油菜素内酯在拟南芥光依赖发育中的作用。科学。1996;272(5260):398 - 401。
- 18.
李建军,李建军,赵安,等。植物类固醇受体5 -还原酶(类固醇受体5 -还原酶)功能的保护。中国科学院院刊1997;94(8):3554-9。
- 19。
植物与类固醇代谢相似的新证据:malacoxylon的5a-还原酶活性。Endocrynology。2003;144(1):220 - 9。
- 20.
王志强,王志强,王志强,等。毛地黄中5 - 3 β羟类固醇脱氢酶(3 β HSD)的研究进展。重组酶的异种表达与特性。足底医学。2007;73(7):704 - 10。
- 21.
王志强,王志强,王志强,等。植物P450单加氧酶电子传递组分的分子多样性。Biosci前面。2004;9:1587 - 97。
- 22。
Picciocchi A, Douce R, Alban C.植物生物素合成酶反应。主要线粒体辅助蛋白成分的鉴定与特性。中国生物医学工程学报。2003;27(4):491 - 497。
- 23。
田志刚,田志刚,田志刚。拟南芥线粒体铁氧还蛋白和铁氧还蛋白还原酶的鉴定和分子生物学特性研究。植物学报。2003;52(4):817-30。
- 24.
Shematorova EK, Slovokhotov IY, Khaliluev MR, Berdichevets IN, Baranova EN, Babak OG, Shpakovski DG, Spivak SG, Shpakovski GV。线粒体可能是植物中类固醇生物合成的起始阶段。j .压力杂志。生物化学家。2014;10(4):85 - 97。
- 25.
植物中的哺乳动物性激素。组织生物学和细胞生物学。2005年,43(2):71 - 9。
- 26.
应用超高效液相色谱-质谱联用技术对植物中几种哺乳动物类固醇激素进行鉴定和定量。植物生长规律。2009;28(2):125-36。
- 27.
Pauli GF, Friesen GB, Gоdecke T, Farnsworth NR, Glodny B.两种高等植物中孕酮和相关动物类固醇的发生。中国科学(d辑:地球科学)2010;
- 28.
的Murashige T,Skoog的FA。快速增长和生物检测烟草组织培养订正中期。physiol植物。1962; 15(3):473-97。
- 29.
Spivak SG, Berdichevets IN, Yarmolinsky DG, Maneshina TV, Shpakovski GV, Kartel NA。表达CYP11A1基因编码细胞色素P450转基因烟草植株的构建及特性研究鳞状细胞癌.遗传学报。2009;45(9):1067-73。
- 30.
Hellens RP, Edwards EA, Leyland NR, Bean S, Mullineaux PM。农杆菌介导的植物转化的通用和灵活的二元钛载体。植物学报。2000;42(6):819-32。
- 31.
Lazo GR, Stein PA, Ludwig RAADNA。农杆菌转化能力强的拟南芥基因组文库。自然生物技术。1991;9(10):963 - 7。
- 32.
HöfgenR,感受态细胞的农杆菌转化Willmitzer L.存储。核酸RES。1988; 16(20):9877。
- 33.
Khaliluev MR, Bogoutdinova LR, Baranova GB, Baranova EN, Kharchenko PN, Dolgov SV。基因型、外植体类型和培养基成分对番茄离体愈伤组织诱导和茎部器官发生的影响医学杂志。2014;41(6):512 - 21。
- 34。
SAMBROOKĴ,弗里奇FF,马尼亚蒂斯T.分子克隆:实验室手册。纽约:冷泉港实验室。按;1989年。
- 35。
用于PCR分析的植物基因组DNA的简单快速制备方法。核酸学报1991;19(6):1349。
- 36.
Chomczynski P,通过酸性硫氰酸胍 - 苯酚 - 氯仿抽提分离RNA的萨基N.单步方法。肛门生物化学。1987; 162(1):156-9。
- 37.
斯皮瓦克SG,Berdichevets IN,Litvinovskaya RP,德劳奇SV,木床NA,Shpakovski GV。类固醇代谢的在转基因烟草植物轴承细胞色素P450的cDNA的CYP11A1某些特性鳞状细胞癌来自牛的肾上腺皮质。生物化学学报。2010;36(2):224-32。
- 38.
Perry KL, Palukaitis P. Mol gen genet。番茄核糖体DNA的转录与基因间间隔体的组织。中国科学(d辑:地球科学)1990;221(1):103-12。
- 39.
雷诺兹。在电子显微镜下使用高pH的柠檬酸铅作为电子不透明染色剂。J Cell Biol. 1963;17(1): 208-12。
- 40.
Luzikov VN, Novikova LA, Spiridonova VA, Isaeva LV, Whelan J, Hugosson M, Glazer E.外源线粒体设计:进口牛细胞色素P-450鳞状细胞癌植物线粒体的前体。生物化学Mosc。1994;59(7):1098 - 101。
- 41.
Salvato F, Havelund JF, Chen M, Rao RS, Rogowska-Wrzesinska A, Jensen ON, Gang DR, Thelen JJ, Møller IM。马铃薯块茎线粒体蛋白质组。植物杂志。2014;164(2):637 - 53年。
- 42.
Ylstra B, Touraev A, Brinkmann AO, Heberle-Bors E, Tunen A.甾醇激素促进离体成熟烟草花粉萌发和试管生长。植物杂志。1995;107(2):639 - 43。
- 43.
哺乳动物性激素刺激抗氧化系统并促进鹰嘴豆植物的生长。植物学报。2011;33:1011-7。
- 44.
从石榴中提取孕烯醇酮的研究。植物化学,1969;8(12):2317 - 9。
- 45.
王志强,王志强,王志强,等。毛地黄体细胞胚中妊娠烷衍生物的生物合成。植物化学,1997;46(3):507 - 13所示。
- 46。
杨晓华,徐志华,薛宏文。拟南芥膜类固醇结合蛋白1参与抑制细胞伸长。植物细胞。2005;17(1):116 - 31所示。
- 47。
李志刚,李志刚,李志刚,等。青叶茄中雌激素和雌激素受体样蛋白的研究进展。BBRC。2001年,289(5):1175 - 9。
确认
使用由IBCHсore设施(CKP IBCH,由俄罗斯教育部和科学,授予RFMEFI62117X0018支持)提供的设备进行实验部分进行。作者还感谢A.G. Pryadko博士(IBCH,白俄罗斯NAS)为我们提供了孕酮EIA试剂盒。
资金
该项目由俄罗斯基础研究基金会(项目编号:10-04-90051和16-54-00227)和白俄罗斯共和国基础研究基金会(项目编号:B10R-199和B16R-129)资助。文章的发表费用由俄罗斯基础研究基金会资助(项目编号16-54-00227)。
数据和材料的可用性
所有相关的数据支持的结果可以手稿和其他文件中找到。
关于这个补充
本文已作为BMC植物生物学2017年第17卷增编1:PlantGen 2017节选文章。该补充的全部内容可在网上找到//www.cinefiend.com/articles/supplements/volume-17-supplement-1.
作者信息
从属关系
贡献
GVS, SGS和EKS构思并设计了实验。INB、OGB、SVK、IYuS、ENB、MRK和EKS进行实验。GVS、SGS、OGB、AVK、AVA、DGS、ENB、MRK进行数据分析。OGB, MRK, SGS, EKS和GVS起草了手稿。EKS和GVS对手稿进行了修改。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。GVS、SGS和INB持有俄罗斯联邦专利(No. 2237717,发布日期:2004年10月10日,优先级- 2002年12月20日起;Byull。Izobret。那20.04, no. 10) and Republic of Belarus (No. 9201, issued 25.01.2007, priority – from 30.12.2002) on recombinant plasmids and methods for obtainingCYP11A1转基因植物,提高生产力和抗真菌植物病原。
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
额外的文件1:
植物中已检测到的哺乳动物类固醇激素的生物合成方案。(医生74 kb)
额外的文件2:
引物的描述中,扩增和产物长度为PCR分析的条件。(DOC 34 KB)
额外的文件3:
控制(1,HIGHT - 15厘米)和转基因(图2,HIGHT - 71厘米)在现场条件下生长的一个个月后的烟草植物。(DOC 157 KB)
额外的文件4:
转基因烟草植物的杀菌性能的评估。(DOC 28 KB)
额外的文件5:
复总状花序,有大的萼片和不发达的雌蕊和转基因系7号的雄蕊。(医生237 kb)
额外的文件6:
转4号和7号转基因株系的果实大小和种子形成。(医生633 kb)
额外的文件7:
成长阶段CYP11A1转基因番茄植株在九月的第二个十年。在前台 - 线4号,随后由控制各种Recordsmen(远远落后),在左侧 - 线号7。注意当然加速在4号线个体发育阶段(作为一个结果 - 的一些早熟水果和黄叶)。7号线的特征在于,绿化和在营养赛季结束密集生长。(DOC 107 KB)
额外的文件8:
产品的具体特点CYP11A1转基因系的7号:叶的深绿色和茎枝,大叶片与波纹表面,在水果种子的低量,提高的抗疾病。(DOC 72 KB)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Shpakovski, g.v., Spivak, s.g., Berdichevets, I.N.et al。植物动物类固醇可以起到的关键酶增强自身的免疫力,加速成长和发展的过程。BMC植物杂志17,189(2017)。https://doi.org/10.1186/s12870-017-1123-2
关键字
- 转基因植物
- 细胞色素P450SCC.(CYP11A1)
- 烟草
- 葡萄孢菌
- 黄体激素
- 线粒体
- 番茄
- 非生物胁迫
- 类固醇荷尔蒙