抽象的
背景
糖苹果 (番荔枝属squamosaL.)是一种很受欢迎的水果,具有很高的药用和营养特性,在南亚和美洲的热带地区广泛种植。畸形花是造成糖苹果产量下降的主要原因。然而,关于正常的糖苹果花和畸形的糖苹果花之间的差异的信息很少。
结果
为了综合了解糖苹果的正常和畸形花的差异,正常和畸形花的cDNA文库独立制备,用于illumina测序。该数据共产生了70,189,896个读数,该读数被整合并组装成55,097个unigenes,平均长度为783 bp。鉴定了大量差异表达基因(DEGS)。在这些DEG中,包括701个花发育相关的转录因子编码基因。此外,还鉴定了大量的开花和激素相关的次数,并且大多数这些基因在畸形花中表达下调。使用定量PCR验证了15种所选基因的表达水平。测量了几种内源激素的含量。与普通花相比,畸形的花朵显示出较低的内源激素水平。
结论
我们研究中的表达数据以及激素水平将作为调查糖苹果中花器官发育的调控机制的综合资源。
背景
糖苹果 (番荔枝属squamosaL.)的成员annonaceae.是一种重要的药用植物,广泛分布于南亚热带和美洲[1].除了具有药用价值外,糖苹果还可用于果汁、果冻和果盘[2].由于其药用和营养特性,白糖苹果在中国是一种受欢迎的热带水果[3.].糖苹果开花是一个复杂的过程,受各种环境因素的调节,如不适当的梢态、低温或短日照条件[4.].开花畸形是造成栽培糖苹果可育果率低的主要原因。然而,有关该属花器官发育相关基因的现有信息粮食供给非常稀缺。
开花是植物生命周期中一个重要的发育过程[5.].高等植物要成功繁殖,就需要从营养生长到生殖发育的协调过渡[6.].在模型植物中拟南芥,花器官身份的规范由大量的花生基因进行调节,其中大部分是编码转录因子。基于表型拟南芥突变体,建立了经典的ABC模型[7.].根据该模型,大部分与花器官识别相关的基因可分为A、B和c三类,其中萼片由A类基因识别;花瓣被鉴定为A类和B类基因;雄蕊分为B类基因和C类基因;和心皮是由C类基因识别的[8.].最近,ABC模型由基因(e)延长和修改,这对于所有类型的花卉器官的规范至关重要[9.].同源基因的功能在不同的物种中高度保守,这使得我们能够分析和识别与糖苹果花发育相关的潜在基因。
各种环境和内源性信号与在花粉形成期间的生物化学和细胞过程阵列相关[10].在这些信号中,植物激素是参与花的转变、开花和花器官发育的内源性化合物[11].几种古典植物激素,如胃纤维素(气体),植物素,细胞质素(CKS),乙烯,脱落酸(ABA),茉莉酸盐(Jas),水杨酸(SA)和芸苔类固醇(BRS),并在开花时间内致意途径[11].天然气是一类植物激素,不仅可以诱导到开花的过渡,还可以控制开花时间[12].GAs在植物转变中的作用反映了其通过della介导途径作为整合者的公认功能[13].气体通过触发一系列花卉积分器编码基因的表达来促进开花,包括constans过表达抑制因子1那叶子和开花轨迹T(在花序和花分生组织中[14那15].Auxins,另一种具有花卉归解信号传导作用的古典激素,被报告为胚胎和后后发育的调节因子。内源性生长素含量和开花时间之间存在密切相关[16].一些蛋白,如translocate PROMOTER REGION, SUPPRESSOR OF AUXIN RESISTANCE3和HASTY,参与了生长素反应和开花时间控制[17].CKS与助体素一起调节分裂周期和公司稳态,并可促进花卉过渡[18].在拟南芥,外源ck的应用加速开花,尽管这背后的分子机制很大程度上是未知的[19].
因此,有关该属花的起源和分化的分子基础资料有限粮食供给.在没有参考基因组的情况下,从头测序是一种有效的方法来鉴定大多数树木的候选基因,包括甜瓜、荔枝和中国樱桃[20.那21那22].在我们的研究中,构建了两个独立的cDNA文库,一个是正常的花,一个是畸形的糖苹果花,用于Illumina RNA测序(RNA-seq)。通过对转录组序列的注释,可以对糖苹果花器官发育相关的潜在基因进行鉴定和分析。
方法
植物材料和取样
在我们的研究中,10岁的成年树答:squamosa简历。‘Bendi’种植面积为4 × 4 m,按要求进行滴灌和施肥。树木的位置为中国广东省湛江市岭南师范大学野外实验站。开放前的花分别采自正常花和畸形花。所有花标本立即在液氮中冷冻,并在−80°C下保存,以备进一步研究。
cDNA文库制备和转录组分析的illumina测序
总RNA提取使用TRIzol试剂盒根据制造商的方案(Promega,北京,中国)。用RNase-free DNase I (TaKaRa,中国大连)去除残留的DNA污染。RNA质量通过无rnase琼脂糖凝胶电泳验证,总RNA浓度使用2100 Bioanalyzer (Agilent Technologies, Santa Clara, CA, USA)在260 nm和280 nm处测量。260 nm/280 nm比率在1.8和2.0之间的RNA样本用于后续分析。每个cDNA文库由三个独立的复制样品混合构建。正常花的库命名为“NF”,畸形花的库命名为“MF”。利用Gene Denovo公司(Gene Denovo, Guangzhou, China)的Illumina HiSeq™2500平台,将这两个文库用于转录组测序的比较分析。原始reads以配对端格式生成,NF和MF转录组数据集存储在GenBank Short Read Archive中,登录号为SRA508784。
DE NOVO集装和illumina测序的功能注释
过滤并移除低质量读取(具有超过5%的未知基础)和适配器序列,然后使用Trinity软件组装清洁读取以产生独特的共识折叠[23].用序列聚类软件计算所有的contigs,并将最长序列定义为unigenes。将组装的糖苹果单基因与多个蛋白质数据库进行比对,如NCBI Nr蛋白(http://www.ncbi.nlm.nih.gov)、Swiss-Prot蛋白(http://www.expasy.ch/sprot),基因和基因组(Kegg)途径的京都百科全书(http://www.genome.jp/kegg.)和同源组簇(COG) (http://www.ncbi.nlm.nih.gov/COG),使用e值<0.00001的BLASTX算法。在unigene注释方面,利用Blast2GO程序生成unigenes的基因本体(GO)注释,并利用BLAST算法对KEGG数据库(http://www.genome.jp/kegg/)用于分析代谢过程中的蛋白质产物及细胞过程中的相关基因功能[24].
数字基因表达(DGE)标签的分析和映射
为了映射DGE标签,对原始数据进行过滤,以去除低质量标签(序列中有许多未知的' N ')、空标签(序列中只包含适配器)和只有一个副本号的标签(序列中的序列错误)。对于注释,包含CATG的清洁标签和21 bp的标签序列被映射到我们的转录组参考数据库。最初,映射到多个基因的标签被过滤掉了。然后,将剩余的标签作为无歧义标签进行基因表达分析。计算每个基因的明确标签的数量,然后归一化到每百万干净标签的转录本数量。利用NF和MF之间的差异表达标签进行进一步分析和作图。
差异表达基因(DEGs)鉴定
使用对准软件Bowtie 0.12.8,用每个UNIGENE复杂地映射到转录组的读数(https://sourceforge.net/projects/bowtie-bio/files/bowtie/0.12.8/).为了计算unigene表达式,对每个unigene的映射读数进行计数,并将其标准化为每kb /百万读(RPKM)值。要确定显著差异,错误发现率< 0.001和log的绝对值2比率> 1被设定为阈值。使用edger包计算两种花样之间的°[25].根据先前的报告方法进行两种花样之间的DEGs的GO和KEGG富集分析[26].
定量实时PCR(QRT-PCR)验证
从使用用于测序的相同样品中提取总RNA。总共,每个样品的3μgRNA用于逆转录。使用Reveraid First Strand cDNA合成套件合成cDNA(Thermo Scientific。中国上海)。使用SYBR预混件(Takara,大连,中国)和ABI棱镜7700DNA序列检测系统(上海,中国)的ABI棱镜7700序列检测系统进行QRT-PCR。来自“NF”和“MF”的三个独立的cDNA样品用于QRT-PCR验证。使用底漆总理5软件(Paro Alto,CA,USA)设计了底漆序列。糖苹果肌动蛋白基因用作基于比较周期阈值的相对折叠差异的内标(2-ΔΔCT.)的值。然后,ddH2O作为无模板控制。qRT-PCR程序如下:cDNA稀释1/10 μL2O添加到5 μL的2× SYBR®Green buffer中,每个引物的浓度为0.1 μM, H2O至10μl的最终体积。反应如下:50℃持续2分钟,95℃10分钟,然后在96℃下为30℃,56℃,30°C为30℃,30°C为96℃。光学反应板[27].每个real-time PCR反应进行3次。
各种激素的测量
对于外源激素含量分析,收获来自正常和畸形糖苹果花的独立样品,立即在液氮中冷冻并在-80℃下储存以进一步提取。使用焦点GC-DSQII(Thermo Fisher Scientific Inc.,Austin,TX,USA)确定外源性吲哚-3-乙酸(IAA)含量如前所述[28].内源性GA是使用前面描述的纳米lc - esi - q - tof - ms分析方法测定的[29].此外,使用Kasote等人描述的UFLC-MS / MS系统检测ABA和ZEATIN核糖苷(ZRS)。[30.].
统计分析
使用具有Tukeel软件的Tukey Rese的单向分析来计算不同样本之间的显着差异(以α= 0.01)在Excel软件中的差异。为三个生物重复进行所有表达分析。所有报告的值都表示三个重复的平均值,数据表示为平均值或减去标准偏差(平均值±SD)。
结果
测序,de novo装配和序列注释
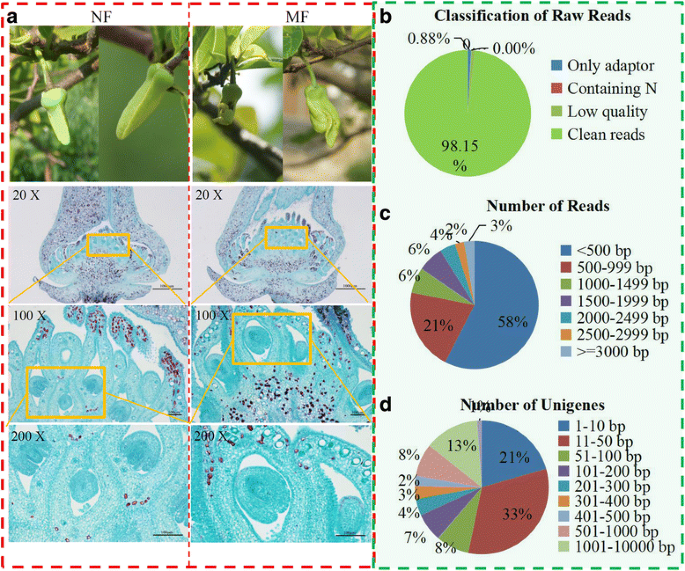
获取参考转录组答:squamosa利用正常花和畸形花的RNA样本,分别构建了两个独立的RNA-seq文库。正常花和畸形花的表型特征如图所示。1a.畸形花中花瓣的分化和发育是不规则的。与同时期的正常花相比,畸形花的胚珠发育终止发生在囊胚形成之前。畸形花中未见雌配子。
在我们的研究中,获得了大量的原始reads,包括98.15%的clean reads, 0.88%的仅适配器reads和0.97%的含n reads(图3)。1 b).共有70,189,896名读数被整合并组装成55,097个unigenes,平均长度为783 bp。所获得的读取的详细信息列于其他文件中1.糖苹果中的清洁读取和unigenes的尺寸分布如图2所示。1 c和d.对于clean reads, 3%的reads长度为>3000 bp,大部分(58%)的reads长度小于500 bp。只有1%的unigenes长度为> ~ 10000 bp,大部分unigenes长度在11 ~ 50 bp之间。
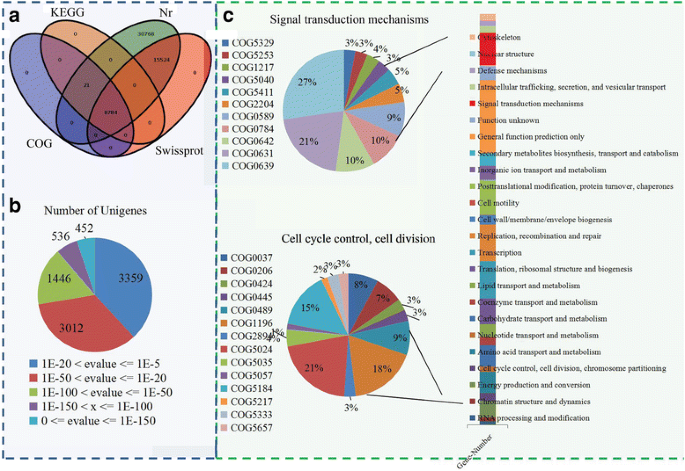
使用基于BLASTX算法的软件,对Nr、SwissProt、KEGG和COG等数据库进行unigenes的标注。在Nr数据库中共鉴定出55097条unigenes, 24308条unigenes与SwissProt数据库中已知蛋白具有显著相似性,COG和KEGG数据库中根据序列同源性分别注释了8805条unigenes(图)。2).在所有四个数据库中,大约有8784个unigenes与一个同源物相匹配。经注释的unigenes的e值分布如图所示。2 b.
在COG分类中,13548个unigenes被分为25个功能分类。最大项“仅通用功能预测”包含2415个unigenes。“复制、重组和修复”、“细胞壁/膜/包膜”、“翻译后修饰”和“信号转导机制”等词中有很大比例的unigenes。此外,只有9个unigenes被归类为“细胞运动性”,2个unigenes被归类为“核结构”。此外,我们还详细分析了与花发育相关的两个COG术语“信号转导机制”和“细胞周期控制,细胞分裂”。2摄氏度).
Go和Kegg unigenes的分类
在糖苹果中,大部分unigenes可被划分为46个功能项,分别属于氧化石墨烯(GO)的生物过程、细胞成分和分子功能三类。在生物过程中,“代谢过程”(6128个unigenes)和“细胞过程”(5721个unigenes)是主导术语;在细胞组分中,占主导地位的有“细胞”(6377个unigenes)、“细胞部分”(6227个unigenes)和“细胞器”(6128个unigenes);在分子功能方面,大量的unigenes与“代谢过程”(6707个)、“催化活性”(5942个)和“结合”(5168个)相关(附加文件)2).
此外,所有的unigenes在KEGG数据库中都被定位到规范通路。我们的数据显示,7191个来自糖苹果的unigenes被分配到124个KEGG通路(附加文件3.).最代表性的KEGG途径是“代谢途径”,1940年(KO01100)。另外,959个unigenes与Kegg途径“二次代谢物的生物合成”相关,将335个unigenes映射到“核糖体”,并将219个未成根分配给“内质网中的蛋白质加工”。
正常花与畸形花间差异基因的筛选与分类
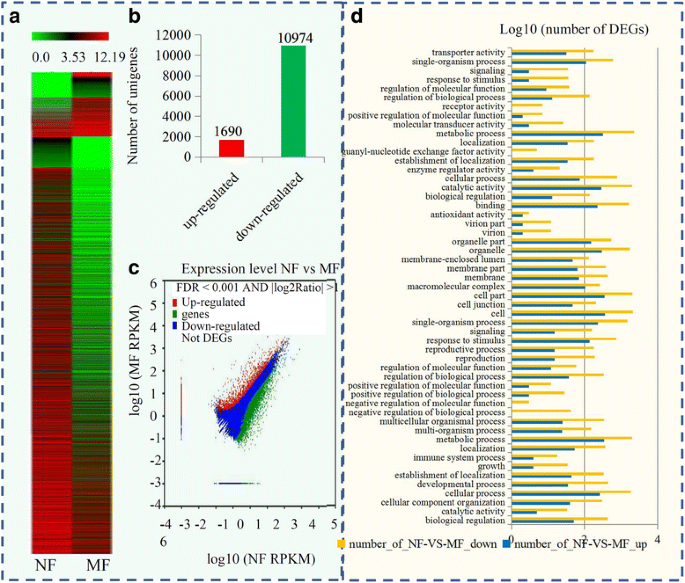
为了比较正常和畸形的花朵之间的°,确定RPKM值计算每个UNIGENE的读取密度。在糖苹果中正常和畸形的花朵之间的表达型材在热图中示出了(图。3).鉴定了总共12,664只次数,包括1690个上调基因和10,974个下调基因(图。3 b).使用火山图可视化正常和畸形花之间的°的显着性分析(图。3 c).并对其生物学功能进行了分析。其中2822个unigenes可以从go同源序列中注释出来。在氧化石墨烯分类中,生物过程中氧化石墨烯最大的5个术语分别是“代谢过程”、“细胞过程”、“单生物过程”、“对刺激的反应”和“定位”;在细胞组分中,氧化石墨烯含量最高的前五项分别是“细胞”、“细胞部分”、“细胞器”、“细胞器部分”和“大分子复合物”;在分子功能上,“代谢过程”、“催化活性”、“结合”、“单生物过程”和“细胞过程”是氧化石墨烯最大的五个功能项(图2)。3 d).
鉴定花器官发展相关的TF编码基因和MAD-BOX基因
总共有701特遣部队基因被鉴定为DEGs(附加文件4.).前五大差异表达的TF系列是:ERF(53名成员),BHLH(42名成员),相关(38名成员),FAR1(37个成员)和NAC(36个成员)。此外,几种与激素相关的TFS也被鉴定为DEGS,包括24Grass和9个ARF。在我们的研究中,从糖苹果花上揭示了21个疯狂箱子基因(附加档案5.).在这些疯箱基因中,四个基因,如AGL9.那SEP1.那AP1-like,在MIKC家族中发现17个基因,如AP3样式那AGL63.和PISTILLATA-like.
开花和花发育相关关键基因的鉴定
大量开花和花朵发育相关基因在整个花的发育周期中发挥着重要作用[31].在NCBI和UniProt数据库中,共有18个DEGs与已知的开花和花发育相关基因具有同源性(Additional file)6.).例如,两个促花因子基因(Unigene0041725和Unigene0054870)在畸形花中的表达量高于正常花。此外,四个早期开花蛋白基因(Unigene0023978、Unigene0023976 Unigene0033968和Unigene0008711),一个开花轨迹T基因(Unigene0000043),一个花期控制蛋白质FY-like基因(Unigene0025538), 3开花时间控制蛋白质FPA-like基因(Unigene0005475, Unigene0019814和Unigene0005474),一个花期对照蛋白fca样基因(Unigene0024514)也被鉴定为DEGs。
根据他们的GO术语(GO:0009908),将41只DEG被识别为与花卉发展相关的基因(附加文件7.).有趣的是,两个基因,一个可能是组蛋白H2A变异3样基因(Unigene0017118)和气味1样基因(Unigene0047135),在畸形花中被大量诱导(> 5倍)。在畸形花中,大多数其他与花发育相关的基因表达减少。
鉴定激素相关的次数
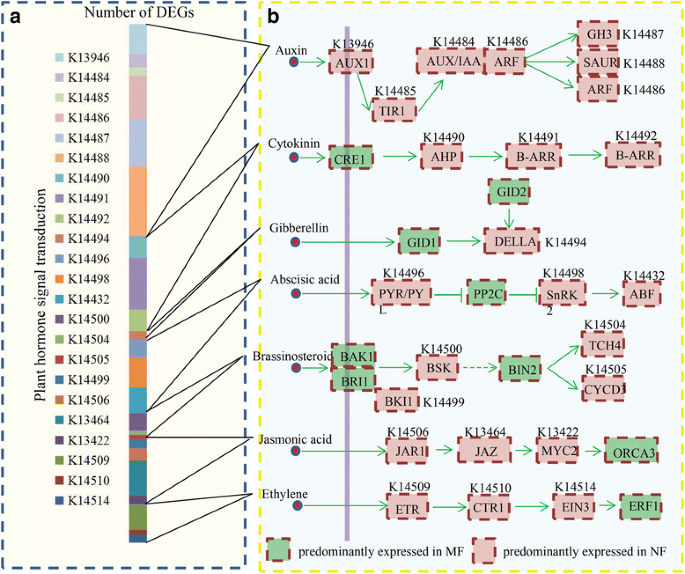
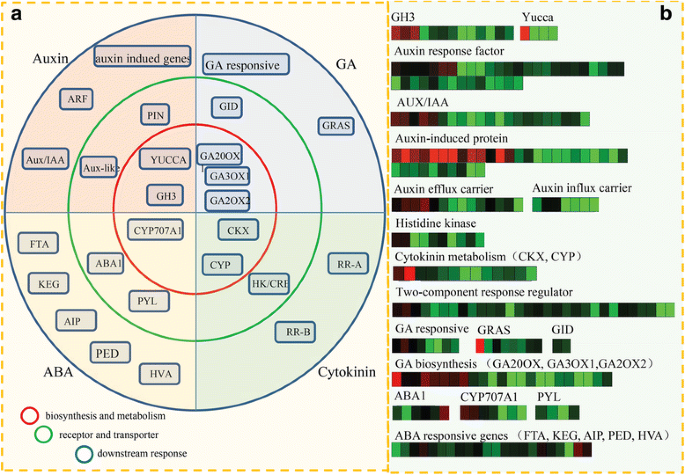
在我们的研究中,在正常和畸形的花朵之间鉴定了大量与激素相关的果酒。kegg分析为各种激素信号传导途径中涉及的关键组件分配了大部分的egs(图。4).有趣的是,大量激素相关的DEGs属于生长素和CK信号通路。图中显示了糖苹果中各种激素信号网络的概述。4 b.大多数与激素相关的DEG主要在普通花中表达。
首先,分析了与生长素相关的基因表达。生长素的生物合成和代谢丝兰基因和13.GH3基因被鉴定为DEGS;对于植化素转运,将14个流出的载体编码基因和七个流入载体编码基因鉴定为℃。对于下游响应,35种毒素诱导的基因,3种毒素 - 抑制基因,39个胃蛋白响应因子编码基因,以及21种毒素/ IAA编码基因被鉴定为DEG。其次,确定了与ABA相关的DEG。对于阿巴生物合成,七CYP707A1获得基因。对于ABA受体和转运蛋白,鉴定了七个ABA1编码基因和四个幽门编码基因。对于ABA下游响应,21次被注释为FTA.那桶那航那PED和HVA.基因。然后,分析了遗传算法相关的DEGs。在GA生物合成方面,共鉴定出23个编码GA20OX1、GA3OX1和GA2OX2的deg,其中3个deg被注释为GA受体。在GA下游反应中,8个deg被鉴定为GA应答基因,8个deg被鉴定为GRAS基因。此外,有53个DEGs被定位到CK途径。共13个DEGs与CK的生物合成和代谢相关(如CYP和CKX)、10个deg为HK/ cre编码基因,31个CK下游响应基因(图)。5).
基于RPKM值,分析了激素相关unigenes的表达水平并在图2中示出。5 b.多数激素相关基因在正常花中的表达水平高于畸形花。
验证几种关键激素相关基因的表达
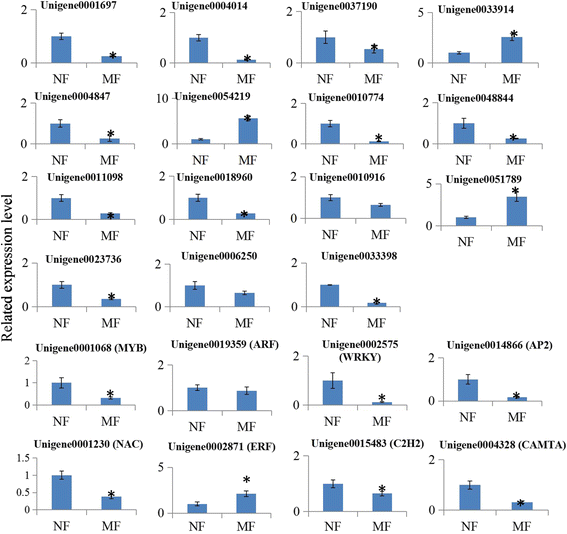
为了验证RNA-seq鉴定的一些关键激素相关基因的差异表达水平,采用qRT-PCR检测从正常和畸形花中采集的独立样本。随机选取15个关键的花激素相关基因和8个花器官发育相关的tf编码基因进行RNA-seq数据验证。所选基因的表达水平与RNA-seq结果基本一致(图2)。6.).此外,利用从不同发育阶段采集的独立样本分析了这些选择的基因的表达[32].这些基因在花发育过程中的表达谱见附加文件8.和9..引物序列列在附加文件中10.
几种相关激素相关基因的实时定量PCR验证。从正常和畸形的花中提取总RNA。直方图显示了这些基因关于山核桃中的肌动蛋白的相对表达水平。基因的具体同一性:Unigene0001697(营养蛋白蛋白5ng4样),Unigene0004014(营养响应因子5样),Unigene0037190(IAA29样),Unigene0033914(PIN5),Unigene0004847(Gibberellin调节蛋白9),Unigene0054219(GRAS系列转录因子),UNIGENE0010774(Gibberellin 2-氧化酶2),UNIGENE0048844(Gibberellin 3-Beta-羟化酶),Unigene0011098(APRR2),Unigene0018960(PRR95),Unigene0010916(细胞肝素脱氢酶3样),Unigene0051789(3-酮酰基-COA硫醇酶2),UNIGENE0023736(ZeAxanthin环氧酶),Unigene0006250(ABA 8'-羟化酶),Unigene0033398(Pyr1样)。通过三个独立的重复分析数据,标准偏差显示出误差条。表达水平的显着差异由“*”表示
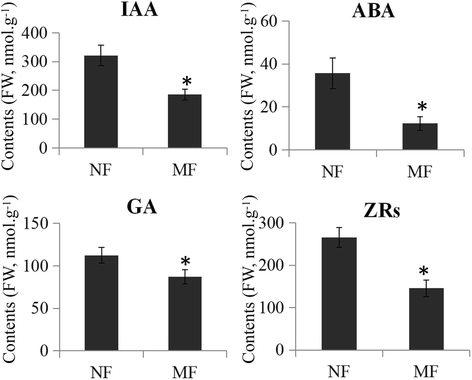
内源性激素测量
检查正常和畸形的花朵之间内源激素的变化,测量IAA,ABA,GA和ZRS内容物。从不同的花中采集三个独立的样本用于内源激素的测定。IAA,ABA,GA和ZRS含量在畸形的花中减少(图。7.).详细介绍,与正常花相比,IAA内容从321.23降至185.25 nmol·g-1ABA含量从35.63 nmol·g降至12.32 nmol·g-1, GA含量从112.36 nmol·g降至87.23 nmol·g-1ZRs含量从265.32 nmol·g降至145.68 nmol·g-1在畸形的花朵。
讨论
糖苹果是一种流行的果树,亚热带和热带地区的商业价值高,[1].如果没有一个公开的基因组数据库,有关它们生长和发育的基因的详细信息就无法用于糖苹果的研究。DEG分析是研究基因表达的时间调控的一个很好的工具[33].在前期工作中,我们构建了四种不同花期的独立cDNA文库答:squamosaIllumina公司RNA-seq。已经鉴定出大量与花发育阶段相关的基因[32].本研究利用正常花和畸形花在同一发育阶段(花瓣部分开放的成熟花)的转录组数据,揭示了正常花和畸形花之间的差异,为研究糖苹果提供了更充分的资源。
在模型植物中,据报道,各种TF家族,如MYB,MYS-BOX,NAC,ARF和BHLH,涉及花卉发展[34那35那36那37那38].因此,我们在本研究中分析了正常花和畸形花之间TF基因的差异表达水平。我们之前的研究发现了大量与花发育相关的TF家族,包括bHLH、NAC、B3、myb相关和bZIP。MYB因子促进花瓣和雄蕊的生长拟南芥.例如,MYB21对JA生物合成相关基因的表达进行负向反馈,通过降低JA水平来控制花的发育[39].我们之前的研究发现了一个大型MYB相关的转录因子,表明MYB因子在糖苹果花器官发育中发挥重要作用[32].在本研究中,MYB家族中差异表达的TFs数量最多(59个成员)。此外,bHLH是另一个大型TF家族,调控各种与花发育相关的过程[40].在糖苹果中,bHLH家族在正常花和畸形花中差异表达的TFs数量第二多(35个成员)。我们之前的研究表明bHLH是参与糖苹果花发育的最大TF家族,说明MYB和bHLH家族参与了正常花和畸形花的差异。
这拟南芥TFsARF6.和ARF8.在多个花组织中表达,例如萼片,花瓣和雄蕊丝[41].此外,这两个基因在不同的器官中发挥作用,促进从封闭的芽向成熟的可育花的转变[42].ARF1.和ARF2.调节花器官的衰老和脱落拟南芥[43].在糖苹果中,有9个arf被鉴定为正常花和畸形花之间差异表达的转录因子,表明arf介导的生长素信号参与了花的发育。
据报道,花器官的形态发生受多个MADS-box基因的控制。任何必需MADS-box基因功能的缺失都可能导致花器官的同源性转换[44].例如,四个兰花agl9样MADS-box基因在花的转化和形成中起重要作用拟南芥[45].在本研究中,鉴定了4个mic型MADS-box基因AGL9.基因,可能参与糖苹果花的转变。此外,有报道称SEPALLATA亚家族MADS-box蛋白对水稻小穗分生组织的鉴定具有正调控作用[46].在糖苹果中也发现了一个SEPALLATA 1样蛋白编码基因。这些数据为了解糖苹果花器官的发育过程提供了较为全面的信息。
基于DEGs分析,大量生长素相关基因,包括东盟地区论坛年代,辅助/ IAA年代,ghS,被确定为DEGS。植物甾族植物毒素参与调节植物生长和发展的许多方面[47那48].遗传证据揭示了生殖枝条外围的鲜花中植物的古典作用[49].例如,在PIN1.或PID,生长素外排载体编码基因,缺花[50].在早期,雌配子体的发育受植物发育的控制AtPIN1 -介导的助产助剂[51].在我们的研究中,将鉴定的植物素流入载体编码基因和大部分鉴定的制冷素流出载体编码基因下调在畸形的花中。在拟南芥那ARF4.与花图案相关联[52].另一个东盟地区论坛的基因,AtARF3,集成了功能钦am和Apetala2.在花分生组织决定论中[53那54].这里,大多数鉴定的表达ARFS.和辅助/ IAAs在畸形花中也减少。因此,生长素和生长素运输可能是糖苹果花分生组织决定和花型形成的必要条件。
CK在植物发育的许多方面起着关键作用,包括雄性和雌性功能的形成[55].在拟南芥,花的同源基因Apetala1.通过促进CK降解基因的表达,直接降低内源CK的生物合成细胞分裂素氧化酶/ DEHYDROGENASE3并抑制CK Biosynthetic基因的表达孤独GUY1[56].在我们的研究中,大量的CK生物合成相关基因,包括3cyp和10ckxs.,被鉴定为糖苹果中的果酒。CK的生物合成中的减少可能导致畸形的花表型。
此外,GA和ABA在花的发育过程中也起着重要作用。例如,外源GA的影响3.已经分析了葡萄花的应用。RNA-SEQ转录组分析表明,葡萄花序的形态可以通过GA的生物合成和信号传导来控制3.[57].在拟南芥,一个缺陷突变体,ga1-3,花器官4轮生长迟缓,应用外源GA可挽救其花表型[58].GA- insensitive DWARF1 (GID1)是一种与激素敏感脂肪酶高度相似的可溶性蛋白,首次在水稻中克隆为GA受体[59].在我们的研究中,两个gid编码基因被鉴定为DEGs,表明GA信号通路参与了糖苹果花的发育。对于GA的生物合成GA2ox在不同的植物物种中发现了家族基因[60].根据我们的转录组数据,GA3OX1家族基因如Unigene0016441在畸形花中大量减少,而GA2OX2家族基因如Unigene0010774和Unigene0004102在畸形花中被诱导。这表明在花发育过程中GA的生物合成调控机制是多种多样的。大量的转录组研究揭示了ABA信号与植物花发育之间的密切关系非洲菊矮牵牛[61].我们的数据证实了aba相关基因在正常和畸形花之间也表现出了显著的表达变化。
畸形花的内源激素水平低于正常花。这与畸形花中激素相关基因表达水平的下降是一致的。在拟南芥,生长素水平的增加归因于茎尖开始成花[62].除生长素外,细胞分裂素的积累也引起花发育的改变拟南芥[63].在糖苹果中,低养蛋白和细胞素水平可能影响花发育的下游过程,导致畸形的花朵。阿巴改变了手镯的数量拟南芥[64].与正常花相比,ABA水平的降低可能会影响畸形花心皮的形成。最近的研究表明GA与雄蕊发育有关。例如,GA受体的突变会影响雄蕊的伸长[65].GA浓度可能在糖苹果中的雄蕊发育中发挥作用。
在我们之前的工作中,在糖苹果中发现了与花的转变和花的发育相关的基因[32].在本研究中,大多数选择的DEGs在花发育过程中表达显著变化,提示与畸形花相关的缺陷存在因果关系。
结论
总之,分别构建和测序来自糖苹果的正常和畸形花的两个独立cDNA文库。在正常和畸形的花朵之间识别出大量的DEG。使用QRT-PCR分析分析并验证了与激素相关的未造林的表达变化。表达分析与激素含量一起提供综合资源,用于研究正常和畸形花之间的差异表达基因。
缩写
- 阿坝:
-
脱盐酸
- br:
-
芸苔类固醇
- 中正:
-
cytokinins.
- 齿轮:
-
局部群体的簇
- 可见:
-
差异表达基因
- DGE:
-
数字基因表达
- 气体:
-
赤霉素
- 走:
-
基因本体论
- 国际宇航科学院:
-
indole-3-acetic酸
- 雅:
-
茉莉酸盐
- Kegg:
-
京都基因和基因组百科全书
- 存在:
-
定量实时聚合酶链反应
- RNA-seq:
-
RNA序列
- RPKM:
-
每百万千克读数读取
- SA:
-
水杨酸
- zr型:
-
玉米素核苷
参考文献
- 1.
Hollerhage M,Rosler Tw,Berjas M,Luo R,Tran K,Richards Km,等。Annonaceae物种膳食补充剂的神经毒性。int j毒品。2015; 34(6):543-50。
- 2.
邓发国,徐丹鹏,李胜,李海波。超声波辅助提取糖苹果天然抗氧化剂的工艺优化(番荔枝属squamosaL.)使用响应表面方法剥离。分子。2015; 20(11):20448-59。
- 3.
刘凯,李华,袁超,黄艳,陈艳,刘杰(番荔枝属squamosal)使用扩展的bbch量表。Sci Hortic。2015;181:76 - 80。
- 4.
奥尔森,马尔登SJ。落叶处理对番荔枝花发育的影响(Annona Cherimola.磨坊。×a。squamosa和花发育模型的含义。植物学报。2012;60(2):160-4。
- 5.
陈志强,陈志强,陈志强,等。mirna在植物成花过程中的作用及其应用。生物技术学报;2015;13(3):282-92。
- 6.
李c,顾m,shi n,张h,yang x,osman t等。移动FT mRNA有助于花卉诱导中的全身氟化。SCI批准。2011; 1:73。
- 7。
Mendoza L, Thieffry D, Alvarez-Buylla ER。水稻花形态发生的遗传控制拟南芥:逻辑分析。生物信息学。1999; 15(7-8):593-606。
- 8。
花器官身份:20年的abc。细胞生物学杂志。2010;21(1):73-9。
- 9。
花器官身份的发展:来自MADS房子的故事。植物学报。2001;4(1):75-85。
- 10.
花的开花和确定性拟南芥.中国生物医学工程学报。2007;58(5):899-907。
- 11.
戴维斯SJ。将激素整合到花的转化途径中拟南芥.植物学报。2009;32(9):1201-10。
- 12.
庞军,王丽,胡江琴,向涛,梁海华。赤霉素和细胞分裂素对红花花芽离体直接再生的协同促进作用。中国生物医学工程学报。2006;42(5):450-4。
- 13.
DavièreJM,LUCAS MD,PRAT S.转录因子交互:Della功能的中央步骤。CurrOpin Genet Dev。2008; 18(4):295-303。
- 14.
刘超,陈洪,李海龙,等。AGL24和SOC1的直接相互作用将开花信号整合在拟南芥.发展。2008;135(8):1481 - 91。
- 15.
张MZ,YE D,Wang LL,Pang JL,张义,Zheng K,等。黄瓜叶状物质CFL和激素治疗的过度表达在格洛尼亚植物中改变花卉发育(Sinningia Speciosa.).acta botanica sinica(云南植物学报). 2008;47(4):419 - 427。
- 16.
白天和夜晚的温度响应拟南芥:对赤霉素和生长素含量、细胞大小、形态和开花时间的影响。安机器人。2003;92(4):601 - 12所示。
- 17.
Jacob Y, Mongkolsiriwatana C, Veley KM, Kim SY, Michaels SD。核孔蛋白AtTPR是RNA稳态、开花时间和生长素信号转导所必需的。植物杂志。2007;144(3):1383 - 90。
- 18。
赵颖。生长素和细胞分裂素的局部生物合成在植物发育中的作用。植物学报。2008;11(1):16-22。
- 19。
黄志强,陈志强,陈志强,等。植物开花时间调控的生物学研究进展。生物技术学报;2005;3(1):3 - 16。
- 20。
Corbacho J, Romojaro F, Pech JC, Latche A, Gomez-Jimenez MC.涉及甜瓜成熟果实脱落的转录组事件包括细胞壁降解基因的顺序诱导和胞内和胞外分泌的刺激。《公共科学图书馆•综合》。2013;8 (3):e58363。
- 21。
陈辉,胡振华,周斌。荔枝发育不全叶片的转录组组装。以及对活性氧反应的差异表达基因的鉴定。BMC基因组学。2014;15:805。
- 22.
朱勇,李勇,辛东,陈伟,邵旭,王勇,等。基于rna - seq的中国樱桃休眠花芽转录组分析(李属pseudocerasus).基因。2015;555(2):362 - 76。
- 23.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I,等。从RNA-Seq数据中重建一个没有基因组的全长转录组。生物科技Nat》。2011;29(7):644 - 52。
- 24.
沈超,郭洪,陈洪,石勇,陆军,等。生物活性成分合成相关基因的鉴定与分析Dendrobium Officinale.使用RNA-Seq。Sci众议员2017;7(1):187。
- 25.
罗宾逊MD,麦卡锡DJ,SMYTH GK。编辑:用于数字基因表达数据的差异表达分析的生物导体包。生物信息学。2010; 26(1):139-40。
- 26.
沈超,杨勇,刘凯,张磊,郭华,孙涛,等。内源性水杨酸在植物缺铁反应中的参与拟南芥.J Exp Bot。2016; 67(14):4179-93。
- 27.
沉c,悦r,白y,feng r,sun t,wang x等。鉴定和分析Medicago Truncatula.生长素转运体基因家族揭示其在应答中的作用Sinorhizobium meliloti感染。植物细胞杂志。2015; 56(10):1930-43。
- 28.
沉c,悦r,sun t,张l,杨y,王h. osarf16,调节水稻的铁缺乏反应所必需的转录因子调节植物中的转录因子(栽培稻l .)。植物科学。2015;231:148-58。
- 29.
陈明莉,付晓明,刘建强,叶婷婷,侯淑英,黄玉强,等。利用衍生化方法结合纳米lc - esi - q - tof - ms分析酸性植物激素的高灵敏度和定量分析。中国有色金属学报(英文版);
- 30.
Kasote DM,Ghosh R,Chung Jy,Kim J,Bae I,Bae H.基于多反应监测模式的液相色谱 - 质谱法,用于同时定量芸苔属植物和其他植物激素涉及非生物胁迫的植物激素。int j alm chem。2016; 2016:7214087。
- 31.
隋姝,罗军,马军,朱强,雷旭,李敏Chimonanthus早熟发现应激反应和花发育相关基因。排版功能基因组学。2012; 2012:134596。
- 32.
刘凯,冯胜,潘勇,钟军,陈勇,袁超,等。糖苹果花转化和花发育相关基因的转录组分析与鉴定(番荔枝属squamosal .)。植物学报2016;7:1695。
- 33.
郝军,郭华,史旭,王永强,万强,宋勇等。比较蛋白质组分析水松物种(水松×媒体和水松mairei)揭示了与紫杉醇和其他代谢物相关的代谢变化。植物学报。2017。DOI:10.1093 / PCP / PCX128.
- 34.
yu c,gu h,zhang y,song y,pi e,yu c,zhang l等。鉴定有助于两种紫杉醇物种之间的紫杉型含量变异的潜在基因(水松媒体和水松mairei).树生理。2017年;DOI:10.1093 / treephys / tpx091.
- 35.
宁永强,马志勇,黄宏文,莫辉,赵婷婷,李丽等。两种新的NAC转录因子通过与组蛋白去甲基化酶JMJ14相关调控基因表达和开花时间。核酸的研究。2015年,43 (3):1469 - 1484
- 36.
刘克,元C,李H,林W,杨Y,沉C,等。番木瓜花卉和水果发育有关的植物响应因子(ARF)家族基因组鉴定及表征(番木瓜l .)。BMC基因组学。2015; 16(1):901。
- 37.
开花和毛状体发育共享激素和转录因子的调控。J Exp Bot. 2016;67(5): 1209-19。
- 38.
Becker A,Theissen G. Mad-Box基因的主要腕表及其在开花植物的发展和演变中的作用。mol phylocyet evol。2003; 29(3):464-89。
- 39.
Reeves PH, Ellis CM, Ploense SE, Wu MF, Yadav V, Tholl D,等。协调花成熟的调控网络。公共科学图书馆麝猫。2012;8 (2):e1002506。
- 40。
张伟,孙颖,张伟,马海涛。拟南芥绒毡层发育和功能的调控机制。植物学报,2008,29(6):659 - 663。发展。2006;133(16):3085 - 95。
- 41。
Nagpal P, Ellis CM, Weber H, Ploense SE, Barkawi LS, Guilfoyle TJ,等。生长素反应因子ARF6和ARF8促进茉莉酸的产生和花的成熟。发展。2005;132(18):4107 - 18。
- 42。
吴曼夫,田强,李志伟。拟南芥microRNA167调控ARF6和ARF8的表达模式,并调控雌性和雄性的生殖。发展。2006;133(21):4211 - 8。
- 43。
ellis cm,nagpal p,年轻的jc,hagen g,guilfoyle tj,芦苇jw。一种悬垂响应因子1和疾病响应因子2调节衰老和花式器官脱落拟南芥.发展。2005; 132(20):4563-74。
- 44。
Parenicova L, de Folter S, Kieffer M, Horner DS, Favalli C, Busscher J,等。完整MADS-box转录因子家族的分子和系统发育分析拟南芥: MADS世界的新开端。植物细胞。2003;15(7):1538 - 51。
- 45。
张洋洋,赵艳芳,吴建文,杨春四兰(金蝶兰属植物高尔半岛拉姆齐)AP1 / AGL9样疯子盒基因显示新的表达模式,并对造成不同影响的花卉过渡和地层拟南芥.植物细胞杂志。50 2009;(8): 1425 - 38。
- 46.
Kobayashi K, Maekawa M, Miyao A, Hirochika H, Kyozuka J. PANICLE PHYTOMER2 (PAP2)编码SEPALLATA亚家族mas -box蛋白,正调控水稻小穗分生组织的特性。植物细胞杂志。2010年,51(1):47-57。
- 47.
杨X,刘X,LV W,Li L,Shi Q,Yang J等。减少表达BJRCE1.通过核 - 细胞质不相容地调节基因在细胞质雄性无菌中改变了养蛋响应芸苔属植物juncea.《公共科学图书馆•综合》。2012;7 (6):e38821。
- 48.
刘凯,岳瑞,袁超,刘杰,张磊,孙涛,等。生长素信号参与铁缺乏诱导的水稻光合抑制和茎部生长缺陷(栽培稻l .)。植物学报,2015;58(6):391-401。
- 49.
Wu MF, Winter CM, Berns MC, Nole-Wilson S, Yamaguchi A, et al.;生长素介导的花原基起始的分子框架。Dev细胞。2013;24(3):271 - 82。
- 50.
Przemeck GK,Mattsson J,Hardtke CS,Sung Zr,Berleth T.研究了作用的研究拟南芥基因MONOPTEROS在维管发育和植物细胞轴化过程中。足底。1996;200(2):229 - 37。
- 51.
Ceccato L, Masiero S, Sinha Roy D, Bencivenga S, Roig-Villanova I, Ditengou FA, et al.;雌配子体发育需要对PIN1进行母系控制拟南芥.《公共科学图书馆•综合》。2013;8 (6):e66148。
- 52.
研究发现,反式作用的sirna介导的ETTIN和ARF4抑制调控了异位性拟南芥.发展。2006;133(15):2973 - 81。
- 53.
王鹤,胡b,陈gp,shi nn,zha y,yin qc,等。应用拟南芥转基因烟草花发育的无鳞第2内含子研究。植物学报2008;27(2):251-9。
- 54.
徐X,Bian J,Liu S,Song H,Shi N,Tao Y等。伞菌第二内含子驱动的拟南芥PCS1的特异性表达降低了转基因植物的生育率。mol品种。2011; 27(3):337-46。
- 55.
Kinoshita-Tsujimura K,Kakimoto T.孢子体中的孢子素素受体对于男性和女性功能至关重要拟南芥.植物信号表现。2011; 6(1):66-71。
- 56.
韩艳,张超,杨华,焦元。细胞分裂素途径介导的APETALA1在花分生组织建立中的作用拟南芥.中国科学(d辑:地球科学)2014;
- 57.
程C,娇C,歌手SD,GAO M,XU X,周Y等。Gibberellin诱导的葡萄葡萄鱼转录组的变化(葡萄属狐狸X诉酿酒用葡萄) 简历。京都花。BMC基因组学。2015; 16:128。
- 58.
到N,法里斯RP。赤霉素在赤霉素缺陷突变体花器官发育中的作用,GA1-1的,拟南芥.植物学报。1999;77(7):944-54。
- 59.
任东,饶勇,吴林,徐强,李志,余辉,等。多效性异常花和矮化1影响水稻株高、花发育和籽粒产量。acta botanica yunnanica(云南植物研究). 2016;58(6):529-39。
- 60。
李亚东,李亚东,李亚东,李亚东等。草中赤霉素生物合成基因的异体表达和转录分析揭示了GA3ox家族的新功能。BMC Plant Biol. 2015;15:130。
- 61。
李丽,张伟,张丽,李宁,彭军,王勇,等。赤霉素和脱落酸对植物花瓣生长的拮抗作用的转录组学研究非洲菊矮牵牛.植物科学学报2015;6:168。
- 62。
Taoka K,Yanagimoto Y,Daimon Y,Hibara K,Aida M,Tasaka M. NAC结构域介导杯形子叶蛋白的功能特异性。工厂J. 2004; 40(4):462-73。
- 63。
李Xg,苏啊,赵xy,李文,高xq,张xs。细胞分裂素过量生产导致花卉发育的改变部分由CUC2和CUC3部分介导拟南芥.基因。2010;450(1 - 2):109 - 20。
- 64。
Fitzpatrick啊,Shrestha N,Bhandari J,Crowell DN。法内尔和阿巴的角色拟南芥花卉发展。植物信号表现。2011; 6(8):1189-91。
- 65。
引用本文Iuchi S, Suzuki H, Kim YC, Iuchi A, Kuromori T, Ueguchi-Tanaka M,等。拟南芥赤霉素受体AtGID1s的多重功能缺失完全关闭了赤霉素信号。植物j . 2007;(6): 958 - 66。
确认
我们感谢钱刘和杨刘(来自广州根德纳沃生物科技有限公司)的技术支持。
资金
基金资助:国家自然科学基金(批准号:)。31201586);广东省科技计划项目(批准号:)2014 a020208138和2015 a020208018);湛江市科技计划项目(no.2016A03016);岭南师范大学自然科学基金(批准号:LZL1507)。所有这些资金都在研究的设计、数据的收集、分析和解释以及手稿的撰写中发挥作用。
数据和材料的可用性
支持本文结论的数据集包含在文章及其附加文件中。
作者信息
隶属关系
贡献
KL, HL, WL, JZ进行了分子研究,参与了分析并起草了手稿。YC进行qRT-PCR分析。HL进行了统计分析。KL和CY构思了这项研究,并参与了设计。KL获得了资金。CS帮助起草了手稿。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
成年树答:squamosa简历。'Bendi'在中国广泛培育。该项目使用植物材料,不利用转基因技术。它不需要道德批准。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
额外的文件1:
所获得的读数的详细信息。(XLSX 8 KB)
额外的文件2:
unigenes的GO分类。(XLSX 10 KB)
额外的文件3:
unigenes的KEGG分类。(XLSX 13 kb)
额外的文件4:
701个TF基因被鉴定为DEGs。(XLSX 21 kb)
额外的文件5:
从糖苹果花揭示了21个疯子箱基因的信息。(XLSX 15 KB)
额外的文件6:
开花和花发育相关关键基因的鉴定。(XLSX 12 kb)
额外的文件7:
GO基因列表:0009908。(XLSX 10 KB)
额外的文件8:
花发育过程中15个关键激素相关基因的表达谱。多克斯(658 kb)
额外的文件9:
八种花器官发展相关的TF编码基因的表达谱。(docx 560 kb)
额外的文件10:
引物序列。(XLSX 10 KB)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
刘凯,李鸿飞,李伟。等等。糖苹果中正常和畸形花的比较转录组分析(番荔枝属squamosa以鉴定正常花与畸形花之间的差异表达基因。BMC植物杂志17,170(2017)。https://doi.org/10.1186/s12870-017-1135-y
收到了:
公认:
发表:
关键词
- 答:squamosa
- 普通花
- 畸形的花
- 转录组
- 数字基因表达
- 植物激素