摘要
背景
Pennycress [菥蓂L(十字花科)被驯化作为一种可再生的生物柴油的原料,它也提供重要的生态系统服务,包括作为授粉营养资源。然而,它的花产生比其他十字花科作物的亲戚花蜜显著少。进行这项研究,以了解菥蓂蜜腺的基本生物学作为对从它的花果茶提高产量的可能性的第一步。
结果
Pennycress Flowers含有四个等同的蜜腺位于短和长雄蕊的插入部位的底部。与其他Brassicaceae一样,蜜蜂在其表面上有露出露迹,这可能是花蜜分泌的遗址。蜜腺产生四个不同的花蜜液滴,该液滴在四个花瓣中的每一个的底座上累积。为了了解Pennycress Nectary的分子生物学,RNA与“未成熟的”(预分泌)和'成熟'(分泌)蜜腺分离并进行RNA-SEQ。大约184米的成对读数(368米总读数)是De Novo组装成总共16,074个独立的contig,它在Pennycress基因组中映射到12,335个独特的基因。发现近3700个基因在未成熟和成熟的粪便之间差异表达,并进行基因本体和代谢途径分析。最后,在Silico分析中,将158个Pennycress Orthologs鉴定为拟南芥基因,富集在Nectaries中富集。通过半定量RT-PCR验证这些富集的富集的表达模式以选择Pennycress Loci。
结论
Pennycress蜜腺相对于其他重要的十字花科植物来说是独一无二的,因为它们包含四个等价的蜜腺,在花瓣基部有特殊的杯状结构提供花蜜。尽管存在这些形态上的差异,但在花蜜的调控和生产方面的基因在很大程度上是保守的拟南芥.这些结果为利用正向和反向遗传学方法提高pennycress花蜜的合成和分泌提供了一个起点。
背景
随着世界人口的同时增长[1]和生物多样性下降[2,有效利用土地和能源是至关重要的。为了部分解决这个问题,pennycress (菥蓂)正在开发作为一种可再生的生物柴油的原料,它也提供重要生态系统服务[3.].Pennycress种子含油量高(20-36%,wt/wt),可与大豆和油菜等其他油籽作物竞争[3.].pennycress种子的油可以加工为柴油发动机以及商用飞机和喷气式飞机提供动力。4].
由于pennycress是冬季一年生植物,生命周期短,它可以在玉米和大豆轮作中间作,增加了我们农业生态系统的生物多样性,并利用了中西部北部通常在秋季、冬季和春季休耕的1600万公顷土壤[3.].因此,pennycress是一种非常畅销的“经济”覆盖作物,可以增加农民的利润,同时抑制杂草[5],防止养分流失[6],保护土壤不受侵蚀[7].农民通常对种植覆盖作物持抵制态度,理由是利润有限、逃逸后代带来的杂草问题和高管理要求[7];然而,目前的pennycress育种计划正在解决这些问题。因此,由于pennycress的市场用途和生态系统服务,以及它相对于其他现有覆盖作物(包括油菜籽和亚麻荠)的耐寒性,pennycress预计将在整个上中西部的农场广泛使用。
Pennycress可以通过在今年临时时间,早春的临时时间为花粉和花粉的形式提供了另一个主要的生态系统服务。粉丝群人群的健康对粮食生产至关重要,因为近75%的全球作物物种依赖于某些水平的动物介导的授粉[8].2010年,仅在美国,授粉服务估计价值290亿美元[9].传粉对粮食安全的重要性最近受到关注的白宫,其中指出菥蓂为需要更多的研究[一个潜在的有价值的授粉资源10.].
昆虫很容易吸引到菥蓂的花朵,即使相比密切相关的油菜时(他们生产的甘露相对低的水平芸苔属植物显著)及亚麻荠(Camelina Sativa)[11.].目前尚不清楚为什么Pennycress吸引了许多不同的粉碎机,但也提供了很少的花蜜,但昆虫可能是喂养花粉。一个有趣的发现是,蜂蜜蜜蜂是少数少数人对Pennycress花的游客[11.,可能是由于扁豆花相对较小,花蜜产量低。例如,pennycress花大约是亚麻荠花的三分之一大小,产生大约八分之一的花蜜糖[11.].这些结果表明,可能有机会增强Pennycress花卉特征,以使蜂蜜蜜蜂和其他粉丝器受益。NECTAL,花粉和较大的花卉展会增加的Pennycress品种的鉴定和开发可能会使野生粉碎机和驯养的蜂蜜蜜蜂种群受益,同时增加作物产量[12.].特别是,额外的营养资源对春季蜂蜜蜜蜂的蜂蜜资源非常有价值,这是一年的批判性荨麻疹和野生蜜蜂的关键时刻[13.,14.].
蜜腺是腺体负责产生在花蜜发现的化合物的复杂混合物。十字花科的成员通常包含每花蜜腺4 [15.,16.].在拟南芥和油菜中,两个侧蜜腺分泌的>占总蜜腺的99%,而两个较小的中位蜜腺的产量要低得多[15.,16.].外侧蜜腺的维管组织多于中间蜜腺,这可能部分地负责这两个器官间不同的蜜腺分泌(A.R. Davis在[17.])。
我们以前确定了大量在水平中表达的基因拟南芥和芸苔属植物拉伯,两种与pennycress有关的物种,通过转录分析[18.,19.].随后的工作证明了19个基因在蜜腺功能中的机制作用[20.].特别是,在十字花科中发现了一种合成和分泌花蜜糖的途径(详细描述于结果和讨论)[21.,22.].
鉴于pennycress作为封面的快速发展和经济作物,及其可能普遍实现数百万英亩的中西部地区,该研究是本手稿中描述的理解的基本生物学pennycress蜜腺作为最初的一步的可能性提高花花蜜输出。
结果
蜜腺结构和花蜜演示
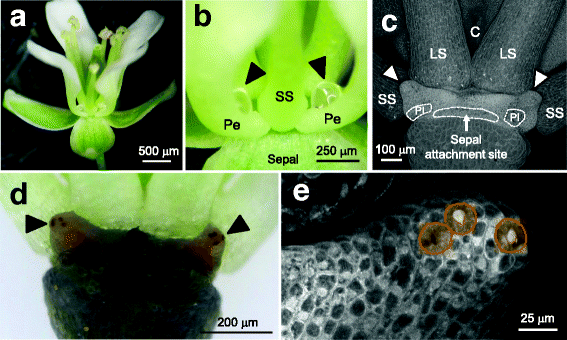
Pennycress花发育4个相同的蜜腺,它们位于短雄蕊和长雄蕊之间的插入点的基部。1).每个蜜腺位于花瓣附接部位,并在花瓣基座处产生由杯形结构支撑的花蜜液滴(图。1a,b).最后用淀粉染色和共聚焦显微镜分析蜜腺的超微结构。这些分析表明,蜜腺表面含有气孔(蜜腺口),在积极分泌蜜腺中积累淀粉(图。1 d),这些气孔似乎是开着的(图。1 e).图中气孔内的闭塞物质。1 e是最可能的交联花蜜溶质,尽管蜜腺气孔阻塞以前有报道[23.].
蜜腺的转录分析
在十字花科中,花蜜的产生通常开始于花期,这对pennycress也适用。为了了解花蜜产生之前的事件,以及什么机制定义了一个活跃的分泌蜜腺,pennycress蜜腺在两个发育时间点被人工采集:分泌前(“未成熟”,相当于拟南芥的11-12阶段;无花果。2)和分泌(“成熟”,相当于拟南芥14-15期;在[24])。总RNA,随后从一式三份成熟和未成熟的蜜腺分离和Illumina公司的Hi-SEQ 2500测序(包括RNA质量,多聚腺苷酸纯化和库创建的评估)处理。大约184中号配对末端50bp的读出从等效单次测序车道,随后被修整,组装,并映射到菥蓂基因组获得(368米总阅读)。总之,生成了16074点独立的重叠群(附加文件1),它映射到12335个独特的pennycress基因(附加文件2).在附加文件中可以找到所有contigs的总reads数和最近的拟南芥基因(通过BLASTP鉴定)1.由于多个重叠群经常映射到相同的菥蓂轨迹(由于不完全覆盖,选择性剪接等),读出用于这种重叠群随后求和用于附加文件的每个基因座菥蓂2.有趣的是,376点的重叠群并没有映射在菥蓂基因组草图到基因座,但其中242有显著身份拟南芥基因座(附加文件1).
未成熟蜜腺与成熟蜜腺基因的差异表达
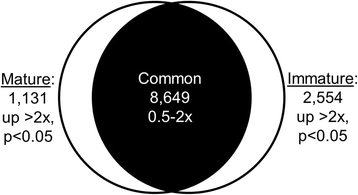
近3700个pennycress基因在未成熟和成熟蜜腺中的表达差异为>的2倍(p<0.05),分别具有2554和1131分别在未成熟和成熟的蜜腺中更高(图。3.).由于这些基因标记了准备分泌花蜜的蜜腺和积极分泌花蜜的蜜腺之间的差异,这些位点通过黑豹分类系统的“统计过度表征测试”接受了基因本体论和路径分析(http://pantherdb.org/),使用最近的拟南芥同源物作为输入(附加文件3.).基因座在未成熟的上调与成熟蜜腺包括涉及“生物合成过程”(过多270个基因,p= 1.96 × 10-24),特别是参与脂肪酸生物合成的人(17个基因,p= 1.97 × 10−4)和翻译(157个基因,p= 1.13 × 10−36).相反,成熟蜜腺优先表达的基因过度表达囊泡介导的运输过程(41个基因,p= 9.26 × 10−3)和泛素蛋白连接酶活性(30个基因,p= 1.26×10−2),以及其他(附加文件3.).毫不奇怪,在pennycress和拟南芥中,许多基因在未成熟和成熟蜜腺中表现出相似的差异表达4).
基因蜜腺组织中优先表达
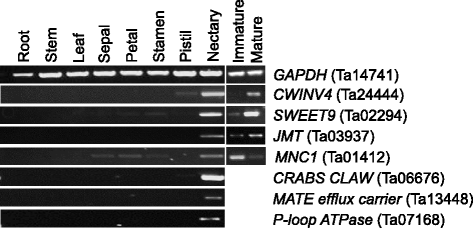
此前的一项研究使用微阵列分析确定了270个拟南芥基因座,在13个其他参考组织(如叶子、花瓣、茎、根等)的蜜腺中显示>3倍的表达。19.].这些拟南芥位点与pennycress蜜腺中表达的基因进行了比较(来自附加文件)2),以测定与分泌花蜜有关的过程可能被保存的程度。在270个具有丰富蜜腺表达的拟南芥基因座中,有近60%(158个)的基因座是由pennycress蜜腺转录组中最高的pennycress ortholog(由BLASTP确定)表示的(附加文件)5).随后通过半定量PCR证实了这些推定直脑中的几种富核的富集表达(图。4).这是可能的直向同源物到剩余蜜腺富集拟南芥基因(112出来的270)在菥蓂转录未鉴定仍然可以表达,但是在本分析中没有发现由于密切相关旁系在两个基因组的存在。
识别和菥蓂基因与蜜腺富集表达的验证。推定菥蓂已知蜜腺富集表达拟南芥基因的直系同源物通过BLASTP鉴定针对来自RNA-SEQ衍生翻译重叠群。半定量RT-PCR来验证这些直向同源物如图中左侧面板。右侧面板被用于验证在未成熟的几个这些基因的差异表达(阶段12)与成熟(阶段15)花如在本研究中鉴定通过RNA-SEQ。的菥蓂基因数目和相关的拟南芥直向同源物如下:CWINV4(Ta24444; AT2G36190),SWEET9(Ta02294; AT2G39060),JMT(Ta03937; AT1G19640),MNC1(Ta01412; AT1G74820),蟹爪(Ta06676; AT1G69180),MATE流出载体(Ta13448; AT1G23300),P-ATP酶循环(Ta07168; AT5G60760),GAPDH(Ta14741; AT3G04120)
保持分泌花蜜的途径
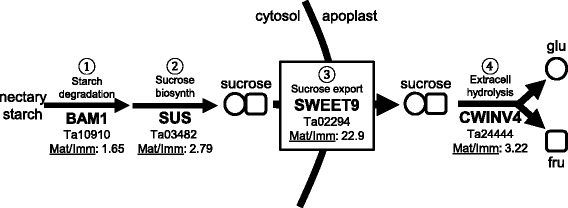
我们之前的工作发现了十字花科和茄科的合成和分泌花蜜糖的途径,并建议在其他地方进行保护[21.,22.].在我们的工作模型中,花蜜由前甘蔗糖和来自韧皮肌的其他代谢物形成[21.,22.].花蜜前可能通过胞间连丝共穿过几层薄壁组织,在那里它以淀粉的形式沉积在未成熟花的淀粉体中[21.,22.].在开花期(花开放)的淀粉被降解和蔗糖是重新合成从由蔗糖磷酸合酶和/或蔗糖合酶的那些糖。然后,这些蔗糖分子通过质膜本地化蔗糖转运SWEET9导出到细胞外空间[21.].在细胞外间隙细胞壁上,INVERTASE4 (CWINV4)将蔗糖裂解为己糖单体果糖和葡萄糖[22.].己糖产生负水势使水朝糖移动,从而形成液滴花蜜[22.].
在RNA-seq数据中确定了假定的pennycress与每一个基因的同源性,或参与上述每一个花蜜生产步骤的代表性酶。此外,这些基因不仅存在于pennycress转录组中,而且在成熟蜜腺中高表达(读计数在所有表达基因的前1.5%),并显著上调(p<0.05)在日益成熟的未成熟蜜腺(附加文件2图。4和5).这些基因编码的蛋白质可能涉及淀粉降解(β-淀粉酶1,BAM1, Ta10910),蔗糖合成(蔗糖合酶,SUS, Ta03482),蔗糖输出(SWEET9, Ta02294)和细胞外水解(CWINV4, Ta24444)等步骤。
讨论
大多数十字花科的花,包括芸苔属植物SPP。和拟南芥,含有两组非等效的水平。横向扁平碱产生绝大多数花蜜,位于短雄蕊的基础上,而中位数产量产生很少或没有花蜜,并发现长雄蕊的基础[16.].有趣的是,菥蓂蜜腺结构似乎是独特的,至少相对于其它农业上重要的十字花科,因为它们有四个等效蜜腺分泌花蜜液滴入凹结构在花瓣的底部(图1).位于每朵花同一内侧的两个蜜腺通过组织脊彼此相连(图)。1 c),而在相同侧面上的蜜腺被短稳压器分开(图。1 d);目前还不清楚连接两个相邻蜜腺的组织是否在分泌蜜腺中起作用,比如连接供应血管。Pennycress的小的,开放型的花很容易获得花蜜滴表明它被通才传粉者访问,这确实是最近的报道[11.,25].主要的游客菥蓂鲜花包括小蜜蜂,苍蝇,和蝴蝶[11.,25].
从一些物种蜜腺在其表面上stomates在积极分泌花强烈染色淀粉,包括拟南芥和芸苔属植物拉伯[26].这也适用于pennycress,通常每个蜜腺有~ 3-5个气孔(如图。1D,E).有人认为蜜腺的气孔是“修改过的”,并且是永久开放的[27,但似乎这种现象只在单一物种中进行过彻底的试验[23.,28,29].
在两个发育时间点进行银行蜜腺素的转录分析,以获得一种基因的快照,其中基因定义了花蜜生产的土壤制备,在活性分泌中的一个。RNA-SEQ派生的Contigs(附加文件1)映射到超过12,000个Pennycress基因(附加文件2),这相当于所预测的基因的45%存在于菥蓂草案基因组[30.].这表明,目前的mRNA在蜜腺取样到接近枯竭。
未成熟和成熟的粪便脱光对潜在新发现的比较表达分析,潜在的新发现概述在未指出的花蜜生产过程中。特别地,参与脂质和蛋白质合成的基因在未成熟的粪便中高度上调(附加文件3.,4和6),而囊泡运输和泛素化过程在成熟蜜腺中富集。花蜜的产生是一个分泌过程,它至少部分依赖于与质膜的囊泡融合来释放一些花蜜成分[26].因此,很可能未成熟的蜜腺会主动合成脂质,这些脂质是产生膜质材料所必需的,而膜质材料又将用于成熟蜜腺中的美浆素或颗粒促红细胞素型(囊泡型)分泌。
本研究还将pennycress蜜腺转录组与拟南芥进行了比较。在拟南芥蜜腺中高度富集表达的60%的拟南芥直接同源基因也在拟南芥蜜腺中表达,这一事实提供了有力的证据,表明两个物种之间的蜜腺成熟和蜜腺分泌机制是保守的(补充文件)4;附加文件5).此外,可能参与花蜜糖合成和分泌全途径的基因在成熟的pennycress蜜腺中显著上调(图。5).有趣的是,蔗糖 - 磷酸盐合成酶在Pennycress Nectaries中不高度表达,即使拟南芥的花蜜生产需要它们[21.].然而,直系同源基因拟南芥蔗糖SYNTHASE1(SUS1, Ta03482)在薄穗芥成熟蜜腺中高表达(图。5).而蔗糖合酶通常被认为参与了蔗糖的分解代谢[31,在某些情况下,它们参与了蔗糖的合成[32].因此,Ta03482可能在功能上取代了pennycress蜜腺中蔗糖-磷酸合酶的作用。还需要注意的是,CWINV4的高水平表达(图。4和5)是具有以下发现菥蓂花蜜是己糖占优势,含有很少或不含蔗糖[一致11.].
方法
植物材料及生长条件
菥蓂栽培MN108植株在4个″花盆中生长,在阳光生长LC8土壤中添加渗透花和蔬菜智能释放植物食品(14-14-14;按厂家说明书)在16 h昼/8 h夜的周期下,光合光通量为200 μmol m−2年代−1,温度为22℃。
蜜腺标本制备及RNA分离
两种类型的RNA样品,由Pennycress Nectaries制备:成熟的蜜腺(相当于第14-15阶段的花朵拟南芥;在[17.,38])和不成熟的蜜腺(相当于第11-12阶段的花朵拟南芥).成熟的蜜腺分泌花蜜,而不成熟的蜜腺是分泌前的。用手摘取约40日龄植株初生花序的所有蜜腺组织。由于蜜腺体积较小,解剖在黎明后4 - 8小时内进行,这是相关十字花科植物分泌蜜腺的高峰期[19.].分离的蜜腺在RNAlater™溶液(Ambion, Austin, TX)中冷藏,并在RNA提取前储存在4°C。每朵花最多采集4个蜜腺,大约200个蜜腺被作为单个RNA样本处理。每个生物复制用不同组植物的蜜腺来表示。
RNA提取、文库创建和测序
通过使用微量离心杵的机械破坏从Nectaries中提取RNA,并使用具有植物RNA分离助剂(Ambion,Austin,Tx)的RNAwewous®-micro RNA分离试剂盒(Ambion,Austin,Tx)。琼脂糖凝胶电泳和紫外分光光度法用于评估所有样品的RNA质量在提交到明尼苏达大学基因组学中心进行条形码库创作和Illumina Hiseq 2500测序。六个Truseq RNA V2文库从〜500ng的总RNA(用于未成熟和成熟蜜腺的三份样品)产生并通过50bp测序,使用快速化学在Hiseq 2500上进行配对延伸。将所有图书馆汇集并在两个车道上测序,以实现相当于一个车道输出。这产生了〜368米的总读数(〜184米配对读数),平均质量评分高于Q30。
RNA-SEQ质量,组件,标准化和统计分析
使用Trinity分别组装来自未成熟和成熟的蜜腺样品的测序读数[39],自动将阅读质量和一致性考虑在内,然后与Dorn等人的转录组合并[40产生49,933个contig。Reads被NCBI的blastn映射到这个contig集合,e值截断为0.00001,计数上四分位数归一化。使用DESeq v1.6.1将归一化计数拟合为负二项分布[41].由此产生的p通过限制在未成熟和成熟样品之间的平均表达中具有50%或更大变化的CONTIG来过滤来自DESEQ的价值,并且在任何一种样品类型中具有至少100或更多的归一计数。本杰里尼 - Hochberg方法用于控制决定差别表达为0.05的角色的假发现率42].
RT PCR验证
从各种组织菥蓂总RNA作为用于上述蜜腺描述和cDNA根据制造商的说明用Promega的反转录系统(A3500,Promega公司,麦迪逊,WI,USA)中创建分离。无反转录阴性对照也被用来确保没有污染的基因组DNA。半定量RT PCR反应包括7微升水中2O、2.5 μL基因反向引物(10 μM)、2.5 μL基因正向引物(10 μM)、12.5 μL GoTaq®(Promega Corp., Madison, WI, USA)、0.5 μL未成熟或成熟花cDNA。GAPDH作为阳性对照,因为它在组织间表达的变异相对较低。靶基因是根据蜜腺中已知表达丰富的拟南芥基因的推测同源性选择的(见[19.])。本研究中使用的所有寡核苷酸引物的序列可在附加文件中获得7.样品在95°C初始保持120 s,然后重复95°C 30s, 55°C 30s, 72°C 70s。反应经过27、30、35、40次循环后,可去除5.5 μL的DNA。每次移除前,循环保持在72°5分钟,然后冷却到21°C。5 μL PCR产物在1%琼脂糖/TAE凝胶上用SYBR Safe (S33102, ThermoFisher)进行可视化。
显微镜
对于图像土壤淀粉,鲜花,用萼片和花瓣染色,在Lugol的溶液(L6146,Sigma Chemical)中染色〜30秒,在水中漂洗〜3分钟,并立即用立体显微镜成像。
为了通过共聚焦显微镜检查蜜腺形态,使用了Landis等人改良的方法[43].简单地说,鲜花在戊二醛固定液(4%戊二醛25mm NaPO)中固定4(pH值7.3)在4°C下过夜。花组织经过一系列乙醇/水漂洗:50%在−20°C下冲洗90分钟,70%在−20°C下冲洗90分钟,85%在4°C下冲洗60分钟,95%在4°C下冲洗60分钟,95%在4°C下过夜。用100%乙醇漂洗1 h,再用100%乙醇4℃过夜,再用100%乙醇室温漂洗1-2 h。使用Histo-Clear(国家诊断公司)在室温下(1:0,3:1,1:1,1:3,0:1)用一系列Histo-Clear:乙醇漂洗去除覆盖蜜腺的蜡质角质层,每次1小时。然后依次用稀释的乙醇漂洗液将组织(75%,50%,25%,0%)再水化1小时。为制备荧光显微镜下的样品,花用1% (w/v)苯胺蓝与磷酸盐缓冲盐水混合,真空渗透10分钟,孵育过夜,并在成像前在水中漂洗。明尼苏达州成像中心大学的尼康A1谱共聚焦显微镜用于将整个染色的花朵图像在405nm处激发,发射从500到550nm收集。使用NIS元素软件从Z堆栈系列生成三维图像。
不成熟与成熟水平的功能群超级陈述分析
成熟蜜腺和不成熟蜜腺中>基因的表达有2倍的显著差异6,由DESeq和FDR通过benjamin - hochberg方法确定,p使用Panther分类系统使用默认设置和Bonferroni校正来分析<0.05),使用默认设置和多个测试(p<0.05)([44]http://pantherdb.org/).
缩写
- BAM:
-
β淀粉酶
- CWINV:
-
细胞壁转化酶
- RT PCR:
-
反转录聚合酶链反应
- SUS:
-
蔗糖合成酶
参考资料
- 1。
Godfray HC, Beddington JR, Crute IR, Haddad L, Lawrence D, Muir JF, Pretty J, Robinson S, Thomas SM, Toulmin C.粮食安全:养活90亿人的挑战。科学。2010;327:812-8。
- 2。
Hoffmann M,Hilton-Taylor C,Angulo A,Bohm M,Brooks TM,Butchart Sh,Carpenter Ke,Chanson J,Collen B,Cox Na等。保护对世界脊椎动物状况的影响。科学。2010; 330:1503-9。
- 3.
促进野生植物快速驯化为油料作物的新方法:例如pennycress (菥蓂l .)。植物科学。2014;227:122-32。
- 4.
Fan J, Shonnard DR, Kalnes TN. p.b.j, s.r: pennycress的生命周期评价(菥蓂L.)衍生的喷气燃料和柴油。生物质生物能源。2013; 55:87-100。
- 5.
Johnson Ga,Kantar MB,Betts KJ,Wyse DL。明尼苏达大豆双裁剧系统中的野外手段生产和杂草控制。Agron J. 2015; 107:532-40。
- 6。
院长JE,威尔RR。芸苔覆盖作物在大西洋中部海岸平原氮潴留。ĴENVIRON资格赛。2009; 38:520-8。
- 7。
Snapp SS, Swinton SM, Labarta R, Mutch D, Black JR, Leep R, Nyiraneza J, O'Neil K.评估覆盖作物在种植系统生态位中的效益、成本和性能。阿格龙j . 2005; 97:322-32。
- 8。
克莱恩AM,VAISSIERE BE,甘蔗JH,STEFFAN-Dewenter我,坎宁安SA,克曼C,在不断变化的世界农作物授粉景观的Tscharntke T.重要性。P罗伊志B-生物科学。2007; 274:303-13。
- 9.
Calderone的NW。昆虫授粉作物,传粉昆虫和美国农业:本期1992-2009汇总数据的趋势分析。Plos一个。2012; 7:e37235。
- 10。
国家传粉者研究行动计划。http://bobamawhitehouse.archives.gov/sites/default/files/microsites/ostp/pollinator%20research%20.pdf..
- 11.
Eberle CA, Thom MD, Nemec KT, Forcellaa F, Lundgren JG, Gesch RW, Riedell WE, Papiernik SK, Wagner A, Peterson DH等。利用平瓣菜、亚麻荠和油菜籽作为经济覆盖作物来提供传粉者。作物学报2015;75:20-5。
- 12.
Goulson D, Nicholls E, Botias C, Rotheray EL。蜜蜂数量的下降是由寄生虫、杀虫剂和缺少花朵的综合压力造成的。科学。2015;347:1255957。
- 13.
马蒂拉·HR,奥蒂斯GW。幼虫发育过程中花粉可得性对春养蜂工蜂行为和生理的影响。Apidologie。2006;37:533-46。
- 14.
郑宝良,郑福伟,波黑星。早春日粮蛋白质水平对工蜂种群生长、生产性能和生理的影响。昆虫科学(英文版),2014;
- 15.
Davis AR, Fowke LC, Sawhney VK,低新罕布什尔州。花蜜分泌与倍性芸苔属植物拉伯和显著(Brassicaceae)II。快速循环线路水平结构的量化变异性和功能。Ann Bot。1996年; 77:223-34。
- 16.
Davis AR, Pylatuik JD, Paradis JC,低新罕布什尔州。花蜜碳水化合物的生产和组成与蜜腺解剖和位置的关系在个别花十字花科。足底。1998;205:305-18。
- 17。
鲍曼杰。拟南芥:形态和发育图谱。纽约州:Springer-Verlag New York, Inc.;1994.
- 18。
Hampton M, WW X, Kram BW, Chambers EM, Ehrnriter JS, Gralewski JH, Joyal T, Carter CJ。差异基因表达的鉴定芸苔属植物拉伯通过表达序列标签分析蜜腺。《公共科学图书馆•综合》。2010;5:e8782。
- 19.
克拉姆BW, WW X,卡特CJ。发现的拟南芥土壤转录组:鉴别基因表达在花质组织中的鉴别基因表达。BMC植物BIOL。2009; 9:92。
- 20.
Bender R,Klinkenberg P,Jiang Z,Bauer B,Karypis G,Nguyen N,Perera Madn,Nikolau BJ,Carter CJ。黄芩中花蜜生产的功能基因组学。植物群。2012; 207:491-6。
- 21.
Lin IW, Sosso D, Chen LQ, Gase K, Kim SG, Kessler D, Klinkenberg PM, Gorder MK, Hou BH, XQ Q,等。花蜜的分泌需要蔗糖磷酸合酶和糖转运体SWEET9。大自然。2014;508:546-9。
- 22。
RUHLMANN JM,克拉姆BW,卡特CJ。细胞壁转化4需要在拟南芥花蜜生产。实验植物学。2010; 61:395-404。
- 23。
Gunning BES的Davis AR。花蜜腺的修饰气孔蚕豆大号0.1。发展,解剖学和超微结构。原生质。1992; 166:134-52。
- 24。
Bender RL, Fekete ML, Klinkenberg PM, Hampton M, Bauer B, Malecha M, Lindgren K. J AM, Perera MA, Nikolau BJ, Carter CJ: PIN6在蜜腺生长素反应和短雄蕊发育中是必需的。植物j . 2013; 74:893 - 904。
- 25.
Thom MD, Eberle CA, Forcella F, Gesch R, Weyers S, Lundgren JG。油料种子的花蜜生产:农业景观中传粉者的食物。作物科学。2016;56:727-39。
- 26.
克拉姆BW,卡特CJ。拟南芥作为蜜腺功能分析的模型。性植物再植。2009;22:235-46。
- 27.
Teuber LR, Albertsen MC, Barnes DK, Heichel GH。紫花苜蓿花蜜腺的结构(Medicago Sativa.L)与花蜜生产有关。Am J Bot. 1980; 67:433-9。
- 28.
Gunning BES的Davis AR。花蜜腺的修饰气孔蚕豆l . 2。气孔数量和分布作为高产花蜜糖育种的选择标准。Acta长的矮。1991;288:329-35。
- 29。
Gunning BES的Davis AR。花蜜腺的修饰气孔蚕豆l。3。生理方面,包括与叶面气孔的比较。机器人学报。1993;106:241-53。
- 30.
田芥基因组草图(菥蓂)为驯化新冬季生物燃料作物提供工具。DNA Res。2015; 22:121-31。
- 31.
巴罗哈费尔南德斯E,Munoz的FJ,李江,Bahaji A,阿尔马格罗G,Montero的男,埃切贝里亚E,Hidalgo的男,塞斯马MT,Pozueta-Romero的J.蔗糖合成酶在SUS1 / SUS2 / SUS3 / SUS4拟南芥突变体活性足以支持正常纤维素和淀粉生产。P国家科学院院刊USA。2012; 109:321-6。
- 32.
诺埃尔GM,脑桥HG。在休眠菊芋块茎果聚糖的动员期间蔗糖合成蔗糖合酶的参与。植物SCI。2000; 159:191-5。
- 33.
王W,刘G,NIU H,Timko MP,张H. MyB305上游F箱蛋白COI1功能,调节烟草原代碳水化酶代谢(尼古拉塔巴哈克鲁克。TN90).实验植物学。2014; 65:2147-60。
- 34。
刘国强,任国强,刘国强。MYB305转录因子调控烟草花蜜腺中油桃素基因的表达。植物细胞。2009;21:2672 - 87。
- 35。
刘G,索恩伯格RW。击倒MYB305破坏蜜腺淀粉代谢和花蜜生产。植物杂志2012; 70:377-88。
- 36。
Wiesen LB, Bender RL, Paradis T, Larson A, Perera MADN, Nikolau BJ, Olszewski NE, Carter CJ。赤霉素2-氧化ase6和赤霉素在调节花蜜生产中的作用。莫尔工厂.2016;9:753-75637。
- 37.
Roy R, Schmitt AJ, Thomas JB, Carter CJ。花蜜生物学:从分子到生态系统。植物科学。2017;262:148 - 64。
- 38.
(1)拟南芥花的早期发育。植物细胞。1990;2:755 - 67。
- 39.
Grabherr MG,哈斯BJ,Yassour男,莱JZ,汤普森DA,阿米特I,Adiconis X,番L,Raychowdhury R,曾QD,等人。从RNA测序数据全长转录组件而不参照基因组。NAT BIOTECHNOL。2011; 29:644-U130。
- 40.
多恩KM,FANKHAUSER JD,慧智DL,标记MD。德的菥蓂的从头组装(菥蓂)转录组为开发冬季覆盖作物和生物柴油原料提供了工具。植物j . 2013; 75:1028-38。
- 41.
安德斯S,用于顺序计数数据胡伯W.差异表达分析。基因组生物学。2010; 11:R106。
- 42.
控制错误发现率——一种实用而强大的多重测试方法。J Roy Stat Soc B Met. 1995; 57:289-300。
- 43.
兰迪斯JB,文KL,SOLTIS DE,SOLTIS PS,奥本海默DG。光学切片和3D重建作为替代扫描电子显微镜对细胞形状的分析。申请植物科学。2015; 3:1400112。
- 44.
宓H,黄X,Muruganujan A,唐H,米尔斯C,康d,托马斯PD。PANTHER 11版:从基因本体和Reactome途径和数据分析工具的增强扩展注释数据。核酸RES。2017; 45:D183-9。
确认
不适用。
资金
这项工作得到了美国国家科学基金会(1339246对CJC)、孟山都研究生研究助理奖学金和明尼苏达大学的多元化观点和经验(DOVE)奖学金的支持。这些资助机构在本研究的设计、收集、分析、数据解释或手稿写作中没有发挥作用。
可用性数据和材料
支持本文结论的RNA-SEQ数据集可在NCBI基因表达式综合征中作为GSE96725提供。在当前研究期间使用和/或分析的附加数据集可从合理的请求上获得相应的作者。在签署物资转移协议后,可以提供佩尼克品种MN108的种子,这表明他们不会用于商业目的。
作者信息
从属关系
贡献
JBT, MDM, KMD, MEH, CJC分别构思并进行了实验,进行了数据分析,并参与了手稿的撰写。所有作者都已阅读并批准了本手稿的最终版本。
相应的作者
道德声明
伦理批准和同意参与
Pennycress品种MN108是由Don Wyse教授(农学和植物遗传学系)根据美国明尼苏达州的法律,在美国明尼苏达州科茨附近的一块田地上鉴定和收集的
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
Pennycress蜜腺contigs和read。所有蜜腺contigs的完整列表,相关的pennycresloci, top Arabidopsis hit,和标准化读计数。(XLS 5381 kb)
额外的文件2:
菥蓂蜜腺由轨迹读取。总结读取由蜜腺转录成绩单代表所有的菥蓂轨迹。(XLSX 2041 KB)
额外的文件3:
去苗条的分析.在未成熟蜜腺和成熟蜜腺之间差异表达的基因中,生物过程、分子功能和细胞成分的表达过多或过少。(XLSX 130 kb)
额外的文件4:
Pennycress和Arabidopsis的差异表达。在pennycress和拟南芥中不成熟和成熟蜜腺之间通常有差异调节的基因列表。(XLSX 200 kb)
额外的文件5:
Nectary-enriched基因。Pennycress与已知在蜜腺中富集表达的拟南芥基因同源。(XLSX 44 kb)
附加文件6:
差异表达的基因。显示>2倍差异和p<0.05在未成熟之间的表达(阶段11-12)和成熟(阶段14-15)蜜腺。(XLSX 607 KB)
附加文件7:
本研究中使用的寡核苷酸。用于RT PCR验证实验的引物列表。(XLSX 19 kb)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
托马斯,j.b.,汉普顿,法医,多恩,K.M.等等。Pennycress(菥蓂L.)土壤(结构和转录组织表征)。BMC植物杂志17,201(2017)。https://doi.org/10.1186/s12870-017-1146-8
收到了:
接受:
发表:
关键词
- Pennycress
- 花蜜
- 蜜腺
- 蜜
- 菥蓂
- 十字花科