抽象的
背景
虽然传统上对花的对称性进行定性评估,但几何形态计量学的最新进展为使用稳健的多元统计方法具体量化花的形状和大小开辟了新的途径。在这项研究中,我们首次检验了几何形态计量学检测病毒诱导基因沉默(VIGS)后花背腹侧不对称形态差异的能力。使用Fedia Graciliflora费斯。和Meyer(缬草科)为模型,利用正则变量分析比较未处理花的花冠形状和敲低表型CYCLOIDEA2A(FGCYC2A),花青素合成酶(FgANS)和空的病媒控制.
结果
未经处理的鲜花和所有Vigs的治疗在一起彼此之间的形态学,表明Vigs可能会导致花卉形状的微妙变化。击倒FGCYC2A是最显著的,影响了背瓣相对于侧瓣的位置,从而导致更像辐射对称的花。此外,FgANSKnockdowns发展更大的花与更宽的花冠筒开口。
结论
这些结果提供了一种量化特定基因在左右对称花中影响对称背腹轴发育通路中的作用的方法。此外,他们认为答可能会对花的大小和形状产生意想不到的影响。
背景
基因表达、分化和功能的自然多样性现在可以在非模式生物和跨分支中进行检测[1,2]随着新的分子工具的出现和改进的遗传资源(例如,转录om和越来越多的基因组)。在一个ngiosperms, a growing number of non-model plants are emerging to characterise the role(s) of specific genes, or gene copies following polyploidization, in the evolution of morphological novelty, especially as it pertains to floral development (e.g., flexibility in floral structures in尼哈拉(毛茛科)3.];膨胀性花萼综合征空泡(茄科)4];和粉丝器转移模拟(Phrymaceae) [5])。基因功能的检测依赖于在候选基因表达的数量、位置或时间上的实验变化后对表型变化的分析。然而,当这种变化是微妙的或由于冗余的基因功能时,精确地定位表型差异可能是具有挑战性的。由于野生种群的基因组中已经存在自然变异,这也可能更加困难。因此,当使用反向遗传学时,需要能够量化精细尺度的形状变化。这里,我们使用非模型植物,Fedia Graciliflora(缬草科),以显示耦合反向遗传学与几何形态计量技术量化形态变异的力量。
查明该科(忍冬科;续踝目由七属组成(c.350种),并在花形和果型方面表现出相当多的多样性[6,7].先前的分子研究提供了强有力的证据,表明至少有三个形态学上受限制的属嵌入到其他谱系中[8,为研究新角色的进化及其潜在的遗传机制提供了独特的机会。一个这样的例子,以嵌入的属为例联邦兴趣Gaertn。(3 spp)内Valerianella轧机。(c.是大的,强烈的左右对称的粉红色花的进化,有两个卵形的背瓣和边缘毛,无毛和拉长的侧瓣和腹瓣发育出明显的深粉色授粉向导,和拉长的花冠管(图。1) [9]源自一种假辐射形的、较小的白花谱系。Cytotaxonomic [10]和基因组大小[11研究表明联邦兴趣可能是由于多倍化的结果而进化(x= 8;2n = 32;2C = 1.14-1.79),与基于DNA流式细胞术的基因组含量几乎是两倍的两倍)与Valerianella(x= 8;2 n = 16;2 c = 0.39 - -0.61;[11])。对10个当地人口的调查Fedia Graciliflora费斯。&c.a.梅伊。横跨地中海显示的二倍体染色体数量与单个六倍异常相同(2N = 48);然而,染色体结构表明易位,(即,两个非同源染色体的断裂和重新吸取)是一种常见的现象[10,这一发现也在拟南芥人口(12,这在一定程度上解释了高数量的种群内部变异。总体上,形态特征的近期进化包括强烈的左右对称花,加上动态的基因组结构联邦兴趣,使其成为研究表型转变的分子机制的有价值的属。
一种通常与植物多样化和自适应演进相关的一种表型是花卉对称性[13,14,15],转变为左右对称(即两侧对称的花)[16]被认为是更专业的,因为具有增加的形象率增加[17]可能与授粉综合症的变化相关[18].从辐射形花到左右形花的转变已经多次被证明涉及到几个转录因子的募集,其中最大的焦点是TCP基因的ECE分支(即,CYCLOIDEA(赛克),Dichotoma.(Dich.)在Cyc2 Clade [19,20.])。对Zygomorphy进行多次独立转变的检查揭示了表达赛克来自ECE分支的类基因[20.局限于花冠的背侧区域(即朝向上花瓣)(见[21,22)具有丧失功能的突变体赛克- 在分子和玫瑰花中产生更多径向状花的基因[19,23,24,25].另外,重复赛克- 般的基因通常与双侧对称的变化相关[15,26].在金鱼草属植物在美国,两个CYC2基因分支成员都具有冗余功能,两个拷贝同时失去功能是产生完全放射状花的必要条件。Fedia Graciliflora拥有两个Cyc2基因的副鸟,CYC2A和CYC2B,由两侧对称的Caprifoliaceae从放射状对称的Adoxaceae分化而来的重复[27].一般表达式模式CYC2基因是CYC2B在背部和侧向花瓣中表达,同时表达CYC2A变得更局限于背部花瓣[28].根据这个一般规律,我们假设击倒一个CYC2类复制将导致部分转移到径向对称f . graciliflora.
由于功能缺失突变体在大多数非模式植物中并不容易获得,我们利用病毒诱导的基因沉默(VIGS)来检测基因功能。该技术已越来越多地用于进化发育生物学(evo-devo)研究(例如,[3.,5,25,29,30.,31,32,33,34,35,36在不具备稳定转化协议的花发育过程中下调一些蛋白质编码基因[37,38,39].VIGS同时促进单个或多个基因的下调[29,39,40,41];最近,它被证明有能力敲除参与rna定向DNA甲基化的表观遗传修饰物拟南芥[42].此外,VIGS还有助于研究源自分生组织和花器官的植物生长和分化的调控(例如,[43,44]),除非有针对性,否则它不会损害生育率[45].VIGS通常导致在基因敲除中有大量变异的花叶表型[39,40,41,46,47].在研究花的形状和对称时,解释这些不同的结果可能是复杂的;因此,报告基因通常与相关基因(GOI)同时被敲除,以验证接种成功,并推测下调[30.,37,48].在花组织中一个经常被靶向的报告基因是花青素合成酶(答;[3.,37,49,50),这种酶在陆地植物花青素的三种主要途径中都起着关键的生化作用[51].伟大的答由于花青素途径的下调,在不改变花的形状的情况下,应该会导致花组织无色素(见图)。1;额外的文件1).然而,即使使用可辨别的报告基因,也可以使大量的自然变化和微妙的形状变化可以使解释难。出于这个原因,我们包含几何形态化学(例如,[52,53,54]),以更精确地量化和形象化大小和形状的形态变化,包括对称图案[55,56,57,58,59,60,61].
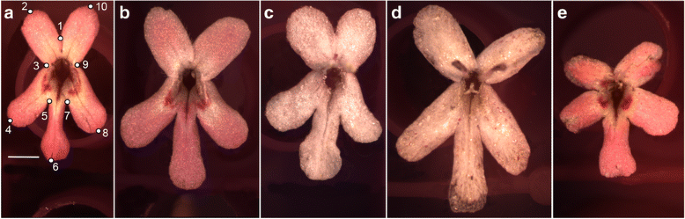
在这里,我们第一次将几何形态计量学与植物中的VIGS结合起来,以统计学的方式分析敲除植物后的形状和对称变化CYCLOIDEA2A式(CYC2A)Cyc2 Clade的Ortholog [20.] 在Fedia Graciliflora.我们量化和比较未经处理的花的形状和大小数据(图。1),模拟处理(空TRV2)控制植物(TRV2-E;图。1 b),答击倒(TRV2 -FgANS;无花果。1 c),双CYC2A和答(TRV2 -FGCYC2A+ TRV2 -FgANS;无花果。1 d)击倒,单打CYC2A(TRV2 -FGCYC2A;无花果。1 e)敲除,以量化和表征功能丧失时潜在的形状变化FGCYC2A和FgANS植物。我们对花冠花瓣位置的一致移动的发现证实了其他植物的类似结果(例如,金鱼草属植物[19),Pisum[25])丧失功能的功能CYC2A类似的同构关系导致了更径向对称的花。我们也证明了FgANS敲低的花卉形状和尺寸的微妙变化,特别是关于背部花瓣的长度和花冠槽开口的尺寸,表明酶可以直接或间接地参与花生长和发育。
方法
植物栽培技术
的种子Fedia Graciliflora费斯。&c.a.梅伊。从马耳他野生植物购买(www.maltawildplants.com).所有种子在4°C在表面灭菌之前和随后使用标准方法的发芽。将幼苗移植到单个盆(4×4×4cm)(4×4×4cm),在20-22时在全谱(6500 k)T5荧光灯的117W下生长°3-4周,以促进营养生长。为了启动开花,将生长室每个架子上的39 W全光谱灯泡替换为红色光谱(2700 K)灯泡。FgANS和FGCYC2A将基因敲除的植株接种重组菌根癌土壤杆菌(农),在红光照射后2 - 4周和花序发育开始时进行培养。
克隆FgANS和FGCYC2A
从快速冷冻中分离总RNA,并汇集f . graciliflora使用RNeasy Plant Mini Kit (Qiagen, Valencia, CA),按照制造商的协议,并包括柱上RNase-Free dnase步骤(Qiagen, Valencia, CA)的花蕾样品(即,在开花前采集的花蕾)。从总RNA中提取2 μL的cDNA,采用带有铂的上标III一步RT-PCR试剂盒Taq.(Invitrogen,Alameda,CA)。的FgANS利用简并引物克隆基因(附文件)2),基于GenBank数据库菊花×莫瑞洛(菊科;EU810810),Ipomoea hederifolia(旋花科植物;AB618110),非洲菊杂交品种塔科(菊科);AY997840),大丽花pinnata(Asteraceae; AB591830),和Lactuca sativa(菊科;AB525912)。的FGCYC2A基因克隆如前所述[27].保守的,序列特异性引物(附加文件2)的原代扩增子FgANS和FGCYC2A,利用附加的序列特异性引物,包括XbaI和BamHI限制性位点进行再扩增(附加文件)2和3.).的全长序列FGCYC2A采用5 '和3 ' RACE (cDNA末端快速扩增;SMARTer RACE 5 ' /3 '套件,克隆技术;额外的文件2),以开发序列不相似区域的引物赛克- 麦克拉多哥。使用Brest(NCBI)进行测序,验证所有PCR产物,并沉积在Genbank(KX981057和KX981058)中。
病毒接种
烟草响尾蛇病毒(TRV)含RNA1和RNA2的二元表达载体[62,63的反义片段结扎产生FgANS(455个基点)FGCYC2A(296 bp)进入ptrv2二进制向量以产生ptrv2-FgANS和pTRV2 -FGCYC2A重组载体(附加文件3.).
重组pTRV2结构体被引入农(EHA105) (ATCC)冻融培养,并在含25 mg L的LB培养基上维持−1利福平(EHA105的选择)和50毫克L.−1卡那霉素(二元载体的选择)。从LB选择板传代至5 mL LB选择肉汤进行液体培养。培养物于28℃摇瓶孵育48-72 h,接种于30 mL含200 μM乙酰丁香酮的LB中孵育12-24 h,再悬浮于10 mM MgCl的渗透培养基中2, 10 mM MES, 200 μM acettosyringone)至光密度0.8-1.0,25℃孵育2 h [63].Co-infiltration的农pTRV1与pTRV2- e(1:1)、pTRV2-FgANS(1: 1), pTRV2 -FGCYC2A(1: 1)或pTRV2-FgCYC2A +pTRV2 -FgANS(1:1:1)用无针注射器接种于紧接正在发育的花序的两组叶片中,以增加病毒载量,如前所述[62].除未处理14株外,接种以下品种56株:6株TRV2- e, 15株TRV2-FgANS,8 trv2-FGCYC2A, 27 TRV2-FGCYC2A+ TRV2 -FgANS.将植物留在湿度室过夜以进行共培养,之后它们返回生长室。
定量表达和下调FgANS和FGCYC2A
接种后2-3周采集各处理的芽。每个处理(包括未经处理的处理)获得6个生物重复,每个重复代表一个独立的接种,以及按照前面提到的方案提取总RNA之前在液氮中快速冷冻。味蕾TRV2 -FgANS和trv2-FgCYC2A +TRV2 -FgANS接种植株根据其下调的表型优先选择,而单独接种TRV2-的植株优先选择FGCYC2A是随机采样。开发了引物来扩增FgANS(360个基点)FGCYC2A(169 bp)(补充档案3.)进行实时定量PCR (qPCR)分析(图。2;额外的文件4).PCR产物测序,BLAST验证(NCBI)。RNA样本归一化为2ng mL−1使用SYBR Green (Bio-Rad, Hercules, CA)的iScript一步RT-PCR试剂盒进行qPCR。相对表达水平FgANS,FGCYC2A,FGCYC2A + FGANS,和参考基因,甘油醛3磷酸脱氢酶(GAPDH.),计算有三个生物重复的重复(两个技术复制)使用2——ΔΔCT方法(64].化验的FgANS,FGCYC2A,FGCYC2A + FGANS,内参基因在Bio-Rad MyIQ单色实时荧光定量PCR检测系统(Bio-Rad, Hercules, CA)上96孔板上检测。
对称的几何形态分析
在这里,我们测试的假设结果的表型f . graciliflora由VIGS击倒产生FGCYC2A和FgCYC2A + FgANS与敲低相比,在形状和尺寸方面发展不同的形态FgANS、模拟处理(TRV2-E)对照和未处理对照。我们使用几何形态计量方法结合多元统计形状分析来测试未处理和不同敲除花表型之间的差异(例如,[65,66])。使用安装在蔡斯Stemi-2000-C立体显微镜上的Lumenara相机(# Infinity2-1C-ACS),以相同的方式拍摄了来自总共70种植物的136朵花。考虑到VIGS的花叶特性,从花冠筒中随机挑选出白色的花(未经处理的是深紫红色)FgANS被击倒了。来自未经处理的花卉,TRV2-E和TRV2-FGCYC2A都是随机选取的。从花序上取下后,每朵花的繁殖结构被切断,花瓣被置于水中。在放置地标之前,对图像进行回顾,并根据以下标准选择最终的图像数据集:(1)花朵代表完全成熟和开放的花朵;(2)花朵没有部分浸水或折叠;(3)路标位置缺乏可能影响路标位置重现性的重叠生殖结构。对于每张照片,使用tpsDig2 2.17版本在两个维度上收集了一套10个地标[67来描述建筑的特点f . graciliflora花(图。1).这些标志要么位于原脉和次脉与花瓣边缘的交点,要么位于花瓣基部的交点。
Fedia Graciliflora鲜花具有双侧对称的轴线,通过腹侧花瓣的中间(由地标1和6描述,图1和6描述。1),并在物体对称法中加以考虑[56,57,58,60].按照这种方法,地标的原始配置由成对的地标构成,它们是相对于对称轴的彼此镜像,并且位于对称轴之外,而未成对的地标位于对称轴上。首先,地标的原始配置被复制,然后,这些副本通过成对地标的适当重新标记被反映出来。然后,对双数据集进行广义Procrustes拟合,去除尺寸、位置和方向等无关信息,根据最小二乘准则提取形状数据。计算平均形状配置(一致),并围绕该平均值(例如,[65,68,69,70)被分解成具有生物学意义的组成部分。因为我们感兴趣的是在种群水平上,未处理的花和所有处理的表型之间的差异,我们只考虑对称形状变异的组成部分,它是通过对每个个体地标的原始和经过适当转换和重新标记的副本的Procrustes坐标进行平均来计算的。因此,这里简化了双边对称结构研究中传统使用的双向混合模型Procrustes方差分析(ANOVA),并根据成像和数字化导致的“个体”和测量误差的主要影响分解了总形状变化[58,60,71,72].为了测试由于成像和数字化造成的测量误差,每朵花都被拍摄了两次,每张照片都被数字化了两次。
质心大小是几何形态测量学中最常见和最明确的尺寸测量方法,其计算方法为所有地标距离质心的平方和的平方根(例如,[65,73,74])。用质心大小的单因素方差分析来测试未处理的花和所有其他处理之间的大小差异(附加文件5).通过Tukey的“诚实显著差异”(Honest Significant Difference, HSD)评估大小两两差异的统计学意义,并根据R [75)(附加文件5).为避免由于我们分析中的规模而在群体之间潜在的混淆效应,我们在质心尺寸上使用了汇集的小组内部多变量回归竞争坐标[76].形状变量和质心大小之间关系的统计显著性是通过10,000轮随机排列的排列检验来评估的[76,77].大小对形状有显著影响(P-值= 0.002),形状对形心尺寸的回归占总形状变异的3.6%。
为了测试形状上的差异,并可视化未治疗对照和击倒治疗之间的变化模式,我们使用了规范变量分析(CVA)。这是一种判别分析,旨在最大化组间差异和最小化组内差异,以获得组间可能的最佳隔离(例如,[78,79,80,81,82])。由于尺寸对形状有显著影响,我们仅使用形状对形心尺寸回归的残余分量,与组内变异和组间尺寸相关差异的异速生长分量分离。使用Procrustes距离(例如,[53,65,70]),它是基于路标的方法中的标准度量,用于描述组间形态差异的度量(例如,[83)(附加文件6).我们还使用判别分析,对未经处理的花朵的平均整体形状与每一处理的平均形状进行具体的两两比较,以可视化每一组与未经处理的样本相比的平均形状偏离。所有分析均使用MorphoJ进行[84]和r [75].
结果
击倒的FgANS和FGCYC2A基因
描述由于…的功能丧失而引起的假定的形状变化FGCYC2A和FgANS,我们建立了烟草响尾蛇病毒(TRV)介导的VIGS系统[62,85] 在f . graciliflora.引入二元载体结构(pTRV1和pTRV2)农并用于表达针对靶基因转录本的反义片段。我们的策略有三:(1)开发一种高效的rna沉默系统f . graciliflora;(2)应用这一体系来检验假定的角色FGCYC2A在f . graciliflora花卉发展;(3)利用几何形态分析来表征突变体的表型。在f . graciliflora的反义片段FgANS置于双CaMV35S启动子(TRV2-FgANS;额外的文件3.).尽管尝试了几种接种方法,包括真空渗透和花浸,直接通过无针注射器渗透叶片的背面,在花序发育之前产生最一致的下调FgANS(相同的是观察到的FGCYC2A).
42株接种了TRV2-的植物FgANS或TRV2-的组合CYC2A+ TRV2 -FgANS在美国,所有42种植物都能产生至少一些花朵,这些花朵显示出低水平的答.如前所述[3.,37,49,50],重视答同源基因导致花叶表型,下调程度从轻微到强烈,从大部分白花布满花青素细胞到斑点状花青素填充区域到完全下调的白花(补充文件)1).模拟处理的植物(TRV2-E)也进行了比较,以检查任何可能的影响农病毒结构的渗透和随后的系统运动进入分生组织对整个花的形态有影响。
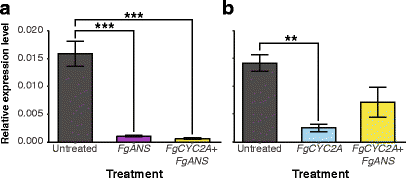
对未处理对照(N= 7) TRV2 -FgANS(N= 6) TRV2 -FGCYC2A(N= 3)和TRV2-FGCYC2A+ TRV2 -FgANS(N = 3)处理的植物,证实下调是由于病毒接种剂下调内源性转录本(图。2).未处理和TRV2-E花之间未检测到差异(附加文件7和8);但是,重大减少FgANS当将未处理的水平与TRV2-检测到的水平进行比较时,可以观察到转录本丰度FgANS(P < 0.001) or TRV2-FGCYC2A+ TRV2 -FgANS(P< 0.001)击倒(图。2).为了确定观察到的花冠的表型变异性是由于敲除FGCYC2A,我们比较了内源性的水平FGCYC2ATRV2-在未处理的芽中转录丰富FGCYC2A单击倒和TRV2-FGCYC2A+ TRV2 -FgANS击倒(无花果。2 b).在TRV2-发现内源性转录物水平的非显着降低FGCYC2A+ TRV2 -FgANS植物与未经处理的样品相比,同时显着减少(P< 0.01)的内源性转录水平在未处理和TRV2-之间观察到FGCYC2A植物(图。2).
VIGS敲除的几何形态分析
未经处理的样本测量误差的方差分析显示,“个体”的主要影响是显著的,这意味着花之间的差异大大超过由于成像的测量误差(附加文件9).“成像”误差代表的是在不同阶段为同一个人拍照时的测量误差。这一项意义重大,即成像误差大于数字化误差。“数字化”误差是指在不同阶段对同一个人的同一幅图像进行数字化时,由于测量误差而产生的误差。这些结果表明,种群水平上的生物变异很大程度上超过了未经处理的样本中由于成像和数字化而产生的所有测量误差来源。同样,在涉及其他处理方法的所有分析中,测量误差也可以忽略不计。
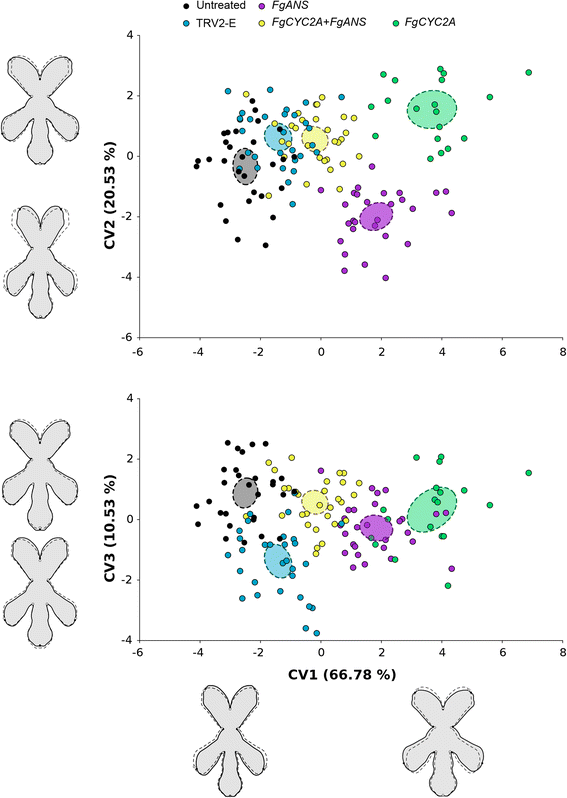
CVA图显示不同组对称形状变化的组件的形态分离模式(图。3.).CV1占组间相对变异量的66.78%,CV2占20.53%,CV3占10.53%。CV1显示的形状变化主要影响花冠管的宽度和背侧花瓣的位置。具体地说,从负向正方向,位于背瓣顶端的标志向下移动,稍稍偏离对称轴;而位于侧瓣顶端的标志向上移动,稍稍偏离对称轴。CV1将所有的治疗分开,最大的差异发生在未处理的样本和FGCYC2A可拆卸的。值得注意的是,这两个单基因敲除的植物FgANS和FGCYC2A在CV1中,从阴性向阳性的转变大于FgCYC2A + FgANS双可拆卸的植物。CV2代表的形状变化,使背侧和侧瓣远离对称轴,只有沿背侧轴的变化很小。CV2分离得最清楚FGCYC2A从FgANS击倒,背和侧花瓣更接近对称轴在FgANS并且远离对称轴FGCYC2A.集体,CV1和CV2描述了从Zygomorphic的形态变化到放射体状的花朵。CV3描述了主要局部局部局部局部局部偏离花的腹侧区域,而且还揭示了与具有短腹侧花瓣的模拟处理(TRV2-E)花的背区微妙变化,其具有短的腹侧花瓣的花瓣(图。3.).
的典型变量分析(CVA)图Fedia Graciliflora花朵形状的数据。模拟处理对照(TRV2-E)对CVA进行组内异速生长校正(N = 30),FgANS(N = 28),FgCYC2A + FgANS(n = 30),和FGCYC2A(N= 19)击倒处理与未处理相比(N= 29)。每组均值的95%置信椭圆表示(虚线填充椭圆)。花的轮廓图纸显示形状变化与每个简历相关的总体平均形状(虚线和开放的圆圈)CV1分数−3 + 4,CV2分数−3 + 2,和CV3分数−2 + 2(固体黑色轮廓与灰色背景和固体黑色圆圈)。请注意,这些轮廓图是基于薄板样条技术的实际地标的内插形式,使形状变化更容易可视化。这意味着CVA中的相关信息来自于地标的位置,而不是轮廓图
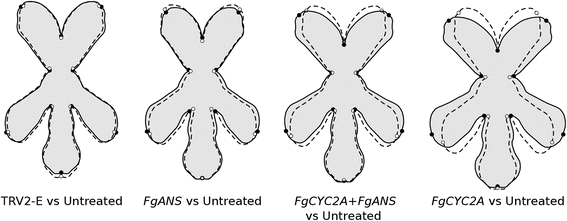
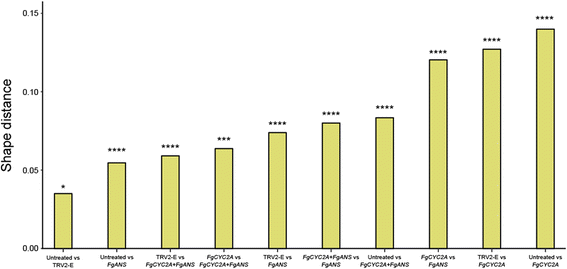
对未处理样品和各处理进行两两比较(图。4)表明,TRV2-E植物的花与未接种的花非常相似,但花瓣长度略有差异。此外,FgANS被击倒的植株在整体形状上也与未被击倒的植株相似,但花冠管更宽,背瓣更短,侧瓣略微向背瓣移动。尽管花FGCYC2A击倒则更为极端FGCYC2A和FgCYC2A + FgANS敲低展示了形态的相似变化,明确转向更径向对称的花朵。具体而言,横向纵横覆盖并朝向彼此移动,减小它们之间的角度。非参数测试表明,这些组中所做的所有成对比较都是非常重要的(图。5额外的文件6),说明不同基因敲除处理和未处理花的表型是不同的,其中花瓣位置相对于两侧对称轴的形态差异最大的是FGCYC2A与未经处理的控制相比,击倒。
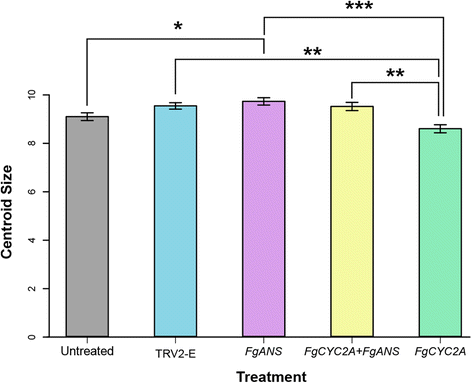
有关处理之间比较的质心大小的方差分析表明,在未处理对照和所有击倒处理之间存在大小差异。Tukey ' s HSD进一步评估了大小成对差异的统计学意义,并进行了多次比较调整,表明未处理的花和未处理的花在大小上存在显著差异FgANS在TRV2-E和FGCYC2A可拆卸的,FgANS和FGCYC2A可拆卸的,FGCYC2A + FgANS和FGCYC2A可拆卸的,FGCYC2A击倒的花比其他处理略小,包括未处理的对照(图。6额外的文件5).
讨论
击倒花内显著变异Fedia Graciliflora
随着检测基因序列、表达和功能的工具的数量不断扩大,利用非模式物种更好地理解分子过程的能力也变得更加切实。这些非模式物种和进化支提供了广泛的自然变异,以检验分子序列的变化如何最终改变形态[26].通过更多样化的物种阵列检查基因表达和功能的能力,例如,可以对相同形态变化的多次迭代进行比较[86]或形态学的逐步变化[28,87,88,89].
Vigs是一种强大的技术,用于检查非模型植物中的敲低表型,这些植物少于稳定的转化方法的劳动密集且更快速[40].在Fedia Graciliflora例如,接种后平均需要3-4周才能观察到下调的表型。不幸的是,VIGS表型很难测定,因为GOI的敲减通常是嵌合的和短暂的[39,40,41,46,47].为了进一步使对Vigs的评估复杂化,最近进化物种内的固有和遗传的自然变化可能难以分开。尽管可能的基因组背景多样化联邦兴趣,它仍然是一个非常有用的组,花的对称性的发育研究,因为这三个物种中的每一个都有强烈的左右对称的花,花瓣的背侧排列明显。此外,f . graciliflora生长迅速,每株能开出100多朵花。
量化形状变化FGCYC2A可拆卸的
的作用CYC2类基因的模式花的对称性已经在被子植物中进行了研究,主要集中在开花植物的冠组,核心的双子体(见[21,26])。在核心双二子叶植物中,包括跨瓣目,CYC2拟对数的表达在两侧对称的花中背侧受限[21,90].我们之前已经证明,在其他的续踝目物种中,背侧限制的程度与背侧和腹侧区域(即两侧对称的程度)的差异相关[22,28].在asterid和rosid进化枝中,一个或多个CYC2拟对数功能的丧失导致向更径向对称的、腹部化的花方向转移[19,23,25].在金鱼草属植物,都是CYC2谬误,赛克和Dich.,必须同时表现出功能的丧失,才能产生完全放射状的花[19].每个拟象函数的损失分别只导致部分的双边对称性的损失赛克具有比。强表型的突变体Dich.突变体(19,这表明这两种谬误已进化出一定程度的功能冗余。
随着Cyc2副病虫戈的背部限制,Zygomorphic谱系倾向于维持两份或更多份CYC2类基因(见[21,26])。在复裂科中,在左右对称的忍片科的多样化周围发生了重复s.l。导致两个CYC2例如拷贝(Dipscyc2a.和Dipscyc2B.),两者都有在大多数谱系中保留的直肠(或通过后续重复的额外副寄生),包括f . graciliflora(例如,FGCYC2A和FGCYC2B.) [22,27].因此,通过敲除一个CYC2模拟f . graciliflora,FGCYC2A,我们预计会部分丧失两侧对称。
其实,给了可变的花f . graciliflora, VIGS的镶嵌特性,以及VIGS的功能冗余CYC2- 般的基因拷贝,难以单独用眼睛一致地确定敲低表型。然而,通过利用几何形态化学测量从从每个治疗中随机选择的花照片的形状变化,两者都明显朝向径向对称的花的变化FGCYC2A和FGCYC2A + FgANS如CV1和CV2的变化所示(图2)。3.)和两两比较(图。4).
典型的未处理花f . graciliflora有一个拉长的腹瓣,通常是弱爪和侧面瓣典型的无爪和稍短(图。1).侧面和侧面的花瓣在花冠开口附近都有厚的、深粉色的花青素带作为授粉向导。背面花瓣,另一方面,更短,通常更圆,总是缺乏额外的粉红色标记。与未经处理的花相比,FGCYC2A敲除突出了预期的表型,部分转移到一个更径向对称的花。侧瓣和背瓣看起来更腹部化,与未处理的相比,它们的花瓣平均更长。背瓣也经常包含花青素标记,类似于腹瓣和侧瓣。花瓣的位置也从背腹轴转移到更径向的位置,背瓣向腹侧移动,侧瓣向背侧移动(图。4).
CVA揭示了所有治疗方法之间的差异
CV3将TRV2-E与其他组稍微分开,考虑到数据之间细微的形状变化和重叠,这可能是采集到的植物腹部花瓣长度的自然变化。另一方面,CV1和CV2描述了向放射状对称花的转变。未处理和模拟处理(TRV2-E)植株在CV1中重叠,并逐渐向正方向分离FGCYC2A + FgANS从FgANS和FGCYC2A可拆卸的。FGCYC2A和FgANS在正方向上击倒最远,两组都有更宽的花冠管和侧向花瓣背向移动。在这两个FGCYC2A和FgANS敲低,背部瓣瓣介绍;然而,我们假设不同的形态变化正在形成这种结果。在FGCYC2A通过增加背瓣之间的角度,背瓣向腹侧移动,如在CV2和两两比较中所见(Figs。3.和4).在FgANS敲低,背部花瓣标准似乎向下移动,因为背部花瓣较短(见图。4).此外,CVA图还显示了在FgANS和FGCYC2A击倒在CV1中相互相对,因为双击倒没有像单一敲击一样移动。这可能是因为背部花瓣FGCYC2AKnockdowns较长,距离对称轴较远,而FgANS敲落更短,更接近对称轴,这表明背瓣的长度和位置可能直接相反。
这些数据表明答能使花的形态发生微妙的变化,特别是在CV1和CV2一起分离的情况下FgANS从所有其他处理击倒。例如集中答花中的色素和花冠管开口的宽度已被证明与传粉者的偏好相关[91,92),这表明答可能与其他与授粉有关的非色素特性有关。微妙的形状也有可能发生变化FgANS敲低可能是能量或资源分配的结果,因为不再产生厚的花青素引导件。在f . graciliflora,答在侧瓣和腹瓣中被不同的利用,表明它在这组中被不对称地调节。无论如何,因为答被用作报告基因来识别成功的接种,此前已在VIGS中使用[3.,32,37,49,50]研究人员应该了解生长中小变化的潜力。
Procrustes距离和质心大小
使用几何形态化学方法使我们能够量化未处理的花朵和每个实验治疗中的营销距离(图。5).正如预期的那样,未经处理的花朵在形状上与模拟处理的对照最相似,而未经处理和模拟处理之间的形状差异最大FGCYC2A可拆卸的花朵。这些类型的数据可以用来测试关于协议设计效率的假设。例如,双基因敲除的VIGS协议通常包括单个TRV2结构上的两个基因[32,36,37,93,尽管当使用大麦条纹花叶病毒,研究人员已经成功地将两个单独的TRV2结构上的片段接种和下调基因[94,95].我们的双击倒FgANS和FGCYC2A使用后一个协议,因为最初的目的是利用FgANS来实现成功的下调。在两次击倒中,TRV2-FgANS和trv2-FGCYC2A以(1:1)的比例添加,与单个敲除相比,每个载体的浓度只有一半。我们的结果显示,在单一FGCYC2A与双击击相比,敲击时,每个治疗和未处理的花朵之间的形状距离在单次敲定中的比大于1.5倍(约1.66)。检查平均形状成对比较(图。4),双张开时显示与单一的地标运动相似FGCYC2A击倒,但他们没有转移。未来的实验可能包括检测双敲除后的形状距离,该敲除使用包含这两部分的单个TRV2载体FgANS和FGCYC2A.在给定的实验中,计算控制和不同处理之间的Procrustes距离可以用来比较协议之间的效率。
除了整体形状距离之外,细菌尺寸也在处理中变化。FGCYC2A击倒的质心大小比其他所有处理都要小,可能是由于花朵更径向对称和/或整体上更小的花朵的发展。FgANS另一方面,Knockdowns的质心大小明显大于未处理的对照组,这可能是由于花朵更长和/或整体上发展出更大的花朵。双击倒更类似于FgANS可拆卸的比FGCYC2A支持假设丧失花青素颜料的假设可能意味着更多的能量可用于生长,导致略大的花朵。
结论
VIGS与几何形态计量学耦合的能力
对非模式物种使用VIGS,例如Fedia Graciliflora,可以用于提供关于基因功能的快速,有用的信息,条件是可以量化形态变化和清晰地分析。虽然几何形态识别性长期以来一直用于动物研究,但使用它越来越兴趣地使用它来分析花和叶形(例如,[3.,14,96,97,98,99]),在分类学上(例如,[13,One hundred.),在生态学中(例如,[101,102]),以及在进化背景下(例如,[3.,103,104,105])。在这里,我们首次说明了几何形态计量学如何有效地用于量化敲除单个CYC2相似物的表型效应,FGCYC2A,以及报告基因,FgANS.未来的研究可能会检查受这些因素影响的特定形状成分赛克(1)不同的拟并行是否表现出部分冗余函数;(2)副对数的累积效应如何加在一起,形成形状上日益增加的复杂性。这为进一步理解花形态变异的遗传学和发育起源开辟了广阔的应用前景,特别是在对称和不对称的背景下,对称和不对称被认为在被子植物的适应性多样化中发挥了重要作用。
缩写
- “HSD”:
-
诚实的显著差异
- 方差分析:
-
方差分析
- 答:
-
花青素合成酶
- 英国石油公司:
-
碱基对
- C:
-
摄氏
- 互补脱氧核糖核酸:
-
互补脱氧核糖核酸
- CV1:
-
正则变量轴1
- CV2:
-
正则变量轴2
- CV3:
-
正则变量轴3
- 患者:
-
典型变量分析
- 赛:
-
CYCLOIDEA
- CYC2A:
-
CYCLOIDEA2A
- DICH:
-
Dichotoma.
- 今晚的:
-
进化发育生物学
- Fg:
-
Fedia Graciliflora
- FgANS:
-
江蓠花青素合成酶
- FgCYC2A:
-
Fedia graciliflora CYCLOIDEA2A
- GAPDH:
-
甘油醛3磷酸脱氢酶
- GOI:
-
感兴趣的基因
- h:
-
小时
- 凯西:
-
开尔文
- 磅:
-
溶原性肉汤
- mg L−1:
-
毫克每升
- Mgcl.2:
-
氯化镁
- mL:
-
毫升
- 护士:
-
样本大小
- ng ml.−1:
-
毫微克每毫升
- PCR:
-
聚合酶链反应
- pTRV1:
-
和富RNA1质粒
- pTRV2:
-
和富RNA2质粒
- qPCR:
-
定量实时聚合酶链反应
- TCP:
-
tB1cycloidea.PCF转录因子家族
- 和:
-
烟草使病毒
- TRV2-E:
-
用TRV2空载体接种的植物
- TRV2-FGANS:
-
用TRV2接种含有TRV2的植物FgANS片段
- TRV2-FgCYC2A:
-
用TRV2接种含有TRV2的植物FGCYC2A片段
- 中收取:
-
病毒诱导基因沉默
- W:
-
瓦特
- μL:
-
微升
- μM:
-
微摩尔的
参考文献
- 1.
张志强,张志强,张志强。花的起源与进化:基因组时代的新视角。遗传学。2016;202:1255 - 65。
- 2.
邓恩议员Howarth DG研究发育进化的系统发育方法:一个模式分支方法。In: Kliman RM,编辑器。进化生物学百科全书。牛津大学:学术出版社;2016.246 - 53页。
- 3.
王鹏,廖华,张伟,于旭,张锐,单洪,等。螺旋花结构的灵活性及其内在机制。Nat植物。2015;2:1-10。
- 4.
张建生,赵军,张松,何灿。烟草叶螨病毒介导的高效基因沉默空泡.Plos一个。2014; 9:E85534-9。
- 5.
Preston Jc,Barnett Ll,Kost Ma,Oborny NJ,Hileman LC。病毒诱导基因沉默的优化促进新兴模型物种中的EVO-Devo研究Mimulus guttatus(Phrymaceae)。Ann Mo Bot Gard. 2014; 99:301-12。
- 6.
Donoghue MJ, Bell CD, Winkworth RC。续肢科生殖性状的进化。acta botanica sinica(云南植物学报);2003;
- 7.
E.水果和种子缬草枝(断吻科):多样性与进化。acta botanica yunnanica(云南植物研究),2010;
- 8.
贝尔CD, Kutschker A, Arroyo MTK。南安第斯山脉缬草科植物的系统发育与多样性。分子系统学进展。2012;63:724-37。
- 9.
文体学修订版联邦兴趣Gaertn。修订Moench(查明该科)。Nat Monspel Ser Bot, 1990; 54:3-77。
- 10.
De Ench Xena N,Cardona A,Mathez J.StudioCitotaxonómicodelGénero联邦兴趣Gaertn。(查明该科)。马德里,1991;48:157-69。
- 11.
缬草科植物基因组大小的研究:初步结果和新的假设。J机器人。2010;2010:1-19。
- 12.
丁建平,王志强,王志强,等。Chromosome-level组装拟南芥l呃揭示易位和倒位多态性的程度。中国科学院院刊2016;113:E4052-60。
- 13.
Shipunov AB,Bateman Rm。几何形态化学作为理解的工具dactylorhiza.(兰科西)在欧洲俄罗斯的多样性。Biol J Linn Soc。2005; 85:1-12。
- 14.
戈麦斯JM,完美F,卡马乔JPM。自然选择在Erysimum mediohispanicum花的形状:深入了解两侧对称的进化。阿米尔- Nat。2006;168:531-45。
- 15.
花旗H,Jabbour F,Nadot S,Damerval C,Citerne H,Jabbour F,Nadot S,Damerval C.花卉对称的演变。在:kader j-c,德尔塞尼亚,编辑。植物学研究进展:ELSELVIER LTD;2010. p。85-137。
- 16.
花的对称性:多样性与进化。acta botanica sinica(云南植物学报),1999;
- 17.
SARGENT RD。花卉对称影响缓解植物的物质率。Proc R SoC Lond B. 2004; 271:603-8。
- 18.
王志强,王志强,王志强,等。植物传粉系统中花的对称性及其作用:术语、分布和假说。《生态学报》1998;29:345-73。
- 19.
罗丹,卡彭特,文森金鱼草属植物.大自然。1996;383:794-9。
- 20.
Howarth DG, Donoghue MJ。“ECE”的系统发育分析(赛克/TB1.)演化枝揭示了早于核心双子体的重复。美国国家科学学院学报2006;103:9101-6。
- 21。
Hileman)信用证。通过系统发育和发育遗传学进展揭示花对称进化的趋势。Phil Trans R Soc B. 2014; 369:20130348-8。
- 22。
Berger BA, Thompson V, Lim A, Ricigliano V, Howarth DG。两侧对称的阐述Knautia macedonica头状突与腹侧瓣表达的变化有关CYCLOIDEA- 样基因。evodevo。2016; 7:8。
- 23。
冯旭,赵志强,田志强,徐胜,罗勇,蔡志强,等。控制花瓣形状和花的左右对称Lotus对虾.美国国家科学学院学报2006;103:4970-5。
- 24。
Kim M,Cui M-L,Cubas P,Gillies A,Lee K,Chapman Ma,等。调节基因控制物种之间转移的关键形态和生态特征。科学。2008; 322:1116-9。
- 25。
王志强,罗勇,李旭东,王磊,徐胜,杨军,等。豌豆花颧骨形态的遗传控制(Pisum一L.)。Proc Natl Acad Sci U S A. 2008; 105:10414-9。
- 26.
Specht CD,罗马DG。适应花卉形式:比较Evodevo方法。新植物。2014; 206:74-90。
- 27.
Howarth DG, Donoghue MJ。重复的赛克续踝目的类基因与花的形态相关。acta botanica sinica(云南植物学报),2005;
- 28.
Howarth DG, Martins T, Chimney E, Donoghue MJ。多样化的CYCLOIDEA在忍冬科双侧花对称性进化中的表达金银花(川绿断目)。安机器人。2011;107:1521-32。
- 29.
病毒诱导的基因沉默作为比较功能研究的工具Thalictrum.《公共科学图书馆•综合》。2010;5:e12064。
- 30.
病毒诱导的基因沉默(VIGS)Cysticapnos vesicaria,一种左右对称花的罂粟科(毛茛科,基部双子叶植物)。安机器人。2012;109:911-20。
- 31.
关键词:ranuncullid突变体,C-类花同源性基因功能,C-和e-类蛋白互作中国科学技术大学学报(自然科学版)2012;109:E2267-75。
- 32.
Gonçalves B, Nougué O, Jabbour F, Ridel C, Morin H, Laufs P, et al.;一个APETALA3同源基因控制着花瓣的特性和花的分生组织模式Nigella Damascena.l .(毛茛科)。植物j . 2013; 76:223-35。
- 33.
HSIEH M-H,PAN Z-J,LAI P-H,LU H-C,YEH H-H,HSU C-C等人。病毒诱导的基因沉默不允许涉及花卉生长和开发的多种转录因子蝴蝶兰属兰花。J Exp Bot。2013; 64:3869-84。
- 34.
潘志军,陈永勇,杜建生,陈永勇,钟明昌,蔡文昌,等。花的发展蝴蝶兰属兰花涉及功能发散sepallata.- 样基因。新植物。2014; 202:1024-42。
- 35.
宋耀昌,林鹏平,陈继忠。病毒诱导基因沉默的优化Catharanthus Roseus..植物病理学研究。2014;63:1159 - 67。
- 36.
Zhang S, Zhang J-S, Zhao J, He C. a -class MADS-box基因的亚功能化和新功能化physalis floridana.足底。2015;241:387 - 402。
- 37.
病毒诱导的基因沉默在新型模式植物中的功能分析耧斗菜(哥伦比亚,毛茛科)。植物方法。2007; 3:6。
- 38.
Velásquez AC, Chakravarthy S, Martin GB。病毒诱导基因沉默(VIGS)烟草benthamiana和番茄。J Vis Exp. 2009:e1292。
- 39.
贝克尔A,兰格M. VIGS -基因组学的功能。植物科学进展。2010;15:1-4。
- 40.
Burch-Smith TM, Anderson JC, Martin GB, Dinesh-Kumar SP.,病毒诱导基因沉默在植物基因功能研究中的应用和优势。植物j . 2004; 39:734-46。
- 41.
病毒诱导的基因沉默,一种转录后基因沉默方法。植物基因组学杂志。2009;1 - 8。
- 42.
邦德DM,BaulCombe DC。表观遗传过渡导致遗传,RNA介导的de novo沉默拟南芥.美国国家科学研究院2015;112:917-22。
- 43.
Kim BM,Inaba J-I,Masuta C.病毒诱导基因沉默金鱼草majus使用黄瓜马赛克病毒向量:功能分析AINTEGUMENTA(我-蚂蚁)基因答:majus.生物技术。2011;52:176-82。
- 44.
植物mads域因子的发育和进化多样性:来自最近研究的见解。发展。2012;139:3081 - 98。
- 45。
Senthil-Kumar M, Mysore KS。病毒诱导的基因沉默可持续2年以上,并可传递给子代幼苗烟草benthamiana和番茄。生物技术学报。2011;32(6):733 - 736。
- 46。
Meins F, Si-Ammour A, Blevins T. RNA沉默系统及其与植物发育的相关性。《细胞发展生物学》2005;21:297-318。
- 47。
Kumar P, Pandit SS, Baldwin IT。烟草响尾病毒载体:一种快速和短暂的沉默手段Manduca sexta基因被植物介导的RNA干扰。《公共科学图书馆•综合》。2012;7:e31347。
- 48。
王磊,叶胜,刘辉,等。烟草响尾草病毒(TRV)诱导的外源基因沉默是进行木本植物功能基因组学研究的有效途径。植物学报。2013;116:163-74。
- 49。
王志强,王志强,王志强,等APETALA3兔子在兔子的瘫痪及其对花瓣演进的影响。新植物。2011; 191:870-83。
- 50.
王志强,王志强APETALA3拟南花对植物新器官的进化有重要贡献耧斗菜(哥伦比亚,毛茛科)。新植醇。2012;197:949-57。
- 51.
Campanella JJ, Smalley JV, Dempsey ME。植物初级花青素生产途径的系统发育研究。机器人钉。2014;55:10。
- 52.
slice de。几何形态化学。annu rev奥克洛尔。2007; 36:261-81。
- 53.
Zelditch ml,Swiderski DL,床单高清。生物学家的几何形态化学:一个底漆。第二次。牛津大学:学术出版社;2012年。
- 54.
一个领域成熟了:21世纪的几何形态测量学。Hystrix。2013;24:7-14。
- 55.
Klingenberg CP, McIntyre GS。发育不稳定性的几何形态计量学:用Procrustes方法分析波动不对称的模式。进化。1998;52:1363 - 75。
- 56.
Mardia kv,Bookstein fl,Moreton IJ。形状双侧对称性的统计评估。Biometrika。2000; 87:285-300。
- 57.
Kent JT, Mardia KV。形状,普氏切线投影和两侧对称。生物统计学。2001;88:469 - 85。
- 58.
Klingenberg CP,Barluenga M,Meyer A.对称结构的形状分析:量化个体和不对称之间的变化。进化。2002; 56:1909-20。
- 59.
陈志强,陈志强。对称和异速生长的几何形态特征Micrasterias rotata(Zygnemophyceae Viridiplantae)。Nova Hedwig Beih. 2010; 136:43-54。
- 60.
Savriama Y,Klingenberg CP。超越双边对称:任何类型对称的几何形态学方法。BMC EVOL BIOL。2011; 11:280。
- 61.
王志强,王志强,王志强,等。花冠形状的几何形态学特征:对对称和不对称变异的解剖Erysimum mediohispanicum(Brassicaceae)。新植物。2012; 196:945-54。
- 62.
Ratcliff F, Martin-Hernandez AM, Baulcombe DC。烟草响尾蛇病毒作为基因功能沉默分析的载体。植物j . 2001; 25:237-45。
- 63.
刘Y,Schiff M,Marathe R,Dinesh-Kumar Sp。烟草Rar1.,EDS1和NPR1/NIM1就像基因一样N-介导的烟草花叶病毒抗性。植物j . 2002; 30:415-29。
- 64.
Livak KJ, Schmittgen TD。使用实时定量PCR和2−ΔΔCT方法分析相关基因表达数据。方法。2001;25:402-8。
- 65.
德莱顿IL,玛迪亚KV。统计形状分析。奇切斯特:威利;1998.
- 66.
几何形态测量学:“革命”后的十年进展。[J] .成都师范大学学报(自然科学版)。
- 67.
Rohlf FJ。tps系列软件。Hystrix。2015;26:9-12。
- 68.
Rohlf FJ, Slice D.最优地标叠加Procrustes方法的扩展。系统医学杂志。1990;39:40-59。
- 69。
古道尔C.普罗克鲁斯蒂的方法在形状的统计分析。[J R Statist Soc B. 1991; 53:285-339 .]
- 70.
slice de。通过促进分析对齐的地标坐标不会位于肯德尔的形状空间中。系统中的生物学。2001; 50:141-9。
- 71.
近交系和杂种家鼠的形态计量学研究。V.方向和波动的不对称。阿米尔- Nat。1984;123:579 - 93。
- 72.
波动不对称:测量,分析,模式。《生态学报》1986;17:391-421。
- 73.
切片DE, Bookstein FL, Marcus LF, Rohlf FJ。附录一:几何形态计量学术语表。在:马库斯LF, Corti M, Loy A, GJP N,切片DE,编辑。进步的形态学。北约ASI系列a生命科学;1996.531 - 52页。
- 74.
Rohlf FJ。形状统计:Procrustes叠加和切线空间。J Classif。1999;16:197 - 223。
- 75.
R开发核心团队。统计计算的语言和环境。维也纳:统计计算基础;2016.[https://www.R-project.org]
- 76.
Klingenberg CP。大小,形状和形式:几何形态化学中的各种概念。开发基因Evol。2016; 226:1-25。
- 77.
形态学改变的步伐:圣伯纳德犬颅骨形状的历史转变。中国科学(d辑:地球科学)2008;
- 78.
Albrecht GH。多变量分析和形式研究,特别参考规范变量分析。阿米尔-黑旋风。1980;20:679 - 93。
- 79.
Campbell NA, Atchley WR。正则变量分析的几何。系统医学杂志。1981;30:268 - 80。
- 80.
Cruz-Castillo JG, gananeshanandam S, MacKay BR, Lawes GS, Lawoko CRO, Woolley DJ。典型判别分析在园艺研究中的应用。Hortscience。1994;29:1115-9。
- 81.
Fernandez-MazueCos M,Blanco-Vertor JL,Gomez JM,Vargas P. Corolla形态学影响了Bifid toadflaxes中的多样化率(Linaria.教派。多色的).安机器人。2013;112:1705-22。
- 82.
传粉媒介对安第斯猴花花蜜引导表型的选择,Mimulus危害.生态。2003; 84:1721-32。
- 83.
良好的P.排列测试:测试假设的重新取样方法的实用指南。第三版纽约:施普林格系列统计,斯普林格;2013.
- 84.
Klingenberg CP。Morphoj:一种用于几何形态识别性的集成软件包。Mol Ecol Resour。2011; 11:353-7。
- 85.
刘玉玲,刘玉玲。番茄病毒诱导基因沉默的研究进展。植物j . 2002; 31:777 - 86。
- 86.
Prud'homme B, Gompel N, Rokas A, Kassner VA, Williams TM, Yeh S-D,等。重复的形态进化独联体-多效基因的调节变化。大自然。2006;440:1050-3。
- 87.
高Q,陶耶,燕d,王yz,李泽。表达分化赛克- 样式的花粉对称基因与其蛋白质序列分歧相关Chirita heterotricha(苦苣苔科)。发展基因进化。2008;218:341-51。
- 88.
周晓荣,王永忠,Smith JF,陈瑞。花发育中TCP和MYB基因表达模式的改变Bournea(苦苣苔科)。新植物。2008; 178:532-43。
- 89.
歌曲CF,林QB,梁鲁,王yz。与背部和腹侧雄蕊的堕胎有关的ECE-CYC2思科基因的表达opithandra.(苦苣苔科)。BMC Evol Biol. 2009;9:244。
- 90。
Preston JC, Kost MA, Hileman LC。分化花型金鱼近缘对称发育程序的保存与多样化。新植醇。2009;182:751 - 62。
- 91。
Schemske D,Bradshaw H. Tollinator偏好和猴子花卉花卉的演变(模拟).美国国家科学院学报。1999; 96:11910。
- 92.
Nakazato T, Rieseberg LH, Wood TE。物种形成的遗传基础Giliopsis血统的iPomopsis.(花荵科)。遗传。2013;111:227-37。
- 93.
Kramer EM, Holappa L, Gould B, Jaramillo MA, Setnikov D,圣地亚哥总理。B基因功能的阐述,包括鉴定新的花器官在低双子叶科耧斗菜.植物细胞。2007;19:750 - 66。
- 94.
Cakir C,Scofield S.评估大麦条纹马赛克病毒诱导的基因沉默系统同时沉默两颗小麦基因的能力。咖喱店。2008; 36:217-22。
- 95.
黄丽丽,王志强,王志强,等。大麦条纹花叶病毒对小麦多基因沉默的研究进展。生物技术学报2010;2:12-20。
- 96.
Herrera厘米。鹰蛾授粉紫罗兰花的形态选择和繁殖力的环境决定。生态Monogr。1993;63:251 - 75。
- 97.
王志强,王志强。一种旋转对称性的量化方法。新植醇。2007;175:785 - 91。
- 98.
van der Niet T, zollikfer CPE, de León MSP, Johnson SD, Linder HP。研究花的形状变化的三维几何形态测量学。植物学报。2010;15:423-6。
- 99.
达拉亚普RM,马托雷斯,德马约CG。描述莫卡拉兰品种的花的花瓣,萼片和唇瓣形状的地标和大纲方法。国际农业杂志。2011;13:652-58。
- One hundred.
冯晓峰,张晓东,张晓东,等。异速生长的进化金鱼草属植物.植物细胞。2009;21:2999 - 3007。
- 101.
Baranov SG。使用形态学测定法研究叶片中的波动不对称椴树属cordata在工业污染。Adv Environ Biol. 2014; 8:2391-8。
- 102.
Vujić V, Avramov S, Tarasjev A.交通相关空气污染对花形态的影响虹膜pumila- 污染城市地区的比较和未受污染的熟食砂(自然保护区)。申请ECOL Environ Res。2015; 13:405-15。
- 103.
Albarrán Lara AL, Mendoza Cuenca L, Valencia Avalos S, González Rodríguez A, Oyama k栎木玉兰玉兰和Quercus resinosa(Fagaceae)通过墨西哥的一直梯度。int j植物sci。2010; 171:310-22。
- 104.
王志强,王志强,王志强,等。复叶形态整合的发育可塑性、形态变异和进化性研究。应用生态学报,2013,29(5):591 - 598。J J Evol Biol. 2011; 25:115-29。
- 105.
北美自交居群的花冠大小和花粉:胚珠比的小的减少,但花的形状没有变化拟南芥lyrata.环境科学。2017;183:401-13。
确认
作者感谢现在和过去的Howarth实验室成员Jukka Jernvall博士、Sylvain Gerber博士、Outi Hallikas博士、Miquel Marin-Riera博士、Lisandro Milocco、Jhon Alves、Fabien Lafuma,以及几位匿名评审员进行了有益的讨论。我们还要感谢Stephen MifsudFedia Graciliflora种子来自马耳他。
资金
本研究由美国国家科学基金会(NSF)提供给DGH (IOS 1121301)。资助机构确实对研究的设计、工作的传导、数据的解释或手稿的写作产生了影响。
数据和材料的可用性
在当前研究中生成和/或分析的序列数据可在GenBank存储库中获得(KX981057, KX981058), [https://www.ncbi.nlm.nih.gov/genbank/].在当前研究期间使用和分析的QPCR和原始图像可从合理的请求上获得相应的作者。
作者信息
从属关系
贡献
BB、VR、YS、AL、VT、DH设计研究;BB、VR、AL、VT进行研究;BB、AL、VT、YS分析数据;BB、VR、YS、AL、VT、DH撰写论文。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
的变化江蓠花青素合成酶(FgANS)可拆卸的花朵。(a)弱下调表型。(b)中度下调表型。(c)显著下调表型。(比例尺,2mm)。(每股收益13471 kb)
额外的文件3:
病毒诱导基因沉默(VIGS)载体片段和TRV构建原理图。(一)示意图江蓠花青素合成酶(FgANS),f . graciliflora CYCLOIDEA2A(FGCYC2A)CDNA包括引物位置。图像不会绘制。(b)TRV1和TRV2构建体的示意图。LB =左边框,RB =右侧边框,RDRP = RNA依赖性RNA聚合酶,MP =运动蛋白,16 k = 16KD蛋白,RZ =自切割核酶,NOST = NOS终止剂,CP = CP = CP =丙蛋白,MCS =多克隆地点。(EPS 1521 KB)
额外的文件4:
实时荧光定量PCR (qPCR)分析FgANS和FGCYC2A在未经处理的样品和击倒处理。(一)qPCRFgANS显示未经处理的样本的生物复制(N= 4) compared to those fromFgANS(N= 6)和FgCYC2A + FgANS(N= 3)击倒花蕾。(b) qPCRFGCYC2A显示未经处理的样本的生物复制(N= 3) compared to those fromFGCYC2A(N = 3) andFGCYC2A + FgANS(N= 3)击倒花蕾。(每股收益1055 kb)
额外的文件5:
对未处理样本和处理样本的质心大小进行方差分析比较,然后进行Tukey的HSD检验进行两两差异。Tukey多重比较的平均值与95%的家庭明智的置信水平P-value调整多次比较。Diff:观测平均值的差值;Lwr,基于样本均值范围的区间下限;Upr:上终点;p的,P为多次比较调整后的值。(XLS 62 kb)
额外的文件6:
测试未处理样品和处理样品之间的两两形状差异。P-排列测试(10,000个排列轮)组间Procrustes距离的值表示为:****,P< 0.0001;*,P< 0.05。(XLS 60 kb)
额外的文件7:
实时荧光定量PCR (qPCR)分析江蓠花青素合成酶(FgANS)未处理和模拟处理(TRV2-E)花蕾。表达无明显差异。(TIFF 7723 KB)
额外的文件8:
实时荧光定量PCR (qPCR)分析f . graciliflora CYCLOIDEA2A(FGCYC2A)未处理和模拟处理(TRV2-E)花蕾。表达无明显差异。(TIFF 7702 kb)
额外的文件9:
关于未处理样品的形状和大小的测量误差的ANOVA。SS,平方和;MS,均方;DF,自由度;F,F值;P,P价值。(XLS 28 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
伯杰,文学学士,里奇利亚诺,弗吉尼亚州,萨维里亚马et al。几何形态计量学揭示了基因敲除后花的形状、对称性和大小的变化CYCLOIDEA和花青素合成酶.BMC植物杂志17日,205(2017)。https://doi.org/10.1186/s12870-017-1152-x
收到了:
接受:
发表:
关键字
- 几何的形态学
- 病毒诱导基因沉默
- CYCLOIDEA
- Fedia Graciliflora
- 花对称性
- 花青素合成酶