- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发表:gydF4y2Ba
ARF17对花药的微调和花粉形成gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba17.gydF4y2Ba, 文章编号:gydF4y2Ba243.gydF4y2Ba(gydF4y2Ba2017gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
在gydF4y2Ba拟南芥gydF4y2Ba,绒毡层和小孢子细胞是花粉形成的关键。先前的研究表明gydF4y2BaARF17gydF4y2Ba以微孢子囊细胞和四纹体表达,直接调节花粉形成的四壁合成。gydF4y2BaARF17gydF4y2Ba直接目标是gydF4y2Bamir160.gydF4y2Ba,gydF4y2BapromoterARF17gydF4y2Ba::gydF4y2Ba5MARF17gydF4y2Ba(gydF4y2Ba5MARF17gydF4y2Ba/ wt)转基因植物,其中包含五个无声突变gydF4y2Bamir160.gydF4y2Ba- 互动域,是无菌的。gydF4y2Ba
结果gydF4y2Ba
在这里,我们发现ARF17也在绒毡层中表达gydF4y2BaARF17gydF4y2Ba突变体。和....相比gydF4y2BaARF17gydF4y2Ba突变体,gydF4y2Ba5MARF17 /gydF4y2BaWT植物具有异常的胶质细胞和四面体,但在绦虫中却较低。免疫细胞化学测定表明,ARF17蛋白在Tapetum,microcorocytes和四边形中积累的gydF4y2Ba5MARF17gydF4y2Ba/ WT植物在早期花药阶段,但在花药开发期间,其表达模式不受影响。gydF4y2Ba5MARF17gydF4y2Ba被它的原生推动者所驱动,并没有拯救gydF4y2BaARF17gydF4y2Ba雄性无菌表型。表达gydF4y2Ba5MARF17gydF4y2Ba由绒毡层特异性启动子驱动gydF4y2BaA9gydF4y2Ba导致转基因植物绒毡层缺陷和雄性不育。这些结果提示ARF17在绒毡层和小孢子细胞中过表达gydF4y2Ba5MARF17gydF4y2Ba/ WT植物导致雄性不育。微阵列数据显示,涉及转录和翻译中涉及的基因的异常表达gydF4y2Ba5MARF17 /gydF4y2BaWT植物。gydF4y2Ba
结论gydF4y2Ba
我们的研究表明,ARF17在花药发育和花粉形成中起着重要的作用gydF4y2Bamir160.gydF4y2Ba监管对于在花药开发期间的功能至关重要。gydF4y2Ba
背景gydF4y2Ba
在开花植物中,雄性生殖过程发生在雄蕊中。减数分裂后,单倍体小孢子进一步发育为花粉粒。每个子房室包含四个围绕着小孢子细胞/小孢子/花粉的体细胞层[gydF4y2Ba1gydF4y2Ba].花粉壁通常由外部和内部组成。绦虫组织的最内层,绦虫,与微微孢子直接接触,为花粉谷物成熟提供必要的营养和花粉壁材料[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].外壁的沉积模式是由四分体阶段胼胝质的形成所决定的[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].gydF4y2Ba
植物因在植物男性生殖发展中起着重要作用[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].生物合成和运输均涉及花粉发展[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10.gydF4y2Ba,gydF4y2Ba11.gydF4y2Ba].植物连体响应因子(ARFS)响应植金;ARF可以靶向下游基因的植物蛋白响应元素,可以用作转录激活剂或阻遏物[gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba13.gydF4y2Ba].几种arf参与花药发育和花粉形成。gydF4y2BaARF1gydF4y2Ba和gydF4y2BaARF2gydF4y2Ba规范开花时间和裂缝[gydF4y2Ba14.gydF4y2Ba),而gydF4y2BaARF6gydF4y2Ba和gydF4y2BaARF8gydF4y2Ba促进雌蕊和雄蕊的发育[gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba16.gydF4y2Ba].功能丧失gydF4y2BaARF17gydF4y2Ba直接影响表达gydF4y2Ba调用合成酶5.gydF4y2Ba(gydF4y2BaCALS5.gydF4y2Ba),这对胼胝质的合成至关重要。gydF4y2BaARF17gydF4y2Ba突变体表现为胼胝质壁和异常的外壁模式,导致雄性不育[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba17.gydF4y2Ba].gydF4y2Ba
microrna (mirna)有21个核苷酸长,是植物和动物中基因表达的负调控因子[gydF4y2Ba18.gydF4y2Ba].大多数植物miRNA具有切割具有完美或近乎完美互补序列的目标mRNA的功能[gydF4y2Ba19.gydF4y2Ba].在gydF4y2Ba拟南芥gydF4y2Ba,gydF4y2Bamir167.gydF4y2Ba调节gydF4y2BaARF6gydF4y2Ba和gydF4y2BaARF8gydF4y2Ba胚珠和花药的表达[gydF4y2Ba15.gydF4y2Ba].gydF4y2Bamir160.gydF4y2Ba是对成绩单的补充gydF4y2BaARF10gydF4y2Ba,gydF4y2BaARF16gydF4y2Ba和gydF4y2BaARF17。gydF4y2Ba改变5个碱基gydF4y2Bamir160.gydF4y2Ba在不改变ARF17蛋白氨基酸序列的情况下(gydF4y2Ba5MARF17gydF4y2Ba)防止gydF4y2Bamir160.gydF4y2Ba- 恋gydF4y2BaARF17gydF4y2Ba裂解[gydF4y2Ba20.gydF4y2Ba].gydF4y2Bamarf17 PromoterARF17:: 5gydF4y2Ba转基因植物(gydF4y2Ba5MARF17 /gydF4y2Ba不育的[gydF4y2Ba20.gydF4y2Ba]gydF4y2Ba.gydF4y2Ba然而,细节和机制的影响gydF4y2Ba5MARF17gydF4y2Ba关于植物的生育力还不清楚。gydF4y2Ba
在这里,我们表明ARF17不仅适用于微孢子囊肿/四方发育,而且还具有重要性。ARF17蛋白在Tapetum和Microcorocyts中过度积累,并且这种过累积导致缺陷gydF4y2Ba5MARF17 /gydF4y2BaWT植物。因此,ARF17的精细调控对绒毡层发育和花粉壁形成至关重要。gydF4y2Ba
结果gydF4y2Ba
ARF17对于Tapetum开发至关重要gydF4y2Ba
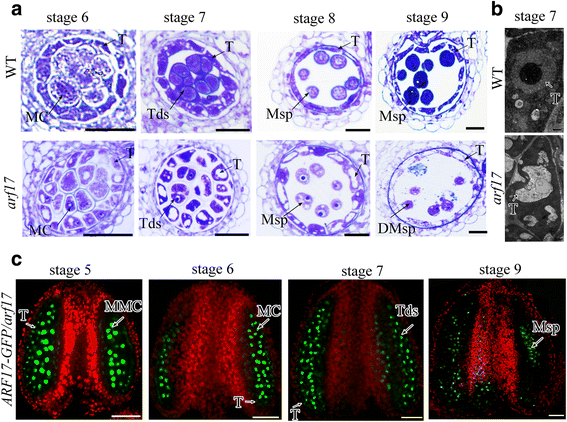
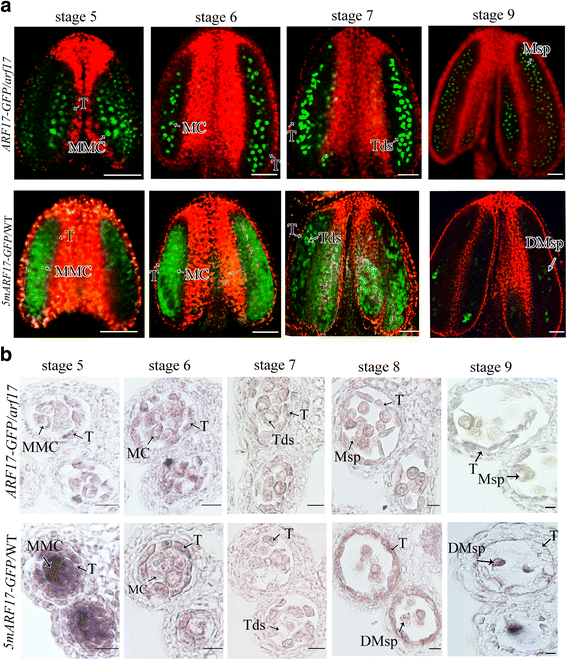
以前的调查表明,ARF17直接规范了表达gydF4y2BaCALS5.gydF4y2Ba用于墙壁形成。在gydF4y2BaARF17gydF4y2Ba突变体,四墙比野生型(WT)更薄,花粉壁图案有缺陷[gydF4y2Ba17.gydF4y2Ba].在这项工作中,我们发现Tapetum开发也有缺陷gydF4y2BaARF17gydF4y2Ba突变体在从第7阶段到第9阶段发育过程中异常真空(图。gydF4y2Ba1a,bgydF4y2Ba).以往的研究表明,ARF17-GFP信号定位于小孢子细胞、小孢子和成熟花粉中,而不是绒毡层细胞[gydF4y2Ba17.gydF4y2Ba].在这里,我们使用共聚焦激光扫描显微镜重新扫描ARF17-GFP信号gydF4y2BaPARF17 :: ARF17-GFP / ARF17gydF4y2Ba互补植物(TgydF4y2Ba3.gydF4y2Ba一代)其中ARF17-GFP完全恢复了gydF4y2BaARF17gydF4y2Ba雄性无菌表型。在阶段5的塔皮特细胞中检测到ARF17-GFP信号,但是从第6至7阶段削弱信号(图。gydF4y2Ba1CgydF4y2Ba).ARF17-GFP在绒毡层细胞中的定位与缺陷绒毡层的定位一致gydF4y2BaARF17gydF4y2Ba突变体。这些结果表明gydF4y2BaARF17gydF4y2Ba对于Tapetum开发来说也是必不可少的。gydF4y2Ba
ARF17对绒毡层发育有重要作用。gydF4y2Ba一个gydF4y2Ba花药的半薄切片gydF4y2BaARF17gydF4y2Ba突变植物。Bar = 20 μm。gydF4y2BabgydF4y2Ba显示WT和WT的Tapetum形态的TEMgydF4y2BaARF17gydF4y2Ba植物阶段7.杆= 500nm。gydF4y2BacgydF4y2Ba荧光共聚焦图像表明GFP信号在花药gydF4y2BaARF17-GFP / ARF17gydF4y2Ba工厂。Bar = 50 μm。绿色为GFP信号(530 nm),红色为叶绿素自身荧光。DMsp退化小孢子;MC,减数分裂细胞;MMC:小孢子母细胞;Msp,小孢子;T,毯;Tds,四联球菌gydF4y2Ba
5MARF17gydF4y2BaWT植物的绒毡层和小孢子细胞都有缺陷gydF4y2Ba
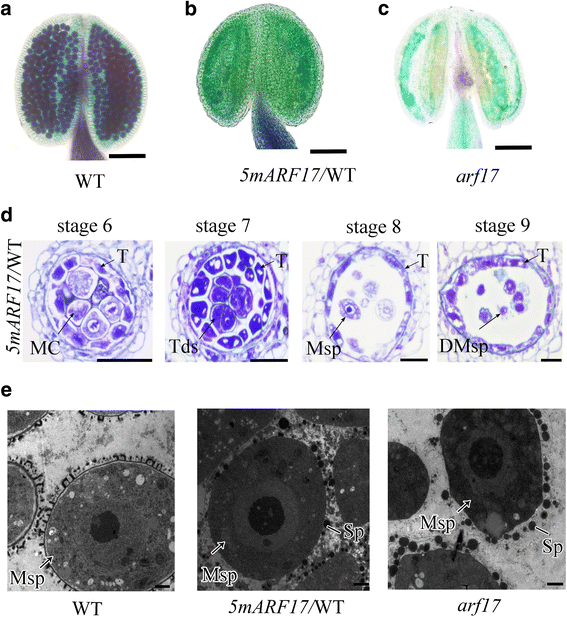
ARF17gydF4y2Ba是gydF4y2Bamir160.gydF4y2Ba的目标gydF4y2Ba拟南芥gydF4y2Ba,gydF4y2Bamarf17 promoterARF17:: 5gydF4y2Ba(gydF4y2Ba5MARF17gydF4y2Ba/ wt)转基因植物是无菌的[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21.gydF4y2Ba].为了更好地理解ARF17在男性生殖中的作用,我们进行了同样的研究gydF4y2Ba5MARF17gydF4y2Ba建设和获得gydF4y2Ba5MARF17 /gydF4y2BaWT转基因植物,显示完全不育如上所述(附加文件gydF4y2Ba1gydF4y2Ba:图S1A-C;[gydF4y2Ba20.gydF4y2Ba])。Alexander染色显示没有成熟花粉gydF4y2Ba5MARF17 /gydF4y2Ba野生型植物,与在野生型植物中观察到的相似gydF4y2BaARF17gydF4y2Ba突变体(无花果。gydF4y2Ba2 a - cgydF4y2Ba).与wt的互核性交叉表明女性生育率不受影响。一半的fgydF4y2Ba1gydF4y2Ba生成gydF4y2Ba5MARF17 /gydF4y2Ba用WT授粉的WT植株表现出雄性不育表型。PCR结果表明,这些雄性不育植株均含有gydF4y2Ba5MARF17gydF4y2Ba碎片和没有一个肥沃的植物包含这个碎片(附加文件gydF4y2Ba1gydF4y2Ba:图S1d)。这些结果表明gydF4y2Ba5MARF17gydF4y2Ba作为雄性不育的主要基因。半薄部分在花药开发中显示出没有显着缺陷gydF4y2Ba5MARF17 /gydF4y2Ba第6阶段之前的WT植物。四分体正常形成于gydF4y2Ba5MARF17 /gydF4y2Ba阶段7的WT植物(图。gydF4y2Ba2DgydF4y2Ba),但胼une墙比WT植物中的较薄较薄得多(附加文件gydF4y2Ba1gydF4y2Ba:图S1e-g)。绒毡层发育异常gydF4y2Ba5MARF17 /gydF4y2BaWT植物(图。gydF4y2Ba2DgydF4y2Ba),但液泡性较gydF4y2BaARF17gydF4y2Ba突变体(无花果。gydF4y2Ba1AgydF4y2Ba).在第8阶段,观察到单个小孢子gydF4y2Ba5MARF17 /gydF4y2BaWT植物(图。gydF4y2Ba2DgydF4y2Ba).透射电子显微镜(TEM)显示出的外部gydF4y2Ba5MARF17 /gydF4y2BaWT植物异常(图。gydF4y2Ba2egydF4y2Ba).在第8阶段后,小孢子开始液泡化,然后降解gydF4y2Ba5MARF17gydF4y2Ba植物(图。gydF4y2Ba2DgydF4y2Ba).因此,绒毡层和四分体均有缺陷gydF4y2Ba5MARF17 /gydF4y2Ba导致花粉破裂和雄性不育。gydF4y2Ba
marf17 PromoterARF17:: 5gydF4y2Ba植物表现为完全雄性不育。gydF4y2Ba一个gydF4y2Ba-gydF4y2BacgydF4y2Ba亚历山大染色显示WT (gydF4y2Ba一个gydF4y2Ba),一个gydF4y2Bamarf17 promoterARF17:: 5gydF4y2Ba(gydF4y2Ba5MARF17 /gydF4y2Bawt)植物(gydF4y2BabgydF4y2Ba)和一个gydF4y2BaARF17gydF4y2Ba突变体(gydF4y2BacgydF4y2Ba).条=50μm。(gydF4y2BadgydF4y2Ba花药的半薄的部分gydF4y2Ba5MARF17 /gydF4y2BaWT植物。Bar = 20 μm。(gydF4y2BaegydF4y2Ba)透射电镜显示WT的小孢子结构,gydF4y2Ba5MARF17gydF4y2Ba和gydF4y2BaARF17gydF4y2Ba突变植物在花药阶段8.棒=5μm。DMsp退化小孢子;MC,减数分裂细胞;Msp,小孢子;T,毯;Tds,四联球菌gydF4y2Ba
5MARF17gydF4y2Ba不影响母语的表达gydF4y2BaARF17gydF4y2Ba
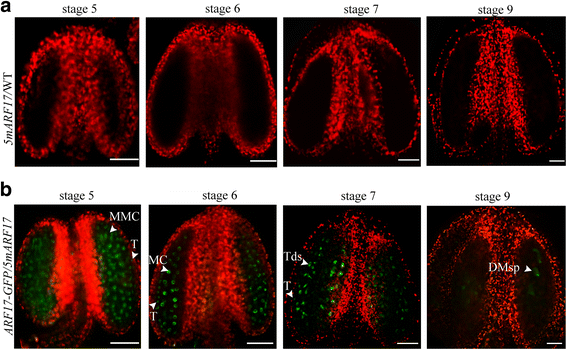
的表型gydF4y2Ba5MARF17 /gydF4y2Ba关于男性发展的WT植物类似于gydF4y2BaARF17gydF4y2Ba突变体,绒毡层细胞除外(图。gydF4y2Ba1gydF4y2Ba额外的文件gydF4y2Ba1gydF4y2Ba:图S1a-c、图gydF4y2Ba2DgydF4y2Ba和gydF4y2BaegydF4y2Ba).确定是否gydF4y2Ba5MARF17gydF4y2Ba转基因影响了本地人的表达gydF4y2BaARF17gydF4y2Ba,gydF4y2Ba5MARF17 /gydF4y2BaWT植物从花粉中授粉gydF4y2BaARF17-GFgydF4y2BaP /gydF4y2BaARF17gydF4y2Ba植物获得gydF4y2BaARF17-GFP / 5 marf17gydF4y2Ba植物。因为ARF17-GFP可以补充gydF4y2BaARF17gydF4y2Ba表型,ARF17-GFP信号表示天然ARF17的表达。在gydF4y2Ba5MARF17gydF4y2Ba/ WT植物,未观察到GFP信号(图。gydF4y2Ba3AgydF4y2Ba).在gydF4y2BaARF17-GFP / 5 marf17gydF4y2Ba植物中,在纯血蜂窝细胞,四胞胎和幼儿孢子中检测ARF17-GFP信号(图。gydF4y2Ba3B.gydF4y2Ba).ARF17-GFP的表达模式gydF4y2BaARF17-GFP / 5 marf17gydF4y2Ba植物是类似的gydF4y2BaARF17-GFP / ARF17gydF4y2Ba植物(图。gydF4y2Ba1CgydF4y2Ba),表示本机表达式。因此,gydF4y2Ba5MARF17gydF4y2Ba转基因没有影响天然ARF17的表达。gydF4y2Ba
天然ARF17的表达未受影响gydF4y2Ba5MARF17gydF4y2Ba/ WT植物。gydF4y2Ba一个gydF4y2Ba和gydF4y2BabgydF4y2Ba荧光共聚焦图像指示A的花纹中的GFP信号gydF4y2Ba5MARF17gydF4y2Ba/ wt植物(gydF4y2Ba一个gydF4y2Ba)和一个gydF4y2BaARF17-GFP / 5 marf17gydF4y2Ba工厂(gydF4y2BabgydF4y2Ba).绿色为GFP信号(530 nm),红色为叶绿素自身荧光。条=50μm。DMsp退化小孢子;MC,减数分裂细胞;MMC:小孢子母细胞;T,毯;Tds,四联球菌gydF4y2Ba
5MARF17gydF4y2Ba不能挽救的不育gydF4y2BaARF17gydF4y2Ba
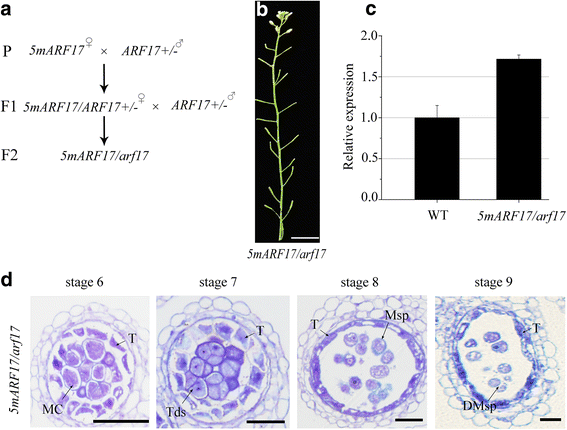
的gydF4y2Ba5MARF17gydF4y2Ba转基因基因编码相同的氨基酸序列gydF4y2BaARF17gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba].调查是否gydF4y2Ba5MARF17gydF4y2Ba满足了相同的功能gydF4y2BaARF17gydF4y2Ba,我们穿过gydF4y2Ba5MARF17 /gydF4y2Ba来自杂合的花粉的WT植物gydF4y2BaARF17gydF4y2Ba/gydF4y2BaARF17gydF4y2Ba工厂。F.gydF4y2Ba1gydF4y2Ba植物有gydF4y2Ba5MARF17gydF4y2Ba转基因在gydF4y2BaARF17gydF4y2Ba/gydF4y2BaARF17gydF4y2Ba背景,并进一步与gydF4y2BaARF17 / ARF17gydF4y2Ba植物获得植物gydF4y2Ba5MARF17gydF4y2Ba转基因和一个gydF4y2BaARF17gydF4y2Ba背景 (gydF4y2Ba5MARF17 / ARF17)gydF4y2Ba(图。gydF4y2Ba4AgydF4y2Ba额外的文件gydF4y2Ba2gydF4y2Ba:图S2a和图b)gydF4y2Ba5MARF17 / ARF17gydF4y2Ba植物仍然是雄性无菌(图。gydF4y2Ba4B.gydF4y2Ba).QRT-PCR的结果表明表达水平gydF4y2BaARF17gydF4y2Ba在里面gydF4y2Ba5MARF17 / ARF17gydF4y2Ba植物高于WT中的植物(图。gydF4y2Ba4CgydF4y2Ba).花药的半薄的部分gydF4y2Ba5MARF17 / ARF17gydF4y2Ba植物在Tapetum和Micropores中显示出类似的缺陷gydF4y2Ba5MARF17 /gydF4y2BaWT植物(无花果。gydF4y2Ba2DgydF4y2Ba和gydF4y2Ba4D.gydF4y2Ba).绒毡层的液泡化明显小于绒毡层gydF4y2BaARF17gydF4y2Ba突变体(无花果。gydF4y2Ba1AgydF4y2Ba)gydF4y2Ba.gydF4y2Ba因此,gydF4y2Ba5MARF17gydF4y2Ba转基因可以部分拯救Tapetum发展,而不是恢复男性生育gydF4y2BaARF17gydF4y2Ba突变体。在我们以前的工作中,同样的启动子gydF4y2BaARF17gydF4y2Ba用来建设gydF4y2BapARF17: ARF17gydF4y2Ba补充的gydF4y2BaARF17gydF4y2Ba突变表型(gydF4y2Ba17.gydF4y2Ba].这些结果表明逃脱gydF4y2BaARF17gydF4y2Ba表达的gydF4y2Bamir160.gydF4y2Ba调节导致花药中的发育缺陷以及雄性不育。gydF4y2Ba
表型gydF4y2Ba5MARF17 / ARF17gydF4y2Ba突变体。gydF4y2Ba一个gydF4y2Ba示意图表示获得a的步骤gydF4y2Ba5MARF17 / ARF17gydF4y2Ba工厂。gydF4y2BabgydF4y2Ba一个35天的历史gydF4y2Ba5MARF17 / ARF17gydF4y2Ba工厂。酒吧= 2厘米。gydF4y2BacgydF4y2Ba定量RT-PCR分析gydF4y2BaARF17gydF4y2Ba在wt和gydF4y2Ba5MARF17 / ARF17gydF4y2Ba味蕾gydF4y2Ba.gydF4y2Ba水平gydF4y2BaARF17gydF4y2Ba将其归一化为微管蛋白,并与WT的微管蛋白进行比较。误差棒表示标准差,并由三个生物重复计算得出。gydF4y2BadgydF4y2Ba半薄部分的花药gydF4y2Ba5MARF17 / ARF17gydF4y2Ba工厂。Bar = 20 μm。DMsp退化小孢子;MC,减数分裂细胞;Msp,小孢子;T,毯;Tds,四联球菌gydF4y2Ba
ARF17蛋白在绒毡层和小孢子细胞中过度积累gydF4y2Ba5MARF17gydF4y2Ba/ wt植物gydF4y2Ba
在以前的一项研究中,gydF4y2Bamir160.gydF4y2Ba没能打通gydF4y2Ba5MARF17gydF4y2BamRNA,和gydF4y2BaARF17/5mARF17gydF4y2Ba信使rna over-accumulated在gydF4y2Ba5MARF17gydF4y2Ba/ WT植物[gydF4y2Ba20.gydF4y2Ba].以确定ARF17蛋白是否也在gydF4y2Ba5MARF17gydF4y2Ba/ wt植物,我们构建了一个gydF4y2BaLiginerarf17 :: 5MARF17-GFPgydF4y2Ba然后将其引入WT工厂获得gydF4y2Ba5MARF17-GFP /gydF4y2BaWT转基因植物。的gydF4y2Ba5MARF17-GFP /gydF4y2Ba野生型植株也表现出雄性不育表型,分离率与野生型植株相似gydF4y2Ba5MARF17 /gydF4y2BaWT植物(附加文件gydF4y2Ba3.gydF4y2Ba:图S3a-c)。用共聚焦激光扫描显微镜研究GFP信号。在花药第5 ~ 7期,5mARF17-GFP蛋白在小孢子细胞、小孢子和绒毡层中表达。然而,在gydF4y2Ba5MARF17-GFP /gydF4y2BaWT植物比ARF17-GFP植物的植物得多(图。gydF4y2Ba5AgydF4y2Ba).Tapetum和Microcorocytes中的缺陷可能导致ARF17-GFP信号的漫反射图案gydF4y2Ba5MARF17-GFP /gydF4y2BaWT植物。确认ARF17是否超积gydF4y2Ba5MARF17 /gydF4y2Ba采用免疫组化方法,利用GFP抗体检测5mARF17-GFP在野生植物中的积累gydF4y2Ba5MARF17 /gydF4y2Ba野生型植物和ARF17-GFP在gydF4y2BaARF17-GFP / ARF17gydF4y2Ba植物。在gydF4y2BaARF17-GFP / ARF17gydF4y2Ba在植物的小孢子细胞、绒毡层、四分体和小孢子中观察到ARF17-GFP信号(图5 - 9)。gydF4y2Ba5B.gydF4y2Ba).在gydF4y2Ba5MARF17-GFP.gydF4y2Ba与ARF17-GFP蛋白相比,5mARF17-GFP蛋白在绒毡层和小孢子细胞中积累较多gydF4y2BaARF17-GFP / ARF17gydF4y2Ba阶段植物5.在6-8阶段,5marf17-GFP蛋白继续在Tapetum和幼儿孢子中表达。然后,我们从两者中收获了年轻的芽(花药阶段5)gydF4y2Ba5MAFR17gydF4y2Ba/ wt和wt植物并研究表达gydF4y2BaARF17gydF4y2Ba通过QRT-PCR。QRT-PCR的结果表明表达了gydF4y2BaARF17gydF4y2Ba在里面gydF4y2Ba5MARF17gydF4y2Ba/WT植物比WT植物更高(附加文件gydF4y2Ba4gydF4y2Ba:图S4b)。结果表明,5 marf17蛋白在花药5期绒毡层和小孢子细胞中均过度积累gydF4y2Ba5MARF17 /gydF4y2BaWT植物。这一发现表明gydF4y2Bamir160.gydF4y2Ba对于在早期花药阶段调节ARF17表达的正常制剂是重要的。gydF4y2Ba
GFP信号gydF4y2BaARF17-GFP / ARF17gydF4y2Ba和gydF4y2Ba5MARF17-GFP /gydF4y2BaWT花药。gydF4y2Ba一个gydF4y2Ba荧光共聚焦图像表明GFP信号在花药gydF4y2BaARF17-GFPgydF4y2Ba/gydF4y2BaARF17gydF4y2Ba和gydF4y2Ba5MARF17-GFP /gydF4y2BaWT植物。Bar = 50 μm。绿色为GFP信号(530 nm),红色为叶绿素自身荧光。gydF4y2BabgydF4y2Ba在5-10阶段的花药中GFP的免疫组织化学测定gydF4y2BaARF17-GFP / ARF17gydF4y2Ba和gydF4y2Ba5MARF17-GFP /gydF4y2BaWT植物。Bar = 20 μm。DMsp退化小孢子;MC,减数分裂细胞;MMC:小孢子母细胞;Msp,小孢子;T,毯;Tds,四联球菌gydF4y2Ba
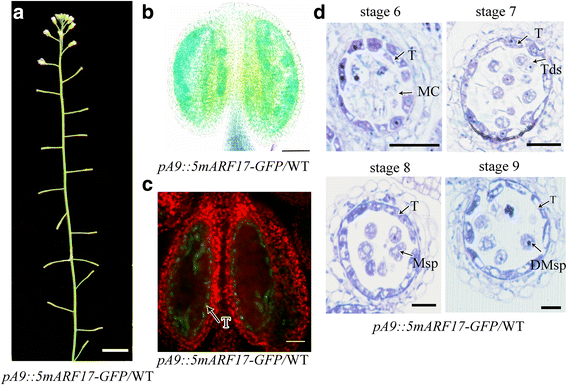
转基因植物包含gydF4y2Ba5MARF17gydF4y2Ba由绒毡层特异性启动子驱动gydF4y2BaA9gydF4y2Ba是男性无菌gydF4y2Ba
绒毡层和小孢子细胞都有助于花粉的形成。为了确定ARF17在绒毡层中过度表达是否会导致小孢子败育和雄性不育,我们构建了一个gydF4y2Bamarf17-gfp promoterA9:: 5gydF4y2Ba构建并将其介绍到WT植物中。的gydF4y2BaA9gydF4y2Ba启动子可以在来自花药阶段5到9的绞花齿中特异性地驱动基因表达[gydF4y2Ba22.gydF4y2Ba,gydF4y2Ba23.gydF4y2Ba].我们发现gydF4y2BapromoterA9:: 5 marf17-gfp /gydF4y2BaWT转基因植物(gydF4y2Ba时::5 marf17-gfpgydF4y2Ba/ wt)是雄性无菌(图。gydF4y2Ba6AgydF4y2Ba,gydF4y2BabgydF4y2Ba),偏析率与gydF4y2Ba5MARF17 /gydF4y2BaWT植物(附加文件gydF4y2Ba4gydF4y2Ba:图S4a)。qRT-PCR结果显示gydF4y2BaARF17gydF4y2Ba在里面gydF4y2Ba时::5 marf17-gfp /gydF4y2Ba野生型植物比野生型植物高(附加文件)gydF4y2Ba4gydF4y2Ba:图S4C)。GFP信号中的信号gydF4y2Ba时::5 marf17-gfp /gydF4y2BaWT植物仅限于Tapetum(图。gydF4y2Ba6C.gydF4y2Ba).半薄部分显示Tapetum发育和花粉形成的缺陷gydF4y2Ba时::5 marf17-gfp /gydF4y2BaWT植物;这些缺陷与gydF4y2Ba5MARF17 /gydF4y2BaWT植物(无花果。gydF4y2Ba2DgydF4y2Ba和gydF4y2Ba6D.gydF4y2Ba).这些结果表明,Tapetum中ARF17的过度积累足以导致Tapetum缺陷和植物无菌。gydF4y2Ba
表型的gydF4y2BapromoterA9:: 5 marf17-gfp /gydF4y2BaWT植物。gydF4y2Ba一个gydF4y2Ba一个35天的历史gydF4y2Bamarf17-gfp promoterA9:: 5gydF4y2Ba(gydF4y2Ba时::5 marf17-gfp /gydF4y2Bawt)植物。酒吧= 2厘米。gydF4y2BabgydF4y2Ba亚历山大的花药染色gydF4y2Ba时::5 marf17-gfpgydF4y2Ba/ wt工厂gydF4y2Ba.gydF4y2BaBar = 200 μm。gydF4y2BacgydF4y2BaGFP信号仅在绒毡层细胞中观察到gydF4y2Ba时::5 marf17-gfpgydF4y2Ba/ WT植物。Bar = 50 μm。gydF4y2BadgydF4y2Ba花药的半薄的部分gydF4y2Ba时::5 marf17-gfpgydF4y2Ba/ WT植物显示来自花粉的花粉阶段6-9。Bar = 20 μm。DMsp退化小孢子;MC,减数分裂细胞;Msp,小孢子;T,毯;Tds,四联球菌gydF4y2Ba
中高表达基因的鉴定与过表达gydF4y2Ba5MARF17gydF4y2Ba/ wt植物gydF4y2Ba
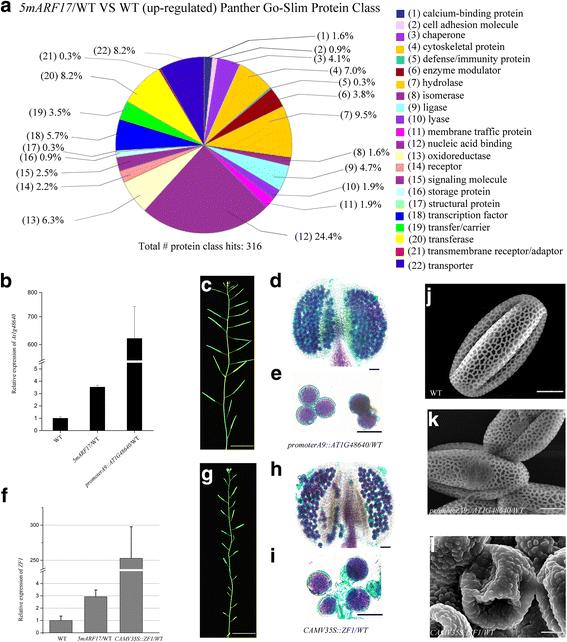
我们以前的工作表明ARF17用作转录激活器[gydF4y2Ba17.gydF4y2Ba].来确定受影响的基因gydF4y2Ba5MARF17 /gydF4y2Ba在野生型植物中,我们使用嫩芽进行了微阵列分析gydF4y2Ba5MARF17 /gydF4y2BaWT和WT植物。共755个基因表达上调gydF4y2Ba5MARF17gydF4y2Ba植物与WT植物的比较(附加文件gydF4y2Ba5gydF4y2Ba:表S3)。根据BAR信息(gydF4y2Bahttp://bar.utoronto.cagydF4y2Ba)、220个(29.14%)基因异位表达,339个(44.90%)基因过表达gydF4y2Ba5MARF17gydF4y2Ba/WT植物(花药阶段5-7)(附加文件gydF4y2Ba5gydF4y2Ba:表S3)。Panther(通过进化关系蛋白质分析,gydF4y2Bahttp://pantherdb.orggydF4y2Ba)[gydF4y2Ba24.gydF4y2Ba]的分析表明,有316个已知基因在gydF4y2Ba5MARF17 /gydF4y2BaWT芽(无花果。gydF4y2Ba6AgydF4y2Ba;额外的文件gydF4y2Ba6gydF4y2Ba表S4), 316个基因中有77个与核酸结合相关(24.4%)。在这组中,DNA解旋酶、RNA结合蛋白、核糖体蛋白和组蛋白高度富集(附加文件)gydF4y2Ba6gydF4y2Ba:表S4)。这些结果表明,过表达ARF17可能导致正常基因表达的改变,从而导致花药和绒毡层发育中断。gydF4y2Ba
测试是否表达了一些上调基因gydF4y2Ba5MARF17gydF4y2BaWT影响花药的发育和花粉的形成gydF4y2BaCamv35s.gydF4y2Ba要么gydF4y2BaA9gydF4y2Ba启动子,以及由此产生的结构体被引入WT植物。gydF4y2BaAT1G48640gydF4y2Ba编码参与根发育的跨膜氨基酸转运体家族基因[gydF4y2Ba25.gydF4y2Ba].12/12转基因素,具有过表达gydF4y2BaAT1G48640gydF4y2Ba在肥沃的gydF4y2BaPromotera9 :: AT1G48640 /gydF4y2BaWT转基因植物(附加文件gydF4y2Ba7gydF4y2Ba:图S6B,图。gydF4y2Ba7B和C.gydF4y2Ba),但它们的花粉颗粒粘附在一起(图。gydF4y2Ba7 d, egydF4y2Ba),扫描电子显微镜(SEM)显示花粉壁结构缺陷。gydF4y2Ba7J,KgydF4y2Ba).锌指蛋白1 (Zinc-finger protein 1, ZF1)是一种转录抑制因子,参与抑制非生物胁迫条件下植物的生长[gydF4y2Ba25.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba27.gydF4y2Ba].8/8转基因素,具有过表达gydF4y2BaZF1gydF4y2Ba表现出降低的生育能力gydF4y2BaCaMV35s: ZF1 /gydF4y2BaWT植物(附加文件gydF4y2Ba7gydF4y2Ba:图S6B,图。gydF4y2Ba7F.gydF4y2Ba和gydF4y2BaggydF4y2Ba).部分花粉败育,粘在一起gydF4y2BaCaMV35s: ZF1 /gydF4y2BaWT植物(图。gydF4y2Ba7小时,我gydF4y2Ba)和SEM显示花粉壁在这些植物中也有缺陷(图。gydF4y2Ba7J.gydF4y2Ba,gydF4y2BalgydF4y2Ba).gydF4y2Ba
在一个上调的基因gydF4y2Ba5MARF17gydF4y2Ba/ wt植物。gydF4y2Ba一个gydF4y2Ba黑豹瘦身蛋白类的上调基因gydF4y2Ba5MARF17gydF4y2Ba共检测到316个基因。每一项的百分比是总蛋白质类命中的聚集基因数:钙结合(5个基因)、细胞粘附分子(3个基因)、伴蛋白(13个基因)、细胞骨架蛋白(22个基因)、防御免疫蛋白(1个基因)、酶调节剂(12个基因)、水解酶(30个基因)、异构酶(5个基因)、连接酶(15个基因)、裂解酶(6个基因)、膜交通蛋白(6个基因)、核酸结合(77个基因)、氧化还原酶(20个基因)、受体(7个基因)、信号分子(8个基因)、储存蛋白(3个基因)、结构蛋白(1个基因)、转录因子(18个基因)、转移/载体蛋白(11个基因)、转移酶(26个基因)、跨膜受体调节/接合蛋白(1个基因)、转运蛋白(26个基因)。gydF4y2BabgydF4y2Ba-gydF4y2BalgydF4y2Ba表型gydF4y2Ba促销员9 :: AT1G48640gydF4y2Ba和gydF4y2BaCAMV35s: ZF1gydF4y2Ba植物。gydF4y2BabgydF4y2Ba定量RT-PCR分析gydF4y2BaAT1G48640gydF4y2Ba在wt中的表达,gydF4y2Ba5MARF17gydF4y2Ba/ WT和gydF4y2BaPromotera9 :: AT1G48640 /gydF4y2Bawt芽。gydF4y2BacgydF4y2Ba一个35天的历史gydF4y2BaPromotera9 :: AT1G48640 /gydF4y2BaWT植物。酒吧= 2厘米。gydF4y2BadgydF4y2Ba和gydF4y2BaegydF4y2Ba亚历山大染色的花药和花粉粒gydF4y2BaPromotera9 :: AT1G48640 /gydF4y2BaWT植物。柱= 20 μm。gydF4y2BafgydF4y2Ba定量RT-PCR分析gydF4y2BaZF1gydF4y2Ba在wt中的表达,gydF4y2Ba5MARF17gydF4y2Ba/ WT和gydF4y2BaCAMV35S :: ZF1 /gydF4y2Bawt芽。gydF4y2BaggydF4y2Ba一个35天的历史gydF4y2BaCAMV35S :: ZF1 /gydF4y2BaWT植物。酒吧= 2厘米。gydF4y2BahgydF4y2Ba和gydF4y2Ba我gydF4y2Ba亚历山大染色的花药和花粉粒gydF4y2BaCAMV35S :: ZF1 /gydF4y2BaWT植物。柱= 20 μm。gydF4y2BajgydF4y2Ba-gydF4y2BalgydF4y2Ba扫描电子显微镜(SEM)显示WT植物的花粉壁结构(gydF4y2BajgydF4y2Ba),一个gydF4y2BaPromotera9 :: AT1G48640 /gydF4y2BaWT植物(gydF4y2BakgydF4y2Ba)和一个gydF4y2BaCAMV35S :: ZF1 /gydF4y2BaWT植物(gydF4y2BalgydF4y2Ba).柱= 5 μm。的水平gydF4y2BaAT1G48640gydF4y2Ba和gydF4y2BaZF1gydF4y2Ba被标准化为管蛋白的那些,并与wt的那些相比。误差栏表示SD,并由三个生物复制计算gydF4y2Ba
讨论gydF4y2Ba
ARF17对于Tapetum和Microcorocyte发育非常重要gydF4y2Ba
ARF17是ARF家族的成员gydF4y2Ba拟南芥gydF4y2Ba.在gydF4y2BaARF17gydF4y2Ba突变体,所有花粉破裂,植物显示雄性不育[gydF4y2Ba17.gydF4y2Ba].在花药发育过程中,小孢子细胞/四分体决定花粉壁形态,绒毡层细胞为花粉形成提供营养和花粉壁物质。ARF17在花药发育过程中的小孢子细胞和四分体中表达,并直接调控gydF4y2BaCALS5.gydF4y2Ba四分体壁合成和外壁模式形成[gydF4y2Ba17.gydF4y2Ba].在本研究中,基于ARF17- gfp信号和免疫细胞化学检测结果,也检测了ARF17在绒毡层中的表达(图1)。gydF4y2Ba1CgydF4y2Ba和gydF4y2Ba5B.gydF4y2Ba).ARF17-GFP信号在绒毡层早期短时间内检测到。此外,小孢子细胞/四分体的信号明显弱于小孢子细胞/四分体(图。gydF4y2Ba1CgydF4y2Ba),较弱的信号是在先前研究中的Tapetum中未检测到表达的主要原因[gydF4y2Ba17.gydF4y2Ba].然而,短的表达期对绒毡层的发育很重要,绒毡层明显缺陷gydF4y2BaARF17gydF4y2Ba突变体(无花果。gydF4y2Ba1AgydF4y2Ba).在第4阶段之后,Dyt1-TDF1-AMS的关键遗传途径对于Tapetum发育和花粉壁形成很重要[gydF4y2Ba28.gydF4y2Ba,gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31.gydF4y2Ba].Dyt1是Tapetum发育所需的最早的转录因子,并且最初在大约5阶段检测到[gydF4y2Ba28.gydF4y2Ba].在gydF4y2BaARF17gydF4y2Ba突变体,gydF4y2BaDYT1gydF4y2Ba,gydF4y2BaTDF1.gydF4y2Ba,gydF4y2Ba自动对盘及成交系统gydF4y2Ba表达没有受到显着影响(附加文件gydF4y2Ba8gydF4y2Ba:图S5a),和gydF4y2BaDYT1gydF4y2Ba和gydF4y2BaTDF1.gydF4y2Ba突变体,gydF4y2BaARF17gydF4y2Ba转录没有大幅影响(附加文件gydF4y2Ba8gydF4y2Ba:图S5b)。因此,ARF17在绒毡层早期发育中起关键作用,可能独立于DYT1-TDF1-AMS通路。gydF4y2Ba
ARF17的过度表达gydF4y2Ba5MARF17gydF4y2Ba/ WT植物导致缺血性杂像卵状细胞和绦虫gydF4y2Ba
先前的研究表明gydF4y2Ba5MARF17 /gydF4y2Ba野生型植物是不育的[gydF4y2Ba20.gydF4y2Ba].与野生型植物的互惠交叉显示,雌性部件不受影响gydF4y2Ba5MARF17 /gydF4y2BaWT植物(附加文件gydF4y2Ba1gydF4y2Ba:图S1d)。的gydF4y2Ba5MARF17 /gydF4y2BaWT植株的花药室内没有成熟花粉,绒毡层和小孢子细胞/四分体均有缺陷(图2)。gydF4y2Ba2 a egydF4y2Ba).总的来说,花药的细胞缺陷在gydF4y2BaARF17gydF4y2Ba和gydF4y2Ba5MARF17 /gydF4y2BaWT植物。绒毡层发育不良gydF4y2BaARF17gydF4y2Ba变种人比gydF4y2Ba5MARF17gydF4y2Ba/ WT植物在第6阶段之后(附加文件gydF4y2Ba7gydF4y2Ba:图S6a)。在gydF4y2BaARF17gydF4y2Ba突变体,ARF17功能的损失导致花粉破裂和雄性不育。在gydF4y2Ba5MARF17 /gydF4y2BaWT植物,转基因gydF4y2Ba5MARF17gydF4y2Ba没有影响ARF17的表达(图。gydF4y2Ba3 a和bgydF4y2Ba).虽然gydF4y2Ba5MARF17gydF4y2Ba编码相同的蛋白质gydF4y2BaARF17gydF4y2Ba,它不能补充雄性不育gydF4y2BaARF17gydF4y2Ba突变体(无花果。gydF4y2Ba4B.gydF4y2Ba).因此,导致两者雄性不育的机制gydF4y2Ba5MARF17 /gydF4y2Bawt和gydF4y2BaARF17gydF4y2Ba植物是不同的。在gydF4y2Ba5MARF17gydF4y2Ba在WT植物中,ARF17蛋白在绒毡层和小孢子细胞中过度积累(图。gydF4y2Ba5AgydF4y2Ba,gydF4y2BabgydF4y2Ba).绒毡层特异的ARF17过度积累足以导致雄性不育,这与观察到的雄性不育相似gydF4y2Ba5MARF17gydF4y2Ba(图/ WT植物。gydF4y2Ba6A-D.gydF4y2Ba).因此,arf17的过度表达在Tapetum中的arf17gydF4y2Ba5MARF17gydF4y2Ba野生型植物阻止正常绒毡层功能。小孢子细胞/四分体也有缺陷gydF4y2Ba5MARF17 /gydF4y2BaWT植物。很可能是arf17在microcercytes / tetrads中的过表达gydF4y2Ba5MARF17gydF4y2Ba/ WT植物导致其雄性不育性。ARF17直接调节表达式gydF4y2BaCALS5.gydF4y2Ba,这是四分体壁形成所必需的。在gydF4y2BaARF17gydF4y2Ba突变体,表达gydF4y2BaCALS5.gydF4y2Ba显著减少[gydF4y2Ba17.gydF4y2Ba].的gydF4y2Ba5MARF17 /gydF4y2BaWT植物还会显示有缺陷的墙壁和减少表达gydF4y2BaCALS5.gydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba:图S1e-h)。这些现象很可能是小孢子细胞/四分体发育缺陷的副作用gydF4y2Ba5MARF17 /gydF4y2BaWT植物。微阵列分析结果表明gydF4y2Ba5MARF17gydF4y2Ba激活花药中许多基因的异位表达gydF4y2Ba5MARF17 /gydF4y2BaWT植物。其中两个基因的过度表达,gydF4y2BaAT1G48640gydF4y2Ba和gydF4y2BaZF1gydF4y2Ba,对花粉形成和植株育性有轻微影响(图。gydF4y2Ba7B-L.gydF4y2Ba).因此,雄性不育gydF4y2Ba5MARF17 /gydF4y2BaWT植物是由这些基因的异位表达和过表达引起的,包括gydF4y2BaAT1G48640gydF4y2Ba和gydF4y2BaZF1gydF4y2Ba.gydF4y2Ba
ARF17的表达在花药开发期间精确调节gydF4y2Ba
ARF17是目标之一gydF4y2Bamir160.gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba32.gydF4y2Ba],淘汰gydF4y2BaARF17gydF4y2Ba导致雄性不育[gydF4y2Ba17.gydF4y2Ba].在这项工作中,我们证明没有gydF4y2Bamir160.gydF4y2Ba控制gydF4y2Ba5MARF17gydF4y2Ba/ WT植物,ARF17过表达,导致雄性不育。因此,ARF17的表达水平对于花粉发育至关重要。5MARF17-GFP的表达模式显然类似于ARF17-GFP的表达模式(图。gydF4y2Ba5B.gydF4y2Ba).因此,gydF4y2BaARF17gydF4y2Ba启动子确定ARF17表达的细胞和组织特异性,而gydF4y2Bamir160.gydF4y2Ba控制ARF17表达水平。在gydF4y2Ba拟南芥gydF4y2Ba,三个前体,包括gydF4y2Bamir160a.gydF4y2Ba,gydF4y2Bamir160b.gydF4y2Ba和gydF4y2Bamir160c.gydF4y2Ba, 可以生产gydF4y2Bamir160.gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba].在人类中,三分列丙酮(TTP)蛋白是RNA诱导的沉默复合物(RISC)的成员[gydF4y2Ba33.gydF4y2Ba,gydF4y2Ba34.gydF4y2Ba].AtTTP是hTTP in的同源词gydF4y2Ba拟南芥gydF4y2Ba并且以icoryporocytes,tetrads和tapetal细胞表达,和gydF4y2BaATTTP.gydF4y2Ba表达高度重叠gydF4y2BaARF17gydF4y2Ba.过度的gydF4y2BaATTTP.gydF4y2Ba降低成熟的程度gydF4y2Bamir160.gydF4y2Ba,而表达的gydF4y2BaARF17gydF4y2Ba增加它[gydF4y2Ba35.gydF4y2Ba].因此,AtTTP参与其中gydF4y2Bamir160.gydF4y2BaARF17在花药发育过程中对花粉形成的精细调控。gydF4y2Ba
结论gydF4y2Ba
ARF17是目标gydF4y2Bamir160.gydF4y2Ba,gydF4y2Ba5MARF17 /gydF4y2BaWT植物显示雄性不育gydF4y2BaARF17gydF4y2Ba植物。在本研究中,我们发现ARF17在花药发育和花粉形成中起重要作用。没有gydF4y2Bamir160.gydF4y2Ba规则,表达模式gydF4y2BaARF17gydF4y2Ba在花药中的表达量不受影响,但在花药中的表达量显著升高gydF4y2Ba5MARF17gydF4y2Ba/ WT植物。ARF17在gydF4y2Ba5MARF17gydF4y2Ba植物导致花粉形成和植物无菌的缺陷。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
在这项研究中,gydF4y2Ba拟南芥gydF4y2Ba(gydF4y2Ba拟南芥gydF4y2Ba)野生型、转基因和col0生态型背景下的突变植株。gydF4y2BaARF17gydF4y2Ba突变体和gydF4y2Ba5MARF17gydF4y2Ba/ WT植物在Z.N的实验室中被保存。杨。种子在蛭石上播种并使其占用2至3天。在生长室中16小时光/ 8小时黑暗的条件下植物生长约22天。gydF4y2Ba
显微镜gydF4y2Ba
这些工厂是用Cyber Shot T-20数码相机(索尼)拍摄的。Alexander染色液的制备方法如下[gydF4y2Ba23.gydF4y2Ba].在室温(RT,22°C)的室温下染色约2-12小时。对于半薄部分,花蕾固定并嵌入塞子树脂中。通过将芽切割为1μm的芽,然后在42℃下以0.1%甲苯胺蓝/钠硼酸钠溶液孵育5-10分钟,然后将部分用水洗涤,以制备半薄部分。在亮场显微镜下用奥林巴斯BX51显微镜观察该部分。gydF4y2Ba
荧光显微镜gydF4y2Ba
对于胼染粒,将四个阶段的花头挤压到载玻片上并如前所述用甲苯胺蓝染色[gydF4y2Ba17.gydF4y2Ba].花草中的GFP信号gydF4y2BaARF17-GFP / ARF17gydF4y2Ba,gydF4y2Ba5MARF17-GFP /gydF4y2Bawt,和gydF4y2BaARF17-GFP / 5 marf17gydF4y2Ba使用Carl Zeiss共聚焦激光扫描显微镜(LSM 5 Pascal)观察植物。gydF4y2Ba
电子显微镜gydF4y2Ba
对于TEM检查,将花芽固定在0.1M磷酸盐缓冲液(pH7.2)中,用2.5%戊二醛(gydF4y2BavgydF4y2Ba/ v)然后用PBS(pH7.4)洗涤几次,然后用乙醇脱水并通过丙烯环氧化物替代。将样品嵌入孢子树脂中,并如前所述在60℃下聚合48小时[gydF4y2Ba23.gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].然后,使用TEM显微镜(JEOL,日本)观察幻灯片。对于SEM观察,将新鲜的花粉晶体涂有8nm的金,并在JSM-840显微镜(JEOL)下观察[gydF4y2Ba23.gydF4y2Ba].gydF4y2Ba
转基因植物质粒的构建与鉴定gydF4y2Ba
的gydF4y2Bamarf17 promoterARF17:: 5gydF4y2Ba使用基因组区域使用gydF4y2BaARF17gydF4y2Ba引物(Proarf17-F / R)和(5MARF17G-F / R)按照Mallory识别来补充野生型(WT)[gydF4y2Ba20.gydF4y2Ba].的gydF4y2Bamarf17-gfp promoterA9:: 5gydF4y2Ba碎片是用gydF4y2BaA9gydF4y2Ba启动子(ProA9-F/R)和gydF4y2Ba5MARF17gydF4y2Ba基因组区域补充重量。用于GFP融合,gydF4y2Ba5MARF17gydF4y2Ba使用引物(5MARF17G-F / 5MARF17G-GFP-G-GFP-G-GFP-R)克隆没有止乳沉积物的基因组片段克隆到改性的GFP-PCAMBIA1300载体中以补充WT。的gydF4y2Ba促销员9 :: AT1G48640gydF4y2Ba碎片是用gydF4y2BaA9gydF4y2Ba启动子(ProA9-F/R)和gydF4y2BaAT1G48640gydF4y2BaCDS (4864-F/4864-R)区域转移到WTgydF4y2BaCaMV35: ZF1gydF4y2Ba碎片是用gydF4y2BaCAMV35gydF4y2Ba启动子(35 S-F / 35 S-R)和gydF4y2BaZF1gydF4y2BaCDS(ZF1-F / ZF1-R)区域引入WT。使用KOD聚合酶(Takara Biotechnology)扩增这些片段,并克隆到Pcambia1300和GFP-PCAMBIA1300载体(Cambia)中。通过测序验证片段。将质粒转化为gydF4y2Ba农杆菌肿瘤术gydF4y2Ba(GV3101)并使用50mg / ml Kanamycin,40mg / ml庆大霉素和50mg / ml利福平的筛选。将含有质粒构建体的细菌引入花芽中。使用20mg / L潮霉素选择转基因植物。引物序列列于附加文件中gydF4y2Ba9gydF4y2Ba:表S1。gydF4y2Ba
免疫组织化学染色gydF4y2Ba
对于免疫组织化学染色,将花芽固定在甲醛/乙酸中1天,在乙醇梯度中脱水并嵌入蜡中。使用旋转性显微电机(MR2; RMC)制备8mm厚的部分。再水化后,将这些部分在煮沸的柠檬酸盐缓冲液(pH6.4)中孵育10-15分钟,然后冷却至室温。将载玻片在PBS(pH7.4)中洗涤两次5分钟。然后,将该部分用PBS中的5%BSA封闭30分钟至1小时。兔抗6×GFP抗体(Thermo Sciencific)在PBS(pH7.4)中稀释1:100,然后将载玻片在4℃温育过夜。然后,将载玻片在Tris缓冲盐水溶液(TBS; pH 7.4)中洗涤三次5分钟,并在室温下在TBS(pH7.4)中在TBS(pH7.4)中稀释1:200的抗兔-AP抗体孵育1小时。将载玻片在TBS中洗涤三次,5分钟,BCIP / NBT溶液(CWBIO)用于在室温下进行比色检测。gydF4y2Ba
定量RT-PCRgydF4y2Ba
使用TRIzol试剂盒(Invitrogen公司)从WT、转基因和突变植物的花蕾中提取总RNA。按照厂家说明书(Toyobo),合成了第一链互补DNA (cDNA)。使用ABI PRISM 7300检测系统(Applied Biosystems)和SYBR Green I master mix (Toyobo)进行定量RT-PCR。利用引物ARF17qRT-F/R检测表达水平gydF4y2BaARF17gydF4y2Ba.根据循环数计算相对表达水平。QRT-PCR结果显示为与管蛋白的相对表达水平标准化。阳性对照是小管蛋白基因(桶F / R),对每个实验进行三种重复。相关的引物序列列于附加文件中gydF4y2Ba10.gydF4y2BaS2:表。gydF4y2Ba
微阵列gydF4y2Ba
微阵列是根据前面描述的程序进行的[gydF4y2Ba30.gydF4y2Ba].从WT和gydF4y2Ba5MARF17 /gydF4y2BaWT植物立即在液氮中冷冻。使用低RNA输入的线性放大套件(安捷伦技术)用于扩增和标记总RNA。在制造商的指示之后应用5-(3-氨基烯丙基)-UTP(AMACION),CY3 NHS酯(GE Healthcare Biosciences)和Cy5 NHS酯(GE Healthcare Biosciences)。使用RNEasy Mini试剂盒(QIAGEN)纯化标记的CRNA。根据制造商的说明,每44-kgydF4y2Ba拟南芥gydF4y2Ba使用基因表达杂交试剂盒(Agilent)在杂交炉(Agilent)中与825ng cy3标记的cRNA和825ng cy5标记的cRNA杂交寡核苷酸芯片玻片。使用安捷伦微阵列扫描仪(Agilent Microarray Scanner, Agilent)和特征提取软件10.7 (Agilent)在默认设置下扫描幻灯片。使用了三个独立培养材料的生物重复。使用Gene Spring Software 11.0 (Agilent)对原始数据进行局部加权散点图平滑(Lowess)算法归一化。gydF4y2Ba
参考文献gydF4y2Ba
- 1。gydF4y2Ba
Goldberg RB,Beals TP,桑德斯PM。花药开发:基本原则和实际应用。植物细胞。1993年; 5(10):1217-29。gydF4y2Ba
- 2。gydF4y2Ba
Heslop-Harrison PJ。进出口的起源。自然。1962; 195(4846):1069-71。gydF4y2Ba
- 3.gydF4y2Ba
Mariani C, Beuckeleer, M.D, Truettner, J., Leemans, J., and Goldberg, R.B.:通过嵌合核糖核酸酶基因诱导植物雄性不育。自然1990,347(6295):737 - 741。gydF4y2Ba
- 4。gydF4y2Ba
东X,洪Z,Sivaramakrishnan M,Mahfouz M,Verma DP。在微酰胺化期间,在拟南芥中的花粉活力需要愈伤组合酶(CALS5)。工厂J. 2005; 42(3):315-28。gydF4y2Ba
- 5。gydF4y2Ba
周Q,朱茹,崔Yl,杨泽。超微结构分析显示拟南芥花粉壁发育早期孢子醇蛋白沉积和缘缘形成。SCI BULL。2015; 60(2):273-6。gydF4y2Ba
- 6。gydF4y2Ba
Cecchetti V,Altamura MM,Falasca G,Costantino P,Cardarelli M.植物蛋白调节拟南芥花药裂开,花粉成熟和丝伸长。植物细胞。2008; 20(7):1760-74。gydF4y2Ba
- 7。gydF4y2Ba
生长素在雄蕊形成和发育中的极性运输:有多少行动者?植物科学学报。2014;5:333。gydF4y2Ba
- 8。gydF4y2Ba
(1)拟南芥碱类突变体的形态发生。植物j . 1995; 8(4): 505 - 20。gydF4y2Ba
- 9。gydF4y2Ba
张志强,张志强,张志强,等。植物生长素在植物器官发育中的作用。植物生长调节剂的研究进展。细胞。2003;115(5):591 - 602。gydF4y2Ba
- 10。gydF4y2Ba
程颖,戴旭,赵艳艳。丝兰黄素单加氧酶合成生长素对拟南芥花器官和维管组织形成的调控。基因Dev。2006;20(13):1790 - 9。gydF4y2Ba
- 11.gydF4y2Ba
Bender RL,Fekete Ml,Klinkenberg PM,Hampton M,Bauer B,Malecha M,Lindgren K,A Maki J,Perera Ma,Nikolau BJ等。PIN6需要NECTARY AUXIN响应和短雄蕊开发所必需的。工厂J. 2013; 74(6):893-904。gydF4y2Ba
- 12.gydF4y2Ba
Guilfoyle TJ,Hagen G.一种营养因子响应因素。CurrOp植物BIOL。2007; 10(5):453-60。gydF4y2Ba
- 13。gydF4y2Ba
Guilfoyle TJ。生长素反应因子和aux/IAA蛋白中的PB1结构域:生长素反应中一个通用的蛋白质相互作用模块。植物细胞。2015;27(1):33-43。gydF4y2Ba
- 14。gydF4y2Ba
Ellis CM, Nagpal P, Young JC, Hagen G, Guilfoyle TJ, Reed JW。生长素反应因子1和生长素反应因子2调控拟南芥的衰老和花器官脱落。发展。2005;132(20):4563 - 74。gydF4y2Ba
- 15.gydF4y2Ba
吴MF,天Q,芦苇JW。拟南芥MicroRNA167控制ARF6和ARF8表达的模式,并调节女性和男性繁殖。发展。2006; 133(21):4211-8。gydF4y2Ba
- 16。gydF4y2Ba
Nag A, King S. Jack T: miR319a靶向TCP4在拟南芥花瓣生长发育中起关键作用。中国科学(d辑:地球科学)2009;gydF4y2Ba
- 17。gydF4y2Ba
杨杰,田兰,太阳MX,黄XY,朱茹,关毅,贾Qs,杨泽。援助响应因子17对于拟南芥的花粉墙图案形成是必不可少的。植物理性。2013; 162(2):720-31。gydF4y2Ba
- 18。gydF4y2Ba
mirna对蛋白质合成的抑制作用:有多少机制?细胞生物学杂志。2007;17(3):118-26。gydF4y2Ba
- 19。gydF4y2Ba
Iwakawa Ho,Tomari Y.分子洞察MicroRNA介导的植物翻译镇压。Mol细胞。2013; 52(4):591-601。gydF4y2Ba
- 20。gydF4y2Ba
Mallory AC,Bartel DP,Bartel B. MicroRNA指导的拟南芥疾病响应因子17对于适当的开发和调节早期疾病响应基因的表达至关重要。植物细胞。2005; 17(5):1360-75。gydF4y2Ba
- 21。gydF4y2Ba
刘X,黄杰,王y,khanna k,谢z,欧文ha,zhao d。在心脏病中的拟南芥中的拟南芥突变突变,有机组织和调节其表达机制的作用。工厂J.2010; 62(3):416-28。gydF4y2Ba
- 22。gydF4y2Ba
冯晓峰,李志刚。拟南芥花药中绒毡层细胞的分布、分化和增殖。发展。2010;137(14):2409 - 16。gydF4y2Ba
- 23。gydF4y2Ba
徐XF,王b,娄y,韩WJ,鲁杰,李德,李lg,朱茹,杨泽。镁转运蛋白5在拟南芥中的男性配子瘤发育中起重要作用。工厂J. 2015; 84(5):925-36。gydF4y2Ba
- 24。gydF4y2Ba
Mi H,Muruganujan A,Casagrande JT,Thomas Pd。豹分类系统的大规模基因功能分析。NAT PROTOC。2013; 8(8):1551-66。gydF4y2Ba
- 25。gydF4y2Ba
Bruex A,Kainkaryam RM,Wieckowski Y,Kang Yh,Bernhardt C,夏Y,Zheng X,Wang Jy,Lee Mm,Benfey P等人。拟南芥中根表皮细胞分化的基因调节网络。Plos Genet。2012; 8(1):E1002446。gydF4y2Ba
- 26。gydF4y2Ba
Kuroha T, Okuda A, Arai M, Komatsu Y, Sato S, Kato T, Tabata S, Satoh S.基因诱捕法鉴定根中特异表达的拟南芥枯草菌素样丝氨酸蛋白酶。杂志。2009;137(3):281 - 8。gydF4y2Ba
- 27。gydF4y2Ba
Kodaira Ks,Qin F,Tran LS,Maruyama K,Kidokoro S,Fujita Y,Shinozaki K,Yamaguchi-Shinozaki K.拟南芥Cys2 / His2锌 - 手指蛋白AZF1和AZF2负面调节非生物下的脱落酸性抗抑郁和生长素诱导基因压力条件。植物理性。2011; 157(2):742-56。gydF4y2Ba
- 28。gydF4y2Ba
朱杰,陈某,李立,高JF,江H,王C,关毅,杨泽。Tapetal开发和功能1的缺陷对于拟南芥中微孔成熟的表达和Tapetal功能至关重要。工厂J. 2008; 55(2):266-77。gydF4y2Ba
- 29。gydF4y2Ba
顾杰,朱茹,俞y,teng xd,lou y,xu xf,liu jl,杨zn。DYT1直接调节TDF1表达TDF1在拟南芥中的Tapetum发育和花粉壁形成。工厂J. 2014; 80(6):1005-13。gydF4y2Ba
- 30.gydF4y2Ba
娄阳,徐晓峰,朱军,顾金金,Blackmore S,杨正宁。绒毡层AHL家族蛋白TEK决定花粉壁上的外系形成。Nat Commun。2014;5:3855。gydF4y2Ba
- 31.gydF4y2Ba
熊SX,陆杰,娄y,腾Xd,顾jn,张c,shi qs,杨zn,zhu J.转录因子MS188和AMS形成拟南芥孢子酸钠素生物合成的复合体。工厂J. 2016; 88(6):936-46。gydF4y2Ba
- 32.gydF4y2Ba
王吉,王立,毛耶,蔡维,薛鹤,陈XY。用拟南芥的MicroRNA靶向植物蛋白响应因子控制根帽形成。植物细胞。2005; 17(8):2204-16。gydF4y2Ba
- 33。gydF4y2Ba
Jing Q, Huang S, Guth S, Zarubin T, Motoyama A, Chen J, Di Padova F, Lin SC, Gram H, Han J. microRNA参与AU-rich element介导的mRNA不稳定性。细胞。2005;120(5):623 - 34。gydF4y2Ba
- 34。gydF4y2Ba
Franks TM,Lykke-Andersen J.TTP和BRF蛋白质成核加工身体形成沉默MRNA与富有的元素。基因开发。2007; 21(6):719-35。gydF4y2Ba
- 35。gydF4y2Ba
施振华,张超,徐晓峰,朱军,周强,马丽娟,牛健,杨志南。AtTTP过表达影响ARF17的表达,导致拟南芥雄性不育。《公共科学图书馆•综合》。2015;10 (3):e0117317。gydF4y2Ba
致谢gydF4y2Ba
我们感谢Jun Yang为他的帮助建设gydF4y2Bamarf17 promoterARF17:: 5gydF4y2Ba植物。gydF4y2Ba
资金gydF4y2Ba
中国科技部(2013CB945100),中国国家科学基金会(31670314)和中国国家科学基金(31401030)的主要研究计划得到了支持的支持。资助者在研究设计,数据收集和分析中没有作用,决定发布或准备稿件。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持本文结果的数据包含在文章及其附加文件中。基因和启动子序列gydF4y2BaARF17gydF4y2Ba存放在Tair(gydF4y2Bahttps://www.arabidopsis.org.gydF4y2Ba),加入编号为AT1G77850。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
ZXL和ZNY管理项目;XXF,ZXL和ZNY构思了原始的筛选和研究计划;ZNY监督实验;BW表现了大部分实验;YHY,SQL和JXZ参与进行实验;BW和XXF设计了实验,分析了数据并与JSX和XZY的贡献写了文章;ZNY审查并编辑了写作。所有作者阅读并认可的终稿。gydF4y2Ba
相应的作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
结果表明,该菌的表型、分离分析和表达gydF4y2BaCALS5.gydF4y2Ba在gydF4y2Ba5MARF17 /gydF4y2BaWT植物。A- c 35日龄野生型植物(WT) (A);gydF4y2Ba5MARF17gydF4y2Ba/ wt植物(b)和gydF4y2BaARF17gydF4y2Ba突变体(c)。酒吧= 2厘米。(d)传输效率gydF4y2Ba5MARF17 /gydF4y2BaWT突变体gydF4y2Ba.gydF4y2BaTEgydF4y2BafgydF4y2Ba:女性传动效率;TEgydF4y2Ba米gydF4y2Ba:男性传播效率;拿拿淋:任何应用程序。从WT工厂(E)的胼ins的E-g苯胺蓝染色;一个gydF4y2Ba5MARF17gydF4y2Ba/ WT植物(F);和一个gydF4y2BaARF17gydF4y2Ba突变体(G). bar = 20 μm。(H)荧光定量RT-PCR分析gydF4y2BaCALS5.gydF4y2Ba在wt中的表达,gydF4y2Ba5MARF17gydF4y2Ba和gydF4y2BaARF17gydF4y2Ba味蕾gydF4y2Ba.gydF4y2Ba水平gydF4y2BaCALS5.gydF4y2Ba被标准化为小管蛋白并与wt的相比。误差条表示SD,并由三个生物重复计算。(TIFF 5996 KB)gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
鉴定a中的序列gydF4y2Ba5MARF17 / ARF17gydF4y2Ba工厂。基因组PCR分析gydF4y2Ba5MARF17 / ARF17gydF4y2Ba植物背景。b克隆5个碱基测序gydF4y2Ba5MARF17 / ARF17gydF4y2Ba植物。(TIFF 4304 KB)gydF4y2Ba
附加文件3:图S3。gydF4y2Ba
表型和偏析分析gydF4y2Ba5MARF17-GFP /gydF4y2BaWT植物。A和B一个35天老gydF4y2Ba5MARF17-GFP /gydF4y2Bawt植物(a)和gydF4y2BaARF17-GFP / 5 marf17gydF4y2BaB .条= 2厘米。(C)传输效率gydF4y2Ba5MARF17-GFP /gydF4y2BaWT植物gydF4y2Ba.gydF4y2BaTEgydF4y2BafgydF4y2Ba:女性传动效率;TEgydF4y2Ba米gydF4y2Ba:男性传播效率;拿拿淋:任何应用程序。(TIFF 1132 kb)gydF4y2Ba
附加文件4:图S4。gydF4y2Ba
传输效率gydF4y2Ba时::5 marf17-gfp / WTgydF4y2Ba工厂。传输效率gydF4y2BapromoterA9:: 5 marf17-gfp /gydF4y2Bawt(gydF4y2Ba时::5 marf17-gfp /gydF4y2BaWT)工厂gydF4y2Ba.gydF4y2BaB定量RT-PCR分析gydF4y2BaARF17gydF4y2Ba在wt和gydF4y2Ba5MARF17gydF4y2Ba/ wt芽在第5阶段5. C定量RT-PCR分析gydF4y2BaARF17gydF4y2Ba在wt和gydF4y2Ba时::5 marf17-gfp /gydF4y2BaWT芽gydF4y2Ba.gydF4y2Ba水平gydF4y2BaARF17gydF4y2Ba被标准化为小管蛋白并与wt的相比。误差条表示SD,并由三个生物重复计算。TEgydF4y2BafgydF4y2Ba:女性传动效率;TEgydF4y2Ba米gydF4y2Ba:男性传播效率;拿拿淋:任何应用程序。(TIFF 491 KB)gydF4y2Ba
附加文件5:表S3。gydF4y2Ba
上调基因列表gydF4y2Ba5MARF17gydF4y2Ba/ wt通常在wt芽中表达或不存在。(XLSX 65 KB)gydF4y2Ba
附加文件6:表S4。gydF4y2Ba
PANTHER对上调基因的蛋白质分类。(XLS 116 kb)gydF4y2Ba
附加文件7:图S6。gydF4y2Ba
花药半薄切片及PCR分析。WT花药的半薄切片,gydF4y2BaARF17gydF4y2Ba和gydF4y2Ba5MARF17gydF4y2Ba/ WT工厂从第5阶段到9. BAR =20μm。B WT中转基因序列的鉴定,gydF4y2BapromoterA9: AT1G48640gydF4y2Ba/ WT和gydF4y2BaCAMV35S :: ZF1gydF4y2Ba/ WT。DMsp退化小孢子;MC,减数分裂细胞;MMC:小孢子母细胞;Msp,小孢子;T,毯;Tds、四联球菌。(TIFF 23380 kb)gydF4y2Ba
附加文件8:图S5。gydF4y2Ba
绦虫和花粉形成基因的相对表达gydF4y2Ba5MARF17gydF4y2Ba/ WT和gydF4y2BaARF17gydF4y2Ba植物。绒毡层和花粉发育相关基因表达量的定量RT-PCR分析。B定量RT-PCR分析gydF4y2BaARF17gydF4y2Ba表达gydF4y2BaDYT1gydF4y2Ba和gydF4y2BaTDF1.gydF4y2Ba突变体。的水平gydF4y2BaDYT1gydF4y2Ba,gydF4y2BaTDF1.gydF4y2Ba,gydF4y2Batek.gydF4y2Ba,gydF4y2BaCDKG1gydF4y2Ba,gydF4y2BaRPG1.gydF4y2Ba,gydF4y2BaMS188gydF4y2Ba,gydF4y2BaMS1gydF4y2Ba,gydF4y2BaACOS5gydF4y2Ba,gydF4y2BaARF17gydF4y2Ba被标准化为管蛋白的那些,并与wt的那些相比。误差条表示SD,并由三个生物重复计算。(TIFF 937 KB)gydF4y2Ba
附加文件9:表S1。gydF4y2Ba
用于克隆和鉴定的引物清单。(XLS 21 kb)gydF4y2Ba
附加文件10:表S2gydF4y2Ba
QRT-PCR中使用的引物列表。(XLS 22 KB)gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条提供的数据,除非另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
王,b。,薛,js。,yu,yh。gydF4y2Baet al。gydF4y2BaARF17对花药开发和花粉形成的细微调节。gydF4y2BaBMC植物BIOL.gydF4y2Ba17,gydF4y2Ba243(2017)。https://doi.org/10.1186/s12870-017-1185-1gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-017-1185-1gydF4y2Ba
关键字gydF4y2Ba
- 花药gydF4y2Ba
- Tapetum.gydF4y2Ba
- 雄性不育gydF4y2Ba
- ARF17gydF4y2Ba
- 5MARF17gydF4y2Ba